Химия: Металл эместер — различия между версиями
Admine2 (обсуждение | вклад) (→Фосфор) |
Admine2 (обсуждение | вклад) (→Фосфор) |
||
| Строка 424: | Строка 424: | ||
{{left|[[file:P.png|150px|link=]]}} | {{left|[[file:P.png|150px|link=]]}} | ||
<div class="textblock">Фосфор – (P) ''грек тилинен Phosphorus – («жарык алып жүрүүчү»)'' деп которулат. Фосфор 1669–жылы Брандт «философиялык ташты» табуу максатында адамдын заарасын бууланткан. Жыйынтыгында ак түстөгү, жаркырап күйгөн затты алган. Бранд аны «жарыкты алып жүрүүчү» деп атаган. Фосфор жаратылышта минералдардын жана туздардын курамында кездешет. Жаныбарлардын жана өсүмдүктөрдүн организмдеринде фосфор сөөктүн, тиштин жана өсүмдүктөрдүн клеткаларында кездешет. Жер шарынын 0,12% түзөт. Курамында фосфору бар эң маанилүү минералдар– фосфориттер жана апатиттер. Фосфорит – Са<sub>2</sub>(РО<sub>4</sub>)<sub>3</sub> жана апатит – бул Са<sub>2</sub>(РО<sub>4</sub>)<sub>3</sub> менен СаСl<sub>2</sub> же CaF<sub>2</sub> аралашмасы болуп саналат.</div> | <div class="textblock">Фосфор – (P) ''грек тилинен Phosphorus – («жарык алып жүрүүчү»)'' деп которулат. Фосфор 1669–жылы Брандт «философиялык ташты» табуу максатында адамдын заарасын бууланткан. Жыйынтыгында ак түстөгү, жаркырап күйгөн затты алган. Бранд аны «жарыкты алып жүрүүчү» деп атаган. Фосфор жаратылышта минералдардын жана туздардын курамында кездешет. Жаныбарлардын жана өсүмдүктөрдүн организмдеринде фосфор сөөктүн, тиштин жана өсүмдүктөрдүн клеткаларында кездешет. Жер шарынын 0,12% түзөт. Курамында фосфору бар эң маанилүү минералдар– фосфориттер жана апатиттер. Фосфорит – Са<sub>2</sub>(РО<sub>4</sub>)<sub>3</sub> жана апатит – бул Са<sub>2</sub>(РО<sub>4</sub>)<sub>3</sub> менен СаСl<sub>2</sub> же CaF<sub>2</sub> аралашмасы болуп саналат.</div> | ||
| + | |||
<div class="show-for-large-up">{{right|[[file:P инфографика.png|400px|Фосфор]]}}</div> | <div class="show-for-large-up">{{right|[[file:P инфографика.png|400px|Фосфор]]}}</div> | ||
Версия 08:53, 11 мая 2018
Химиялык элементтердин мезгилдик системасында бордон астатка чейин диогнал сызыгын жүргүзсөк, таблицанын оң жактагы жогору бурчун ээлеген 20–25 элемент металл эместер болуп саналат. Алардын көпчүлүгү р элементтер, суутек менен гелий гана s элементи болуп саналат. Металл эместер 3 төн 8ге чейинки валенттүүлүктү жана –4 төн + 8 чейинки кычкылдануу даражаларын көрсөтөт. Алар 2ден 4 электрон–вольтко чейинки жогорку терс электрдүүлүккө ээ болгондуктан, күчтүү кычкылдандыргыч болуп саналат. Бирок, молекулаларынын курамына жараша химиялык реакцияга киргенде металл эместер кычкылдандыргыч да, калыбына–келтиргич да болушу мүмкүн. Элементтердин металл эместик касиети мезгилдерде солдон оңду карай, ал эми группаларда жогортон төмөн карай күчөйт. Металл эместер жаратылышта чоң мааниге ээ, алар топурактын 84%, өсүмдүктөрдүн 98,5% жана адамдардын денесинин 97,6% түзүп турат. Ошондой эле көмүртек, кычкылтек, суутек, азот, фосфор жана күкүрт элементтери белоктордун, нуклеин кислоталарынын, майлардын, углеводдордун жана витаминдердин курамына кирет. Абанын курамын карасак, ал азоттон, кычкылтектен жана асыл газдардан турат.
Суу да эки металл эместен: суутектен жана кычкылтектен турат. Металл эместердин арасынан бир гана атомдон турган–асыл газдарды жана эки атомдон турган газ абалындагы заттар – суутек, азот, кычкылтек, фтор, хлорду белгилөөгө болот. Металл эместердин арасында ар түрдүү агрегаттык абалдагы заттар бар. Аларга, суюк абалдагы–бромду, аморфтук абалдагы – кызыл жана ак фосфорду жана кристаллдык заттар – көмүртекти, кремнийди жана иодду киргизүүгө болот. Ошону менен катар эле металл эместер жөнөкөй заттардын аллотропиясын (түр өзгөрүшү) пайда кылуу жөндөмдүүлүгүнө ээ болушат.Мисалы, алмаз–графитти, кычкылтек–озонду ж.б. пайда кылат. Металл эместер электр тогун жана жылуулукту начар өткөрүшөт. Демек, заттардын касиети алардын курамын түзгөн металл эместерден көз каранды болот.
Содержание
Суутек
Суутек үч изотопту пайда кылат: ![]() – жеңил суутек (Протий),
– жеңил суутек (Протий), ![]() – оор суутек (Дейтерий) и
– оор суутек (Дейтерий) и ![]() – өтө оор суутек (Тритий). Суутектин терс электрдүүлүгү Полингдин таблицасында – 2,1 барабар.
– өтө оор суутек (Тритий). Суутектин терс электрдүүлүгү Полингдин таблицасында – 2,1 барабар.
Мeталлдар < Терс электрдүүлүгү (Н) 2,1 < Металл эместер
Жер катмарында суутек суунун, нефттин, минералдардын жана жандуу организмдин курамында кездешет. Бардык химиялык заттардын 95% өзүнө суутекти кармап жүрөт. Эң жеңил газ катары атмосферанын жогорку катмарында космос мейкиндигинин – 63%, литосферанын – 0,15%, гидросферанын – 4% түзүп турат.
Суутек – өңсүз, түссүз, жытсыз газ. Абадан 14,5 эсеге жеңил, кайноо температурасы –252,8 оС, сууда начар эрийт. Электр тогун жакшы өткөрөт. Кээ бир металлдарда балкып эрийт (Pt, Pd, Ni), абада күйөт.
2 көлөм суутек H2 жана 1 көлөм кычкылтек O2 аралашса, «күркүрөк газ» деген жарылгыч затты пайда кылат.
Суутек суунун – H2O, күкүрттүү суутектин – H2S, галоген суутектердин – HCl, HBr, HF, HJ, аммиактын – NH3, метандын – CH4, фосфиндин – PH3, металлдардын гидриддеринин –NaH, CaH2 курамдарына кирет. Суутек бардык кислоталардын да курамдарында болот. Суутектин эң негизги бирикмеси суу болуп эсептелет. Суутек металлдар менен реакциялашып, гидриддерди пайда кылууда өзүн кычкылдандыргыч катары, ал эми металл эместер менен аракеттенишкенде өзүн калыбына келтиргич катары алып жүрөт. Ысытканда металлдарды оксиддеринен калыбына келтирет.
.
Жездин оксидинин (II) суутек менен калыбына келиши.
Суутек металл эместерден күкүрт, хлор, иод жана азот менен реакцияга кирет: ![]() . Лабораторияда суутек металлдар менен кислотанын өз ара аракеттенишүүсүнөн алынат:
. Лабораторияда суутек металлдар менен кислотанын өз ара аракеттенишүүсүнөн алынат:
Zn + 2HCl ![]() ZnCl2 + H2↑.
ZnCl2 + H2↑.
Өнөр жайда суутек метандан алынат: ![]() ,
, ![]() .
.
Суутек аэростаттарды, зонддорду толтурууда, калыбына келтиргич катары сейрек кездешүүчү өтө таза металлдарды молибденди, вольфрамды (Мо,W) алууда, ширетүү жана ысытуу иштеринде колдонулат.
Суутек NH3 – аммиакты, HCl – хлордуу суутекти жана CH3OH – метанолду алууда сырье катары да колдонулат.
-

Метеозонддор суутек менен толтурулат
-

Ракета куруу иштеринде суутек күйүүчү отун катары колдонулат
-

Суутекти жеңилдиги үчүн аэросүзүүдө да колдонушат
-

Суутек күйгөндө жылуулук көп бөлүнүп чыккандыктан, ширетүүдө да колдонулат
Кычкылтек
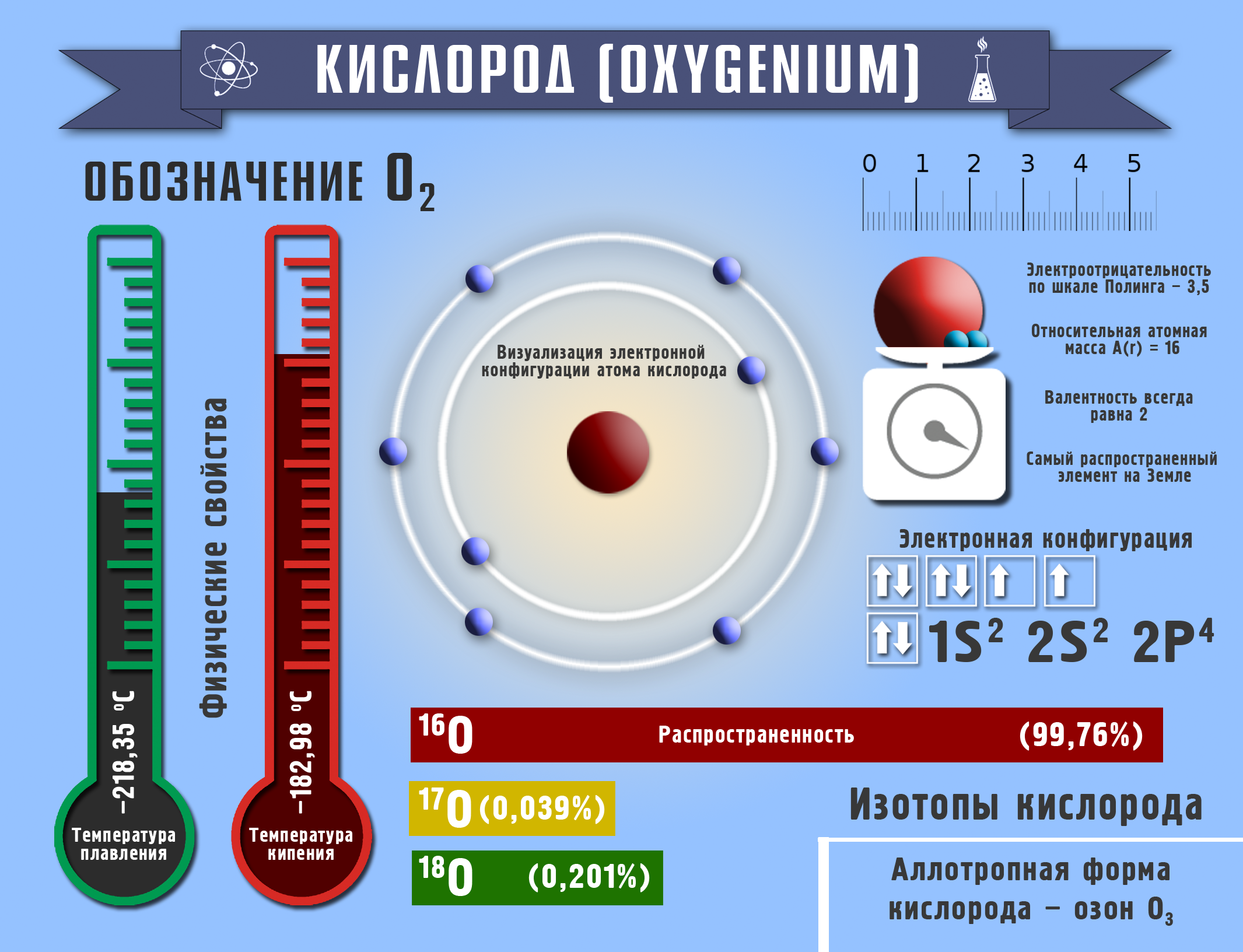
Ядросунун заряды +8, салыштырмалуу атомдук массасы A(r)=16 м.а.б. терс электрдүүлүгү Полингдин таблицасы боюнча 3,5, химиялык элементтердин мезгилдик системасында VIА группада жайгашса да валенттүүлүгү 2 ни көрсөтөт. Кычкылдануу даражасы: –2, –1, 0, +2.
Молекуласы кычкылтектин эки атомунан турат – О2. Аллотропиялык түр өзгөрүшү О3 – озон, молдук массасы М (О3) = 48 г/моль барабар болот.
Кычкылтек – эң кеңири таралган элемент, ал жер катмарынын 49% түзөт. Көлөмү боюнча атмосфералык абанын – 21%, литосферанын – 47,2% түзөт. Кычкылтек суунун, минералдардын жана органикалык заттардын курамына кирет (өсүмдүктөрдүн же жаныбарлардын 50–85% кычкылтектен турат).
Абанын курамы: О2 – 21%, N2 – 78%, инерттүү газдар – 1%. (Абанын орточо массасы = 29 г/моль). Кычкылтек – өңсүз, түссүз, жытсыз газ, абадан бир аз оорураак. Тыгыздыгы 1,43 г/л, tкайн. –183 оС. Сууда аз эрийт – 0,04 г/л. Суюк кычкылтек көгүш түстө болот, магнитке тартылат. Кычкылтек бардык заттар менен реакцияга кирет (гелий, неон, аргондон башка). Ал фосфор, хлор, алтын жана платина менен түздөн–түз реакцияга кирбейт.
Кычкылтек дайыма кычкылдандыруучу болот. (ОF2 башкасын). Металлдар жана металл эместер менен аракеттенишип, оксиддерди (СаО, Р2О5) пайда кылат.
Щелочтуу металлдар менен реакцияга кирип, өтө кычкылдарды (Na2O2) пайда кылат. Химиялык элементтердин кычкылтек менен болгон реакциясы экзотермикалык – жылуулукту жана жарыкты бөлүп чыгаруу менен жүрөт. Кычкылдануунун кубаттуу жүрүшү күйүү деп аталат. Бардык органикалык жана органикалык эмес заттар күйүүгө жөндөмдүү болушат Алар абага караганда кычкылтекте жакшы күйүшөт, мисалы, аммиак абада күйбөйт, ал эми кычкылтекте күйөт.
![]()
Күкүрттүү суутек абада да кычкылтекте да күйөт, бирок, бул учурда эки башка зат пайда болот. 2H2S + O2 ![]() 2S↓ + 2H2O (абада),
2S↓ + 2H2O (абада),
![]() (кычкылтектев). Бардык органикалык заттар кычкылтекте күйгөндө көмүр кычкыл газы жана суу пайда болот (CO2 и H2O): CH4 + 2O2
(кычкылтектев). Бардык органикалык заттар кычкылтекте күйгөндө көмүр кычкыл газы жана суу пайда болот (CO2 и H2O): CH4 + 2O2 ![]() CO2↑ + 2H2O.
CO2↑ + 2H2O.
Оксиддер өнөр жайда сульфиддерди күйгүзүү жолу менен алынат ![]() .
.
Кычкылтекти лабораторияда татаал заттарды ажыратуу менен алууга болот:
2KMnO4 ![]() K2MnO4 + MnO2 + O2↑,
K2MnO4 + MnO2 + O2↑,
2KClO3 ![]() 2KCl + 3O2↑,
2KCl + 3O2↑,
2H2O2 ![]() 2H2O + O2↑ (MnO2 – катализатор).
2H2O + O2↑ (MnO2 – катализатор).
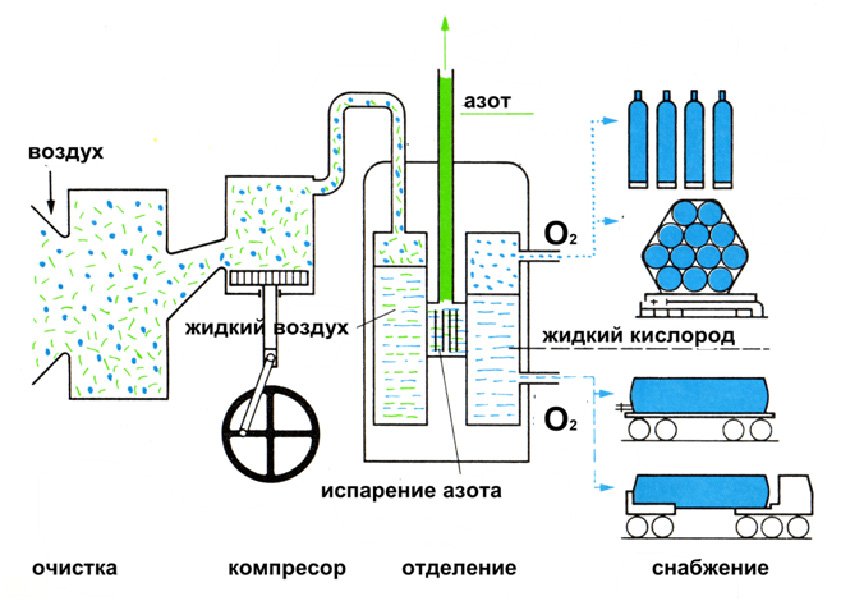
Өнөр жайда кычкылтекти сууну электр тогунун таасири астында ажыратуу менен же суюк абаны фракцияларга буулантып айдоо менен алышат: 2Н2О ![]() 2Н2↑+О2↑ или фракционной перегонкой жидкого воздуха.
2Н2↑+О2↑ или фракционной перегонкой жидкого воздуха.
Суюк абадан адегенде азот, андан кийин кычкылтек бууланат. Бул процессти ректификациялык колоннада бир нече жолу кайталагандан кийин бир аз гана азоттун аралашмасы бар таза кычкылтекти алууга болот.
Озон (О3) – кычкылтектин аллотропиялык түр өзгөрүшү – кычкылтекке караган күчтүү кычкылдандыргыч болуп саналат. Озон тамак–аш содасын, агын сууларды тазалоо үчүн жана медицинада дезинфекциялоочу каражат катары колдонулат.
Көмүртек
Көмүртек эркин абалында 5 аллотропиялык түр өзгөрүүлөрдү пайда кылат, алардын ичинен белгилүүсү алмаз жана графит. Жакында үчүнчү түр өзгөрүшү фуллерен ачылды. Көмүртектин аллотропиялык формалары бири–биринен кристаллдык торчолордун түзүлүшү менен айрымаланышат. Алмаз электр тогун өткөрбөйт, анын кристаллдары жарыкты күчтүү чагылдыруучу касиетке ээ. Графит – металлдык жалтырактыкка ээ, катмарларга бөлүнүп туран боз зат. Катмарларын өзүнчө бөлүп алууга болот. Графит электр тогун өткөрөт. Фуллерен – С60, С70 деген курамдагы сфера формасындагы зат, жасалма жол менен алынган, кийинчерээк күлдүн курамынан табылган.
Кадимки шарттарда көмүртектин бардык аллотропиялык түрлөрү химиялык жактан инерттүү болот, бирок жогорку температурада бул заттар активдүү болуп калат. Ысытканда көмүртек жөнөкөй жана татаал заттар менен реакцияга кирет. Ал металлдар менен аракеттенишкенде карбиддерди – Al4C3 (алюминий карбиди), Mg2C (магний карбиди), кычкылтек менен эки оксидди CO (көмүртектин (II) оксиди), CO2 (көмүртектин (IV) оксиди), күкүрт жана галогендер менен да реакциялашып CS2 (күкүрттүү көмүртекти) жана CCl4 (тетрахлорметанды) пайда кылат. Көмүртек металлдардын оксиди менен реакцияга киргенде кычкылтекти өзүнө кошуп алып, металлдарды калыбына келтирет. Ал күчтүү калыбына келтиргич болуп саналат.
C + CuO ![]() Cu + CO, 2C + PbO2
Cu + CO, 2C + PbO2 ![]() Pb + 2CO
Pb + 2CO
От болуп кызарган көмүр аркылуу суу буусун өткөргөндө суу газы – ис газы жана суутектин аралашмасы алынат:
C + H2O (пар) ![]() CO + H2 (суу газы).
CO + H2 (суу газы).
Бардык органикалык заттардын курамында көмүртек болгондуктан, алар абада күйгөндө, көмүр кычкыл газы, суу жана жылуулук бөлүнүп чыгат.
Көмүртектин бирикмелери
CO2 – көмүр кычкыл газы – көмүртектин оксиди (II), бардык тирүү организмдер дем чыгарганда бөлүнүп чыгат. Көмүр кычкыл газы уулуу эмес, аны менен дем алууга болбойт.
- Магний көмүр кычкыл газында күйөт
- Таң каларлык кургак муз
Жарыктын таасири астында көмүр кычкыл газы (СО2) өсүмдүктөрдүн жалбырагында суу менен кошулуп, фотосинтез процесси жүрөт. Реакциянын натыйжасында глюкоза пайда болот жана абага кычкылтек бөлүнүп чыгат.
6СО2 + 6Н2О ![]() С6Н12О6 + 6О2.
С6Н12О6 + 6О2.
Көмүр кислотасы (Н2СО3) – көмүр кычкыл газынын суу менен аракеттенишүүсүнөн пайда болот (газдалган суу).
Ал эки түрдөгү туздарды пайда кылат: карбонаттар (орто туздар) Na2CO3 – кристаллдык сода, К2СО3 – поташ жана гидрокарбонаттар (кычкыл туздар) NaHCO3 – тамак–аш содасы.
Жер шарындагы эң чоң байлык – бул көмүр отундары болуп саналат. Алар төмөнкүлөр: катуу отундар – көмүр, чым көң, сланец, жыгач отуну, кокс; суюк отундар – нефть, нефть продуктылары; газ абалындагы отундар – жаратылыш жана жолбун газдар.
Көмүрдүн 3 түрү бар: антрацит (95% көмүртектен турат), таш көмүр (90–70% С), күрөң көмүр (65–70% С). Көмүрдү абаны катыштырбай ысытканда учма заттар, аммиак суусу бөлүнүп чыгат да жыгач көмүрү калат. Мындай көмүр каналдардан жана боштуктардан турат жана өзүнө газдарды, уулуу заттарды сиңирип алууга жөндөмдүү болот. Жыгач көмүрүнүн бул касиети адсорбция деп аталат. Чым көң – бул көмүрдүн пайда болушунун биринчи стадиясы болуп саналат. Чым көңдү кургак айдаганда андан чым көң коксу алынат.
Нефть – көмүртектин суутектик бирикмелеринин аралашмасы болуп саналат (150 бирикме бар). Ысытканда: бензин, керосин, газойль, мазут алынат. Нефтиде эриген жолбун газдарды тундуруу жолу менен бөлүп алышат. Жаратылыш газынын курамы 95% – СН4 метандан турат. Көмүртектин бирикмелери жылуулукту көп бөлүп чыгаргандыктан, отун катары колдонулат.
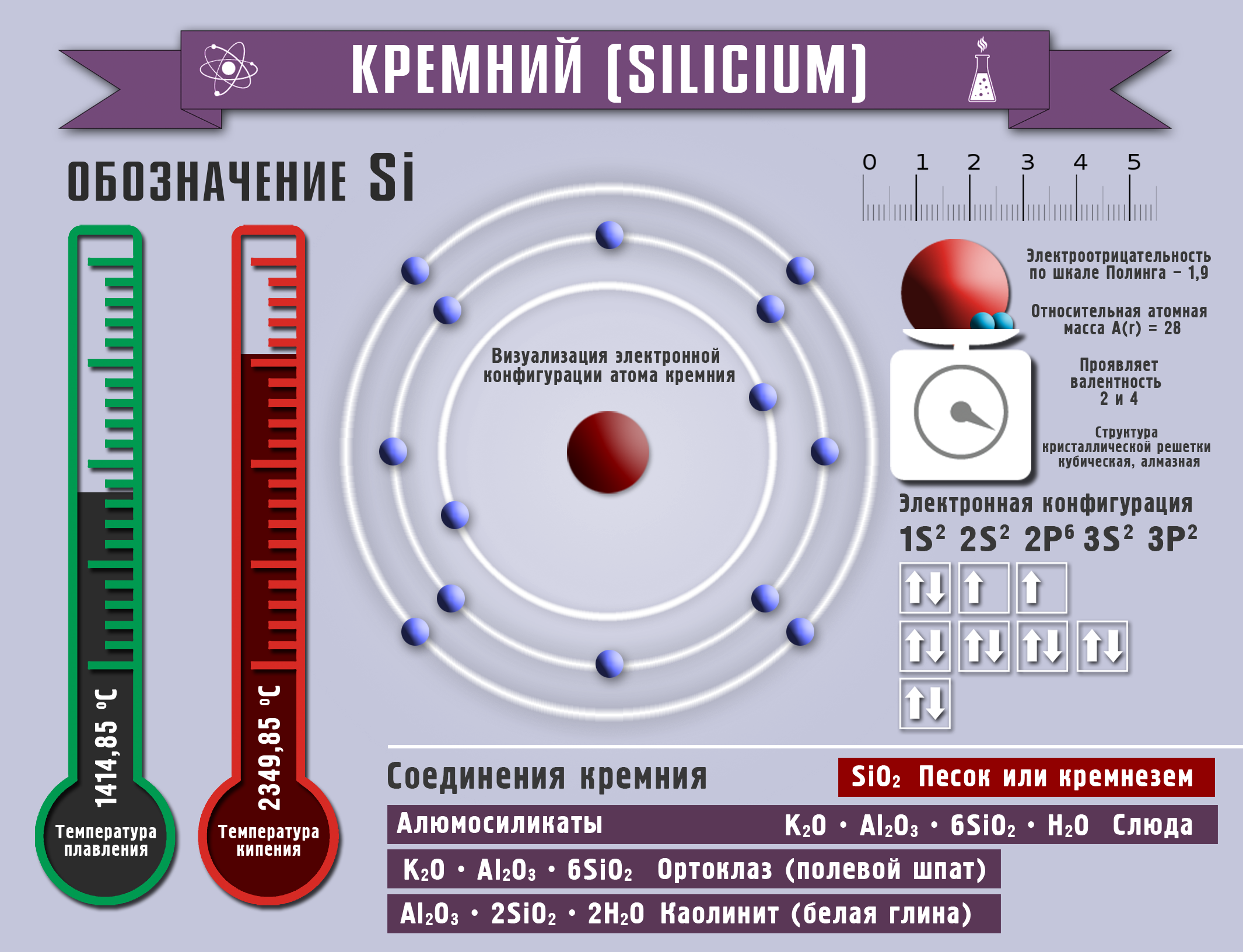
Кремний жана анын бирикмелери

Кремний таза кумду кокс менен бирге ысытуудан алынат SiO2 + 2C ![]() Si +2CO, ал эми лабораторияда активдүү металлдардын оксиддерин калыбына келтирүү менен алууга болот:
Si +2CO, ал эми лабораторияда активдүү металлдардын оксиддерин калыбына келтирүү менен алууга болот:
SiO2 + 2Mg ![]() Si + 2MgO,
Si + 2MgO,
3SiO2 + 4Al ![]() 3Si +2Al2O3
3Si +2Al2O3
Реакциянын натыйжасында алынган аморфтуу кремний өтө активдүү болот, ал электр тогун өткөрүүгө жөндөмдүү. Кремний IVА группанын элементи, 2,4, деген валенттүүлүктөрдү көрсөтөт жана кычкылдануу даражасы –4 төн +2, +4 барабар болот.
Кадимки шарттарда кремний фтор менен гана реакцияга кирет, жогорулатылган температурада хлор, бром менен, ал эми жогорку температурада азот жана көмүртек менен аракеттенишип,, кремнийдин карбидин (же карборундду SiC). пайда кылат. Кычкылтекте кремний күйөт. Кислоталар (плавик кислотасынан башкасы) кремнийге таасир этпейт, бирок щелочтордун эритмелери аны менен реакцияга кирет.
SiO2 – кислоталык оксид, сууда эрибейт. Кремнийдин оксиди плавик кислотасы менен гана реакциялашат:
SiO2 + 4HF ![]() SiF4 + 2H2O. Бул реакция айнектерди кайра иштетүүдө колдонулат (химиялык стакандагы белгилерди карагыла).
SiF4 + 2H2O. Бул реакция айнектерди кайра иштетүүдө колдонулат (химиялык стакандагы белгилерди карагыла).
Кремнийдин оксидинен – кремний кислотасы (H2SiO3) алынат, ал сууда эрибейт, начар кислота катары белгилүү. Ал эми кремний кислотасынын тузу – натрий силикаты канцелярдык же силикат желими деген ат менен белгилүү. Алар сууда жакшы эришет, силикат желимин тактайга же кездемелерге сиңирсе, алар отко туруктуу болуп, ным өткөрбөй калышат. Кремний кислотасынын туздары – натрий жана калий силикаты (Na2SiO3, K2SiO3) эригич айнек деп аталат. Силикаттар курулуш материалдары катары колдонулат. Алардан айнек, цемент, керамика, фарфор жана фаянс алынат.
Азот

N2 – азот – түссүз, жытсыз, даамсыз газ. tкайн. –196oС, tэрүү. –210oС. Абанын 78,1% түзөт, инерттүү. –140oС суюктукка айланат. Азотту өнөр жайда абаны конденсациялоо менен, ал эми лабораторияда аммоний нитратын ажыратуу аркылуу алышат:
NH4NO2 ![]() N2 + 2H2O
N2 + 2H2O
Кадимки температурада азот литий менен, ал эми жогорку температурада башка металлдар (Mg,Ca). менен да реакцияга кирет. Азот кычкылдандыргыч да (NH3), калыбына–келтиргич (NO) да боло алат. Суутек менен аракеттенишип, аммиакты пайда кылат. Аммиак NH3 – кескин жыттуу газ.
Аммиак суу менен аракеттенишип, NH4OH – аммонийдин гидроксидин пайда кылат. Аммоний гидроксиди сууда эрийт, бирок начар негиз болуп саналат.
Аммиак башка заттар менен донор–акцептордук байланыш менен байланышып, аммоний туздарын пайда кылат.Алар негизинен жер семирткич катары колдонулат. Мисалы, аммоний дигидрофосфаты NH4H2PO4, аммонийдин гидрофосфаты (NH4)2HPO4. Амонийдин туздарына щелочту таасир эткенде аммиак бөлүнүп чыгат. б.а. аммиактын кескин жыты пайда болот.
Азот кычкылданып, газ абалындагы оксиддерди пайда кылат. N2O – «көңүл көтөрүүчү газ», бул газ менен дем алганда, ал наркоз катары таасир эткендиктен, аны хирургиялык операция убагында пайдаланышат, NO, NO2 – өңүнө карата «түлкүнүн куйругу» деп аташат.
Азот образует азотную кислоту (HNO3).
Азот кислотасы
Азот кислотасы башка кислоталардан күчтүү кычкылдандыруучу касиети менен айрымаланып турат. HNO3 – кескин жыттуу, түссүз суюктук, оңой бууланат, 86oС кайнайт. Концентрацияланган азот кислотасы адатта сары түстө болот. Мындай түстү ага азоттун (IV) оксиди берет, азоттун оксиди болсо, азот кислотасынын анча–мынча ажырашынын натыйжасында пайда болот. Азот кислотасы менен иштегенде коопсуздукту сактабаса өрт чыгып кетиши мүмкүн, себеби, күйгөн чычаланы азот кислотасынын эритмесине жакындатканда ал өзүнөн–өзү от алып күйөт.
Өнөр жайда азот кислотасын катализаторду катыштырып, аммиакты абанын кычкылтеги менен кычкылдандырып алышат. Лабораторияда азот кислотасын концентрацияланган күкүрт кислотасын натрийдин же калийдин кристаллдык нитратына таасир этип, бир аз ысытуу менен алышат.
Азот кислотасынын туздары ысытканда азоттун оксидин жана кычкылтекти пайда кылуу менен ажырайт, ошондуктан, аларды сактоодо өрт коопсуздугунун эрежелерине өзгөчө көңүл буруу керек.
Азот кислотасынын дагы бир өзгөчөлүгү, анын металлдар жана металл эместер менен аракеттенишкенде ар түрдүү заттарды пайда кылгандыгы болуп саналат.
Азот кислотасынын металл эместер менен аракеттенүүсү:
- 4HNO3(конц.) + C
 CO2 +4NO2 +2H2O
CO2 +4NO2 +2H2O
- (көмүртек менен концентрацияланган азот кислотасы гана реакцияга кирет, мында азоттун (IV)оксиди NO2 бөлүнүп чыгат,себеби, көмүртектин кристаллдык торчосу өтө бекем болот)
- P + 5HNO3(конц)
 HPO3 + 5NO2 + 2H2O
HPO3 + 5NO2 + 2H2O - 3P +5HNO3(разб)
 3H3PO4 +5NO+ 2H2O
3H3PO4 +5NO+ 2H2O - S +6HNO3 (конц)
 H2SO4 +6NO2 +2H2O
H2SO4 +6NO2 +2H2O - S +2HNO3(разб)
 H2SO4 +2NO
H2SO4 +2NO - B + 3HNO3(конц)
 H3BO3 +3NO2
H3BO3 +3NO2
- (Бор концентрацияланган азот кислотасы менен гана аракеттенишет)
Азот кислотасынын металлдар менен аракеттенүүсү:
Азот кислотасынын металлдар менен болгон аракеттенишүүсү кычкылдануу–калыбына келүү реакциясы менен жүрөт, мында металлдардын, азот кислотасынын курамындагы азоттун кычкылдануу даражасы өзгөрөт.
- Азот кислотасы металлдар менен реакцияга киргенде суутек (Н2) бөлүнүп чыкпайт.
- Бул учурда газ абалындагы кычкылдануу даражалары ар башка болгон азоттун оксиддери же аммиак бөлүнүп чыгат.
- Бөлүнүп чыккан газ абалындагы заттардын кычкылдануу даражалары кислотанын концентрациясына байланыштуу болот.
- Ошону менен катар эле бөлүнүп чыккан газ абалындагы заттардын кычкылдануу даражалары металлдын тыгыздыгына да көз каранды болот (тыгыздыгы 5 г/см3 жогору болгондор – оор металлдар же тыгыздыгы 5 г/ см3 төмөн болгондор– жеңил металлдар).
Азот кислотасынын металлдар менен аракеттенишүүсүнүн закон ченемдүүлүктөрү:
- Металлдар азот кислотасы (HNO3) менен реакцияга кирип, оксиддерди пайда кылат. Эгерде кычкылдануу даражасы +3 болгон металлдын оксиди пайда болсо, ал металлдар жука оксид пленкасы менен капталып калат б.а. алардын активдүүлүгү төмөндөйт. (Fe, Cr, Al, Au, Pt, Ir, Tl.).Бул пленка андан ары металлды кислотанын таасиринен сактап турат.
3Al + 12HNO3 ![]() Al(NO3)3 +Al2O3 +9NO2 +6H2O (пленканын калыңдыгы Al2O3=10–5 метр).
Al(NO3)3 +Al2O3 +9NO2 +6H2O (пленканын калыңдыгы Al2O3=10–5 метр).
- Концентрацияланган азот кислотасы (HNO3) төмөнкү металлдар менен реакцияга кирбейт (Pt, Au, Ir, Tl).
- Концентрацияланган азот кислотасы оор металлдар менен реакцияга киргенде азот (IV) оксиди (NO2) бөлүнүп чыгат
Cu + 4HNO3(конц) ![]() Cu(NO3)2 +2NO2↑ + H2O
Cu(NO3)2 +2NO2↑ + H2O
- Ал эми оор металлдар менен суюлтулган азот кислотасы реакцияга киргенде азот (II) оксиди (NO) бөлүнүп чыгат
3Cu +8HNO3(суюл.) ![]() 3Cu(NO3)2 +2NO↑ +4H2O
3Cu(NO3)2 +2NO↑ +4H2O
- Жеңил металлдар концентрацияланган азот кислотасы менен реакциялашканда азот(I) оксиди N2O, кээ бир учурда N2 – (азот кислотасынын концентрациясына жараша) бөлүнүп чыгат.
4Mg +10HNO3(конц) ![]() 4Mg(NO3)2 +N2O +5H2O
4Mg(NO3)2 +N2O +5H2O
5Mg +12HNO3(суюл.) ![]() 5Mg(NO3)2 +N2 +6H2O (Mg, Zn).
5Mg(NO3)2 +N2 +6H2O (Mg, Zn).
- Ал эми жеңил металлдар суюлтулган азот кислотасы менен реакцияга киргенде, аммиак (NH3) бөлүнүп чыгат, бирок аммиак ошол замат эле азот кислотасы менен аракеттенишип, аммонийдин нитратын пайда кылат:
NH3 + HNO3 ![]() NH4NO3
NH4NO3
4Mg +10HNO3(очень разб) ![]() 4Mg(NO3)2 + NH4NO3 + 3H2O
4Mg(NO3)2 + NH4NO3 + 3H2O
4Zn +10HNO3(очень разб) ![]() 4Zn(NO3)2 +NH4NO3 + 3H2O
4Zn(NO3)2 +NH4NO3 + 3H2O
- Алюминий (Al) өтө суюлтулган азот кислотасы менен аракеттенгенде азот(II) оксиди (NO) бөлүнүп чыгат.
Al + 4HNO3(суюл.) ![]() Al(NO3)3 +NO +2H2O
Al(NO3)3 +NO +2H2O
- Азот кислотасы менен реакцияга киргенде скандий өзүн жеңил металл катары алып жүрөт, кычкылдануу даражасы +3 барабар болот.
8Sc +30HNO3(өтө суюл) ![]() 8Sс(NO3)3 +3NH4NO3 +9H2O
8Sс(NO3)3 +3NH4NO3 +9H2O
- Азот кислотасынын өтө суютулган эритмеси кальций (Ca) жана (Mg) менен аракеттенгенде, бул металлдар суутекти сүрүп чыгарат (кээ бир учурда гана).
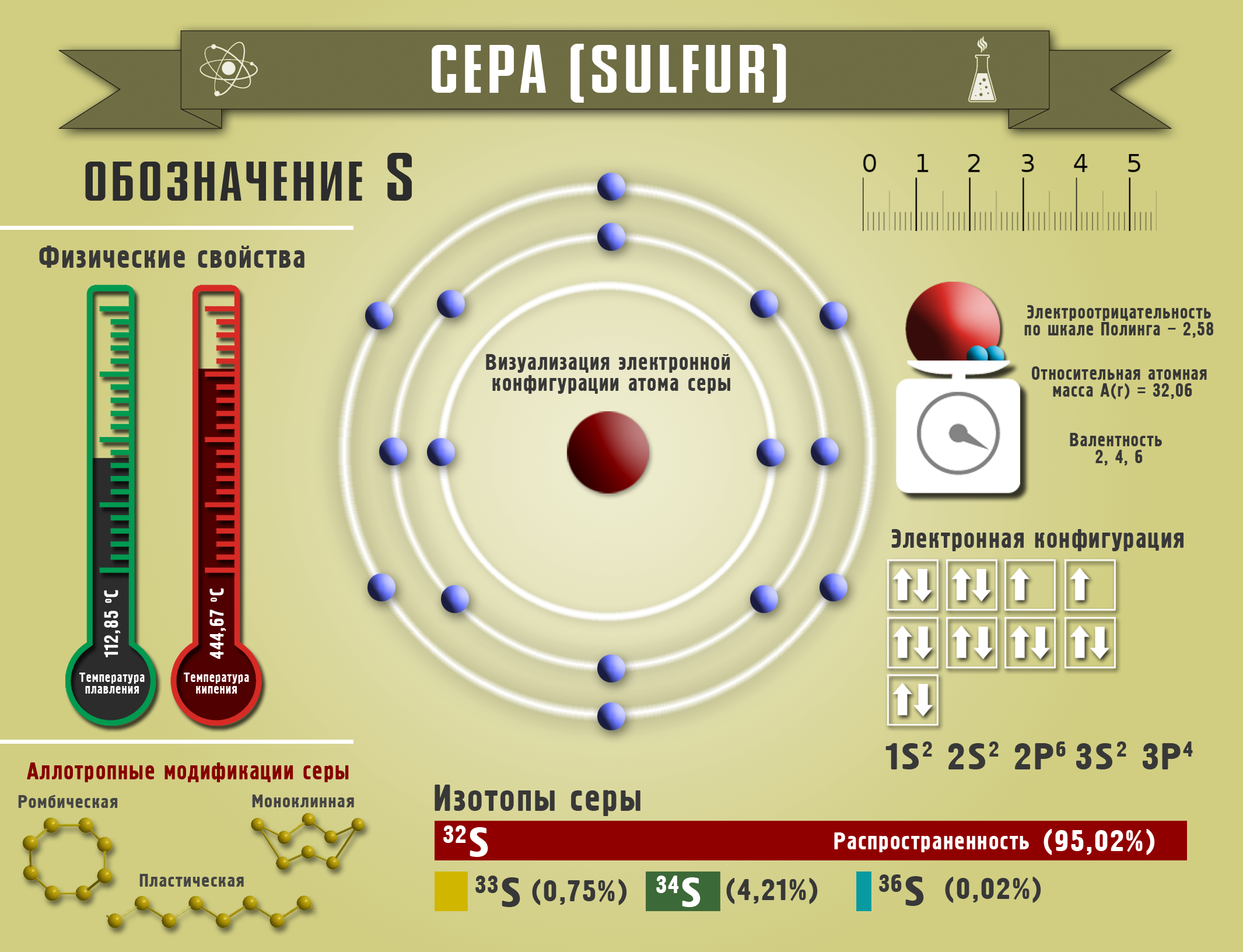
Күкүрт

Эркин абалында күкүрттүн бир нече аллотропиялык түр өзгөрүүлөрү бар. Алардын ичинен үч түрү белгилүү: курамы (S8) болгон ромб түрүндөгү күкүрт (α–күкүрт), моноклиндик (β–күкүрт) жана ар кандай узундуктагы циклдик чынжырча түрдөгү пластикалык күкүрт (каучук сыяктуу).
Күкүрттү эркин абалында башка тоо тектеринен бөлүү үчүн анын оңой эригичтиги пайдаланылат. Күкүрт алынуучу минералга түтүктөр аркылуу суунун буусун үйлөтүшөт. Күкүрт эриген абалында түтүктөр аркылуу көтөрүлүп чыгат, муздаганда ромб түрүндөгү күкүрткө айланат. Курамында күкүртү бар ар бир минералдан күкүрттү алууга болот. Күкүрт жаныбарлардын жүнүндө, канаттуулардын канатында, жаныбарлардын жана өсүмдүктөрдүн калдыктарында да кездешет. Адам денесинде орто эсеп менен 1,5 кг фосфор кездешсе, анын 1,4 кг – сөөктө; булчуңда – 130 г; мээде жана нерв системасында – 12 г болот.
Жаратылышта күкүрт – пириттин Fe2S (темир колчеданы), жез жаркырагынын СuS, – күмүш жаркырагынын Ag2S, коргошун жаркырагынын PbS ошондой эле сульфаттар CaSO4 • 2H2O – жаратылыш гипсинин, Na2SO4 • 10H2O – мирабилиттин, глаубер тузунун, MgSO4 • 7H2O – ачуу (англия) туздун жана FeSO4 • 7H2O – темир купоросунун курамына кирет. Күкүрт металлдар (Al, Fe) жана металл эместер (C, P, H2) менен реакцияга кирет. Абада жана таза кычкылтекте күкүрт көгүш жалын чыгарып күйөт.
S + O2 ![]() SO2.
SO2.
Татаал заттардын ичинен күкүрт күкүрт, азот кислоталары жана щелочтор менен реакцияга кирет.
Күкүрт күкүрттүн гидридин (Н2S) – сасыган жумуртка жыттанган газды пайда кылат. Күкүрттүү суутек уулуу болот, сууда начар эрийт (1 литр сууда 2,5 көлөм), ал эми анын эритмеси күкүрттүү суутек кислотасы болуп эсептелет.
- Күкүрт эки оксидди – 4 валенттүү күкүрт оксидин (IV) SO2 жана 6 валенттүү (SO3) (VI) күкүрттүн оксидин пайда кылат. SO2 (IV) күкүрттүү газ абадан 2 эсе оор, кескин жыттуу түссүз газ, сууда жакшы эрийт, сууда эригенде начар кислота – күкүрттүү кислота (H2SO3) пайда болот.
- Экинчи оксид (SO3) (VI) – күкүрт оксиди – түссүз, тез кайноочу суюктук +17oC ак түстөгү гигроскоптуу кристаллдарга айланат, сууда жакшы эрийт да күчтүү кислота–күкүрт кислотасын (H2SO4). пайда кылат. Күкүрт (VI) оксиди SO3 күкүрт кислотасында эрүү менен олеумду пайда кылат. H2SO4 + nSO3
 H2SO4 • nSO3 (олеум). Концентрацияланган күкүрт кислотасы көмүртекти көмүр кычкыл газына чейин кычкылдандырат. Ал органикалык заттарды (кантты) көмүргө айландырат.
H2SO4 • nSO3 (олеум). Концентрацияланган күкүрт кислотасы көмүртекти көмүр кычкыл газына чейин кычкылдандырат. Ал органикалык заттарды (кантты) көмүргө айландырат.
Күкүрт кислотасы өнөр жайда жана лабораторияда газдарды кургатууда, башка кислоталарды, жер семирткичтерди жана боёкторду алууда колдонулат. Күкүрт кислотасынын көпчүлүк туздары сульфаттар– кристаллогидраттар болуп саналат. Алар: CuSO4 • 5H2O – жез купоросу, FeSO4 • 7H2O – темир купоросу.
Күкүрт кислотасы
Күкүрт кислотасынын металл эместер менен аракеттенүүсү:
- С + 2H2SO4
 CO2↑ + 2SO2↑ + 2H2O
CO2↑ + 2SO2↑ + 2H2O
S + 2H2SO4 3SO2↑ + 2H2O
3SO2↑ + 2H2O
Реакциянын жүрүшүн видеодон көрө аласыңар
Күкүрт кислотасынын металлдар менен аракеттениши:
- Концентрацияланган күкүрт кислотасы темирдин Fe, хромдун Cr жана алюминийдин Al активдүүлүгүн төмөндөтөт, ошондуктан, аны темир же алюминий цистерналарында ташышат.
- Активдүүлүгү төмөн металлдарды (жезден баштап Cu) концентрацияланган күкүрт кислотасы менен ысытканда газ абалындагы күкүрттүн (IV) оксиди бөлүнүп чыгат.
Cu + 2H2SO4(конц.) ![]() CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
- Күкүрт кислотасы (H2SO4) активдүү металлдар менен реакциялашканда концентрациясына карата ар түрдүү заттар алынат:
- Zn + 2H2SO4(конц.)
 ZnSO4 + SO2↑ + 2H2O
ZnSO4 + SO2↑ + 2H2O - 3Zn + 4H2SO4(50%)
 3ZnSO4 + S↓ + 4H2O
3ZnSO4 + S↓ + 4H2O - 4Zn + 5H2SO4(20%)
 4ZnSO4 + H2S↑ + 4H2O
4ZnSO4 + H2S↑ + 4H2O - Zn + H2SO4(5-8%)
 ZnSO4 + H2↑ (суутекке чейинки металлдар)
ZnSO4 + H2↑ (суутекке чейинки металлдар)
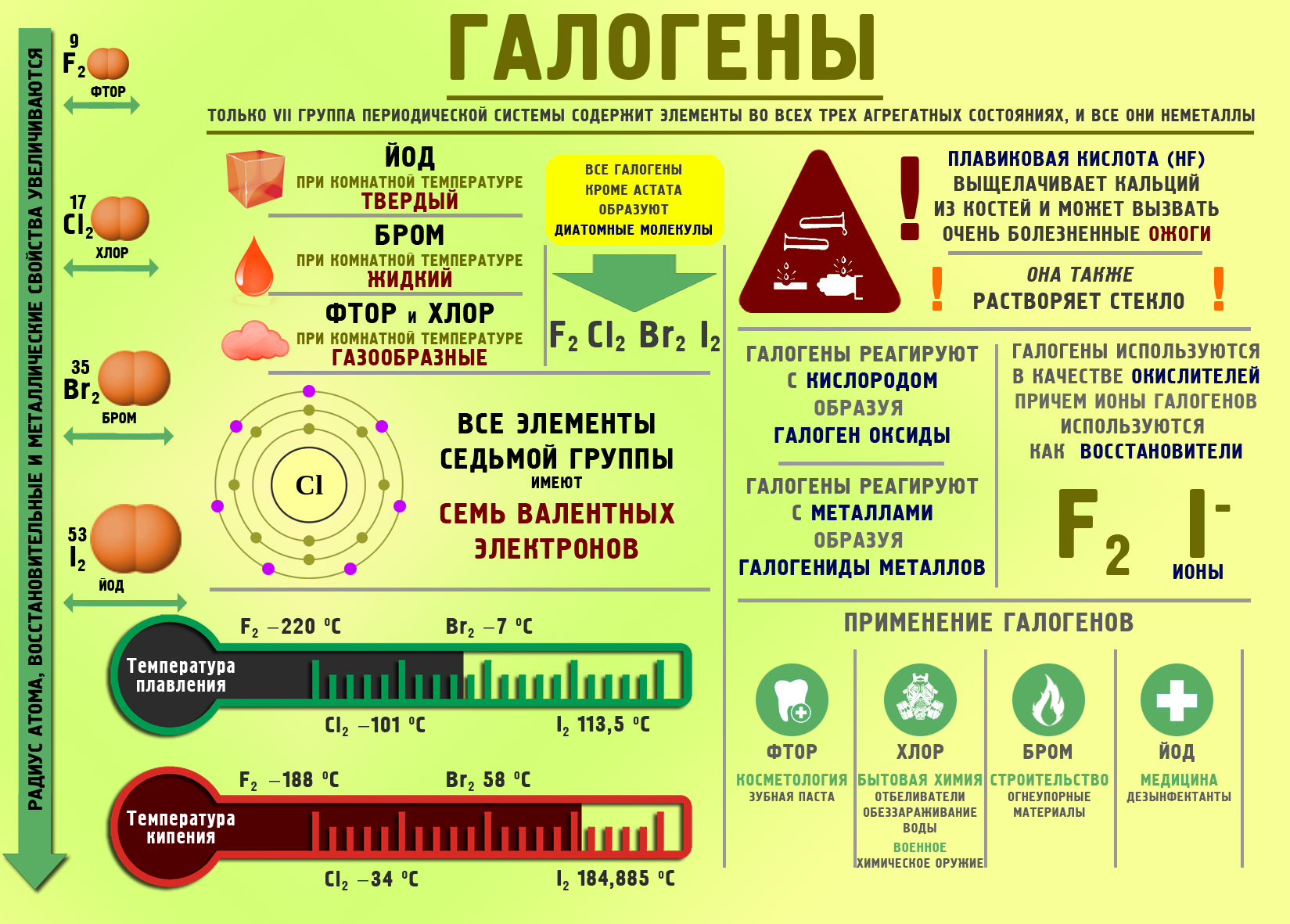
Галогендер
Галогендер («туз пайда кылуучу») деген маанини билдирет, аларга VII A группанын элементтери: F, Cl, Br, I, At кирет.
Фтор (F) – эң күчтүү кычкылдандыргыч, валенттүүлүгү 1 ге, кычкылдануу даражасы – 1ге барабар
Башка галогендер кычкылдандыргыч да калыбына–келтиргич да боло алышат.
Хлор (Cl) – VII A группын элементтеринин өкүлү – терс электрдүүлүгү 3,0 барабар болгон жана сырткы электрондук катмарында 7 электрону бар күчтүү кычкылдандыргыч. Ошондуктан, хлор бирикмелеринде 1,3,5,7 деген валенттүүлүктү көрсөтөт. Хлор 1774–жылы швед окумуштуусу Шееле тарабынан ачылган. Жер шарында таралышы боюнча он биринчи орунда турат. Ал деңиз сууларынын, өсүмдүктөрдүн хлорофиллинин, жаныбарлардын тканында – кандын плазмасынын жана карын зилинин курамында болот. Жер кыртышынын 0,05% түзөт.
Хлор (Cl2) – сары–жашыл түстөгү уулуу газ, башка заттар менен реакцияга кубаттуу кирет, абадан 2,5 эсе оор. Суутек менен реакциялашканда хлордуу суутекти пайда кылат, хлордуу суутек сууда эригенде туз кислотасы (HCl). алынат Жаратылышта хлор таш тузунун, галиттин – (NaCl, сильвиниттин – (KCl • NaCl), карнаилиттин – (KCl • MgCl • H2O), каиниттин – (KCl • MgSO4 • H2O) курамында кездешет. Хлор күкүрт, фосфор жана натрий менен реакцияга кирет.
Хлордун кислоталык бирикмелери
Хлордуу суутек (туз) кислотасы башка кислоталар сыяктуу эле металлдар, негиздик оксиддер жана туздар менен реакцияга кирет. Хлор ичүүчү сууларды тазалоодо, ткандарды, кагаздарды агартууда жана хлор акиташын CaCl(OСl) өндүрүүдө колдонулат.
- Фтор хлорду,бромду жана иодду алардын туздарынан жана кислоталарынан сүрүп чыгат. Хлор бромду,иодду, бром иодду гана сүрүп чыгарат. (Мисалы: Cl2 +2KI
 2KCl +I2 ↓), б.а. терс электрлүүлүгү күчтүү элементтер начарыраактарын алардын кислоталарынын жана туздарынын эритмелеринен сүрүп чыгарат.
2KCl +I2 ↓), б.а. терс электрлүүлүгү күчтүү элементтер начарыраактарын алардын кислоталарынын жана туздарынын эритмелеринен сүрүп чыгарат. - Фтор эң күчтүү кычкылдандыргыч, кремнийдин бирикмелери менен реакцияга кирет.
- Астат – радиоактивдүү, аз изилденген туруксуз изотоп.
- Бардык галогенсуутектер газ абалында болушат, сууда жакшы эришет.
- Галогенсуутектердин суудагы эритмелери кислота болуп саналат.
- Хлор менен бир аз эле дем алса ал дем алуу органдарынын жабыркоосуна жана жөтөлгө алып келет.
- 1 көлөм сууда 2,5 колөм хлор эрип, хлор суусун пайда кылат (7,9 г/л). Cl2 + H2O
 HCl + HClO
HCl + HClO - Суюлтулган хлор 600кПа басым астында болоттон жасалган баллондордо сакталат. Лабораторияда хлор калий перманганатына туз кислотасын таасир этип, ысытуунун натыйжасында алынат:
2KMnO4 +16HCl ![]() 2MnCl2 + 2KCl + 8H2O + 5Cl2 ↑
2MnCl2 + 2KCl + 8H2O + 5Cl2 ↑
- Өнөр жайда хлор кайнатма туздун NaCl концентарцияланган эритмесин электоролиздөө жолу менен алынат: 2NaCl
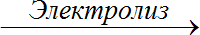 2Na + Cl2 ↑
2Na + Cl2 ↑ - Адамдын организминде 200 граммга чейинки өлчөмдө натрий хлориди бар.
- Туз кислотасы металлдардын үстүнкү катмарын тазалоо жана жасалгалоо иштеринде, тамак–аш өнөр жайында, медицинада колдонулат.
- Хлор – органикалык бирикмелерди алуу үчун сырье катары колдонулат.
Курамында хлору бар кислоталар:
HCl –хлордуусуутек, туз кислотасы, кислоталык калдыгы – (-Cl – хлорид)
HСlO – гипохлорит кислотасы, кислоталык калдыгы (-ClO – гипохлорит)
HСlO2 – хлорит кислотасы,, кислоталык калдыгы (-ClO2 – хлорит)
HСlO3 – хлорат кислотасы, кислоталык калдыгы (-ClO3 – хлорат)
HСlO4 – перхлорат кислотасы, кислоталык калдыгы (-ClO4 – перхлорат)
Йод (I2) – кочкул түстөгү кристаллдар. Ысытканда суюктукка айланбай туруп эле бууланат. Иоддун бул касиети (кургак айдоо же сублимация деп аталат).
Фосфор

Фосфор жөнөкөй зат катары үч аллотропиялык модификацияны пайда кылат: ак, кызыл жана кара фосфор. Булар катуу, кристаллдык же аморфтук заттар. Кызыл фосфор металл эместик касиетти алып жүрөт. Кара фосфор графитке окшош, майлуу, жарым өткөргүч болуп саналат, металлдык касиетке ээ. Ак фосфор – активдүү металл эмес, фтор, хлор, күкүрт жана кычкылтек менен реакцияга кирет.
Ысытканда фосфор активдүү металлдар– натрий жана кальций менен аракеттенишет. Ак фосфор кызыл фосфорду алуу үчүн колдонулат, ал эми кызыл фосфор ширеңке өндүрүүдө пайдаланылат. Фосфордон фосфор кислотасы алынат, ал эми фосфор кислотасынан минералдык жер семирткичтер өндүрүлөт.
Фосфор эркин түрүндө кальций фосфатынан Ca3(PO4)2 алынат. Ошондой эле фосфордон фосфин (PH3) газы алынат. Фосфин–түссүз, чеснок жыттанган, уулуу газ. Фосфордун эки оксиди бар: Р2О3 – фосфордун(III) оксиди – ак кристаллдык зат, өтө уулуу. Бул оксиддин суудагы эритмеси фосфордуу кислотаны (H3PO3) пайда кылат. Р2О5 – фосфордун (V) оксиди – ак түстөгү гигроскоптуу (суу буусун өзүнө сиңирип алган) кристаллдар. Бул оксидге эки кислота туура келет – метафосфор кислотасы (НРО3) жана ортофосфор кислотасы (Н3РО4). Бул – түссүз кристаллдык зат, +42оС балкып эрийт, уулуу эмес, сууда жакшы эрийт.
Өнөр жайда фосфор кислотасын фосфориттерди жана апатиттерди концентрацияланган күкүрт кислотасы менен аракеттештирип, ысытуу менен алышат.
Ca3(PO4)2 + 3H2SO4 ![]() 3CaSO4 ↓ + 2H3PO4.
3CaSO4 ↓ + 2H3PO4.
Фосфор кислотасынын туздары жер семирткич катары колдонулат.
Пайдалуу ссылкалар
Глоссарий
- Ассимилировать – өздөштүрүү
- Кургак айдоо же сублимация – катуу затты бууландырып, суюктукка өткөрбөй туруп газ абалындагы затты алуу. Бул касиет иодго – (I2) мүнөздүү.
- Вулканизация – күкүрттүн таасири астында каучуктун резинага айланышы.
- Гидратация – сууну кошуп алуу.
- Донор–акцептор байланышы – бул бир атомдогу (донор) жуп электрондук булуттан жана башка атомдогу (акцептор) бош орбиталдын эсебинен пайда болот.
- Идентификациялоо – окшоштуктуруу, дал келүүчүлүктү аныктоо.
- Изотоп – бир эле химиялык элементтин электрондорунун жана протондорунун саны бирдей, бирок нейтрондорунун саны ар башка болгон түрлөрү (катар саны бирдей, бирок атомдук массасы ар башка болот).
- Инертный –
- Инсектицид – зыяндуу курт–кумурскалар менен күрөшүүнүн каражаты.
- Парамагнетизм – заттын магнитке тартылуу касиети.
- Сфера – шар формасында.
- Терс электрдүүлүк – атомдордун электрондорду өзүнө тартып алуу жөндөмдүүлүгү.
- Эндотермикалык – жылуулукту сиңирип алуу.
Библиография
- А.А. Журин «Химические формулы». Москва «Аквариум» 1997г.
- А.А. Карцова, А.А.Макаров, А.В.Трухин. Справочник школьника. Химия. Биология.Экология. Санкт-Петербург. «Сова». Москва.»ЭКСМО-ПРЕСС». 2002.
- А.В. Мешельский. Химия в экзаменационных вопросах и ответах. Справочник для учителей , репетиторов и абитуриентов. Изд. 2. Минск, «Белорусская энциклопедия». 1999.
- А.Г. Кульман. «Общая химия». Изд. 3. Москва «Колос». 1979.
- А.Годмен «Иллюстрированный химический словарь» Москва «Мир» 1988.
- А.И. Бусеев, И.П. Ефимов. Словарь химических терминов. Москва «Просвещение» 1971.
- А.П. Крешков «Основы аналитической химии». Москва «Химия» 1976.
- Большой справочник для школьников и поступающих в Вузы. «Химия». /Л.Л.Андреева, Д.Ю. Добротин, О.С. Габриелян и др./ «Дрофа», Москва, 2004
- В.А. Волков, Е.В. Вонский, Г.И. Кузнецова. «Химики» Биографический справочник. Киев «наукова Думка» 1984.
- В.А. Рабинович. З.Я.Хавин. «Краткий химический справочник» изд. 3 Ленинград. «Химия». 1991г.
- В.В Писаренко. Справочник химика – лаборанта. Изд. 2 Москва. «Высшая школа» 1974.
- В. Рич. «В поисках элементов». Москва «Химия» 1985г.
- В. Рич «Охота за элементами». Москва «Химия» 1982г.
- Г.Е. Рудзитис. Ф.Г. Фельдман «Химия 8». Учебник для 8 класса средней школы. Изд.2 Москва «Просвещение». 1991.
- Г.П. Хомченко «Химия для поступающих в ВУЗы». Изд. 2. Москва «Высшая школа» 1994г.
- Д. Верзейм. К. Ослейд. Д. Ватерхаус «Химия». Школьный иллюстрированный справочник. (перевод с латинского) РОСМЭН. First published. Лондон 1986г.
- Д.И. Менделеев «Основы химии» Изд. 13. 1947г., 2 тома Москва - Ленинград. (Санкт – Петербург, 1872)
- Д.М. Кирюшкин. В.С. Полосин «Методика обучения химии». Москва «Просвещение» 1970г.
- Дж.А. Кемпбел «Современная общая химия» в 3 т. (перевод с английского). Москва «Мир» 1975г.
- З. Энгельс, А. Новок «По следам элементов» (пер с нем.) Москва «Металлургия» 1983г.
- И.В. Кузьменко, В.В. Ерёмин, В.А. Попков «Начала химии. Современный курс для поступающих в ВУЗы» 2 т. Москва 1-я книготорговая компания. 1979г.
- И.В. Кузьменко. В.В. Ерёмин. В.А. Попков. «Химия для школьников старших классов и поступающих в ВУЗы» Москва «Дрофа» 1985 г.
- И.В. Шиманович. М.Л. Павлович. В.Ф. Тикавый. П.М. Малашко. (ред. В.Ф. Тикавого). Общая химия в формулах, определениях, схемах. Минск «Унiверсiтэцкае» 1996г.
- И.Т. Гороновский. Ю.П. Назаренко. Е.Ф. Некряч «Краткий справочник по химии». Изд. 4. Киев «Наукова Думка» 1974.
- К.Я. Парменов «Химический эксперимент в средней школе». Изд. Академии педагогических наук РСФСР. Москва 1959г.
- Книга для чтения по химии. Часть I (сост. К.Я. Парменов, Л.М. Сморгонский). Изд. 3. Государственное учебно-педагогическое издательство министерства просвещения РСФСР. Москва 1961г.
- Л.М. Монастырский «Физика за 2 года». Ростов-на-Дону «Феникс» 1995г.
- Л.Полинг «Химия» (перевод с английского). Москва «Мир» 1968г.
- М. Колтун «Мир химии» Москва «Детская литература». 1988.
- М. Колтун «Превращения черного дракона» Москва. «Детская литература» 1990.
- М. Льис Химия. Школьный курс в 100 таблицах. Москва. Аст-Пресс 1997.
- М.М. Петров, М.А. Михелев, Ю.Н. Кукушкин. «Неорганическая химия». Изд 2 Ленинград «Химия» 1976 г.
- М. Фримантл «Химия в действии» в 2х частях. (пер. с английского) Москва «Мир» 1991.
- М.И. Гельфман, В.П. Юстратов «Химия». Санкт – Петербург. Издательство «Лань» 2000 г.
- Н.И. Кошкин. М.Г. Ширкевич. «Справочник по элементарной физике» Москва «Наука» 1966.
- Н.С. Ахметов «Неорганическая химия», в 2-х частях, изд. III, Москва «просвещение». 1992г.
- Общая и педагогическая химия. Методические указания. Москва. «Высшая школа» 1990г.
- П.И Воскресенский «Техника лабораторных работ». Изд. 10е. Москва «Химия» 1973г.
- П.Р. Таубе «От водорода, до …?» Москва «Высшая школа» 1964 г.
- Популярная библиотека химических элементов (сост. В.В. Станцо, М.В. Черченко) Москва «Наука» 1983.
- Р.А. Лидин «Справочник по общей и неорганической химии». Москва «Просвещение» 1997г.
- Р.П. Суровцева. Л.С. Гузей Н.И. Останний, А.О. Тамур. «Тесты. Химия». 8-9 класс. Москва. Издательский дом «Дрофа» 1997.
- С.Б. Шустов. Л.В. Шустова. Химические основы экологии». Москва «Просвещение» 1995.
- Н.А.Варкентина, Р.Х.Дженлода «Химические элементы в школьном курсе химии». Бишкек, «Азия Технографика», 2010 г.
- Урок окончен – занятие продолжаются. (ред. Э.Г. Злотникова) Москва «Просвещение» 1992 г.
- Учебный справочник школьника «Дрофа». Москва. 2002. 4-е издание. Ред.Н.Е. Рудомазина и др.
- Ф.Г. Фельдман, Г.Е. Рудзитис «Химия 9» учебник для 9 класса средней школы. Москва «Просвещение».
- Физика и химия. «Универсальная энциклопедия школьника». Минск. «Валев». 1995г.(сост. А.А.Воротников).
- Химическая энциклопедия том 1-2. (ред. И.Л. Кнунянц) Москва. Издательство «Советская энциклопедия». 1988.
- Химия в формулах. Справочное пособие. 8-11 класс. Состав В.В. Ерёмин. Москва. Издательский дом «Дрофа».
- Химия. (пер. с немецкого В.А. Молочко. С.В. Крынкиной). Москва «Химия» 1989.
- Химия. Пособие – репетитор. (ред. А.Ф. Егоров) изд. 2 Ростов-на-Дону «Феникс» 2000г.
- Химия. Справочник школьника (научная разработка и составление М. Кременчугской и С. Васильева) Филологическое общество «Слово» Компания «Ключ-С». ТКОАСТ. Центр гуманитарных наук при факультете журналистики МГУ им. Ломоносова. Москва 1997.
- Химия. Справочное руководство (пер. с немецкого) оед. Ф.Г. Гаврюченкова, М.И. Курочкиной, А.А. Потехина. В.А Рабиновича). Ленинград «Химия»
- Химия: справочные материалы ( под ред. Ю.Д. Третьякова I-III изд. Москва «Просвещение» 1984, 1988, 19993 г.
- Э. Гроссе. Х. Вайсмантель «Химия для любознательных». Изд.2 Ленинград «Химия».1985г.
- Энциклопедический словарь юного химика. (ред. М.А. Прокофьев) Москва «Педагогика» 1990 г.
- Энциклопедия для детей «Аванта». Москва. 2000г. Гл. ред. В.А. Володин
- Ю.Ю. Лурье. «Справочник по аналитической химии». Изд. 4. Москва «Химия» 1971.
- Я.А. Угай. «Общая и неорганическая химия». Изд. 2. Москва «Высшая школа» 2000г.
- Я познаю мир. Детская энциклопедия. Химия. (Авт.-сост.Л.А.Савина). Москва. АСТ. 1995г.
- В.А. Волков, Е.В.Вонский, Г.И. Кузнецова «Химики». Изд. «Наукова думка». Киев. 1984 г.
о водороде
Водород, являющийся s-элементом, в различных вариантах периодической системы помещают то вместе с щелочными металлами, то с галогенами, а иногда даже рассматривают отдельно. Действительно, он сходен с щелочными металлами, так как образует положительный ион Н+ и играет роль восстановителя в реакциях. Сродство к электрону и электроотрицательность у водорода меньше, чем у галогенов. Тем не менее водород имеет гораздо больше сходства с галогенами, чем с щелочными металлами. В гидридах активных металлов (NaH. СаН2) содержится ион Н⁺, подобный ионам в галидах (NaCl, СаСI2). Молекулы водорода и галогенов двухатомны. Для водорода, как для фтора или хлора, характерны газообразное состояние и неметаллические свойства. Первые потенциалы ионизации водорода и галогенов довольно близки. Атомы водорода легко замещают атомами галогенов в органических соединениях .
Кроме того, водород имеет ряд индивидуальных особенностей, связанных с тем, что его валентный электрон находится непосредственно в сфере действия атомного ядра (без промежуточного электронного слоя). Например, протон не образует соединений с ионной связью. Особенностями строения атома водорода обусловлено также существование водородной связи.
- Водород – самый распространенный элемент во Вселенной.
- На Земле общее количество водорода- 1% от веса земной коры.
- Во Вселенной водород играет роль «космического топлива», дающего энергию звездам, в том числе нашему Солнцу.
- Водород не ядовит.
- В свободном виде водород выделяется с вулканическими газами.
- На 5000 атомов Протия приходится 1 атом Дейтерия.
- 1 атом Трития приходится на миллиард миллиардов Протия.
- Тяжелая вода, содержащая Дейтерий замерзает при температуре 3,8 градуса, а кипит при 101,4 градуса.
- Высокая температура горения водорода в кислороде используется для плавления кварца, тугоплавких металлов, разрезания стальных плит.
- При огромных давлениях был получен металлический водород.
о кислороде
- Благодаря реакции регенерации воздуха 2Na2O2 + 2CO2
 2Na2CO3 + O2 ↑, люди могут длительное время находиться в ограниченных пространствах, например на подводных лодках.
2Na2CO3 + O2 ↑, люди могут длительное время находиться в ограниченных пространствах, например на подводных лодках.
- В случаях снижения окислительных процессов в организме, озон в малых дозах приносит пользу, например лечение в барокамерах воздухом под давлением, обогащенным озоном.
- Озоновый слой задерживает ультрафиолетовое излучение, опасное для живых организмов, хотя общее его содержание соответствует слою газа толщиной всего 3 миллиметра.
- Если бы озон задерживал все ультрафиолетовое излучение, у организмов бы не вырабатывался витамин D и развитие было бы невозможным.
- Изобретателем резки металла кислородно-водородным пламенем явился взломщик несгораемых сейфов в 1890 году.
о углероде
- Атомы углерода могут неограниченно соединяться в цепи: линейные, разветвленные, циклические
- Алмазы полируются только собственным порошком.
- При t=3000 oС и давлении 1010Па графит превращается в алмаз.
- Карбин – аллотропная форма углерода, найден в кратерах вулканов, образованных при падении метеоритов.
- Все карбиды гидролизуются с образованием оснований и углеродосодержащих газов:
Al4C3 + 12H2O ![]() 4Al(OH)3 + 3CH4
4Al(OH)3 + 3CH4
- Полупромышленный способ получения ацетилена происходит по реакции:
CaC2 + 2H2O ![]() Ca(OH)2 + C2H2.
Ca(OH)2 + C2H2.
- Ацетилен используется для газовой сварки металлов, потому, что он дает наивысшую температуру при сгорании в кислороде среди химических реакций выше 3000oС.
- Способ получения карбида кальция обжигом известняка происходит в две стадии:
CaCO3 ![]() CaO + CO2
CaO + CO2
CaO + 3C ![]() CaC2 + CO
CaC2 + CO
- Активные металлы могут гореть в углекислом газе
2Mg + CO2 ![]() 2MgO + C
2MgO + C
- Природный силикаты альмандин (3FeO•Al2O3 • 3SiO2) и ортоклаз - основные минералы Тянь – Шанских гор.
- Природные силикаты в чистом виде являются драгоценными камнями: аквамарин, изумруд, топаз.
- Полудрагоценные камни: агат, аметист, яшма также содержат оксид кремния - SiO2.
- SiO2 в очень чистом виде известен как горный хрусталь или кварц.
- Песок красно-желтого цвета окрашен солями Fe(III), а зеленовато-серый солями Cr(III),(IV).
- Все способы получения кремния приводят к образованию аморфного кремния – бурого порошка с t(пл) =1420оС.
- Кристаллический кремний получают перекристаллизацией аморфного кремния.
- Кристаллический Si довольно инертен, т. к. его структура, аналогичная алмазу.
- При освещении, нагревании электропроводность кремния возрастает
- Кремний часто употребляется в технике как полупроводник.
- Оксидная пленка SiO2 растворяется только в плавиковой кислоте (HF).
- C галогеноводородами кремний в реакции не вступает, но в присутствии азотной
кислоты реагирует: 3Si +12HF + 4HNO3 ![]() 4NО + 3SiF4 + 8H2O
4NО + 3SiF4 + 8H2O
- Как восстановитель кремний используются для получения некоторых металлов из их оксидов 2MgO + Si
 2Mg + SiО2.
2Mg + SiО2. - С водородом образует ядовитый газ силан (SiH4), который самовоспламеняется на воздухе:
- Сплав кремния с железом называется ферросилиций.
- При содержании кремния в стали до 0,15% сплав становится кислотоустойчивым, из него делают химическое оборудование.
- Карборунд (SiС) имеет алмазоподобную кристаллическую решетку, поэтому по твердости близок к алмазу.
- Получают карборунд в электропечах из смеси песка и кокса SiO2 + 3C
 SiC + 2CO ↑
SiC + 2CO ↑ - В технике карборунд применяют для изготовления точильных камней, шлифовальных кругов, буров.
- SiO - аморфный порошок желтого цвета, получен искусственно, входит в состав краски для пола – желто-коричневого цвета.
- Кремниевая кислота (H2SiO3) при хранении переходит в поликремниевую кислоту в виде студенистого осадка.
- Получают H2SiO3 действием сильных кислот на жидкие стекла – соли кремневой кислоты и щелочных металлов.
- Все силикаты тугоплавки и нерастворимы в воде (кроме солей Na, K)
- Сырьем для производства стекла является сода - Na2CО3, известняк или мел - СaCO3 и песок SiO2.
- Формула обычного оконного стекла Na2O •CaO • 6SiO2
- В стекла особого назначения (огнеупорных, особой прочности) при варке добавляют оксиды бария, свинца, бора.
- Окрашенные стекла получают добавлением оксидов кобальта (синее стекло), оксида хрома (зеленое стекло).
- Добавлением оксида свинца (РbО) получают хрустальное стекло, обладающее повышенной преломляемость световых лучей.
- Стекла красного цвета образуются при добавлении очень мелко измельченного (10-5 м) золота.
- Цемент – представляет собой смесь силикатов, из которых образуется смесь: CaO, SiO2, Al2O3, Fe2O3.
В промышленности цемент получают спеканием глины и известняка (СаСО3). Если порошок цемента смешать с водой, то получается масса, постепенно твердеющая на воздухе.
- При добавлении к цементу песка или щебня (дробленная галька) в качестве наполнителя получают бетон, который широко используется в строительстве.
- Прочность бетона возрастает, если в него вводится каркас из железных стержней.
- Из обожженной глины получают изделия из керамики («керамон» переводится с греческого языка как глина).
- Из каолинита или «белой глины» производят фарфоровые и фаянсовые изделия.
- В нормальных условиях азот бесцветный газ без запаха и вкуса.
- Азот составляет около 78% воздуха, которым мы дышим.
- Азот присутствует во всех живых организмах, включая человеческое тело и растения.
- Газообразный азот используется в пищевых хранилищах, чтобы сохранить свежесть продуктов. Он также используется при изготовлении электронных деталей для промышленных целей и имеет много других полезных применений.
- Азот часто используется в качестве альтернативы двуокиси углерода для хранения пива в бочках под давлением. Меньшие пузырьки, которые он образует, предпочтительны для некоторых типов пива.
- Титан, самая большая луна Сатурна, имеет атмосферу, почти полностью состоящую из азота (более 98%). Известно, что это единственная луна в нашей солнечной системе с плотной атмосферой.
- Азот находится в жидком состоянии при очень низкой температуре. Жидкий азот кипит при t(кип)-196 оC. Он легко транспортируется и имеет множество полезных свойств, в области криогеники (наука о том, как ведут себя материалы при очень низких температурах), в качестве компьютерного хладагента (жидкости, используемой для предотвращения перегрева), удаления бородавок и многого другого.
- Декомпрессионная болезнь (также известная как кессонная болезнь) это образование пузырьков азота, в кровотоке и других важных областях тела, когда люди слишком быстро снижают давление после глубоководного погружения. Аналогичные ситуации могут произойти с космонавтами и пилотами негерметичных самолетов.
- Закись азота (также известная как веселящий газ (N2O)) используется в больницах и стоматологических клиниках в качестве анестезирующего средства (устранение или уменьшение боли во время операций).
- Закись азота также используется в автоспорте для увеличения мощности двигателя и скорости автомобиля.
- Нитроглицерин – это жидкость, используемая для создания взрывчатых веществ, таких как динамит. Это соединение часто используется в промышленности, а так же в военных целях.
Сера имеет жуткий запах и обладает удушающим действием на человека. Жрецы использовали ее для проведения разных обрядов и священных курений, а военные добавляли в состав различных горючих смесей.
Функции серы в организме
Ни один процесс в организме не может обойтись без серы. Она является одним из главных составляющих всех существующих белков. Функции, которые возлагаются на работу серы в человеческом организме огромны. Начиная от стабильной работы нервных клеток, уравновешивания сахара в крови и общего повышения иммунитета, заканчивая ранозаживляющими и противовоспалительными действиями.
"Чудо"-сера входит в состав лекарств и используется в чистом виде для лечения.
Питание
Кому-то покажется странным, а кто-то об этом давным давно знает, однако сера содержится в массе продуктов, которые мы используем ежедневно, даже на подозревая об этом. К этому числу относятся: все бобовые, злаки и крупы, а также хлебобулочные изделия (!); лук, чеснок и капуста; яблоки, виноград и крыжовник; молочные продукты; рыба.
Неудивительно, что до сегодняшнего дня зафиксированных случаев с дефицитом серы, ничтожно мало. Ведь что-то из перечисленного мы в любом случае употребляем в рацион питания.
- Когда мы режем лук и "плачем", мы должны сказать "спасибо" именно сере, которая впитывается в почву, где он растет.
- В одной из провинций Индонезии существует вулкан, полностью заполненный серой, который носит название Кава Иджен. Сера оседает на трубах, после чего рабочие сбивают ее арматурой и несут на взвешивание. Таким образом они зарабатывают себе на жизнь.
- Гигиенические "продукты" на основе серы созданы специально для чистки проблемной кожи от угрей и сыпи.
- Ушная сера, которую нас приучили удалять еще с детства ватными тампонами, "отравляет" нашу жизнь с благородными намерениями. В ней содержатся особые ферменты лизозимы; именно они "не пускают" в наш организм все инородно - бактериальное.
В 1811 году французский химик-технолог и фармацевт Бернар Куртуа открыл йод. У него был любимый кот, который во время обеда сидел обычно на плече своего хозяина.
Куртуа часто обедал в лаборатории. В один из дней во время обеда кот, чего-то испугавшись, прыгнул на пол, но попал на бутылки, стоявшие около лабораторного стола. В одной бутылке Куртуа приготовил для опыта суспензию золы водорослей (содержащей йодид натрия) в этаноле, а в другой находилась концентрированная серная кислота.
Бутылки разбились и жидкости смешались. С пола стали подниматься клубы сине-фиолетового пара, которые оседали на окружающих предметах в виде мельчайших черно-фиолетовых кристалликов с металлическим блеском и едким запахом. Это и был новый химический элемент йод.
Однажды английский химик Гемфри Дэви, забыв, что сосуд уже заполнен угарным газом — веществом без цвета и запаха, — впустил в этот сосуд хлор, чтобы сохранить его для опытов, намеченных на следующий день. Закрытый сосуд остался стоять на лабораторном столе около окна. День был ясный и солнечный. На следующий день утром Дэви увидел, что хлор в сосуде потерял свою желтовато-зеленую окраску. Приоткрыв кран сосуда, ученый почувствовал своеобразный запах, напоминающий запах яблок, сена или разлагающейся листвы. Дэви исследовал содержимое сосуда и установил присутствие нового газообразного вещества, которому дал название «фосген», что в переводе с греческого означает «рожденный светом». Так в 1811 г. было открыто сильное отравляющее вещество удушающего действия, широко использовавшееся во время Первой мировой войны.
Открытие фтора было одной из труднейших задач. Первыми жертвами фтора были два члена Ирландской Академии наук братья: Томас Нокс скончался от отравления фтороводородом, а Георг стал инвалидом. Следующей жертвой стал бельгийский химик П. Лайет. Мученическую смерть при проведении опытов по выделению фтора принял французский химик Джером Никлес. Отравились, надышавшись небольшими количествами фтороводорода, а также получили серьезные ожоги французские химики Жозеф Гей-Люссак, Луи Тенар и английский химик Гемфри Дэви. При попытках выделить фтор при помощи электролиза его соединений нанесли ущерб своему здоровью французский химик Эдмон Фреми и английский электрохимик Георг Гор. Только в 1886 году французскому химику Анри Муассану сравнительно безболезненно удалось получить фтор. Муассан случайно обнаружил, что при электролизе смеси жидкого безводного HF и гидродифторида калия (KHF2) в платиновом сосуде на аноде выделяется светло-желтый газ со специфическим резким запахом. Однако, когда Муассан докладывал Парижской академии наук о своем открытии, один глаз ученого был закрыт черной повязкой. Нобелевская премия по химии была присуждена Муассану в 1906 г "в признание большого объема исследований - получения элемента фтора и введения в лабораторную и промышленную практику электрической печи, названной его именем".
- В воде фосфор нерастворим, поэтому его хранят в воде для защиты от окисления.
- На воздухе белый фосфор быстро окисляется и при этом светится в темноте, отсюда его название – (фос - свет, фор - несу).
- Белый фосфор сильно ядовит. Десятые доли грамма белого фосфора при попадании внутрь действуют смертельно.
- Белый фосфор легко воспламеняется, на коже оставляет долго незаживающие ожоги.
- Красный фосфор получают из белого фосфора при нагревании до 250оС под давлением без доступа воздуха.
- При нагревании красный фосфор не плавится, а сразу сублимирует (испаряется из твердого состояния, минуя жидкую фазу).
- При охлаждении красный фосфор переходит в белый фосфор.
- При нагревании белого и красного фосфора > 200 0С под высоким давлением образуется черный фосфор.
- Кристаллы оксида фосфора (V) - (Р2О5) применяются для осушения воздуха в эксикаторах.
- При осторожном прокаливании фосфорной кислоты образуется двуфосфорная (дифосфорная), пирофосфорная кислота
2Н3РО4 ![]() Н4Р2О7 +Н2О
Н4Р2О7 +Н2О
- Фосфорную кислоту используют для изготовления реактивов, органических веществ, для получения катализаторов, для создания защитных покрытий на металлах, в фармацевтической промышленности.