Химия: Металл эместер
Химиялык элементтердин мезгилдик системасында бордон астатка чейин диогнал сызыгын жүргүзсөк, таблицанын оң жактагы жогору бурчун ээлеген 20–25 элемент металл эместер болуп саналат. Алардын көпчүлүгү р элементтер, суутек менен гелий гана s элементи болуп саналат. Металл эместер 3 төн 8ге чейинки валенттүүлүктү жана –4 төн + 8 чейинки окистенүү даражаларын көрсөтөт. Алар 2ден 4 электрон–вольтко чейинки жогорку терс электрдүүлүккө ээ болгондуктан, күчтүү окистендиргич болуп саналат. Бирок, молекулаларынын курамына жараша химиялык реакцияга киргенде металл эместер окистендиргич да, калыбына–келтиргич да болушу мүмкүн. Элементтердин металл эместик касиети мезгилдерде солдон оңду карай, ал эми группаларда жогортон төмөн карай күчөйт. Металл эместер жаратылышта чоң мааниге ээ, алар топурактын 84%, өсүмдүктөрдүн 98,5% жана адамдардын денесинин 97,6% түзүп турат. Ошондой эле көмүртек, кычкылтек, суутек, азот, фосфор жана күкүрт элементтери белоктордун, нуклеин кислоталарынын, майлардын, углеводдордун жана витаминдердин курамына кирет. Абанын курамын карасак, ал азоттон, кычкылтектен жана асыл газдардан турат.
Суу да эки металл эместен: суутектен жана кычкылтектен турат. Металл эместердин арасынан бир гана атомдон турган–асыл газдарды жана эки атомдон турган газ абалындагы заттар – суутек, азот, кычкылтек, фтор, хлорду белгилөөгө болот. Металл эместердин арасында ар түрдүү агрегаттык абалдагы заттар бар. Аларга, суюк абалдагы–бромду, аморфтук абалдагы – кызыл жана ак фосфорду жана кристаллдык заттар – көмүртекти, кремнийди жана иодду киргизүүгө болот. Ошону менен катар эле металл эместер жөнөкөй заттардын аллотропиясын (түр өзгөрүшү) пайда кылуу жөндөмдүүлүгүнө ээ болушат.Мисалы, алмаз–графитти, кычкылтек–озонду ж.б. пайда кылат. Металл эместер электр тогун жана жылуулукту начар өткөрүшөт. Демек, заттардын касиети алардын курамын түзгөн металл эместерден көз каранды болот.
Содержание
Суутек
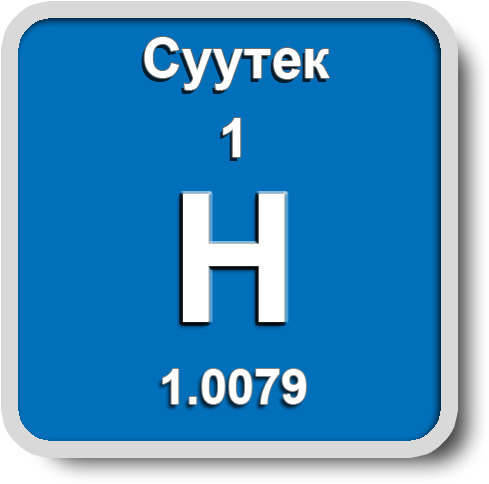
Суутек үч изотопту пайда кылат: ![]() – жеңил суутек (Протий),
– жеңил суутек (Протий), ![]() – оор суутек (Дейтерий) и
– оор суутек (Дейтерий) и ![]() – өтө оор суутек (Тритий). Суутектин терс электрдүүлүгү Полингдин таблицасында – 2,1 барабар.
– өтө оор суутек (Тритий). Суутектин терс электрдүүлүгү Полингдин таблицасында – 2,1 барабар.
Мeталлдар < Терс электрдүүлүгү (Н) 2,1 < Металл эместер
Жер катмарында суутек суунун, нефттин, минералдардын жана жандуу организмдин курамында кездешет. Бардык химиялык заттардын 95% өзүнө суутекти кармап жүрөт. Эң жеңил газ катары атмосферанын жогорку катмарында космос мейкиндигинин – 63%, литосферанын – 0,15%, гидросферанын – 4% түзүп турат.
Суутек – өңсүз, түссүз, жытсыз газ. Абадан 14,5 эсеге жеңил, кайноо температурасы –252,8 оС, сууда начар эрийт. Электр тогун жакшы өткөрөт. Кээ бир металлдарда балкып эрийт (Pt, Pd, Ni), абада күйөт.
2 көлөм суутек H2 жана 1 көлөм кычкылтек O2 аралашса, «күркүрөк газ» деген жарылгыч затты пайда кылат.
Суутек суунун – H2O, күкүрттүү суутектин – H2S, галоген суутектердин – HCl, HBr, HF, HJ, аммиактын – NH3, метандын – CH4, фосфиндин – PH3, металлдардын гидриддеринин –NaH, CaH2 курамдарына кирет. Суутек бардык кислоталардын да курамдарында болот. Суутектин эң негизги бирикмеси суу болуп эсептелет. Суутек металлдар менен реакциялашып, гидриддерди пайда кылууда өзүн окистендиргич катары, ал эми металл эместер менен аракеттенишкенде өзүн калыбына келтиргич катары алып жүрөт. Ысытканда металлдарды оксиддеринен калыбына келтирет.
.
Жездин оксидинин (II) суутек менен калыбына келиши.
Суутек металл эместерден күкүрт, хлор, иод жана азот менен реакцияга кирет: ![]() . Лабораторияда суутек металлдар менен кислотанын өз ара аракеттенишүүсүнөн алынат:
. Лабораторияда суутек металлдар менен кислотанын өз ара аракеттенишүүсүнөн алынат:
Zn + 2HCl ![]() ZnCl2 + H2↑.
ZnCl2 + H2↑.
Өнөр жайда суутек метандан алынат:
![]()
![]() .
.
Суутек аэростаттарды, зонддорду толтурууда, калыбына келтиргич катары сейрек кездешүүчү өтө таза металлдарды молибденди, вольфрамды (Мо,W) алууда, ширетүү жана ысытуу иштеринде колдонулат.
Суутек NH3 – аммиакты, HCl – хлордуу суутекти жана CH3OH – метанолду алууда сырье катары да колдонулат.
-

Метеозонддор суутек менен толтурулат
-

Ракета куруу иштеринде суутек күйүүчү отун катары колдонулат
-

Суутекти жеңилдиги үчүн аэросүзүүдө да колдонушат
-

Суутек күйгөндө жылуулук көп бөлүнүп чыккандыктан, ширетүүдө да колдонулат
Кычкылтек
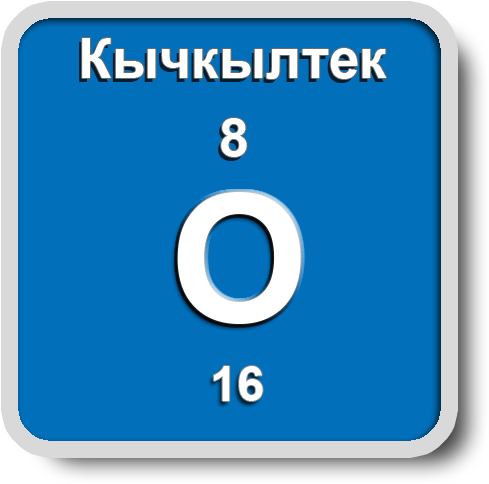
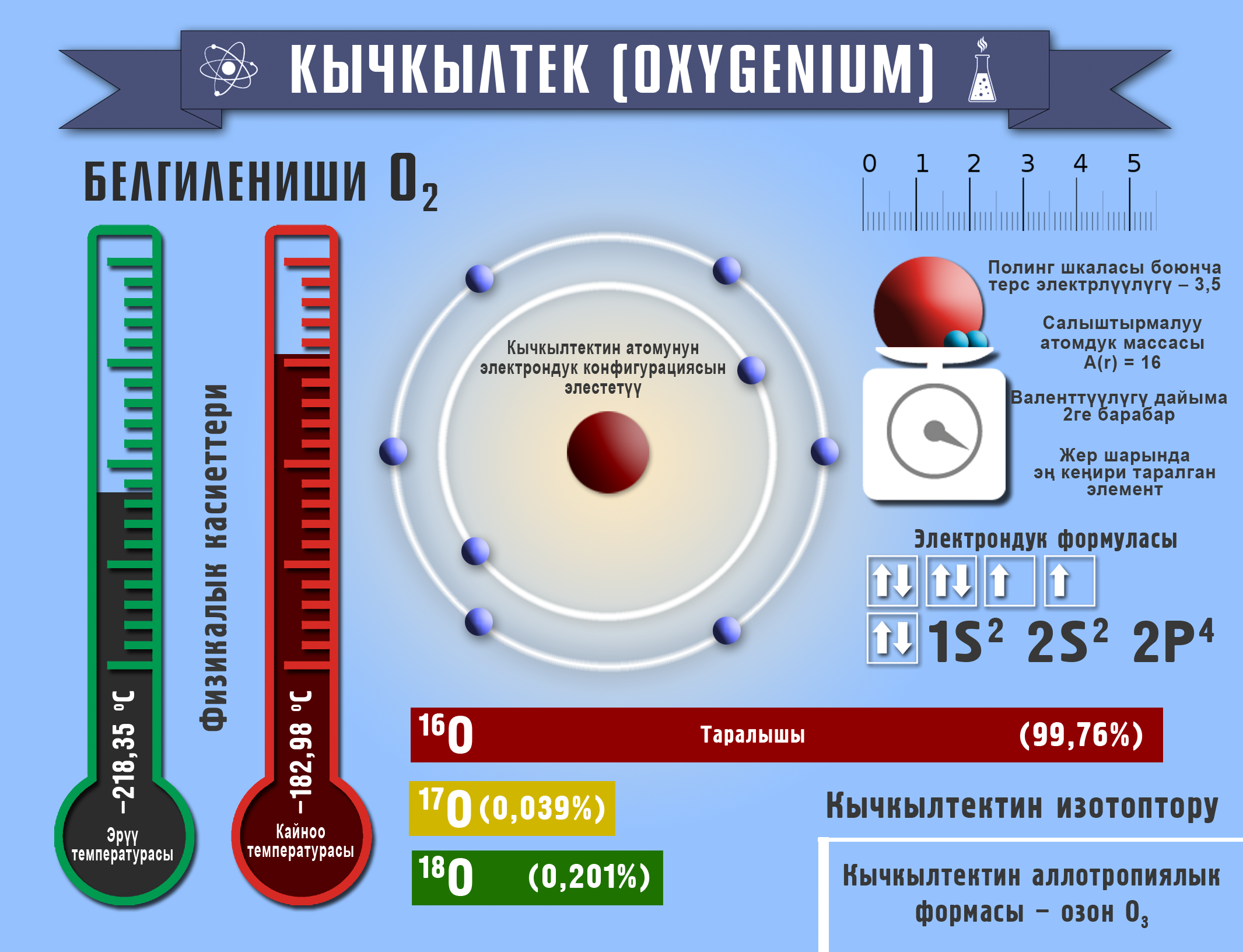
Ядросунун заряды +8, салыштырмалуу атомдук массасы A(r)=16 м.а.б. терс электрдүүлүгү Полингдин таблицасы боюнча 3,5, химиялык элементтердин мезгилдик системасында VIА группада жайгашса да валенттүүлүгү II ни көрсөтөт. Кычкылдануу даражасы: –2, –1, 0, +2.
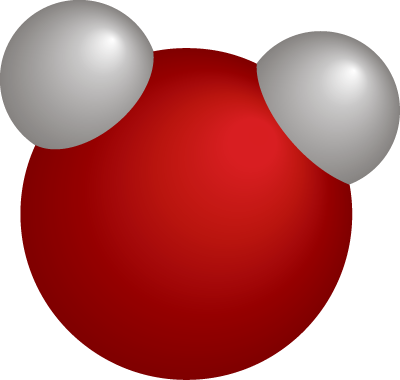
Молекуласы кычкылтектин эки атомунан турат – О2. Аллотропиялык түр өзгөрүшү О3 – озон, молдук массасы М (О3) = 48 г/моль барабар болот.
Кычкылтек – эң кеңири таралган элемент, ал жер катмарынын 49% түзөт. Көлөмү боюнча атмосфералык абанын – 21%, литосферанын – 47,2% түзөт. Кычкылтек суунун, минералдардын жана органикалык заттардын курамына кирет (өсүмдүктөрдүн же жаныбарлардын 50–85% кычкылтектен турат).
Абанын курамы: О2 – 21%, N2 – 78%, инерттүү газдар – 1%. (Абанын орточо массасы = 29 г/моль). Кычкылтек – өңсүз, түссүз, жытсыз газ, абадан бир аз оорураак. Тыгыздыгы 1,43 г/л, tкайн. –183 оС. Сууда аз эрийт – 0,04 г/л. Суюк кычкылтек көгүш түстө болот, магнитке тартылат. Кычкылтек бардык заттар менен реакцияга кирет (гелий, неон, аргондон башка). Ал фосфор, хлор, алтын жана платина менен түздөн–түз реакцияга кирбейт.
Кычкылтек дайыма окистендирүүчү болот. (ОF2 башкасын). Металлдар жана металл эместер менен аракеттенишип, оксиддерди (СаО, Р2О5) пайда кылат.
Щелочтуу металлдар менен реакцияга кирип, өтө кычкылдарды (Na2O2) пайда кылат. Химиялык элементтердин кычкылтек менен болгон реакциясы экзотермикалык – жылуулукту жана жарыкты бөлүп чыгаруу менен жүрөт. Кычкылдануунун кубаттуу жүрүшү күйүү деп аталат. Бардык органикалык жана органикалык эмес заттар күйүүгө жөндөмдүү болушат Алар абага караганда кычкылтекте жакшы күйүшөт, мисалы, аммиак абада күйбөйт, ал эми кычкылтекте күйөт.
![]()
Күкүрттүү суутек абада да кычкылтекте да күйөт, бирок, бул учурда эки башка зат пайда болот. 2H2S + O2 ![]() 2S↓ + 2H2O (абада),
2S↓ + 2H2O (абада),
![]() (кычкылтекте). Бардык органикалык заттар кычкылтекте күйгөндө көмүр кычкыл газы жана суу пайда болот (CO2 и H2O): CH4 + 2O2
(кычкылтекте). Бардык органикалык заттар кычкылтекте күйгөндө көмүр кычкыл газы жана суу пайда болот (CO2 и H2O): CH4 + 2O2 ![]() CO2↑ + 2H2O.
CO2↑ + 2H2O.
Оксиддер өнөр жайда сульфиддерди күйгүзүү жолу менен алынат ![]() .
.
Кычкылтекти лабораторияда татаал заттарды ажыратуу менен алууга болот:
2KMnO4 ![]() K2MnO4 + MnO2 + O2↑,
K2MnO4 + MnO2 + O2↑,
2KClO3 ![]() 2KCl + 3O2↑,
2KCl + 3O2↑,
2H2O2 ![]() 2H2O + O2↑ (MnO2 – катализатор).
2H2O + O2↑ (MnO2 – катализатор).
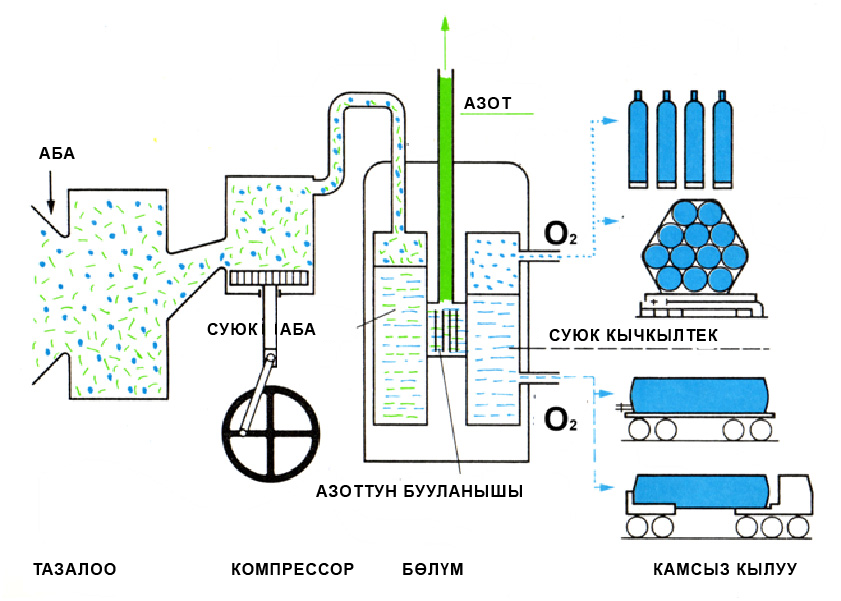
Өнөр жайда кычкылтекти сууну электр тогунун таасири астында ажыратуу менен же суюк абаны фракцияларга буулантып айдоо менен алышат: 2Н2О ![]() 2Н2↑+О2↑
2Н2↑+О2↑
Суюк абадан адегенде азот, андан кийин кычкылтек бууланат. Бул процессти ректификациялык колоннада бир нече жолу кайталагандан кийин бир аз гана азоттун аралашмасы бар таза кычкылтекти алууга болот.
Озон (О3) – кычкылтектин аллотропиялык түр өзгөрүшү – кычкылтекке караган күчтүү окистендиргич болуп саналат. Озон тамак–аш содасын, агын сууларды тазалоо үчүн жана медицинада дезинфекциялоочу каражат катары колдонулат.
Көмүртек

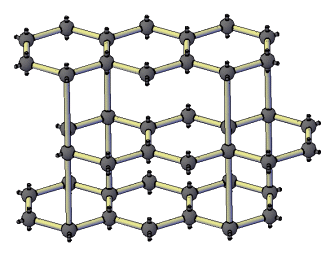
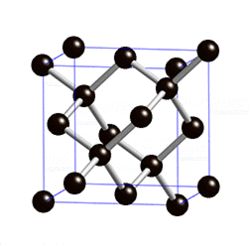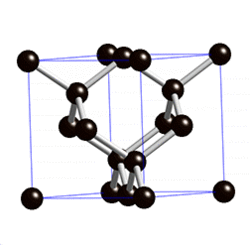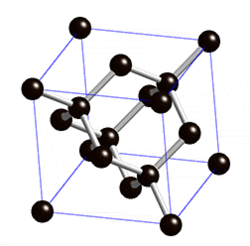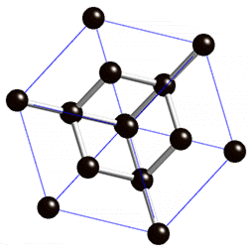
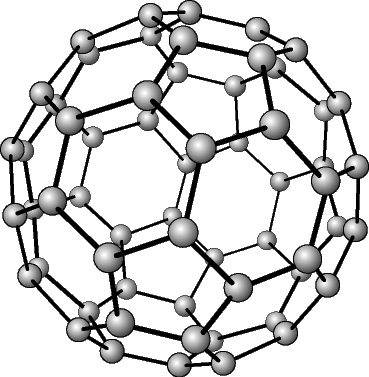
Көмүртек эркин абалында 5 аллотропиялык түр өзгөрүүлөрдү пайда кылат, алардын ичинен белгилүүсү алмаз жана графит. Жакында үчүнчү түр өзгөрүшү фуллерен ачылды. Көмүртектин аллотропиялык формалары бири–биринен кристаллдык торчолордун түзүлүшү менен айрымаланышат. Алмаз электр тогун өткөрбөйт, анын кристаллдары жарыкты күчтүү чагылдыруучу касиетке ээ. Графит – металлдык жалтырактыкка ээ, катмарларга бөлүнүп туран боз зат. Катмарларын өзүнчө бөлүп алууга болот. Графит электр тогун өткөрөт. Фуллерен – С60, С70 деген курамдагы сфера формасындагы зат, жасалма жол менен алынган, кийинчерээк күлдүн курамынан табылган.
Кадимки шарттарда көмүртектин бардык аллотропиялык түрлөрү химиялык жактан инерттүү болот, бирок жогорку температурада бул заттар активдүү болуп калат. Ысытканда көмүртек жөнөкөй жана татаал заттар менен реакцияга кирет. Ал металлдар менен аракеттенишкенде карбиддерди – Al4C3 (алюминий карбиди), Mg2C (магний карбиди), кычкылтек менен эки оксидди CO (көмүртек (II) оксиди), CO2 (көмүртек (IV) оксиди), күкүрт жана галогендер менен да реакциялашып CS2 (күкүрттүү көмүртекти) жана CCl4 (тетрахлорметанды) пайда кылат. Көмүртек металлдардын оксиди менен реакцияга киргенде кычкылтекти өзүнө кошуп алып, металлдарды калыбына келтирет. Ал күчтүү калыбына келтиргич болуп саналат.
C + CuO ![]() Cu + CO, 2C + PbO2
Cu + CO, 2C + PbO2 ![]() Pb + 2CO
Pb + 2CO
От болуп кызарган көмүр аркылуу суу буусун өткөргөндө суу газы – ис газы жана суутектин аралашмасы алынат:
C + H2O (буу) ![]() CO + H2 (суу газы).
CO + H2 (суу газы).
Бардык органикалык заттардын курамында көмүртек болгондуктан, алар абада күйгөндө, көмүр кычкыл газы, суу жана жылуулук бөлүнүп чыгат.
Көмүртектин бирикмелери
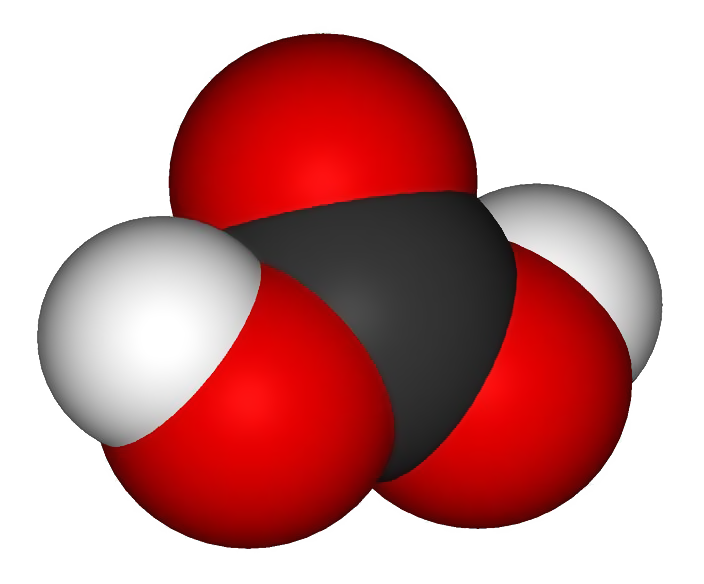
CO2 – көмүр кычкыл газы – көмүртек оксиди (II), бардык тирүү организмдер дем чыгарганда бөлүнүп чыгат. Көмүр кычкыл газы уулуу эмес, аны менен дем алууга болбойт.
- Магний көмүр кычкыл газында күйөт
- Таң каларлык кургак муз
Жарыктын таасири астында көмүр кычкыл газы (СО2) өсүмдүктөрдүн жалбырагында суу менен кошулуп, фотосинтез процесси жүрөт. Реакциянын натыйжасында глюкоза пайда болот жана абага кычкылтек бөлүнүп чыгат.
6СО2 + 6Н2О ![]() С6Н12О6 + 6О2.
С6Н12О6 + 6О2.
Көмүр кислотасы (Н2СО3) – көмүр кычкыл газынын суу менен аракеттенишүүсүнөн пайда болот (газдалган суу).
Ал эки түрдөгү туздарды пайда кылат: карбонаттар (орто туздар) Na2CO3 – кристаллдык сода, К2СО3 – поташ жана гидрокарбонаттар (кычкыл туздар) NaHCO3 – тамак–аш содасы.
Жер шарындагы эң чоң байлык – бул көмүр отундары болуп саналат. Алар төмөнкүлөр: катуу отундар – көмүр, чым көң, сланец, жыгач отуну, кокс; суюк отундар – нефть, нефть продуктылары; газ абалындагы отундар – жаратылыш жана жолбун газдар.
Көмүрдүн 3 түрү бар: антрацит (95% көмүртектен турат), таш көмүр (90–70% С), күрөң көмүр (65–70% С). Көмүрдү абаны катыштырбай ысытканда учма заттар, аммиак суусу бөлүнүп чыгат да жыгач көмүрү калат. Мындай көмүр каналдардан жана боштуктардан турат жана өзүнө газдарды, уулуу заттарды сиңирип алууга жөндөмдүү болот. Жыгач көмүрүнүн бул касиети адсорбция деп аталат. Чым көң – бул көмүрдүн пайда болушунун биринчи стадиясы болуп саналат. Чым көңдү кургак айдаганда андан чым көң коксу алынат.
Нефть – көмүртектин суутектик бирикмелеринин аралашмасы болуп саналат (150 бирикме бар). Ысытканда: бензин, керосин, газойль, мазут алынат. Нефтиде эриген жолбун газдарды тундуруу жолу менен бөлүп алышат. Жаратылыш газынын курамы 95% – СН4 метандан турат. Көмүртектин бирикмелери жылуулукту көп бөлүп чыгаргандыктан, отун катары колдонулат.
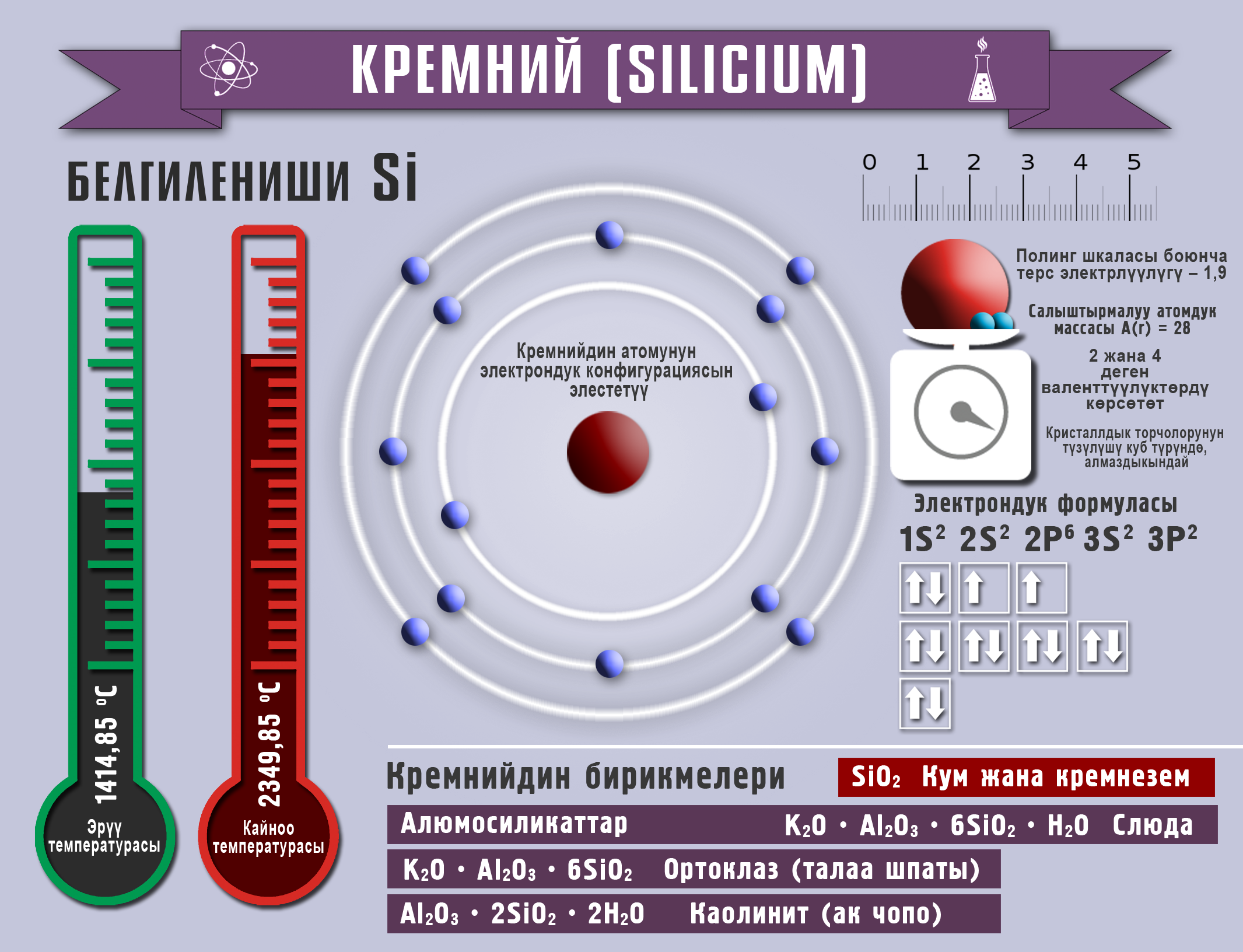
Кремний жана анын бирикмелери

Кремний таза кумду кокс менен бирге ысытуудан алынат SiO2 + 2C ![]() Si +2CO, ал эми лабораторияда активдүү металлдардын оксиддерин калыбына келтирүү менен алууга болот:
Si +2CO, ал эми лабораторияда активдүү металлдардын оксиддерин калыбына келтирүү менен алууга болот:
SiO2 + 2Mg ![]() Si + 2MgO,
Si + 2MgO,
3SiO2 + 4Al ![]() 3Si +2Al2O3
3Si +2Al2O3
Реакциянын натыйжасында алынган аморфтуу кремний өтө активдүү болот, ал электр тогун өткөрүүгө жөндөмдүү. Кремний IVА группанын элементи, 2,4, деген валенттүүлүктөрдү көрсөтөт жана кычкылдануу даражасы –4 төн +2, +4 барабар болот.
Кадимки шарттарда кремний фтор менен гана реакцияга кирет, бир аз ысытканда хлор, бром менен, ал эми жогорку температурада азот жана көмүртек менен аракеттенишип, кремнийдин карбидин (же карборундду SiC) пайда кылат. Кычкылтекте кремний күйөт. Кислоталар (плавик кислотасынан башкасы) кремнийге таасир этпейт, бирок щелочтордун эритмелери аны менен реакцияга кирет.
SiO2 – кислоталык оксид, сууда эрибейт. Кремнийдин оксиди плавик кислотасы менен гана реакциялашат:
SiO2 + 4HF ![]() SiF4 + 2H2O. Бул реакция айнектерди кайра иштетүүдө колдонулат (химиялык стакандагы белгилерди карагыла).
SiF4 + 2H2O. Бул реакция айнектерди кайра иштетүүдө колдонулат (химиялык стакандагы белгилерди карагыла).
Кремнийдин оксидинен – кремний кислотасы (H2SiO3) алынат, ал сууда эрибейт, начар кислота катары белгилүү. Ал эми кремний кислотасынын тузу – натрий силикаты канцелярдык же силикат желими деген ат менен белгилүү. Алар сууда жакшы эришет, силикат желимин тактайга же кездемелерге сиңирсе, алар отко туруктуу болуп, ным өткөрбөй калышат. Кремний кислотасынын туздары – натрий жана калий силикаты (Na2SiO3, K2SiO3) эригич айнек деп аталат. Силикаттар курулуш материалдары катары колдонулат. Алардан айнек, цемент, керамика, фарфор жана фаянс алынат.
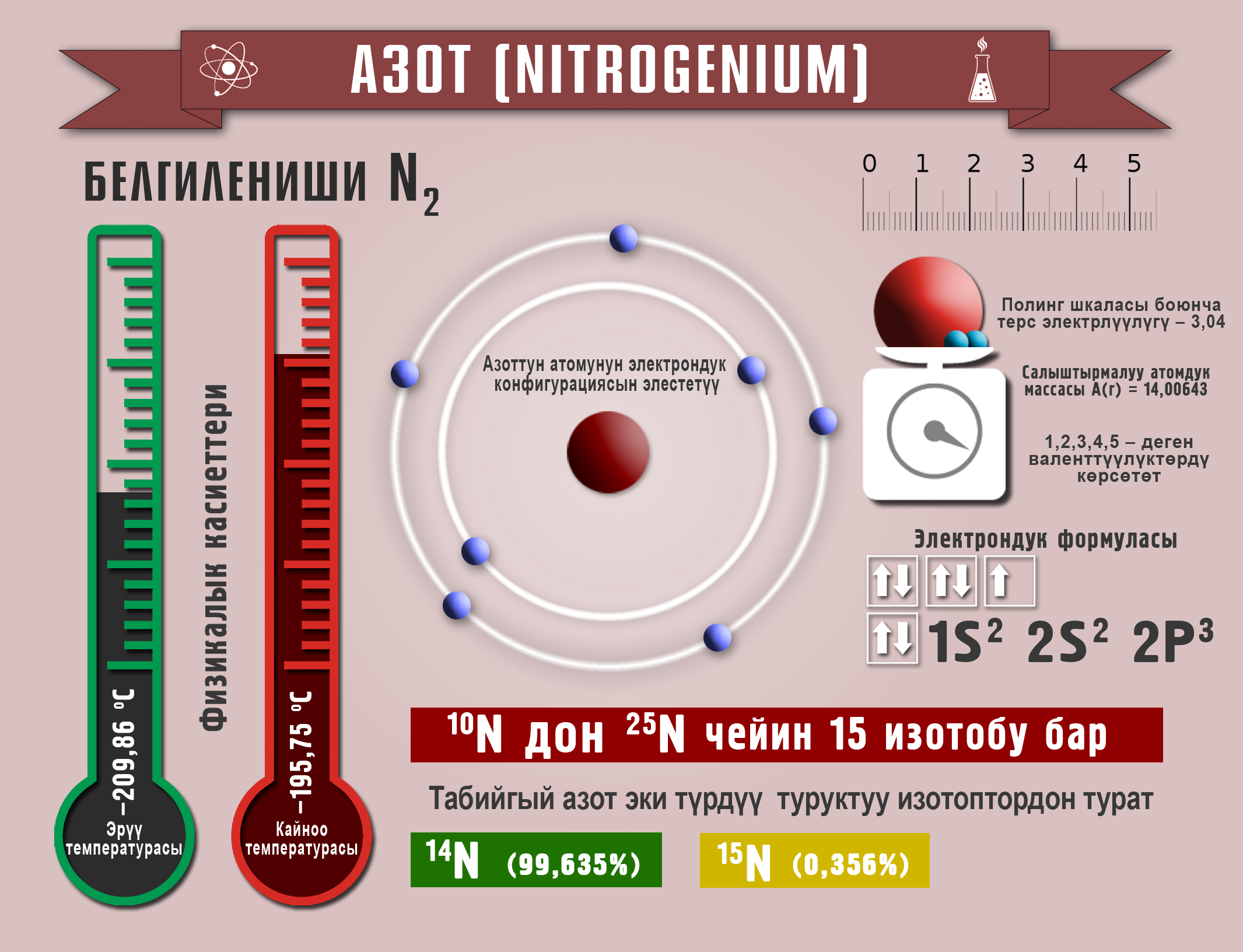
Азот

N2 – азот – түссүз, жытсыз, даамсыз газ. tкайн. –196oС, tэрүү. –210oС. Абанын 78,1% түзөт, инерттүү. –140oС суюктукка айланат. Азотту өнөр жайда абаны конденсациялоо менен, ал эми лабораторияда аммоний нитратын ажыратуу аркылуу алышат:
NH4NO2 ![]() N2 + 2H2O
N2 + 2H2O
Кадимки температурада азот литий менен, ал эми жогорку температурада башка металлдар (Mg,Ca). менен да реакцияга кирет. Азот окистендиргич да (NH3), калыбына–келтиргич (NO) да боло алат. Суутек менен аракеттенишип, аммиакты пайда кылат. Аммиак NH3 – кескин жыттуу газ.
Аммиак суу менен аракеттенишип, NH4OH – аммонийдин гидроксидин пайда кылат. Аммоний гидроксиди сууда эрийт, бирок начар негиз болуп саналат.
Аммиак башка заттар менен донор–акцептордук байланыш менен байланышып, аммоний туздарын пайда кылат.Алар негизинен жер семирткич катары колдонулат. Мисалы, аммоний дигидрофосфаты NH4H2PO4, аммонийдин гидрофосфаты (NH4)2HPO4. Амонийдин туздарына щелочту таасир эткенде аммиак бөлүнүп чыгат. б.а. аммиактын кескин жыты пайда болот.
Азот кычкылданып, газ абалындагы оксиддерди пайда кылат. N2O – «көңүл көтөрүүчү газ», бул газ менен дем алганда, ал наркоз катары таасир эткендиктен, аны хирургиялык операция убагында пайдаланышат, NO, NO2 – өңүнө карата «түлкүнүн куйругу» деп аташат.
Азот азот кислотасын (HNO3) пайда кылат.
Азот кислотасы
Азот кислотасы башка кислоталардан күчтүү окистендирүүчү касиети менен айрымаланып турат. HNO3 – кескин жыттуу, түссүз суюктук, оңой бууланат, 86oС кайнайт. Концентрацияланган азот кислотасы адатта сары түстө болот. Мындай түстү ага азот (IV) оксиди берет, азот оксиди болсо, азот кислотасынын анча–мынча ажырашынын натыйжасында пайда болот. Азот кислотасы менен иштегенде коопсуздукту сактабаса өрт чыгып кетиши мүмкүн, себеби, күйгөн чычаланы азот кислотасынын эритмесине жакындатканда ал өзүнөн–өзү от алып күйөт.
Өнөр жайда азот кислотасын катализаторду катыштырып, аммиакты абанын кычкылтеги менен кычкылдандырып алышат. Лабораторияда азот кислотасын концентрацияланган күкүрт кислотасын натрийдин же калийдин кристаллдык нитратына таасир этип, бир аз ысытуу менен алышат.
Азот кислотасынын туздары ысытканда азоттун оксидин жана кычкылтекти пайда кылуу менен ажырайт, ошондуктан, аларды сактоодо өрт коопсуздугунун эрежелерине өзгөчө көңүл буруу керек.
Азот кислотасынын дагы бир өзгөчөлүгү, анын металлдар жана металл эместер менен аракеттенишкенде ар түрдүү заттарды пайда кылгандыгы болуп саналат.
Азот кислотасынын металл эместер менен аракеттенүүсү:
- 4HNO3(конц.) + C
 CO2 +4NO2 +2H2O
CO2 +4NO2 +2H2O
- (көмүртек менен концентрацияланган азот кислотасы гана реакцияга кирет, мында азот (IV)оксиди NO2 бөлүнүп чыгат,себеби, көмүртектин кристаллдык торчосу өтө бекем болот)
- P + 5HNO3(конц)
 HPO3 + 5NO2 + 2H2O
HPO3 + 5NO2 + 2H2O - 3P +5HNO3(суюл)
 3H3PO4 +5NO+ 2H2O
3H3PO4 +5NO+ 2H2O - S +6HNO3 (конц)
 H2SO4 +6NO2 +2H2O
H2SO4 +6NO2 +2H2O - S +2HNO3(суюл)
 H2SO4 +2NO
H2SO4 +2NO - B + 3HNO3(конц)
 H3BO3 +3NO2
H3BO3 +3NO2
- (Бор концентрацияланган азот кислотасы менен гана аракеттенишет)
Азот кислотасынын металлдар менен аракеттенүүсү:
Азот кислотасынын металлдар менен болгон аракеттенишүүсү окистенүү–калыбына келүү реакциясы менен жүрөт, мында металлдардын, азот кислотасынын курамындагы азоттун окистенүү даражасы өзгөрөт.
- Азот кислотасы металлдар менен реакцияга киргенде суутек (Н2) бөлүнүп чыкпайт.
- Бул учурда газ абалындагы окистенүү даражалары ар башка болгон азоттун оксиддери же аммиак бөлүнүп чыгат.
- Бөлүнүп чыккан газ абалындагы заттардын окистенүү даражалары кислотанын концентрациясына байланыштуу болот.
- Ошону менен катар эле бөлүнүп чыккан газ абалындагы заттардын окистенүү даражалары металлдын тыгыздыгына да көз каранды болот (тыгыздыгы 5 г/см3 жогору болгондор – оор металлдар же тыгыздыгы 5 г/ см3 төмөн болгондор– жеңил металлдар).
Азот кислотасынын металлдар менен аракеттенишүүсүнүн закон ченемдүүлүктөрү:
- Металлдар азот кислотасы (HNO3) менен реакцияга кирип, оксиддерди пайда кылат. Эгерде окистенүү даражасы +3 болгон металлдын оксиди пайда болсо, ал металлдар жука оксид пленкасы менен капталып калат б.а. алардын активдүүлүгү төмөндөйт. (Fe, Cr, Al, Au, Pt, Ir, Tl.).Бул пленка андан ары металлды кислотанын таасиринен сактап турат.
3Al + 12HNO3 ![]() Al(NO3)3 +Al2O3 +9NO2 +6H2O (пленканын калыңдыгы Al2O3=10–5 метр).
Al(NO3)3 +Al2O3 +9NO2 +6H2O (пленканын калыңдыгы Al2O3=10–5 метр).
- Концентрацияланган азот кислотасы (HNO3) төмөнкү металлдар менен реакцияга кирбейт (Pt, Au, Ir, Tl).
- Концентрацияланган азот кислотасы оор металлдар менен реакцияга киргенде азот (IV) оксиди (NO2) бөлүнүп чыгат
Cu + 4HNO3(конц) ![]() Cu(NO3)2 +2NO2↑ + H2O
Cu(NO3)2 +2NO2↑ + H2O
- Ал эми оор металлдар менен суюлтулган азот кислотасы реакцияга киргенде азот (II) оксиди (NO) бөлүнүп чыгат
3Cu +8HNO3(суюл.) ![]() 3Cu(NO3)2 +2NO↑ +4H2O
3Cu(NO3)2 +2NO↑ +4H2O
- Жеңил металлдар концентрацияланган азот кислотасы менен реакциялашканда азот(I) оксиди N2O, кээ бир учурда N2 – (азот кислотасынын концентрациясына жараша) бөлүнүп чыгат.
4Mg +10HNO3(конц) ![]() 4Mg(NO3)2 +N2O +5H2O
4Mg(NO3)2 +N2O +5H2O
5Mg +12HNO3(суюл.) ![]() 5Mg(NO3)2 +N2 +6H2O (Mg, Zn).
5Mg(NO3)2 +N2 +6H2O (Mg, Zn).
- Ал эми жеңил металлдар суюлтулган азот кислотасы менен реакцияга киргенде, аммиак (NH3) бөлүнүп чыгат, бирок аммиак ошол замат эле азот кислотасы менен аракеттенишип, аммонийдин нитратын пайда кылат:
NH3 + HNO3 ![]() NH4NO3
NH4NO3
4Mg +10HNO3(өтө суюл) ![]() 4Mg(NO3)2 + NH4NO3 + 3H2O
4Mg(NO3)2 + NH4NO3 + 3H2O
4Zn +10HNO3(өтө суюл) ![]() 4Zn(NO3)2 +NH4NO3 + 3H2O
4Zn(NO3)2 +NH4NO3 + 3H2O
- Алюминий (Al) өтө суюлтулган азот кислотасы менен аракеттенгенде азот(II) оксиди (NO) бөлүнүп чыгат.
Al + 4HNO3(суюл) ![]() Al(NO3)3 +NO +2H2O
Al(NO3)3 +NO +2H2O
- Азот кислотасы менен реакцияга киргенде скандий өзүн жеңил металл катары алып жүрөт, окистенүү даражасы +3 барабар болот.
8Sc +30HNO3(өтө суюл) ![]() 8Sс(NO3)3 +3NH4NO3 +9H2O
8Sс(NO3)3 +3NH4NO3 +9H2O
- Азот кислотасынын өтө суютулган эритмеси кальций (Ca) жана (Mg) менен аракеттенгенде, бул металлдар суутекти сүрүп чыгарат (кээ бир учурда гана).
Күкүрт

Эркин абалында күкүрттүн бир нече аллотропиялык түр өзгөрүүлөрү бар. Алардын ичинен үч түрү белгилүү: курамы (S8) болгон ромб түрүндөгү күкүрт (α–күкүрт), моноклиндик (β–күкүрт) жана ар кандай узундуктагы циклдик чынжырча түрдөгү пластикалык күкүрт (каучук сыяктуу).
Күкүрттү эркин абалында башка тоо тектеринен бөлүү үчүн анын оңой эригичтиги пайдаланылат. Күкүрт алынуучу минералга түтүктөр аркылуу суунун буусун үйлөтүшөт. Күкүрт эриген абалында түтүктөр аркылуу көтөрүлүп чыгат, муздаганда ромб түрүндөгү күкүрткө айланат. Курамында күкүртү бар ар бир минералдан күкүрттү алууга болот. Күкүрт жаныбарлардын жүнүндө, канаттуулардын канатында, жаныбарлардын жана өсүмдүктөрдүн калдыктарында да кездешет. Адам денесинде орто эсеп менен 1,5 кг фосфор кездешсе, анын 1,4 кг – сөөктө; булчуңда – 130 г; мээде жана нерв системасында – 12 г болот.
Жаратылышта күкүрт – пириттин Fe2S (темир колчеданы), жез жаркырагынын СuS, – күмүш жаркырагынын Ag2S, коргошун жаркырагынын PbS ошондой эле сульфаттар CaSO4 • 2H2O – жаратылыш гипсинин, Na2SO4 • 10H2O – мирабилиттин, глаубер тузунун, MgSO4 • 7H2O – ачуу (англия) туздун жана FeSO4 • 7H2O – темир купоросунун курамына кирет. Күкүрт металлдар (Al, Fe) жана металл эместер (C, P, H2) менен реакцияга кирет. Абада жана таза кычкылтекте күкүрт көгүш жалын чыгарып күйөт.
S + O2 ![]() SO2.
SO2.
Татаал заттардын ичинен күкүрт күкүрт, азот кислоталары жана щелочтор менен реакцияга кирет.
Күкүрт күкүрттүн гидридин (Н2S) – сасыган жумуртка жыттанган газды пайда кылат. Күкүрттүү суутек уулуу болот, сууда начар эрийт (1 литр сууда 2,5 көлөм), ал эми анын эритмеси күкүрттүү суутек кислотасы болуп эсептелет.
- Күкүрт эки оксидди – 4 валенттүү күкүрт оксидин (IV) SO2 жана 6 валенттүү (SO3) (VI) күкүрттүн оксидин пайда кылат. SO2 (IV) күкүрттүү газ абадан 2 эсе оор, кескин жыттуу түссүз газ, сууда жакшы эрийт, сууда эригенде начар кислота – күкүрттүү кислота (H2SO3) пайда болот.
- Экинчи оксид (SO3) (VI) – күкүрт оксиди – түссүз, тез кайноочу суюктук +17oC ак түстөгү гигроскоптуу кристаллдарга айланат, сууда жакшы эрийт да күчтүү кислота–күкүрт кислотасын (H2SO4). пайда кылат. Күкүрт (VI) оксиди SO3 күкүрт кислотасында эрүү менен олеумду пайда кылат. H2SO4 + nSO3
 H2SO4 • nSO3 (олеум). Концентрацияланган күкүрт кислотасы көмүртекти көмүр кычкыл газына чейин кычкылдандырат. Ал органикалык заттарды (кантты) көмүргө айландырат.
H2SO4 • nSO3 (олеум). Концентрацияланган күкүрт кислотасы көмүртекти көмүр кычкыл газына чейин кычкылдандырат. Ал органикалык заттарды (кантты) көмүргө айландырат.
Күкүрт кислотасы өнөр жайда жана лабораторияда газдарды кургатууда, башка кислоталарды, жер семирткичтерди жана боёкторду алууда колдонулат. Күкүрт кислотасынын көпчүлүк туздары сульфаттар– кристаллогидраттар болуп саналат. Алар: CuSO4 • 5H2O – жез купоросу, FeSO4 • 7H2O – темир купоросу.
Күкүрт кислотасы
Күкүрт кислотасынын металл эместер менен аракеттенүүсү:
- С + 2H2SO4
 CO2↑ + 2SO2↑ + 2H2O
CO2↑ + 2SO2↑ + 2H2O
S + 2H2SO4 3SO2↑ + 2H2O
3SO2↑ + 2H2O
Реакциянын жүрүшүн видеодон көрө аласыңар
Күкүрт кислотасынын металлдар менен аракеттениши:
- Концентрацияланган күкүрт кислотасы темирдин Fe, хромдун Cr жана алюминийдин Al активдүүлүгүн төмөндөтөт, ошондуктан, аны темир же алюминий цистерналарында ташышат.
- Активдүүлүгү төмөн металлдарды (жезден баштап Cu) концентрацияланган күкүрт кислотасы менен ысытканда газ абалындагы күкүрттүн (IV) оксиди бөлүнүп чыгат.
Cu + 2H2SO4(конц.) ![]() CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
- Күкүрт кислотасы (H2SO4) активдүү металлдар менен реакциялашканда концентрациясына карата ар түрдүү заттар алынат:
- Zn + 2H2SO4(конц.)
 ZnSO4 + SO2↑ + 2H2O
ZnSO4 + SO2↑ + 2H2O - 3Zn + 4H2SO4(50%)
 3ZnSO4 + S↓ + 4H2O
3ZnSO4 + S↓ + 4H2O - 4Zn + 5H2SO4(20%)
 4ZnSO4 + H2S↑ + 4H2O
4ZnSO4 + H2S↑ + 4H2O - Zn + H2SO4(5-8%)
 ZnSO4 + H2↑ (суутекке чейинки металлдар)
ZnSO4 + H2↑ (суутекке чейинки металлдар)
Галогендер
Галогендер («туз пайда кылуучу») деген маанини билдирет, аларга VII A группанын элементтери: F, Cl, Br, I, At кирет.
Фтор (F) – эң күчтүү окистендиргич, валенттүүлүгү 1 ге, окистенүү даражасы – 1 ге барабар
Башка галогендер окистендиргич да калыбына–келтиргич да боло алышат.
Хлор (Cl) – VII A групапын элементтеринин өкүлү – терс электрлүүлүгү 3,0 барабар болгон жана сырткы электрондук катмарында 7 электрону бар күчтүү окистендиргич. Ошондуктан, хлор бирикмелеринде 1,3,5,7 деген валенттүүлүктү көрсөтөт. Хлор 1774–жылы швед окумуштуусу Шееле тарабынан ачылган. Жер шарында таралышы боюнча он биринчи орунда турат. Ал деңиз сууларынын, өсүмдүктөрдүн хлорофиллинин, жаныбарлардын тканында – кандын плазмасынын жана карын зилинин курамында болот. Жер кыртышынын 0,05% түзөт.
Хлор (Cl2) – сары–жашыл түстөгү уулуу газ, башка заттар менен реакцияга кубаттуу кирет, абадан 2,5 эсе оор. Суутек менен реакциялашканда хлордуу суутекти пайда кылат, хлордуу суутек сууда эригенде туз кислотасы (HCl). алынат Жаратылышта хлор таш тузунун, галиттин – (NaCl, сильвиниттин – (KCl • NaCl), карнаилиттин – (KCl • MgCl • H2O), каиниттин – (KCl • MgSO4 • H2O) курамында кездешет. Хлор күкүрт, фосфор жана натрий менен реакцияга кирет.
Хлордун кислоталык бирикмелери
Хлордуу суутек (туз) кислотасы башка кислоталар сыяктуу эле металлдар, негиздик оксиддер жана туздар менен реакцияга кирет. Хлор ичүүчү сууларды тазалоодо, ткандарды, кагаздарды агартууда жана хлор акиташын CaCl(OСl) өндүрүүдө колдонулат.
- Фтор хлорду,бромду жана иодду алардын туздарынан жана кислоталарынан сүрүп чыгат. Хлор бромду,иодду, бром иодду гана сүрүп чыгарат. (Мисалы: Cl2 +2KI
 2KCl +I2 ↓), б.а. терс электрлүүлүгү күчтүү элементтер начарыраактарын алардын кислоталарынын жана туздарынын эритмелеринен сүрүп чыгарат.
2KCl +I2 ↓), б.а. терс электрлүүлүгү күчтүү элементтер начарыраактарын алардын кислоталарынын жана туздарынын эритмелеринен сүрүп чыгарат. - Фтор эң күчтүү окистендиргич, кремнийдин бирикмелери менен реакцияга кирет.
- Астат – радиоактивдүү, аз изилденген туруксуз изотоп.
- Бардык галогенсуутектер газ абалында болушат, сууда жакшы эришет.
- Галогенсуутектердин суудагы эритмелери кислота болуп саналат.
- Хлор менен бир аз эле дем алса ал дем алуу органдарынын жабыркоосуна жана жөтөлгө алып келет.
- 1 көлөм сууда 2,5 көлөм хлор эрип, хлор суусун пайда кылат (7,9 г/л). Cl2 + H2O
 HCl + HClO
HCl + HClO - Суюлтулган хлор 600кПа басым астында болоттон жасалган баллондордо сакталат. Лабораторияда хлор калий перманганатына туз кислотасын таасир этип, ысытуунун натыйжасында алынат:
2KMnO4 +16HCl ![]() 2MnCl2 + 2KCl + 8H2O + 5Cl2 ↑
2MnCl2 + 2KCl + 8H2O + 5Cl2 ↑
- Өнөр жайда хлор кайнатма туздун NaCl концентарцияланган эритмесин электролиздөө жолу менен алынат: 2NaCl
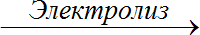 2Na + Cl2 ↑
2Na + Cl2 ↑ - Адамдын организминде 200 граммга чейинки өлчөмдө натрий хлориди бар.
- Туз кислотасы металлдардын үстүнкү катмарын тазалоо жана жасалгалоо иштеринде, тамак–аш өнөр жайында, медицинада колдонулат.
- Хлор – органикалык бирикмелерди алуу үчун сырье катары колдонулат.
Курамында хлору бар кислоталар:
HCl –хлордуусуутек, туз кислотасы, кислоталык калдыгы – (-Cl – хлорид)
HСlO – гипохлорит кислотасы, кислоталык калдыгы (-ClO – гипохлорит)
HСlO2 – хлорит кислотасы,, кислоталык калдыгы (-ClO2 – хлорит)
HСlO3 – хлорат кислотасы, кислоталык калдыгы (-ClO3 – хлорат)
HСlO4 – перхлорат кислотасы, кислоталык калдыгы (-ClO4 – перхлорат)
Йод (I2) – кочкул түстөгү кристаллдар. Ысытканда суюктукка айланбай туруп эле бууланат. Иоддун бул касиети (кургак айдоо же сублимация деп аталат).
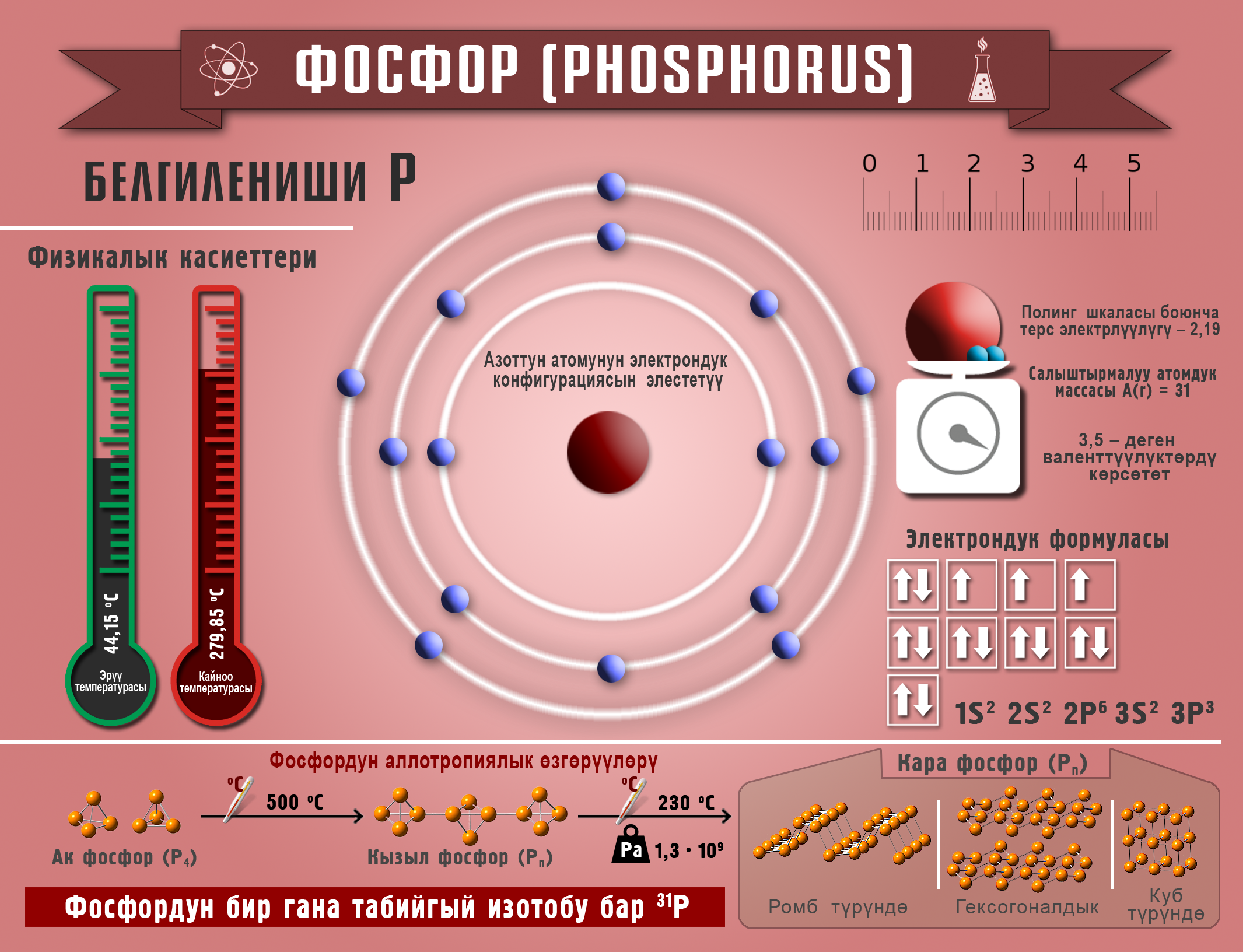
Фосфор

Фосфор жөнөкөй зат катары үч аллотропиялык модификацияны пайда кылат: ак, кызыл жана кара фосфор. Булар катуу, кристаллдык же аморфтук заттар. Кызыл фосфор металл эместик касиетти алып жүрөт. Кара фосфор графитке окшош, майлуу, жарым өткөргүч болуп саналат, металлдык касиетке ээ. Ак фосфор – активдүү металл эмес, фтор, хлор, күкүрт жана кычкылтек менен реакцияга кирет.
Ысытканда фосфор активдүү металлдар– натрий жана кальций менен аракеттенишет. Ак фосфор кызыл фосфорду алуу үчүн колдонулат, ал эми кызыл фосфор ширеңке өндүрүүдө пайдаланылат. Фосфордон фосфор кислотасы алынат, ал эми фосфор кислотасынан минералдык жер семирткичтер өндүрүлөт.
Фосфор эркин түрүндө кальций фосфатынан Ca3(PO4)2 алынат. Ошондой эле фосфордон фосфин (PH3) газы алынат. Фосфин–түссүз, чеснок жыттанган, уулуу газ. Фосфордун эки оксиди бар: Р2О3 – фосфор (III) оксиди – ак кристаллдык зат, өтө уулуу. Бул оксиддин суудагы эритмеси фосфордуу кислотаны (H3PO3) пайда кылат. Р2О5 – фосфор (V) оксиди – ак түстөгү гигроскоптуу (суу буусун өзүнө сиңирип алган) кристаллдар. Бул оксидге эки кислота туура келет – метафосфор кислотасы (НРО3) жана ортофосфор кислотасы (Н3РО4). Бул – түссүз кристаллдык зат, +42оС балкып эрийт, уулуу эмес, сууда жакшы эрийт.
Өнөр жайда фосфор кислотасын фосфориттерди жана апатиттерди концентрацияланган күкүрт кислотасы менен аракеттештирип, ысытуу менен алышат.
Ca3(PO4)2 + 3H2SO4 ![]() 3CaSO4 ↓ + 2H3PO4.
3CaSO4 ↓ + 2H3PO4.
Фосфор кислотасынын туздары жер семирткич катары колдонулат.
Пайдалуу шилтемелер
Глоссарий
- Ассимиляциялоо – өздөштүрүү
- Кургак айдоо же сублимация – катуу затты бууландырып, суюктукка өткөрбөй туруп газ абалындагы затты алуу. Бул касиет иодго – (I2) мүнөздүү.
- Вулканизация – күкүрттүн таасири астында каучуктун резинага айланышы.
- Гидратация – сууну кошуп алуу.
- Донор–акцептор байланышы – бул бир атомдогу (донор) жуп электрондук булуттан жана башка атомдогу (акцептор) бош орбиталдын эсебинен пайда болот.
- Идентификациялоо – окшоштуктуруу, дал келүүчүлүктү аныктоо.
- Изотоп – бир эле химиялык элементтин электрондорунун жана протондорунун саны бирдей, бирок нейтрондорунун саны ар башка болгон түрлөрү (катар саны бирдей, бирок атомдук массасы ар башка болот).
- Инерттүү – башка заттар менен реакцияга кирбейт
- Инсектицид – зыяндуу курт–кумурскалар менен күрөшүүнүн каражаты.
- Парамагнетизм – заттын магнитке тартылуу касиети.
- Сфера – шар формасында.
- Терс электрдүүлүк – атомдордун электрондорду өзүнө тартып алуу жөндөмдүүлүгү.
- Эндотермикалык – жылуулукту сиңирип алуу.
Библиография
- А.А. Журин «Химические формулы». Москва «Аквариум» 1997г.
- А.А. Карцова, А.А.Макаров, А.В.Трухин. Справочник школьника. Химия. Биология.Экология. Санкт-Петербург. «Сова». Москва.»ЭКСМО-ПРЕСС». 2002.
- А.В. Мешельский. Химия в экзаменационных вопросах и ответах. Справочник для учителей , репетиторов и абитуриентов. Изд. 2. Минск, «Белорусская энциклопедия». 1999.
- А.Г. Кульман. «Общая химия». Изд. 3. Москва «Колос». 1979.
- А.Годмен «Иллюстрированный химический словарь» Москва «Мир» 1988.
- А.И. Бусеев, И.П. Ефимов. Словарь химических терминов. Москва «Просвещение» 1971.
- А.П. Крешков «Основы аналитической химии». Москва «Химия» 1976.
- Большой справочник для школьников и поступающих в Вузы. «Химия». /Л.Л.Андреева, Д.Ю. Добротин, О.С. Габриелян и др./ «Дрофа», Москва, 2004
- В.А. Волков, Е.В. Вонский, Г.И. Кузнецова. «Химики» Биографический справочник. Киев «наукова Думка» 1984.
- В.А. Рабинович. З.Я.Хавин. «Краткий химический справочник» изд. 3 Ленинград. «Химия». 1991г.
- В.В Писаренко. Справочник химика – лаборанта. Изд. 2 Москва. «Высшая школа» 1974.
- В. Рич. «В поисках элементов». Москва «Химия» 1985г.
- В. Рич «Охота за элементами». Москва «Химия» 1982г.
- Г.Е. Рудзитис. Ф.Г. Фельдман «Химия 8». Учебник для 8 класса средней школы. Изд.2 Москва «Просвещение». 1991.
- Г.П. Хомченко «Химия для поступающих в ВУЗы». Изд. 2. Москва «Высшая школа» 1994г.
- Д. Верзейм. К. Ослейд. Д. Ватерхаус «Химия». Школьный иллюстрированный справочник. (перевод с латинского) РОСМЭН. First published. Лондон 1986г.
- Д.И. Менделеев «Основы химии» Изд. 13. 1947г., 2 тома Москва - Ленинград. (Санкт – Петербург, 1872)
- Д.М. Кирюшкин. В.С. Полосин «Методика обучения химии». Москва «Просвещение» 1970г.
- Дж.А. Кемпбел «Современная общая химия» в 3 т. (перевод с английского). Москва «Мир» 1975г.
- З. Энгельс, А. Новок «По следам элементов» (пер с нем.) Москва «Металлургия» 1983г.
- И.В. Кузьменко, В.В. Ерёмин, В.А. Попков «Начала химии. Современный курс для поступающих в ВУЗы» 2 т. Москва 1-я книготорговая компания. 1979г.
- И.В. Кузьменко. В.В. Ерёмин. В.А. Попков. «Химия для школьников старших классов и поступающих в ВУЗы» Москва «Дрофа» 1985 г.
- И.В. Шиманович. М.Л. Павлович. В.Ф. Тикавый. П.М. Малашко. (ред. В.Ф. Тикавого). Общая химия в формулах, определениях, схемах. Минск «Унiверсiтэцкае» 1996г.
- И.Т. Гороновский. Ю.П. Назаренко. Е.Ф. Некряч «Краткий справочник по химии». Изд. 4. Киев «Наукова Думка» 1974.
- К.Я. Парменов «Химический эксперимент в средней школе». Изд. Академии педагогических наук РСФСР. Москва 1959г.
- Книга для чтения по химии. Часть I (сост. К.Я. Парменов, Л.М. Сморгонский). Изд. 3. Государственное учебно-педагогическое издательство министерства просвещения РСФСР. Москва 1961г.
- Л.М. Монастырский «Физика за 2 года». Ростов-на-Дону «Феникс» 1995г.
- Л.Полинг «Химия» (перевод с английского). Москва «Мир» 1968г.
- М. Колтун «Мир химии» Москва «Детская литература». 1988.
- М. Колтун «Превращения черного дракона» Москва. «Детская литература» 1990.
- М. Льис Химия. Школьный курс в 100 таблицах. Москва. Аст-Пресс 1997.
- М.М. Петров, М.А. Михелев, Ю.Н. Кукушкин. «Неорганическая химия». Изд 2 Ленинград «Химия» 1976 г.
- М. Фримантл «Химия в действии» в 2х частях. (пер. с английского) Москва «Мир» 1991.
- М.И. Гельфман, В.П. Юстратов «Химия». Санкт – Петербург. Издательство «Лань» 2000 г.
- Н.И. Кошкин. М.Г. Ширкевич. «Справочник по элементарной физике» Москва «Наука» 1966.
- Н.С. Ахметов «Неорганическая химия», в 2-х частях, изд. III, Москва «просвещение». 1992г.
- Общая и педагогическая химия. Методические указания. Москва. «Высшая школа» 1990г.
- П.И Воскресенский «Техника лабораторных работ». Изд. 10е. Москва «Химия» 1973г.
- П.Р. Таубе «От водорода, до …?» Москва «Высшая школа» 1964 г.
- Популярная библиотека химических элементов (сост. В.В. Станцо, М.В. Черченко) Москва «Наука» 1983.
- Р.А. Лидин «Справочник по общей и неорганической химии». Москва «Просвещение» 1997г.
- Р.П. Суровцева. Л.С. Гузей Н.И. Останний, А.О. Тамур. «Тесты. Химия». 8-9 класс. Москва. Издательский дом «Дрофа» 1997.
- С.Б. Шустов. Л.В. Шустова. Химические основы экологии». Москва «Просвещение» 1995.
- Н.А.Варкентина, Р.Х.Дженлода «Химические элементы в школьном курсе химии». Бишкек, «Азия Технографика», 2010 г.
- Урок окончен – занятие продолжаются. (ред. Э.Г. Злотникова) Москва «Просвещение» 1992 г.
- Учебный справочник школьника «Дрофа». Москва. 2002. 4-е издание. Ред.Н.Е. Рудомазина и др.
- Ф.Г. Фельдман, Г.Е. Рудзитис «Химия 9» учебник для 9 класса средней школы. Москва «Просвещение».
- Физика и химия. «Универсальная энциклопедия школьника». Минск. «Валев». 1995г.(сост. А.А.Воротников).
- Химическая энциклопедия том 1-2. (ред. И.Л. Кнунянц) Москва. Издательство «Советская энциклопедия». 1988.
- Химия в формулах. Справочное пособие. 8-11 класс. Состав В.В. Ерёмин. Москва. Издательский дом «Дрофа».
- Химия. (пер. с немецкого В.А. Молочко. С.В. Крынкиной). Москва «Химия» 1989.
- Химия. Пособие – репетитор. (ред. А.Ф. Егоров) изд. 2 Ростов-на-Дону «Феникс» 2000г.
- Химия. Справочник школьника (научная разработка и составление М. Кременчугской и С. Васильева) Филологическое общество «Слово» Компания «Ключ-С». ТКОАСТ. Центр гуманитарных наук при факультете журналистики МГУ им. Ломоносова. Москва 1997.
- Химия. Справочное руководство (пер. с немецкого) оед. Ф.Г. Гаврюченкова, М.И. Курочкиной, А.А. Потехина. В.А Рабиновича). Ленинград «Химия»
- Химия: справочные материалы ( под ред. Ю.Д. Третьякова I-III изд. Москва «Просвещение» 1984, 1988, 19993 г.
- Э. Гроссе. Х. Вайсмантель «Химия для любознательных». Изд.2 Ленинград «Химия».1985г.
- Энциклопедический словарь юного химика. (ред. М.А. Прокофьев) Москва «Педагогика» 1990 г.
- Энциклопедия для детей «Аванта». Москва. 2000г. Гл. ред. В.А. Володин
- Ю.Ю. Лурье. «Справочник по аналитической химии». Изд. 4. Москва «Химия» 1971.
- Я.А. Угай. «Общая и неорганическая химия». Изд. 2. Москва «Высшая школа» 2000г.
- Я познаю мир. Детская энциклопедия. Химия. (Авт.-сост.Л.А.Савина). Москва. АСТ. 1995г.
- В.А. Волков, Е.В.Вонский, Г.И. Кузнецова «Химики». Изд. «Наукова думка». Киев. 1984 г.
Суутек s–элементи болсо да, мезгилдик системада щелочтуу металлдардын жана галогендердин катарында, ал эми кээде ɵзүнчɵ жайгашат. Чындыгында, ал щелочтуу металлдарга Н+ оң ионун пайда кылгандыгы жана реакцияларда калыбына келтиргич болгондугу менен окшош болот. Бирок, галогендерге караганда суутектин терс электрлүүлүгү тɵмɵн болот. Ошого карабастан, суутек щелочтуу металлдарга караганда, галогендерге кɵбүрɵɵк жакын болот. Активдүү металлдардын гидриддеринде (NaH. СаН2) галиддер сыяктуу эле (NaCl, СаСI2) Н+ иону болот. Суутектин молекуласы галогендердин молекуласы сыяктуу эки атомдон турат. Фтор жана хлор сыяктуу эле суутек газ абалында болуп, металл эместик касиеттерди алып жүрɵт. Органикалык бирикмелерде суутектин атомун галогендердин атомдору оңой алмаштырышат.
Мындан сырткары, суутек бир нече жеке касиеттерге ээ болот, себеби, анын валенттик электрону (аралык электрондук катмарда эмес) атомдун ядросунун сферасында жайгашкан. Мисалы, протон иондук байланыш менен бирикмелерди пайда кылбайт. Суутектин атомунун түзүлүшүнүн ɵзгɵчɵлүгү анын суутектик байланышты түзгɵндүгү да болуп саналат.
- Суутек ааламда эң кеңири таралган элемент.
- Суутек жер шарынын 1% түзөт.
- Ааламда суутек жылдыздарга жана Күнгө энергия бергендиктен, аны «космос отуну» деп аташат.
- Суутек уулуу эмес.
- Суутек эркин абалында вулкандык газдар менен бөлүнүп чыгат.
- Протийдин 5000 атомуна Дейтерийдин 1 атому туура келет.
- Тритийдин 1 атому миллиарддаган Протийге туура келет.
- Дейтерийден турган оор суу 3,8 градуста тоңот, ал эми 101,4 градуста кайнайт.
- Суутек кычкылтекте күйгөндө бөлүнүп чыккан жылуулук кварцты, металлдарды балкытып эритүүгө жана болот плиталарын кесүүгө колдонулат.
- Металл түрүндөгү суутек жогорку басым астында алынган.
- Абада окистенүү – калыбына келүү реакциясы жүргɵндүктɵн, адамдар кɵпкɵ чейин чектелген мейкиндикте, мисалы, суу астында жүрүүчү кемелерде жүрɵ алышат.
2Na2O2 + 2CO2 ![]() 2Na2CO3 + O2 ↑
2Na2CO3 + O2 ↑
- Организмде кычкылдандыруу азайганда, озон менен байытылган барокамераларда дарылоо улантылат.
- Озон катмарынын калыңдыгы болгону 3 миллиметр болсо да, тирүү организмдерге зыяндуу болгон ультра кочкул нурларда тосуп калат.
- Эгерде абадагы озон бардык ультра–кочкул нурларын тосуп алса, анда организм тарабынан D витамини иштелип чыкпай, ɵсүп, ɵнүгүү да болмок эмес.
- 1890–жылы отко чыдамдуу сейфтерди бузуп ачкан адам металлдарды кычкылтек–суутектик жалын менен кескен ойлоп табуучу болуп калган
- Көмүртектин атомдору чынжырларга чексиз биригүүгө жөндөмдүү: сызыктуу, бутактанган жана циклдик түрдө.
- Алмазды өзүнүн гана порошогу менен жылмалоого болот.
- 3000 oС температурада жана 1010Па басымда графит алмазга айланат..
- Карбин – көмүртектин аллотропиялык түрү, ал метеориттер түшкөн учурда пайда болгон вулкандардын кратерлеринен табылган.
- Бардык карбиддер негиздерге жана курамында кɵмүртек бар газдарга гидролизденет:
Al4C3 + 12H2O ![]() 4Al(OH)3 + 3CH4
4Al(OH)3 + 3CH4
- Ацетиленди ɵнɵр жайда алуу реакциясы:
CaC2 + 2H2O ![]() Ca(OH)2 + C2H2.
Ca(OH)2 + C2H2.
- Ацетилен металлдарды газ менен ширетүүдɵ колдонулат, анткени, ал кычкылтекте күйгɵндɵ эң жогорку температурадагы (3000oС) жылуулукту бɵлүп чыгарат.
- Акиташты күйгүзүү жолу менен кальций карбидин алуу эки стадия менен жүрɵт:
CaCO3 ![]() CaO + CO2
CaO + CO2
CaO + 3C ![]() CaC2 + CO
CaC2 + CO
- Активдүү металлдар кɵмүр кычкыл газында күйɵт:
2Mg + CO2 ![]() 2MgO + C
2MgO + C
- Альмандин (3FeO•Al2O3 • 3SiO2) жаратылыш силикаты жана ортоклаз – Тянь – Шань тоолорундагы негизги минералдары.
- Жаратылыш силикаттары таза түрүндө кымбат баалуу таштар катары колдонулат. Аларга аквамарин, изумруд, топаз кирет.
- Ошондой эле жарым жартылай баалуу таштар, агатта, аметистте жана яшмада кремний оксиди – SiO2 болот..
- Таза түрүндөгү кремний оксидин тоо хрусталы же кварц деп атайбыз.
- Кызгылт–сары түскө боёлгон кумда темир гидроксидинин Fe(III) туздары, ал эми боз–жашыл түстөгү кумда хромдун Cr(III), (IV) туздары болот.
- Кандай жол менен алынса да, биринчи күрɵң түстɵгү аморфтук кремний алынат t(эр) =1420оС.
- Аморфтук кремнийди кайрадан кристаллдаштыруудан кийин гана кристаллдык кремний алынат.
- Кристаллдык кремний инерттүү, себеби, анын түзүлүшү алмаздыкына окшош болот.
- Ысытканда, жарыктандырганда кремнийдин электр ɵткɵргүчтүгү жогорулайт.
- Кремний техникада кɵбүнчɵ жарым ɵткɵргүч катары колдонулат.
- Кремний оксидинин SiO2 оксид пленкасы плавик кислотасында (HF) гана эрийт.
- Кремний галоген суутектер менен азот кислотасы катышканда гана реакцияга кирет:
3Si +12HF + 4HNO3 ![]() 4NО + 3SiF4 + 8H2O
4NО + 3SiF4 + 8H2O
- Кремний металлдарды алардын оксиддеринен калыбына келтирүүчү катары колдонулат:
2MgO + Si ![]() 2Mg + SiО2.
2Mg + SiО2.
- Суутек менен реакцияга киргенде уулуу, ɵзүнɵн ɵзү жалындап күйгɵн силан газы (SiH4) бɵлүнүп чыгат.
- Кремнийдин металл менен болгон куймасы ферросилиций деп аталат.
- Болот куйманын курамында 0,15% кремний болсо, ал кислотага туруктуу болот жана андан химиялык жабдыктар жасалат.
- Карборунд (SiС) алмаз сыяктуу кристаллдык торчого ээ, ошондуктан ал катуулугу боюнча алмазга жакын болот.
- Карборундду электр мештеринде кум менен кокстун аралашмасынан алышат:
SiO2 + 3C ![]() SiC + 2CO ↑
SiC + 2CO ↑
- Техникада карборундду бычак курчутуучу таштарды алууда колдонушат.
- Кремний оксиди SiO2 сары–күрөң түстөгү полдун краскасына кошулат.
- Кремний кислотасы (H2SiO3) сакталып турса, поликремний кислотасынын килкилдеген чөкмөсүнө айланат.
- Кремний кислотасын H2SiO3 суюк айнекке – (кремний кислотасынын туздары жана щелочтуу металлдар) күчтүү кислотаны таасир этүү менен алышат.
- Бардык силикаттар кыйындык менен балкышат жана сууда эришпейт (Na, K туздарынан башка).
- Айнек өндүрүү үчүн сырье катары сода – Na2CО3, акиташ же бор – СaCO3 жана кум SiO2 пайдаланылат.
- Кадимки айнектин формуласы: Na2O • CaO • 6SiO2.
- Бекем, отко чыдамдуу өзгөчө айнектерди алуу үчүн аралашмага барийдин, коргошундун жана бордун оксиддери кошулат.
- Ар кандай түстөргө боёлгон айнектерди алуу үчун кобальттын оксидин (көк айнек) жана хромдун оксидин (жашыл айнек) кошушат.
- Коргошундун оксидин (РbО) кошуу менен хрусталь айнегин алууга болот.
- Эритмеге майдаланган алтынды(10–5м) кошсо, анда кызыл түстөгү айнек алынат.
- Цемент – силикаттардан турат, алар CaO, SiO2, Al2O3, Fe2O3 аралашмасын пайда кылат..Эгерде цементтин порошогуна суу кошсо, анда акырындык менен абада катыган масса алынат.
- Цементке кумду же шагылды кошсок, анда курушуш иштеринде кеңири колдонулган бетонду алууга болот.
- Бетонго темир каркастарын кошсо, ал анда андан да бекем болот.
- Бышырылган чоподон керамика буюмдарын жасоого болот («керамон» грек тилинен «чопо» деп которулат).
- Каолиниттен же «ак чоподон» фарфор жана фаянс буюмдары жасалат.
- Кадимки шартта азот түссүз, жытсыз жана даамсыз газ.
- Азот биз дем алган абанын курамынын 78% түзɵт.
- Азот бардык жандуулардын оргинизминде кездешет, (адамдын денесинде жана ɵсүмдүктɵ да).
- Газ абалындагы азот тамак–аш бузулбас үчүн аларды сактоочу жайларда пайдаланылат. Ошондой эле ал ɵндүрүштɵ электрондук тетиктерди жасоодо колдонулат.
- Азот газы кɵпчүлүк учурда кɵмүртектин эки оксидинин ордуна пивонун кээ бир сортторун бочкада басым астында сактоодо колдонулат.
- Титан, Сатурндун эң чоң айынын атмосферасы толугу менен азоттон (98% кɵп) турат. Күн системасындагы тыгыз атмосферадан турган жалгыз ай болгондугу да белгилүү.
- Азот ɵтɵ тɵмɵнкү температурада суюк абалга ɵтɵт. Суюк азот t(кай) –196 оC кайнайт. Ал транспортто жеңил ташылат жана кɵптɵгɵн пайдалуу касиеттерге ээ: ɵзгɵчɵ криогеникада, компьютердик хладагент катары (ысып кетүүнүн алдын алуу үчүн),сɵɵлдү кетирүү ж.б. колдонулат.
- Декомпрессион оорусу (же кессон оорусу) – бул адам ɵтɵ терең сууга түшкɵндɵ, кан басымы тɵмɵндɵйт, бул денедеги канда азоттун кɵбүгүнүн пайда болушуна алып келет. Ушундай эле кɵрүнүш самолеттордо учкучтарда жана космонавттарда болушу мүмкүн.
- Азоттун закиси (N2O) («кɵңүл кɵтɵрүүчү газ» деген ат менен белгилүү) ооруканаларда жана тиш дарылоочу клиникаларда анестезиялоочу каражат катары колдонулат (операция убагында ооруну жок кылуучу жана азайтуучу).
- Ошондой эле автоспортто кыймылдаткычтын кубаттуулугун жана унаанын ылдамдыгын күчɵтүү үчүн да колдонулат.
- Нитроглицерин – бул жарылгыч заттарды жасоодо колдонулуучу суюктук, мисалы. динамит. Бул бирикме ɵндүрүштɵ жана согуштук максатта колдонулат.
Күкүрт кескин жыттуу жана адамды муунтуучу зат. Диний ыйык кызматкерлер (жрецтер) аны ар түрдүү ырым–жырымдарды жасоодо, түтɵтүүгɵ пайдаланса, ал эми аскерлер аны күйүүчү аралашмаларга кошкон.
Күкүрттүн организмдеги ролу
Организмдеги бир дагы процесс күкүртсүз жүрбɵйт. Ал бардык белоктордун курамына кирет. Күкүрт адамдын организми үчүн чоң ролду аткарат. Нерв клеткаларынын бир калыпта иштɵɵсүнɵн баштап, кандагы канттын курамын теңдɵɵ, иммунитетти жогорулатуу жана суук тийгенге каршы аракеттерди жасайт.
Мындан сырткары, күкүрттүн дагы бир керемети анын таза түрүндɵ дарылоодо колдонулгандыгында.
Тамактануу
Биздин күнүмдүк колдонгон тамак–аштардын курамында күкүрттүн бар экендиги кээ бир адамдарды таң калтырар. Аларга: бардык чанактууларды, тарууну, нан азыктарын, пияз, чеснокту, алманы, жүзүмдү, сүт азыктарын жана балыкты киргизүүгɵ болот.
- Ошондуктан, бизге күкүрттүн жетишсиздиги сезилбейт, анткени, бул азыктарды дайыма пайдаланабыз.
- Индонезиянын бир провинциясында Кава Иджен деп аталган, ичи толук күкүрткɵ толгон вулкан бар. Күкүрт түтүктɵрдүн ичине чейин толуп калат, аны жумушчулар таразага тартышат да, аларды сатып, акча таап, үй–бүлɵɵлɵрүн багышат экен.
- Гигиеналык "продуктылар" – күкүрттɵн бетке чыккан ысык ж.б. дарылоо үчүн кремдер жасалат.
- Бизди бала кезибизден бери кебез тампондору менен кулактагы кулкунду алууга үйрɵтүшкɵн. Ал эми кулкунда ɵзгɵчɵ ферменттер – лизозимдер болот, алар кулакты ар түрдүү бактериялардан сактайт экен.
1811–жылы француз химик–технологу жана фармацевт Бернар Куртуа йодду ачкан. Түшкү тамактануу учурунда дайыма жакшы кɵргɵн мышыгы анын ийнине отуруп алган.
Куртуанын лабораторияда тамактанган учуру кɵп болгон. Күндɵрдүн биринде түшкү тамактануу учурунда мышык бир нерседен чочуп кеткендиктен, жерге секирип түшɵт. Ал кокусунан лабораториялык столдо турган бɵтɵлкɵнү кулатып кетет. Бɵтɵлкɵнүн бирɵɵнɵ Куртуа балырлардын күлүнɵн жасалган этил спиртинин суспензиясын (натрий иодиди), ал эми экинчисине концентрацияланган күкүрт кислотасын куюп койгон.
Бɵтɵлкɵлɵр талкаланып, суюктуктар аралашып калган. Жерден кочкул–кɵк түстɵгү буулар жогору карай кɵтɵрүлгɵн жана металлдык жалтырактыкка ээ, кескин жыттуу, кара–кочкул түстɵгү кичинекей кристаллдар топтоло баштаган. Бул жаңы ачылган элемент–йод болгон.
Бир жолу англиялык химик Гемфри Дэви, идишке ис газы– түссүз жана жытсыз зат менен толуп калгандыгын унутуп, бул идишке кийинки күндɵгү тажрыйбага даярдалган хлорду толура баштаган.Оозу жабык идиш лабораториялык столдо, терезенин жанында калган. Күн ачык эле. Эртеси эртең менен Дэви идиштеги хлордун саргыч–жашыл түсүнүн ɵзгɵргɵндүгүн байкаган. Идишти ачканда, окумуштуу ɵзгɵчɵ жытты, алманын, чɵптүн жана жалбырактын чириндилеринин жытындай экендигин сезген.Дэви идиштеги затты изилдеп, газ абалындагы жаңы заттын пайда болгондугун аныктаган. Ал аны «фосген» деп атаган, грек тилинен которгондо, “жарыкты алып жүрүүчү” деген маанини түшүндүргɵн. Мына ошентип, 1811–жылы Биринчи Дүйнɵлүк согушта кеңири пайдаланылган ууландыруучу зат ачылган.
Фтордун ачылышы эң татаал ачылыштардын бири болгон. Ирландия Илимдер Академиясынын эки мүчɵсү фтордон биринчи жабыр тартышкан. Томас Нокс фтордуу суутектен ууланып каза болсо, Георг майып болуп калган. Фтордун кийинки курмандыгы бельгиялык химик П. Лайет болгон. Ал эми франциялык химик Джер Никлес фторду алуу боюнча тажрыйба жүргүзүп жатып, кыйналып ɵлгɵн. Француз химиктери Жозеф Гей–Люссак, Луи Тенар жана англиялык химик Гемфри Дэви фтордуу суутек менен ууланып, олуттуу күйүккɵ кабыл болушкан. Фторду анын бирикмелеринен электролиз жолу менен алууга аракет кылган француз химиги Эдмон Фреми жана англиялык электрохимик Георг Гор ден–соолуктарына зыян келтиришкен. 1886–жылы гана француз химиги Анри Муассан фторду оңой ала алган. Муассан фтордуу суутектин HF жана калийдин гидродифторидинин (KHF2) суюк аралашмасы электролизден кийин, платина идишке, аноддо кескин жыттуу, ачык–жашыл түстɵгү газдын бɵлүнүп чыкканын кокусунан байкап калган. Бирок, Муассан Париж Илимдер Академиясында ɵзүнүн ачылышы жɵнүндɵ доклад жасап жатканда, окумуштуунун бир кɵзү таңылып турган. 1906–жылы Муассанга химия боюнча «кɵптɵгɵн изилдɵɵ иштерин жүргүзгɵндүгү – фторду алгандыгы жана анын аты менен лабораторияда жана ɵндүрүштɵ электр мештерин практикага киргизгендиги үчүн» Нобель сыйлыгы ыйгарылган.
- Фосфор сууда эрибейт, ошондуктан аны кычкылданып кетпеши үчүн сууда сакташат.
- Ак фосфор абада тез кычкылданат жана караңгыда күйөт, ошондуктан аны «жарыкты алып жүрүүчү» деп аташат (фос – жарык, фор – алып жүрөт, ташыйт).
- Ак фосфор өтө уулуу. 1 граммдын ондон бир бөлүгү да адамды өлтүрөт
- Ак фосфор жеңил от алып күйөт, териде көпкө айыкпаган жараны пайда кылат.
- Ак фосфорду 250оС басым астында абаны катыштырбай ысытуу менен кызыл фосфорду алууга болот.
- Кызыл фосфорду ысытканда, ал балкып эрибейт, катуу абалдан суюк абалга ɵтпɵстɵн эле, газ абалына(бууга) ɵтүп кетет (сублимация).
- Кызыл фосфорду муздатканда, ак фосфорго ɵтɵт.
- Ак жана кызыл фосфорду 200oС басым астында ысытканда, кара фосфор пайда болот.
- Фосфордун оксидинин (V) – (Р2О5) кристаллдары эксикатордогу абаны кургатуу үчүн колдонулат.
- Фосфор кислотасын акырындык менен ысытканда, экифосфор (дифосфор) кислотасы жана пирофосфор кислотасы пайда болот.
2Н3РО4 ![]() Н4Р2О7 +Н2О
Н4Р2О7 +Н2О
- Фосфор кислотасы реактивдерди, органикалык заттарды даярдоодо, катализаторлорду алууда, металлдарды коргоочу жабууларды түзүүдɵ жана дары чыгаруу ɵнɵр жайларында колдонулат.