Химия: Неметаллы
К неметаллам относятся 20–25 элементов расположенных в Периодической системе химических элементов справа вверх от диагонали бор–астат. Большинство из них p – элементы, только водород и гелий относятся к s – элементам. Им характерны валентности от 3 до 8 и степени окисления от –4 до + 8. Все они сильные окислители, имеющие высокие показатели электроотрицательности от 2 до 4 электрон – вольт. Однако при взаимодействии неметаллы могут быть как окислителями, так и восстановителями, в зависимости от состава молекул. Свойства неметалличности элементов усиливаются слева направо в пределах периода и уменьшаются сверху вниз в пределах группы. Роль неметаллов в природе очень велика: 84 % в составе почвы, 98,5 % в составе растений и 97,6 % в составе тела человека. Такие элементы как углерод, кислород, водород, азот, фосфор и сера входят в состав белков, нуклеиновых кислот, жиров, углеводов и витаминов. Воздух также состоит из неметаллов – азота, кислорода, благородных газов.
Вода – производное двух неметаллов: водорода и кислорода. Среди неметаллов есть газообразные вещества, молекулы простых веществ которых состоят из одного атома – это благородные газы, из двух атомов – водород, азот, кислород, фтор и хлор. Среди неметаллов есть жидкость – молекулы брома из двух атомов и твердые вещества аморфного состояния – красный и белый фосфор, сера, а также кристаллические вещества – углерод, кремний, йод. Они могут образовывать аллотропные модификации в простых веществах, например: алмаз – графит; кислород – озон и т.д. Неметаллы плохо проводят тепло и электрический ток. Таким образом, многие свойства природных объектов зависят от свойств неметаллов.
Содержание
Водород
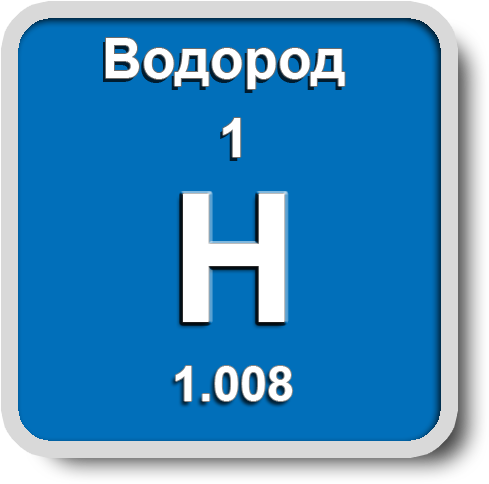
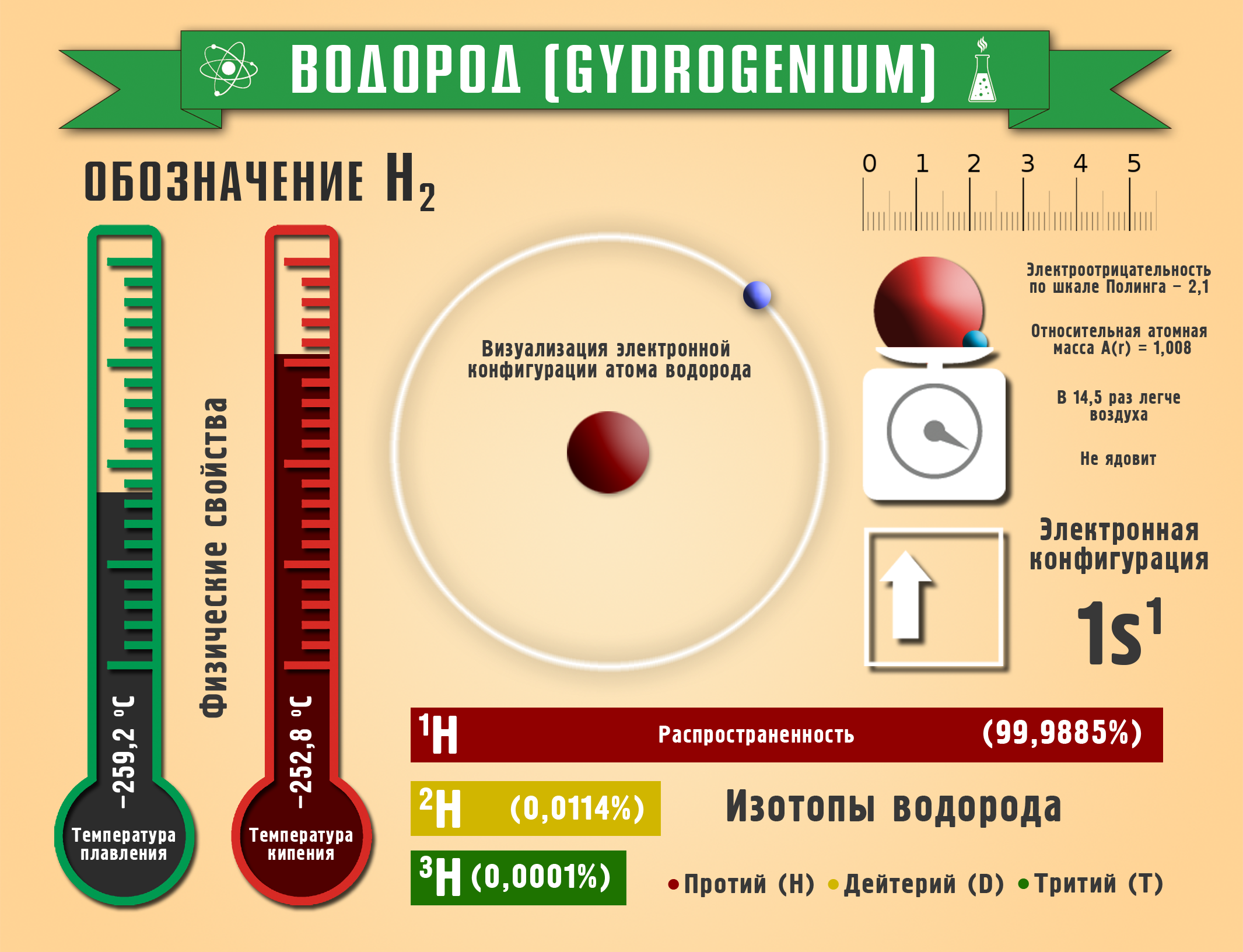
Водород образует три изотопа: ![]() - легкий водород (Протий),
- легкий водород (Протий), ![]() - тяжелый водород (Дейтерий) и
- тяжелый водород (Дейтерий) и ![]() - сверхтяжелый водород (Тритий). Электроотрицательность водорода по Полингу – 2,1.
- сверхтяжелый водород (Тритий). Электроотрицательность водорода по Полингу – 2,1.
Мeталлы < Электроотрицательность (Н) 2,1< Неметаллы
На Земле водород находится в связанном виде в составе воды, нефти, минералов, живых существ. 95% всех химических веществ содержат водород. Как самый лёгкий газ обнаруживается в верхних слоях атмосферы, в космосе – 63%, в литосфере – 0,15%, в гидросфере – 4%.
Водород - газ без цвета, запаха. В 14,5 раз легче воздуха, температура кипения -252,8 оС, плохо растворим в воде. Обладает высокой теплопроводностью. Хорошо растворяется в некоторых металлах (Pt, Pd, Ni). Горит в воздухе.
Смесь 2 объемов H2 + 1 объема O2 – взрывоопасна, называется «гремучий газ».
Водород входит в состав воды – H2O, сероводорода – H2S, галогеноводородов – HCl, HBr, HF, HJ, аммиака– NH3, метана – CH4, фосфина – PH3, гидридов металлов –NaH, CaH2. Все кислоты содержат водород.
Водород проявляет себя как окислитель в реакциях образования гидридов металлов и как восстановитель в реакциях с неметаллами. Восстанавливает металлы из их оксидов при нагревании ![]() .
.
Реакция восстановления оксида меди II водородом.
Водород реагирует с неметаллами серой, хлором ![]() , йодом, азотом. Получают водород в лаборатории взаимодействием металлов с кислотой Zn + 2HCl
, йодом, азотом. Получают водород в лаборатории взаимодействием металлов с кислотой Zn + 2HCl ![]() ZnCl2 + H2↑.
ZnCl2 + H2↑.
В промышленности водород получают из метана: ![]() ,
, ![]() .
.
Применяют водород для заполнения аэростатов, зондов, как восстановитель для получения тугоплавких, редких и особо чистых металлов (Мо,W); в установках водородной сварки, водородных горелках.
Водород используется как сырьё для получения NH3-аммиака, HCl - хлороводорода, CH3OH - метанола.
Жидкий водород используется как топливо для ракет.
-

Метеозонды накачивают водородом
-

В ракетостроении водород используют в качестве топлива
-

Подъемная сила водорода используется и в аэроплавании
-

Водород горит с большим выделением тепла, его используют в качестве сварки
Кислород
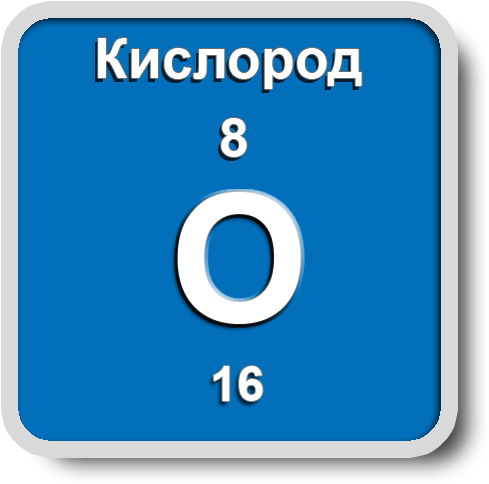
Заряд ядра +8, A(r)=16 а.е.m. Электроотрицательность по Полингу 3,5. Валентность-всегда 2, хотя и стоит он в VIА группе ПСЭ; степени окисления: -2, -1, 0, +2.
Молекула состоит из двух атомов - О2. Образует аллотропное видоизменение - О3 (озон) с М (О3) = 48 г/моль.
Кислород - самый распространенный элемент на Земле - 49% (по массе). Атмосферный воздух содержит - 21% кислорода по объему, литосфера - 47,2%. В связанном виде кислород входит в состав воды, минералов, органических веществ: (50-85% массы растений или животных состоят из кислорода.)
Состав воздуха: О2 - 21%, N2 - 78%, инертные газы -1%. (Средняя масса воздуха = 29 г/моль). Кислород - газ без цвета, запаха, вкуса, тяжелее воздуха. Плотность 1,43 г/л, tкип -183°С. В воде кислород малорастворим - 0,04 г/л. Жидкий кислород голубоватого цвета, парамагнитен. Кислород образует соединения со всеми веществами, кроме гелия, неона, аргона. Не реагирует напрямую с фосфором, хлором, золотом, с платиновыми металлами.
Кислород всегда окислитель. (Кроме вещества ОF2). В реакциях с металлами и неметаллами образуются оксиды (СаО, Р2О5).
С щелочными металлами кислород образует пероксиды (Na2O2). Все реакции элементов с кислородом - экзотермичны - идут с выделением тепла и света, Горят органические и неорганические вещества. Бурное окисление называется горением. В чистом кислороде вещества горят интенсивней, чем в воздухе, например в воздухе аммиак не горит, а горит только в кислороде ![]()
Сероводород горит на воздухе (или при недостатке кислорода) по сравнению с чистым кислородом, образуя разные продукт реакции 2H2S + O2 ![]() 2S↓ + 2H2O (в воздухе),
2S↓ + 2H2O (в воздухе),
![]() (в чистом кислороде). Органические вещества в кислороде сгорают до углекислого газа и воды (CO2 и H2O): CH4 + 2O2
(в чистом кислороде). Органические вещества в кислороде сгорают до углекислого газа и воды (CO2 и H2O): CH4 + 2O2 ![]() CO2↑ + 2H2O.
CO2↑ + 2H2O.
В промышленности при восстановлении металлов для получения оксидов обжигают сульфиды: ![]() .
.
В лаборатории кислород получают, разлагая богатые им вещества:
2KMnO4 ![]() K2MnO4 + MnO2 + O2↑,
K2MnO4 + MnO2 + O2↑,
2KClO3 ![]() 2KCl + 3O2↑,
2KCl + 3O2↑,
2H2O2 ![]() 2H2O + O2↑ (MnO2 – катализатор).
2H2O + O2↑ (MnO2 – катализатор).
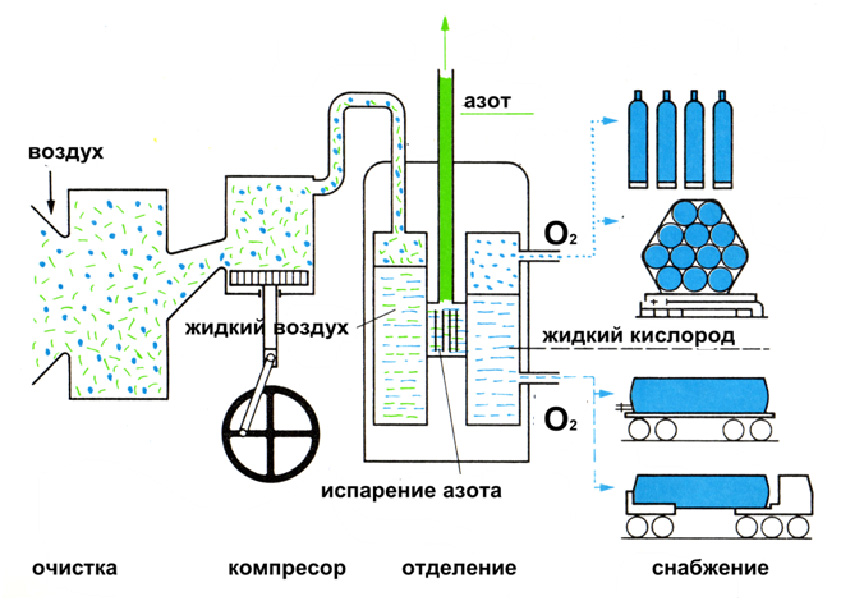
В промышленности кислород получают разложением воды электрическим током: 2Н2О ![]() 2Н2↑+О2↑ или фракционной перегонкой жидкого воздуха.
2Н2↑+О2↑ или фракционной перегонкой жидкого воздуха.
Из жидкого воздуха в первую очередь будет испаряться азот, а затем кислород. При многократном проведении такого процесса в ректификационных колоннах – можно получить достаточно чистый кислород с незначительной примесью азота.
Озон (О3) – аллотропное видоизменение кислорода - более сильный окислитель, чем кислород. Озон применяется для обеззараживания питьевой воды и сточных вод. А также в медицине как дезинфицирующее средство.
Углерод
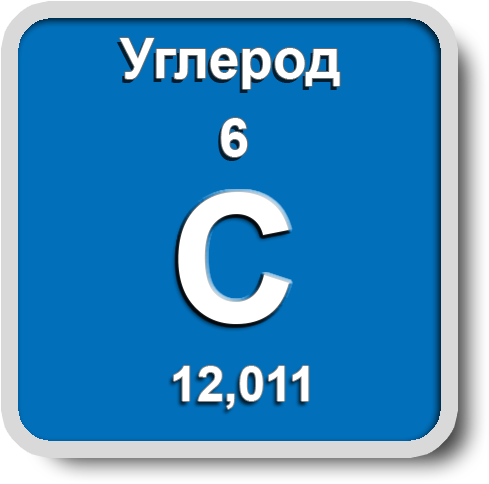
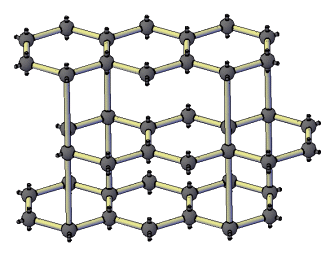
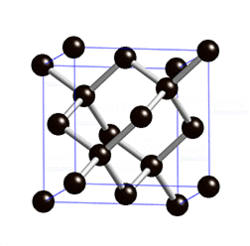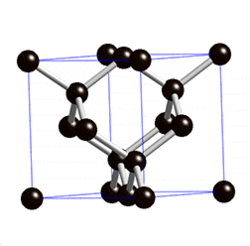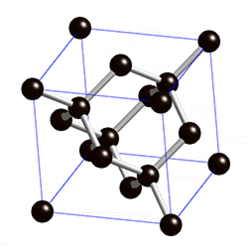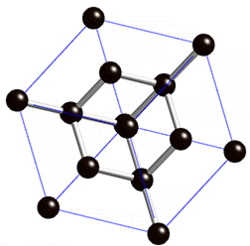
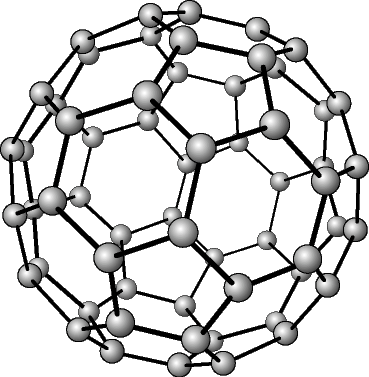
В свободном состоянии углерод образует 5 аллотропных видоизменений, но наиболее известны алмаз и графит. Недавно открыт фуллерен. Аллотропные формы углерода различаются строением кристаллической решетки. Алмаз не проводит электрический ток. Кристаллы алмазов обладают сильным преломляющим свет свойством. Графит – серые кристаллы с металлическим блеском, имеет слоистое строение. Слои могут смещаться относительно друг друга. Графит проводит электрический ток. Фуллерен - представляет собой полые сферы состава С60, С70. Были получены искусственным путем, а позже обнаружены в саже.
При низкой температуре все аллотропные виды углерода инертны. При нагревании углерод реагирует со многими простыми и сложными веществами. С металлами углерод образуют карбиды Al4C3, Mg2C, с кислородом два оксида CO, CO2, реагирует с серой и галогенами CS2 (сероуглерод), CCl4 (тетрахлорметан, четырехлористый углерод). Углерод является важнейшим восстановителем, отбирая кислород у оксидов металлов. C + CuO ![]() Cu + CO, 2C + PbO2
Cu + CO, 2C + PbO2 ![]() Pb + 2CO
Pb + 2CO
При пропускании водяного пара над раскаленным углеродом образуется водяной газ - смесь угарного газа и водорода: C + H2O (пар) ![]() CO + H2 (водянной газ).
CO + H2 (водянной газ).
Все органические вещества, содержащие углерод горят в воздухе, выделяя тепло, углекислый газ и воду.
Соединения углерода
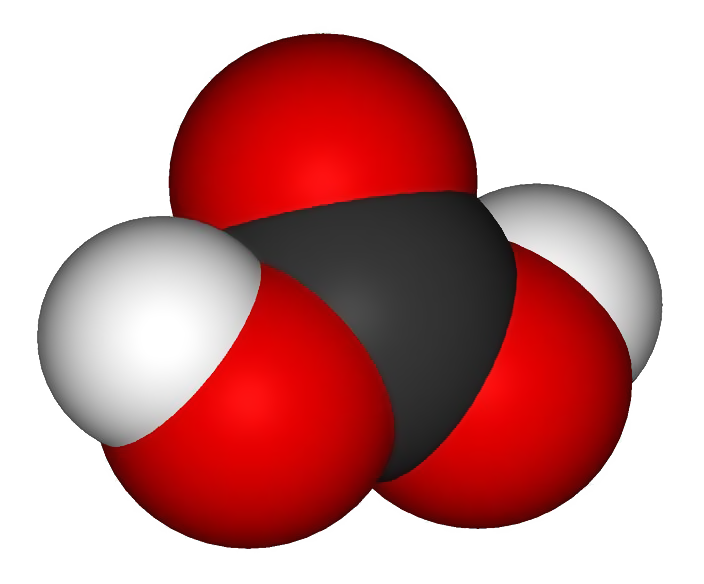
CO2 - углекислый газ - оксид углерода (II), образуется в процессе дыхания любых живых существ. Углекислый газ не ядовит, однако, не поддерживая дыхания, может вызвать удушье.
- Магний сгорает в углекислом газе
- Удивительный сухой лед
СО2 ассимилируется зелеными листьями растений и в процессе фотосинтеза превращается в глюкозу, при этом в атмосферу выделяется кислород
6СО2 + 6Н2О ![]() С6Н12О6 + 6О2.
С6Н12О6 + 6О2.
Угольная кислота (Н2СО3) – образованная реакцией углекислого газа с водой (известна как газированная вода).
Она образует два вида солей: карбонаты (средние соли) Na2CO3 – кальцинированная сода, – кристаллическая сода, К2СО3 – поташ и гидрокарбонаты (кислые соли) NaHCO3 – питьевая сода.
Богатством планеты является - углеродное топливо. Оно бывает: твердое – уголь, торф, сланцы, дрова, кизяк, кокс; жидкое – нефть, нефтепродукты; газы - природные, попутные.
Различают 3 вида углей: антрацит (сдержит 95% углерода ), каменный (90-70% С), бурый (65-70% С). При нагревании угля без доступа воздуха выделяются летучие соединения, аммиачная вода и остается твердый продукт - древесный уголь, содержащий систему пустот и каналов и обладающий способностью поглощать газы, яды, это сорбционные или сорбирующие способности древесного угля. Торф - это продукт первой стадии образования угля. При сухой перегонки из торфа получают торфяной кокс.
Нефть - смесь 150 водородных соединений углерода. При термической обработке получают: бензин, керосин, газойль, мазут. Попутные газы, растворенные в нефти, отделяют от нефти при выстаивании. Существуют самостоятельные месторождения природного газа, состоящие в основном из метана (95% - СН4). Углеводородные соединения – высококалорийное топливо.
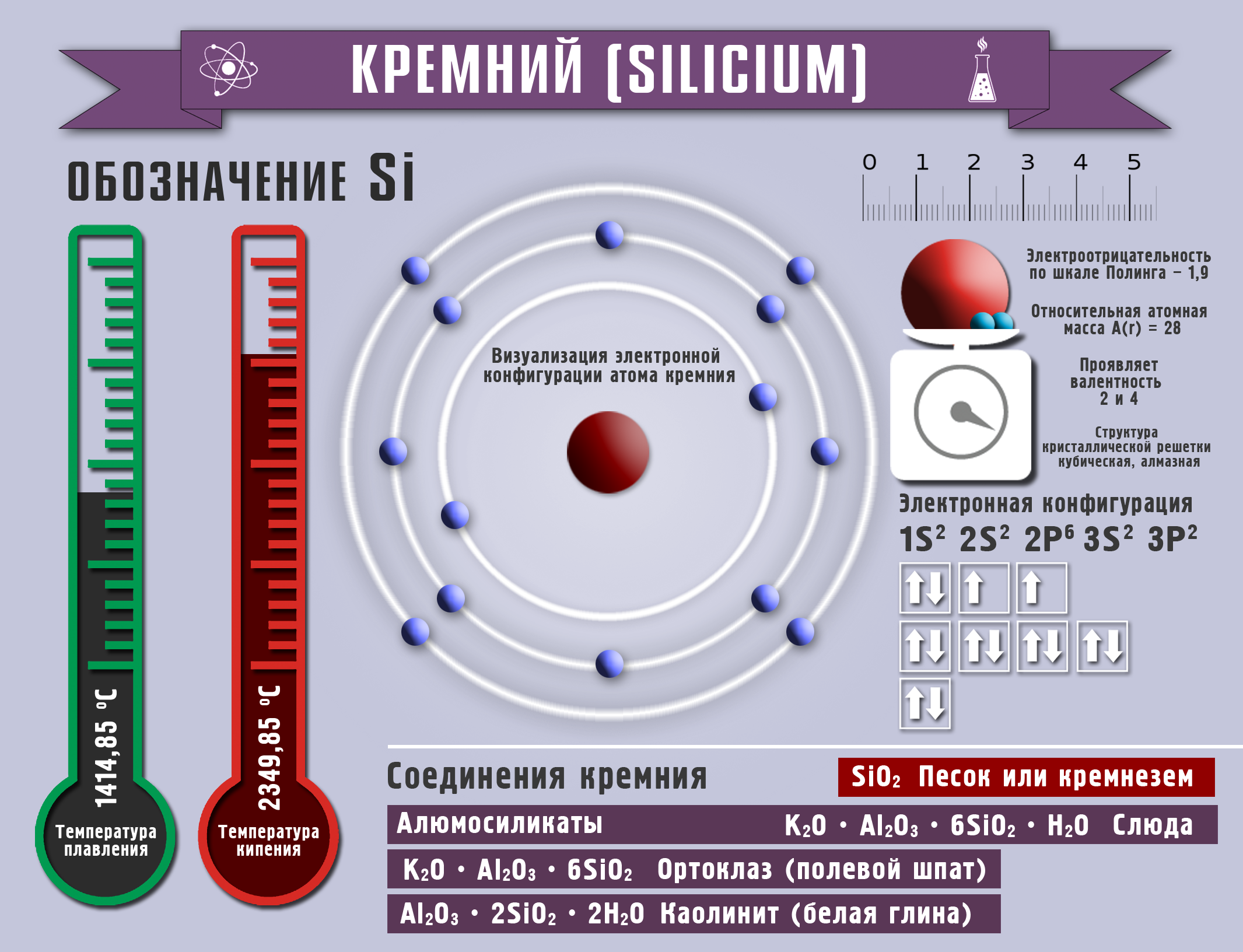
Кремний и его соединения

Получают кремний при нагревании чистого песка с коксом SiO2 + 2C ![]() Si +2CO, а в лаборатории восстановлением кремния из оксида активными металлами:
SiO2 + 2Mg
Si +2CO, а в лаборатории восстановлением кремния из оксида активными металлами:
SiO2 + 2Mg ![]() Si + 2MgO, 3SiO2 + 4Al
Si + 2MgO, 3SiO2 + 4Al ![]() 3Si +2Al2O3
3Si +2Al2O3
Полученный аморфный кремний очень реакционноспособен, проводит электрический ток. Это элемент IVА группы, проявляет валентности 2,4, а степени окисления от -4 до +2, +4.
При обычной температуре кремний реагирует только с фтором, при нагревании – с хлором, бромом; при очень высоких температурах – с азотом и углеродом с образованием карбида кремния или карборунда (SiC). В кислороде кремний сгорает. Кислоты на кремний не действуют. Кремний реагирует с водными растворами щелочей.
SiO2 – кислотный оксид, нерастворимый в воде. Оксид кремния реагирует только с плавиковой кислотой
SiO2 + 4HF ![]() SiF4 + 2H2O. Эта реакция используется для травления стекла (смотри метки на хим. посуде).
SiF4 + 2H2O. Эта реакция используется для травления стекла (смотри метки на хим. посуде).
Оксиду кремния соответствует кремневая очень слабая кислота (H2SiO3). В воде она практически нерастворима, а в смеси с NaCI известна как конторский или силикатный клей, который при длительном хранении выпадает в осадок. Соли кремниевой кислоты силикаты натрия и калия (Na2SiO3, K2SiO3) называются жидкими стеклами, они растворимы в воде, используются для пропитки древесины и тканей для придания им негорючести. Силикаты являются основой строительных материалов. Из них получают стекло и цемент, а так же керамику, фарфор и фаянс.
Азот

N2 – азот - газ без цвета, вкуса и запаха. tкип -196oС, tпл. -210oС. Входит в состав воздуха в количестве 78,1%. Инертен. Сгущается в жидкость при –140oС. Получают азот конденсацией из воздуха, в лаборатории разложением нитрита аммония: NH4NO2 ![]() N2 + 2H2O
N2 + 2H2O
При обычных условиях азот реагирует только с литием , а при повышенной температуре реагирует с другими металлами (Mg,Ca). Может быть как окислителем (NH3), так и восстановителем (NO). С водородом образует аммиак NH3 - газ с характерным раздражающим запахом.
С водой аммиак образует NH4OH - гидроксид аммония – очень слабое основание, но растворимое в воде.
По принципу донорно-акцепторной связи аммиак образует соли аммония, чаще всего используемые как удобрения: NH4H2PO4, (NH4)2HPO4. При действии щелочи на любую соль аммония выделяется характерный запах аммиака.
Азот образует газообразные оксиды; N2O - «веселящий газ», вдыхание которого вызывает наркотическое состояние и используется при проведении хирургических операций , NO, NO2 - называемый «лисий хвост» по цвету газа.
Азот образует азотную кислоту (HNO3).
Азотная кислота
Среди всех кислот – это самый сильный окислитель, бесцветная жидкость с резким запахом, легко испаряется, кипит при 86oС. При хранении приобретет желтый цвет, разлагаясь с образованием NO2 и O2. Пожароопасна. Тлеющая лучина возгорается над поверхностью азотной кислоты.
В промышленности азотную кислоту получают окислением аммиака кислородом в присутствии катализатора с последующей гидратацией в присутствии кислорода. В лаборатории азотную кислоту можно получить из её солей действием концентрированной серной кислоты.
Соли азотной кислоты при нагревании разлагаются с выделением оксидов азота и кислорода, поэтому при их хранении следует соблюдать все правила противопожарной безопасности.
Азотная кислота весьма специфично реагирует с металлами и неметаллами, выделяя разнообразные продукты реакций.
Взаимодействие азотной кислоты с неметаллами:
- 4HNO3(конц.) + C
 CO2 +4NO2 +2H2O
CO2 +4NO2 +2H2O
- (с углеродом взаимодействует только концентрированная кислота и реакция идет с выделением NO2, т. к. у углерода очень крепкая кристаллическая решетка)
- P + 5HNO3(конц)
 HPO3 + 5NO2 + 2H2O
HPO3 + 5NO2 + 2H2O - 3P +5HNO3(разб)
 3H3PO4 +5NO+ 2H2O
3H3PO4 +5NO+ 2H2O - S +6HNO3 (конц)
 H2SO4 +6NO2 +2H2O
H2SO4 +6NO2 +2H2O - S +2HNO3(разб)
 H2SO4 +2NO
H2SO4 +2NO - B + 3HNO3(конц)
 H3BO3 +3NO2
H3BO3 +3NO2
- (Бор реагирует только с концентрированной азотной кислотой)
Взаимодействие азотной кислоты c металлами:
Реакции азотной кислоты с металлами всегда окислительно-восстановительные, с изменением степени окисления как металлов, так и азота в составе азотной кислоты и его оксидов.
- При реакции азотной кислоты с металлами никогда не выделяется водород (Н2).
- Как газообразные продукты, выделяются оксиды азота с различными степенями окисления или аммиак.
- Степень окисления газообразных продуктов реакции зависит от концентрации кислоты.
- Степень окисления газообразных продуктов реакции зависит от плотности металла (тяжелые металла с плотность выше 5 г/см3 или легкие с плотностью ниже 5 г/ см3).
Закономерности взаимодействия азотной кислоты с металлами:
- Металлы, образующие оксиды со степенью окисления равной +3 концентрированной азотной кислотой (HNO3) пассивируются, т. к. покрываются очень тонкой пленкой своего оксида, который предохраняет металл от действия кислоты: (Fe, Cr, Al, Au, Pt, Ir, Tl.)
3Al + 12HNO3 ![]() Al(NO3)3 +Al2O3 +9NO2 +6H2O (толщина пленки Al2O3=10–5 метра).
Al(NO3)3 +Al2O3 +9NO2 +6H2O (толщина пленки Al2O3=10–5 метра).
- Концентрированная HNO3 не действует на платиновые металлы (Pt, Au, Ir, Tl).
- Тяжелые металлы с концентрированной HNO3 выделяют NO2
Cu + 4HNO3(конц) ![]() Cu(NO3)2 +2NO2↑ + H2O
Cu(NO3)2 +2NO2↑ + H2O
- Тяжелые металлы с разбавленной HNO3 выделяют NO
3Cu +8HNO3(разб) ![]() 3Cu(NO3)2 +2NO↑ +4H2O
3Cu(NO3)2 +2NO↑ +4H2O
- Легкие металлы с концентрированной HNO3 выделяют N2O, а иногда N2 - (в зависимости от концентрации азотной кислоты)
4Mg +10HNO3(конц) ![]() 4Mg(NO3)2 +N2O +5H2O
4Mg(NO3)2 +N2O +5H2O
5Mg +12HNO3(разб) ![]() 5Mg(NO3)2 +N2 +6H2O (для Mg, Zn).
5Mg(NO3)2 +N2 +6H2O (для Mg, Zn).
- Легкие металлы с разбавленной HNO3 реагирует с выделением NH3, однако аммиак тут же взаимодействует с азотной кислотой с образованием нитрата аммония:
NH3 + HNO3 ![]() NH4NO3
NH4NO3
4Mg +10HNO3(очень разб) ![]() 4Mg(NO3)2 + NH4NO3 + 3H2O
4Mg(NO3)2 + NH4NO3 + 3H2O
4Zn +10HNO3(очень разб) ![]() 4Zn(NO3)2 +NH4NO3 + 3H2O
4Zn(NO3)2 +NH4NO3 + 3H2O
- Легкий трехвалентный металл Al реагирует с сильно разбавленной HNO3, но с выделением NO
Al +4HNO3(разб) ![]() Al(NO3)3 +NO +2H2O
Al(NO3)3 +NO +2H2O
- Скандий ведет себя как типичный легкий металл, проявляя степень окисления равную +3.
8Sc +30HNO3(очень разб) ![]() 8Sс(NO3)3 +3NH4NO3 +9H2O
8Sс(NO3)3 +3NH4NO3 +9H2O
- Очень (ну, очень) разбавленные растворы HNO3 c Ca, Mg могут вытеснять водород (рассматривается как исключение).
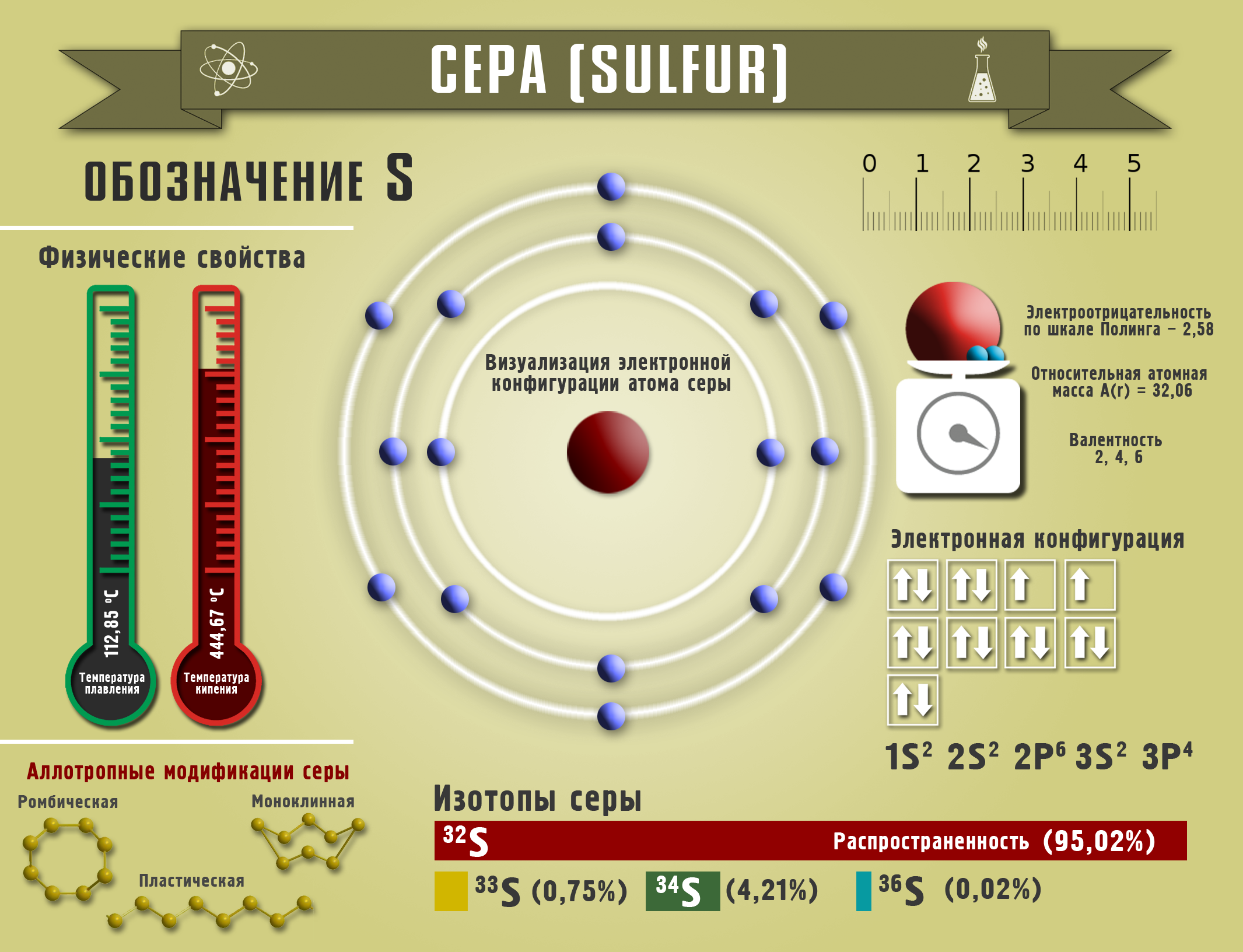
Сера

Добывают серу, закачивая по трубам перегретый пар воды в пласты месторождений. И уже в расплавленном виде сера поднимается по другой трубе, охлаждаясь, превращается в ромбическую серу. Любой минерал, содержащий серу, может стать источником ее получения. Сера входит в состав шерсти животных, перьев птиц, растительных и животных остатков, каменного угля.
В природе сера встречается в составе – пирита Fe2S (железный колчедан), медного блеска СuS, - серебряного блеска Ag2S, свинцового блеска PbS, а также в виде сульфатов CaSO4•2H2O - природный гипс, Na2SO4•10H2O - мирабилит, глауберова соль, MgSO4•7H2O - горькая (английская) соль, FeSO4•7H2O - железный купорос. Сера реагирует с металлами (Al, Fe) и неметаллами (C, P, H2) На воздухе и в чистом кислороде сера горит голубоватым пламенем S + O2 ![]() SO2.
SO2.
Из сложных веществ сера реагирует с серной, азотной кислотами и щелочами.
Сера образует – сероводород (Н2S) – газ с запахом тухлых яиц. Этот устойчивый гидрид серы ядовит, плохо растворим в воде (2,5 объема на 1 литр воды), водный раствор H2S является кислотой.
- Сера образует два оксида - SO2 - оксид серы (IV) - диоксид серы, сернистый газ - бесцветный газ с резким запахом, тяжелее воздуха в 2 раза, хорошо растворимый в воде (40V), при этом образуется слабая сернистая кислота (H2SO3).
- Второй оксид (SO3) – оксид серы (VI) - бесцветная легкокипящая жидкость при .+17oC превращающаяся в белые, очень гигроскопичные кристаллы, хорошо растворимые в воде и образующие сильную серную кислоту (H2SO4). SO3 способен растворяться в серной кислоте, образуя олеум H2SO4 + nSO3
 H2SO4 • nSO3 (олеум). Концентрированная серная кислота окисляет углерод до углекислого газа и обугливает органические вещества.
H2SO4 • nSO3 (олеум). Концентрированная серная кислота окисляет углерод до углекислого газа и обугливает органические вещества.
Серная кислота применяется как осушитель газов в промышленности и в лаборатории, в производстве других кислот, для получения удобрений и красителей. Большинство солей серной кислоты - сульфаты являются кристаллогидратами: CuSO4•5H2O – медный купорос, FeSO4• 7H2SO4 – железный купорос.
Серная кислота
Взаимодействие серной кислоты с неметаллами:
- С + 2H2SO4
 CO2↑ + 2SO2↑ + 2H2O
CO2↑ + 2SO2↑ + 2H2O
S + 2H2SO4 3SO2↑ + 2H2O
3SO2↑ + 2H2O
Пример реакции показан на видео
Взаимодействие серной кислоты с металлами:
- Концентрированная серная кислота пассивирует Fe, Cr и Al, поэтому ее перевозят в железных или алюминиевых цистернах.
- Малоактивные металлы (начиная с меди (Cu)) реагируют только с концентрированной серной кислотой и при нагревании, при этом в качестве газообразного продукта выделяется оксид серы (IV).
Cu + 2H2SO4(конц.) ![]() CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
- Взависимости от концентрации H2SO4 при взаимодействии с активными металлами выделяются разные продукты реакции:
- Zn + 2H2SO4(конц.)
 ZnSO4 + SO2↑ + 2H2O
ZnSO4 + SO2↑ + 2H2O - 3Zn + 4H2SO4(50%)
 3ZnSO4 + S↓ + 4H2O
3ZnSO4 + S↓ + 4H2O - 4Zn + 5H2SO4(20%)
 4ZnSO4 + H2S↑ + 4H2O
4ZnSO4 + H2S↑ + 4H2O - Zn + H2SO4(5-8%)
 ZnSO4 + H2↑ (для металлов, стоящих до водорода)
ZnSO4 + H2↑ (для металлов, стоящих до водорода)
Галогены
F, Cl, Br, I, At – галогены, (солероды), элементы VII A группы.
Фтор (F) – самый сильный окислитель, проявляет валентность 1 и степень окисления -1.
Все остальные галогены (солероды) являются как окислителями, так и восстановителями.
Хлор (Cl) – представитель элементов VII A группы – Галогенов – сильный окислитель, электроотрицательность которого равна 3,0 и имеющий 7 электронов на внешней электронной оболочке. Поэтому валентности хлора 1,3,5,7. Хлор выделен Шееле (Швеция) в1774 году. Одиннадцатый элемент по распространенности. Входит в состав морской воды, в состав растений, в хлорофилл, находится в тканях животных – в составе плазмы крови, желудочного сока. В земной коре его 0,05%.
Желто – зеленый газ хлор (Cl2) реакционноспособен и ядовит, в 2,5 раза тяжелее воздуха, образует хлороводород, при растворении в воде которого получается соляная кислота (HCl). В природе хлор встречается только в виде солей в каменной соли, галите - (NaCl, сильвините – (KCl • NaCl), карнаилите - (KCl • MgCl • H2O), каините – (KCl • MgSO4 • H2O). Хлор реагирует с серой, фосфором, натрием.
Кислотные соединения хлора
Хлороводородная (соляная) кислота проявляет свойства типичной кислоты и реагирует с металлами, основными оксидами, солями. Применяют хлор для обеззараживания питьевой воды, отбеливания тканей, бумаги, соломки, получения хлорной извести CaCl(OСl)
- Фтор вытесняет хлор, бром, йод из их солей и кислот; хлор вытесняет бром, йод, а бром только йод. (пример: Cl2 +2KI
 2KCl +I2 ↓), так как более сильные по электроотрицательности элементы вытесняют менее сильные из кислот и солей.
2KCl +I2 ↓), так как более сильные по электроотрицательности элементы вытесняют менее сильные из кислот и солей. - Фтор самый сильный окислитель, реагирует с соединениями кремния.
- Астат - радиоактивный, нестабильный изотоп, изучен мало.
- Все галогеноводороды газообразны, легко растворимы в воде.
- Водные растворы галогеноводородов являются кислотами.
- Вдыхание даже небольших доз хлора вызывает раздражение дыхательных путей, першение и кашель.
- В 1 объеме воды растворятся 2,5 объема хлора с образованием хлорной воды (7,9 г/л). Cl2 + H2O
 HCl + HClO
HCl + HClO - Сжиженный газ хлор хранят в стальных баллонах при давлении 600 кПа. В лаборатории хлор получают по реакции: 2KMnO4 +16HCl
 2MnCl2 + 2KCl + 8H2O + 5Cl2 ↑
2MnCl2 + 2KCl + 8H2O + 5Cl2 ↑ - В промышленности хлор получают электролизом водного концентрата раствора поваренной соли NaCl: 2NaCl
 2Na + Cl2 ↑
2Na + Cl2 ↑ - В организме человека содержится до 200 граммов хлорида натрия.
- Соляная кислота применяется для получения солей, травления металлов, в пищевой промышленности, медицине, химическом анализе.
- Хлор - сырье для химического синтеза органических соединений
Хлоросодержащие кислоты:
HCl – хлороводородная, соляная, кислотный остаток - (-Cl – хлорид)
HСlO – хлорноватистая, кислотный остаток (-ClO – гипохлорит)
HСlO2 – хлористая, кислотный остаток (-ClO2 – хлорит)
HСlO3 – хлорноватая, кислотный остаток (-ClO3 – хлорат)
HСlO4 – хлорная, кислотный остаток (-ClO4 – перхлорат)
Йод (I2) – черно-фиолетовые кристаллы. При нагревании испаряются, минуя жидкое состояние. Это свойство называется возгонка или сублимация.
Фосфор

Фосфор как простое вещество образует три аллотропные модификации: белый, красный, черный фосфор – все это твердые, кристаллические или аморфные вещества. Красный фосфор проявляет чисто неметаллические свойства. Черный фосфор похож на графит, жирен на ощупь, является полупроводником, проявляет металлические свойства. Белый фосфор – активный неметалл, реагирует с фтором, хлором, серой, кислородом.
При нагревании фосфор реагирует с активными металлами – натрием, кальцием. Белый фосфор используется для получения красного фосфора. Красный фосфор используется в производстве спичек. Фосфор расходуется на производство фосфорной кислоты, из которой получают удобрения.
Свободный фосфор получают из фосфата кальция Ca3(PO4)2. Фосфор образует фосфин (PH3) – газ без цвета, с запахом гниющей рыбы, очень ядовит и два оксида: Р2О3 – оксид фосфора(III) – белое кристаллическое вещество, сильно ядовитое, ему соответствует Н3РО3 – фосфористая кислота и Р2О5 – оксид фосфора (V) – белые гигроскопичные (жадно поглощающие пары воды) кристаллы. Этому оксиду соответствуют две кислоты - метафосфорная кислота (НРО3) и ортофосфорная кислота или Фосфорная кислота (Н3РО4), – это – бесцветное кристаллическое вещество, плавящееся при +42оС., не ядовита, хорошо растворима в воде, В промышленности фосфорную кислоту получают экстракционным методом, обрабатывая фосфориты и апатиты концентрированной серной кислотой.
Ca3(PO4)2 + 3H2SO4 ![]() 3CaSO4 ↓ + 2H3PO4.
3CaSO4 ↓ + 2H3PO4.
Соли фосфорной кислоты используются как удобрения.
Полезные ссылки
Глоссарий
- Ассимилировать – усваивать.
- Возгонка или сублимация - испарение из твердого состояния до газообразного, минуя жидкое состояние. Свойство характерно для иода - (I2).
- Вулканизация – процесс превращения каучука в резину под действием серы.
- Гидратация – присоединение воды.
- Донорно-акцепторная связь – это такая связь, при которой один атом (донор) предоставляет неподеленную пару электронов, которая становится общей между этим и другим атомом (акцептором).
- Идентификация – отождествление, установление совпадения.
- Изотоп – атомы одного и того же химического элемента, ядра которых содержат одинаковое число протонов, но разное число нейтронов.
- Инертный – бездеятельный.
- Инсектицид – средства борьбы с вредными насекомыми.
- Парамагнетизм – свойство вещества намагничиваться в направлении, совпадающим с направлением поля.
- Сфера – форма шара.
- Эксикатор – сосуд, в котором поддерживается определённая влажность воздуха (обычно близкая к нулю), изготовленный из толстого стекла или пластика.
- Электроотрицательность – свойство атомов оттягивать на себя электроны от атомов других элементов в соединениях.
- Эндотермический – теплопоглощающий.
Библиография
- А.А. Журин «Химические формулы». Москва «Аквариум» 1997г.
- А.А. Карцова, А.А.Макаров, А.В.Трухин. Справочник школьника. Химия. Биология.Экология. Санкт-Петербург. «Сова». Москва.»ЭКСМО-ПРЕСС». 2002.
- А.В. Мешельский. Химия в экзаменационных вопросах и ответах. Справочник для учителей , репетиторов и абитуриентов. Изд. 2. Минск, «Белорусская энциклопедия». 1999.
- А.Г. Кульман. «Общая химия». Изд. 3. Москва «Колос». 1979.
- А.Годмен «Иллюстрированный химический словарь» Москва «Мир» 1988.
- А.И. Бусеев, И.П. Ефимов. Словарь химических терминов. Москва «Просвещение» 1971.
- А.П. Крешков «Основы аналитической химии». Москва «Химия» 1976.
- Большой справочник для школьников и поступающих в Вузы. «Химия». /Л.Л.Андреева, Д.Ю. Добротин, О.С. Габриелян и др./ «Дрофа», Москва, 2004
- В.А. Волков, Е.В. Вонский, Г.И. Кузнецова. «Химики» Биографический справочник. Киев «наукова Думка» 1984.
- В.А. Рабинович. З.Я.Хавин. «Краткий химический справочник» изд. 3 Ленинград. «Химия». 1991г.
- В.В Писаренко. Справочник химика – лаборанта. Изд. 2 Москва. «Высшая школа» 1974.
- В. Рич. «В поисках элементов». Москва «Химия» 1985г.
- В. Рич «Охота за элементами». Москва «Химия» 1982г.
- Г.Е. Рудзитис. Ф.Г. Фельдман «Химия 8». Учебник для 8 класса средней школы. Изд.2 Москва «Просвещение». 1991.
- Г.П. Хомченко «Химия для поступающих в ВУЗы». Изд. 2. Москва «Высшая школа» 1994г.
- Д. Верзейм. К. Ослейд. Д. Ватерхаус «Химия». Школьный иллюстрированный справочник. (перевод с латинского) РОСМЭН. First published. Лондон 1986г.
- Д.И. Менделеев «Основы химии» Изд. 13. 1947г., 2 тома Москва - Ленинград. (Санкт – Петербург, 1872)
- Д.М. Кирюшкин. В.С. Полосин «Методика обучения химии». Москва «Просвещение» 1970г.
- Дж.А. Кемпбел «Современная общая химия» в 3 т. (перевод с английского). Москва «Мир» 1975г.
- З. Энгельс, А. Новок «По следам элементов» (пер с нем.) Москва «Металлургия» 1983г.
- И.В. Кузьменко, В.В. Ерёмин, В.А. Попков «Начала химии. Современный курс для поступающих в ВУЗы» 2 т. Москва 1-я книготорговая компания. 1979г.
- И.В. Кузьменко. В.В. Ерёмин. В.А. Попков. «Химия для школьников старших классов и поступающих в ВУЗы» Москва «Дрофа» 1985 г.
- И.В. Шиманович. М.Л. Павлович. В.Ф. Тикавый. П.М. Малашко. (ред. В.Ф. Тикавого). Общая химия в формулах, определениях, схемах. Минск «Унiверсiтэцкае» 1996г.
- И.Т. Гороновский. Ю.П. Назаренко. Е.Ф. Некряч «Краткий справочник по химии». Изд. 4. Киев «Наукова Думка» 1974.
- К.Я. Парменов «Химический эксперимент в средней школе». Изд. Академии педагогических наук РСФСР. Москва 1959г.
- Книга для чтения по химии. Часть I (сост. К.Я. Парменов, Л.М. Сморгонский). Изд. 3. Государственное учебно-педагогическое издательство министерства просвещения РСФСР. Москва 1961г.
- Л.М. Монастырский «Физика за 2 года». Ростов-на-Дону «Феникс» 1995г.
- Л.Полинг «Химия» (перевод с английского). Москва «Мир» 1968г.
- М. Колтун «Мир химии» Москва «Детская литература». 1988.
- М. Колтун «Превращения черного дракона» Москва. «Детская литература» 1990.
- М. Льис Химия. Школьный курс в 100 таблицах. Москва. Аст-Пресс 1997.
- М.М. Петров, М.А. Михелев, Ю.Н. Кукушкин. «Неорганическая химия». Изд 2 Ленинград «Химия» 1976 г.
- М. Фримантл «Химия в действии» в 2х частях. (пер. с английского) Москва «Мир» 1991.
- М.И. Гельфман, В.П. Юстратов «Химия». Санкт – Петербург. Издательство «Лань» 2000 г.
- Н.И. Кошкин. М.Г. Ширкевич. «Справочник по элементарной физике» Москва «Наука» 1966.
- Н.С. Ахметов «Неорганическая химия», в 2-х частях, изд. III, Москва «просвещение». 1992г.
- Общая и педагогическая химия. Методические указания. Москва. «Высшая школа» 1990г.
- П.И Воскресенский «Техника лабораторных работ». Изд. 10е. Москва «Химия» 1973г.
- П.Р. Таубе «От водорода, до …?» Москва «Высшая школа» 1964 г.
- Популярная библиотека химических элементов (сост. В.В. Станцо, М.В. Черченко) Москва «Наука» 1983.
- Р.А. Лидин «Справочник по общей и неорганической химии». Москва «Просвещение» 1997г.
- Р.П. Суровцева. Л.С. Гузей Н.И. Останний, А.О. Тамур. «Тесты. Химия». 8-9 класс. Москва. Издательский дом «Дрофа» 1997.
- С.Б. Шустов. Л.В. Шустова. Химические основы экологии». Москва «Просвещение» 1995.
- Н.А.Варкентина, Р.Х.Дженлода «Химические элементы в школьном курсе химии». Бишкек, «Азия Технографика», 2010 г.
- Урок окончен – занятие продолжаются. (ред. Э.Г. Злотникова) Москва «Просвещение» 1992 г.
- Учебный справочник школьника «Дрофа». Москва. 2002. 4-е издание. Ред.Н.Е. Рудомазина и др.
- Ф.Г. Фельдман, Г.Е. Рудзитис «Химия 9» учебник для 9 класса средней школы. Москва «Просвещение».
- Физика и химия. «Универсальная энциклопедия школьника». Минск. «Валев». 1995г.(сост. А.А.Воротников).
- Химическая энциклопедия том 1-2. (ред. И.Л. Кнунянц) Москва. Издательство «Советская энциклопедия». 1988.
- Химия в формулах. Справочное пособие. 8-11 класс. Состав В.В. Ерёмин. Москва. Издательский дом «Дрофа».
- Химия. (пер. с немецкого В.А. Молочко. С.В. Крынкиной). Москва «Химия» 1989.
- Химия. Пособие – репетитор. (ред. А.Ф. Егоров) изд. 2 Ростов-на-Дону «Феникс» 2000г.
- Химия. Справочник школьника (научная разработка и составление М. Кременчугской и С. Васильева) Филологическое общество «Слово» Компания «Ключ-С». ТКОАСТ. Центр гуманитарных наук при факультете журналистики МГУ им. Ломоносова. Москва 1997.
- Химия. Справочное руководство (пер. с немецкого) оед. Ф.Г. Гаврюченкова, М.И. Курочкиной, А.А. Потехина. В.А Рабиновича). Ленинград «Химия»
- Химия: справочные материалы ( под ред. Ю.Д. Третьякова I-III изд. Москва «Просвещение» 1984, 1988, 19993 г.
- Э. Гроссе. Х. Вайсмантель «Химия для любознательных». Изд.2 Ленинград «Химия».1985г.
- Энциклопедический словарь юного химика. (ред. М.А. Прокофьев) Москва «Педагогика» 1990 г.
- Энциклопедия для детей «Аванта». Москва. 2000г. Гл. ред. В.А. Володин
- Ю.Ю. Лурье. «Справочник по аналитической химии». Изд. 4. Москва «Химия» 1971.
- Я.А. Угай. «Общая и неорганическая химия». Изд. 2. Москва «Высшая школа» 2000г.
- Я познаю мир. Детская энциклопедия. Химия. (Авт.-сост.Л.А.Савина). Москва. АСТ. 1995г.
- В.А. Волков, Е.В.Вонский, Г.И. Кузнецова «Химики». Изд. «Наукова думка». Киев. 1984 г.
о водороде
Водород, являющийся s-элементом, в различных вариантах периодической системы помещают то вместе с щелочными металлами, то с галогенами, а иногда даже рассматривают отдельно. Действительно, он сходен с щелочными металлами, так как образует положительный ион Н+ и играет роль восстановителя в реакциях. Сродство к электрону и электроотрицательность у водорода меньше, чем у галогенов. Тем не менее водород имеет гораздо больше сходства с галогенами, чем с щелочными металлами. В гидридах активных металлов (NaH. СаН2) содержится ион Н⁺, подобный ионам в галидах (NaCl, СаСI2). Молекулы водорода и галогенов двухатомны. Для водорода, как для фтора или хлора, характерны газообразное состояние и неметаллические свойства. Первые потенциалы ионизации водорода и галогенов довольно близки. Атомы водорода легко замещают атомами галогенов в органических соединениях .
Кроме того, водород имеет ряд индивидуальных особенностей, связанных с тем, что его валентный электрон находится непосредственно в сфере действия атомного ядра (без промежуточного электронного слоя). Например, протон не образует соединений с ионной связью. Особенностями строения атома водорода обусловлено также существование водородной связи.
- Водород – самый распространенный элемент во Вселенной.
- На Земле общее количество водорода- 1% от веса земной коры.
- Во Вселенной водород играет роль «космического топлива», дающего энергию звездам, в том числе нашему Солнцу.
- Водород не ядовит.
- В свободном виде водород выделяется с вулканическими газами.
- На 5000 атомов Протия приходится 1 атом Дейтерия.
- 1 атом Трития приходится на миллиард миллиардов Протия.
- Тяжелая вода, содержащая Дейтерий замерзает при температуре 3,8 градуса, а кипит при 101,4 градуса.
- Высокая температура горения водорода в кислороде используется для плавления кварца, тугоплавких металлов, разрезания стальных плит.
- При огромных давлениях был получен металлический водород.
о кислороде
- Благодаря реакции регенерации воздуха 2Na2O2 + 2CO2
 2Na2CO3 + O2 ↑, люди могут длительное время находиться в ограниченных пространствах, например на подводных лодках.
2Na2CO3 + O2 ↑, люди могут длительное время находиться в ограниченных пространствах, например на подводных лодках.
- В случаях снижения окислительных процессов в организме, озон в малых дозах приносит пользу, например лечение в барокамерах воздухом под давлением, обогащенным озоном.
- Озоновый слой задерживает ультрафиолетовое излучение, опасное для живых организмов, хотя общее его содержание соответствует слою газа толщиной всего 3 миллиметра.
- Если бы озон задерживал все ультрафиолетовое излучение, у организмов бы не вырабатывался витамин D и развитие было бы невозможным.
- Изобретателем резки металла кислородно-водородным пламенем явился взломщик несгораемых сейфов в 1890 году.
об углероде
- Атомы углерода могут неограниченно соединяться в цепи: линейные, разветвленные, циклические
- Алмазы полируются только собственным порошком.
- При t=3000 oС и давлении 1010Па графит превращается в алмаз.
- Карбин – аллотропная форма углерода, найден в кратерах вулканов, образованных при падении метеоритов.
- Все карбиды гидролизуются с образованием оснований и углеродосодержащих газов:
Al4C3 + 12H2O ![]() 4Al(OH)3 + 3CH4
4Al(OH)3 + 3CH4
- Полупромышленный способ получения ацетилена происходит по реакции:
CaC2 + 2H2O ![]() Ca(OH)2 + C2H2.
Ca(OH)2 + C2H2.
- Ацетилен используется для газовой сварки металлов, потому, что он дает наивысшую температуру при сгорании в кислороде среди химических реакций выше 3000oС.
- Способ получения карбида кальция обжигом известняка происходит в две стадии:
CaCO3 ![]() CaO + CO2
CaO + CO2
CaO + 3C ![]() CaC2 + CO
CaC2 + CO
- Активные металлы могут гореть в углекислом газе
2Mg + CO2 ![]() 2MgO + C
2MgO + C
- Природные силикаты альмандин (3FeO•Al2O3 • 3SiO2) и ортоклаз - основные минералы Тянь – Шанских гор.
- Природные силикаты в чистом виде являются драгоценными камнями: аквамарин, изумруд, топаз.
- Полудрагоценные камни: агат, аметист, яшма также содержат оксид кремния - SiO2.
- SiO2 в очень чистом виде известен как горный хрусталь или кварц.
- Песок красно-желтого цвета окрашен солями Fe(III), а зеленовато-серый солями Cr(III),(IV).
- Все способы получения кремния приводят к образованию аморфного кремния – бурого порошка с t(пл) =1420оС.
- Кристаллический кремний получают перекристаллизацией аморфного кремния.
- Кристаллический Si довольно инертен, т. к. его структура, аналогичная алмазу.
- При освещении, нагревании электропроводность кремния возрастает
- Кремний часто употребляется в технике как полупроводник.
- Оксидная пленка SiO2 растворяется только в плавиковой кислоте (HF).
- C галогеноводородами кремний в реакции не вступает, но в присутствии азотной
кислоты реагирует: 3Si +12HF + 4HNO3 ![]() 4NО + 3SiF4 + 8H2O
4NО + 3SiF4 + 8H2O
- Как восстановитель кремний используются для получения некоторых металлов из их оксидов 2MgO + Si
 2Mg + SiО2.
2Mg + SiО2. - С водородом образует ядовитый газ силан (SiH4), который самовоспламеняется на воздухе:
- Сплав кремния с железом называется ферросилиций.
- При содержании кремния в стали до 0,15% сплав становится кислотоустойчивым, из него делают химическое оборудование.
- Карборунд (SiС) имеет алмазоподобную кристаллическую решетку, поэтому по твердости близок к алмазу.
- Получают карборунд в электропечах из смеси песка и кокса SiO2 + 3C
 SiC + 2CO ↑
SiC + 2CO ↑ - В технике карборунд применяют для изготовления точильных камней, шлифовальных кругов, буров.
- SiO - аморфный порошок желтого цвета, получен искусственно, входит в состав краски для пола – желто-коричневого цвета.
- Кремниевая кислота (H2SiO3) при хранении переходит в поликремниевую кислоту в виде студенистого осадка.
- Получают H2SiO3 действием сильных кислот на жидкие стекла – соли кремневой кислоты и щелочных металлов.
- Все силикаты тугоплавки и нерастворимы в воде (кроме солей Na, K)
- Сырьем для производства стекла является сода - Na2CО3, известняк или мел - СaCO3 и песок SiO2.
- Формула обычного оконного стекла Na2O •CaO • 6SiO2
- В стекла особого назначения (огнеупорных, особой прочности) при варке добавляют оксиды бария, свинца, бора.
- Окрашенные стекла получают добавлением оксидов кобальта (синее стекло), оксида хрома (зеленое стекло).
- Добавлением оксида свинца (РbО) получают хрустальное стекло, обладающее повышенной преломляемостью световых лучей.
- Стекла красного цвета образуются при добавлении очень мелко измельченного (10-5 м) золота.
- Цемент – представляет собой смесь силикатов, из которых образуется смесь: CaO, SiO2, Al2O3, Fe2O3.
В промышленности цемент получают спеканием глины и известняка (СаСО3). Если порошок цемента смешать с водой, то получается масса, постепенно твердеющая на воздухе.
- При добавлении к цементу песка или щебня (дробленная галька) в качестве наполнителя получают бетон, который широко используется в строительстве.
- Прочность бетона возрастает, если в него вводится каркас из железных стержней.
- Из обожженной глины получают изделия из керамики («керамон» переводится с греческого языка как глина).
- Из каолинита или «белой глины» производят фарфоровые и фаянсовые изделия.
- В нормальных условиях азот бесцветный газ без запаха и вкуса.
- Азот составляет около 78% воздуха, которым мы дышим.
- Азот присутствует во всех живых организмах, включая человеческое тело и растения.
- Газообразный азот используется в пищевых хранилищах, чтобы сохранить свежесть продуктов. Он также используется при изготовлении электронных деталей для промышленных целей и имеет много других полезных применений.
- Азот часто используется в качестве альтернативы двуокиси углерода для хранения пива в бочках под давлением. Меньшие пузырьки, которые он образует, предпочтительны для некоторых типов пива.
- Титан, самая большая луна Сатурна, имеет атмосферу, почти полностью состоящую из азота (более 98%). Известно, что это единственная луна в нашей солнечной системе с плотной атмосферой.
- Азот находится в жидком состоянии при очень низкой температуре. Жидкий азот кипит при t(кип)-196 оC. Он легко транспортируется и имеет множество полезных свойств, в области криогеники (наука о том, как ведут себя материалы при очень низких температурах), в качестве компьютерного хладагента (жидкости, используемой для предотвращения перегрева), удаления бородавок и многого другого.
- Декомпрессионная болезнь (также известная как кессонная болезнь) это образование пузырьков азота, в кровотоке и других важных областях тела, когда люди слишком быстро снижают давление после глубоководного погружения. Аналогичные ситуации могут произойти с космонавтами и пилотами негерметичных самолетов.
- Закись азота (также известная как веселящий газ (N2O)) используется в больницах и стоматологических клиниках в качестве анестезирующего средства (устранение или уменьшение боли во время операций).
- Закись азота также используется в автоспорте для увеличения мощности двигателя и скорости автомобиля.
- Нитроглицерин – это жидкость, используемая для создания взрывчатых веществ, таких как динамит. Это соединение часто используется в промышленности, а так же в военных целях.
Сера имеет жуткий запах и обладает удушающим действием на человека. Жрецы использовали ее для проведения разных обрядов и священных курений, а военные добавляли в состав различных горючих смесей.
Функции серы в организме
Ни один процесс в организме не может обойтись без серы. Она является одним из главных составляющих всех существующих белков. Функции, которые возлагаются на работу серы в человеческом организме огромны. Начиная от стабильной работы нервных клеток, уравновешивания сахара в крови и общего повышения иммунитета, заканчивая ранозаживляющими и противовоспалительными действиями.
"Чудо"-сера входит в состав лекарств и используется в чистом виде для лечения.
Питание
Кому-то покажется странным, а кто-то об этом давным давно знает, однако сера содержится в массе продуктов, которые мы используем ежедневно, даже на подозревая об этом. К этому числу относятся: все бобовые, злаки и крупы, а также хлебобулочные изделия (!); лук, чеснок и капуста; яблоки, виноград и крыжовник; молочные продукты; рыба.
Неудивительно, что до сегодняшнего дня зафиксированных случаев с дефицитом серы, ничтожно мало. Ведь что-то из перечисленного мы в любом случае употребляем в рацион питания.
- Когда мы режем лук и "плачем", мы должны сказать "спасибо" именно сере, которая впитывается в почву, где он растет.
- В одной из провинций Индонезии существует вулкан, полностью заполненный серой, который носит название Кава Иджен. Сера оседает на трубах, после чего рабочие сбивают ее арматурой и несут на взвешивание. Таким образом они зарабатывают себе на жизнь.
- Гигиенические "продукты" на основе серы созданы специально для чистки проблемной кожи от угрей и сыпи.
- Ушная сера, которую нас приучили удалять еще с детства ватными тампонами, "отравляет" нашу жизнь с благородными намерениями. В ней содержатся особые ферменты лизозимы; именно они "не пускают" в наш организм все инородно - бактериальное.
В 1811 году французский химик-технолог и фармацевт Бернар Куртуа открыл йод. У него был любимый кот, который во время обеда сидел обычно на плече своего хозяина.
Куртуа часто обедал в лаборатории. В один из дней во время обеда кот, чего-то испугавшись, прыгнул на пол, но попал на бутылки, стоявшие около лабораторного стола. В одной бутылке Куртуа приготовил для опыта суспензию золы водорослей (содержащей йодид натрия) в этаноле, а в другой находилась концентрированная серная кислота.
Бутылки разбились и жидкости смешались. С пола стали подниматься клубы сине-фиолетового пара, которые оседали на окружающих предметах в виде мельчайших черно-фиолетовых кристалликов с металлическим блеском и едким запахом. Это и был новый химический элемент йод.
Однажды английский химик Гемфри Дэви, забыв, что сосуд уже заполнен угарным газом — веществом без цвета и запаха, — впустил в этот сосуд хлор, чтобы сохранить его для опытов, намеченных на следующий день. Закрытый сосуд остался стоять на лабораторном столе около окна. День был ясный и солнечный. На следующий день утром Дэви увидел, что хлор в сосуде потерял свою желтовато-зеленую окраску. Приоткрыв кран сосуда, ученый почувствовал своеобразный запах, напоминающий запах яблок, сена или разлагающейся листвы. Дэви исследовал содержимое сосуда и установил присутствие нового газообразного вещества, которому дал название «фосген», что в переводе с греческого означает «рожденный светом». Так в 1811 г. было открыто сильное отравляющее вещество удушающего действия, широко использовавшееся во время Первой мировой войны.
Открытие фтора было одной из труднейших задач. Первыми жертвами фтора были два члена Ирландской Академии наук братья: Томас Нокс скончался от отравления фтороводородом, а Георг стал инвалидом. Следующей жертвой стал бельгийский химик П. Лайет. Мученическую смерть при проведении опытов по выделению фтора принял французский химик Джером Никлес. Отравились, надышавшись небольшими количествами фтороводорода, а также получили серьезные ожоги французские химики Жозеф Гей-Люссак, Луи Тенар и английский химик Гемфри Дэви. При попытках выделить фтор при помощи электролиза его соединений нанесли ущерб своему здоровью французский химик Эдмон Фреми и английский электрохимик Георг Гор. Только в 1886 году французскому химику Анри Муассану сравнительно безболезненно удалось получить фтор. Муассан случайно обнаружил, что при электролизе смеси жидкого безводного HF и гидродифторида калия (KHF2) в платиновом сосуде на аноде выделяется светло-желтый газ со специфическим резким запахом. Однако, когда Муассан докладывал Парижской академии наук о своем открытии, один глаз ученого был закрыт черной повязкой. Нобелевская премия по химии была присуждена Муассану в 1906 г "в признание большого объема исследований - получения элемента фтора и введения в лабораторную и промышленную практику электрической печи, названной его именем".
- В воде фосфор нерастворим, поэтому его хранят в воде для защиты от окисления.
- На воздухе белый фосфор быстро окисляется и при этом светится в темноте, отсюда его название – (фос - свет, фор - несу).
- Белый фосфор сильно ядовит. Десятые доли грамма белого фосфора при попадании внутрь действуют смертельно.
- Белый фосфор легко воспламеняется, на коже оставляет долго незаживающие ожоги.
- Красный фосфор получают из белого фосфора при нагревании до 250оС под давлением без доступа воздуха.
- При нагревании красный фосфор не плавится, а сразу сублимирует (испаряется из твердого состояния, минуя жидкую фазу).
- При охлаждении красный фосфор переходит в белый фосфор.
- При нагревании белого и красного фосфора > 200 0С под высоким давлением образуется черный фосфор.
- Кристаллы оксида фосфора (V) - (Р2О5) применяются для осушения воздуха в эксикаторах.
- При осторожном прокаливании фосфорной кислоты образуется двуфосфорная (дифосфорная), пирофосфорная кислота
2Н3РО4 ![]() Н4Р2О7 +Н2О
Н4Р2О7 +Н2О
- Фосфорную кислоту используют для изготовления реактивов, органических веществ, для получения катализаторов, для создания защитных покрытий на металлах, в фармацевтической промышленности.