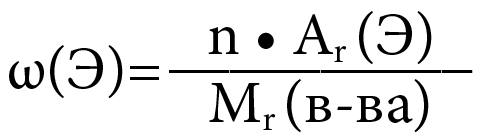Химия: Количественные соотношения
Закон Авогадро. Молярный объём газов
Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
(1811 г, итальянский учёный Амедео Авогадро) Лоренцо Романо Амедео Карло Авогадро ди Кваренья э ди Черрето
Cледствия закона Авогадро:
1 следствие:
Так, 6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём равный 22,4 л.
Такой объём называется молярным объёмом и обозначается Vm
Молярный объём – это постоянная величина для веществ – газов при нормальных условиях (н.у.): Vm = 22,4 л/моль нормальные условия – это p (давление) = 1 амт (101325 Па) t (температура) = 0 ˚C (273 К)
2 следствие:
Эта величина называется относительной плотностью D
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества: υ = V / Vm = N / Na = m / M M = ρVm
Относительная атомная и молекулярная массы
Атомы имеют очень маленький размер и очень маленькую массу. Если выражать массу атома какого-нибудь химического элемента в граммах, то это будет число перед которым находится более двадцати нулей после запятой. Поэтому измерять массу атомов в граммах неудобно.
Однако, если принять какую-либо очень малую массу за единицу, то все остальные малые массы можно выражать как отношение к этой единицы. В качестве единицы измерения массы атома была выбрана 1/12 часть массы атома углерода.
Относительной атомной массой является величина, равная отношению реальной массы атома конкретного химического элемента к 1/12 реальной массы атома углерода. Это безразмерная величина, так как делятся две массы.
Ar = mат. / (1/12)mугл.
Однако абсолютная атомная масса равна относительной по значению и имеет единицу измерения а.е.м.
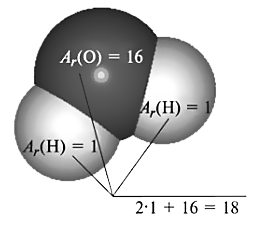
То есть относительная атомная масса показывает, во сколько раз масса конкретного атома больше 1/12 атома углерода. Если у атома Ar = 12, значит его масса в 12 раз больше 1/12 массы атома углерода, или, другими словами, в нем 12 атомных единиц массы. Такое может быть только у самого углерода (C). У атома водорода (H) Ar = 1. Это значит, что его масса равна массе 1/12 части от массы атома углерода. У кислорода (O) относительная атомная масса равна 16 а.е.м. Это значит, что атом кислорода в 16 раз массивнее 1/12 атома углерода, в нем 16 атомных единиц массы.
Самый легкий элемент — это водород. Его масса примерно равна 1 а.е.м. У самых тяжелых атомов масса приближается к 300 а.е.м.
Обычно для каждого химического элемента его значение абсолютной массы атомов, выраженных через а. е. м. округляют.
Значение атомных единиц массы записаны в таблице Менделеева.
Для молекул используется понятие относительной молекулярной массы (Mr). Относительная молекулярная масса показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Но поскольку масса молекулы равна сумме масс составляющих ее атомов, то относительную молекулярную массу можно найти, просто сложив относительные массы этих атомом. Например, в молекулу воды (H2O) входят два атома водорода с Ar = 1 и один атом кислорода с Ar = 16. Следовательно, Mr(Н2O) = 18.
Ряд веществ имеет немолекулярное строение, например металлы. В таком случае их относительную молекулярную массу считают равной их относительной атомной массе. В химии важным является величина, которая называется массовая доля химического элемента в молекуле или веществе. Она показывает, какая часть относительной молекулярной массы приходится на данный элемент. Например, в воде на водород приходится 2 доли (так как два атома), а на кислород 16. То есть, если смешать водород массой 1 кг и кислород массой 8 кг, то они прореагируют без остатка. Массовая доля водорода равна 2/18 = 1/9, а массовая доля кислорода 16/18 = 8/9.
Современные методы исследования позволяют определить чрезвычайно малые массы атомов с большой точностью. Так, например, масса атома углерода равна 1,993•10-26 кг. Это очень маленькая величина. Поэтому в химии используются не абсолютные значения атомных масс, а относительные. За единицу атомной массы принята атомная единица массы, равная 1/12 части массы атома углерода. Относительной атомной массой химического элемента называется величина, показывающая во сколько раз масса данного атома больше 1/12 массы атома углерода. Она обозначается буквой Аr.
Относительные атомные массы указаны в периодической таблице.
Стрелкой обозначена относительная атомная масса углерода
Например Аr(Н)=1, Аr(С)=12. Атомные массы округляем до целых величин, исключая атом хлора - Аr(Cl)=35,5.
Например Мr(H2SO4)=1•2+32+16•4=98.
Итак, чтобы узнать относительную молекулярную массу воды (Н2O) мы складываем относительные атомные массы с учётом индексов:
Относительная атомная масса водорода равна 1 (по таблице Менделеева) по формуле мы видим,что у нас есть 2 водорода (так как после водорода стоит индекс 2);
Относительная атомная масса кислорода равна 16 (по таблице Менделеева);
Рассчитаем относительную молекулярную массу:
Мr(Н2O)=1•2+16=16+2=18
(1•2) т.к у нас 2 водорода.
Количество вещества
- Моль – обозначается буквой ν (ню)
Массовые отношения(массовая доля элемента)
- Формула:
-
Где:
ω(Э) – массовая доля элемента Э в веществе
n – число атомов элемента Э в веществе (индекс)
Ar – относительная атомная масса элемента Э
Mr(в-ва) – относительная молекулярная масса вещества
Качественный состав молекулы показывает какие виды атомов входят в состав вещества.
Количественный состав показывает сколько атомов определённого вида входит в состав молекулы вещества.
Закон постоянства состава веществ
К основным законам химии относится закон постоянства состава:
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г.
Он писал: "От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь".
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
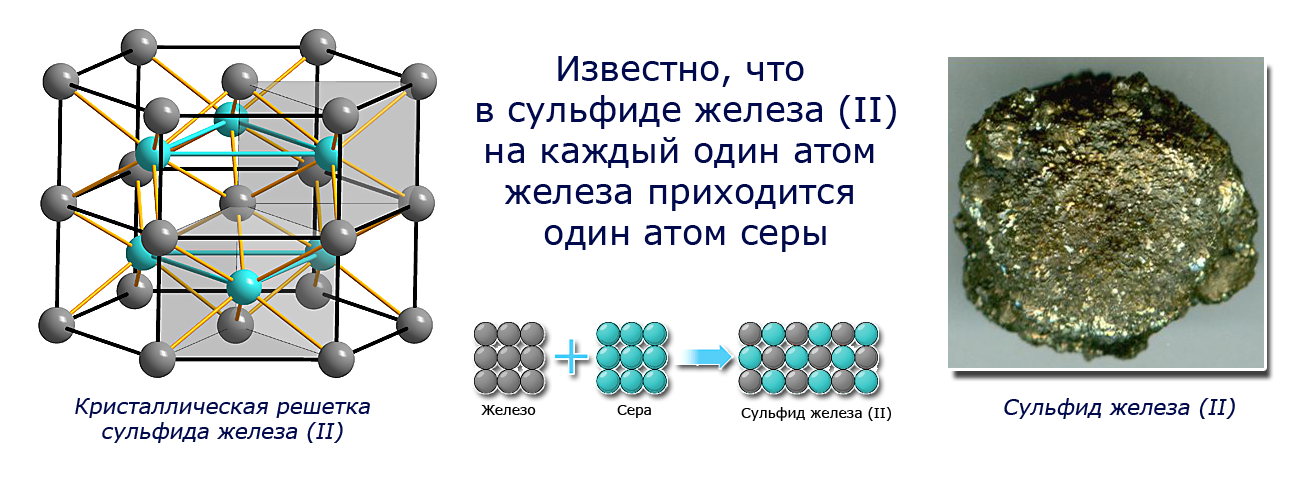
Чтобы получить сульфид железа(II), мы смешивали железо и серу в соотношении 7:4. Посмотрите видео-эксперимент. Если смешать их в другой пропорции, например 10:4, то химическая реакция произойдет, но 3 г железа в реакцию не вступит. Почему наблюдается такая закономерность? Известно, что в сульфиде железа(II) на каждый один атом железа приходится один атом серы. Следовательно, для реакции нужно брать вещества в таких массовых соотношениях, чтобы сохранялось соотношение атомов железа и серы (1:1). Поскольку численные значения атомных масс Fe, S и их относительных атомных масс Ar(Fe), Ar(S) совпадают, можно записать:Ar(Fe):Ar(S) = 56:32 = 7:4.
Отношение 7:4 сохраняется постоянно, в каких бы единицах массы ни выражать массу веществ (г, кг, т, а.е.м.). Большинство химических веществ обладает постоянным составом.
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые - бертоллидами(в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н2О, НCl, ССl4, СO2. Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
В каких массовых отношениях соединяются химические элементы в серной кислоте, химическая формула которой H2SO4?
Решение: Используя периодическую систему химических элементов найдём относительные атомные массы химических элементов: Ar(H)=1, Ar(S)=32, Ar(O)=16.
Определим массовые отношения этих элементов в формуле H2SO4 m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2 : 32 : 64 = 1 : 16 : 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г - Н, 16 г - S и 32 г - О.
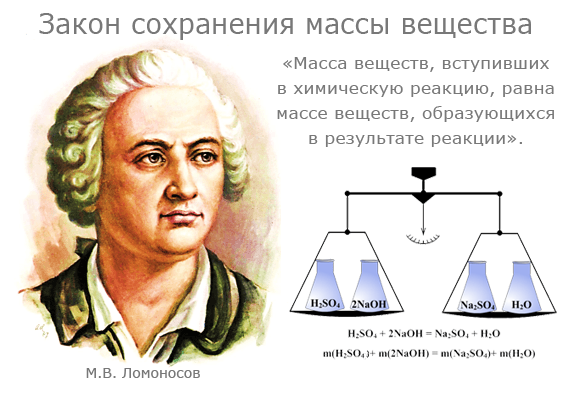
Закон сохранения массы веществ
Проблемный вопрос: изменится ли масса реагирующих веществ по сравнению с массой продуктов реакции?
Чтобы ответить на данный вопрос понаблюдайте за следующим экспериментом:
- Нагревание меди в закрытом сосуде
- Описание эксперимента:
В коническую колбу помесите 2 грамма измельченной меди. Плотно закройте колбу пробкой и взвесьте. Запомните массу колбы. Осторожно нагревайте колбу в течение 5 минут и наблюдайте за происходящими изменениями. Прекратите нагревание, и когда колба охладится, взвесьте её. Сравните массу колбы до нагревания с массой колбы после нагревания.
Вывод: Масса колбы после нагревания не изменилась.
Понаблюдаем за другими видео-экспериментами:
Вывод: Масса веществ до и после реакции не изменилась.
-
С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка.
Закон сохранения массы веществ является основным законом химии, все расчеты по химическим реакциям производятся на его основе. Именно с открытием этого закона связывают возникновение современной химии как точной науки.
Закон сохранения массы был теоретически открыт в 1748 году и экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым.
Французский учёный Антуан Лавуазье в 1789 году окончательно убедил учёный мир в универсальности этого закона. Как Ломоносов, так и Лавуазье пользовались в своих экспериментах очень точными весами. Они нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали исходные вещества и продукты реакции.
Химические уравнения
Закон сохранения массы веществ применяется при составлении уравнений химических реакций.
Химическим уравнением называют условную запись химической реакции посредством химических знаков и формул.
Посмотрим видео - эксперимент:
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Fe + S = FeS
Алгоритм составления уравнения химической реакции
Составим уравнение химической реакции взаимодействия фосфора и кислорода 1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку:
P + O2
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
P + O2P2O5
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
В данном случае это атомы кислорода.
Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов кислорода –10:
Находим коэффициенты путём деления наименьшего кратного на число атомов данного вида, полученные цифры ставим в уравнение реакции:
P + 5O22P2O5
Закон сохранения массы вещества не выполнен, так как число атомов фосфора в реагентах и продуктах реакции не равно, поступаем аналогично ситуации с кислородом:
Получаем окончательный вид уравнения химической реакции. Стрелку заменяем на знак равенства. Закон сохранения массы вещества выполнен:
4P + 5O22P2O5
Глоссарий
- Химическое вещество характеризуется атомной массой, а молекулы — молекулярной массой.
- Атомная единица массы (а.е.м.) - ровно 1/12 часть массы атома углерода–12, в ядре которого 6 протонов и 6 нейтронов, а в электронной оболочке 6 электронов. Другое название - углеродная единица. Единица, в которой измеряют массу атомов, молекул и субатомных частиц. См. также ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА и АТОМНЫЙ ВЕС.
- Относительная атомная масса - обозначается символом Ar ("r" - от английского "relative" - относительный) - отношение массы атома к массе 1/12 атома углерода–12 (см. а.е.м.). В современной научной литературе наряду с термином относительная атомная масса используюется термин АТОМНЫЙ ВЕС (как синонимы).
- Относительная молекулярная масса (Mr) — величина, показывающая, во сколько раз масса молекулы данного вещества больше 1 / 12 массы атома углерода–12. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов, составляющих химическое соединение, с учетом индексов.
- Моль вещества (n) — это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится их в 12 г изотопа углерода 12C.
- Число структурных единиц, содержащихся в 1 моле вещества равно 6,02 • 1023. Это число называется числом Авогадро (NA)
- Молярная масса (M) показывает массу 1 моля вещества и равна отношению массы вещества к соответствующему количеству вещества.
M = m / n
- В 1808 Ж. Пруст сформулировал Закон постоянства состава, который гласит, что независимо от способа получения все индивидуальные вещества имеют постоянный количественный и качественный состав.
- Важную роль в развитии химической науки сыграли газовые законы (справедливы только для газов).
В 1811 г. Авогадро ди Кваренья (Закон Авогадро) доказал, что - в равных объемах любых газов при постоянных условиях (температуре и давлении) содержится одинаковое число молекул. В одинаковых условиях одно и то же число молекул занимают равные объемы, а 1 моль любого газа при температуре 273 oК и давлении 101,3 кПа газа занимает объем 22,4 л, который называется молярным объемом газа (Vm).
В 1756 г. М.В. Ломоносов, после длительных испытаний, пришел к важному открытию: вес всех веществ, вступающих в химическую реакцию, равен весу всех продуктов реакции. - Закон сохранения вещества отражается в законе сохранения массы, который заключается в следующем: масса веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Вещества не исчезают и не возникают из ничего, а происходит химическое превращение. Закон является основой при составлении химических реакций и количественных расчетов в химии.
- Моль - количество вещества, равное 6,022 . 1023 структурных единиц данного вещества: молекул (если вещество состоит из молекул), атомов (если это атомарное вещество), ионов (если вещество является ионным соединением). Число 6,022 . 10 23 называется постоянной Авогадро или числом Авогадро.
- Молярная масса - масса одного моля вещества в граммах называется молярной массой вещества или грамм-молем (размерность г/моль). Численное выражение молярной массы (грамм-моля) в граммах совпадает с молекулярным весом (или атомным, если вещество состоит из атомов) в единицах а.е.м.
Нормальными условиями (н.у.) называют температуру 0 оС (273 K) и давление 1 атм (760 мм ртутного столба или 101 325 Па). Не путать со СТАНДАРТНЫМИ СЛОВИЯМИ! - Относительная атомная масса - обозначается символом Ar ("r" - от английского "relative" - относительный) - отношение массы атома к массе 1/12 атома углерода-12 (см. а.е.м.). В современной научной литературе наряду с термином "относительная атомная масса" используюется термин АТОМНЫЙ ВЕС (как синонимы).
- Постоянная Авогадро - 6,022 · 1023 (см. “моль”).
- Число Авогадро - 6,022 · 1023 (см. “моль”).
Полезные ссылки
Бибилиография:
НЕТУ
- Ахметов Н. С. Актуальные вопроса курса неорганической химии. — М.: Просвещение, 1991. — 224 с — ISBN 5-09-002630-0
Задача 1. Какой объем (н.у.) занимает 5·10-3 кг углекислого газа?
Найдем молекулярную массу СО2:
Mr(CO2)= 12+2·16=44 г.
Tакже нам известен молярный объем газа, который равен 22,4 м3.
Составим следующую пропорцию:
44 кг СО2 занимает объем 22,4 м3
5·10-3 кг СО2 занимает объем – х
откуда х=(5·10-3·22,4)/44=2,5·10-3 м3
Таким образом, 5·10-3 кг углекислого газа занимает объем равный 2,5·10-3 м3.
Задача 2. Определить массу 0,9·10-3 м3 кислорода при 21 °С и давлении 96000 Па, если масса 10-3 м3 кислорода равна 1,5·10-3 кг при нормальных условиях.
Найдем температуру в Кельвинах Т=273+21=294 К;
Найдем объем газа, приведенный к н.у. по формуле
P1V1 / T1 = P2V2 / T2;
V1= T1P2V2 / T2P1=
=(273·96000·0.9·10-3) / (294·101325)=0.8·10-3 м3
Теперь рассчитаем массу вычисленного объема:
10-3 м3 кислорода имеют массу равную 1,5·10-3 кг
0,8·10-3 м3 кислорода имеют массу равную х
х = 0,8·10-3·1,5·10-3/10-3=1,2·10-3 кг
Таким образом, 0,8·10-3 м3 кислорода имеют массу равную 1,2·10-3 кг.
Задача 3. Рассчитайте объем атома железа, если его плотность равна 7900 кг/м3
Найдем молярный объем железа (M(Fe)=56 г.)
V=n/ρ=56/7900=7,1·10-3 м3
Условно примем, что атомы имеют форму шара и в кристалле касаются друг друга, то истинный объем будет составлять только 74% от общего объема:
V=0,071·0,74=5,25·10-3 м3
Тогда объем одно атома железа будет равен:
VА=5,25·10-3/6,02·1026=8,7·10-30 м3
Задача 4. Определить массу молекулы газа, если масса 10-3 м3 газа, при н.у., равна 0,3810-3 кг.
Число молекул 1 кмоль любого вещества равна числу Авогадро (6,02·1026 ), поэтому для начала определим 1 кмоль газа:
10-3 м3 газа имеют массу равную 0,3810-3 кг
22,4 м3 газа имеют массу равную — х
х=22,4·0,3810-3/10-3=7,6 кг,
Далее определяем массу молекулы газа:
m=7,6/6,02·1026=1,26·10-26 кг.
Задача 5. Рассчитайте молярную массу эквивалента металла, если при соединении 7,2 г. металла с хлором было получено 28,2 г. соли. Молярная масса эквивалента хлора равна 35,45 г/моль
Согласно закону эквивалента отношение массы металла и соли должно быть равно отношению их молярных масс эквивалентов. Обозначим молярную массу эквивалента металла через х, тогда:
7,2/28,2=х/(х+35,45)
Решая уравнение, находим, что х=12,15 г/моль.
Таким образом, молярная масса эквивалента металла Мэкв=12,15 г/моль.
Задача 6. Определение молярной массы эквивалента сложных веществ в реакциях обмена
Определите молярные массы эквивалентов H2SO4 в следующих реакциях:
А) H2SO4+2KOH = K2SO4+2H2O
Б) H2SO4+KOH = KHSO4+H2O
Значение эквивалента вещества зависит от того, в какой именно реакции оно участвует.
В реакции А) 1 моль H2SO4 взаимодействует с 2 моль KOH, а эквивалент H2SO4 с 2 эквивалентами KOH. Молярная масса эквивалента KOH равна его молекулярной массе, следовательно, молярная масса эквивалента H2SO4 равна половине ее молекулярной массы:
Мэкв=98/2=49 г/моль
В реакции Б) 1 моль H2SO4 взаимодействует с 1 моль KOH, а эквивалент H2SO4 с 1 эквивалентами KOH. Молярная масса эквивалента KOH равна его молекулярной массе, следовательно, молярная масса эквивалента H2SO4 равна ее молекулярной массе: 98 г/моль.
Задача 7. Рассчитайте молярную массу эквивалента кислоты, если на нейтрализацию 9 г. ее израсходовано 8 г. гидроксида натрия.
Молярная масса эквивалента гидроксида натрия равна его молекулярной массе Мэкв =40 г/моль.
Вещества взаимодействуют между собой в массах, пропорциональных из молярным массам эквивалента, т.е.:
Обозначим молярную массу эквивалента кислоты – х, тогда
9/8=х/40=45 г/моль
Задача 8. Найдите молекулярную формулу вещества, если относительная плотность паров этого вещества по водороду равна 67,5, а массовые доли элементов (%) в веществе следующие: серы – 23,7, кислорода – 23,7, хлора – 52.
Формулу искомого соединения можно представить как SxOyClz. Найдем соотношение между числом атомов S, O, Cl делением его содержания на его атомную массу:
x:y:z = 23,7/32 : 23,7/16 : 52/35,5 = 0,74 : 1,48 : 1,46
Делим все полученные соотношения на наименьшее, получаем:
x:y:z =1:2:2
Простейшая формула вещества SO2Cl2
Его молекулярная масса равна Mr = 32+16·2+35,5·2 = 135 г.
Теперь найдем молекулярную массу вещества по плотности паров этого вещества по водороду:
Mr = 2DH2= 2·67,5 = 135 г.
Следовательно, истинная формула вещества совпадает с простейшей: SO2Cl2
Задача 9. Рассчитайте молекулярную массу газа, если 7·10-3 кг. его при 20°С и 0,253·105 Па занимают объем 22,18·10-3 м3
В данном случае, вычислить молярную массу газа можно, используя уравнение Клапейрона – Менделеева:
pV = nRT = (m/M)RT;
R=8,3144·103 Дж/моль·К
Т=273+20=293 К
М=mRT/pV=7·10-3·8,3144·103293/(0,253·105·22,18·10-3)=30,35 г/моль
Молярная масса газа равна 30,35 г/моль
Задача 10. При 0°С в сосуде объемом 14·10-3 м3 содержится 0,8·10-3 кг водорода и 6,3·10-3 кг азота. Определите парциальное давление азота и общее давление смеси.
Найдем количества вещества водорода и азота:
n=m/Mn(H2)=0,8·10-3/2=0,4·10-3моль
n(N2)= 6,3·10-3/28=0,225·10-3моль
Далее, с помощью уравнения Клапейрона – Менделеева, найдем парциальное давление каждого газа в смеси:
pV = nRT = (m/M)RT;
p = nRT/V;
p(H2)=n(H2)
RT/V=0,4·10-3·8,3144·103·273/14·10-3=64,85·103Па
p(N2)= n(N2)
RT/V=0,225·10-3*8,3144·103·273/14·10-3=36,479·103Па
pобщ=p(H2)+p(N2)= 64,85·103+36,479·103=101329 Па
Задача 11. Газовая смесь составлена из 5·10-3 м3 метана под давлением 96000 Па, 2·10-3 м3 водорода под давлением 84000 Па и 3·10-3 м3 диоксида углерода под давлением 109000 Па. Объем смеси 8·10-3 м3. Определите парциальные давления газов в смеси и общее давление смеси.
Сначала найдем парциальное давление каждого из газов:
p(CH4)=P(CH4)·V(CH4)/Vобщ=96000·5·10-3/8·10-3=60000 Па
p(H2)=P(H2)·V(H2)/Vобщ=84000·2·10-3/8·10-3=21000 Па
p(CО2)=P(CО2)·V(CО2)/Vобщ=109000·3·10-3/8·10-3=40875 Па
Общее давление:
pобщ= p(CH4)+ p(H2)+ p(CО2)= 60000+21000+40875=121875 Па
Задача 12.Газовая смесь состоит из оксида и диоксида азота. Вычислите парциальные давления газов в смеси, если объемные доли газов соответственно равны (%) 37,5 и 62,5. Общее давление газовой смеси 106640 Па.
Парциальное давление газа в смеси равно произведению общего давления на его объемную долю в смеси:
p(NO)= pобщ·φNO=106640·0,375=39990 Па
p(NO2)= pобщ·φNO2=106640·0,625=66650 Па
Дочитаем всю страницу…
Имена координат
Даст отгадка двух шарад.
I.
Три буквы плода треугольного,
Две буквы от стола, от школьного,
"П" между этими фрагментами…
Все вместе - столбик с элементами!
Группа
II.
Птичий мех, но не пух, и без букв последних двух,
Плюс раствор для смазки ссадин, что сажают дети за день;
Вместе - ряд горизонтальный получаем моментально.
Период
Предупреждаю вас заранее:
Я непригоден для дыхания!
Но все как будто бы не слышат
И постоянно мною дышат.
yt
...
Я светоносный элемент.
Я спичку вам зажгу в момент.
Сожгут меня - и под водой
Оксид мой станет кислотой.
Фосфор?
...
У меня дурная слава:
Я - известная отрава.
Даже имя говорит,
Что я страшно ядовит.
yt