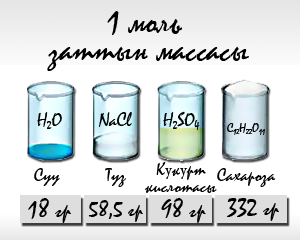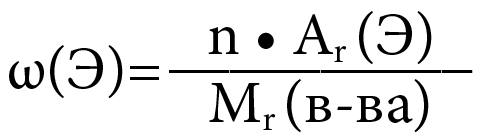Химия: Сандык катыштар
Версия от 09:16, 5 июня 2018; Admine2 (обсуждение | вклад) (→Салыштырмалуу атомдук жана молекулалык масса)
Заттардын массасынын сакталуу закону Авогадро саны. Авогадро закону
Содержание
Салыштырмалуу атомдук жана молекулалык масса
Атомдор микроскоптук бөлүкч өлөр болгондуктан, алардын массасы өтө кичине болот. Эгерде кайсы бир химиялык элементтин атомунун массасын эсептеп көрсөк, сандын алдына коюлган үтүрдөн кийин жыйырмадан ашык нөл жазылат. Бул атомдун массасын грамм менен туюнтуунун ыңгайсыздыгын билдирип турат. Бирок, эгерде кандайдыр бир кичине санды бирдик катары кабыл алсак, калган кичине массаларды ушул бирдикке болгон анын катышы катары карасак болот. Ошондуктан, абсолюттук атомдук массанын ордуна салыштырмалуу атомдук масса колдонулат. Атомдун массасын өлчөөнүн бирдиги катары көмүртектин атомунун массасынын 1/12 бөлүгү кабыл алынган.
Салыштырмалуу атомдук масса (Ar) берилген атомдун массасы, көмүртектин атомунун массасынын 1/12 бөлүгүнө болгон катышына барабар.
Ar = mат. / (1/12)mС
Абсолюттук атомдук масса өзүнүн мааниси боюнча салыштырмалуу болот жана массанын атомдук бирдиги (м.а.б.) менен өлчөнөт. Б.а. салыштырмалуу атомдук масса берилген атомдун массасы көмүртектин атомунун 1/12 бөлүгүнөн канча эсе чоң экендигин көрсөтөт.
Эгерде атомдун салыштырмалуу атомдук салмагы Ar = 12 болсо, демек, анын массасы көмүртектин атомунун массасынын 1/12 бөлүгүнөн 12 эсе чоң болот, б.а. массанын атомдук бирдиги 12 барабар болот. Бул көмүртектин атомунда гана болушу мүмкүн. Суутектин салыштырмалуу атомдук массасы бирге барабар Ar = 1. Бул анын массасы көмүртектин атомунун массасынын 1/12 бөлүгүнө барабар экендигин билгизет. Кычкылтектин атомунун салыштырмалуу атомдук массасы 16 массанын атомдук бирдигине (м.а.б.) барабар болот. Бул кычкылтектин атому көмүртектин атомунун 1/12 бөлүгүнөн 16 эсеге чоң экендигин билгизет, массанын атомдук бирдиги 16 барабар. Эң жеңил химиялык элемент – суутек болуп саналат. Анын массасы болжол менен 1 массанын атомдук бирдигине барабар. Эң оор атомдордун массасы 300 м.а.б. жакын мааниге ээ болот.
Бардык элементтердин атомунун абсолюттук массалары бүтүн санга тегеректелет.
Молекулалар үчүн салыштырмалуу молекулалык масса (Mr) деген түшүнүк колдонулат. Салыштырмалуу молекулалык масса молекуланын массасы көмүртектин атомунун массасынын 1/12 бөлүгүнөн канча эсе чоң экендигин билгизет.
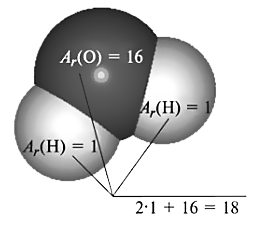
Бирок, молекуланын массасы ал түзгөн атомдордун массаларынын суммасына барабар болгондуктан, салыштырмалуу молекулалык массаны табуу үчүн бул атомдордун массаларын кошуу керек. Мисалы, суунун молекуласы(H2O) эки атом суутектин Ar(Н) = 1 жана бир атом кычкылтектин атомунан Ar(О) = 16 турат. Демек, Mr(Н2O) = 2+16=18 болот.
Кээ бир заттар, мисалы металлдар молекулалык эмес, атомдук түзүлүштө болушат. Бул учурда алардын салыштырмалуу молекулалык массалары менен салыштырмалуу атомдук массаларынын сандык мааниси бирдей болуп калат. Химияда элементтин молекуладагы же заттагы массалык үлүшү деген чоңдук маанилүү. Ал салыштырмалуу молекулалык массанын кайсы бөлүгү берилген элементке туура келээрин аныктайт. Мисалы, суунун 2 массалык үлүшү суутекке (эки атом болгондуктан), 16 массалык үлүшү кычкылтекке туура келет. Б.а. эгерде 1кг суутек жана 8 кг кычкылтек аракеттенсе, алар калдыксыз реакцияга кирет. Суутектин массалык үлүшү 2/18 = 1/9, ал эми кычкылтектин массалык үлүшү 16/18 = 8/9 барабар болот.
Азыркы учурдагы изилдөөнүн методдору атомдордун өтө кичине массаларын да тактык менен аныктай алат. Мисалы, көмүртектин атомунун массасы 1,993•10–26 кг барабар. Бул эң кичине чоңдук. Ошондуктан, химияда атомдук массалардын абсолюттук эмес, салыштырмалуу мааниси колдонулат. Атомдук массанын бирдиги катары көмүртектин атомунун массасынын 1/12 бөлүгү кабыл алынган. Химиялык элементтин салыштырмалуу атомдук массасы деп, берилген атомдун массасы көмүртектин атомунун массасынын 1/12 бөлүгүнөн канча эсе чоң экендигин көрсөтүүчү чоңдукту айтабыз. Ал Аr тамгасы менен белгиленет.
Салыштырмалуу атомдук массалар мезгилдик таблицада көрсөтүлгөн.
Стрелкой обозначена относительная атомная масса углерода
Мисалы, Аr(Н)=1, Аr(С)=12. Бардык элементтердин массалары бүтүн санга тегеректелет. Хлордун атому гана бөлчөк сан менен белгиленет – Аr(Cl)=35,5
Мисалы, Мr(H2SO4)=1•2+32+16•4=98.
Демек, суунун салыштырмалуу молекулалык массасын (Н2O) табуу үчүн атомдордун санын эсепке алуу менен, суутектин жана кычкылтектин салыштырмалуу атомдук массаларын суммалайбыз.
Суутектин салыштырмалуу атомдук массасы 1 барабар. (Д.И. Менделеевдин таблицасында), формула боюнча суутектен 2 атом болоорун билебиз (суутектен кийин 2 деген индекс турат);
Кычкылтектин салыштырмалуу атомдук масасы 16 барабар (Д.И.Менделеевдин таблицасында);
Суунун салыштырмалуу молекулалык массасын эсептейбиз:
Мr(Н2O)=1•2+16=16+2=18
(1•2) т.к у нас 2 водорода.
Количество вещества
- Моль – ν (ню) тамгасы менен белгиленет.
Элементтердин массалык үлүшү
- Берилген элементтин салыштырмалуу атомдук массасынын молекуладагы атомдун санына болгон көбөйтүндүсүнүн заттын жалпы молекуласынын массасына болгон катышы аталат:
-
ω(Э) – элементтин массалык үлүшү
n – чэлементтин молекуладагы атомдорунун саны (индекс)
Ar – элементтин салыштырмалуу атомдук массасы
Mr(зат) – заттын салыштырмалуу молекулалык массасы
Молекуланын сапаттык курамы заттын курамына кандай атомдор кирээрин көрсөтөт.
Сандык курам заттын молекуласынын курамына кирген атомдордун санын билдирет.
Заттардын курамынын туруктуулук закону
Химиянын негизги закондоруна заттардын курамынын туруктуулук закону кирет.
Заттардын курамынын туруктуулук законун франсуз окумуштуусу Ж. Пруст 1808–жылы алгачкылардан болуп түзгөн.
Ал: «Жер шарынын бир полюсунан башкасына чейин бирикмелер бирдей курамга жана бирдей касиетке ээ болушат. Түштүк жана Түндүк жарым шардагы темирдин оксиддери бири–биринен айрымаланбайт. Сибирден алынган малахит менен Испаниядагы малахит бирдей эле курамга ээ болот. Дүйнө жүзүндө бир эле киноварь бар»
Закондун бул аныктамасында жогоруда айтылгандай бирикмелер алынуу жолуна жана кайсы жерде жайгашканына карабастан туруктуу курамга ээ болоору белгиленген.
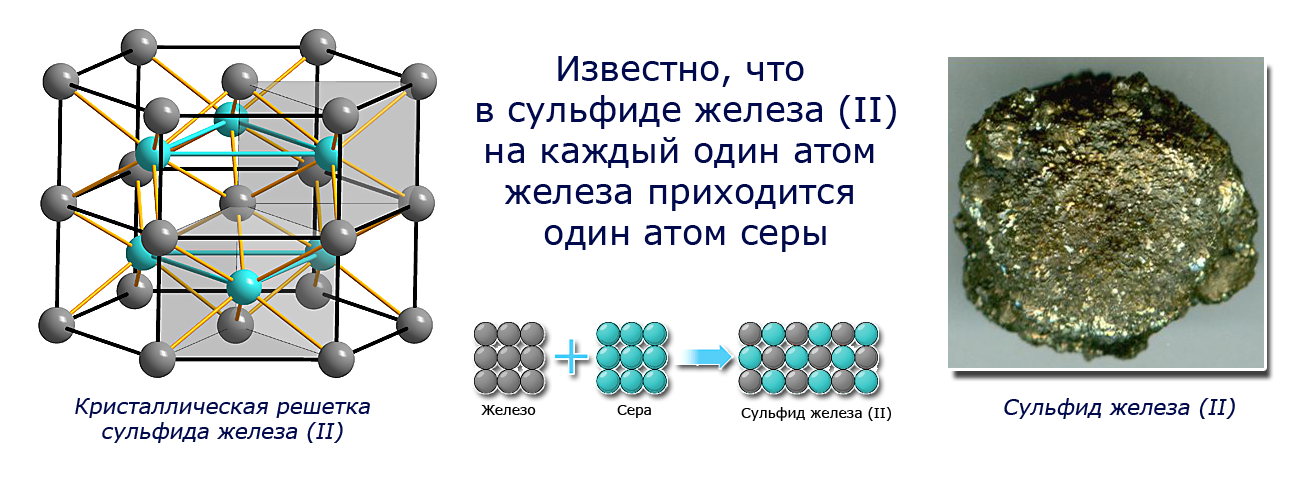
- Темирдин(II) сульфидин алуу үчүн биз темирди жана күкүрттү 7:4 өлчөмүндө кошуп, аралаштырдык. Видео– экспериментти көрсөңөр болот. Эгерде аларды башка пропорция менен, мисалы 10:4 өлчөмүндө аралаштырсак, химиялык реакция жүрөт, бирок 3г темир реакцияга катышпайт. Эмне үчүн мындай болду? Бизге белгилүү болгондой темирдин сульфидинде(II) бир атом темирге 1 атом күкүрт туура келет. Демек, реакция жүрүшү үчүн заттарды (1:1) массалык катышта алабыз. Темирдин жана күкүрттүн салыштырмалуу атомдук массаларын табабыз. Ar(Fe):Ar(S) = 56:32 = 7:4.
Заттын массасын кандай гана бирдиктер (г, кг, т, м.а.б.). менен белгилебейли 7:4 болгон катышы туруктуу болот.Көпчүлүк химиялык заттар туруктуу курамга ээ болушат.
Химия илиминин өнүгүшү туруктуу курамдагы бирикмелерден башка өзгөрмөлүү курамга ээ болгон бирикмелердин да бар экендигин көрсөттү. Н.С. Курнаковдун сунушу боюнча дальтониддер (англиялык химик жана физик Дальтондун урматына) жана бертоллиддер (бул бирикмелерди алдын–ала аныктаган француз химиги Бертолленин урматына) деп аталган бирикмелер түзүлгөн. Дальтониддердин курамы жөнөкөй формулалар менен туюнтулган. Мисалы, Н2О, НCl, ССl4, СO2. Бертоллиддердин курамы өзгөрүп турат жана туруктуу формуласы жок.
Өзгөрмөлүү курамдагы заттардын табылгандыгына байланыштуу заттардын курамынын туруктуулук законунун азыркы аныктамасына толуктоо киргизүү зарылдыгы бар.
Күкүрт кислотасынын H2SO4 курамын түзгөн химиялык элементтердин массалык катышын тапкыла?
Чыгаруу: Химиялык элементтердин мезгилдик системасын пайдалануу менен химиялык элементтердин салыштырмалуу атомдук массаларын аныктайбыз: Ar(H)=1, Ar(S)=32, Ar(O)=16.
Формула боюнча массалык катыштарын табабыз: H2SO4 m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2 : 32 : 64 = 1 : 16 : 32
Демек, 49 г күкүрт кислотасын алуу үчүн (1+16+32=49), 1 г – Н, 16 г – S жана 32 г – О алышыбыз керек экен.
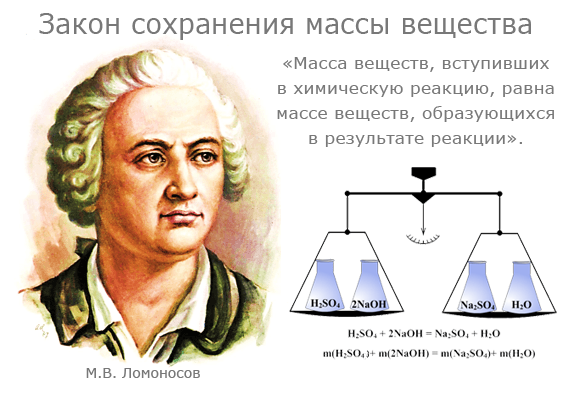
Заттардын массасынын сакталуу закону
Суроо: Реакцияга кирген заттардын массасы реакциядан кийин өзгөрөбү?
Бул суроого жооп бериш үчүн төмөнкү экспериментке көңүл буралы:
- Жезди жабык идиште ысытуу
- Описание эксперимента:
Колбага 2 гр майдаланган жездин порошогун салгыла. Колбанын оозун тыгын менен бекем жаап туруп, таразага тарткыла. Колбанын салмагын эстеп калгыла. Колбаны 5 мүнөттөй акырындык менен ысытып, андагы өзгөрүүлөргө көңүл бургула. Ысытууну токтотуп, колба бир аз муздагандан кийин кайрадан аны таразага тарткыла. Колбанын ысытканга чейинки жана андан кийинки салмактарын салыштыргыла.
Жыйынтык: Колбанын салмагы ысыткандан кийин өзгөргөн жок.
Башка эксперименттерди да байкап көрөлү:
Жыйынтык: Заттын массасы реакцияга чейин канча болсо, реакциядан кийин да ошол боюнча өзгөрүүсүз калат.
-
Атом–молекулалык окуунун негизинде закон төмөнкүдөй түшүндүрүлөт,химиялык реакция учурунда атомдордун саны өзгөрбөйт, алар кайрадан топтолушуп, биригишет.
Заттардын массасынын сакталуу закону химия илиминдеги негизги закондордун бири болуп саналат, анткени химиялык реакциялар боюнча бардык эсептөөлөр ушул закондун негизинде жүргүзүлөт. Бул закондун ачылышы менен химия илими так илимдердин катарына кирген.
Массанын сакталуу закону 1748–жылы теориялык түрдө ачылган жана 1756–жылы М.В. Ломоносов тарабынан эксперименталдык жол менен тастыкталган.
Химиялык теңдемелер
Заттардын массасынын сакталуу закону химиялык теңдемелерди түзүүдө колдонулат.
Видео – экспериментти көрөлү:
-
Күкүрттүн темир менен өз ара аракеттенүүсүнөн темирдин сульфиди (II) алынат–реакциянын натыйжасында, темирге да күкүрткө да окшобогон жаңы зат пайда болот. Аларды магнит аркылуу да бөлүп алууга болбойт. Демек, химиялык реакция жүрдү.
Исходные вещества, принимающие участие в химических реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Химиялык реакциянын теңдемесин жазабыз:
Химиялык реакциянын тендемесин түзүүнүн эрежелери
Фосфордун кычкылтек менен болгон реакциясынын теңдемесин түзɵбүз 1. Теңдеменин сол жагына реакцияга кирген заттардын (реагент) химиялык формулаларын жазабыз. Эсиңерден чыгарбагыла! Көпчүлүк жɵнɵкɵй заттардын молекулалары эки атомдон турат: H2; N2; O2; F2; Cl2; Br2; I2. Реакцияга кирген заттардын ортосуна «+» белгиси, аягына жебе (стрелка) коюлат:
P + O2 ![]()
2. Теңдеменин оң жагына (жебеден кийин) реакциядан пайда болгон заттардын формуласы жазылат. Химиялык формула валенттүүлүктүн негизинде түзүлɵт:
P + O2 ![]() P2O5
P2O5
3. Заттардын массасынын сакталуу законуна ылайык, реакцияга чейинки жана реакциядан кийинки атомдордун саны барабар болушу керек. Ал үчүн реакцияга кирген жана пайда болгон заттардын формулаларынын алдына коэффициенттерди коёбуз.
Биринчи, атомунун саны кɵп болгон зат теңделет. Бул реакцияда кычкылтектин атомунун саны кɵп экендиги кɵрүнүп турат.
Теңдеменин сол жана оң жагындагы кычкылтектин орточо санын табабыз. Реакцияга чейин кычкылтектин атому 2 ге, реакциядан кийин 5 барабар. Экиге да бешке да бɵлүнгɵн эң кичине орто сан – 10. Ал санды кычкылтектин атомунун санына бɵлɵбүз:
P + 5O2 ![]() 2P2O5
2P2O5
Кычкылтектин атомдору теңделди, эми фосфордун атомун теңдейбиз.
Химиялык реакция толугу менен теңделди. Жебени барабардык менен алмаштырып койсок болот.
4P + 5O2 ![]() 2P2O5
2P2O5
Авогадро саны. Авогадро закону
Авогадро закону: Ар кандай газдар бирдей көлөмдө,бирдей шартта (температура жана басым) бирдей сандагы молекулаларды камтыйт.
Авогадро законунун корутундулары:
1–корутунду:
Бул көлөм газдардын молдук көлөмү деп аталат жана Vm менен белгиленет.
Молдук көлөм – бул нормалдуу шартта (н.ш.) заттар–газдар үчүн турактуу чоңдук:
Vm = 22,4 л/моль
нормалдуу шарт–бул:
p (басым) = 1 амт (101325 Па)
t (температура) = 0 ˚C (273 К)
заттардын–газдардын турактуу чоңдугу.
2–корутунду:
Бул чоңдук D салыштырмалуу тыгыздык деп аталат.
Молярдык массанын, молдук көлөмдүн, Авогадро санынын жана заттын санынын өз ара байланышы:
υ = V / Vm = N / Na = m / M
M = ρVm
Глоссарий
- 1 моль заттагы структуралык бирдиктердин саны 6,02 • 1023 барабар болот. Бул сан Авогадро саны деп аталат (NA).
- Химиялык заттар атомдук масса, молекулалар молекулалык масса менен мүнөздөлөт. Химия илиминин өнүгүшүнө газ закондору чоң роль ойнойт.
- 1811–жылы Авогадро ди Кваренья ( Авогадро закону) бирдей көлөмдө, бирдей шартта(температура жана басым) ар түрдүү газдарда бирдей сандагы молекулалардын болоорун далилдеген. Бирдей шартта, бирдей сандагы молекулалар бирдей көлөмгө ээ болот, 1моль газ 273 oК температурада жана 101,3 кПа басымда көлөмү 22,4 л барабар болот. Бул көлөм газдын молдук көлөмү деп аталат (Vm). 1756–жылы М.В. Ломоносов көптөгөн сыноолордон кийин маанилүү ачылыш жасаган: Химиялык реакцияга чейинки заттын массасы реакциядан кийинки массага барабар.
- Заттын массасынын сакталуу закону заттын сакталуу законунда чагылдырылган. Заттар жок болуп кетпейт жана жоктон пайда болбойт, реакция убагында химиялык айлануу гана жүрөт.Закон химиялык теңдемелерди түзүүнүн жана мисалдарды чыгаруунун негизи болуп саналат.
- 1808–жылы Ж. Пруст заттардын курамынын туруктуулук законун ачкан. Ал «бардык заттар алынуу жолуна карабастан туруктуу сапаттык жана сандык курамга ээ болот», деген.
- Массанын атомдук бирдиги (м.а.б.) – ядросунда 6 протону, 6 нейтрону жана электрондук катмарында 6 электрону бар көмүртектин атомунун массасынын 1/12 бөлүгү. Дагы көмүртектик бирдик деп да аталат.
- Моль – бул 0,012кг (12г) көмүртектин изотобунда көмүртектин канча атому болсо, алынган затта да ошончо бөлүкчө (атомдор, молекулалар же башкалар) болуучу заттын саны.
- Молдук масса (M) 1 моль заттын массасына барабар жана заттын массасынын заттын санына болгон катышына барабар жана грамм–моль (г/моль) менен туюнтулат.
- Моль – берилген заттын 6,022. 1023 структуралык бирдикке барабар болгон заттын саны: молекулалардан (эгер зат молекулалардан турса), атомдордон(эгер зат атомдук түзүлүштө болсо), иондордон (эгер зат иондук бирикме болсо).
- Молдук масса – бир моль заттын грамм менен туюнтулушу заттын молдук массасы же грамм–молу (г/моль) деп аталат. Молдук массанын (грамм–моль) сандык мааниси молекулалык массага (атомдук масса, эгер зат атомдордон турса) м.а.б. барабар болот.
- Нормалдуу шарт (н.ш.) – 0 OС (273 K) температурага, 1 атм (760 мм сымап мамычасы же 101 325 Па) басымга барабар болот. Стандарттык шарттар менен алмаштырбоо керек.
- Салыштырмалуу атомдук масса – Ar («r» – англис тилинен «relative» – салыштырмалуу ) белгиси менен белгиленет. Атомдун массасынын көмүртектин атомунун массасынын 1/12 бөлүгүнө болгон катышына барабар. Азыркы учурдагы илимий адабияттарда салыштырмалуу атомдук массадан сырткары АТОМДУК САЛМАК деген термин да колдонулат (синоним катары).
- Салыштырмалуу молекулалык масса (Mr) – Заттын салыштырмалуу молекулалык массасы химиялык бирикмени түзгөн атомдордун салыштырмалуу атомдук массаларынын суммасына барабар.
Пайдалуу шилтемелер
class="biblio"|
class="biblio"|
class="biblio"|
Библиография:
НЕТУ
- Ахметов Н. С. Актуальные вопроса курса неорганической химии. — М.: Просвещение, 1991. — 224 с — ISBN 5-09-002630-0
Италиялык физик жана химик Амедео Авогадро билими боюнча юрист болгон. Бирок ага атак–даңкты анын физика жана химия илиминдеги ачылыштары алып келген.
Ал Туринде туулган. Турин Университетинин юридикалык факультетин 1792–жылы аяктаган. 1800–жылдан тартып математика жана физика илимдерин өз алдынча окуп баштаган. 1809 – 1819 жылдары Верчелли шаарындагы лицейде физикадан сабак берген. 1820 – 1822 жана 1834 – 1850 жылдары Турин Университетинде физика илиминин профессору катары эмгектенген.
1811–ж. италиялык окумуштуу Авогадро газ законун ачкан. Анда бирдей көлөмдө, бирдей температурада жана басымда газдарда бирдей сандагы молекулалардын болоорун айткан (Авогадро закону). Авогадронун аты менен 1 моль газдагы молекулалардын саны – Авогадро турактуулугу да аталган.
Авогадро (1811–ж.) молекулалалык массаларды аныктоонун методун түзгөн, башка изилдөөчүлөрдүн эксперименттеринин негизинде биринчилерден болуп кычкылтектин, көмүртектин, азоттун, хлордун жана башка бир катар элементтердин атомдук массаларын аныктаган (1811–1820 жж.). Ал көптөгөн заттардын (суу, суутек,кычкылтек, азот, аммиак, азоттун оксиди, хлор, фосфор, мышьяк, сурьма) молекуласынын сандык курамын аныктаган (1814–ж). Ошону менен катар эле щелочтук жана щелочтук жер металлдардын,метандын, этил спиртинин, этилендин көптөгөн бирикмелердин курамын так көрсөткөн.
Авогадро биринчилерден болуп азоттун, фосфордун, мышьяктын жана сурьманын касиеттериндеги окшоштуктарга көңүл бурган. Бул химиялык элементтер кийин Мезгилдик системанын VA–группасын түзгөн.
Авогадронун «Молекулярдык теория” боюнча илимий эмгектеринин жыйынтыгы 1860–жылы Карлсруэдеги I Эл аралык химиктердин конгрессинде таанылган.
Авогадро жөнөкөй турмушта жашаган, сегиз баланын атасы болгон,байлыкка, атак–даңкка умтулган эмес.
1754–жылы 26–сентябрда Анжеде аптекардын үй–бүлөсүндө туулган. Париж Университетинен окуган.
1775–ж. Сальпетриер ооруканасынын дарыканасынын башчылык кызматына дайындалган. 1777–ж. Вергардагы (Испания) Королдук семинариянын химия жана металлургия кафедрасына чакыруу алган. 1785 –ж. Испаниянын королу Карл III Прустту Сеговиядагы Артиллериялык мектепке химия илиминин профессорунун кызматына чакырган. Андан ары Пруст Саламанка (1789–ж.) жана Мадрид (1791–1808 жж.), Университеттеринде химия кафедрасын жетектеген (1789–ж.), лаборатория уюштурган, минералдардын жана реактивдердин баалуу коллекциясын түзгөн.
1808–жылы Наполеондун аскерлери Мадрид шаарын басып кирген учурда Прусттун лабораториясы толугу менен талкалангандыктан, Пруст Францияга кайтып келген. 1816–жылы окумуштуу Париж Илимдер Академиясына мүчө болуп шайланган.
Испанияда Пруст калай, жез, темир, никель ж.б. металлдардын касиеттерин жана алардын бирикмелеринин курамын изилдеген. Ал көптөгөн бирикмелер оксид эмес гидроксид түрүндө болоорун далилдеген, «Гидрат» деген терминди киргизген жана жүзүмдүн ширесинен глюкозаны алган.
Ар түрдүү металлдардын оксиддери, хлориддери жана сульфиддеринин курамын изилдөө (1797–1809–жж.) анын химиялык бирикмелердин курамынын туруктуулук законун ачуусуна негиз болгон(1806–ж.). Бул багытта белгилүү химик К. Бертолле экөонүн ортосундагы талаш–тартыш жаралат. Ал 1801–жылдан 1808–жылга чейин созулат да, кийин Прусттун пайдасына чечилген.
Пруст Анжеде 1826–жылы 5–июлда каза болгон.
23–октябрда эртең менен саат 6:02 дүйнɵ жүзү боюнча Моль күнү (же 6.02•1023 моль–1 барабар болгон Авогадро саны) белгиленет. Салт болуп калгандай, бул күнү уюштуруучулар Молдун эл аралык сайтында ар түрдүү кызыктуу конкурстарды уюштурушат. Мисалы, «Эгерде итти моль (күбɵ) чагып алса эмне болот?” деген суроого тамаша түрүндɵ жооп табуу керек. Же болбосо, Молеассес деген ат менен аталган печенье, Авогадро кремин же Тако–моль соусун даярдоо керек болот. Даярдалган таттуу азык заттардын аталышы сɵссүз илим менен байланышта болушу керек.
80–жылдарда «The Science Teacher» басылмасында химия илимине кызыккандар үчүн чакырык катары макала жазылган, макалага жооп кылып 1991–жылы Моль күнүнүн Эл аралык фонду негизделген. 2003–жылдан баштап, ChemEd конференциясында Моль күнүнүн калыптанышына жана химия илимине кошкон салымы үчүн алдыңкы химиктерге «Жылдын улуттук молу” деген ардактуу наам ыйгарылып турат. Бул жɵнүндɵ Моль күнүнүн Эл аралык фондунун сайтында маалымат берилген. Моль заттын санын ченɵɵнүн бирдиги экендиги белгилүү. Эгер аны кантип колдонууну билсеңер жана жаныңарда мезгилдик таблица болсо, анда силер каалаган заттын атомдорун жана молекулаларын граммга айландырып же тескерисинче граммды атомго жана молекулага айландыра аласыңар. Бул аркылуу силер берилген затта башка заттын активдүү бɵлүкчɵлɵрү менен реакцияга кире турган, канча бɵлүкчɵлɵрдүн бар экендигин билсеңер болот. Мына ошентип, заттын массасы жана молдук массасы грамм менен туюнтулат. Мисалы, суунун молдук массасы – 18,015 болот, жана бир моль суу да – 18,015 граммга барабар. Эгерде адамдар: «Менде 36,03 грамм суу бар» десе, химиктер: «Химиялык реакция жүргүзүү үчүн менде 2 моль суу бар» деп айтышат.
1909–жылга чейин эле физик жана Нобель сыйлыгынын лауреаты Жан Перрен Авогадро туруктуулугун аныктаган, андан соң окумуштуулар суунун белгилүү бир саны катары 12.04·1023 молекуланы кабыл алышкан.
Перрен Амадео Авогадронун урматына туруктуу санды «Авогадро» деп атаган. Ал эми Авогадро жүз жыл мурда эле газдын кɵлɵмү менен молекуланын же атомдун ортосунда байланыштын бар экендигин божомолдогон.
1–маселе. 5·10-3 кг көмүр кычкыл газы (н.ш.) кандай көлөмгө ээ болот?
Көмүр кычкыл газынын СО2 молекулалык массасын табабыз:
Mr(CO2)= 12+2·16=44 г.
Ошондой эле бизге 22,4 м3 барабар болгон газдын молдук көлөмү да белгилүү.
Төмөнкү пропорцияны түзөбүз:
44 кг СО2 – 22,4 м3 көлөмгө ээ болот
5·10-3 кг СО2 – х көлөмгө ээ болот
мында, x = (5·10-3·22,4)/44=2,5·10-3 м3
Демек, 5·10-3 кг көмүр кычкыл газы 2,5·10-3 м3 көлөмгө ээ болот.
2–маселе. Эгерде 10-3 м3 кычкылтектин массасы нормалдуу шартта 1,5·10-3 кг барабар болсо, анда 0,9·10-3 м3 кычкылтектин 21 °С температурада жана 96000 Па басымдагы массасын аныктагыла?
Температураны Кельвин боюнча табабыз: Т=273+21=294 К;
Формулага (н.ш.) салып, газдын көлөмүн аныктайбыз:
P1V1 / T1 = P2V2 / T2;
V1 = T1P2V2 / T2P1=
=(273·96000·0.9·10-3) / (294·101325)=0.8·10-3 м3
Эми бул көлөм канча массага ээ экендигин эсептеп чыгабыз:
10-3 м3 кычкылтек –1,5·10-3 кг массага ээ болсо,
0,8·10-3 м3 кычкылтектин массасы белгисиз болот – х
х = 0,8·10-3·1,5·10-3/10-3=1,2·10-3 кг
Демек, 0,8·10-3 м3 кычкылтек 1,2·10-3 массага ээ болот.
3–маселе. Тыгыздыгы 7900 кг/м3 барабар болгон темирдин атомунун көлөмүн эсептегиле.
Темирдин молдук көлөмүн табабыз: (M(Fe)=56 г.)
V=n/ρ=56/7900=7,1·10-3 м3
Шарттуу түрдө темирдин атому шар формасында болот жана кристаллда алар бири–бирине тийишип турат деп алсак, анда темирдин чыныгы көлөмү жалпы көлөмдүн 74% түзөт:
V=0,071·0,74=5,25·10-3 м3
Анда бир атом темирдин көлөмү
VА=5,25·10-3/6,02·1026=8,7·10-30 м3
4–маселе. Эгерде н.ш. 10–3 м3 газдын массасы 0,3810-3 кг барабар болсо, анда газдын молекуласынын массасын аныктагыла.
1 кмоль ар бир заттын молекуласынын саны Авогадро санына (6,02·1026) барабар, ошондуктан, адегенде биз 1 кмоль газды аныктайбыз:
10-3 м3 – 0,3810-3 массага ээ болот,
22,4 м3 газ – х массага ээ болот.
х=22,4·0,3810-3/10-3=7,6 кг,
Андан ары газдын молекуласынын массасын аныктайбыз:
m=7,6/6,02·1026=1,26·10-26 кг.
5–маселе. 7,2 г металл хлор менен аракеттенишкенде 28,2 г туз алынган. Металлдын эквивалентинин молдук массасын эсептеп чыккыла. Хлордун эквивалентинин молдук массасы 35,45 г/молго барабар.
Эквиваленттин законуна ылайык, металлдын жана туздун массасынын катышы алардын эквиваленттеринин молдук массаларынын катышына барабар. Металлдын эквивалентинин молдук массасын х менен белгилесек, анда:
7,2/28,2=х/(х+35,45)
Теңдемени чыгаруу менен: х=12,15 г/молго барабар экендигин табабыз.
Ошентип, металлдын эквивалентинин молдук массасы Мэкв = 12,15 г/молго барабар болот.
6–маселе. Алмашуу реакциясындагы татаал заттардын эквивалентинин молдук массасын аныктагыла.
Төмөнкү реакциялардан күкүрт кислотасынын H2SO4 эквиваленттеринин молдук массаларын аныктагыла:
А) H2SO4+2KOH = K2SO4+2H2O
Б) H2SO4+KOH = KHSO4+H2O
Заттын эквивалентинин мааниси анын кандай реакцияга катышкандыгына байланыштуу болот.
А) Биринчи реакцияда 1 моль күкүрт кислотасы H2SO4 2 моль калий гидроксиди KOH менен H2SO4 1 эквиваленти KOH 2 эквиваленти менен аракеттенишет. Калий гидроксидинин KOH эквивалентинин молдук массасы анын молекулалык массасына барабар болот, демек күкүрт кислотасынын H2SO4 эквивалентинин молдук массасы анын молекулалык массасынын жарымын түзөт:
Мэкв=98/2=49 г/моль
Б) Экинчи реакцияда 1 моль күкүрт кислотасы H2SO4 1 моль калий гидроксиди KOH менен , күкүрт кислотасынын H2SO4 эквиваленти калий гидроксидинин KOH 1 эквиваленти менен аракеттенишет. Калий гидроксидинин KOH эквивалентинин молдук массасы анын молекулалык массасына барабар болот. Демек, кукүрт кислотасынын H2SO4 эквивалентинин молдук массасы анын молекулалык массасына барабар болот: 98 г/моль.
7–маселе. 9 г. кислотаны нейтралдаштыруу үчүн 8 г. натрийдин гидроксиди сарпталса, анда кислотанын эквивалентинин молдук массасын эсептегиле.
Натрийдин гидроксидинин эквивалентинин молдук массасы анын молекулалык массасына барабар болот: Мэкв = 40 г/моль.
Заттар өз ара эквиваленттеринин молдук массаларына пропорциялуу болгон массада аракеттенишет, б.а.:
Кислотанын эквивалентинин молдук массасын х менен белгилесек, анда:
9/8=х/40=45 г/моль
8–маселе. Берилген заттын буусунун суутек боюнча салыштырмалуу тыгыздыгы 67,5, аны түзгөн элементтердин массалык үлүшү (%) төмөнкүдөй: күкүрт – 23,7, кычкылтек – 23,7, хлор – 52 болсо, заттын молекулалык формуласын тапкыла.
Белгисиз бирикменин формуласын SxOyClz деп белгилейбиз. Массалык үлүштөрүн алардын атомдук массаларына бөлүү менен атомдордун S, O, Cl санынын катыштарын табабыз:
x:y:z = 23,7/32 : 23,7/16 : 52/35,5 = 0,74 : 1,48 : 1,46
Алынган катыштарды эң кичине санга кыскартабыз:
x:y:z =1:2:2 алабыз.
Заттын жөнөкөй формуласы SO2Cl2 болот.
Анын молекулалык массасы Mr = 32+16·2+35,5·2 = 135 г. барабар болот.
Эми берилген заттын буусунун суутек боюнча тыгыздыгын аныктайбыз:
Mr = 2DH2= 2·67,5 = 135 г.
Демек , заттын формуласы жөнөкөй формулага туура келет: SO2Cl2
9–маселе. Массасы 7·10-3 кг. болгон газдын 20°С температурада, 0,253·105 Па басымда көлөмү 22,18·10-3 м3 барабар болсо, бул газдын молдук массасын эсептегиле.
Мында газдын молдук массасын эсептөө үчүн Клапейрон–Менделеевдин теңдемесин пайдаланабыз:
pV = nRT = (m/M)RT;
R=8,3144·103 Дж/моль·К
Т=273+20=293 К
М=mRT/pV=7·10-3·8,3144·103293/(0,253·105·22,18·10-3)=30,35 г/моль
Газдын молдук массасы 30,35 г/молго барабар болот.
10–маселе. 0°С температурада көлөмү 14·10–3 м3 болгон идиште 0,8·10–3 кг суутек жана 6,3·10–3 кг азот толтурулат. Азоттун парциалдык басымын жана бул аралашманын жалпы басымын аныктагыла.
Суутектин жана азоттун заттын санын табабыз:
n=m/Mn(H2)=0,8·10-3/2=0,4·10-3моль
n(N2)= 6,3·10-3/28=0,225·10-3моль
Андан ары Клапейрон – Менделеевдин теңдемесин пайдалануу менен аралашмадагы ар бир газдын парциалдык басымын табабыз:
pV = nRT = (m/M)RT;
p = nRT/V;
p(H2)=n(H2)
RT/V=0,4·10-3·8,3144·103·273/14·10-3=64,85·103Па
p(N2)= n(N2)
RT/V=0,225·10-3*8,3144·103·273/14·10-3=36,479·103Па
pобщ=p(H2)+p(N2)= 64,85·103+36,479·103=101329 Па
11–маселе. 96000 Па басым астында 5·10–3 м3 метандан, 84000 Па басым астында 2·10–3 м3 суутектен жана 109000 Па басым астында 3·10–3 м3 көмүртектин оксидинен турган газдардын аралашмасы алынган. Аралашманын көлөмү 8·10–3 м3 барабар болот. Аралашмадагы газдардын парциалдык басымын жана аралашманын жалпы басымын аныктагыла.
Адегенде ар бир газдын парциалдык басымын аныктайбыз:
p(CH4)=P(CH4)·V(CH4)/Vобщ=96000·5·10-3/8·10-3=60000 Па
p(H2)=P(H2)·V(H2)/Vобщ=84000·2·10-3/8·10-3=21000 Па
p(CО2)=P(CО2)·V(CО2)/Vобщ=109000·3·10-3/8·10-3=40875 Па
Жаопы басым:
pобщ= p(CH4)+ p(H2)+ p(CО2)= 60000+21000+40875=121875 Па
12 – маселе. Азот оксидинен жана азоттун төрт оксидинен турган газдардын аралашмасы берилген. Эгерде газдардын көлөмдүк үлүшү (%) 37,5 жана 62,5 барабар болсо, аралашмадагы газдардын парциалдык басымын эсептеп чыккыла. Газдардын аралашмасынын жалпы басымы 106640 Па барабар.
Парциалдык басымды табуу үчүн аралашманын жалпы басымын анын көлөмдүк катышына бөлөбүз:
p(NO)= pобщ·φNO=106640·0,375=39990 Па
p(NO2)= pобщ·φNO2=106640·0,625=66650 Па