Химия: Химиялык реакция
Бир заттын башка заттарга айлануу кубулушу химиялык реакция деп аталат. Химиялык реакцияга кирген баштапкы заттар реагенттер деп, ал эми реакциядан кийин пайда болгон заттар реакциянын продуктылары деп аталат.
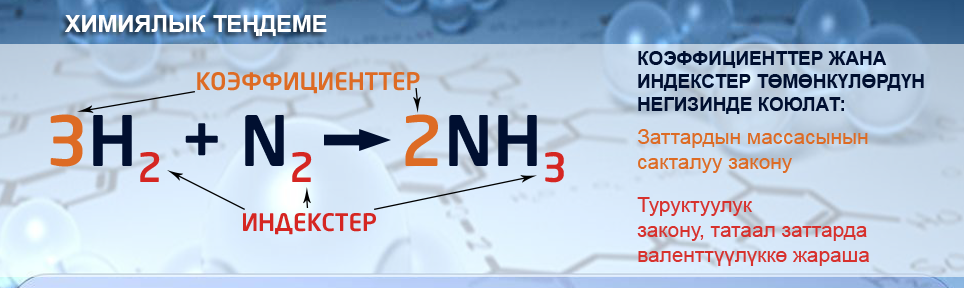
- Химиялык теңдеме – бул химиялык белгилердин жана формулалардын жардамы менен химиялык реакцияларды шарттуу түрдө туюнтуп жазуу. Химиялык формулалар менен туюнтулган химиялык теңдеме оң жана сол жакка бөлүнөт. Тендеменин сол жагына реагенттер, ал эми оң жагына реакциянын продуктылары жазылат. Заттардын формуласында химиялык элементтин атомдорунун саны индекс аркылуу көрсөтүлөт. Бул заттын касиетине бир кыйла таасир этет:
-
H2SO4 H2SO3 Күкүрт кислотасы Күкүрттүү кислота Күчтүү Начар Туруктуу Туруктуу эмес Териге тийсе күйгүзөт Жарыктын таасири менен ажырайт Майланышкан суюктук Газдын суулуу эритмеси
Химиялык тендемелерде формулалардын алдына коэффициент жазылат, ал реакцияга катышкан молекулалардын санын көрсөтөт.
Адатта, химиялык реакция убагында энергия сиңирилип же бөлүнүп чыкса, теңдемеге барабардык жазылат. (Бул реакциянын жылуулук эффекти) 2Mg + O2 = 2MgO + 1203 кДж. Химиялык теңдемени жазууда реакциянын багытын көрсөтүүчу жебе (стрелка) колдонулат: SO2 + H2O ![]() H2SO3
H2SO3
Содержание
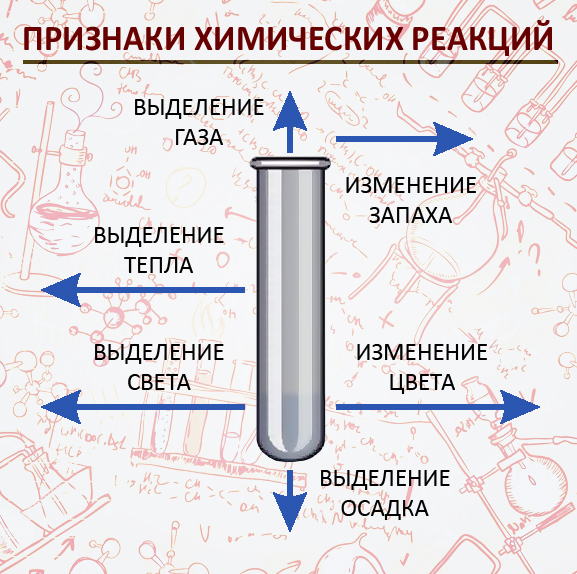
Химиялык реакциялардын белгилери
- Жылуулуктун бөлүнүп чыгышы
Опыт № 54 или (горение костра) - Жарыктын чыгышы
Опыт № 3 (горение серы в кислороде) - Чөкмөнүн чөгүшү
Опыт № 77 (галогены с ионом серебра) - Газдын бөлүнүп чыгышы
Опыт № 37 (медь с конц. азотной кислотой –«лисий хвост») - Өңүнүн өзгөрүшү
Опыт № 75 (хлорид кобальта с гидроксидом натрия – синий цвет) - Жыттын пайда болушу
(гниющий мусор)
Химиялык реакциянын убагында заттарда болгон өзгөрүүлөр реакциянын жүргөндүгүн билдирет жана химиялык реакциянын белгилери болуп саналат.
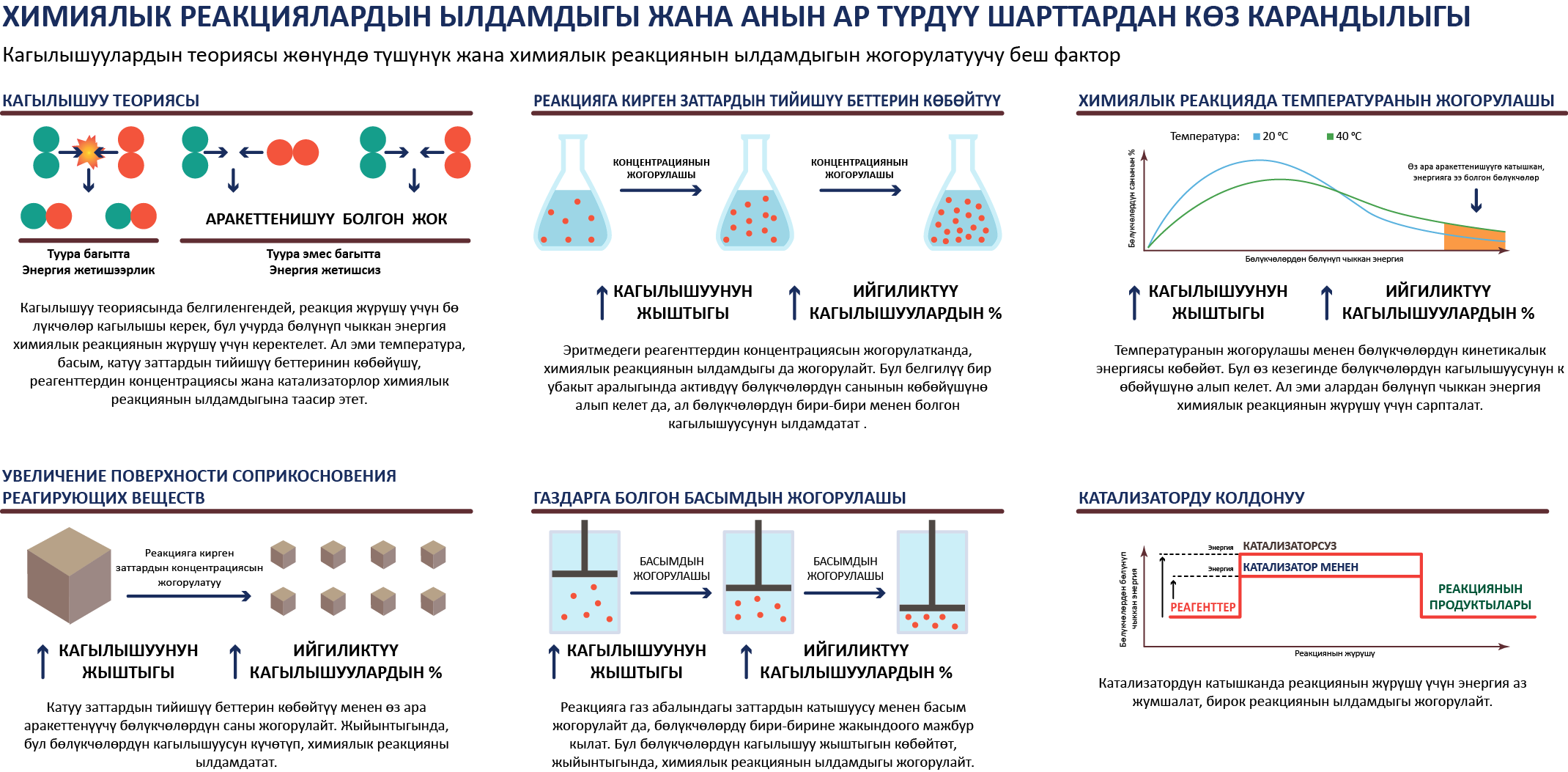
Көпчүлүк заттар бири–бири менен өз алдынча аракеттене алышпайт. Реакциянын жүрүшү үчүн белгилүү бир шарттар түзүлүшү керек.
Химиялык реакциянын жүрүү шарттары
- 1. Майдалоо 2. Аралаштыруу 3. Ысытуу
Заттардын тийишүү беттерин көбөйтүү үчүн аларды майдалашат, газ абалына айландырылат. Кээ бир заттарды сууда эритсек, эритме абалында алар бири–бири менен реакцияга жакшы кирет.
Көпчүлүк убакта бул жетишсиздик кылат, ошондуктан, реакцияга кирген заттарды ысытышат. Жыгачтын чычаласы, темир менен күкүрттүн аралашмасы, жез бөлмө температурасында реакцияга кирбейт, реакциянын жүрүшү үчүн аларды сөссүз ысытуу керек.
Кээ бир учурларда химиялык процесстин жүрүшү үчүн жарык талап кылынат. Дайыма жарыктын таасири астында жүргөн реакциялардын бири катары, баарыбызга белгилүү фотосинтезди белгилесек болот.
Химиялык реакциялардын ылдамдыгы
Химиялык реакциялардын классификациясы
left:20%; top:58%; left:25%; top:88%; left:34%; top:108%; left:48%; top:123%; left:62%; top:108%; left:72%; top:88%; left:76%; top:58%;






Жɵнɵкɵй жана татаал заттардын сандык жана сапаттык курамы ɵзгɵрбɵстɵн жүрүүчү химиялык реакциялар
Аллотропиялык ɵзгɵрүүлɵр жана изомерлешүү
Мисалы: Кычкылтектин озонго айланышы жана изомерлердин пайда болушу.
Бир элементтин бир нече жөнөкөй заттарды пайда кылуусу аллотропия деп аталат.. Аллотропия кубулушу бир эле заттын курамындагы атомдордун саны ар түрдүү болгондо (O2 –кычкылтек, O3 – озон), же кристаллдык торчодогу атомдор ар түрдүү формада болгон учурда пайда болот (алмаз, графит).
3O2 ![]() 2O3
2O3
Изомерлер – бул сапаттык жана сандык курамы бирдей, бирок молекулаларынын түзүлүшү жана касиеттери ар түрдүү болгон заттар.
Кайталанма реакция
Кайталанма жана кайталанбас реакция
Мисалы: суутектин иод менен болгон реакциясы жана аммонийдин дихроматынын ажыроо реакциясы.
Химиялык тең салмактуулукка алып келген реакция кайталанма реакция деп аталат. Кайталанма реакцияларда эки ылдамдыкты белгилөөгө болот: реакциянын продуктысы пайда болгон түз реакциянын ылдамдыгы. Ошондой эле пайда болгон заттар баштапкы заттарга ажыраган – кайталанма реакциянын ылдамдыгы. Качан гана түз жана кайталанма реакциялардын ылдамдыгы бири–бирине барабар болгондо, химиялык тең салмактуулук пайда болот. Бул, убакыт бирдигинде канча молекула ажыраса, ошончо молекула пайда болоорун билдирет.
H2 + I2 ![]() 2HI
2HI
Кайталанбас реакцияларда химиялык реакция бир тараптуу жүрɵт жана реакциянын натыйжасында чɵкмɵ, газ абалындагы зат же суу пайда болот.
(NH4)2Cr2O7 ![]() 2NH3↑ + H2O + 2CrO3
2NH3↑ + H2O + 2CrO3
Жылуулук энергиясы
Экзотермиялык жана эндотермиялык реакциялар
Мисалы: магнийдин күйүү жана сымаптын оксидинин ажыроо реакциялары
Экзотермиялык реакция–жылуулукту бөлүп чыгаруу менен жүргөн реакция. Кошулуу реакцияларынын көпчүлүгү экзотермиялык болуп саналат.
2Мg +O2 ![]() 2МgO + Q
2МgO + Q
Эндотермиялык реакция– жылуулукту сиңирип алуу менен жүргөн реакция. Ажыроо реакцияларынын көпчүлүгү эндотермиялык реакция болуп саналат.
2HgO ![]() 2Hg + O2 – Q
2Hg + O2 – Q
Химиялык реакция убагында бөлүнүп чыккан же сиңирип алынган жылуулуктун саны (Q), реакциянын жылуулук эффекти деп аталат.
Реакцияга кирүүчү заттардын баштапкы абалы
Гомогендүү жана гетерогендүү реакциялар
Мисалы: азоттун кычкылтек менен болгон реакциясы.
Гомогендүү реакция – агрегаттык абалдары бирдей болгон заттардын ортосунда жүргɵн реакция.
Гетерогендүү реакция – ар түрдүү агрегаттык абалдагы заттардын ортосунда болгон реакция. (Гомо – бирдей, гетеро – ар түрдүү).
N2 + O2 ![]() 2NO − Q.
2NO − Q.
Катализатор
Каталитиздик жана катализдик эмес реакциялар
Мисалы: катализатордун таасири астында аммиактын кычкылданышы жана аммиактын суу менен болгон реакциясы.
Каталитиздик реакция – катализатордун таасири астында гана жүргөн химиялык реакция. Реакцияга ар түрдүү катализаторлорду катыштыруу менен ар башка продуктыларды алууга болот.
4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
Катализатор – химиялык реакциянын жүрүшүн ылдамдаткан заттар.
Катализаторлор химиялык реакцияны ылдамдатат, бирок өзү реакцияга катышпайт.
Химиялык реакциянын жүрүшүн акырындаткан катализаторлор ингибиторлор деп аталат.
Катализаторду катыштырбай жүргөн химиялык реакциялар катализдик эмес реакциялар деп аталат.
NH3 + H2O ![]() NH4OH
NH4OH
Окистенүү–калыбына келүү реакциясы
Мисалы: Цинктин туз кислотасы менен болгон реакциясы жана кальций карбонатынын ажыроо реакциясы.
Окистенүү–калыбына келүү реакциясы – окистенүү даражаларынын өзгөрүшү менен жүргөн реакция.
Кошулуу жана алмашуу реакциялары көбүнчө окистенүү–калыбына келүү реакциялары болуп саналат.
Zn + 2HCl ![]() ZnCl2 + H2↑
ZnCl2 + H2↑
Бирок, окистенүү даражасы өзгөрбөй жүргөн да химиялык реакциялар болот.
CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
Реакцияга кирген жана реакциядан алынган заттардын катышы
Кошулуу, ажыроо, сүрүп чыгаруу жана алмашуу реакциялары
Мисалы: Кɵмүрдүн кычкылтекте күйүү реакциясы, суутектин ɵтɵ кычкылынын ажыроо реакциясы, жездин сымаптын нитраты менен болгон реакциясы жана күмүштүн нитратынын натрий хлориди менен болгон реакциясы.
Кошулуу реакциясы – эки же андан көп заттар кошулуп, жаңы затты пайда кылган реакция.
S + O2 ![]() SO2↑
SO2↑
CaO + H2O ![]() Ca(OH)2
Ca(OH)2
CaCO3 + CO2 + H2O ![]() Ca(HCO3)2
Ca(HCO3)2
Ажыроо реакциясы – бир татаал заттан эки же андан көп жөнөкөй же татаал зат пайда болгон реакция.
2HgO ![]() 2Hg + O2↑
2Hg + O2↑
Сu(OH)2 ![]() СuO + H2O
СuO + H2O
2AgNO3 ![]() 2Ag + 2NO2↑ + O2↑
2Ag + 2NO2↑ + O2↑
Сүрүп чыгаруу реакциясы – жөнөкөй жана татаал заттардын ортосунда болуп, жөнөкөй заттын атому татаал заттын атому менен орун алмашкан реакция. Мында, пайда болгон жаңы затта терс электрлүүлүгү жогору болгон атом, терс электрлүүлүгү төмөн болгон атом менен биригет. Ал эми ортодогу терс электрлүүлүктү көрсөткөн атомдор жөнөкөй зат катары бөлүнүп чыгат. Жыйынтыгынды, жаңы татаал жана жаңы жөнөкөй зат пайда болот.
Fe + CuSO4 ![]() FeSO4 + Cu↓
FeSO4 + Cu↓
Zn + 2HCl ![]() ZnCl2 + H2↑
ZnCl2 + H2↑
2KBr + Cl2 ![]() 2KCl + Br2
2KCl + Br2
Алмашуу реакциясы – эки татаал заттын ортосунда болуп, алардын курамдык бөлүктөрү алмашкан реакция. Реакцияга чейин биринчи жазылган бөлүгү, жаңы затта да биринчи болуп жазылат, экинчи жазылган элемент жаңы затта да экинчи болуп жазылат.
AgNO3 + NaCl ![]() AgCl↓ + NaNO3
AgCl↓ + NaNO3
NaOH + HCl ![]() NaCl + H2O
NaCl + H2O
FeCl3 + 3NaOH ![]() Fe(OH)3↓ + 3NaCl
Fe(OH)3↓ + 3NaCl
![]()
Глоссарий
- Аллотропией называется образование разных простых веществ одним элементом. Аллотропия возникает или из–за разного количества атомов в составе вещества (O2 –кислород, O3 – озон), или из–за разного соединения атомов в кристаллическую решетку (алмаз, графит).
- Гомогенными называются реакции, в которых все реагирующие вещества, продукты реакции и катализатор тоже в каталитических реакциях, находятся в одном агрегатном состоянии. Если хотя бы одно из веществ имеет другое агрегатное состояние, то такая реакция называется гетерогенной. (Гомо – одинаковый, гетеро – разный).
- Изомеры – это вещества одинакового качественного и количественного состава, но имеющие разное строение молекул и различные свойства.
- Катализаторами называют вещества, которые влияют на скорость реакции, чаще всего, ускоряя скорость реакции. Катализаторы принимают непосредственное участие в химической реакции, но по окончании реакции высвобождаются.
- Катализаторы, замедляющие скорость химических реакций называются ингибиторами.
- Каталитическими реакциями называются такие реакции, которые идут только в присутствии катализатора. Использование различных катализаторов приводит к получению различных продуктов реакции.
- Количество теплоты, которое выделяется или поглощается при химический реакции, называется тепловым эффектом реакции.
- Окислительно–восстановительными реакциями являются такие реакции, в которых у атомов, входящих в состав молекул, изменяются степени окисления по окончании реакции. Окислительно–восстановительными чаще бывают реакции соединения и замещения.
- Реакцией замещения называется реакция между простым и сложным веществом, при которой атомы простого вещества замещают атомы в сложном веществе по принципу: в новом веществе атомы с наибольшей электроотрицательностью соединяются с атомами с наименьшей электроотрицательностью. Атомы элемента с промежуточной между ними электроотрицательностью высвобождаются в виде простого вещества. В результате образуются новое сложное и новое простое вещества.
- Реакцией обмена называется реакция между двумя сложными веществами при которой они обмениваются своими составными частями. Причем та часть, что стояла первой, в новом веществе будет стоять первой, а та часть, что стояла второй и в новом веществе тоже будет стоять на втором месте.
- Реакцией разложения называется реакция, в результате которой из одного вещества образуется два или нескольких новых веществ.
- Реакцией соединения называется реакция, в результате которой из двух или нескольких веществ образуется одно новое вещество.
- Реакции, приводящие к установлению химического равновесия, называются обратимые. У обратимых реакций две скорости – скорость прямой реакции, приводящая к образованию продукта реакции. И скорость обратной реакции – распад продукта реакции до исходных веществ. Когда скорости прямой и обратной реакций становятся равными, наступает химическое динамическое равновесие. Это означает, что в единицу времени образуется столько молекул, сколько их распадается за это же время.
- У необратимых реакций только одна скорость и они протекают только в одну сторону, если продуктом реакции является осадок, газообразное вещество или вода.
- Химические реакции, которые идут без участия катализаторов называются некаталитическими.
- Экзотермическими реакциями называются реакции, идущие с выделением теплоты. Многие реакции соединения являются экзотермическими реакциями.
- Эндотермическими реакциями называются такие реакции, которые идут с поглощением теплоты Эндотермическими реакциями являются многие реакции разложения.
Пайдалуу шилтемелер
Видеоурок «Качественные реакции в химии». Сайт «Видеоуроки в интернет» (Электронный ресурс). //URL:.https://www.youtube.com/watch?v=pk7UXWVBC9U&t=193s (дата обращения 07.03.18.)
Библиография
- Волков В. А., Вонский Е. В., Кузнецова Г. И. Выдающиеся химики мира. — М.: Высшая школа, 1991. — 656 с. — 100 000 экз. — ISBN 5-06-001568-8. (в пер.)
- Кособаева Б. – Использование компьютера в учебном процессе химии / Текст / Б. Кособаева, Н.Б. Арстанбекова // Абай атындагы Казак Улуттукпедагогикалык университеттинин Хабарши (Вестник) Жаратылыш таануу-география илимдери сериясынын 2012 №2 (32). – 68–71–бб.
- Стартовый эксперимент как форма включенности каждого ученика в учебный процесс / Текст / Б. Кособаева, Син Е.Е. // Химия в школе. – Москва, 2016. – №6.
- Дидактические особенности использования технологии обучения на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №6(48), С.155–160.
- Применение технологии системного усвоения знаний в обучении химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №7(49), С.152–159.
- Реализация межпредметных связей на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №10(52), С.136–139.
- Методологические аспекты обучения в современных условиях. / Текст / Б. Кособаева, Син Е.Е., Жакышова Б.Ш. // Проблемы современной науки и образования. – Иваново, 2016. – №13(55), С.104–108.
- Формирование системы понятий при обучении химии в школе. / Текст / Б. Кособаева, П.Э. Токомбаева // Вестник Кыргызского национального университета имени Ж. Баласагына. – Бишкек, 2017. – Специальный выпуск. С.77–81.
Был одним из инициаторов основания в 1868 г. Русского химического общества (наряду с А. А. Воскресенским, Н. Н. Зининым и Д. И. Менделеевым), был его делопроизводителем (1868—1891) и первым редактором «Журнала РХО» (1869—1900). В марте 1869 г. на заседании Русского химического общества Меншуткин доложил от имени Менделеева его Периодический закон — периодическую систему элементов.
Основное направление работ Меншуткина — исследование скорости химических превращений органических соединений.
Меншуткин обнаружил влияние разбавления на скорость реакции. Эти работы Меншуткина легли в основу классической химической кинетики. В 1886—1889 гг. Меншуткин установил влияние природы растворителя и температуры на процессы образования и разложения аминов и амидов кислот. В 1890 г. установил каталитическое действие растворителей в реакциях этерификации и солеобразования.
Какая масса углекислого газа образуется при сжигании 6 г углерода?
22 г
Какой объем кислорода выделится при разложении 5 г 10% перекиси водорода?
0,175 л
Какова масса осадка, образованного при слиянии раствора содержащего 3.4 грамма нитрата серебра и раствора содержащего 0,585 грамма хлорида натрия?
1, 435 г.
Сколько тепла выделится при горении одного заряда салюта массой 0,6 граммов, если термохимическое уравнение
2Mg + O2 ![]() 2MgO + 1203 кДж?
2MgO + 1203 кДж?
15,05 кДж
Определить практический выход продукта реакции, если из 50 литров аммиака при его каталитическом окислении образовалось 30 литров оксида азота (II).
60 %