Химия: Органикалык эмес бирикмелердин класстары
Версия от 13:15, 12 июня 2018; Admine2 (обсуждение | вклад)

Татаал заттар оксиддерге, негиздерге жана туздарга бɵлүнɵт. Бирикмелердин ар бир классы ɵз кезегинде дагы бир нече түрлɵргɵ бɵлүнɵт.
Оксиддер негизги, амфотердик, туз пайда кылбоочу жана кислоталык оксиддерге бɵлүнɵт.
Гидроксиддер щелочторго (сууда эрүүчү негиздер), негиздерге, амфотердүү негиздерге жана кислоталарга бɵлүнɵт.
Туздар нормалдуу же орто туздар, кычкыл, негиздик, комплекстүү же кош туздар жана аралаш туздарга бɵлүнɵт.
Бардык бирикмелердин активдүүлүгү солдон оңго карай азаят.
Таблицаны пайдалануунун эрежелери:
1) Формулалары ар башка, кызыл жана кɵк түскɵ боёлгон заттардын ортосунда реакция жакшы жүрɵт.
2) Сыя кɵк түскɵ боёлгон заттар формулалары кɵк жана кызыл түскɵ боёлгон заттар менен ɵз ара аракеттенишет.
3) Формулалары бирдей түс менен жазылган заттар ɵз ара аракеттенишпейт.
4) Оксиддер жɵнɵкɵй заттар жана гидроксиддер менен реакцияга кирет, ал эми туздар менен реакцияга кирбейт.
5) Гидроксиддер оксиддер жана туздар менен реакцияга кирет.
6) Туздар гидроксиддер менен гана аракеттенишет.
Жогоруда аталган топтор ɵзүнчɵ ачык тилкелерде белгиленген. Металлдар, металл эместер жана татаал заттар активдүүлүгүнɵ жараша белгилүү бир ирээттүүлүктɵ жайгашкан. Заттардын ортосундагы генетикалык байланыштын белгилүү бир түстɵрдɵ берилиши, кайсы заттардын ɵз ара аракеттенише же аракеттенишпей тургандыгын кɵрсɵтүп турат.
Содержание
Органикалык эмес бирикмелердин классификациясы
H3AlO3 → HAlO2 + H2O; H2ZnO2; H3FeO3 → HFeO2 + H2O;
H3CrO3 → HCrO2 + H2O; H4PbO4 → H2PbO3 + H2O; H4SnO4 → H2O + H2SnO3
Жɵнɵкɵй жана татаал заттар
Бардык химиялык заттар жɵнɵкɵй жана татаал заттарга бɵлүнɵт

Жɵнɵкɵй заттарга бир гана химиялык элементтин атомдорунан турган заттар кирет.
Жɵнɵкɵй заттын курамындагы атомдордун санына же кристаллдык торчолордун түзүлүшүнɵ карата алар ар түрдүү аллотропиялык ɵзгɵрүүлɵрдү пайда кылат (мисалы,О2 – кычкылтек жана О3 – озон; алмаз жана графит).
Эки же андан кɵп химиялык элементтин атомдорунан турган заттар татаал заттар деп аталат.
Эки элементтин ɵз ара аракеттенишүүсүнɵн бинардык бирикмелер пайда болот.Бинардык бирикмелердин аталышы – ид деген мүчɵ менен аяктайт.
Мисалы: Mg3N2 – магний нитриди.
Биз бинардык бирикмелердин ичинен – эң маанилүүсү – оксиддерди карап кɵрɵлү.
Металлдар жана металл эместер
Бардык элементтер шарттуу түрдɵ металлдарга жана металл эместерге бɵлүнɵт.
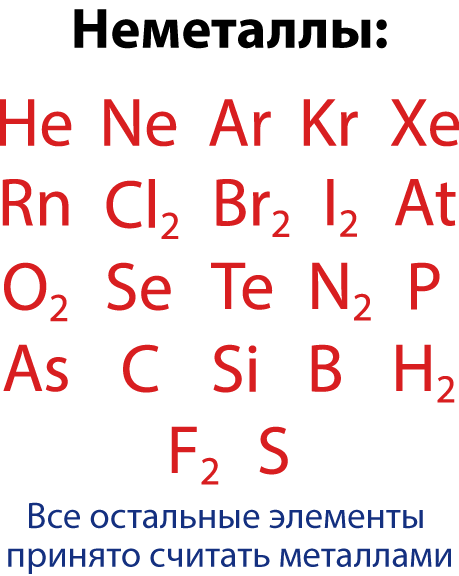
Металлдар – сырткы электрондук катмарындагы 1,2,3 электрондорун башка атомго оңой берген элементтер.
Металл эместер – сырткы электрондук катмарында 4 тɵн кɵп электрону бар элементтер (ошондой эле сырткы электрондук катмарында 3 электрону бар борду кошууга болот).
Бирок, металл эместердин арасында газ абалындагы, молекуласы бир гана атомдон турган элементтердин тобу бар. Алар– инерттүү же асыл газдар болуп саналат (VIII – A группа). Ал эми металлдардын арасында, бирикмелери кислоталык да, негиздик да касиетти алып жүргɵн элементтер бар. Ошондуктан, аларды амфотердүү– «кош касиетке ээ» деп аташат.
(«Амфос» деген сɵздүн уңгусун салыштырсак, – амфора деп, эки кармагычы бар вазаны аташат. Амфибия деп – сууда да, кургакта да дем алган жаныбарларды аташат, мисалы, бака).
Берилген таблицада металлдык касиетке ээ болгон элементтер жана алардын бирикмелери кɵк түс менен белгиленген. Ал эми металл эместик касиетке ээ болгон элементтер жана алардын бирикмелери кызыл түс менен белгиленген. Амфотердүү заттар кош касиетти алып жүргɵндүктɵн, сыя–кɵк түс менен белгиленген, себеби, сыя–кɵк түс кызыл түс менен кɵк түстү аралашмасы.
Оксиддер

Оксиддерди аталышында биринчи элементтин аты , андан соң «оксиди» деген сɵз кошулуп айтылат.
Мисалы: ВаО – барий оксиди.
Оксиддин курамындагы ɵзгɵрмɵлүү валенттүүлүккɵ ээ болгон элементтердин валенттүүлүгү сɵзсүз жазылат, мисалын: СuO – жез оксиди (II) же Cu2O – жез оксиди (I).
Оксиддер 4 топко бɵлүнɵт – туз пайда кылбоочу, негиздик, амфотердик жана кислоталык.
Туз пайда кылбоочу оксиддерге окистенүү даражасы +1 жана +2 болгон металл эместердин оксиддери кирет (H2O, CO, SiO, NO, N2O).
Негиздик оксиддерге окистенүү даражасы +1 жана +2 болгон металлдардын оксиддери кирет (K2O, Na2O, BaO, CaO, MgO, FeO, CrO, MnO, VO, PbO, SnO, CuO). Негиздик оксиддерге негиздер жана сууда эрүүчү негиздер–щелочтор туура келет.
Амфотердүү оксиддерге окистенүү даражасы +3 жана +4 барабар болгон металлдын оксиддери туура келет (Al2O3, ZnO, Fe2O3, Cr2O3, MnO2, V2O3, PbO2, SnO2). Амфотердүү оксиддерге амфотердүү негиздер туура келет.
Кислоталык оксиддерге окистенүү даражасы +3, +4, +5, +6, +7 болгон металл эместердин оксиддери (Cl2O7, SO3, N2O5, P2O5, SO2↑, N2O3, P2O3, CO2↑, SiO2↓).
(Cl, Br, I– окистенүү даражалары +1 барабар) (Cl2O), жана окистенүү даражасы +5, +6, +7 болгон металлдардын оксиддери (CrO3, Mn2O7, V2O5) кирет. Кислоталык оксиддерге кислоталар туура келет.
Туз пайда кылбоочу оксиддер
Алынышы
1) Туз пайда кылбоочу оксиддер металл эместерди окистендирүү жолу менен алынат (кычкылтек аз ɵлчɵмдɵ катышат).
2С + О2 ![]() 2CO
2CO
2) Түз синтездɵɵ аркылуу (реакция абада чагылган болгондо) жүрɵт.
N2 +O2 t=2000→ 2NO — Q
3) Күйүп жаткан кɵмүртек (кɵмүр) аркылуу кɵмүр кычкыл газын өткɵрүүдɵн.
СО2 + С ![]() 2CO
2CO
4) Заттарды термикалык же каталитикалык жол менен ажыратуудан.
НСООН t, H2SO4→ H2O + CO
5) Окистенүү – калыбына келүү реакцияларынын натыйжасында.
3Cu + 8HNO3(суюл) ![]() 3Cu(NO3)2 + 2NO + 4H2O
3Cu(NO3)2 + 2NO + 4H2O
4Mg + 10HNO3(суюл) ![]() 4Mg(NO3)2 + N2O + 5H2O
4Mg(NO3)2 + N2O + 5H2O
Химиялык касиеттери
1) 1) Кадимки температурада суу активдүү металлдар менен реакцияга кирет.
2H2O + 2Na ![]() 2NaOH + H2↑
2NaOH + H2↑
2) Туз пайда кылбоочу оксиддер кычкылтек менен реакцияга кирип, кислоталык оксиддерге чейин кычкылданышат.
2CO + O2 ![]() 2CO2
2CO2
2NO + O2 ![]() 2NO2
2NO2
2SiO + O2 ![]() 2SiO2
2SiO2
3) Кɵмүртектин оксиди (II) менен реакцияга кирип, металлдарды калыбына келтирет.
CO + FeO ![]() Fe + CO2
Fe + CO2
2CO + SnO2 ![]() Sn + 2CO2
Sn + 2CO2
Мүнɵздɵмɵсү
CO – кɵмүртек оксиди (II), ис газы, түссүз, даамсыз, жытсыз, уулуу газ, 0,2% концентрациясы ɵлүмгɵ алып келет. Ал кандагы гемоглобин менен биригип, организм боюнча тарайт. t(кайн) = –192 0С, t(эрүү) = –2030С барабар. Күйүүгɵ жɵндɵмдүү, тамекинин түтүнүндɵ болот.
N2O – азот оксиди (I), «кɵңүл кɵтɵрүүчү газ» – бул сууда жакшы эриген анестезиялык зат, кычкылтек менен болгон аралашмасы хирургиялык операция болоор алдында наркоз катары колдонулат, аны менен дем алганда, адам күлɵ баштайт. Ал жогорку температурада ажырайт:
2N2O ![]() 2N2 +O2 +39 Ккал.
2N2 +O2 +39 Ккал.
NO – азот оксиди (II) – түссүз, жытсыз газ, сууда начар эрийт, абада чагылгандын учкундарынан эндотермиялык реакциянын натыйжасында пайда болгон жалгыз оксид.
N2 + O2 t=2000→ 2NO — Q.
Негиздик оксиддер
Алынышы
1) Металлдарды окистендирүүдөн алынат (ысытуусуз):
2Fe + O2 ![]() 2FeO
2FeO
2) Бир негиздик оксидге активдүү металлды таасир этүү менен башка негиздик оксид алынат:
CuO + Mg ![]() MgO +Cu
MgO +Cu
3) Активдүү металлдар менен калыбына келтирүүдɵн алынат:
Fe2O3 + Mg ![]() 2FeO + MgO
2FeO + MgO
4) Негиздик оксиддер кɵмүртек оксиди менен калыбына келтирүүдɵн алынат:
Fe2O3 + C ![]() 2FeO + CO
2FeO + CO
5) Негиздик оксиддерди кɵмүртек оксиди (II) менен калыбына келтирүүдɵн алынат:
Fe2O3 + CO ![]() 2FeO + CO2
2FeO + CO2
6) Негиздик оксиддер амфотердик оксиддерди суутек менен калыбына келтирүүдɵн алынат:
Fe2O3 + H2 ![]() 2FeO + H2O
2FeO + H2O
7) Кислоталык оксиддер металлдар менен калыбына келтирүүдɵн алынат:
CrO3 + 2Mg ![]() CrO + 2MgO
CrO + 2MgO
8) Кислоталык оксиддерди кɵмүртек менен калыбына келтирүүдɵн алынат:
CrO3 + 2C ![]() CrO + 2CO
CrO + 2CO
9) Кислоталык оксиддерди кɵмүртек оксиди (II) менен калыбына келтирүүдɵн алынат:
CrO3 + 2CO ![]() CrO + 2CO2
CrO + 2CO2
10) Кислоталык оксиддерди суутек менен калыбына келтирүүдɵн алынат:
CrO3 + 2H2 ![]() CrO + 2H2O
CrO + 2H2O
11) Сууда эрибɵɵчү негиздерди ысытып, ажыратуу жолу менен алынат (щелочтордон алууга мүмкүн эмес):
Cu(OH)2 ![]() CuO + H2O
CuO + H2O
12) Газ абалындагы кислоталык оксиддерден пайда болгон туздарды термикалык ажыратуудан алынат:
CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
CuSO3 ![]() CuO + SO2↑
CuO + SO2↑
Негиздик оксиддердин химиялык касиеттери
1) Негиздик оксиддер активдүү металлдар менен реакцияга кирип, калыбына келет:
MgO + Ba ![]() BaO + Mg
BaO + Mg
2) Активдүүлүк катарында суутектен кийин турган металлдардын негиздик оксиддери суутек менен реакцияга кирип, калыбына келет:
CuO + H2 ![]() Cu + H2O
Cu + H2O
Металлдардын активдүүлүк катарында алюминийден кийин турган металлдардын негиздик оксиддери кокс кɵмүрү (C) же кɵмүртек оксиди (II) менен калыбына келет:
FeO + C ![]() Fe + CO↑
Fe + CO↑
SnO + CO ![]() Sn + CO2↑
Sn + CO2↑
Өзгɵрмɵлүү валенттүүлүккɵ ээ болгон металлдардын негиздик оксиддери кычкылтекке чейин калыбына келет.
4FeO + O2 ![]() 2Fe2O3
2Fe2O3
3) Щелочтуу жана щелочтуу жер металлдардын негиздик оксиддери суу менен аракеттенишип, щелочту пайда кылат:
Na2O + H2O ![]() 2NaOH
2NaOH
4) Негиздик оксиддер балкытып эриткенде амфотердик оксиддер менен аракеттенишет:
Na2O + ZnO ![]() Na2ZnO2
Na2ZnO2
5) Негиздик оксиддер кислоталык оксиддер менен реакцияга кирип, туздарды пайда кылат:
CaO + CO2 ![]() CaCO3
CaCO3
6) Негиздик оксиддер кислоталар менен реакцияга кирип, туздарды пайда кылат:
BaO + 2HCl ![]() BaCl2 + H2O
BaCl2 + H2O
7) Негиздик оксиддер амфотердик негиздер менен аракеттенишип, туздарды пайда кылат:
Na2O + Zn(OH)2 ![]() Na2ZnO2 + H2O
Na2ZnO2 + H2O
8) Негиздик оксиддер кычкыл туздарды нейтралдаштырат:
Na2O + 2NaHCO3 ![]() 2Na2CO3 + H2O
2Na2CO3 + H2O
Мүнɵздɵмɵсү
CaO – кальций оксиди, ɵчүрүлбɵгɵн акиташ – ак түстɵгү катуу зат, суу менен жылуулукту бɵлүп чыгаруу менен кубаттуу реакцияга кирет (акиташты ɵчүрɵт), t(эрүү) = 26300С.
CaO + H2O ![]() Сa(OH)2 + Q
Сa(OH)2 + Q
CuO – жез оксиди (II) кара түстɵгү катуу, морт зат,сууда эрибейт, 800 0С жогорку температурада Cu2O – жез оксидин (I), пайда кылуу менен ажырайт, тыгыздыгы –6,45 г/см3 барабар.
Cu2(ОН)2CO3 ![]() CuO + CO2↑ + H2O
CuO + CO2↑ + H2O
Амфотердик оксиддер
Алынышы
1) Амфотердик оксиддер металлдарды окистендирүү жолу менен алынат:
4Al + 3O2 ![]() 2Al2O3
2Al2O3
2) Негиздик оксиддерди металлдар менен окистендирүү аркылуу алууга болот:
4FeO + O2 ![]() 2Fe2O3
2Fe2O3
3) Бир амфотердик оксидге активдүү металлды таасир этүү менен башка амфотердик оксидди алууга болот:
Fe2O3 + 2Al ![]() Al2O3 + 2Fe
Al2O3 + 2Fe
4) Кислоталык оксиддерди калыбына келтирүү менен алынат:
V2O5 + 2H2 ![]() V2O3 + 2H2O
V2O3 + 2H2O
5) Амфотердик негиздерди ысытуу менен ажыратуу менен алууга болот:
Zn(OH)2 ![]() ZnO + H2O
ZnO + H2O
6) Газ абалындагы кислоталык оксиддер менен амфотердик металлдын реакциялашуусунун негизинде пайда болгон туздарды ысытуу менен ажыратуудан да алууга болот:
ZnCO3![]() ZnO + CO2↑
ZnO + CO2↑
7) Амфотердик металлдардан пайда болгон кычкыл туздарды ысытуу менен ажыратуудан алынат:
2Al(HCO3)3 ![]() Al2O3 + 6CO2↑ + 3H2O
Al2O3 + 6CO2↑ + 3H2O
Амфотердик оксиддердин химиялык касиети
1) Амфотердик оксиддерге активдүү металлды таасир эткенде, металлга чейин калыбына келет:
MnO2 + 2Mg ![]() Mn + 2MgO
Mn + 2MgO
2) Активдүүлүк катарында суутектен кийин турган металлдардын амфотердик оксиддери суутек менен реакцияга кирип, негиздик оксидге чейин калыбына келет:
Fe2O3 + H2 ![]() 2FeO + H2O
2FeO + H2O
3) Активдүүлүк катарында алюминийден кийин турган металлдардын амфотердик оксиддери кокс кɵмүрү (С) же кɵмүртек оксиди (II) менен реакцияга кирип, негиздик оксидге чейин калыбына келет:
Fe2O3 + C ![]() 2FeO + CO↑
2FeO + CO↑
2Fe2O3 + 3C ![]() 4Fe + 3CO2↑
4Fe + 3CO2↑
ZnO + CO ![]() Zn + CO2↑
Zn + CO2↑
4) Өзгɵрмɵлүү валенттүү металлдардын амфотердик оксиддери кычкылтектин атому менен аракеттенишип, кислоталык оксидге чейин кычкылданат:
Cr2O3 + 3[О] ![]() 2CrO3
2CrO3
5) Амфотердик оксиддер балкып эригенде негиздик оксиддер менен реакцияга кирип, туздарды пайда кылат:
ZnO + Na2O ![]() Na2ZnO2
Na2ZnO2
CaO + ZnO ![]() СaZnO2
СaZnO2
6 ) Амфотердик оксиддер күчтүү кислоталык оксиддер менен реакцияга кирип, туздарды пайда кылат:
ZnO + N2O5 ![]() Zn(NO3)2
Zn(NO3)2
7) Амфотердик оксиддер негиздер менен реакцияга кирип, тузду жана сууну пайда кылат:
ZnO + Сa(OН)2 ![]() СaZnO2 + H2O
СaZnO2 + H2O
8) Амфотердик оксиддер күчтүү кислоталар менен реакцияга кирип, тузду жана сууну пайда кылат:
ZnO + 2НNO3 ![]() Zn(NO3)2 + H2O
Zn(NO3)2 + H2O
Мүнɵздɵмɵсү
ZnO — цинк оксиди – ак түстɵгү кристаллдык зат, сууда эрибейт, t(эрүү) = 1975 0С барабар. Ак боёкко кошулуучу зат катары колдонулат.
Кислоталык оксиддер
Алынышы
1) Кислоталык оксиддер окистенүү – калыбына келүү реакциясына катышып, металлдын атомардык кычкылтек менен кычкылдануусунан алынат:
Cr + 3[O] ![]() CrO3
CrO3
2) Металл эместин түздɵн–түз окистенүүсүнөн же күйүүсүнɵн алынат:
4P + 5O2 ![]() 2P2O5
2P2O5
3) Туз пайда кылбоочу оксиддерди окистендирүү жолу менен алууга болот:
2CO + O2 ![]() 2CO2
2CO2
4) Негиздик оксиддер атомардык кычкылтек менен окистендирүү аркылуу алынат:
CrO + 2[O] ![]() CrO3
CrO3
5) Кислоталык оксидди амфотердик оксидди атомардык кычкылтек менен окистендирүүдөн алууга болот:
Cr2O3 + 3[O] ![]() 2CrO3
2CrO3
6) Кислоталык оксидди кошумча окистендирүүдөн алынат:
P2O3 + O2 ![]() P2O5
P2O5
7) Газ абалындагы оксиддерден алынган орто туздарды ысытуу менен ажыратуудан алынат:
CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
8) Газ абалындагы оксиддерден пайда болгон кычкыл туздарды ысытуу менен ажыратуудан алынат:
2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
Кислоталык оксиддердин химиялык касиети
1) Кислоталык оксиддер активдүү металлдар менен реакцияга кирет:
SiO2 + 2Mg ![]() 2MgO + Si (аморфтук кремний алынат)
2MgO + Si (аморфтук кремний алынат)
2) Кислоталык оксиддер суутек менен реакцияга кирет:
SiO2 + 2H2 ![]() 2H2O + Si (аморфтук кремний алынат)
2H2O + Si (аморфтук кремний алынат)
3) Кислоталык оксиддер кɵмүртек менен реакцияга кирет:
SiO2 + C ![]() CO2 + Si (кристаллдык кремний алынат, С – кристаллдарды пайда кылуучу зат катары колдонулат)
CO2 + Si (кристаллдык кремний алынат, С – кристаллдарды пайда кылуучу зат катары колдонулат)
4) Кɵмүртек оксиди (II) менен реакцияга кирет:
SiO2 + 2CO ![]() 2CO2 + Si
2CO2 + Si
5) Кислоталык оксиддер кычкылтек менен окистенет:
P2O3 + О2 ![]() P2O5
P2O5
6) Кислоталык оксиддер суу менен реакцияга кирип, кислоталарды пайда кылат:
SO3 + H2O ![]() Н2SO4
Н2SO4
7) Кислоталык оксиддер амфотердик оксиддер менен реакцияга кирип, туздарды пайда кылат:
N2O5 + ZnO ![]() Zn(NO3)2
Zn(NO3)2
8) Щелочтор менен реакцияга кирип, туздарды пайда кылат:
SO2 + NaOH ![]() NaHSO3
NaHSO3
SO2 + 2NaOH ![]() Na2SO3 + H2O
Na2SO3 + H2O
9) Кислоталык оксиддер амфотердик негиздер менен реакцияга кирип, тузду жана сууну пайда кылат:
3N2O5 + 2Al(OH)3 ![]() 2Al(NO3)3 + 3 H2O
2Al(NO3)3 + 3 H2O
10) Газ абалындагы активдүүлүгү жогору болгон кислоталык оксиддер, кислоталардын жана туздардын курамындагы активдүүлүгү тɵмɵн болгон оксиддерди сүрүп чыгарат:
H2CO3 + SO2 ![]() H2SO3 + CO2↑
H2SO3 + CO2↑
Na2CO3 + SO2 ![]() Na2SO3 + CO2↑
Na2SO3 + CO2↑
11) Кислоталык оксиддер негиздик туздарды нейтралдаштырат:
N2O5 + 2Ca(OH)NO3 ![]() 2Ca(NO3)2 + H2O
2Ca(NO3)2 + H2O
Мүнɵздɵмɵсү
SO3 — күкүрт оксиди (IV), күкүрт ангидриди – түссүз, учма суюктук, tэрүү. 16,8 0С барабар, катализаторду катыштырып, күкүрт оксидин SO2 окистендирүү жолу менен алынат, күчтүү окистендирүүчү касиетке ээ.
2SO2 + О2 ![]() 2SO3
2SO3
Р2O5 —ак түстɵгү, гигроскоптуу, порошок сымал зат, 359 0С, газ абалына ɵтɵт, нымдуулукту соруп алуучу каражат катары колдонулат.
Соли
Солями называют сложные химические вещества, состоящие из атомов металлов и кислотных остатков.
Соли бывают средние (нормальные), кислые, основные, двойные, комплексные, смешанные.
Средними или нормальными солями называются соли, в которых полностью замещены все атомы водорода на атомы металлов, а все гидроксильные группы замещены кислотными остатками.
Кислыми солями называют соли, в которых не все атомы водорода из кислот замещены атомами металлов.
Основными солями называются соли, в которых наряду с кислотными остатками сохранились гидроксогруппы группы от оснований.
Двойными солями называются такие, в которых атомы водорода замещены атомами двух разных металлов.
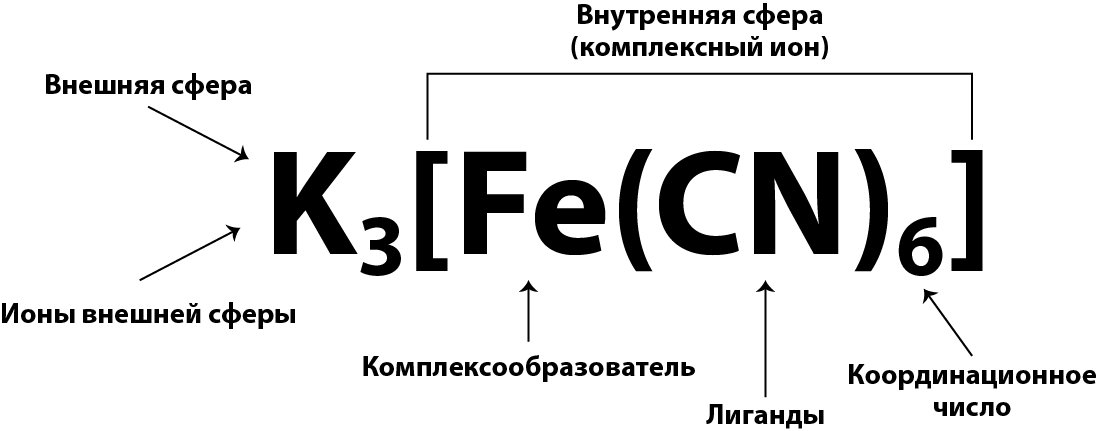
Комплексные соли, имеющие слоистое строение, состоят из центрального атома металла – комплексообразователя, окруженного лигандами – противоположно заряженными ионами по сравнению с комплексообразователем или нейтральными молекулами, что составляет внутреннюю сферу комплексной соли, а следующий слой составляют ионы внешней сферы, противоположно заряженные по отношению к ионам внутренней сферы.
Смешанными солями называют соли, у которых при одном атоме металла находятся два разных кислотных остатка. Ca(OCl)Cl — гипохлоритхлорид кальция (хлорная известь).
Способы получения солей
1) Соли получают методом прямого синтеза в реакции металлов с неметаллами
2Na + Cl2 ![]() 2NaCl
2NaCl
Fe + S ![]() FeS
FeS
2) Соли образуются в реакции взаимодействия металлов с кислотами
Zn + 2HCl ![]() ZnCl2 + H2 ↑
ZnCl2 + H2 ↑
3) Новые соли образуются при реакции солей с более активными металлами
Fe + CuSO4 ![]() FeSO4 + Cu
FeSO4 + Cu
4) Соли образуются при сплавлении основных и амфотерных оксидов
K2O + ZnO ![]() K2ZnO2
K2ZnO2
5) Соли образуются при реакции основных и кислотных оксидов
CaO + CO2 ![]() CaCO3
CaCO3
6) Соли образуются при сплавлении амфотерных и кислотных оксидов
Al2O3 + P2O5 ![]() 2AlPO4
2AlPO4
7)Соли образуются при реакции основных оксидов с кислотами
CuO + H2SO4 ![]() CuSO4 + H2O
CuSO4 + H2O
8) Соли образуются при реакции кислотных оксидов с щелочами, при этом могут образоваться как средние, так и кислые соли
СO2 + NaOH ![]() + NaHСO3
+ NaHСO3
СO2 + 2NaOH ![]() + Na2СO3 + H2O
+ Na2СO3 + H2O
9) Новые соли образуются при реакции более активных газообразных оксидов с солями
SO2 + Na2CO3 ![]() Na2SO3 + CO2↑
Na2SO3 + CO2↑
10) Соли образуются при реакции нейтрализации между основаниями и кислотами, причем продуктами реакции могут быть средние, кислые и основные соли
Ba(OH)2 + H2SO4 ![]() BaSO4↓ + 2H2O
BaSO4↓ + 2H2O
NaOH + H2SO4 ![]() NaHSO4 + H2O
NaHSO4 + H2O
Ba(OH)2 + HCl ![]() Ba(OH)Cl + H2O
Ba(OH)Cl + H2O
11) Новые соли образуются при реакции между основаниями и солями
Ca(OH)2 + 2Na3PO4 ![]() Ca3(PO4)2↓ + 3NaOH
Ca3(PO4)2↓ + 3NaOH
Химические свойства солей
1. Соли взаимодействуют в реакциях замещения с более активными металлами
3K + AlCl3![]() 3KCl + Al
3KCl + Al
Fe + CuSO4 ![]() FeSO4 + Cu
FeSO4 + Cu
2. Соли реагируют с растворимыми основаниями (щелочами) с образованием новой соли и нового основания
2NaOH + CuSO4 ![]() Cu(OH)2 ↓ + Na2(SO4)2
Cu(OH)2 ↓ + Na2(SO4)2
3. Соли реагируют с кислотами с образованием новой соли и новой кислоты.
Na3PO4 + 3HCl ![]() 3NaCl + H3PO4
3NaCl + H3PO4
4. Соли реагируют между собой с образованием новых солей, особенно, если образуется менее диссоциирующее вещество.
BaCl2 + Na2(SO4)2 ![]() BaSO4↓ + 2NaCl
BaSO4↓ + 2NaCl
Солями называют сложные химические вещества, состоящие из атомов металлов и кислотных остатков. Кроме атомов металлов в состав солей может входить ион аммония - вещества, образованного по принципу донорно-акцепторной связи.
Основания
Основаниями называются сложные химические вещества, состоящие из атомов металлов, соединенных с одной или несколькими гидроксильными группами. Различают растворимые и нерастворимые в воде основания. Растворимые основания называются щелочами.
К растворимым основаниям – щелочам относят все основания металлов с валентностью I, а также основания бария, стронция и кальция.
Среди оснований выделяют группу веществ, именующуюся амфотерными (двойственными) основаниями. К амфотерным основаниям относятся основания, где у металлов валентность равна III и IV, а также основание двухвалентного цинка. Все амфотерные основания нерастворимы в воде. Амфотерные основания обладают способностью реагировать как с кислотами, так и с щелочами. Одно и тоже амфотерное основание можно представить в виде Al(OH)3 и H3AlO3. В химических реакциях вещество проявляется в той или иной форме в зависимости от среды, в которой происходит реакция. Если гидроксид алюминия реагирует с кислотой, то выбирается формула Al(OH)3, а при реакции с щелочью формула отражает ортоалюминиевую кислоту H3AlO3. Все амфотерные основания в присутствии щелочей обладают способностью выделять воду [кроме Zn(OH)2], и таким образом проявляются как в орто – так и в метаформе HAlO2 (метаалюминиевая кислота) + H2O, образуя два типа соединений.
Способы получения щелочей и оснований
1. Щелочи получают взаимодействием активных металлов с водой
2Na + 2H2O → 2NaOH + H2↑
2. Щелочи получают взаимодействием оксидов активных металлов с водой
СaO + H2O → Ca(OH)2
3. Нерастворимые в воде основания, в том числе и амфотерные основания, получают в реакциях обмена из солей, действием растворимых щелочей
MgCl2 + 2KOH → Mg(OH)2 ↓ + 2KCl
ZnSO4 + 2NaOH → Zn(OH)2 ↓ + Na2SO4
FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
4. Гидроксиды калия и натрия в больших количествах получают электролизом из водных растворов их солей в виде хлоридов.
2KCl + 2H2O ![]() 2KOH + H2↑ + Cl2↑
2KOH + H2↑ + Cl2↑
Химические свойства оснований
1. Щелочи взаимодействуют с оксидом углорода (II), с образованием формиата щелочного металла.
NaOH + CO ![]() HCOONa
HCOONa
2. Щелочи взаимодействуют с амфотерными оскидами с образованием солей.
2NaOH + ZnO ![]() Na2ZnO2 + H2O
Na2ZnO2 + H2O
6NaOH + Al2O3 ![]() 2Na3AlO3 + 3H2O
2Na3AlO3 + 3H2O
2NaOH + Al2O3 ![]() 2NaAlO2 + H2O (наиболее часто встречающийся вариант реакции)
2NaAlO2 + H2O (наиболее часто встречающийся вариант реакции)
3. Щелочи взаимодействуют с оксидом углорода (IV), с образованием двух видов солей
NaOH + CO2 ![]() NaHCO3
NaHCO3
NaOH + CO2 ![]() Na2CO3 + H2O
Na2CO3 + H2O
4. Щелочи взаимодействуют с амфотерными гидроскидами с образованием солей.
2NaOH + Zn(OH)2 ![]() Na2ZnO2 + 2H2O
Na2ZnO2 + 2H2O
3NaOH + Al(OH)3 ![]() Na3AlO3 + 3H2O
Na3AlO3 + 3H2O
NaOH + Al(OH)3 ![]() NaAlO2 + 2H2O
NaAlO2 + 2H2O
5. Щелочи и нерастворимые основания взаимодействуют с кислотами.
NaOH + HCl ![]() NaCl + H2O
NaCl + H2O
Fe(OH)3 + 3HCl ![]() FeCl3 + 3H2O
FeCl3 + 3H2O
Растворимые щелочи, нерастворимые основания и нерастворимые амфотерные основания при взаимодействии с сильными кислотами переходят в растворимые соли.
Реакция между основаниями и кислотами, в результате которой образуется соль и вода, называется реакцией нейтрализации.
6. В случае неполной нейтрализации основания кислотой, образуются основные соли
Ba(OH)2 + HNO3 ![]() Ba(OH)NO3 + H2O
Ba(OH)NO3 + H2O
7. Щелочи взаимодействуют с солями с образованием новых оснований и новых солей
FeCl3 + 3NaOH ![]() Fe(OH)3↓ + 3NaCl
Fe(OH)3↓ + 3NaCl
CuSO4 + 2KOH ![]() Cu(OH)2↓ + K2SO4
Cu(OH)2↓ + K2SO4
Кислоты
К кислотам относятся сложные химические вещества, состоящие из атомов водорода, способных обмениваться на атомы металлов, и кислотных остатков. Количество атомов водорода, входящих в состав кислоты определяет основность кислоты. По признаку основности кислоты разделяют на одноосновные, двухосновные и многоосновные. По наличию атома кислорода кислоты разделяют на бескислородные (HI, HBr, HCl, HF, H2S↑, HCN) и кислородсодержащие( HClO4, H2SO4, HNO3, H4P2O7, H2SO3↑, H3PO4, HNO2, H2CO3↑).
Способы получения кислот
1) Бинарные бескислородные кислоты можно получить прямым синтезом из неметаллов, одним из которых должен быть водород
H2 + Cl2 ![]() 2HCl
2HCl
H2 + S ![]() H2S
H2S
2) Галогенсодержащие кислоты получают вытеснением менее сильных по электроотрицательности галогенов более сильными галогенами
2HI + Cl2 ![]() 2HCl + I2↓
2HCl + I2↓
3) Кислородсодержащие кислоты получают взаимодействием кислотных оксидов с водой
P2O5 + 3H2O ![]() 2H3PO4
2H3PO4
4) Новые кислоты могут быть получены в реакциях доокисления
2H2SO3 + O2 ![]() 2H2SO4
2H2SO4
5) Кислоты получают вытеснением более активными кислотными оксидами менее активных оксидов (особенно характерно для газообразных кислотных оксидов)
H2CO3 + SO2 ![]() H2SO3 + CO2↑
H2SO3 + CO2↑
6) Кислоты можно получить в реакциях обмена между солями и другими сильными кислотами
Ba(NO3)2 + H2SO4 ![]() BaSO4↓ + 2HNO3
BaSO4↓ + 2HNO3
Химические свойства кислот
1) Кислоты взаимодействуют с активными и амфотерными металлами с выделением водорода
2HCl + Zn ![]() ZnCl2 + H2↑
ZnCl2 + H2↑
H2SO4(разб.) + Mn ![]() MnSO4 + H2↑
MnSO4 + H2↑
2) Концентрированные кислоты, такие как серная и азотная являются сильными окислителями и при реакции с металлами выделяют другие продукты реакции : сернистый газ, сероводород, серу, оксиды азота с различной степенью окисления или аммиак.
3) Для галогенсодержащих бескислородных кислот характерно замещение в кислотах менее активных галогенов более активными галогенами
2HI + Cl2 ![]() 2HCl + I2 ↓
2HCl + I2 ↓
4) Кислоты взаимодействуют с основными оксидами с образованием соли и воды
H2SO4(разб.) + BaO ![]() BaSO4↓ + H2O
BaSO4↓ + H2O
5) Кислоты взаимодействуют с амфотерными оксидами с образованием соли и воды
2HNO3 + ZnO ![]() Zn(NO3)2 + H2O
Zn(NO3)2 + H2O
6) Кислоты способны взаимодействовать с более активными кислотными оксидами с образованием новой кислоты и выделением менее активного кислотного оксида. Особенно хорошо реакция прослеживается с газообразными оксидами
H2CO3 + SO2 ![]() H2SO3 + CO2↑
H2SO3 + CO2↑
7) Кислоты взаимодействуют с основаниями как растворимыми (щелочами), так и нерастворимыми в реакции нейтрализации. Продуктами этих реакций могут быть как средние соли, так и продукты неполной нейтрализации – соли кислые
2NaOH + H2SO4 ![]() Na2SO4 + 2H2O
Na2SO4 + 2H2O
NaOH + H2SO4 ![]() NaHSO4 + H2O
NaHSO4 + H2O
8) Между кислотами происходят оксислительно-восстановительные реакции с изменением степени окисления элементов, входящих в состав этих кислот
H2SO4 + HBr ![]() Br2 + SO2↑ + H2O
Br2 + SO2↑ + H2O
9) При взаимодействии кислот с солями в реакциях обмена образуются как новая кислота, так и новая соль
H2SO4(конц) + Ba(NO3)2 ![]() BaSO4↓ + 2HNO3
BaSO4↓ + 2HNO3
10) Кислоты способны проводить донейтрализацию основных солей с образованием средних солей
Mg(OH)Cl + HCl ![]() MgCl2 + H2O
MgCl2 + H2O
11) Сильные кислоты разлагают соли, содержащие газообразные оксиды
CaSO3 + 2HCl ![]() CaCl2 + SO2↑
CaCl2 + SO2↑
Характеристика некоторых представителей кислот
HNO3 азотная кислота. Это бесцветная жидкость с резким запахом, легко испаряется, tкип = 860С, с водой смешивается в любых соотношениях. Среди всех кислот – эта кислота самый сильный окислитель. При хранении имеет желтую окраску т.к. разлагается с выделением бурого газа – NO2 – оксида азота (IV), растворяющегося в ней. Тлеющая лучина, поднесенная к поверхности концентрированной азотной кислоты, разгорается за счет выделения кислорода.
4HNO3 hv→ 2H2O + 4NO2 + O2↑
Поступаемая в продажу кислота обычно имеет 63% концентрацию и плотность равную 1,4г/см3. При попадании на кожу вызывает сильные ожоги с образованием желтых пятен, так как реагирует с белками. Ее надо смыть большим количеством воды и нейтрализовать раствором соды.
H2SO4 серная кислота – это бесцветная маслянистая жидкость без запаха, t крист +10,50C. Старинное название серной кислоты - олеум, а безводной H2SO4 – купоросное масло. Серная кислота, являясь сильным окислителем, проявляет типичные свойства кислоты. Эта двухосновная кислота диссоциирует ступенчато, образуя кислые и средние соли. Раствор серной кислоты с концентрацией менее 70% называется разбавленным, более 70% - концентрированным. Концентрированная серная кислота при попадании на кожу оставляет сильные ожоги, поэтому при попадании кислоты на кожу надо обильно смыть ее водой и обработать раствором питьевой соды. Избегать попадания серной кислоты в глаза.
HCl соляная кислота – водный раствор хлороводорода, бесцветная жидкость дымящаяся на влажном воздухе, tпл = – 1140С, tкип = - 850С. Получают сжиганием водорода в хлоре и растворением полученного хлороводорода в воде. В поступающей в продажу соляной кислоте массовая доля хлороводорода 37%, при плотности раствора 1,19г/см3. Соляная кислота применяется для получения солей, травления металлов, в пищевой промышленности, медицине, химическом анализе. Входит в состав желудочного сока.
Н3РО4 фосфорная кислота, ортофосфорная кислота. Это – бесцветное кристаллическое вещество, tпл = 420С, трехосновная кислота, однако несильная, хорошо растворима в воде, не ядовита, применяется в пищевой промышленности для приготовления сиропов. В промышленности получают экстракционным методом, обрабатывая фосфориты и апатиты концентрированной серной кислотой.
Ca3(PO4)2 + 3H2SO4 ![]() 3CaSO4↓ + 2H3PO4
3CaSO4↓ + 2H3PO4
Глассарий
- Металлами называют элементы, обладающие способностью легко отдавать имеющиеся у них на внешнем электронном слое 1,2, 3 электрона.
- Неметаллами называют элементы с 4 и более электронами на внешнем электронном слое ( а также бор , у которого 3 электрона на внешнем электронном слое).
- Инертные или благородные газы (VIII – A группа) — это группа элементов, которые являются газами, и молекула которых состоит из одного атома.
- Амфотерными металлами являются такие, соединения которых проявляют как свойства кислоты, так и свойства основания, поэтому их называют «двойственные». (Сравни названия с корнем «амфос» – амфора – ваза с двумя ручками, амфибия – животное, которое дышит и в воде и на воздухе – например, лягушка).
- Простыми веществам называются такие, молекулы которых состоят из атомов одного химического элемента. В зависимости от количества атомов в составе простого вещества или от различного строения кристаллической решетки, простые вещества создают различные аллотропные модификации или аллотропные видоизменения (например О2 – кислород и О3 – озон; алмаз и графит).
- Сложными химическими веществами называют вещества, состоящие из атомов двух или более химических элементов.
- Бинарные соединения.состоят из атомов двух элементов. При наименовании бинарных соединений, их окончание обозначается суффиксом – ид. Например: Mg3N2 – нитрид магния.
- Оксидами называются сложные химические вещества, состоящие из атомов двух элементов, одном из которых является кислород. При наименования оксидов вначале указывается корень слова – окси-, затем добавляется суффикс –ид и называется элемент в родительном падеже. Например: ВаО – оксид бария. Для элементов с переменной валентностью указывается валентность элемента в составе оксида, например: СuO –оксид меди (II) или Cu2O – оксид меди (I).
- Несолеобразующими оксидам и называются оксиды неметаллов со степенью окисления +1 и +2 (H2O, CO, SiO, NO, N2O).
- Основным оксидами называются оксиды металлов со степенью окисления +1 и +2 (K2O, Na2O, BaO, CaO, MgO, FeO, CrO, MnO, VO, PbO, SnO, CuO), (кроме ZnO). Основным оксидам в качестве гидроксида соответствуют основания и растворимые основания – щелочи.
- Амфотерными оксидам называются оксиды металлов со степенью окисления +3 и +4 (Al2O3, Fe2O3, Cr2O3, MnO2, V2O3, PbO2, SnO2 и ZnO). Амфотерыми оксидам в качестве гидроксида соответствуют амфотерные основания.
- Кислотными оксидам называются оксиды неметаллов со степенью окисления +3, +4, +5, +6, +7, (Cl2O7, SO3, N2O5, P2O5, SO2↑, N2O3, P2O3, CO2↑, SiO2↓), (Для Cl, Br, I степень окисления также равна +1) (Cl2O), и оксиды металлов со степенью окисления +5, +6, +7 (CrO3, Mn2O7, V2O5). Кислотным оксидам в качестве гидроксида соответствуют кислоты.
Полезные ссылки
Видеоурок «Качественные реакции в химии». Сайт «Видеоуроки в интернет» (Электронный ресурс). //URL:.https://www.youtube.com/watch?v=pk7UXWVBC9U&t=193s (дата обращения 07.03.18.)
Бибилиография
- Волков В. А., Вонский Е. В., Кузнецова Г. И. Выдающиеся химики мира. — М.: Высшая школа, 1991. — 656 с. — 100 000 экз. — ISBN 5-06-001568-8. (в пер.)
В килограммовом пакете кристаллической или стиральной соды (Na2CO3 • 10H2O) содержится только 370 граммов активного вещества, остальное – кристаллическая вода.
Наибольшее количество NaOH используется для очистки нефти.
Самая высокая кислотность в организме человека наблюдается в желудке, где PH может достигать единицы.
Низкокалорийные угли с месторождения Кара-Кече в Кыргызстане выгоднее переводить в газообразную топливную смесь (CO + H2) обработкой угля водой при нагревании и транспортировать по газопроводу до Бишкека.
C + H2O ![]() CO + H2
CO + H2
Методику можно использовать для получения чистого водорода.
9C + 7H2O + O2 ![]() 9CO + 7H2
9CO + 7H2
При горении угля в воздухе, когда в системе температура поднимается выше 800оС возможно образование соединения углерода с азотом воздуха и получения очень ядовитого газа дициана (CN≡NC)