Химия: Классы неорганических соединений
Версия от 10:52, 11 июня 2018; Admine2 (обсуждение | вклад) (→Характеристика некоторых представителей основных оксидов)

Сложные вещества делятся на оксиды, гидроксиды и соли. Каждый класс соединений, в свою очередь, делится на виды соединений.
Оксиды включают несолеобразующие, основные, амфотерные и кислотные оксиды.
Гидроксиды делятся на щелочи (растворимые основания), основания, амфотерные основания и кислоты.
Соли включают нормальные или средние соли, кислые, основные, комплексные или двойные, и смешанные соли.
Все соединения располагаются в порядке уменьшения их реагирующей способности слева направо.
Для объяснения принципов использования таблицы разработаны правила:
1) Легче всего химические реакции происходят между веществами, формулы которых окрашены в противоположные цвета – синий и красный.
2) Вещества, формулы которых окрашены в фиолетовый цвет, способны реагировать с веществами, формулы которых окрашены как в синий, так и в красный цвет.
3) Вещества, формулы которых окрашены в одинаковый цвет между собой не реагируют.
4) Оксиды реагируют с простыми веществами и гидроксидами и не могут реагировать с солями.
5) Гидроксиды реагируют с оксидами и солями.
6) Соли могут реагировать только с гидроксидами.
Для подтверждения этих правил, все названные группы веществ сгруппированы в широкие полоски. Расположение металлов, неметаллов и сложных веществ в определенном порядке подчиняется свойству активности веществ. Сохранение генетической связи элемента с его соединениями выполненное в цвете, позволяет быстро научить разбираться, какие группы веществ будут реагировать с друг с другом , а какие не будут.
Содержание
Классификация неогранических соединений
H3AlO3 → HAlO2 + H2O; H2ZnO2; H3FeO3 → HFeO2 + H2O;
H3CrO3 → HCrO2 + H2O; H4PbO4 → H2PbO3 + H2O; H4SnO4 → H2O + H2SnO3
Простые и сложные вещества
Все химические вещества делятся на простые и сложные.

К простым веществам относятся те, которые состоят из атомов одного химического элемента.
В зависимости от количества атомов в составе простого вещества или от различного строения кристаллической решетки, простые вещества создают различные аллотропные модификации или аллотропные видоизменения (например О2 – кислород и О3 – озон; алмаз и графит).
Вещества состоящие из атомов двух или более химических элементов называются сложными химическими веществами.
При взаимодействии двух элементов образуются бинарные соединения. При наименовании бинарных соединений, их окончание обозначается суффиксом – ид. Например: Mg3N2 – нитрид магния. Мы подробно рассмотрим наиболее важную группу бинарных соединений – оксиды.
Металлы и неметаллы
Условно все элементы делят на две группы – металлы и неметаллы.
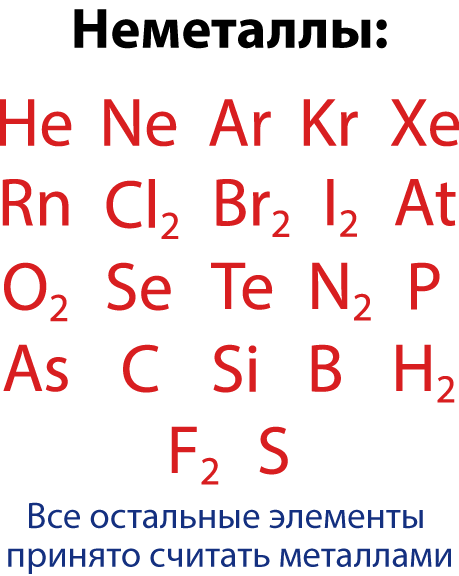
Металлами называют элементы, обладающие способностью легко отдавать имеющиеся у них на внешнем электронном слое 1,2, 3 электрона.
Неметаллами называют элементы с 4 и более электронами на внешнем электронном слое (а также бор , у которого 3 электрона на внешнем электронном слое).
Однако среди неметаллов встречается группа элементов, которые являются газами и молекула который состоит из одного атома – это инертные или благородные газы (VIII – A группа). А среди металлов встречаются такие, соединения которых проявляют как свойства кислоты, так и свойства основания, поэтому их называют амфотерные – т.е. «двойственные».
(Сравни названия с корнем «амфос» - амфора - ваза с двумя ручками, амфибия - животное, которое дышит и в воде и на воздухе – например, лягушка).
В предлагаемой таблице элементы с металлическими свойствами и их соединения обозначены синим цветом. Элементы с неметаллическими свойствами и их соединения обозначены красным цветом. В связи с тем, что амфотерные вещества включают двойственные свойства, они обозначены фиолетовым цветом, так как фиолетовый цвет получается при смешивании красного и синего.Оксиды

При наименовании оксидов вначале указывается корень слова – «окси» –, затем добавляется суффикс – «ид» и называется элемент в родительном падеже. Например: ВаО – оксид бария.
Для элементов с переменной валентностью указывается валентность элемента в составе оксида, например: СuO – оксид меди (II) или Cu2O – оксид меди (I).
Оксиды делятся на 4 группы – несолеобразующие, основные, амфотерные и кислотные.
К несолеобразующим оксидам относятся оксиды неметаллов со степенью окисления +1 и +2 (H2O, CO, SiO, NO, N2O).
К основным оксидам относятся оксиды металлов со степенью окисления +1 и +2 (K2O, Na2O, BaO, CaO, MgO, FeO, CrO, MnO, VO, PbO, SnO, CuO). Основным оксидам в качестве гидроксида соответствуют основания и растворимые основания – щелочи.
К амфотерным оксидам относятся оксиды металлов со степенью окисления +3 и +4 (Al2O3, ZnO, Fe2O3, Cr2O3, MnO2, V2O3, PbO2, SnO2)
Амфотерыми оксидам в качестве гидроксида соответствуют амфотерные основания.
К кислотным оксидам относятся оксиды неметаллов со степенью окисления +3, +4, +5, +6, +7 (по увеличению номера группы в периодической системе); Cl2O7, SO3, N2O5, P2O5, SO2↑, N2O3, P2O3, CO2↑, SiO2↓ (по уменьшению степени активности оксидов слева на право)
(Для Cl, Br, I степень окисления также равна +1) (Cl2O), и оксиды металлов со степенью окисления +5, +6, +7 (CrO3, Mn2O7, V2O5) Кислотным оксидам в качестве гидроксида соответствуют кислоты.
Несолеобразующие оксиды
Способы получения несолеобразующих оксидов
1) Несолеобразующие оксиды получают окислением неметаллов (чаще при недостатке кислорода)
2С + О2 ![]() 2CO
2CO
2) Несолеобразующие оксиды получают прямым синтезом (эндотермическая реакция происходящая в воздухе при разряде молний)
N2 +O2 t=2000→ 2NO — Q
3) Несолеобразующие оксиды получают при пропускании углекислого газа над раскаленным углеродом (углем)
СО2 + С ![]() 2CO
2CO
4) Несолеобразующие оксиды получают при термическом или каталитическом разложении веществ
НСООН t, H2SO4→ H2O + CO
5) Несолеобразующие оксиды получают в окислительно – восстановительных реакциях
3Cu + 8HNO3(разб) ![]() 3Cu(NO3)2 + 2NO + 4H2O
3Cu(NO3)2 + 2NO + 4H2O
4Mg + 10HNO3(разб) ![]() 4Mg(NO3)2 + N2O + 5H2O
4Mg(NO3)2 + N2O + 5H2O
Химические свойства несолеобразующих оксидов
1) При обычной температуре вода реагирует с активными металлами.
2H2O + 2Na ![]() 2NaOH + H2↑
2NaOH + H2↑
2) Несолеобразующие оксиды доокисляются до кислотных оксидов с большей степенью окисления
2CO + O2 ![]() 2CO2
2CO2
2NO + O2 ![]() 2NO2
2NO2
2SiO + O2 ![]() 2SiO2
2SiO2
3) Оксид углерода (II) является хорошим восстановителем для металлов
CO + FeO ![]() Fe + CO2
Fe + CO2
2CO + SnO2 ![]() Sn + 2CO2
Sn + 2CO2
Характеристика некоторых представителей несолеобразующих оксидов
CO – оксид углерода(II), угарный газ, газ без цвета, вкуса, запаха, ядовит, в концентрации 0,2% смертелен, т. к. необратимо связывается с гемоглобином крови. t кип = -192 0С, t пл. = -2030С. Горюч, содержится в табачном дыме.
N2O – оксид азота (I), «веселящий газ» – это анестезирующие вещество, растворимое в воде, тошнотворно-сладкого запаха, в смеси с кислородом употребляется как наркоз перед хирургическими операциями, при вдыхании его бывает стадия смеха, эйфории у больного. При высокой температуре разлагается:
2N2O ![]() 2N2 +O2 +39 Ккал.
2N2 +O2 +39 Ккал.
NO – оксид азота (II) – бесцветный газ, без запаха, малорастворим в воде, единственный оксид, который образуется из воздуха при разрядах молний в эндотермической реакции.
N2 + O2 t=2000→ 2NO — Q.
Основные оксиды
Способы получения основных оксидов
1) Основные оксиды получают при окислении металлов (без нагревания)
2Fe + O2 ![]() 2FeO
2FeO
2) Из одного основного оксида получают другой действием более активного металла
CuO + Mg ![]() MgO +Cu
MgO +Cu
3) Основные оксиды получают частичным восстановлением амфотерных оксидов более активными металлами:
Fe2O3 + Mg ![]() 2FeO + MgO
2FeO + MgO
4) Основные оксиды получают частичным восстановлением амфотерных оксидов углеродом
Fe2O3 + C ![]() 2FeO + CO
2FeO + CO
5) Основные оксиды получают частичным восстановлением амфотерных оксидов оксидом углерода (II)
Fe2O3 + CO ![]() 2FeO + CO2
2FeO + CO2
6) Основные оксиды получают частичным восстановлением амфотерных оксидов водородом
Fe2O3 + H2 ![]() 2FeO + H2O
2FeO + H2O
7) Основные оксиды получают частичным восстановлением кислотных оксидов металлами
CrO3 + 2Mg ![]() CrO + 2MgO
CrO + 2MgO
8) Основные оксиды получают частичным восстановлением кислотных оксидов углеродом
CrO3 + 2C ![]() CrO + 2CO
CrO + 2CO
9) Основные оксиды получают частичным восстановлением кислотных оксидов оксидом углерода (II)
CrO3 + 2CO ![]() CrO + 2CO2
CrO + 2CO2
10) Основные оксиды получают частичным восстановлением кислотных оксидов водородом
CrO3 + 2H2 ![]() CrO + 2H2O
CrO + 2H2O
11) Основный оксид можно получить при термическом разложении нерастворимых оснований (из щелочей нельзя!)
Cu(OH)2 ![]() CuO + H2O
CuO + H2O
12) Основные оксиды можно получить при термическом разложении солей, образованных газообразными кислотными оксидами
CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
CuSO3 ![]() CuO + SO2↑
CuO + SO2↑
Химические свойства основных оксидов
1) Основные оксиды восстанавливаются более активными металлами
MgO + Ba ![]() BaO + Mg
BaO + Mg
2)Основные оксиды металлов, стоящих в ряду активности за водородом, восстанавливаются водородом
CuO + H2 ![]() Cu + H2O
Cu + H2O
Основные оксиды металлов, стоящих в ряду активности за алюминием восстанавливаются коксом ( C ) или оксидом углерода (II)
FeO + C ![]() Fe + CO↑
Fe + CO↑
SnO + CO ![]() Sn + CO2↑
Sn + CO2↑
Основные оксиды металлов с переменной валентностью могут доокисляться кислородом
4FeO + O2 ![]() 2Fe2O3
2Fe2O3
3) Основные оксиды щелочных и щелочеземельных металлов взаимодействуют с водой с образованием щелочей
Na2O + H2O ![]() 2NaOH
2NaOH
4) Основные оксиды взаимодействуют с амфотерными оксидам при сплавлении
Na2O + ZnO ![]() Na2ZnO2
Na2ZnO2
5) Основные оксиды реагируют с кислотными оксидами с образованием солей
CaO + CO2 ![]() CaCO3
CaCO3
6) Основные оксиды реагируют с кислотами с образованием солей
BaO + 2HCl ![]() BaCl2 + H2O
BaCl2 + H2O
7) Основные оксиды реагируют с амфотерными основаниями с образованием солей
Na2O + Zn(OH)2 ![]() Na2ZnO2 + H2O
Na2ZnO2 + H2O
8) Основные оксиды могут донейтрализовывать кислые соли
Na2O + 2NaHCO3 ![]() 2Na2CO3 + H2O
2Na2CO3 + H2O
Характеристика некоторых представителей основных оксидов
CaO – оксид кальция, негашеная известь – белое твердое вещество, легко реагирующее с водой с большим выделением тепла (гашение извести), углекислым газом, tпл = 26300С.
CaO + H2O ![]() Сa(OH)2 + Q
Сa(OH)2 + Q
CuO – Оксид меди (II) твердое хрупкое вещество черного цвета, нерастворимое в воде, при температуре свыше 800 0С разлагается до образования Cu2O – оксида меди (I), плотность 6,45 г/см3.
Получают
Cu2(ОН)2CO3 ![]() CuO + CO2↑ + H2O
CuO + CO2↑ + H2O
Амфотерные оксиды
Способы получения амфотерных оксидов
1) Амфотерные оксиды получают окислением металлов
4Al + 3O2 ![]() 2Al2O3
2Al2O3
2) Амфотерные оксиды получают из основных оксидов доокислением металлов
4FeO + O2 ![]() 2Fe2O3
2Fe2O3
3) Из одного амфотерного оксида получают другой действием более активного металла
Fe2O3 + 2Al ![]() Al2O3 + 2Fe
Al2O3 + 2Fe
4) Амфотерные оксиды получают частичным восстановлением кислотных оксидов
V2O5 + 2H2 ![]() V2O3 + 2H2O
Оксид ванадия(V) Оксид ванадия (III)
V2O3 + 2H2O
Оксид ванадия(V) Оксид ванадия (III)
5) Амфотерные оксиды получают термическим разложением амфотерных оснований
Zn(OH)2ZnO + H2O
6) Амфотерные оксиды получают при термическом разложении солей, образованных газообразными кислотными оксидами и амфотерными металлами
ZnCO3![]() ZnO + CO2↑
ZnO + CO2↑
7) Амфотерные оксиды получают при термическом разложении кислых солей, образованных амфотерными металлами
2Al(HCO3)3Al2O3 + 6CO2↑ + 3H2O
Химические свойства амфотерных оксидов
1) Амфотерные оксиды восстанавливаются до металла более активными металлами
MnO2 + 2Mg ![]() Mn + 2MgO
Mn + 2MgO
2) Амфотерные оксиды металлов, стоящих в ряду активности за водородом, восстанавливаются водородом до основного оксида
Fe2O3 + H2 ![]() 2FeO + H2O
2FeO + H2O
3) Амфотерные оксиды металлов, стоящих в ряду активности за алюминием восстанавливаются до основного оксида или металла коксом (С) или оксидом углерода (II)
Fe2O3 + C ![]() 2FeO + CO↑
2FeO + CO↑
2Fe2O3 + 3C ![]() 4Fe + 3CO2↑
4Fe + 3CO2↑
ZnO + CO ![]() Zn + CO2↑
Zn + CO2↑
4) Амфотерные оксиды металлов с переменной валентностью могут доокисляться до кислотных оксидов только атомарным кислородом
Cr2O3 + 3[О] ![]() 2CrO3
2CrO3
5) Амфотерные оксиды реагируют с основными оксидами при сплавлении с образованием солей
ZnO + Na2O ![]() Na2ZnO2 (Цинкат натрия)
Na2ZnO2 (Цинкат натрия)
CaO + ZnO ![]() СaZnO2 (Цинкат кальция)
СaZnO2 (Цинкат кальция)
6 ) Амфотерные оксиды реагируют с сильными кислотными оксидами с образованием солей
ZnO + N2O5 ![]() Zn(NO3)2 (Нитрат цинка)
Zn(NO3)2 (Нитрат цинка)
7) Амфотерные оксиды реагируют с основаниями с образованием солей и воды
ZnO + Сa(OН)2 ![]() СaZnO2 + H2O (Цинкат кальция)
СaZnO2 + H2O (Цинкат кальция)
8) Амфотерные оксиды реагируют с сильными кислотами с образованием солей и воды
ZnO + 2НNO3 ![]() Zn(NO3)2 + H2O
Нитрат цинка
Zn(NO3)2 + H2O
Нитрат цинка
Характеристика некоторых представителей амфотерны оксидов
ZnO — оксид цинка-белое кристаллическое вещество, практически нерастворимое в воде, tпл = 1975 0С. Употребляется в качестве наполнителя для белой краски и изготовления лекарственных мазей.
Кислотные оксиды
Способы получения кислотных оксидов
1) Кислотный оксид из металла можно получить только при окислении его атомарным кислородом в окислительно-восстановительной реакции
Cr + 3[O] ![]() CrO3
CrO3
2) Кислотный оксид можно получить из неметалла прямым окислением или горением
4P + 5O2 ![]() 2P2O5
2P2O5
3) Кислотный оксид можно получить из несолеобразующего оксида доокислением
2CO + O2 ![]() 2CO2
2CO2
4) Кислотный оксид можно получить из основного оксида доокислением атомарным кислородом
CrO + 2[O] ![]() CrO3
CrO3
5) Кислотный оксид можно получить из амфотерного оксида доокислением атомарным кислородом
Cr2O3 + 3[O] ![]() 2CrO3
2CrO3
6) Кислотный оксид можно получить из кислотного оксида доокислением кислородом
P2O3 + O2 ![]() P2O5
P2O5
7) Кислотный оксид можно получить при термическом разложении средних солей, образованных газообразными оксидами
CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
8) Кислотный оксид можно получить при термическом разложении кислых солей, образованных газообразными оксидами
2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
карбонат натрия
Химические свойства кислотных оксидов
1) Кислотные оксиды реагируют с активными металлами
SiO2 + 2Mg ![]() 2MgO + Si (получается аморфный кремний)
2MgO + Si (получается аморфный кремний)
2) Кислотные оксиды реагируют с водородом
SiO2 + 2H2 ![]() 2H2O + Si (получается аморфный кремний)
2H2O + Si (получается аморфный кремний)
3) Кислотные оксиды реагируют с углеродом
SiO2 + C ![]() CO2 + Si ( получается кристаллический кремний, т.к. С - кристаллическая затравка для образования кристаллов)
CO2 + Si ( получается кристаллический кремний, т.к. С - кристаллическая затравка для образования кристаллов)
4) Кислотные оксиды реагируют с оксидом углерода (II)
SiO2 + 2CO ![]() 2CO2 + Si
2CO2 + Si
5) Кислотные оксиды доокисляются кислородом
P2O3 + О2 ![]() P2O5
P2O5
6) Кислотные оксиды реагируют с водой с образованием кислот
SO3 + H2O ![]() Н2SO4 (серная кислота)
Н2SO4 (серная кислота)
7) Кислотные оксиды реагируют с амфотерными оксидами образованием солей
N2O5 + ZnO ![]() Zn(NO3)2 (Нитрат цинка)
Zn(NO3)2 (Нитрат цинка)
8) Кислотные оксиды реагируют с щелочами с образованием солей
SO2 + NaOH ![]() NaHSO3 (Гидросульфит натрия)
NaHSO3 (Гидросульфит натрия)
SO2 + 2NaOH ![]() Na2SO3 + H2O
Сульфит натрия
Na2SO3 + H2O
Сульфит натрия
9) Кислотные оксиды реагируют с амфотерными основаниями с образованием солей и воды.
3N2O5 + 2Al(OH)3 ![]() 2Al(NO3)3 + 3 H2O
2Al(NO3)3 + 3 H2O
нитрат алюминия
10) Более активные кислотные газообразные оксиды вытесняют менее активные газообразные оксиды из кислот и солей
H2CO3 + SO2 ![]() H2SO3 + CO2↑
H2SO3 + CO2↑
Угольная кислота сернистая кислота
Na2CO3 + SO2 ![]() Na2SO3 + CO2↑
Na2SO3 + CO2↑
Карбонат натрия сульфит натрия
11) Кислотные оксиды донейтрализовывают основные соли.
N2O5 + 2Ca(OH)NO3 ![]() 2Ca(NO3)2 + H2O
2Ca(NO3)2 + H2O
нитрат кальция
Характеристика некоторых представителей кислотных оксидов
SO3 — оксид серы (VI), серный ангидрид – бесцветная летучая жидкость,tпл. 16,8 0С, получают окислением SO2 в присутствии катализатора, проявляет сильные окислительные свойства.
2SO2 + О2 ![]() 2SO3
2SO3
Р2O5 — белое гигроскопичное порошкообразное вещество, возгоняется при 359 0С, применяется как водопоглощающее средство.
Соли
Солями называют сложные химические вещества, состоящие из атомов металлов и кислотных остатков.
Соли бывают средние (нормальные), кислые, основные, двойные, комплексные, смешанные.
Средними или нормальными солями называются соли, в которых полностью замещены все атомы водорода на атомы металлов, а все гидроксильные группы замещены кислотными остатками.
Кислыми солями называют соли, в которых не все атомы водорода из кислот замещены атомами металлов.
Основными солями называются соли, в которых наряду с кислотными остатками сохранились гидроксогруппы группы от оснований.
Двойными солями называются такие, в которых атомы водорода замещены атомами двух разных металлов.
Комплексные соли, имеющие слоистое строение, состоят из центрального атома металла – комплексообразователя, окруженного лигандами – противоположно заряженными ионами по сравнению с комплексообразователем или нейтральными молекулами, что составляет внутреннюю сферу комплексной соли, а следующий слой составляют ионы внешней сферы, противоположно заряженные по отношению к ионам внутренней сферы.
Дать схему строения K3[Fe(CN)6] гексацианоферрат (III) калия
Атом -комплексообразователь лиганды
↑ ↑
K3 [ Fe (CN)6 ]
↓ ↓
Внешняя сфера внутренняя сфера
Смешанными солями называют соли, у которых при одном атоме металла находятся два разных кислотных остатка. Ca(OCl)Cl — гипохлоритхлорид кальция (хлорная известь).
Способы получения солей
1) Соли получают методом прямого синтеза в реакции металлов с неметаллами ![]()
![]()
![]()
![]()
2Na + Cl2 ![]() 2NaCl (Хлорид натрия)
2NaCl (Хлорид натрия)
Fe + S ![]() FeS Сульфид железа (II)
FeS Сульфид железа (II)
2) Соли образуются в реакции взаимодействия металлов с кислотами
Zn + 2HCl ![]() ZnCl2 + H2 ↑
Хлорид цинка
3) Новые соли образуются при реакции солей с более активными металлами
ZnCl2 + H2 ↑
Хлорид цинка
3) Новые соли образуются при реакции солей с более активными металлами
Fe + CuSO4 ![]() FeSO4 + Cu
Сульфат меди Сульфат железа (II)
4) Соли образуются при сплавлении основных и амфотерных оксидов
FeSO4 + Cu
Сульфат меди Сульфат железа (II)
4) Соли образуются при сплавлении основных и амфотерных оксидов
K2O + ZnO ![]() K2ZnO2
Цинкат калия
5) Соли образуются при реакции основных и кислотных оксидов
K2ZnO2
Цинкат калия
5) Соли образуются при реакции основных и кислотных оксидов
CaO + CO2 ![]() CaCO3
Карбонат кальция
6) Соли образуются при сплавлении амфотерных и кислотных оксидов
CaCO3
Карбонат кальция
6) Соли образуются при сплавлении амфотерных и кислотных оксидов
Al2O3 + P2O5 ![]() 2AlPO4
Фосфат алюминия
7)Соли образуются при реакции основных оксидов с кислотами
2AlPO4
Фосфат алюминия
7)Соли образуются при реакции основных оксидов с кислотами
CuO + H2SO4 ![]() CuSO4 + H2O
Сульфат меди
8) Соли образуются при реакции кислотных оксидов с щелочами, при этом могут образоваться как средние, так и кислые соли
CuSO4 + H2O
Сульфат меди
8) Соли образуются при реакции кислотных оксидов с щелочами, при этом могут образоваться как средние, так и кислые соли
СO2 + NaOH ![]() + NaHСO3
Гидрокарбонат натрия
СO2 + 2NaOH
+ NaHСO3
Гидрокарбонат натрия
СO2 + 2NaOH ![]() + Na2СO3 + H2O
Карбонат натрия
9) Новые соли образуются при реакции более активных газообразных оксидов с солями
+ Na2СO3 + H2O
Карбонат натрия
9) Новые соли образуются при реакции более активных газообразных оксидов с солями
SO2 + Na2CO3 ![]() Na2SO3 + CO2↑
Сульфит натрия
10) Соли образуются при реакции нейтрализации между основаниями и кислотами, причем продуктами реакции могут быть средние, кислые и основные соли
Na2SO3 + CO2↑
Сульфит натрия
10) Соли образуются при реакции нейтрализации между основаниями и кислотами, причем продуктами реакции могут быть средние, кислые и основные соли
Ba(OH)2 + H2SO4 ![]() BaSO4↓ + 2H2O
Сульфат бария
NaOH + H2SO4
BaSO4↓ + 2H2O
Сульфат бария
NaOH + H2SO4 ![]() NaHSO4 + H2O
гидросульфат натрия
NaHSO4 + H2O
гидросульфат натрия
Ba(OH)2 + HCl ![]() Ba(OH)Cl + H2O
Ba(OH)Cl + H2O
гидроксохлорид бария
11) Новые соли образуются при реакции между основаниями и солями
Ca(OH)2 + 2Na3PO4 ![]() Ca3(PO4)2↓ + 3NaOH
Фосфат кальция
Ca3(PO4)2↓ + 3NaOH
Фосфат кальция
Химические свойства солей
1. Соли взаимодействуют в реакциях замещения с более активными металлами
3K + AlCl3![]() 3KCl + Al
3KCl + Al
Fe + CuSO4 ![]() FeSO4 + Cu
FeSO4 + Cu
2. Соли реагируют с растворимыми основаниями (щелочами) с образованием новой соли и нового основания
2NaOH + CuSO4 ![]() Cu(OH)2 ↓ + Na2(SO4)2
Cu(OH)2 ↓ + Na2(SO4)2
3. Соли реагируют с кислотами с образованием новой соли и новой кислоты.
Na3PO4 + 3HCl ![]() 3NaCl + H3PO4
3NaCl + H3PO4
4. Соли реагируют между собой с образованием новых солей, особенно, если образуется менее диссоциирующее вещество.
BaCl2 + Na2(SO4)2 ![]() BaSO4↓ + 2NaCl
BaSO4↓ + 2NaCl
Солями называют сложные химические вещества, состоящие из атомов металлов и кислотных остатков. Кроме атомов металлов в состав солей может входить ион аммония - вещества, образованного по принципу донорно-акцепторной связи.
Основания
Основаниями называются сложные химические вещества, состоящие из атомов металлов, соединенных с одной или несколькими гидроксильными группами. Различают растворимые и нерастворимые в воде основания. Растворимые основания называются щелочами.
К растворимым основаниям – щелочам относят все основания металлов с валентностью I, а также основания бария, стронция и кальция.
Среди оснований выделяют группу веществ, именующуюся амфотерными (двойственными) основаниями. К амфотерным основаниям относятся основания, где у металлов валентность равна III и IV, а также основание двухвалентного цинка. Все амфотерные основания нерастворимы в воде. Амфотерные основания обладают способностью реагировать как с кислотами, так и с щелочами. Одно и тоже амфотерное основание можно представить в виде Al(OH)3 и H3AlO3. В химических реакциях вещество проявляется в той или иной форме в зависимости от среды, в которой происходит реакция. Если гидроксид алюминия реагирует с кислотой, то выбирается формула Al(OH)3, а при реакции с щелочью формула отражает ортоалюминиевую кислоту H3AlO3. Все амфотерные основания в присутствии щелочей обладают способностью выделять воду [кроме Zn(OH)2], и таким образом проявляются как в орто – так и в метаформе HAlO2 (метаалюминиевая кислота) + H2O, образуя два типа соединений.
Способы получения щелочей и оснований
1. Щелочи получают взаимодействием активных металлов с водой 2Na + 2H2O → 2NaOH + H2↑ гидроксид натрия
2. Щелочи получают взаимодействием оксидов активных металлов с водой СaO + H2O → Ca(OH)2
3. Нерастворимые в воде основания, в том числе и амфотерные основания, получают в реакциях обмена из солей, действием растворимых щелочей
MgCl2 + 2KOH → Mg(OH)2 ↓ + 2KCl гидроксид магния
ZnSO4 + 2NaOH → Zn(OH)2 ↓ + Na2SO4 гидроксид цинка
FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl гидроксид железа (III)
4. Гидроксиды калия и натрия в больших количествах получают электролизом из водных растворов их солей в виде хлоридов.
2KCl + 2H2O ![]() 2KOH + H2↑ + Cl2↑
2KOH + H2↑ + Cl2↑
Химические свойства оснований
1. Щелочи взаимодействуют с оксидом углорода (II), с образованием формиата щелочного металла.
NaOH + CO ![]() HCOONa формиат натрия
HCOONa формиат натрия
2. Щелочи взаимодействуют с амфотерными оскидами с образованием солей.
2NaOH + ZnO ![]() Na2ZnO2 + H2O цинкат натрия
Na2ZnO2 + H2O цинкат натрия
6NaOH + Al2O3 ![]() 2Na3AlO3 + 3H2O ортоалюминат натрия
2Na3AlO3 + 3H2O ортоалюминат натрия
2NaOH + Al2O3 ![]() 2NaAlO2 + H2O метаалюминат натрия (наиболее часто встречающийся вариант реакции)
2NaAlO2 + H2O метаалюминат натрия (наиболее часто встречающийся вариант реакции)
3. Щелочи взаимодействуют с оксидом углорода (IV), с образованием двух видов солей
NaOH + CO2 ![]() NaHCO3 гидрокарбонат натрия
NaHCO3 гидрокарбонат натрия
NaOH + CO2 ![]() Na2CO3 + H2O карбонат натрия
Na2CO3 + H2O карбонат натрия
4. Щелочи взаимодействуют с амфотерными гидроскидами с образованием солей.
2NaOH + Zn(OH)2 ![]() Na2ZnO2 + 2H2O цинкат натрия
Na2ZnO2 + 2H2O цинкат натрия
3NaOH + Al(OH)3 ![]() Na3AlO3 + 3H2O ортоалюминат натрия
Na3AlO3 + 3H2O ортоалюминат натрия
NaOH + Al(OH)3 ![]() NaAlO2 + 2H2O метаалюминат натрия
NaAlO2 + 2H2O метаалюминат натрия
5. Щелочи и нерастворимые основания взаимодействуют с кислотами.
NaOH + HCl ![]() NaCl + H2O
NaCl + H2O
Fe(OH)3 + 3HCl ![]() FeCl3 + 3H2O
FeCl3 + 3H2O
Растворимые щелочи, нерастворимые основания и нерастворимые амфотерные основания при взаимодействии с сильными кислотами переходят в растворимые соли.
Реакция между основаниями и кислотами, в результате которой образуется соль и вода, называется реакцией нейтрализации.
6. В случае неполной нейтрализации основания кислотой, образуются основные соли
Ba(OH)2 + HNO3 ![]() Ba(OH)NO3 + H2O гидроксонитрат бария
Ba(OH)NO3 + H2O гидроксонитрат бария
7. Щелочи взаимодействуют с солями с образованием новых оснований и новых солей
FeCl3 + 3NaOH ![]() Fe(OH)3↓ + 3NaCl гидроксид железа (III)
Fe(OH)3↓ + 3NaCl гидроксид железа (III)
CuSO4 + 2KOH ![]() Cu(OH)2↓ + K2SO4 гидроксид меди (II)
Cu(OH)2↓ + K2SO4 гидроксид меди (II)
Кислоты
К кислотам относятся сложные химические вещества, состоящие из атомов водорода, способных обмениваться на атомы металлов, и кислотных остатков. Количество атомов водорода, входящих в состав кислоты определяет основность кислоты. По признаку основности кислоты разделяют на одноосновные, двухосновные и многоосновные. По наличию атома кислорода кислоты разделяют на бескислородные (HI, HBr, HCl, HF, H2S↑, HCN) и кислородсодержащие( HClO4, H2SO4, HNO3, H4P2O7, H2SO3↑, H3PO4, HNO2, H2CO3↑).
Способы получения кислот
1) Бинарные бескислородные кислоты можно получить прямым синтезом из неметаллов, одним из которых должен быть водород
H2 + Cl2 ![]() 2HCl
2HCl
H2 + S ![]() H2S
H2S
2) Галогенсодержащие кислоты получают вытеснением менее сильных по электроотрицательности галогенов более сильными галогенами
2HI + Cl2 ![]() 2HCl + I2↓
2HCl + I2↓
3) Кислородсодержащие кислоты получают взаимодействием кислотных оксидов с водой
P2O5 + 3H2O ![]() 2H3PO4
2H3PO4
4) Новые кислоты могут быть получены в реакциях доокисления
2H2SO3 + O2 ![]() 2H2SO4
2H2SO4
5) Кислоты получают вытеснением более активными кислотными оксидами менее активных оксидов (особенно характерно для газообразных кислотных оксидов)
H2CO3 + SO2 ![]() H2SO3 + CO2↑
H2SO3 + CO2↑
6) Кислоты можно получить в реакциях обмена между солями и другими сильными кислотами
Ba(NO3)2 + H2SO4 ![]() BaSO4↓ + 2HNO3
BaSO4↓ + 2HNO3
Химические свойства кислот
1) Кислоты взаимодействуют с активными и амфотерными металлами с выделением водорода
2HCl + Zn ![]() ZnCl2 + H2↑
ZnCl2 + H2↑
H2SO4(разб.) + Mn ![]() MnSO4 + H2↑
MnSO4 + H2↑
2) Концентрированные кислоты, такие как серная и азотная являются сильными окислителями и при реакции с металлами выделяют другие продукты реакции : сернистый газ, сероводород, серу, оксиды азота с различной степенью окисления или аммиак.
3) Для галогенсодержащих бескислородных кислот характерно замещение в кислотах менее активных галогенов более активными галогенами
2HI + Cl2 ![]() 2HCl + I2 ↓
2HCl + I2 ↓
4) Кислоты взаимодействуют с основными оксидами с образованием соли и воды
H2SO4(разб.) + BaO ![]() BaSO4↓ + H2O
BaSO4↓ + H2O
5) Кислоты взаимодействуют с амфотерными оксидами с образованием соли и воды
2HNO3 + ZnO ![]() Zn(NO3)2 + H2O
Zn(NO3)2 + H2O
6) Кислоты способны взаимодействовать с более активными кислотными оксидами с образованием новой кислоты и выделением менее активного кислотного оксида. Особенно хорошо реакция прослеживается с газообразными оксидами
H2CO3 + SO2 ![]() H2SO3 + CO2↑
H2SO3 + CO2↑
7) Кислоты взаимодействуют с основаниями как растворимыми (щелочами), так и нерастворимыми в реакции нейтрализации. Продуктами этих реакций могут быть как средние соли, так и продукты неполной нейтрализации – соли кислые
2NaOH + H2SO4 ![]() Na2SO4 + 2H2O
Na2SO4 + 2H2O
NaOH + H2SO4 ![]() NaHSO4 + H2O
NaHSO4 + H2O
8) Между кислотами происходят оксислительно-восстановительные реакции с изменением степени окисления элементов, входящих в состав этих кислот
H2SO4 + HBr ![]() Br2 + SO2↑ + H2O
Br2 + SO2↑ + H2O
9) При взаимодействии кислот с солями в реакциях обмена образуются как новая кислота, так и новая соль
H2SO4(конц) + Ba(NO3)2 ![]() BaSO4↓ + 2HNO3
BaSO4↓ + 2HNO3
10) Кислоты способны проводить донейтрализацию основных солей с образованием средних солей
Mg(OH)Cl + HCl ![]() MgCl2 + H2O
MgCl2 + H2O
11) Сильные кислоты разлагают соли, содержащие газообразные оксиды
CaSO3 + 2HCl ![]() CaCl2 + SO2↑
CaCl2 + SO2↑
Характеристика некоторых представителей кислот
HNO3 азотная кислота. Это бесцветная жидкость с резким запахом, легко испаряется, tкип = 860С, с водой смешивается в любых соотношениях. Среди всех кислот – эта кислота самый сильный окислитель. При хранении имеет желтую окраску т.к. разлагается с выделением бурого газа – NO2 – оксида азота (IV), растворяющегося в ней. Тлеющая лучина, поднесенная к поверхности концентрированной азотной кислоты, разгорается за счет выделения кислорода.
4HNO3 hv→ 2H2O + 4NO2 + O2↑
Поступаемая в продажу кислота обычно имеет 63% концентрацию и плотность равную 1,4г/см3. При попадании на кожу вызывает сильные ожоги с образованием желтых пятен, так как реагирует с белками. Ее надо смыть большим количеством воды и нейтрализовать раствором соды.
H2SO4 серная кислота – это бесцветная маслянистая жидкость без запаха, t крист +10,50C. Старинное название серной кислоты - олеум, а безводной H2SO4 – купоросное масло. Серная кислота, являясь сильным окислителем, проявляет типичные свойства кислоты. Эта двухосновная кислота диссоциирует ступенчато, образуя кислые и средние соли. Раствор серной кислоты с концентрацией менее 70% называется разбавленным, более 70% - концентрированным. Концентрированная серная кислота при попадании на кожу оставляет сильные ожоги, поэтому при попадании кислоты на кожу надо обильно смыть ее водой и обработать раствором питьевой соды. Избегать попадания серной кислоты в глаза.
HCl соляная кислота – водный раствор хлороводорода, бесцветная жидкость дымящаяся на влажном воздухе, tпл = – 1140С, tкип = - 850С. Получают сжиганием водорода в хлоре и растворением полученного хлороводорода в воде. В поступающей в продажу соляной кислоте массовая доля хлороводорода 37%, при плотности раствора 1,19г/см3. Соляная кислота применяется для получения солей, травления металлов, в пищевой промышленности, медицине, химическом анализе. Входит в состав желудочного сока.
Н3РО4 фосфорная кислота, ортофосфорная кислота. Это – бесцветное кристаллическое вещество, tпл = 420С, трехосновная кислота, однако несильная, хорошо растворима в воде, не ядовита, применяется в пищевой промышленности для приготовления сиропов. В промышленности получают экстракционным методом, обрабатывая фосфориты и апатиты концентрированной серной кислотой.
Ca3(PO4)2 + 3H2SO4 ![]() 3CaSO4↓ + 2H3PO4
3CaSO4↓ + 2H3PO4
Глассарий
- Металлами называют элементы, обладающие способностью легко отдавать имеющиеся у них на внешнем электронном слое 1,2, 3 электрона.
- Неметаллами называют элементы с 4 и более электронами на внешнем электронном слое ( а также бор , у которого 3 электрона на внешнем электронном слое).
- Инертные или благородные газы (VIII – A группа) — это группа элементов, которые являются газами, и молекула которых состоит из одного атома.
- Амфотерными металлами являются такие, соединения которых проявляют как свойства кислоты, так и свойства основания, поэтому их называют «двойственные». (Сравни названия с корнем «амфос» – амфора – ваза с двумя ручками, амфибия – животное, которое дышит и в воде и на воздухе – например, лягушка).
- Простыми веществам называются такие, молекулы которых состоят из атомов одного химического элемента. В зависимости от количества атомов в составе простого вещества или от различного строения кристаллической решетки, простые вещества создают различные аллотропные модификации или аллотропные видоизменения (например О2 – кислород и О3 – озон; алмаз и графит).
- Сложными химическими веществами называют вещества, состоящие из атомов двух или более химических элементов.
- Бинарные соединения.состоят из атомов двух элементов. При наименовании бинарных соединений, их окончание обозначается суффиксом – ид. Например: Mg3N2 – нитрид магния.
- Оксидами называются сложные химические вещества, состоящие из атомов двух элементов, одном из которых является кислород. При наименования оксидов вначале указывается корень слова – окси-, затем добавляется суффикс –ид и называется элемент в родительном падеже. Например: ВаО – оксид бария. Для элементов с переменной валентностью указывается валентность элемента в составе оксида, например: СuO –оксид меди (II) или Cu2O – оксид меди (I).
- Несолеобразующими оксидам и называются оксиды неметаллов со степенью окисления +1 и +2 (H2O, CO, SiO, NO, N2O).
- Основным оксидами называются оксиды металлов со степенью окисления +1 и +2 (K2O, Na2O, BaO, CaO, MgO, FeO, CrO, MnO, VO, PbO, SnO, CuO), (кроме ZnO). Основным оксидам в качестве гидроксида соответствуют основания и растворимые основания – щелочи.
- Амфотерными оксидам называются оксиды металлов со степенью окисления +3 и +4 (Al2O3, Fe2O3, Cr2O3, MnO2, V2O3, PbO2, SnO2 и ZnO). Амфотерыми оксидам в качестве гидроксида соответствуют амфотерные основания.
- Кислотными оксидам называются оксиды неметаллов со степенью окисления +3, +4, +5, +6, +7, (Cl2O7, SO3, N2O5, P2O5, SO2↑, N2O3, P2O3, CO2↑, SiO2↓), (Для Cl, Br, I степень окисления также равна +1) (Cl2O), и оксиды металлов со степенью окисления +5, +6, +7 (CrO3, Mn2O7, V2O5). Кислотным оксидам в качестве гидроксида соответствуют кислоты.
Полезные ссылки
Видеоурок «Качественные реакции в химии». Сайт «Видеоуроки в интернет» (Электронный ресурс). //URL:.https://www.youtube.com/watch?v=pk7UXWVBC9U&t=193s (дата обращения 07.03.18.)
Бибилиография
- Волков В. А., Вонский Е. В., Кузнецова Г. И. Выдающиеся химики мира. — М.: Высшая школа, 1991. — 656 с. — 100 000 экз. — ISBN 5-06-001568-8. (в пер.)
В килограммовом пакете кристаллической или стиральной соды (Na2CO3 • 10H2O) содержится только 370 граммов активного вещества, остальное – кристаллическая вода.
Наибольшее количество NaOH используется для очистки нефти.
Самая высокая кислотность в организме человека наблюдается в желудке, где PH может достигать единицы.
Низкокалорийные угли с месторождения Кара-Кече в Кыргызстане выгоднее переводить в газообразную топливную смесь (CO + H2) обработкой угля водой при нагревании и транспортировать по газопроводу до Бишкека.
C + H2O ![]() CO + H2
CO + H2
Методику можно использовать для получения чистого водорода.
9C + 7H2O + O2 ![]() 9CO + 7H2
9CO + 7H2
При горении угля в воздухе, когда в системе температура поднимается выше 800оС возможно образование соединения углерода с азотом воздуха и получения очень ядовитого газа дициана (CN≡NC)












