Химия: Химиялык байланыштар
Версия от 13:12, 3 мая 2018; Admine2 (обсуждение | вклад)
Химиялык байланыштын түрлөрү Кристаллдык торчолор
Содержание
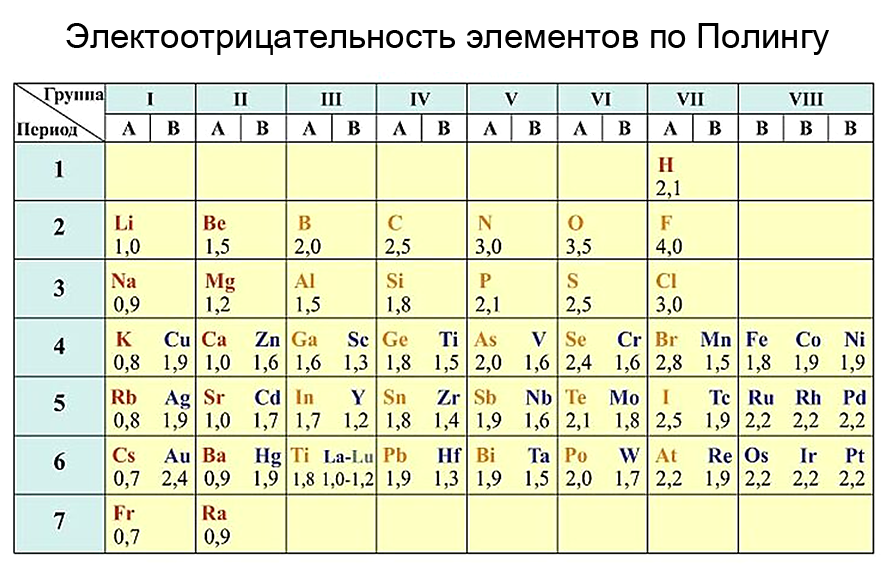
Химиялык элементтердин терс электрлүүлүгү
Электрондук катмарлары толуп бүтө элек бардык атомдор химиялык байланышты түзүүгө жөндөмдүү болушат. Эгерде байланышты түзүүгө ар башка химиялык элементтин атомдору катышса, анда электрондук жуптар бирөөсүнүн атомун көздөй жылышкан абалда болот. Химиялык байланышты түзүүдө, электрондук жупту өзүнө тартып алуу касиети–терс электрдүүлүк деп аталат.
Терс электрдүүлүк – бул атомдун химиялык касиети, б.а. атомдордун башка элементтин электрондорун өзүнө тартып алуу жөндөмдүүлүгү. Атомдордун терс электрлүүлүгү жөнүндөгү түшүнүк америкалык химик Л. Полинг тарабынан берилген.
Атомдун түзүлүш теориясы боюнча, элементтердин металлдарга жана металл эместерге таандык болушу, химиялык реакция убагында алардын атомунун электрондорун берүү же кошуп алуу жөндөмдүүлүгүнө жараша болот.
Атомдору электрондорун оңой берген элементтер күчтүү металлдык касиетке ээ болушат. Алардын терс электрлүүлүгү төмөн болот (χ ≤ 1). Ал эми атомдору электрондорду өзүнө оңой кошуп алган элементтердин металл эместик касиети күчтүү болот.
Группаларда электрондук катмарлардын санынын өсүшү менен элементтердин терс электрлүүлүгү төмөндөйт, б.а.жогортон төмөн карай элементтердин терс электрлүүлүгү азаят. Эң жогорку терс электрлүүлүктү көрсөткөн элемент фтор (F), ал эми төмөнкү терс электрлүүлүктү көрсөткөн элемент франций (Fr) болуп саналат. Мезгилдерде жана группаларда жайгашкан элементтердин терс электрлүүлүгүн салыштыруу үчүн терс электрлүүлүктүн шкаласы пайдаланылат.
Эң кеңири таралган шкаланы белгилүү америкалык химик Л. Полинг түзгөн.
Атомдо электрондук жуптардын жылышынын натыйжасында,электрондорду өзүнө тартып алган атом бир аз терс заряддалат, ал эми электрондорун берген атом бир аз оң зарядга ээ болот. Эгерде электрондордун жылышын толук өттү деп эсептесек, анда электронун берген атом оң заряддалат, ал эми электронду тартып алган атом терс зарядга ээ болот. Берилген элементтин башка элементтин атомуна берген же кошуп алган электрондордун саны кычкылдануу даражасы деп аталат.
Химиялык байланыш
1. Сырткы энергетикалык денгээли 8 электронго чейин толгон атомдун абалы туруктуу болуп саналат (Н, Не – 2 электронго чейин).
2. VIII A группанын атомдорунун сырткы деңгээли толуп бүткөн.
Химиялык байланыштын түзүлүшүнүн негизги себеби – байланыштын пайда болуу процессинде сыртка энергиянын бөлүнүп чыгышы жана пайда болгон молекуланын туруктуулугунун жогорулашы болуп саналат.
4. Атомдогу электрон менен ядронун аракеттенүүсү энергиянын азайышына алып келет, энергия канчалык аз болсо, атом ошончолук туруктуу болот.
5. Атомдордун сырткы деңгээлдерин толтуруунун жолдору:
• жалпы электрондук жуптардын пайда болушу
• электрондорду берүү же кошуп алуу
Химиялык байланыштын түрлөрү
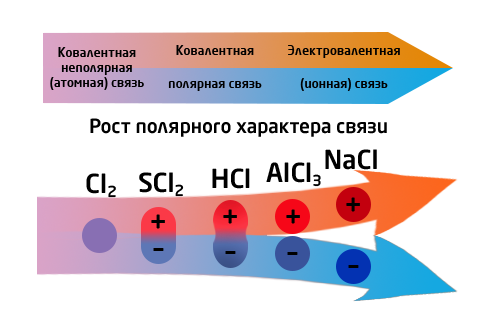
1. Иондук (∆ЭО > 1,7) байланыш – иондордун ортосундагы электростатикалык тартылуу күчүнөн келип чыккан байланыш (иондорду берүү же кошуп алуу). Мещ – О, Г, S; Мещз – О, Г, S.
2. Коваленттик (∆ЭО = 0 – 1,7) байланыш – жалпы электрондук жуптардын пайда болушунан келип чыккан байланыш.
- уюлсуз(∆ЭО = 0) – металл эместердин бир түрдүү атомдорунун ортосундагы байланыш.
- уюлдуу(0<∆ЭО<1,7) – металл эместердин ар түрдүү атомдорунун ортосундагы же металл эмес менен активдүүлүгү төмөн болгон металл менен болгон байланыш (AlCl3).
3. Металлдык байланыш – металлдын кристаллдык торчосунун түйүндөрүндө жайгашкан атомдорду же иондорду валенттик электрондор байланыштырып турат. Бул металлдардагы жана куймалардагы байланыш (болжол менен коваленттик байланыштан 3–4 эсе начар).
4. Суутектик байланыш – суутектин атому менен терс электрлүүлүгү күчтүү болгон элементтин ортосундагы байланыш F, O, N, Cl. (болжол менен коваленттик байланыштан 15–20 эсе начар).
- молекула ичиндеги байланыш – белки, полипептиды
- молекула ортосундагы байланыш – суу, спирт, аммиак, аминокислоталар ж.б.
Коваленттик байланыш
Электрондордун өз ара аракеттенүүсүнөн жалпы электрондук жуптардын пайда болушунан келип чыккан байланыш.
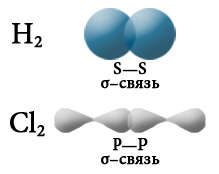
Эгерде бири–бири менен аракеттенишкен атомдордун терс электрдүүлүгү бирдей болсо, анда жалпы электрондук жуп эки атом үчүн бирдей болот, б.а. эки атомго тең бирдей аралыкта жайгашат. Мындай коваленттик байланыш уюлсуз коваленттик байланыш деп аталат. Ал жөнөкөй заттарда– металл эместерде: H2, О2, N2, Cl2, P4, O3 болот.:
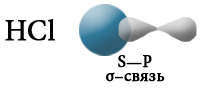
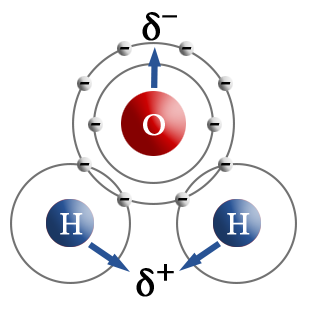
Терс электрдүүлүгү ар түрдүү болгон атомдор өз ара аракеттенгенде, мисалы, суутек менен хлор, жалпы электрондук жуп терс электлүүлүгү жогору болгон атомду карай жылышат, б.а. хлорду көздөй жылат.
Хлордун атому терс заряддалат, ал эми суутектин атому оң заряддалат. Мындай байланыш уюлдуу коваленттик байланыш деп аталат.
Бир эле молекулада оң жана терс уюлу болсо, ал диполь деп аталат. Уюлдуу байланыш терс электрлүүлүгү өтө айрымаланбаган, бирок ар башка атомдордун ортосунда, мисалы, металл эместердин ортосунда болот. Уюлдуу коваленттик байланыш менен байланышкан бирикмелерге металл эместердин ортосундагы жана алардын атомундагы иондордун (NO3–, CH3COO–). Ортосундагы байланышты мисал келтирсек болот. Уюлдук коваленттик бирикмелер органикалык заттардын арасында өзгөчө көп кездешет.
Коваленттик байланыштын мүнөздөмөсү
Коваленттик байланыштын уюлдуулугу ядронун айланасында электрондук булуттардын жылышуусун көрсөтүп турат.
Байланыштын уюлдуулугу байланышты түзгөн атомдордун түрлөрүнөн жана заряддардан көз каранды болот. Органикалык химияда заряддар +δ жана –δ деп белгиленет. Байланыштын уюлдуулугу реакциянын жүрүшү үчүн чон мааниге ээ болот. Уюлсуз байланыш терс электрлүүлүгү бирдей болго атомдордун ортосунда түзүлөт. Уюлсуз байланышкан молекулаларда байланыштын диполу нөлгө барабар болот. Бири–бири менен байланышкан элементтердин терс электрлүүлүктөрү кескин айрымаланса, байланыш ошончо уюлдуу болот.
----
Электрондук булуттардын капталышына карата коваленттик байланыш σ– жана π– байланыштарына бөлүнөт.
«σ» жана «π» грек тамгалары σ– жана π– байланыштарын түзгөн, атомдун орбиталынын формасын билдирген «s жана р» деген латын тамгаларына туура келет. σ– байланышы s–s, s–p же р–р багытында электрондук орбиталдарынын капталышып, жалпы электрондук жуптун (жалпы электрондук тыгыздык) пайда болушунан түзүлөт.
Байланыштын бул түрү жөнөкөй органикалык эмес бирикмелерге мүнөздүү болот.
Байланыштын багыттуулугу заттын жана алардын молекуласынын мейкиндиктеги түзүлүшүн аныктайт.
Молекуланын формасы байланышты түзүүгө катышкан электрондук булуттардын тибинен, о.э. болүнбөгөн электрондук жуптардын болушуна байланыштуу болот. Мисалы, көмүр кычкыл газынын СО2 молекуласы сызыктуу түрдө болот (бөлүнбөгөн электрондук жуптар болбойт), ал эми суунун Н2О жана күкүрттүн оксидинин SO2 молекулалары – үч бурчтук түрүндө болот (бөлүнбөгөн электрондук жуптары болот).
Коваленттик байланыштын касиети
1. Узундук – ядролордун ортосундагы аралык
2. Энергия – химиялык байланыш түзүлгөндө бөлүнүп чыккан же байланыш бузулганда сиңирип алынган энергия.
Байланыштын санынын көбөйүшү менен энергия көбөйөт, байланыш узундугу азаят жана химиялык активдүүлүк төмөндөйт:
| F – F | O = O | N ≡ N | C ≡ O Одна из трёх связей О по донорно-акцепторному механизму |
| 155 кДж/моль | 498 кДж/моль | 946 кДж/моль | 1065 кДж/моль |
3. Каныккандыгы – атомдун чектелген гана сандагы байланышты пайда кылуу жөндөмдүүлүгүн мүнөздөйт:
Мисалы, суутек дайыма бир валенттүү болот; азот аммиактын молекуласында NH3 үч валенттүү жана аммоний ионунда NH4+ төрт валенттүү болот (азоттун атомунун донор–акцептор механизми боюнча байланыш түзүүдө бөлүнбөгөн электрондук жуптун катышкандыгына байланыштуу мүмкүнчүлүктөрү кенейет).
4. Багыттуулук – молекуланын мейкиндиктеги формасын билдирет.
Электрондук булуттар капталышканда пайда болгон коваленттик байланыш атомдордун борборун туташтыруучу бир түз сызыкта жайгашса, σ байланышы түзүлөт.
Иондук байланыш
Байланышка катышкан элементтердин терс электрлүүлүгү(>2), өтө айрымалангандыктан, бирөө экинчисинин электрондорун өзүнө тартып алып, терс заряддалган ионго (анион), экинчиси электронун берип, оң заряддалган ионго (катион) айланат.
Эсиңе тут! Иондук байланыш металлдардын жана металл эместердин атомдорунун ортосунда түзүлөт.
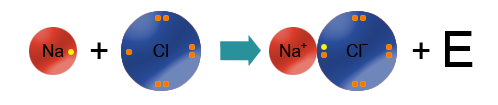
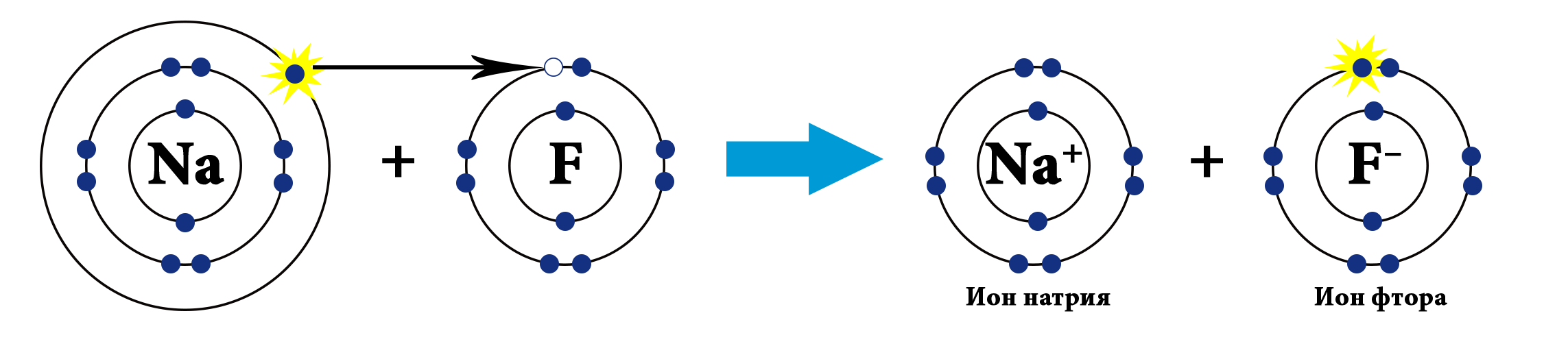
Мисалы, сүрөттө натрийдин жана фтордун атомдору көрсөтүлгөн.Натрий – щелочтуу металл, IA – группанын өкүлү, 1 гана валенттик электрону бар жана калыбына келтирүүчүлүк касиетке ээ (Полингдин терс электрлүүлүк шкаласы боюнча χ(Na)=0,98) барабар). Фтор – галогендердин өкүлү (VIIA группа), 7 валенттик электрондору бар, күчтүү кычкылдандыргыч болуп саналат (χ(F)=4,0). Фтордун терс электрлүүлүгү жогору болгондуктан, натрийдин атомунун валенттик электронун «тартып алат» да анионго, натрийдин атому катионго айланат.
Иондук байланыш ар түрдүү заряддалган бөлүкчөлөрдүн: катиондордун жана аниондордун электростатикалык күчтөр менен тартылуусунан пайда болот.
Иондук байланыштын мүнөздөмөсү
Коваленттик байланыштан айрымаланып, иондук байланыштын багыты болбойт. Мейкиндиктеги иондордун бири–бири менен аракеттенүүсү багыттан көз каранды болбойт,мисалы, ар бир анион өзүнө бир нече катиондорду тарта алат.
Толугу менен иондук болгон байланыш болбойт.Байланыштын «иондуулугу» же байланыштын иондук мүнөзү деп айтуу туурараак болот. Эгерде элементтердин терс электрлүүлүгүнүн (ТЭ) айрымасы 2 ден көп болсо (мисалы, щелочтуу металлдар жана галогендер), анда терс электрлүүлүгү жогору болгон элемент электронду тартып алат да, тиешелүү иондорду пайда кылат.
Иондук байланыштын пайда болуу механизми
Металл эместин атому металлдын атомунун сырткы катмарындагы электрондорун тартып алат да анионго (терс заряддалган ион) айланат. Металлдын атому электрондорун берет да катионго (оң заряддалган ион) айланат. Иондор бири–бири менен электростатикалык күчтөр менен байланышкан. Бул учурда атомдор валенттик электрондорун толук берет (же алат), булуттардын капталышы, жалпы электрондук жуптардын пайда болгондугу байкалбайт.
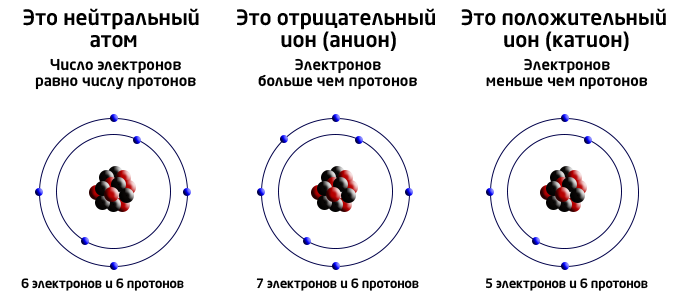
- Ио́н (байыркы грек. ἰόν – «басат») – протондорунун жалпы саны электрондордун жалпы санына эквиваленттүү болбогон бөлүкчө.
- Иондордун аталышы
Натрийдин фторидинин NaF – ис молекуласынын түзүлүшүнүн механизмин карап көрөлү:
| Электронная схема образования молекулы NaF | |
|---|---|
| Na +11)2ē)8ē)1ē |
|
| F +9)2ē)7ē |
|
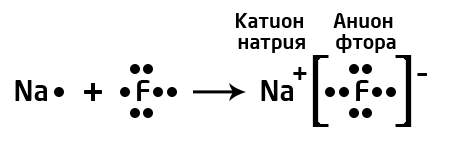
Байланыштын түзүлүшү менен, электрондук жуптар фтордун атомун көздөй жылат, натрийдин жана фтордун карама–каршы заряддалган иондору электростатикалык күчтөрдүн таасири менен тартылат.
-
• Натрий хлоридинин пайда болуу механизми:
-
Коваленттик жана иондук байланыштарды салыштыруу
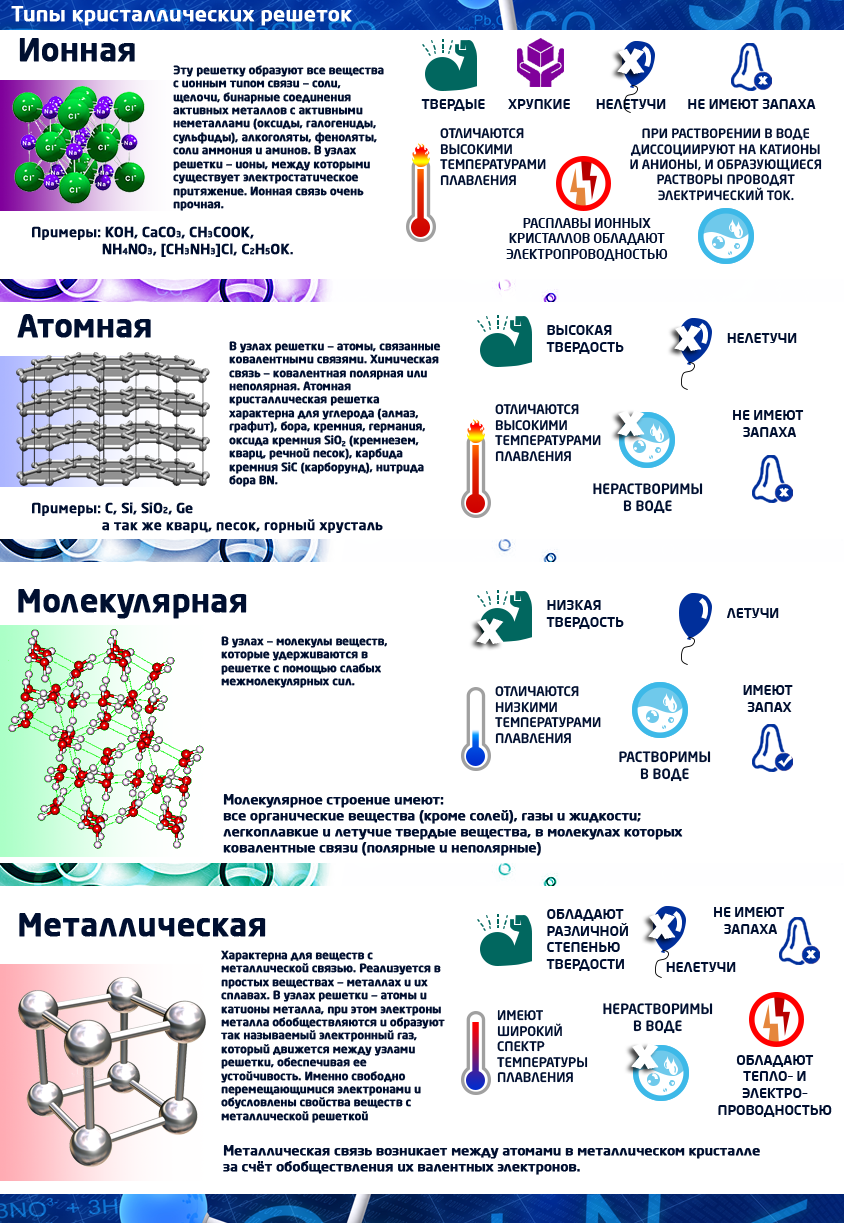
Кристаллдык торчолор
Катуу заттар аморфтук жана кристаллдык деп бөлүнөт (кристаллдык түзүлүштө болот).
Кристаллдык түзүлүш мейкиндикте бөлүкчөлөрдүн белгилүү бир тартип менен жайгашуусун мүнөздөгөн түзүлүш. Бул бөлүкчөлөрдү бири–бири менен сызык аркылуу туташтырсак, кристаллдык торчо келип чыгат. Бөлүкчөлөр жайгашкан чекиттер кристаллдык торчонун түйүндөрү деп аталат.
Кристаллдык торчонун түйүндөрүндө иондор, атомдор же молекулалар болот.
Кристаллдык торчонун түйүндөрүндө жайгашкан бөлүкчөлөрдүн түрүнө жана алардын ортосундагы байланышка карата кристаллдык торчолорду төрт типке бөлүшөт: иондук, атомдук, молекулалык жана металлдык.
Глоссарий
- Аниондор – терс заряддалган иондор.
- Валенттүүлүк – бул химиялык элементтин химиялык байланышты түзүү жөндөмдүүлүгү.
- Суутектик байланыш – молекулалардын ортосундагы байланыштардын бири, электростатикалык күчтөр менен тартылып турат. Суутектик байланыш пайда болушу үчүн молекулада терс электрлүү атомдор(O, N, F) менен байланышкан бир же бир нече суутектин атому болушу керек. Бул терс электрлүү атомдордо бөлүнбөгөн электрондук жуптары болушу керек. Суутектик байланыш суунун молекуласында H2O, аммиакта NH3, фтордуу суутекте HF болот. Суутектик байланыш коваленттик байланышка караганда 20 эсе бекем болот.
- Донордук касиет – атомдун башка бир атомго электронун берүү жөндөмдүүлүгү. Химиялык байланышты түзгөн атомдун донордук касиетинин сандык өлчөмү– терс электрлүүлүк деп аталат.
- Иондук байланыш – карама–каршы заряддалган иондордун бири–бирине тартылуусунан пайда болгон байланыш.
- Иондор – заряддалган бөлүкчөлөр.
- Катион – оң заряддалган иондор.
- Коваленттик байланыш – жупсуз электрондордун жупталышынан пайда болгон байланыш.
- Кристаллдык торчо – кристаллдын мейкиндигинде бөлүкчөлөрдүн белгилүү бир тартип менен жайгашуусун мүнөздөгөн түзүлүш. Бөлүкчөлөрдү бири–менен туташтырсак, кристаллдык торчо келип чыгат. Бөлүкчөлөр жайгашкан жерлери кристаллдык торчонун түйүндөрү деп аталат. Түйүндөрдө иондор, атомдор же молекулалар жайгашышы мүмкүн, кристаллдык торчо бирдей ячейкалардан турат.
- Металлдык байланыш – металлдардын же куймалардын кристаллдык торчолорунун түйүндөрүндөүндөгү катиондор менен эркин электрондордун ортосундагы байланыш.
- Металлдар – металлдык жалтырактыкка ээ, жылуулукту жана электр тогун жакшы өткөргөн, катуу (сымаптан башкасы) зат. Металлдардын атомдору электрондорун берип, оң заряддалган иондорду пайда кылат.
- Металл эместер – молекулалардан турган: газдар, суюктуктар, учма катуу заттар; металлдык жалтырактыкка ээ эмес, электр тогун жана жылуулукту начар өткөргөн заттар. Металл эместердин атомдору сырткы электрондук катмарын толтуруу үчүн электрондорду кошуп алат да терс заряддалат.
- Кычкылдануу даражасы – берилген элементтин башка элементтин атомуна берген же кошуп алган электрондордун саны.
- Терс электрлүүлүк – элементтин өзүнө электрондук жуптарды тартып алуу жөндөмдүүлүгү.
Пайдалуу шилтемелер
Бибилиография
Немецкий физикохимик Рихард Вильгельм Генрих Абегг родился в Данциге (ныне Гданьск, Польша).
Областью научных интересов Абегга являлись неорганическая и физическая химия. Исследовал скорость диффузии в растворах солей и электропроводность расплавленных солей. Совместно с немецким химиком Ф. Ауэрбахом с 1905 г. начал издавать многотомный справочник "Руководство по неорганической химии". Главной заслугой Абегга стало создание первых представлений о связи между атомами, учитывающих сложное строение атома. В 1899 г. Абегг совместно со своим коллегой Гвидо Бодлендером высказал идею о сродстве атомов к электрону – способности атомов присоединять электрон.
На основе этого принципа электросродства Абегг в 1902-1904 гг. разрабатывает теорию электровалентности. Валентностью, по мнению Абегга, обладают ионы, и величина валентности равна заряду иона. Каждый элемент характеризуется двумя максимальными валентностями – положительной и отрицательной; сумма этих валентностей равна восьми (т.н. правило Абегга). Одна из них, производящая более сильное действие, "нормальная", другая – "контрвалентность". Принцип электросродства и теория электровалентности Абегга заложили основу для более поздних теорий химической связи, которые создали Вальтер Коссель, Джилберт Льюис и Ирвинг Ленгмюр.