Химия: Первоначальные химические представления — различия между версиями
Admine2 (обсуждение | вклад) (Новая страница: «__NOTOC__ <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> {{Якорь|Начало}} <div class="row show-for-la…») |
Admine2 (обсуждение | вклад) (→Простые и сложные вещества) |
||
| Строка 209: | Строка 209: | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
== Простые и сложные вещества == | == Простые и сложные вещества == | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
По элементному составу различают простые вещества, состоящие из атомов одного элемента (H<sub>2</sub>, O<sub>2</sub>,Cl<sub>2</sub>, P<sub>4</sub>, Na, Cu, Au), и сложные вещества, состоящие из атомов разных элементов (H<sub>2</sub>O,NH<sub>3</sub>, OF<sub>2</sub>, H<sub>2</sub>SO<sub>4</sub>, MgCl<sub>2</sub>,K<sub>2</sub>SO<sub>4</sub>). | По элементному составу различают простые вещества, состоящие из атомов одного элемента (H<sub>2</sub>, O<sub>2</sub>,Cl<sub>2</sub>, P<sub>4</sub>, Na, Cu, Au), и сложные вещества, состоящие из атомов разных элементов (H<sub>2</sub>O,NH<sub>3</sub>, OF<sub>2</sub>, H<sub>2</sub>SO<sub>4</sub>, MgCl<sub>2</sub>,K<sub>2</sub>SO<sub>4</sub>). | ||
| Строка 236: | Строка 224: | ||
<br clear=all /> | <br clear=all /> | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
== Понятие о химических элементах == | == Понятие о химических элементах == | ||
<ul class="large-block-grid-2 small-block-grid-1"> | <ul class="large-block-grid-2 small-block-grid-1"> | ||
Версия 10:44, 22 декабря 2017
Что изучает химия?
Физические и химические явления
Физические явления
Кроме физических свойств, каждое вещество обладает способностью к превращению. Что же такое превращение веществ?
Представьте, что мы нагрели воду и она испарилась. Произошло ли при этом превращение вещества? Нет, испарение воды – это физическое явление. Водяной пар – это химическое вещество вода, только не в жидком, а газообразном агрегатном состоянии.
Физические явления – это явления, при которых данные вещества не превращаются в другие, а только изменяется их агрегатное состояние или форма.
Химические явления или химические реакции
Возьмем другой пример – ржавление железа. Железо ржавеет при взаимодействии с водой и кислородом. Ржавчина – хрупкое вещество бурого цвета. Таким образом, происходит превращение веществ – железа, кислорода и воды – в ржавчину. Это явление относится к химическим. Химические явления иначе называют химическими реакциями.
Вещества, вступающие в химическую реакцию (в рассмотренном примере – это железо, кислород и вода), называют исходными веществами.
Вещества, получающиеся в результате реакции (в данном случае – ржавчина), называют продуктами реакции.
Вывод
При физическом явлении изменения вещества не происходит, а изменяется лишь его агрегатное состояние или форма. В результате химической реакции происходит превращение исходных веществ в продукты реакции.
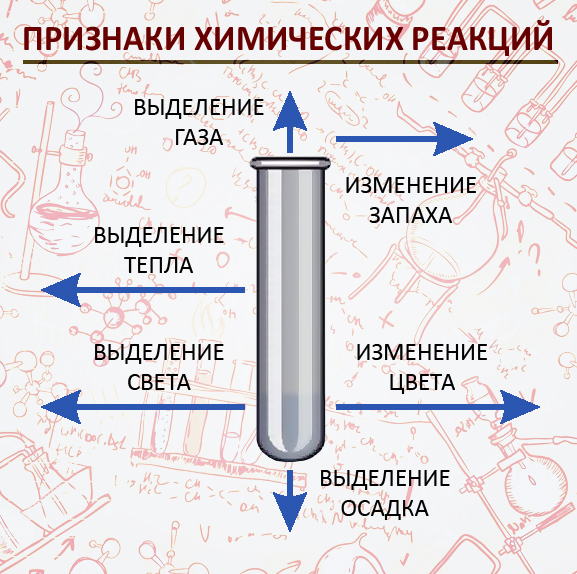
Признаки химических реакций
Изменения, происходящие с веществами, свидетельствуют о протекании химических реакций и являются признаками химических реакций.
Большинство веществ не могут взаимодействовать друг с другом самопроизвольно. Для протекания многих химических реакций необходимо создавать определенные условия.
Условия, необходимые для начала химической реакции

- 1. Измельчить 2. Перемешать 3. Нагреть
Для обеспечения лучшего контакта вещества измельчают, переводят в газообразное состояние. Многие вещества лучше реагируют друг с другом, если они растворены в воде.
Во многих случаях этого недостаточно, поэтому реагирующие вещества нагревают. Деревянная лучинка, смесь железа и серы, медь могут долгое время сохраняться при комнатной температуре, реакции начинаются только при их нагревании.
В некоторых случаях для начала химического процесса необходимо освещение. Одной из таких реакций, требующих постоянного освещения, является известная вам реакция фотосинтеза.
Характеристика веществ

Каждое химическое вещество имеет физические характеристики:
- 1. Агрегатное состояние. Твердое, жидкое, газообразное и состояние плазмы (Токамак- прибор для получения плазмы).
- 2. Цвет. У металлов цвет бывает от серебристо-светлого, до темно-серого, с синеватым отливом или красновато - желтого цвета, Неметаллы бывают бесцветные (кислород, азот), белые (фосфор), желтые, (сера, хлор) красноватые (фосфор), зеленоватые (фтор) или серо – фиолетовые (иод).
- 3. Плотность. Среди металлов самый легкий литий – 0,53 г/см3 , самый тяжелый – осмий - 22, 7 г/см3 . Вставка ( Легкими считают металлы с плотностью до 5 г/см3, тяжелыми после 5 г/см3).
- 4. Теплопроводность и электропроводность. На практике наиболее часто используют медь и алюминий, хотя у серебра и золота преимущества, но они дороги.
- 5. Температура плавления и кипения (смотри индивидуальные характеристики)
Чистые вещества и смеси
Чистыми считают вещества, у которых постоянные физические характеристики (Температуры плавления, кипения).
Абсолютно чистых веществ не бывает в силу контакта их между собой. От степени очистки вещества зависят свойства этих веществ.
Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем: «Смесь – целостная система, состоящая из разнородных компонентов».
Смеси – бывают однородные, когда ни глазами, ни под микроскопом нельзя различить вещества, составляющие смесь (растворы) или неоднородные, когда компоненты смеси можно различить глазами или с помощью приборов.
Различают вещества:
Чистые – 99%
Химически чистые – 99,9%
Чистые для анализа – 99,99%
Особенно чистые – 99,99 9%
Хроматографически чистые - без следов других веществ.
Способы очистки смесей химических веществ
| Пример смеси | Способ разделения |
|---|---|
| Суспензия – смесь речного песка с водой | Отстаивание
Разделение отстаиванием основано на различных плотностях веществ. Более тяжелый песок оседает на дно. Так же можно разделить и эмульсию: отделить нефть или растительное масло от воды. Нефть или растительное масло образует верхний, более легкий слой. В результате отстаивания выпадает роса из тумана, осаждается сажа из дыма, отстаиваются сливки в молоке. |
| Смесь песка и поваренной соли в воде | Фильтрование
На чем основано разделение гетерогенных смесей с помощью фильтрования?На различной растворимости веществ в воде и на различных размерах частиц. Через поры фильтра проходят лишь соизмеримые с ними частицы веществ, в то время как более крупные частицы задерживаются на фильтре. Так можно разделить гетерогенную смесь поваренной соли и речного песка. В качестве фильтров можно использовать различные пористые вещества: вату, уголь, обожженную глину, прессованное стекло и другие. Его используют хирурги – марлевые повязки; буровики и рабочие элеваторов – респираторные маски. С помощью чайного ситечка для фильтрования чая. |
| Смесь порошка железа и серы | Действие магнитом или водой
Порошок железа притягивался магнитом, а порошок серы – нет. Несмачивающийся порошок серы всплывал на поверхность воды, а тяжелый смачивающийся порошок железа оседал на дно. |
| Раствор соли в воде – гомогенная смесь | Выпаривание или кристаллизация
Вода испаряется, а в фарфоровой чашке остаются кристаллы соли.Этот способ разделения основан на различии в температурах кипения растворителя и растворенного вещества. В этом случае пары вещества необходимо собрать и затем сконденсировать при охлаждении. Такой способ разделения гомогенной смеси называется дистилляцией, или перегонкой. В специальных приборах – дистилляторах получают дистиллированную воду, которую используют для нужд фармакологии, лабораторий, систем охлаждения автомобилей. Если же разделять смесь спирта и воды, то первым будет отгоняться (собираться в пробирке-приемнике) спирт с tкип = 78 °С, а в пробирке останется вода. Перегонка используется для получения бензина, керосина, газойля из нефти. |
Атомы и молекулы. Атомно – молекулярное учение
Возникновение представлений об атомах и молекулах
Древнегреческий философ Демокрит 2500 лет назад высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов. Слово “атом” в переводе означает “неделимый”. Позднее, в средние века, учение об атомах преследовалось религией, которая тормозила развитие науки в целом, и химии в частности.
Учение о молекулах и атомах было разработано в середине 18 века великим русским ученым Михаилом Васильевичем Ломоносовым (1711 – 1765 гг.) Он утверждал, что тела в природе состоят из корпускл (молекул), в состав которых входят элементы (атомы).
Молекулы и атомы
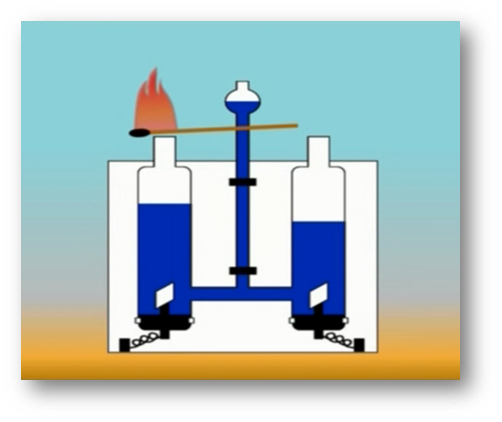
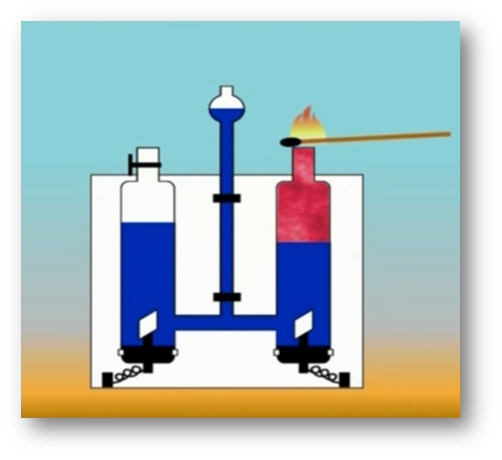
То, что атомы действительно существуют, подтверждают многие химические реакции. Так, например, при пропускании постоянного тока через воду в одной из трубок прибора собирается газ, в котором тлеющая лучинка ярко вспыхивает. Это кислород.
В другой трубке собирается вдвое больше газа, который от зажженной лучинки загорается. Это водород.
Объяснить это явление можно так. Мельчайшая частица воды – молекула состоит из 2 атомов водорода и одного атома кислорода. При пропускании постоянного тока через воду ее молекулы распадаются и образуются химически неделимые частицы – атомы кислорода и водорода.
Затем атомы соединяются по два, и из двух молекул воды образуется одна – двухатомная молекула кислорода и две водорода.
Итак, что такое молекулы и атомы?
Атомно-молекулярное учение
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
Простые и сложные вещества
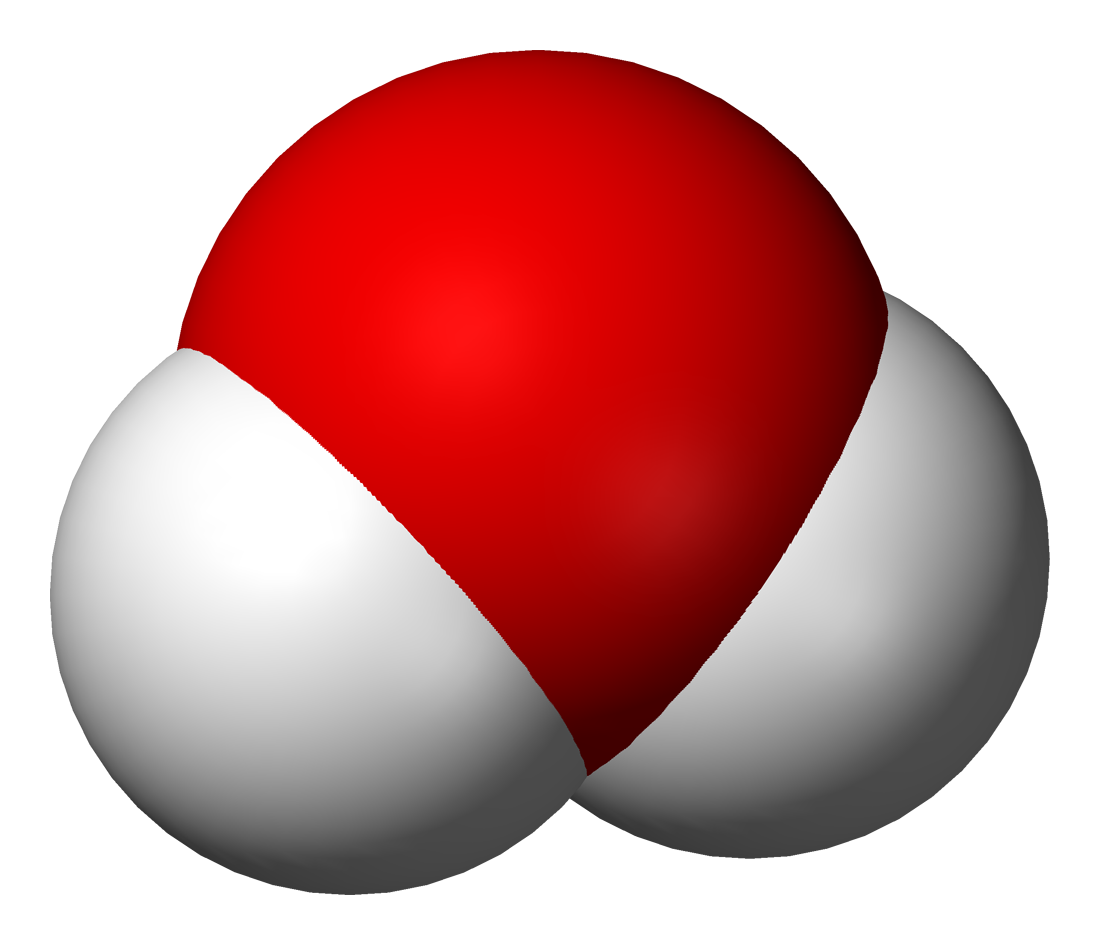
По элементному составу различают простые вещества, состоящие из атомов одного элемента (H2, O2,Cl2, P4, Na, Cu, Au), и сложные вещества, состоящие из атомов разных элементов (H2O,NH3, OF2, H2SO4, MgCl2,K2SO4).
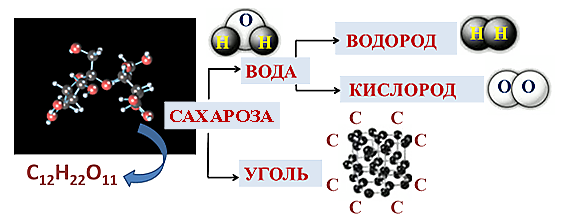
Мы нагревали на пламени сухого горючего пробирку с сахарозой (C12H22O11). Сначала сахароза плавиться и потемнела, а затем началось разложение, и сахар почернел.
Сахар-сложное вещество. Вода-сложное вещество. Уголь-простое вещество. Водород-простое вещество. Кислород-простое вещество.
Простые – молекулы таких веществ состоят из атомов одного вида. В химических реакциях не могут разлагаться с образованием нескольких более простых веществ.
Сложные – молекулы таких веществ состоят из атомов разного вида. В химических реакциях могут разлагаться с образованием более простых веществ.
Понятие о химических элементах
- Джон Дальтон
- Предложенная Дальтоном система обозначений
Как и в любой науке, в химии существует своя система условных обозначений, свой язык.
В 19 в. появилась необходимость использования понятной для всех ученых символики. И одним из первых такую символику предложил Джон Дальтон.
Но его обозначениями было неудобно пользоваться
Система обозначения химических элементов
- Берцелиус, Йёнс Якоб
- По предложению шведского химика Й.Я. Берцелиуса в начале 19 века в качестве символов были приняты в большинстве случаев начальные буквы латинских названий химических элементов.
-
Название Латинское название Символ Водород Hydrogenium H Ртуть Hydrargyrum Hg - Химический элемент водород (Hydrogenium) – Н. Если названия нескольких элементов начинались на одну и ту же букву, то в символе элемента указывали вторую или одну из последующих букв названия. Например, ртуть (Hydrargyrum) обозначается Hg.
-
Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: Название Символ Название Кислород О О Сера S Эс Азот N Эн Углерод С Це -
Знаки других элементов произносятся так же, как и называются сами элементы: Название Символ Название Натрий Na Натрий Калий K Калий Хлор Cl Хлор Фтор F Фтор -
Произношение некоторых знаков соответствует их латинскому названию: Название Символ Название Кремний Si силициум Ртуть Hg гидраргирум Медь Cu купрум Железо Fe феррум
Названия химических элементов
1) Отражение свойств: Водород - рождающий воду; Фосфор – несущий свет; Кислород – рождающий кислоты.
2) В честь небесных тел: Селен - Селена (луна); Теллур – Теллурис (Земля).
3) Заимствованы из мифологии: Тантал (сын Зевса)
4) В честь государств: Германий (Германия); Галлий (Франция); Полоний (Польша).
5) В честь ученых: Кюрий; Эйнштейний; Лоуренсий.
Различие понятий “химический элемент” и “простое вещество”
Отличить понятия “химический элемент” и “простое вещество” можно при сравнении свойств простых и сложных веществ. Например, простое вещество – кислород – бесцветный газ, необходимый для дыхания, поддерживающий горение. Мельчайшая частица простого вещества кислорода – молекула, которая состоит из двух атомов. Кислород входит также в состав оксида углерода (угарный газ) и воды.
- Вода
-
Водород -
Кислород -
Угарный газ
Однако, в состав воды и оксида углерода входит химически связанный кислород, который не обладает свойствами простого вещества, в частности он не может быть использован для дыхания. Рыбы, например, дышат не химически связанным кислородом, входящим в состав молекулы воды, а свободным, растворенным в ней.
Поэтому, когда речь идет о составе каких – либо химических соединений, следует понимать, что в эти соединения входят не простые вещества, а атомы определенного вида, то есть соответствующие элементы.
При разложении сложных веществ, атомы могут выделяться в свободном состоянии и соединяясь, образовывать простые вещества. Простые вещества состоят из атомов одного элемента. Различие понятий «химический элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент может образовывать несколько простых веществ. Например, атомы элемента кислорода могут образовать двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно различные простые вещества.
-
Кислород -
Озон
Этим объясняется тот факт, что простых веществ известно гораздо больше, чем химических элементов.
Простыми называют такие вещества, которые состоят из атомов одного химического элемента.
Сложными называют такие вещества, которые состоят из атомов разных химических элементов.
Сложные вещества часто называют химическими соединениями.Глоссарий
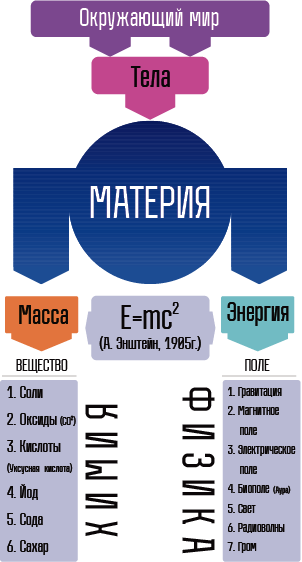
- Материя - То, из чего состоит окружающий мир.
- Масса - свойство объекта. Вес - сила, с которой этот объект притягивается к центру планеты (На космическом корабле в космосе масса сохраняется, а вес стремится к 0 - состояние невесомости)
- Вещество – материя в состоянии массы.
- Химия - наука о веществах, их свойствах, изменениях этих свойств и явлениях, сопровождающих эти изменения.
- Наука – система знаний о закономерностях развития природы, общества и мышления.
- Свойства - признаки, по которым вещества схожи или отличаются друг от друга.
- Явления - изменения, происходящие в природе с веществами.
- Эталон - то, с чем сравнивают.
- Атом - мельчайшая частица химического элемента, сохраняющая его химические свойства. атом построен из субатомных частиц - протонов, нейтронов, электронов.
- Атом - наименьшее количество элемента, которое только может содержаться в молекулах образуемых им соединений.
- Аллотропия — явление существования химического элемента в виде двух или нескольких простых веществ, различных по строению и свойствам. эти простые вещества, различные по строению и свойствам, называются аллотропными формами или аллотропными модификациями. например, графит и алмаз — две аллотропные формы (модификации) углерода, молекулярный кислород и озон — две аллотропные модификации кислорода. при определенных условиях аллотропные модификации могут переходить друг в друга.
- Молекула (новолат. molecula, уменьшит. от лат. moles — масса) - наименьшая частица данного вещества, обладающая его основными химическими свойствами, способная к самостоятельному существованию и состоящая из атомов, соединенных химическими связями.
- Простое веществоw — вещество, состоящее из атомов одного химического элемента: водород, кислород и т. д.
- Свойства — совокупность признаков по которым одни вещества отличаются от других, они бывают химическими и физическими.
- Сложное веществоw — вещество, состоящее из атомов разных химических элементов: кислоты, вода и др.
- Химический элемент — это определенный вид атомов с одинаковым положительным зарядом ядра.
Полезные ссылки
Бибилиография:
- А. В. Мануйлов, В. И. Родионов.Основы химии. Интернет-учебник.
- Г.В. Пчелкина. Химуля
- 100 интересных фактов о химии.
- Толковый словарь по химии
- «Семьдесят богатырей», А. Ивич; Рис. Э. Беньяминсона, Б. Кыштымова, М. Дет. лит. 1986
химические реакции
и химических реакций
Если 100 млн атомов водорода расположить рядом друг с другом, то они образуют цепочку длиною всего лишь в 1 см.
Шведский ученый Карл Шелле является рекордсменом по количеству открытых химических элементов. На его счету хлор, фтор, барий, вольфрам, кислород, марганец, молибден.
Множество химических элементов получили своё название в честь стран или других географических объектов. Сразу 4 элемента — иттрий, иттербий, тербий и эрбий — были названы в честь шведской деревни Иттербю, около которой обнаружили крупное месторождение редкоземельных металлов.
В лампочках используют аргон.
Самым легким среди благородных газов считается гелий.
В изумрудах содержится бериллий.
Чтобы огонь покрасить в зеленый цвет используют бор.
Азот может вызвать помутнение сознания.
Неон способен светиться красным цветом, когда через него пропустить ток.
В океане содержится большое количество натрия.
В компьютерных микросхемах используют кремний.
Для изготовления спичек используют фосфор.
Хлор может вызвать аллергические реакции органов дыхания.