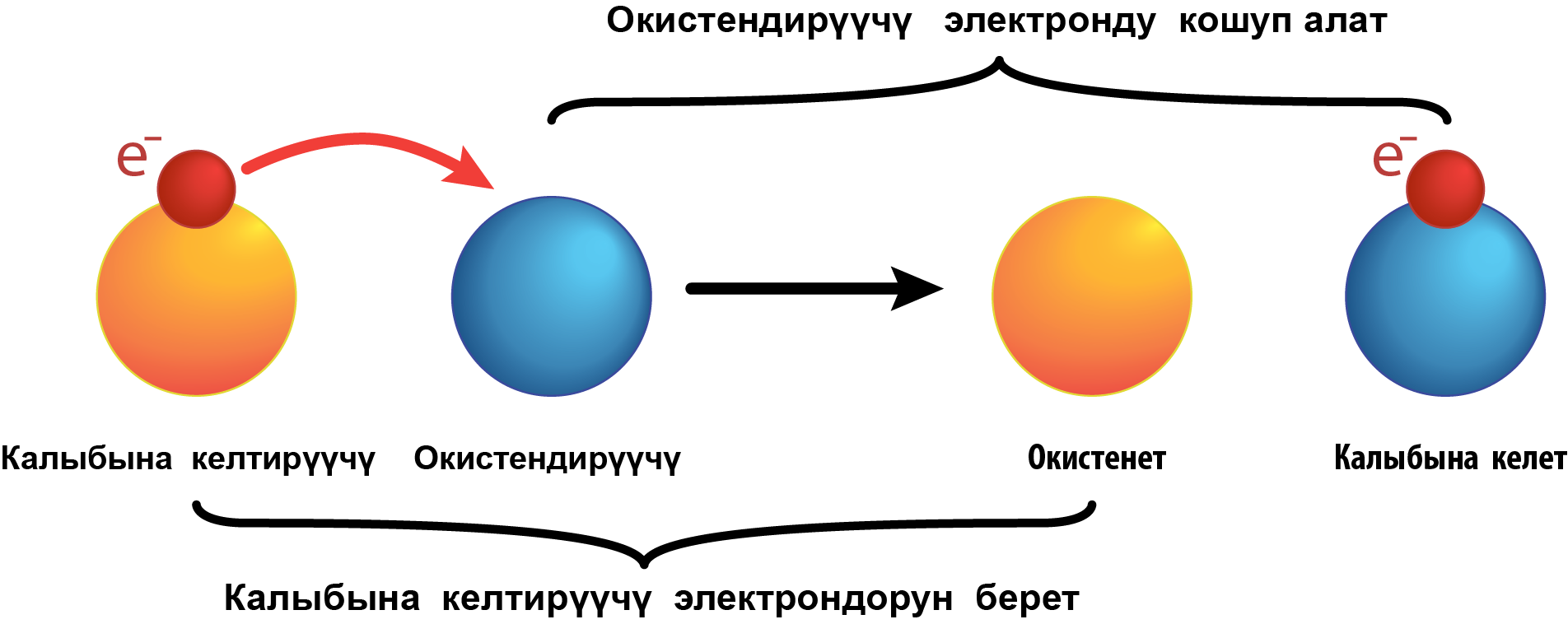Химия: Окистенүү–калыбына келүү реакциялары — различия между версиями
Admine2 (обсуждение | вклад) (Новая страница: «{{Якорь|Начало}} <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> <div class="cutok">#Окистен…») |
(нет различий)
|
Версия 11:10, 13 июня 2018
Кычкылдануу–калыбына келүү реакциялары деп, молекуланы түзгɵн атомдордун окистенүү даражаларынын ɵзгɵрүшү менен жүргɵн реакцияларды айтабыз. Окистенүү же калыбына келүү процесси ɵз алдынча жүрɵ албайт. Бул учурда бир атомдун электрону башка элементтин атомуна ɵтɵт. Ал эми ɵзүн ɵзү окистендирүү жана калыбына келтирүү реакцияларына бир эле элементтин атомдору катышат, алардын бир бɵлүгү электрондорун берсе, башка бɵлүгү аларды кабыл алат. Электрондорун берген атом калыбына келтиргич болуп саналат да, оң заряддалат. Электрондорду тартып алган атом терс зарядга ээ болуу менен окистендирүүчү болуп калат.
Окистендиргичтер дайыма жогорку терс электрдүүлүккɵ ээ болушат. Татаал заттардын формулаларында окистендиргичтер да калыбына келтиргичтер да болот, б.а. бир эле окистендирүүчү болот – бул терс электрдүүлүгү эң жогору болгон, терс заряддалган атом. Ал эми татаал заттардын ичинен калыбына келтиргичтер катары оң заряддалган, 1,2,3 зат болушу мүмкүн. Окистендиргичтин атомунун терс заряддалган иондорунун саны, бардык калыбына келтиргичтердин атомундагы оң заряддалган иондордун санына барабар болот. Атом – электронейтралдуу бɵлүкчɵ болуп саналат. Ошондуктан, окистенүү–калыбына келүүнүн теңдемелерин чыгаруу мына ушул баланска негизделген.
Содержание
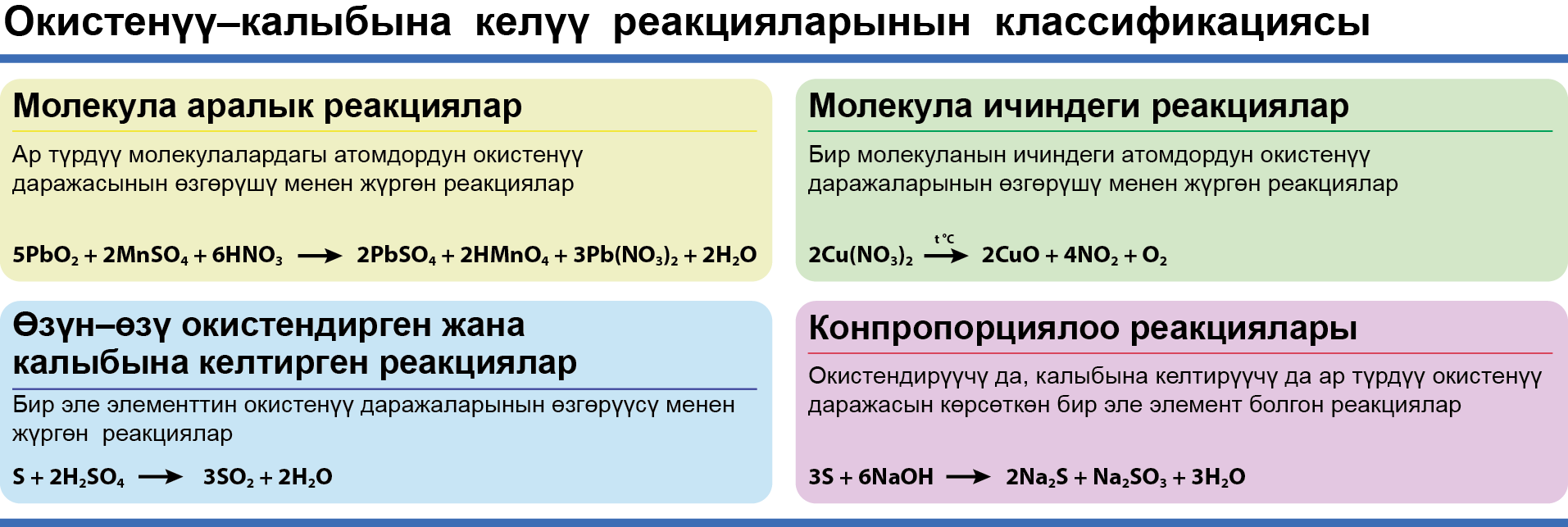
Окистенүү–калыбына келүү реакциясынын классификациясы
Молекула аралык окистенүү–калыбына келүү реакцияларын түзүү
Окистенүү–калыбына келүү реакциясына дайыма үч компонент катышат:
а) калыбына келтиргич,
б) окистендиргич,
в) кошумча окистендирген зат– эң кеңири таралган жана негизги окистендиргич болгон – кычкылтекке бай зат, (кɵп учурда бул реакциялар кычкыл чɵйрɵдɵ жүрɵт).
5H2S + 2KMnO4 + 3H2SO4![]() K2SO4 + 2MnSO4 + 5S↓ + 8H2O
K2SO4 + 2MnSO4 + 5S↓ + 8H2O
В данном уравнении:
H2S – калыбына келтиргич,
KMnO4 – окистендиргич,
H2SO4 – окистендирүүчү зат.
1. Берилген формуладагы бардык заттардын окистенүү даражалары аныкталат:
H2S + KMnO4 + H2SO4![]() K2SO4 + MnSO4 + S↓ + H2O
K2SO4 + MnSO4 + S↓ + H2O
2. Реакцияга чейин жана андан кийин окистенүү даражаларын ɵзгɵрткɵн элементтердин астын чийебиз.
H2S + KMnO4 + H2SO4![]() K2SO4 + MnSO4 + S↓ + H2O
K2SO4 + MnSO4 + S↓ + H2O
3. Электрондук баланс теңдемесине реакцияга чейинки жана андан кийинки окистенүү даражаларын белгилейбиз.
Mn +7 -5e ![]() Mn 2+ | 5 | 2
Mn 2+ | 5 | 2
S +2 +2e ![]() S 0 | 2 | 5
S 0 | 2 | 5
Электрондук баланс теңдемеси
4. Теңдемеге электрондук баланста кɵрсɵтүлгɵн коэффициенттер : теңдеменин оң жагына Mn–2 деген коэффициент., S–5 деген коэффициент жазылат.
H2S + KMnO4 + H2SO4![]() K2SO4 + 2MnSO4 + 5S↓ + H2O
K2SO4 + 2MnSO4 + 5S↓ + H2O
Ушул эле коэффициенттерди теңдеменин сол жагына жазабыз.
5H2S + 2KMnO4 + H2SO4![]() K2SO4 + 2MnSO4 + 5S↓ + H2O
K2SO4 + 2MnSO4 + 5S↓ + H2O
5. Металлдарды теңдейбиз, реакциянын оң жагындагы жана сол жагындагы калийдин алдына 2ден атом болушу керек, ошондуктан, K2SO4 формуланын алдына 1 деген коэффициент коюлат.
5H2S + 2KMnO4 + H2SO4![]() 1K2SO4 + 2MnSO4 + 5S↓ + H2O
1K2SO4 + 2MnSO4 + 5S↓ + H2O
6. Эми металл эместерди теңдейбиз. Теңдеменин оң жагындагы, курамында күкүрттүн атому бар бардык заттардын алдына коэффициенттер коюлган. Күкүрттүн атомдорунун суммасы 8 барабар. Теңдеменин сол жагындагы күкүрттүү суутектин алдына 5 деген коэффициент коюлат, ошондуктан, күкүрт кислотасынын курамындагы күкүрткɵ 3 кошобуз. Күкүрт кислотасынын алдына 3 деген коэффициент жазылат.
5H2S + 2KMnO4 + 3H2SO4![]() 1K2SO4 + 2MnSO4 + 5S↓ + 8H2O
1K2SO4 + 2MnSO4 + 5S↓ + 8H2O
7. Теңдеменин сол жагындагы суутектин атомунун санын эсептейбиз. Күкүрттүү суутекте 10 атом жана күкүрт кислотасынын курамында 6 атом суутек бар.Демек, атомдордун суммасы 16 болушу керек. Ал эми теңдеменин оң жагында сууда гана 2 атом суутек бар.Суутектин саны 16 болушу үчүн суунун алдына 8 деген коэффициент коюлат.
8. Теңдеменин оң жана сол жагындагы кычкылтектин санын теңдейбиз:
2 • 4 + 3 • 4 = 4 + 2 • 4 + 8 | 20 = 20
9. Эгерде теңдеменин сол жагындагы кычкылтектин атомунун саны оң жагындагы кычкылтектин атомунун санына барабар болсо, демек, теңдеме туура түзүлгɵн.
Молекула аралык реакциянын теңдемелеринде сол жагында эки гана зат жазылат жана бир эле зат бир нече функцияны аткарат. Бул теңдемеде азот кислотасы окистендирүүчү да, кошумча окистендирүүчү да болуп калат.
3Cu + 8HNO3(суюл) ![]() 3Cu(NO3)2 + 2NO + 4H2O
3Cu(NO3)2 + 2NO + 4H2O
В уравнении 2KMnO4 +16HCl ![]() 5Cl2↑ + 2MnCl2 + 2KCl + 8H2теңдемесинде хлордуу суутек кислотасынын молекулалары хлорго чейин Окистенет жана кошумча окистендирүүчү да болуп эсептелет.
5Cl2↑ + 2MnCl2 + 2KCl + 8H2теңдемесинде хлордуу суутек кислотасынын молекулалары хлорго чейин Окистенет жана кошумча окистендирүүчү да болуп эсептелет.
Молекула ичиндеги окистенүү–калыбына келүү реакциялары
Молекуланын ичиндеги ККР (окистенүү–калыбына келүү реакциялары) кɵп убакта ысытуу менен жүргɵн ажыроо реакциялары болуп саналат.
2KMnO4 ![]() K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
4KMnO4 ![]() 2K2O + 4MnO2 + 3O2↑ (Өтɵ жогорку температурада)
2K2O + 4MnO2 + 3O2↑ (Өтɵ жогорку температурада)
2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
2NaNO3 ![]() 2NaNO2 + O2↑
2NaNO2 + O2↑
2HgO ![]() 2Hg +O2↑
2Hg +O2↑
2H2O2 MnO2→ 2H2O + O2↑
Өзүн–ɵзү Окистендирген жана калыбына келтирген реакцияда кызыктуу учурлар кездешет:
4KClO3 ![]() 3KClO4 + KCl
3KClO4 + KCl
3So + 6NaOH ![]() 2Na2S-2 +Na2S+4O3 + 3H2O
2Na2S-2 +Na2S+4O3 + 3H2O
Электрондук баланс теңдемеси:
Sо +2e → S-2 | 2 | 1 | 2
Sо -4e → S+4 | 4 | 2 | 1
2Н2S + H2SO3 ![]() 3S↓ + 3H2O
3S↓ + 3H2O
SO2 + 2H2S ![]() 3S↓ + 2H2O
3S↓ + 2H2O
Окистенүү–калыбына келүү реакцияларынын ичинен мылтык ок–дарысын (порох) пайдалануу менен жүргɵн реакцияны ɵзгɵчɵ белгилɵɵгɵ болот. Мында үч элементтин окистенүү даражасы ɵзгɵрɵт:
3C + S + 2KNO3 ![]() K2S + 3CO2↑ + N2↑
K2S + 3CO2↑ + N2↑
Электрондук баланс теңдемеси
Со -4e → С+4
Sо +2e → S-2
2N+5 -10e → N2 0
| –4 | | 4 | 12 | 3
| +2 | | 12 | 4 | 1
| +10 | | 12 | 4 | 1
Бул теңдемеде эки окистендирүүчү зат – азот жана күкүрт бар, ошондуктан, алардын электрондору кошулат да, андан соң кыскарып, кɵмүртектин алдына жазылат. Кыскаргандан кийин кɵмүртектин 1 деген коэффициенти эки элементтин– күкүрттүн жана азоттун алдына жазылат.
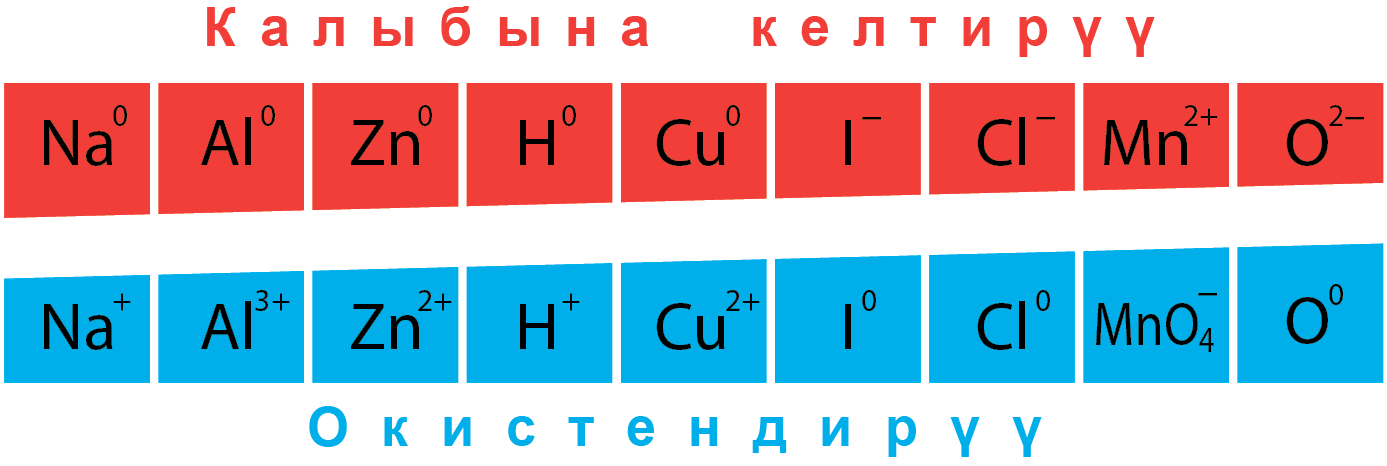
Окистендирүүчү болуп, окистенүү даражаларын ɵзгɵрткɵн жана жогорку окистенүү санын кɵрсɵткɵн элементтер боло алат :
(N +5) HNO3; (Mn +7) KMnO4, HMnO4; (Cr +6) K2CrO7. CrO3 ; (Pb +4) PbO2; (F0 ) F2; (S +6) H2SO4.
Калыбына келтирүүчү болуп, окистенүү даражаларын ɵзгɵрткɵн жана тɵмɵнкү окистенүү санын кɵрсɵткɵн элементтер боло алат:
(N -3) NH3; (S -2)H2S; (F. Cl, Br. I -1) HF. HCl, HBr. HI ; (P -3) РH3; (H -1) гидриды металлов; (все металлы в виде простого вещества) Na, Al, Mg….
Окистендирүүчү да калыбына келтирүүчү да болуп, окистенүү санын ɵзгɵрткɵн жана аралык окистенүү даражасын кɵрсɵткɵн элементтер боло алат:
(N = 0, +3): N2, HNO2; (S=0) S; (Fe +2): FeSO4, FeCl2.
Тɵмɵнкү окистенүү–калыбына келүү реакцияларына электрондук баланс методу менен коэффициенттерди коюп чыккыла:
Zn + H2SO4(ɵтɵ суюлт.) ![]() ZnSO4 + H2S↑ + H2O
ZnSO4 + H2S↑ + H2O
4Zn + 5H2SO4(ɵтɵ суюлт.) ![]() 4ZnSO4 + H2S↑ + 4H2O
4ZnSO4 + H2S↑ + 4H2O
Cu + HNO3(суюлт.) ![]() Cu(NO3)2 + NO↑ + H2O
Cu(NO3)2 + NO↑ + H2O
3Cu + 8HNO3(суюлт.) ![]() 3Cu(NO3)2 + 2NO↑ + 4H2O
3Cu(NO3)2 + 2NO↑ + 4H2O
KI + MnO2 + H2SO4 ![]() K2SO4 + MnI2 + I2 + H2O
K2SO4 + MnI2 + I2 + H2O
4KI + MnO2 + 2H2SO4 ![]() 2K2SO4 + MnI2 + I2 + 2H2O
2K2SO4 + MnI2 + I2 + 2H2O
HCl + MnO2 ![]() Cl2↑ + MnCl2 + H2O
Cl2↑ + MnCl2 + H2O
4HCl + MnO2 ![]() Cl2↑ + MnCl2 + 2H2O
Cl2↑ + MnCl2 + 2H2O
S + HNO3(конц) ![]() H2SO4 + NO2 + H2O
H2SO4 + NO2 + H2O
S + 6HNO3(конц) ![]() H2SO4 + 6NO2 + 2H2O
H2SO4 + 6NO2 + 2H2O
Татаалдатылган мисалдар:
FeCl2 + KMnO4 + HCl ![]() FeCl3 + MnCl2 + KCl + H2O
FeCl3 + MnCl2 + KCl + H2O
5FeCl2 + KMnO4 + 8HCl ![]() 5FeCl3 + MnCl2 + KCl + 4H2O
5FeCl3 + MnCl2 + KCl + 4H2O
FeS2 + O2 ![]() SO2↑ + Fe2O3
SO2↑ + Fe2O3
4FeS2 + 11O2 ![]() 8SO2↑ + 2Fe2O3
8SO2↑ + 2Fe2O3
Cu2O + H2SO4 ![]() CuSO4 + Cu + H2O + O2↑
CuSO4 + Cu + H2O + O2↑
3Cu2O + H2SO4 ![]() CuSO4 + 5Cu + H2O + O2↑
CuSO4 + 5Cu + H2O + O2↑
PbO2 + MnSO4 + HNO3 ![]() PbSO4 + HMnO4 +Pb(NO3)2 + H2O
PbSO4 + HMnO4 +Pb(NO3)2 + H2O
5PbO2 + 2MnSO4 + 6HNO3 ![]() 2PbSO4 + 2HMnO4 +3 Pb(NO3)2 + 2H2O
2PbSO4 + 2HMnO4 +3 Pb(NO3)2 + 2H2O
As2S3 + KMnO4 + H2SO4 ![]() H3AsO4 + K2SO4 + MnSO4 + H2O
H3AsO4 + K2SO4 + MnSO4 + H2O
Глоссарий
- Калыбына келтиргичтер деп, окистенүү убагында электронун берген атомдор, молекулалар же иондорду айтабыз.
- Калыбына келтирүү – электрондорду ɵзүнɵ кошуп алуу.
- Окистенүү – электронун берүү.
- Окистендиргич деп, калыбына келтирүү убагында электрондорду ɵзүнɵ тартып алган атомду, молекуланы же ионду айтабыз.
- Окистенүү–калыбына келүү реакциялары деп, ɵз ара аракеттенишкен атомдордун окистенүү даражаларынын ɵзгɵрүшү менен жүргɵн химиялык реакцияларды айтабыз.
- Окистендирүүчү (подкислитель) – бул это кандайдыр бир кислота.
- Электрондук теңдемелер – окистенүү жана калыбына келүү процессин кɵрсɵткɵн теңдемелер.
Пайдалуу шилтемелер
нету
Видеоурок «Качественные реакции в химии». Сайт «Видеоуроки в интернет» (Электронный ресурс). //URL:.https://www.youtube.com/watch?v=pk7UXWVBC9U&t=193s (дата обращения 07.03.18.)
Библиография
- Д.Д.Дзудцова, Л.Б.Бестаева «Окислительно – восстановительные реакции». Дрофа. М. 2005 г.
- Химия .Пособие – репетитор. Ростов - на – Дону. 1997г.
- Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;
- Л.И. Асанова, Е.Н. Стрельникова «Окислительно–восстановительные реакции». Практикум по химии. Москва. «ВАКО». 2018 г.
Кɵркɵм адабияттар
- Рафаэль Сабатини «Одиссея капитана Блада» Впервые издана в 1922 году.
- Шадерло де Лакло «Опасные связи» Наука 1965 г. «Литературные памятники»
- Фенимор Купер «Следопыт, Зверобой, Последний из могикан, Пионеры, Чингачгук» . Пенталогия Бинезун, 2014г.
- Фенимор Купер, 31 книга. Медиакнига, 2014 г.
- Анна и Серж Голон «Анжелика в Новом свете», «Дорога надежды», «Анжелика и ее победа», «Анжелика в Квебеке», Ташкент, 1993 г.
Лев Владимирович Писаржевский (1874–1938) – физикалык химия бɵлүмү боюнча белгилүү окумуштуу, СССРдин ИА академиги, В.И.Ленин атындагы Премиянын лауреаты.
Писаржевский окистенүү–калыбына келүү реакцияларынын электрондук теориясын түзүү менен электроддордун мүмкүнчүлүгү жɵнүндɵгү гальваникалык элементтердин теориясын сунуш кылган жана катализ теориясын түзгɵн. «Введение в химию» (1926–жыл) деген китебинде биринчи жолу бардык маалыматтар атомдордун жана молекулалардын электрондук теориясынын кɵз карашы менен берилген.
Биз белгилүү болгондой, Американы испандар ачкан жана аны испандар менен кошо португалиялыктар да изилдешкен. Ал эми франсуздар ɵздɵрүнүн бардык туткундарын ал жакка жиберүү менен жерлерди иштетишкен. Француздар фортторду курушкан, мергенчилик кылып, чарбаларды иштетишкен. Ал учурда Англияны Елизавета I башкарып турган, анын күчтүү флоту болгон жана деңиз каракчыларын колдоп турган. Ал каракчыларды колдоп гана тим болбостон, аларга дворяндык наамдарды да ыйгарган. Ал үчүн алар талап–тоноп алган байлыктарынан салык тɵлɵп турушкан. Согуш жарыяланбаса да, Түндүк Америкада, кургакта да, сууда да жүрүп турган.
Англиялык каракчылардын кемелери мылтыктын ок–дарысын же анын компоненттерин ташыган франсуз кемелерин, ɵзгɵчɵ Франциядан ташылган калий селитрасын чɵктүрүп турушкан. Каракчылардын кемесиндеги пушкадан чыккан бир эле ядро мылтыктын ок–дарысы бар суднону толук жарып жиберген. Мына ошентип, француз фортунда мылтыктын ок–дарысынын жетишсиздиги күчɵгɵн. Форттор солдаттар тарабынан корголуп турган. Бирок, душманга каршы ок ата алышкан эмес. Алар жеңилгендигин билгизип, англиялык аскерлерге ак желек ыргытышкан. Фортту кан тɵкпɵстɵн эле басып алышкан. Ошентип, француздар жеңилип калышкан, Түндүк Американын территориясын англиялыктар басып алышкан.
Байыркы мезгилде, адамдардын химия жɵнүндɵ маалыматы жок учурда, алар бермет ташынын жүзүм уксусунда эрүү реакциясынын теңдемесин жаза алышкан эмес:
CaCO3 + 2CH3COOH ![]() Ca(CH3COO)2 + H2O + CO2
Ca(CH3COO)2 + H2O + CO2
же андан да жɵнɵкɵй күн нурунун таасири астында алмаздын абада күйүүсүн түшүндүрɵ алышкан эмес:
C + O2 ![]() CO2
CO2
Албетте, экинчи реакция биринчиден да татаал : анда электрондор бир атомдон экинчи атомго ɵтɵт, демек, бул окистенүү–калыбына келүү реакциясы болуп саналат. Окумуштуулар «окистенүү–бул флагистонду жоготуу(кɵзгɵ кɵрүнбɵгɵн күйүүчү зат), ал эми калыбына келүү– аны таап алуу»,– деп түшүндүрүшкɵн. XIX кылымдын башында А. Лавуазье тарабынан күйүүнүн кычкылтектик теориясы ачылгандан кийин, химиктер окистенүү– заттардын кычкылтек менен аракеттенүүсү, калыбына келүү – суутектин атомунун таасири менен алардын мурунку абалына келүүсү деп эсептешкен.
Темирдин туз кислотасы менен болгон жɵнɵкɵй реакциясын карап кɵрɵлү:
Fe + 2HCl ![]() FeCl2 + H2↑
FeCl2 + H2↑
Бул реакцияга кычкылтек катышкан жок, бирок темир окистенди. Мында, окистендирүүчү болуп, суутектин иону саналат, ал эми темир– калыбына келтирүүчү болот.
Химия илимине электрондор жɵнүндɵ түшүнүк пайда болгондон кийин гана биз: окистендирүүчү – электрондорду ɵзүнɵ тартып алган зат, калыбына келтирүүчү – электронун берген зат экендигин билебиз.