Химия: Алгачкы химиялык түшүнүктɵр — различия между версиями
Admine2 (обсуждение | вклад) |
Admine2 (обсуждение | вклад) |
||
| Строка 1: | Строка 1: | ||
{{Якорь|Начало}} | {{Якорь|Начало}} | ||
<div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | ||
| − | <div class="cutok">[[# | + | <div class="cutok">[[#Физикалык жана химиялык кубулуштар|Физикалык жана химиялык кубулуштар]] [[#Заттардын мүнөздөмөсү|Заттардын мүнөздөмөсү]] [[#Таза заттар жана аралашмалар|Таза заттар жана аралашмалар]]<br>[[#Аралашмаларды бөлүүнүн жолдору|Аралашмаларды бөлүүнүн жолдору]] [[#Атомдор жана молекулалар. Атом-молекулалык окуу|Атомдор жана молекулалар. Атом-молекулалык окуу]]<br>[[#Жөнөкөй жана татаал заттар|Жөнөкөй жана татаал заттар]] [[#Химиялык элементтер|Химиялык элементтер]]</div> |
| − | == | + | ==Химия эмнени окутат?== |
<ul class="small-block-grid-1 large-block-grid-2"> | <ul class="small-block-grid-1 large-block-grid-2"> | ||
<li> | <li> | ||
| − | <div class="textblock">{{center|'''Химия''' | + | <div class="textblock">{{center|'''Химия''' – ''заттардын курамы, түзүлүшү, касиеттери жана алардын айлануулары жөнүндөгү илим''}}</div> |
{{center|[[Файл:Предмет химии Вещества.mp4|400px|right]]}} | {{center|[[Файл:Предмет химии Вещества.mp4|400px|right]]}} | ||
</li> | </li> | ||
| Строка 34: | Строка 34: | ||
</ul> | </ul> | ||
| − | <div class="show-for-large-up">{{right-p|[[Файл:Kilo1.png|180px| | + | <div class="show-for-large-up">{{right-p|[[Файл:Kilo1.png|180px|Килограммдын эталону – бул алтын жана иридийдин куймасынан жасалган кайрак, ал Парижден 60км алыстыктагы Севр шаарында килограммдардын Музейинде айнек идиштин астында сакталат. }}</div> |
| − | == | + | == Физикалык жана химиялык кубулуштар == |
| − | ==== | + | ==== Физикалык кубулуштар ==== |
| − | + | Ар бир зат физикалык касиеттерге ээ болуу менен бирге. башка заттарга айлануу жөндөмдүүлүгүнө да ээ болот. Заттардын айланышы деген эмне? | |
| − | + | Элестетип көрөлүчү, биз сууну ысытсак, ал буулана баштайт. Бул учурда зат башка затка айландыбы? Жок, суунун бууланышы – бул физикалык кубулуш. Суунун буусу– бул суюктук түрүндө эмес, газ агрегаттык абалындагы химиялык зат, суу болуп саналат. | |
| − | + | Физикалык кубулуштар – бул баштапкы зат башка жаңы затка айланбай, анын агрегаттык абалы же формасы гана өзгөргөн кубулуштар. | |
| − | |||
| − | |||
| − | |||
| − | <div class=" | + | <div class="hide-for-large-up">{{center-p|[[Файл:Kilo1.png|180px|Килограммдын эталону – бул алтын жана иридийдин куймасынан жасалган кайрак, ал Парижден 60км алыстыктагы Севр шаарында килограммдардын Музейинде айнек идиштин астында сакталат. ]]</div> |
| + | ==== Химиялык кубулуштар же химиялык реакциялар ==== | ||
| + | Башка мисалды – темирдин дат басышын карап көрөлү. Темир нымдуу аба менен тийишкенде, аны дат басат. Темирдин даты – күрөң түстөгү морт зат. Демек, темир, кычкылтек жана суу менен аракеттенишип, темирдин датын пайда кылды, б.а. бир зат башка жаңы затка айланды. Бул кубулуш химиялык кубулуш болуп саналат. Ал эми химиялык кубулушту химиялык реакция деп аташат. | ||
| − | + | <div class="textblock">Химиялык кубулуштар же химиялык реакциялар – бул баштапкы заттардан курамдары, касиеттери боюнча айрымаланган жаңы заттарды пайда кылуучу кубулуштар.</div> | |
| − | + | Химиялык реакцияга катышкан заттар (мисалы: темир, кычкылтек жана суу), баштапкы заттар деп аталат. | |
| − | =====''' | + | Реакциянын натыйжасында пайда болгон заттар (темирдин даты), реакциянын продуктусу деп аталат. |
| + | |||
| + | ====='''Жыйынтык'''===== | ||
<div class="textblock"> | <div class="textblock"> | ||
| − | + | Физикалык кубулуш учурунда заттардын курамы өзгөрбөйт, алардын агрегаттык абалы же формасы гана өзгөрөт. Ал эми химиялык реакциянын натыйжасында, баштапкы заттар жаңы заттарды пайда кылат.</div> | |
<br clear=all /> | <br clear=all /> | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | == | + | == Заттарды мүнөздөп жазуу == |
| − | <div class="hide-for-small-only">{{right-p|[[Файл:Wertr.jpg|150px| | + | <div class="hide-for-small-only">{{right-p|[[Файл:Wertr.jpg|150px|Үч токамактын бирөө Советтер Союзунун мезгилинен бери Бишкектеги Россия илимдер Академиясынын Илимий станциясында сакталып турат]]}}</div> |
| − | <div class="show-for-small-only">{{center-p|[[Файл:Wertr.jpg|250px| | + | <div class="show-for-small-only">{{center-p|[[Файл:Wertr.jpg|250px|Үч токамактын бирөө Советтер Союзунун мезгилинен бери Бишкектеги Россия илимдер Академиясынын Илимий станциясында сакталып турат]]}}</div> |
| − | ''' | + | '''Ар бир химиялык затты физикалык жактан мүнөздөөгө болот:''' |
| − | : '''1.''' ''' | + | : '''1.''' '''Агрегаттык абалы.''' Катуу, суюк, газ абалында жана плазма түрүндө болот. (Токамак– плазманы алуучу курал). |
| − | : '''2.''' ''' | + | : '''2.''' '''Өңү–түсү.''' Металлдар күмүш сымал ачык түстөн, күңүрт–боз түскө чейин, көгүлтүр же кызгылт–сары өңдө кубулуп турат. Металл эместер түссүз (кычкылтек, азот), ак түстө (фосфор), сары, (күкүрт, хлор) кызгылт (фосфор), жашыл (фтор) же кочкул–боз (иод) түстө болушат. |
| − | : '''3.''' ''' | + | : '''3.''' '''Тыгыздыгы.''' металлдардын ичинен эң жеңили – литий – 0,53 г/см<sup>3</sup> , эң оору – осмий – 22,7 г/см<sup>3</sup>. |
| − | : '''4.''' ''' | + | <div class="textblock">{{center|Тыгыздыгы 5 г/см<sup>3</sup> чейин болсо жеңил металл, 5 г/см<sup>3</sup> оор болсо, оор металл деп эсемтелинет}}</div> |
| − | : '''5.''' ''' | + | : '''4.''' '''Жылуулукту жана электр тогун өткөргүчтүк.''' Күмүш жана алтындын артыкчылыгы болсо да, алардын кымбат болгондугуна байланыштуу күндөлүк турмушта жез жана алюминий кеңири колдонулат. |
| + | : '''5.''' '''Балкуу жана кайноо температуралары''' (жекече мүнөздөмөсүнөн кара) | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | == | + | == Таза заттар жана аралашмалар == |
| − | + | Заттын физикалык касиеттери ''(эригичтиги, кайноо температурасы)'' өзгөрүүсүз, туруктуу болсо, мындай заттарды таза заттар дейбиз. | |
| + | |||
| + | Жаратылышта абсолюттук таза заттар эркин түрдө кездешпейт. Заттардын тазалыгы аларды тазалоонун деңгээлине көз каранды болот. | ||
| − | + | Аралашма деген түшүнүктү XVII кылымда англиялык окумуштуу '''Роберт Бойль''' киргизген. Ал ''«Аралашма – ар түрдүү компоненттерден турган бирдиктүү система» деген аныктама берген''. | |
| − | + | '''Аралашмалар''' – бир тектүү жана бир тектүү эмес болушат. Бир тектүүлөр– сыртынан караганда андагы таза заттарды өзүнчө жөнөкөй көз же микроскоп менен да көрүүгө мүмкүн эмес. Бир тектүү эместер аралашмаларды көз же атайын приборлор менен көрүп эле аларды айрымалоого болот. Мисалы. катуу заттардын аралашмасы – топурак менен кумдун, күкүрт менен темирдин таарындыларын жөнөкөй эле көз менен аныктоого болот. | |
| − | ''' | + | '''Таза заттарды төмөндөгүдөй айрымалоого болот:''' |
| − | + | Таза заттар – 99% | |
| − | + | Химиялык жактан таза – 99,9% | |
| − | + | Анализ үчүн таза – 99,99% | |
| − | + | Өзгөчө таза – 99,99 9% | |
| − | + | Хромотографиялык жактан таза – башка заттар менен аралашпаган | |
| − | |||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | == | + | == Аралашмалардан таза заттарды бөлүп алуунун жолдору == |
{{center|[[Файл:Разделение смесей.mp4|750px]]}} | {{center|[[Файл:Разделение смесей.mp4|750px]]}} | ||
<br> | <br> | ||
| Строка 97: | Строка 100: | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | == | + | == Атомдор жана молекулалар. Атом–молекулалык окуу == |
| − | === | + | === Атомдор жана молекулалар жөнүндө алгачкы түшүнүктөрдүн пайда болушу === |
| − | {{left-p|[[file:Демокрит.jpg|150px|class=show-for-large-up| | + | {{left-p|[[file:Демокрит.jpg|150px|class=show-for-large-up|Байыркы грек философу Демокрит]]}} |
| − | {{center-p|[[file:Демокрит.jpg|250px|class=hide-for-large-up| | + | {{center-p|[[file:Демокрит.jpg|250px|class=hide-for-large-up|Байыркы грек философу Демокрит]]}} |
| − | + | Байыркы грек философу Демокрит 2500 жыл мурда жаратылыштагы бардык заттар эң майда көзгө көрүнбөгөн, бөлүнбөс кыймылдуу бөлүкчөлөрдөн–“атомдордон” тураарын айткан. ''“Атом”'' деген сөз грек тилинен – ''“бөлүнбөс”'' деп которулат. Кийинчерээк орто кылымдарда атом жөнүндөгү окуулар дин тарабынан куугунтукталган, бул илимдин, анын ичинен химия илиминин өнүгүүсүн кечендеткен. | |
| − | + | Молекула жана атом жөнүндөгү окуу XVIII–кылымдын орто ченинде улуу орус окумуштуусу Михаил Васильевич Ломоносов (1711 – 1765 жж.)тарабынын иштелип чыккан. Ал жаратылышта тело корпускулалардан (молекула) тураарын, ал эми алар элементтерден (атом) тураарын тастыктаган. | |
<br clear=all /> | <br clear=all /> | ||
| − | === | + | === Молекулалар жана атомдор === |
| − | {{right-p|[[file:Гидролиз воды 2.png|220px|class=show-for-large-up| | + | {{right-p|[[file:Гидролиз воды 2.png|220px|class=show-for-large-up|Сууну ажыратуу үчүн колдонулган аппарат (Гофман аппараты)]]}} {{right-p|[[file:Гидролиз воды.png|200px|class=show-for-large-up|Сууну ажыратуу үчүн колдонулган аппарат (Гофман аппараты)]]}} |
| − | {{center|[[file:Гидролиз воды 2.png|220px|class=hide-for-large-up| | + | {{center|[[file:Гидролиз воды 2.png|220px|class=hide-for-large-up|Сууну ажыратуу үчүн колдонулган аппарат (Гофман аппараты)]]}} <br> {{center|[[file:Гидролиз воды.png|200px|class=hide-for-large-up|Сууну ажыратуу үчүн колдонулган аппарат (Гофман аппараты)]]}} |
| − | + | Молекулалардын атомдордон түзүлөөрүн көптөгөн химиялык реакциялар аркылуу далилдөөгө болот. Мисалы, суу аркылуу турактуу электр тогун өткөрсөк, айнек идиштин бирөөнө газ бөлүнүп чыгат. Ага чычаланы алып келсек, ал жарык жалын чыгарып күйөт. Демек, бул газ – ''кычкылтек'' болуп саналат. Аппараттын экинчи айнек идишине андан эки эсе көп чогулган газга ширеңкени күйгүзүп туруп жакындатсак, ал газ өзү күйөт. Бул газ – ''суутек'' болуп саналат. | |
| − | + | {{center|[[file:Модел молекулы 2.png|500px|Суунун электр тогунун таасири астында ажырашы]]}} | |
| − | + | Бул кубулушту төмөнкүдөй түшүндүрүугө болот: Суунун молекуласы суутектин эки атомунан жана кычкылтектин бир атомунан турат. Суу аркылуу электр тогун өткөргөндө суунун молекуласы кычкылтектин жана суутектин атомдорунан ажырайт. | |
| − | + | Андан кийин атомдор эки–экиден кошулат да, суунун эки молекуласынан кычкылтектин эки атомдуу бир молекуласы жана суутектин эки атомдуу эки молекуласы пайда болот. | |
| − | + | {{center|[[file:Модел молекулы 1.png|500px|Суунун электр тогунун таасири астында ажырашы]]}} | |
| − | + | Молекула жана атом деген эмне? | |
| − | {{center|[[file:Модел молекулы 1.png|500px| | + | <div class="textblock">'''Молекула''' – бул көп заттардын өтө майда бөлүкчөлөрү, алардын курамы жана химиялык касиеттери берилген заттардыкындай эле болот. Молекулалар б.а. химиялык жактан бөлүнө турган бөлүкчөлөр химиялык реакция убагында ажырашат.</div> |
| − | |||
| − | <div class="textblock">''' | ||
<br> | <br> | ||
| − | <div class="textblock">''' | + | <div class="textblock">'''Атом''' – бул химиялык жактан бөлүнбөй турган заттын эң майда бөлүкчөсү. Молекулалар атомдордон айрымаланып, химиялык жактан бөлүнүшөт.</div> |
<br> | <br> | ||
| − | {{center|'''Молекула Атом | + | {{center|'''Молекула Атом Зат'''}} |
{{center|[[file:Молекула Атом Вещество.mp4|500px]]}} | {{center|[[file:Молекула Атом Вещество.mp4|500px]]}} | ||
| Строка 132: | Строка 133: | ||
<div class="show-for-large-up">{{right-p|[[file:Ломоносов.jpg|150px|Ломоносов, Михаил Васильевич]]}}</div> | <div class="show-for-large-up">{{right-p|[[file:Ломоносов.jpg|150px|Ломоносов, Михаил Васильевич]]}}</div> | ||
<div class="show-for-small-only">{{center-p|[[file:Ломоносов.jpg|250px|Ломоносов, Михаил Васильевич]]}}</div> | <div class="show-for-small-only">{{center-p|[[file:Ломоносов.jpg|250px|Ломоносов, Михаил Васильевич]]}}</div> | ||
| − | + | Атом–молекулалык окуу улуу орус окумуштуусу Михаил Васильевич Ломоносов (1711 – 1765 жж.) тарабынан өнүктүрүлүп, колдонулган. Ломоносовдун окуусунун негизи төмөнкү жоболордо берилген: | |
| − | '''1.''' | + | '''1.''' Бардык заттар “корпускулалардан” (Ломоносов молекулаларды атаган) турат. |
| − | '''2.''' | + | '''2.''' Молекулалар “элементтерден” (Ломоносов атомдорду атаган) турат. |
| − | '''3.''' | + | '''3.''' Бөлүкчөлөр –молекулалар жана атомдор тынымсыз кыймылда болушат. Телонун жылуулук абалы, бөлүкчөлөрдүн кыймылынын жыйынтыгы болуп саналат. |
| − | + | 4.Жөнөкөй заттын атомдору бир түрдүү атомдордон, татаал заттын молекулалары ар түрдүү атомдордон турат. | |
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | == | + | == Жөнөкөй жана татаал заттар == |
| − | + | Бир түрдүү атомдордон турган жөнөкөй заттарды (H<sub>2</sub>, O<sub>2</sub>,Cl<sub>2</sub>, P<sub>4</sub>, Na, Cu, Au) жана ар түрдүү атомдордон турган татаал заттарды (H<sub>2</sub>O,NH<sub>3</sub>, OF<sub>2</sub>, H<sub>2</sub>SO<sub>4</sub>, MgCl<sub>2</sub>,K<sub>2</sub>SO<sub>4</sub>) айрымалап бөлүшөт. | |
| − | {{center-p|[[file:Горение сахарозы.png|550px| | + | {{center-p|[[file:Горение сахарозы.png|550px|Сахарозанын ажырашы]]}} |
| − | + | Биз сахарозаны (C<sub>12</sub>H<sub>22</sub>O<sub>11</sub>) пробиркага салып, спирт шамына ысытабыз. Сахароза адегенде балкып эрийт да күңүрттөнө баштайт, андан кийин ажыроо башталып, сахароза карарат. | |
{{center-p|[[file:Простое и сложное вещество.png|550px|Простое и сложное вещество]]|Простое и сложное вещество}} | {{center-p|[[file:Простое и сложное вещество.png|550px|Простое и сложное вещество]]|Простое и сложное вещество}} | ||
| − | + | <big>'''Жыйынтык:'''</big> | |
| − | Сахароза | + | <div class="textblock> |
| + | Сахароза – татаал зат. Суу да татаал зат. Көмүр – жөнөкөй зат. Суутек– жөнөкөй зат. Кычкылтек– жөнөкөй зат.</div> | ||
| + | |||
| + | '''Жөнөкөй заттар''' – бул заттардын молекуласы бир түрдүү атомдордон турат. Химиялык реакция учурунда алар жөнөкөй заттарга ажырабайт. | ||
| − | ''' | + | '''Татаал заттар''' – бул заттардын молекуласы ар түрдүү атомдордон турат. Химиялык реакцияларда бир нече жөнөкөй заттарды пайда кылуу менен ажырайт. |
| − | |||
<br clear=all /> | <br clear=all /> | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | == | + | == Химиялык элементтер == |
| − | + | Химияда '''“атом”''' жана '''“молекула”''' деген терминден башка '''“элемент”''' деген түшүнүк да колдонулат. | |
| − | |||
| − | |||
| − | + | <div class="textblock">Атомдордун белгилүү бир түрү– химиялык элемент деп аталат.</div> | |
| − | + | Мисалы, суутектин атомдору– суутек элементи, кычкылтектин же сымаптын атомдору– кычкылтек жана сымап элементи деп аталат. Азыркы учурда 118 атомдун түрү, б.а. 500гө жакын жөнөкөй заттарды пайда кылган 118 химиялык элемент белгилүү. | |
| + | |||
<ul class="large-block-grid-2 small-block-grid-1"> | <ul class="large-block-grid-2 small-block-grid-1"> | ||
<li>{{center-p|[[file:Джон Дальтон.jpg|200px|Джон Дальтон]]}}</li> | <li>{{center-p|[[file:Джон Дальтон.jpg|200px|Джон Дальтон]]}}</li> | ||
<li>{{center-p|[[file:Символы Дальтона.jpg|150px|Предложенная Дальтоном система обозначений]]}}</li> | <li>{{center-p|[[file:Символы Дальтона.jpg|150px|Предложенная Дальтоном система обозначений]]}}</li> | ||
</ul> | </ul> | ||
| − | + | Башка илимдердей эле химия илиминде өзүнүн шарттуу белгилери, тили бар. XIX кылымда. бардык окумуштууларга түшүнүктүү болгон химиялык белгилерди түзүп чыгуу зарылдыгы келип чыкан. Биринчилерден болуп мындай белгилерди Дальтон сунуш кылган. Бирок, анын колдонуу ыңгайсыз болгон. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | === | + | === Химиялык элементтерди белгилениши === |
<ul class="large-block-grid-2 small-block-grid-1"> | <ul class="large-block-grid-2 small-block-grid-1"> | ||
<li>{{center-p|[[file:Берцелиус.jpg|200px|Берцелиус, Йёнс Якоб]]}}</li> | <li>{{center-p|[[file:Берцелиус.jpg|200px|Берцелиус, Йёнс Якоб]]}}</li> | ||
| − | <li> | + | <li>XIX кылымдын башында швед окумуштуусу Й.Я. Берцелиус химиялык элементтерди алардын латынча аталышынын биринчи эки тамгасы менен белгилөөнү сунуштаган.</li> |
</ul> | </ul> | ||
<div class="textblock"> | <div class="textblock"> | ||
| Строка 203: | Строка 201: | ||
</li> | </li> | ||
<li> | <li> | ||
| − | + | Суутек химиялык элементи ''(Hydrogenium)'' – '''Н'''. Эгерде бир нече элементтин аталышы бирдей тамга менен башталса, анда элементтин белгисине андан кийинки тамганы кошуп белгиленген. Мисалы, сымап, ''(Hydrargyrum)'' '''Hg''' деп белгиленген. | |
</li></ul></div> | </li></ul></div> | ||
<ul class="large-block-grid-3 small-block-grid-1"> | <ul class="large-block-grid-3 small-block-grid-1"> | ||
<li> | <li> | ||
{|class="tbtext mw-datatable" align="center" | {|class="tbtext mw-datatable" align="center" | ||
| − | |+ | + | |+Кээ бир химиялык элементтер тамганын окулушу менен аталат: |
|- | |- | ||
| − | ! | + | !Элементтин аты |
| − | ! | + | !Белгиси |
| − | ! | + | !Аталышы |
|- | |- | ||
| − | | | + | |Кычкылтек |
|О | |О | ||
|О | |О | ||
|- | |- | ||
| − | | | + | |Күкүрт |
|S | |S | ||
|Эс | |Эс | ||
| Строка 226: | Строка 224: | ||
|Эн | |Эн | ||
|- | |- | ||
| − | | | + | |Көмүртек |
|С | |С | ||
|Це | |Це | ||
| Строка 233: | Строка 231: | ||
<li> | <li> | ||
{|class="tbtext mw-datatable" align="center" | {|class="tbtext mw-datatable" align="center" | ||
| − | |+ | + | |+Башкалары элементтин аты менен аталат: |
|- | |- | ||
| − | ! | + | !Элементтин аты |
| − | ! | + | !Белгиси |
| − | ! | + | !Аталышы |
|- | |- | ||
|Натрий | |Натрий | ||
| Строка 259: | Строка 257: | ||
<br> | <br> | ||
{|class="tbtext mw-datatable" align="center" | {|class="tbtext mw-datatable" align="center" | ||
| − | |+ | + | |+Кээ бир элементтер латынча аталышы менен аталат: |
|- | |- | ||
| − | ! | + | !Элементтин аты |
| − | ! | + | !Белгиси |
| − | ! | + | !Аталышы |
|- | |- | ||
|Кремний | |Кремний | ||
| Строка 269: | Строка 267: | ||
|силициум | |силициум | ||
|- | |- | ||
| − | | | + | |Сымап |
|Hg | |Hg | ||
|гидраргирум | |гидраргирум | ||
|- | |- | ||
| − | | | + | |Жез |
|Cu | |Cu | ||
|купрум | |купрум | ||
|- | |- | ||
| − | | | + | |Темир |
|Fe | |Fe | ||
|феррум | |феррум | ||
| Строка 284: | Строка 282: | ||
</ul> | </ul> | ||
| − | == | + | == Химиялык элементтин аталышынын маанилери == |
| − | 1) | + | 1) Заттын касиетин билдирүүчү: Суутек – “сууну пайда кылуучу”; Фосфор – “жарыкты алып жүрүүчү”; Кычкылтек – “кислотаны пайда кылуучу” |
| − | 2) | + | 2) Асман телолорунун аты менен : Селен – Селена (ай); Теллур – Теллурис (Жер). |
| − | 3) | + | 3) Мифтерден алынган аталыштар: Тантал (Зевстин уулу). |
| − | 4) | + | 4) Мамлекеттердин атынан : Германий (Германия); Галлий (Франция); Полоний (Польша). |
| − | 5) | + | 5) Окумуштуулардын аты менен : Кюрий; Эйнштейний; Лоуренсий. |
| − | <div class="textblock"> | + | <div class="textblock">Атомдордун белгилүү бир түрү – химиялык элемент деп аталат</div> |
| − | ''' | + | Химиялык '''элемент''' жана '''жөнөкөй зат''' |
| − | + | Химиялык '''элемент''' менен '''жөнөкөй затты''' айрымалоо үчүн жөнөкөй жана татаал заттардын касиеттерин салыштырып көрүү керек. Мисалы, кычкылтекти жөнөкөй зат катары мүнөздөсөк, ал өңсүз, түссүз, күйүүгө жардам берген, дем ала турган газ. Кычкылтек жөнөкөй заты кычкылтектин молекуласынан, ал эми молекула эки атомдон турат. Ошону менен бирге эле кычкылтек көмүртектин (II) оксидинин (ис газы) жана суунун курамына кирет. | |
<ul class="large-block-grid-4 small-block-grid-2"> | <ul class="large-block-grid-4 small-block-grid-2"> | ||
| − | <li>{{center-p|[[file:Вода.png|110px| | + | <li>{{center-p|[[file:Вода.png|110px|Суу]]}}</li> |
| − | <li>{{center-p|[[file:Водород.png|100px| | + | <li>{{center-p|[[file:Водород.png|100px|Суутек]]}}</li> |
| − | <li>{{center-p|[[file:Кислород.png|100px| | + | <li>{{center-p|[[file:Кислород.png|100px|Кычкылтек]]}}</li> |
| − | <li>{{center-p|[[file:Угарный газ.png|115px| | + | <li>{{center-p|[[file:Угарный газ.png|115px|Көмүртектин (IV) оксиди (ис газы)]]}}</li> |
</ul> | </ul> | ||
{{left-p|[[file:Кислород в воде.jpg|250px|class=show-for-large-up|Кислород в воде]]}} | {{left-p|[[file:Кислород в воде.jpg|250px|class=show-for-large-up|Кислород в воде]]}} | ||
{{center|[[file:Кислород в воде.jpg|250px|class=hide-for-large-up|Кислород в воде]]}} | {{center|[[file:Кислород в воде.jpg|250px|class=hide-for-large-up|Кислород в воде]]}} | ||
| − | + | Бирок, суунун жана ис газынын курамына кычкылтек жөнөкөй зат катары эмес, атом катары кирет. Демек, кычкылтек атому менен дем алууга мүмкүн эмес. Мисалы, балыктар суунун молекуласындагы кычкылтек менен эмес, сууда эриген кычкылтек менен дем алышат. | |
| − | |||
| − | |||
| − | + | Ошондуктан, химиялык бирикменин курамы жөнүндө сөз кылганда, берилген зат жөнөкөй зат катары эмес, атомдун белгилүү бир түрү–химиялык элемент катары кирээрин билишибиз керек. Татаал заттарды ажыратканда атомдор эркин түрдө жана бири–бири менен биригип, жөнөкөй зат катары бөлүнүп чыгат. Жөнөкөй заттар бир түрдүү атомдордон турат. '''“Химиялык элемент”''' жана '''“жөнөкөй зат”''' деген түшүнүктөрдү айрымалап. билишибиз керек.Бир эле химиялык элемент бир нече жөнөкөй затты пайда кылышы мүмкүн. Мисалы, кычкылтектин атому кычкылтектин эки атомдуу молекуласын жана үч атомдуу–озонду пайда кылат. Кычкылтек жана озон эки башка жөнөкөй зат. | |
<ul class="large-block-grid-2 small-block-grid-1"> | <ul class="large-block-grid-2 small-block-grid-1"> | ||
| − | <li>{{center-p|[[file:Кислород.png|250px| | + | <li>{{center-p|[[file:Кислород.png|250px|Кычкылтек]]}}</li> |
<li>{{center-p|[[file:Озон.png|250px|Озон]]}}</li> | <li>{{center-p|[[file:Озон.png|250px|Озон]]}}</li> | ||
</ul> | </ul> | ||
| − | + | Бул жөнөкөй заттардын саны химиялык элементтердин санынан алда канча көп экендигин түшүндүрүп турат. | |
| + | |||
| + | '''«Химиялык элемент»''' деген түшүнүктү пайдалануу менен жөнөкөй жана татаал заттарга төмөнкүдөй аныктама берүүгө болот: | ||
| − | + | <div class="textblock">Бир химиялык элементтин атомдорунан турган заттар жөнөкөй заттар деп аталат. </div> | |
| − | <div class="textblock"> | + | |
| − | + | <div class="textblock">Ар түрдүү химиялык элементтин атомдорунан турган заттар татаал заттар деп аталат. </div> | |
| + | |||
| + | Татаал заттар химиялык бирикмелер деп да аталат. | ||
| − | |||
| − | |||
| − | |||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
== Глоссарий== | == Глоссарий== | ||
| − | :{{bib|'''Аллотропия''' — | + | :{{bib|'''Аллотропия''' — химиялык элементтин курамы жана касиети боюнча айрымаланган бир нече жөнөкөй зат катары түр өзгөрүшү. Курамы жана касиети менен айрымаланган бул жөнөкөй заттар– аллотропиялык формалар же модификациялар деп аталат. Мисалы, графит жана алмаз — көмүртектин эки аллотропиялык формасы (модификациясы). Молекулалык кычкылтек жана озон — кычкылтектин эки аллотропиялык модификациясы, белгилүү бир шарттарда аллотропиялык модификациялар бири–бирине өтө алат.}} |
| − | :{{bib|'''Атом''' | + | :{{bib|'''Атом''' – бул химиялык касиетти алып жүргөн элементтин эң майда бөлүкчөсү. Атом – протон, нейтрон жана электрондордон турат.}} |
| − | :{{bib|''' | + | :{{bib|'''Атом''' – бирикмелердин молекулаларын түзгөн элементтин эң кичине бөлүкчөсү.}} |
| − | :{{bib | + | :{{bib'''|Жөнөкөй заттар''' — молекуласы бир түрдүү атомдордон турган заттар: суутек, кычкылтек ж.б.}} |
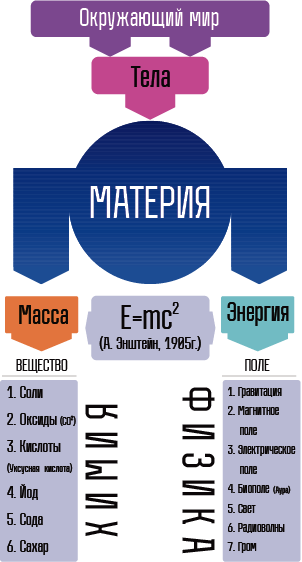
| − | :{{bib|''' | + | :{{bib|'''Зат''' – тынч абалында массага ээ болгон материянын айрым түрү.}} |
| − | :{{bib|''' | + | :{{bib|'''Заттын касиети''' – заттардын окшоштук, айрымачылык белгилери.}} |
| − | :{{bib|''' | + | :{{bib|'''Илим''' – жаратылыштын, коомдун жана ой жүгүртүүнүн өнүгүүсүнүн закон ченемдүүлүктөрүн үйрөткөн билимдердин системасы.}} |
| − | :{{bib | + | :{{bib|'''Касиети''' — заттарды бири–биринен айрымалап турган белгилер, алар химиялык жана физикалык болуп бөлүнөт нде масса сакталат, ал эми салмак 0го– салмаксыздык абалга келет).}} |
| − | :{{bib|''' | + | :{{bib'''|Кубулуштар''' – жаратылышта заттарда болуучу өзгөрүүлөр.}} |
| − | :{{bib|''' | + | :{{bib|'''Масса''' – заттын касиети. Салмак – заттын планетанын борборуна болгон тартылуу күчү. (Космос мейкиндигинде космос корабли Материя – бизди курчап турган дүйнө.}} |
| − | :{{bib|''' | + | :{{bib|'''Молекула''' (жаңы латын. molecula, кичирейтүү. лат. moles — масса) – берилген заттын химиялык касиетин алып жүргөн, өз ара химиялык байланыш менен байланышкан, атомдордон турган, заттын эң майда бөлүкчөсү.}} |
| − | :{{bib|'''Химия''' | + | :{{bib|'''Татаал заттар''' – молекуласы ар түрдүү атомдордон турган заттар: кислоталар, суу ж.б.}} |
| − | :{{bib|''' | + | :{{bib|'''Химия''' – заттар, алардын касиеттери жана алардын өзгөрүшү менен жүргөн айланууларды үйрөтүүчү илим.}} |
| − | :{{bib|''' | + | :{{bib|'''Химиялык элемент''' — оң заряддалган ядродон турган атомдордун белгилүү бир түрү.}} |
| + | :{{bib|'''Эталон''' – салыштыруу ченеми.}} | ||
| − | == | + | == Пайдалуу шилтемелер == |
{{bib|«Химия как часть естествознания. Понятие о веществ»: Сайт "Химуля.com " [Электронный ресурс]//URL: https://sites.google.com/site/himulacom/zvonok-na-urok/8-klass (дата обращения: 04.03.2018)}} | {{bib|«Химия как часть естествознания. Понятие о веществ»: Сайт "Химуля.com " [Электронный ресурс]//URL: https://sites.google.com/site/himulacom/zvonok-na-urok/8-klass (дата обращения: 04.03.2018)}} | ||
{{bib|«100 интересных фактов о химии»: Сайт «100-Фактов.Ру» [Электронный ресурс]//URL: http://100-faktov.ru/100-interesnyx-faktov-o-ximii/ (дата обращения: 10.09.2017)}} | {{bib|«100 интересных фактов о химии»: Сайт «100-Фактов.Ру» [Электронный ресурс]//URL: http://100-faktov.ru/100-interesnyx-faktov-o-ximii/ (дата обращения: 10.09.2017)}} | ||
| Строка 372: | Строка 370: | ||
<div class="sbstyle"> | <div class="sbstyle"> | ||
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric"> | + | <div class="large-10 small-10 large-centered small-centered columns rubric">Коопсуздукту сактайлы! </div> |
</div> | </div> | ||
{{center|[[file:1beso.png|270px]]}}<br> | {{center|[[file:1beso.png|270px]]}}<br> | ||
| Строка 396: | Строка 394: | ||
<div class="sbstyle"> | <div class="sbstyle"> | ||
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">5 | + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Эң кызыктуу, таң калаарлык 5 химиялык реакция</div> |
</div> | </div> | ||
{{center|[[file:5 эффектных физических и химических реакций.mp4|270px]]}} | {{center|[[file:5 эффектных физических и химических реакций.mp4|270px]]}} | ||
| Строка 403: | Строка 401: | ||
<div class="sbstyle"> | <div class="sbstyle"> | ||
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px"> | + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Кызыктар дүйнөсүндө!</div> |
</div> | </div> | ||
| − | * | + | *Эгерде 100 млн суутектин атомун катары менен тизсек, алар болгону 1 см болгон гана чынжырчаны пайда кылат. |
| − | + | * Швед окумуштуусу Карл Шеелени химиялык элементтерди ачуу боюнча рекордсмен десек да болот. Ал хлорду, фторду, барийди, вольфрамды, кычкылтекти , марганецти жана молибденди ачкан. | |
| − | * | + | * Көптөгөн химиялык элементтер мамлекеттин ж.б. географиялык аймактардын аттары менен аталат. Мисалы, 4 элемент — иттрий, иттербий, тербий и эрбий — швед айылы Иттербюнун аты менен аталган. Ал жерде сейрек кездешүүчү металлдардын чоң запасы табылган. |
| − | + | *Лампочкаларды жасоодо аргон колдонулат | |
| − | * | + | * Асыл газдардын ичинен эн жеңили гелий болуп саналат |
| − | + | * Изумруддун курамында бериллий болот | |
| − | * | + | * Отту жашыл түскө боёо үчүн борду колдонушат |
| − | + | *Азоттун аң сезимди бузуп, акылдан адаштыруучу касиети бар | |
| − | * | + | * Неон аркылуу электр тогун өткөргөндө, ал кызыл түстү пайда кылат |
| − | + | * Океандарда натрийдин чоң запасы бар | |
| − | * | + | *Компьютердин микросхемасында кремний колдонулат |
| − | + | *Ширеңке өндүрүүдө фосфор пайдаланылат | |
| − | * | + | *Хлор дем алуу органдарынын аллергиясын пайда кылышы мүмкүн. |
| − | |||
| − | * | ||
| − | |||
| − | *Неон | ||
| − | |||
| − | * | ||
| − | |||
| − | * | ||
| − | |||
| − | * | ||
| − | |||
| − | *Хлор | ||
</div> | </div> | ||
<div class="sbstyle"> | <div class="sbstyle"> | ||
| Строка 468: | Строка 454: | ||
</div> | </div> | ||
</div> | </div> | ||
| − | {{lang| | + | {{lang|Химия: Первоначальные химические представления}} |
[[Category:Средняя школа]] | [[Category:Средняя школа]] | ||
[[Category:Химия]] | [[Category:Химия]] | ||
Версия 11:07, 28 апреля 2018
Аралашмаларды бөлүүнүн жолдору Атомдор жана молекулалар. Атом-молекулалык окуу
Жөнөкөй жана татаал заттар Химиялык элементтер
Содержание
- 1 Химия эмнени окутат?
- 2 Физикалык жана химиялык кубулуштар
- 3 Заттарды мүнөздөп жазуу
- 4 Таза заттар жана аралашмалар
- 5 Аралашмалардан таза заттарды бөлүп алуунун жолдору
- 6 Атомдор жана молекулалар. Атом–молекулалык окуу
- 7 Жөнөкөй жана татаал заттар
- 8 Химиялык элементтер
- 9 Химиялык элементтин аталышынын маанилери
- 10 Глоссарий
- 11 Пайдалуу шилтемелер
- 12 Бибилиография:
Химия эмнени окутат?
-
Химия – заттардын курамы, түзүлүшү, касиеттери жана алардын айлануулары жөнүндөгү илим
-
Физикалык жана химиялык кубулуштар
Физикалык кубулуштар
Ар бир зат физикалык касиеттерге ээ болуу менен бирге. башка заттарга айлануу жөндөмдүүлүгүнө да ээ болот. Заттардын айланышы деген эмне?
Элестетип көрөлүчү, биз сууну ысытсак, ал буулана баштайт. Бул учурда зат башка затка айландыбы? Жок, суунун бууланышы – бул физикалык кубулуш. Суунун буусу– бул суюктук түрүндө эмес, газ агрегаттык абалындагы химиялык зат, суу болуп саналат.
Физикалык кубулуштар – бул баштапкы зат башка жаңы затка айланбай, анын агрегаттык абалы же формасы гана өзгөргөн кубулуштар.
Химиялык кубулуштар же химиялык реакциялар
Башка мисалды – темирдин дат басышын карап көрөлү. Темир нымдуу аба менен тийишкенде, аны дат басат. Темирдин даты – күрөң түстөгү морт зат. Демек, темир, кычкылтек жана суу менен аракеттенишип, темирдин датын пайда кылды, б.а. бир зат башка жаңы затка айланды. Бул кубулуш химиялык кубулуш болуп саналат. Ал эми химиялык кубулушту химиялык реакция деп аташат.
Химиялык реакцияга катышкан заттар (мисалы: темир, кычкылтек жана суу), баштапкы заттар деп аталат.
Реакциянын натыйжасында пайда болгон заттар (темирдин даты), реакциянын продуктусу деп аталат.
Жыйынтык
Заттарды мүнөздөп жазуу
Ар бир химиялык затты физикалык жактан мүнөздөөгө болот:
- 1. Агрегаттык абалы. Катуу, суюк, газ абалында жана плазма түрүндө болот. (Токамак– плазманы алуучу курал).
- 2. Өңү–түсү. Металлдар күмүш сымал ачык түстөн, күңүрт–боз түскө чейин, көгүлтүр же кызгылт–сары өңдө кубулуп турат. Металл эместер түссүз (кычкылтек, азот), ак түстө (фосфор), сары, (күкүрт, хлор) кызгылт (фосфор), жашыл (фтор) же кочкул–боз (иод) түстө болушат.
- 3. Тыгыздыгы. металлдардын ичинен эң жеңили – литий – 0,53 г/см3 , эң оору – осмий – 22,7 г/см3.
- 4. Жылуулукту жана электр тогун өткөргүчтүк. Күмүш жана алтындын артыкчылыгы болсо да, алардын кымбат болгондугуна байланыштуу күндөлүк турмушта жез жана алюминий кеңири колдонулат.
- 5. Балкуу жана кайноо температуралары (жекече мүнөздөмөсүнөн кара)
Таза заттар жана аралашмалар
Заттын физикалык касиеттери (эригичтиги, кайноо температурасы) өзгөрүүсүз, туруктуу болсо, мындай заттарды таза заттар дейбиз.
Жаратылышта абсолюттук таза заттар эркин түрдө кездешпейт. Заттардын тазалыгы аларды тазалоонун деңгээлине көз каранды болот.
Аралашма деген түшүнүктү XVII кылымда англиялык окумуштуу Роберт Бойль киргизген. Ал «Аралашма – ар түрдүү компоненттерден турган бирдиктүү система» деген аныктама берген.
Аралашмалар – бир тектүү жана бир тектүү эмес болушат. Бир тектүүлөр– сыртынан караганда андагы таза заттарды өзүнчө жөнөкөй көз же микроскоп менен да көрүүгө мүмкүн эмес. Бир тектүү эместер аралашмаларды көз же атайын приборлор менен көрүп эле аларды айрымалоого болот. Мисалы. катуу заттардын аралашмасы – топурак менен кумдун, күкүрт менен темирдин таарындыларын жөнөкөй эле көз менен аныктоого болот.
Таза заттарды төмөндөгүдөй айрымалоого болот:
Таза заттар – 99%
Химиялык жактан таза – 99,9%
Анализ үчүн таза – 99,99%
Өзгөчө таза – 99,99 9%
Хромотографиялык жактан таза – башка заттар менен аралашпаган
Аралашмалардан таза заттарды бөлүп алуунун жолдору
Атомдор жана молекулалар. Атом–молекулалык окуу
Атомдор жана молекулалар жөнүндө алгачкы түшүнүктөрдүн пайда болушу
Байыркы грек философу Демокрит 2500 жыл мурда жаратылыштагы бардык заттар эң майда көзгө көрүнбөгөн, бөлүнбөс кыймылдуу бөлүкчөлөрдөн–“атомдордон” тураарын айткан. “Атом” деген сөз грек тилинен – “бөлүнбөс” деп которулат. Кийинчерээк орто кылымдарда атом жөнүндөгү окуулар дин тарабынан куугунтукталган, бул илимдин, анын ичинен химия илиминин өнүгүүсүн кечендеткен.
Молекула жана атом жөнүндөгү окуу XVIII–кылымдын орто ченинде улуу орус окумуштуусу Михаил Васильевич Ломоносов (1711 – 1765 жж.)тарабынын иштелип чыккан. Ал жаратылышта тело корпускулалардан (молекула) тураарын, ал эми алар элементтерден (атом) тураарын тастыктаган.
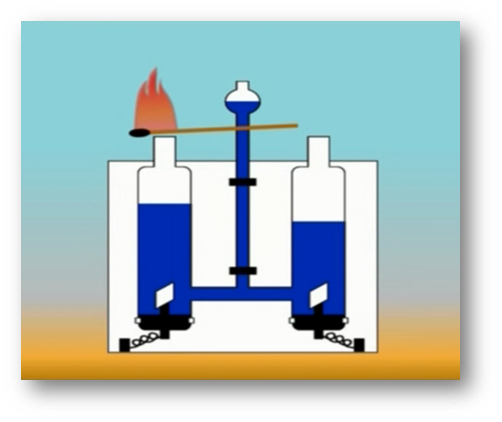
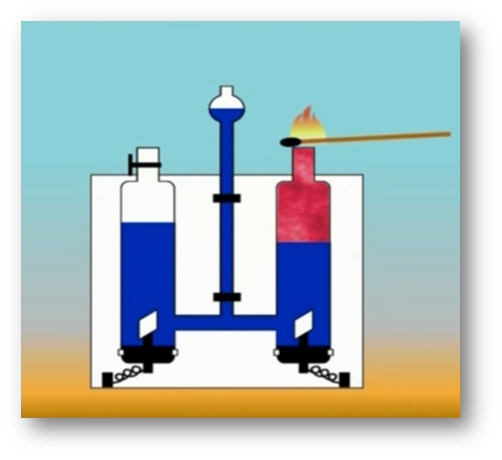
Молекулалар жана атомдор
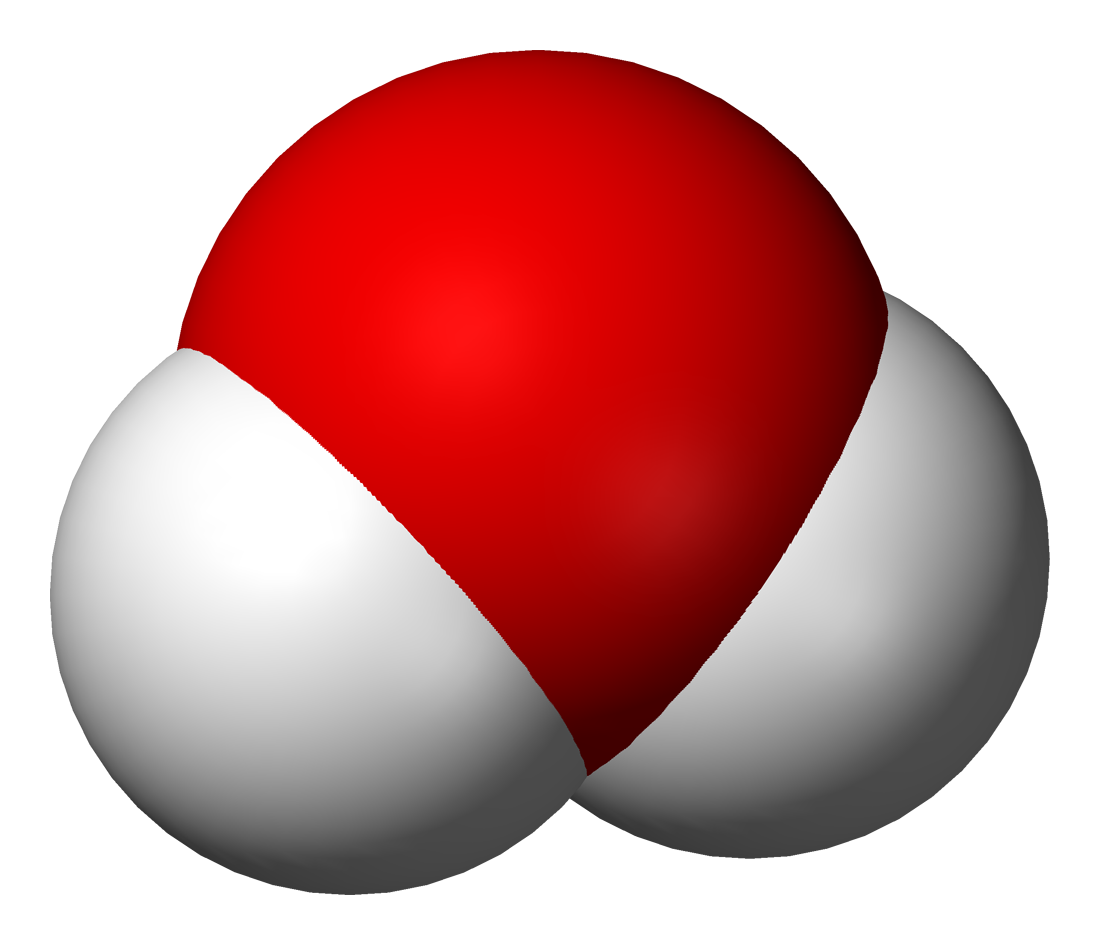
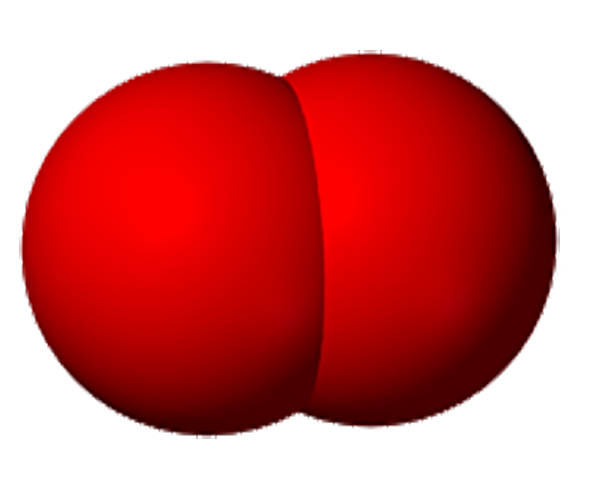
Молекулалардын атомдордон түзүлөөрүн көптөгөн химиялык реакциялар аркылуу далилдөөгө болот. Мисалы, суу аркылуу турактуу электр тогун өткөрсөк, айнек идиштин бирөөнө газ бөлүнүп чыгат. Ага чычаланы алып келсек, ал жарык жалын чыгарып күйөт. Демек, бул газ – кычкылтек болуп саналат. Аппараттын экинчи айнек идишине андан эки эсе көп чогулган газга ширеңкени күйгүзүп туруп жакындатсак, ал газ өзү күйөт. Бул газ – суутек болуп саналат.
Бул кубулушту төмөнкүдөй түшүндүрүугө болот: Суунун молекуласы суутектин эки атомунан жана кычкылтектин бир атомунан турат. Суу аркылуу электр тогун өткөргөндө суунун молекуласы кычкылтектин жана суутектин атомдорунан ажырайт.
Андан кийин атомдор эки–экиден кошулат да, суунун эки молекуласынан кычкылтектин эки атомдуу бир молекуласы жана суутектин эки атомдуу эки молекуласы пайда болот.
Молекула жана атом деген эмне?
Атомно-молекулярное учение
Атом–молекулалык окуу улуу орус окумуштуусу Михаил Васильевич Ломоносов (1711 – 1765 жж.) тарабынан өнүктүрүлүп, колдонулган. Ломоносовдун окуусунун негизи төмөнкү жоболордо берилген:
1. Бардык заттар “корпускулалардан” (Ломоносов молекулаларды атаган) турат.
2. Молекулалар “элементтерден” (Ломоносов атомдорду атаган) турат.
3. Бөлүкчөлөр –молекулалар жана атомдор тынымсыз кыймылда болушат. Телонун жылуулук абалы, бөлүкчөлөрдүн кыймылынын жыйынтыгы болуп саналат.
4.Жөнөкөй заттын атомдору бир түрдүү атомдордон, татаал заттын молекулалары ар түрдүү атомдордон турат.
Жөнөкөй жана татаал заттар
Бир түрдүү атомдордон турган жөнөкөй заттарды (H2, O2,Cl2, P4, Na, Cu, Au) жана ар түрдүү атомдордон турган татаал заттарды (H2O,NH3, OF2, H2SO4, MgCl2,K2SO4) айрымалап бөлүшөт.
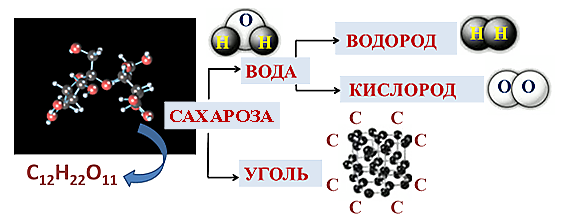
Биз сахарозаны (C12H22O11) пробиркага салып, спирт шамына ысытабыз. Сахароза адегенде балкып эрийт да күңүрттөнө баштайт, андан кийин ажыроо башталып, сахароза карарат.
Жыйынтык:
Жөнөкөй заттар – бул заттардын молекуласы бир түрдүү атомдордон турат. Химиялык реакция учурунда алар жөнөкөй заттарга ажырабайт.
Татаал заттар – бул заттардын молекуласы ар түрдүү атомдордон турат. Химиялык реакцияларда бир нече жөнөкөй заттарды пайда кылуу менен ажырайт.
Химиялык элементтер
Химияда “атом” жана “молекула” деген терминден башка “элемент” деген түшүнүк да колдонулат.
Мисалы, суутектин атомдору– суутек элементи, кычкылтектин же сымаптын атомдору– кычкылтек жана сымап элементи деп аталат. Азыркы учурда 118 атомдун түрү, б.а. 500гө жакын жөнөкөй заттарды пайда кылган 118 химиялык элемент белгилүү.
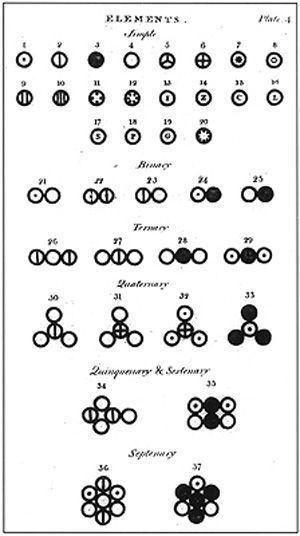
Башка илимдердей эле химия илиминде өзүнүн шарттуу белгилери, тили бар. XIX кылымда. бардык окумуштууларга түшүнүктүү болгон химиялык белгилерди түзүп чыгуу зарылдыгы келип чыкан. Биринчилерден болуп мындай белгилерди Дальтон сунуш кылган. Бирок, анын колдонуу ыңгайсыз болгон.
Химиялык элементтерди белгилениши
- XIX кылымдын башында швед окумуштуусу Й.Я. Берцелиус химиялык элементтерди алардын латынча аталышынын биринчи эки тамгасы менен белгилөөнү сунуштаган.
-
Название Латинское название Символ Водород Hydrogenium H Ртуть Hydrargyrum Hg - Суутек химиялык элементи (Hydrogenium) – Н. Эгерде бир нече элементтин аталышы бирдей тамга менен башталса, анда элементтин белгисине андан кийинки тамганы кошуп белгиленген. Мисалы, сымап, (Hydrargyrum) Hg деп белгиленген.
-
Кээ бир химиялык элементтер тамганын окулушу менен аталат: Элементтин аты Белгиси Аталышы Кычкылтек О О Күкүрт S Эс Азот N Эн Көмүртек С Це -
Башкалары элементтин аты менен аталат: Элементтин аты Белгиси Аталышы Натрий Na Натрий Калий K Калий Хлор Cl Хлор Фтор F Фтор -
Кээ бир элементтер латынча аталышы менен аталат: Элементтин аты Белгиси Аталышы Кремний Si силициум Сымап Hg гидраргирум Жез Cu купрум Темир Fe феррум
Химиялык элементтин аталышынын маанилери
1) Заттын касиетин билдирүүчү: Суутек – “сууну пайда кылуучу”; Фосфор – “жарыкты алып жүрүүчү”; Кычкылтек – “кислотаны пайда кылуучу”
2) Асман телолорунун аты менен : Селен – Селена (ай); Теллур – Теллурис (Жер).
3) Мифтерден алынган аталыштар: Тантал (Зевстин уулу).
4) Мамлекеттердин атынан : Германий (Германия); Галлий (Франция); Полоний (Польша).
5) Окумуштуулардын аты менен : Кюрий; Эйнштейний; Лоуренсий.
Химиялык элемент жана жөнөкөй зат
Химиялык элемент менен жөнөкөй затты айрымалоо үчүн жөнөкөй жана татаал заттардын касиеттерин салыштырып көрүү керек. Мисалы, кычкылтекти жөнөкөй зат катары мүнөздөсөк, ал өңсүз, түссүз, күйүүгө жардам берген, дем ала турган газ. Кычкылтек жөнөкөй заты кычкылтектин молекуласынан, ал эми молекула эки атомдон турат. Ошону менен бирге эле кычкылтек көмүртектин (II) оксидинин (ис газы) жана суунун курамына кирет.
Бирок, суунун жана ис газынын курамына кычкылтек жөнөкөй зат катары эмес, атом катары кирет. Демек, кычкылтек атому менен дем алууга мүмкүн эмес. Мисалы, балыктар суунун молекуласындагы кычкылтек менен эмес, сууда эриген кычкылтек менен дем алышат.
Ошондуктан, химиялык бирикменин курамы жөнүндө сөз кылганда, берилген зат жөнөкөй зат катары эмес, атомдун белгилүү бир түрү–химиялык элемент катары кирээрин билишибиз керек. Татаал заттарды ажыратканда атомдор эркин түрдө жана бири–бири менен биригип, жөнөкөй зат катары бөлүнүп чыгат. Жөнөкөй заттар бир түрдүү атомдордон турат. “Химиялык элемент” жана “жөнөкөй зат” деген түшүнүктөрдү айрымалап. билишибиз керек.Бир эле химиялык элемент бир нече жөнөкөй затты пайда кылышы мүмкүн. Мисалы, кычкылтектин атому кычкылтектин эки атомдуу молекуласын жана үч атомдуу–озонду пайда кылат. Кычкылтек жана озон эки башка жөнөкөй зат.
Бул жөнөкөй заттардын саны химиялык элементтердин санынан алда канча көп экендигин түшүндүрүп турат.
«Химиялык элемент» деген түшүнүктү пайдалануу менен жөнөкөй жана татаал заттарга төмөнкүдөй аныктама берүүгө болот:
Татаал заттар химиялык бирикмелер деп да аталат.
Глоссарий
- Аллотропия — химиялык элементтин курамы жана касиети боюнча айрымаланган бир нече жөнөкөй зат катары түр өзгөрүшү. Курамы жана касиети менен айрымаланган бул жөнөкөй заттар– аллотропиялык формалар же модификациялар деп аталат. Мисалы, графит жана алмаз — көмүртектин эки аллотропиялык формасы (модификациясы). Молекулалык кычкылтек жана озон — кычкылтектин эки аллотропиялык модификациясы, белгилүү бир шарттарда аллотропиялык модификациялар бири–бирине өтө алат.
- Атом – бул химиялык касиетти алып жүргөн элементтин эң майда бөлүкчөсү. Атом – протон, нейтрон жана электрондордон турат.
- Атом – бирикмелердин молекулаларын түзгөн элементтин эң кичине бөлүкчөсү.
- Шаблон:Bib'''
- Зат – тынч абалында массага ээ болгон материянын айрым түрү.
- Заттын касиети – заттардын окшоштук, айрымачылык белгилери.
- Илим – жаратылыштын, коомдун жана ой жүгүртүүнүн өнүгүүсүнүн закон ченемдүүлүктөрүн үйрөткөн билимдердин системасы.
- Касиети — заттарды бири–биринен айрымалап турган белгилер, алар химиялык жана физикалык болуп бөлүнөт нде масса сакталат, ал эми салмак 0го– салмаксыздык абалга келет).
- Шаблон:Bib'''
- Масса – заттын касиети. Салмак – заттын планетанын борборуна болгон тартылуу күчү. (Космос мейкиндигинде космос корабли Материя – бизди курчап турган дүйнө.
- Молекула (жаңы латын. molecula, кичирейтүү. лат. moles — масса) – берилген заттын химиялык касиетин алып жүргөн, өз ара химиялык байланыш менен байланышкан, атомдордон турган, заттын эң майда бөлүкчөсү.
- Татаал заттар – молекуласы ар түрдүү атомдордон турган заттар: кислоталар, суу ж.б.
- Химия – заттар, алардын касиеттери жана алардын өзгөрүшү менен жүргөн айланууларды үйрөтүүчү илим.
- Химиялык элемент — оң заряддалган ядродон турган атомдордун белгилүү бир түрү.
- Эталон – салыштыруу ченеми.
Пайдалуу шилтемелер
Бибилиография:
- А. В. Мануйлов, В. И. Родионов.Основы химии. Интернет-учебник.
- Г.В. Пчелкина. Химуля
- 100 интересных фактов о химии.
- Толковый словарь по химии
- «Семьдесят богатырей», А. Ивич; Рис. Э. Беньяминсона, Б. Кыштымова, М. Дет. лит. 1986
химические реакции
- Эгерде 100 млн суутектин атомун катары менен тизсек, алар болгону 1 см болгон гана чынжырчаны пайда кылат.
- Швед окумуштуусу Карл Шеелени химиялык элементтерди ачуу боюнча рекордсмен десек да болот. Ал хлорду, фторду, барийди, вольфрамды, кычкылтекти , марганецти жана молибденди ачкан.
- Көптөгөн химиялык элементтер мамлекеттин ж.б. географиялык аймактардын аттары менен аталат. Мисалы, 4 элемент — иттрий, иттербий, тербий и эрбий — швед айылы Иттербюнун аты менен аталган. Ал жерде сейрек кездешүүчү металлдардын чоң запасы табылган.
- Лампочкаларды жасоодо аргон колдонулат
- Асыл газдардын ичинен эн жеңили гелий болуп саналат
- Изумруддун курамында бериллий болот
- Отту жашыл түскө боёо үчүн борду колдонушат
- Азоттун аң сезимди бузуп, акылдан адаштыруучу касиети бар
- Неон аркылуу электр тогун өткөргөндө, ал кызыл түстү пайда кылат
- Океандарда натрийдин чоң запасы бар
- Компьютердин микросхемасында кремний колдонулат
- Ширеңке өндүрүүдө фосфор пайдаланылат
- Хлор дем алуу органдарынын аллергиясын пайда кылышы мүмкүн.
Что такое химия?
Одна из множества естественных наук, скажет среднестатистический обыватель. Но кто бы мог подумать, проходя мимо полок в магазине, или проезжая мимо заводов и фабрик, что все это — самый настоящий результат химических превращений?
Нескончаемый каскад реакций дает нам удивительные возможности делать жизнь более комфортной.
- Баночки с кремами, тюбики с краской для волос или зубной пастой, йогурты, сыры, пиво — это все результат химических преобразований.
- Нефтедобывающая и нефтеперерабатывающая промышленности основаны на циклах превращений и переходов одних нефтяных компонентов в другие. Бензин имеет множество марок, машинные масла тоже бывают разных сортов.
- Одежда, предметы быта (вплоть до вилок и ножей), все это – химия. Она дарит нам и красивые праздники, ведь салюты и прочие прелести пиротехники – это тоже химия. Она повсюду, везде и во всем.
- Отправляя космолеты к далеким планетам, первый вопрос, которым задаются ученые, — какой химический состав поверхности планеты и её атмосферы?
- Знание химии в медицине является основополагающим.
Биохимический, электролитный, водно-солевой балансы организма – основные показатели и результат правильного течения химических реакций в организме. Наш организм — это большой биохимический реактор. Каждая его клетка может функционировать только при правильном составе элементов внутри себя. Наша ДНК — это набор нуклеотидов, а нуклеотиды – это аминокислоты, то есть химические соединения. Цвет глаз, форма губ, рост, запах – все это химия.
Фармакология и фармация — это разделы химии о лекарственных средствах. Лекарства, таблетки, мази и сиропы, даже витамины – все это химические соединения.
Химия – это одна из наук, скажите вы? Химия – это жизнь, скажу я вам.
Трудно переоценить значение продуктов химической промышленности в жизни современного человека. Многое из того, что нас окружает, чем мы привычно пользуемся в быту, произведено именно благодаря достижениям такой отрасли как химическая промышленность. Невозможно назвать также ни одну отрасль промышленности, где не применялась бы ее продукция — это строительство и машиностроение, легкая промышленность и сельское хозяйство, энергетика и транспорт.
Химическая промышленность и сельское хозяйство
Когда на нашем столе лежит румяная буханка хлеба, мы благодарим хлеборобов, благодаря неустанному труду которых выращена пшеница, из которой он изготовлен. Но в каждой такой буханке хлеба есть и доля труда работников химической промышленности, ведь благодаря их усилиям созданы препараты, при помощи которых обрабатываются поля от сорняков, вредителей и болезней, а также в целях удобрения почвы, чтобы повысить ее урожайность. Только совместный труд химиков и работников сельского хозяйства позволяет получать большие урожаи, которые доходят до конечного потребителя в виде свежей булки, румяных фруктов и сочных овощей. Современное сельское хозяйство немыслимо без применения такой химической продукции как гербициды (препараты, которые используются для борьбы с сорняками), фунгициды (с их помощью ведется борьба с паразитическими грибками), инсектициды (путем применения этих препаратов уничтожаются вредные насекомые) и многих других веществ, применяемых в качестве средств эффективной защиты культурных растений, выращиваемых на полях и в теплицах, от различных врагов.
Инсектициды
В настоящее время выпускается три группы инсектицидов, которые различаются характером проникновения и поражения организма насекомого. Это – контактные, кишечные и системные инсектициды. Поражение насекомых контактными инсектицидами происходит благодаря внешнему контакту вредителя с обработанной частью поверхности. Действие кишечных инсектицидов основано на поражении органов питания насекомого ядовитыми составляющими препаратов. Системные инсектициды проникают в клетки обработанных растений и губительно воздействуют на насекомое при поедании отдельных частей растений.