Химия: Электролитическая диссоциация — различия между версиями
Admine2 (обсуждение | вклад) (→Гидролиз солей (разложение водой)) |
Admine2 (обсуждение | вклад) (→Гидролиз солей (разложение водой)) |
||
| Строка 135: | Строка 135: | ||
1) Соли, образованные сильной кислотой и сильным основанием гидролизу не подвергаются. При растворении в воде они полностью диссоциируют на положительно заряженные катионы и отрицательно заряженные анионы. | 1) Соли, образованные сильной кислотой и сильным основанием гидролизу не подвергаются. При растворении в воде они полностью диссоциируют на положительно заряженные катионы и отрицательно заряженные анионы. | ||
| − | 2) Соли, образованные сильной кислотой и слабым основанием гидролизуются с получением кислой среды, рН≤7. | + | 2) Соли, образованные сильной кислотой и слабым основанием гидролизуются с получением кислой среды, '''рН≤7.''' |
| − | I ступень | + | '''''I ступень''''' |
CuCl<sub>2</sub>+HOH{{Arrowleft}}Cu(OH)Cl+HCl | CuCl<sub>2</sub>+HOH{{Arrowleft}}Cu(OH)Cl+HCl | ||
| Строка 145: | Строка 145: | ||
Cu<sup>2+</sup>+HOH{{Arrowleft}}CuOH<sup>+</sup> + H<sup>+</sup> | Cu<sup>2+</sup>+HOH{{Arrowleft}}CuOH<sup>+</sup> + H<sup>+</sup> | ||
| + | '''(рН < 7)''' | ||
| − | + | '''''II ступень''''' | |
| + | |||
| + | Cu(OH) + HOH {{Arrowleft}} Cu(OH)<sub>2</sub>{{Arrowdown}} + HCl | ||
| + | |||
| + | CuOH<sup>+</sup> + <span class="ion">Cl<sup>–</sup></span> + HOH {{Arrowleft}} Cu(OH)<sub>2</sub>{{Arrowdown}} + H<sup>+</sup> + <span class="ion">Cl<sup>–</sup></span> | ||
| + | |||
| + | CuOH<sup>+</sup> + HOH {{Arrowleft}} Cu(OH)<sub>2</sub>{{Arrowdown}} +H<sup>+</sup> | ||
| + | |||
| + | '''(pH ≤ 7) – кислая среда''' | ||
| + | |||
| + | 3) Соли, образованные сильным основанием и слабой кислотой гидролизуются с получением щелочной среды, '''рН≥7.''' | ||
| + | |||
| + | '''''I ступень''''' | ||
| + | |||
| + | K<sub>2</sub>S + HOH {{Arrowleft}} KHS + KOH | ||
| − | + | <span class="ion">2K<sup>+</sup></span> + S<sup>2–</sup> + HOH {{Arrowleft}} <span class="ion">K<sup>+</sup></span> + HS<sup>–</sup> + <span class="ion">K<sup>+</sup></span> + OH<sup>–</sup> | |
| − | + | S<sup>2–</sup> +HOH {{Arrowleft}} HS<sup>–</sup> + OH<sup>–</sup> | |
| − | + | '''(рН > 7)''' | |
| + | '''''II ступень''''' | ||
| − | + | KHS + HOH {{Arrowleft}} H<sub>2</sub>S{{ArrowUp}} + KOH | |
| − | + | <span class="ion">K<sup>+</sup></span> + HS<sup>–</sup> + HOH {{Arrowleft}} H<sub>2</sub>S{{ArrowUp}} + <span class="ion">K<sup>+</sup></span> + OH<sup>–</sup> | |
| − | |||
| − | + | HS<sup>–</sup> + HOH {{Arrowleft}} H<sub>2</sub>S{{ArrowUp}} + OH<sup>–</sup> | |
| − | |||
| − | (pH ≥ 7) – щелочная среда | + | '''(pH ≥ 7) – щелочная среда''' |
4) Соли, образованные слабым основанием и слабой кислотой гидролизуются, если соль растворима. Обычно такие соли | 4) Соли, образованные слабым основанием и слабой кислотой гидролизуются, если соль растворима. Обычно такие соли | ||
| − | + | * нерастворимы | |
| + | * разлагаются при растворении | ||
| + | |||
| + | (NH<sub>4</sub>)<sub>2</sub>S + 2HOH {{Arrowleft}} <span class="razlogenie"><span>2NH<sub>3</sub> 2H<sub>2</sub>O<div class="arr2">↓</div><div class="arr1">↓</div></span>2NH<sub>4</sub>OH</span> + H<sub>2</sub>S{{ArrowUp}} | ||
| + | |||
| − | + | * при гидролизе образуется слабое основание и слабая кислота: | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | Константа диссоциации для уксусной кислоты | + | Константа диссоциации для уксусной кислоты CH<sub>3</sub>COOH = 1,8·10<sup>-5</sup>, константа диссоциации для гидроксида аммония также равна NH<sub>4</sub>OH = 1,8·10<sup>-5</sup>. Т.е. численные показатели этих веществ равны, что говорит о получении нейтральной среды при гидролизе ацетата аммония. |
| − | (Химики обычно нюхают соль (кроме цианидов). Ацетат аммония пахнет уксусной кислотой, поэтому говорят о слабой кислотности этой соли) | + | <div class="blocktext">(Химики обычно нюхают соль (кроме цианидов). Ацетат аммония пахнет уксусной кислотой, поэтому говорят о слабой кислотности этой соли)</div> |
Еще рассматривается летучесть аммиака, как газообразного вещества при длительном хранении вещества. | Еще рассматривается летучесть аммиака, как газообразного вещества при длительном хранении вещества. | ||
| − | Гидролиз солей может протекать ступенчато. Количество ступеней равно валентности металла в составе соли или валентности кислотного остатка. | + | '''Гидролиз солей может протекать ступенчато. Количество ступеней равно валентности металла в составе соли или валентности кислотного остатка.''' |
'''Пример (1):''' | '''Пример (1):''' | ||
Версия 10:50, 20 февраля 2018
Содержание
- 1 Электролиты и неэлектролиты
- 2 Теория электролитической диссоциации
- 3 Механизм диссоциации
- 4 Диссоциация кислот, оснований и солей в водных растворах
- 5 Степень диссоциации
- 6 Реакции ионного обмена
- 7 Ионное произведение воды. pH раствора
- 8 Гидролиз солей (разложение водой)
- 9 Буферные растворы
- 10 Значение гидролиза
- 11 Гидролиз в народном хозяйстве
- 12 Гидролиз в жизни человека
- 13 Полезные ссылки
- 14 Глоссарий
- 15 Библиография
Электролиты и неэлектролиты
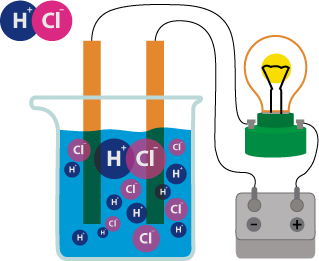
Хорошо известно, что одни вещества в растворенном или расплав ленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора.
Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия. Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами. Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами. К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений.
Теория электролитической диссоциации
Для объяснения особенностей водных растворов электролитов шведским ученым С.Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трем положениям:
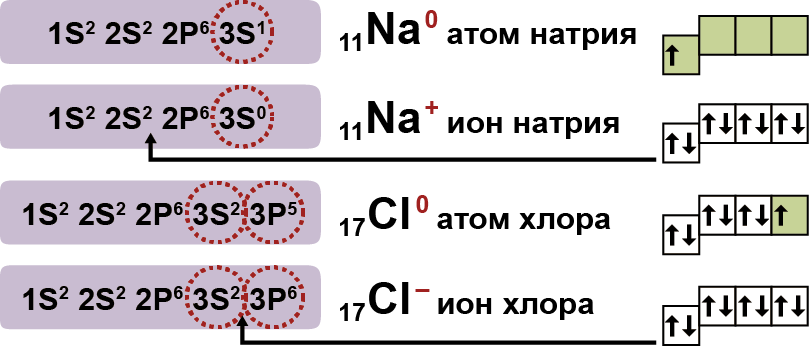
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные. Ионы находятся в более устойчивых электронных состояниях, чем атомы.
Они могут состоять из одного атома — это простые ионы (Na+, Mg2+, Аl3+ и т.д.) — или из нескольких атомов — это сложные ионы (NО3–, SO42– , РО43– и т.д.).
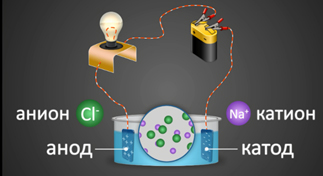
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами, вторые – анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
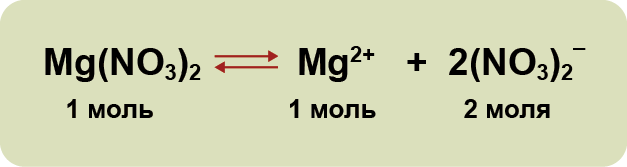
3. Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например:
Механизм диссоциации
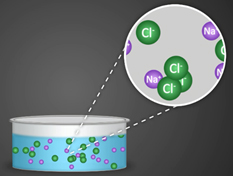
- Существенным является вопрос о механизме электролитической диссоциации. Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор.
Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами H3РO4 имеются ионы (в последовательно уменьшающихся количествах)
| H3РO4 |
дигидрофосфат ион; (первая ступень) |
| H2РO4– |
гидрофосфат ион; (вторая ступень) |
| РO42– |
фосфат ион; (третья ступень) |
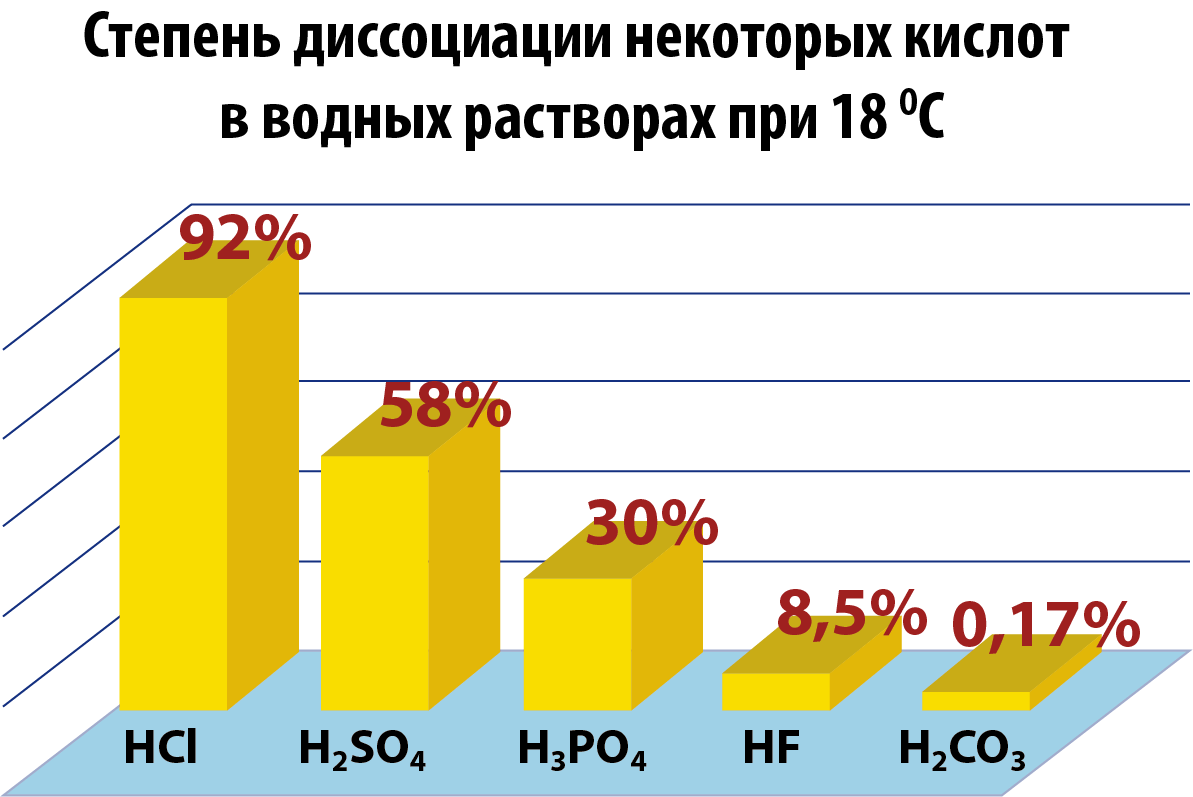
Степень диссоциации
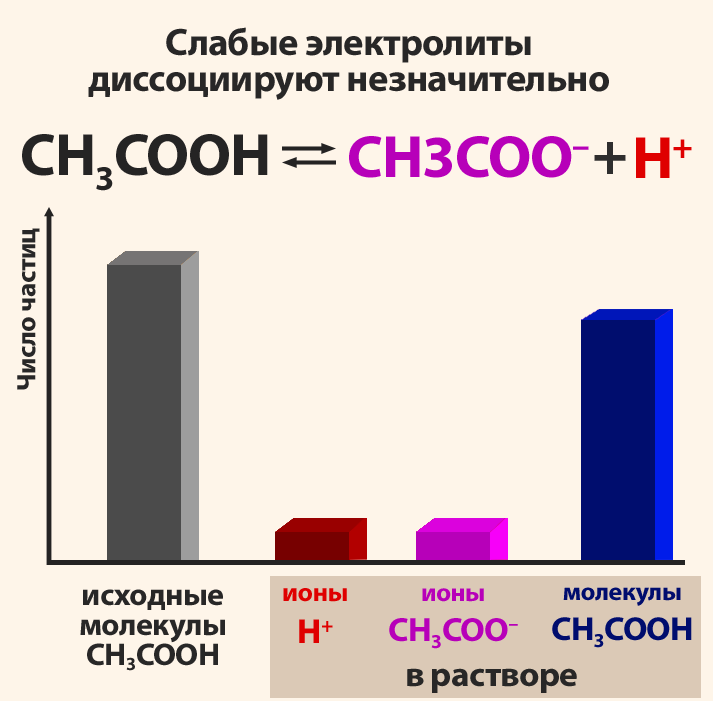
Поскольку электролитическая диссоциация – процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа α). Степень диссоциации — это отношение числа распавшихся на ионы молекул Ni к общему числу растворенных молекул N:
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
- Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита.
Реакции ионного обмена
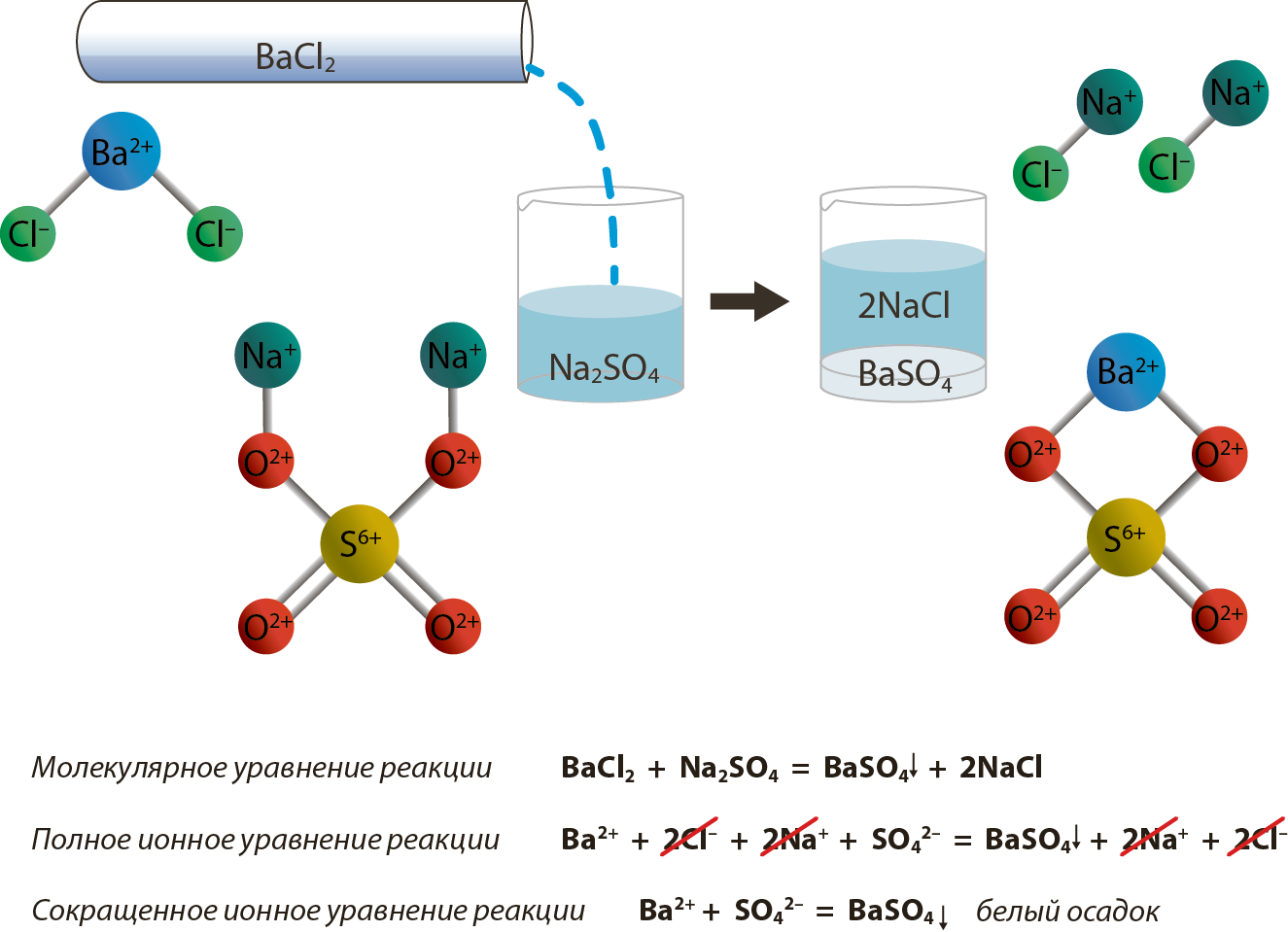
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций — ионными уравнениями. Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер.
- малодиссоциированные (вода),
- малорастворимые (выпадающие в осадок)
- газообразные
Знак ↓ стоящий при формуле вещества, обозначает, что это вещество уходит из сферы реакции в виде осадка, знак ↑ обозначает, что вещество удаляется из сферы реакции в виде газа.
-
Сильные электролиты, как полностью диссоциированные, записывают в виде ионов.Сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части. Для закрепления этих положений рассмотрим пример.
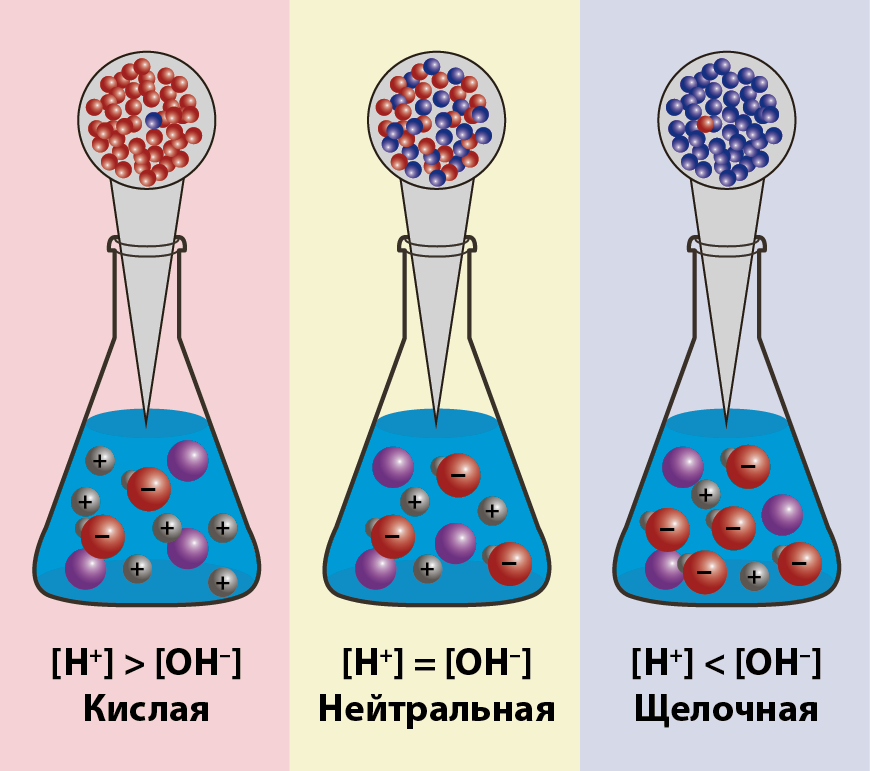
Ионное произведение воды. pH раствора
-
Концентрация молекул воды, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 20 - 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Так как вода является слабым электролитом ( амфолитом ), можно записать для неё константу диссоциации из, непосредственно - диссоциации воды
K•[H2O] = [H+] [OH–]
Обозначим произведение K•[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль2/л2 = [H+]·[OH−] (при 25 °C).
Гидролиз солей (разложение водой)
Гидролиз солей – это обменное разложение солей водой.
В процессе гидролиза образовываются электролит более слабый, недиссоциируемый, следовательно, более устойчивый, чем гидролизуемая соль. Гидролиз практически возможен лишь в том случае, если один из получаемых электролитов (кислота или основание) более слабый, чем гидролизуемая соль. Гидролиз – это процесс обратный процессу нейтрализации
Наиболее быстро и полно гидролиз происходит в разбавленных растворах.
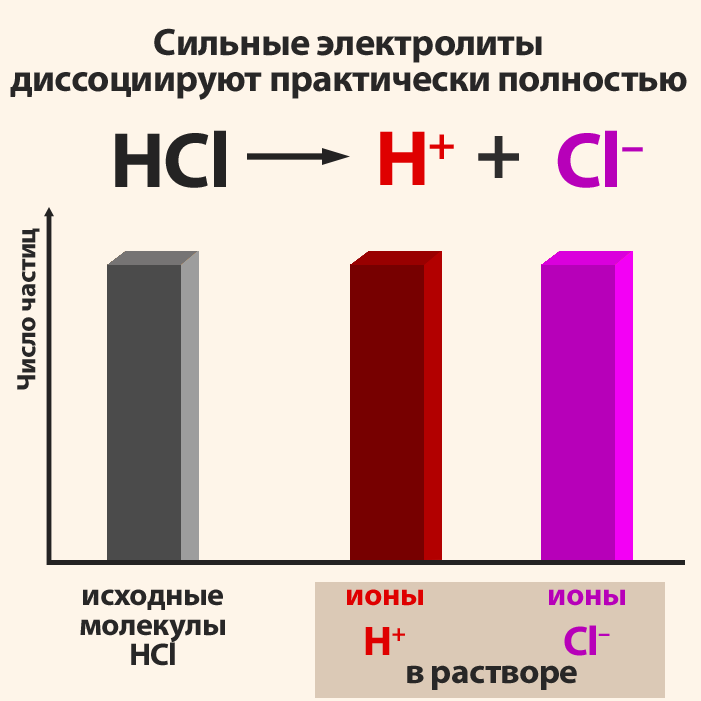
По степени диссоциации все кислоты и растворимые основания (щелочи) разделяют на сильные и слабые.
Сильные кислоты: HClO4, HClO3, H2SO4, HNO3, HI, HBr, HCl.
Сильные основания (щелочи): CsOH, RbOH, KOH, NaOH, LiOH, Ba(OH)2, Sr(OH)2, Ca(OH)2.
1) Соли, образованные сильной кислотой и сильным основанием гидролизу не подвергаются. При растворении в воде они полностью диссоциируют на положительно заряженные катионы и отрицательно заряженные анионы.
2) Соли, образованные сильной кислотой и слабым основанием гидролизуются с получением кислой среды, рН≤7.
I ступень
CuCl2+HOH![]() Cu(OH)Cl+HCl
Cu(OH)Cl+HCl
Cu2+ + 2Cl– + HOH![]() CuOH+ + Cl– + H+ + Cl–
CuOH+ + Cl– + H+ + Cl–
Cu2++HOH![]() CuOH+ + H+
CuOH+ + H+
(рН < 7)
II ступень
Cu(OH) + HOH ![]() Cu(OH)2↓ + HCl
Cu(OH)2↓ + HCl
CuOH+ + Cl– + HOH ![]() Cu(OH)2↓ + H+ + Cl–
Cu(OH)2↓ + H+ + Cl–
CuOH+ + HOH ![]() Cu(OH)2↓ +H+
Cu(OH)2↓ +H+
(pH ≤ 7) – кислая среда
3) Соли, образованные сильным основанием и слабой кислотой гидролизуются с получением щелочной среды, рН≥7.
I ступень
K2S + HOH ![]() KHS + KOH
KHS + KOH
2K+ + S2– + HOH ![]() K+ + HS– + K+ + OH–
K+ + HS– + K+ + OH–
S2– +HOH ![]() HS– + OH–
HS– + OH–
(рН > 7)
II ступень
KHS + HOH ![]() H2S↑ + KOH
H2S↑ + KOH
K+ + HS– + HOH ![]() H2S↑ + K+ + OH–
H2S↑ + K+ + OH–
HS– + HOH ![]() H2S↑ + OH–
H2S↑ + OH–
(pH ≥ 7) – щелочная среда
4) Соли, образованные слабым основанием и слабой кислотой гидролизуются, если соль растворима. Обычно такие соли
- нерастворимы
- разлагаются при растворении
- при гидролизе образуется слабое основание и слабая кислота:
Константа диссоциации для уксусной кислоты CH3COOH = 1,8·10-5, константа диссоциации для гидроксида аммония также равна NH4OH = 1,8·10-5. Т.е. численные показатели этих веществ равны, что говорит о получении нейтральной среды при гидролизе ацетата аммония.
Еще рассматривается летучесть аммиака, как газообразного вещества при длительном хранении вещества.
Гидролиз солей может протекать ступенчато. Количество ступеней равно валентности металла в составе соли или валентности кислотного остатка.
Пример (1):
I ступень
II ступень
III ступень Не идет, т.к. НРО4 – электролит средней силы Пример (2): I ступень
II ступень
III ступень
Реакция по III ступени практически не проходит. Т.к. происходит накопление ионов водорода, поэтому процесс смещается в сторону исходных веществ. Но разбавлением раствора и повышением температуры можно усилить гидролиз. Поэтому может проходить гидролиз и по III ступени.
Таким образов, гидролизуются соли если они растворимы и образованы сильным и слабым компонентами соли (катионом или анионом).
При наличии в составе соли сильного катиона, полученного из щелочи, гидролиз соли приведет к образованию щелочной среды.
Если соль образована сильной кислотой и слабым основанием, то сильный анион приведет к образованию кислой среды при гидролизе соли.
Т.е. работает закон: «Кто сильный тот и прав!».
Представленная модифицированная таблица растворимости солей ориентирована на определение рН среды, которая образуется при гидролизе соли.
Нахождение соли в определенной части таблицы описывает результат гидролиза.
Если соль находится в секторе таблицы, обозначенной буквой:
А) такая соль будет диссоциировать и не будет подвергаться гидролизу.
Б) приведет к гидролизу по кислотному типу и рН будет <7.
В) то ее гидролиз пройдет по щелочному типа и рН при этом будет больше 7.
Г) требует анализа: соль или нерастворима, как большинство солей в этом секторе таблицы или разлагается при растворении в воде. Если соль растворима, то обычно гидролиз приводит к образованию нейтральной среды, когда рН=7,0
Буферные растворы
Способность организма сохранять постоянство состава крови и других жидкостей происходит в результате функционирования буферных систем. В организм поступает и в нем производится множество веществ с различной кислотностью и щелочностью, но сохраняется способность изменять концентрацию ионов H+ и OH- в постоянных пределах pH = 7,37 – 7,44 для крови. Снижение или увеличение этих показателей может привести к смерти. Буферными называются растворы, обладающие способностью сохранять практически постоянное значение pH при добавлении небольших количеств кислоты или щелочи, а также при разбавлении. Буферные системы состоят из слабого основания и его соли, образованной сильной кислотой. Или из слабой кислоты и ее соли, образованной сильным основанием. Примеры: NH4OH + NH4Cl pH = 9,2 или CH3COOH + CH3COONa pH=4,7 При добавлении кислоты будут связываться ионы водорода, а при добавлении щелочи – ионы гидроксила. pH раствора изменится незначительно. Способность регулировать pH у буферных растворов регулируется буферной емкостью. Буферную емкость выражают числом молей кислоты или щелочи, которое необходимо добавить к 1 литру буферного раствора для смещения pH раствора на единицу. В каждой клетка организма работают разные буферные системы, поддерживающие постоянства внутренней среды.
Значение гидролиза
Роль и практическое применение гидролиза Обменные реакции между солями и водой широко распространены в природе.
Явление гидролиза играет огромную роль в химическом преобразовании земной коры. Многие минералы земной коры - это сульфиды металлов, которые хотя и плохо растворимы в воде, постепенно взаимодействуют с ней. Такие процессы идут и на поверхности Земли, и особенно интенсивно в ее глубинах при повышенной температуре. В результате образуется огромное количество сероводорода, который выбрасывается на поверхность при вулканической деятельности. А силикатные породы постепенно переходят в гидроксиды, а затем в оксиды металлов. В результате гидролиза минералов – алюмосиликатов – происходит разрушение горных пород.
Известный нам малахит (Cu2(OH)2CO2) – не что иное, как продукт гидролиза природных карбонатов.
В Мировом океане соли также интенсивно взаимодействуют с водой. Выносимые речной водой гидрокарбонаты кальция и магния придают морской воде слабощелочную реакцию. Именно в такой слабощелочной среде прибрежных вод рН приблизительно равно 9 наиболее интенсивно протекает фотосинтез в морских растениях и наиболее быстро развиваются морские животные. А если вспомнить о составе рН крови млекопитающих, в том числе и человека, то вы сможете не только сделать вывод о единстве животного мира на Земле но и сформулировать и некоторые гипотезы происхождении жизни на планете.
Гидролиз в народном хозяйстве
Гидролиз доставляет немало хлопот нефтяникам. Как известно, в нефти имеются примеси воды и многих солей, особенно хлоридов кальция и магния. При нагревании нефти в процессе ее переработки до 250 град. С и выше происходит интенсивное взаимодействие указанных хлоридов с водяным паром. Образующийся при этом газообразный хлороводород вступает в реакцию с металлом, из которого сделано оборудование, разрушает его, что резко увеличивает стоимость нефтепродуктов. Впрочем, на счету гидролиза немало и добрых дел. Например, образующийся при взаимодействии сульфата алюминия с водой мелкодисперсный осадок гидроксида алюминия уже несколько веков используется в качестве протравы при крашении. Оседая на ткань и прочно соединяясь с ней, гидроксид алюминия затем легко адсорбирует красители и образует весьма устойчивые красящие слои, которые выдерживают многократную стирку ткани. Без протравы качественной окраски тканей не получится. Этот же процесс используют для очистки питьевой воды и промышленных стоков: рыхлый аморфный осадок гидроксида алюминия обволакивает частички грязи и адсорбирует вредные примеси, увлекая все это на дно. Примерно таков же механизм очистки природной воды глинами, которые представляют собой соединения алюминия.
Гидролиз солей Na2CO3 Na3PO4 применяется для очистки воды и уменьшения ее жесткости.
Известкование почв с целью понижения их кислотности также основано на реакции гидролиза
CO32-+HOH![]() HCO3-+OH+
HCO3-+OH+
Посредством гидролиза в промышленности из непищевого сырья (древесины, хлопковой шелухи, подсолнечной лузги, соломы вырабатывается ряд ценных продуктов: этиловый спирт, белковые дрожжи, глюкоза, сухой лед.
Гидролиз в жизни человека
В повседневной жизни мы постоянно сталкиваемся с явлением гидролиза – при стирке белья, мытье посуды, умывании мылом. Даже процессы пищеварения, в частности, расщепление жиров, протекают благодаря гидролизу.
В конце урока мы возвращаемся к стихотворению и отвечаем, почему же Ваня боялся зайти в море
Полезные ссылки
Глоссарий
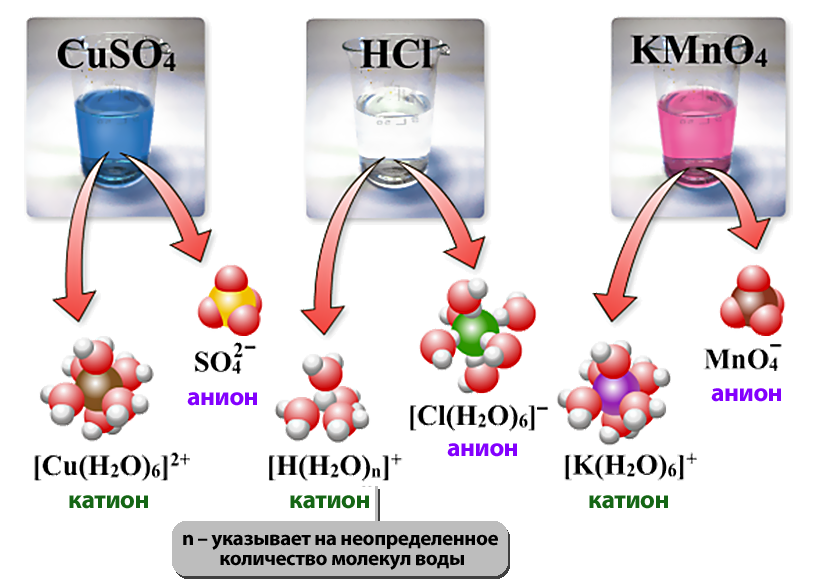
- Аквакомплексы – комплексы, включающие в состав молекулы воды – или кристаллогидраты.
Библиография
- Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.
Английский торговец Бэйкер завещал свое состояние Королевскому научному обществу на выплату тому, кто прочтет «доклад о выдающемся открытии» В ноябре 1807 года Гэмфри Дэви доложил о получении калия и натрия путем разложения щелочей действием электрического тока. Позже он выделил и получил барий, магний, кальций и стронций. Дэви стал основателем электрохимии.
Он сумел доказать опьяняющее действие веселящего газа на организм.

Из практических изобретений надо выделить безопасную для взрыва метана шахтерскую лампу, которой пользовались долгие годы до введения в шахтах электрического освещения.
Дэви работал в Пневматическом институте в Бристоле, и хотя у него было только среднее образование, он стал с 1802 профессором Королевского института.
В 1805 году Французская академия наук присудила ему премию в 3000 франков. В 1812 году Дэви в возрасте 34 лет за научные работы был посвящён в рыцари. Член множества научных организаций, в том числе иностранный почётный член Петербургской АН (1826 год).
В 1826 году Дэви поразил первый апоплексический удар, а 29 мая 1829 года на пути в Англию из Европы Дэви поразил второй удар, от которого он и умер на пятьдесят первом году жизни в Женеве.
Похоронен в Вестминстерском аббатстве в Лондоне, на месте захоронения выдающихся людей Англии. В его честь Лондонское Королевское общество учредило награду для учёных — медаль Дэви.
1 Из 1 кг гидрида лития можно получить 2800 литров водорода, столько его содержит 40 кг баллон под давлением 120-150 атмосфер.
2 Солью, извлеченной из морской воды можно было бы засыпать всю сушу слое в 130 метров.
3 В состав жидкого мыла входит калий.
4 Каждую секунду в организме человека распадается 5000 атомов радиоактивного изотопа калия, которого в нем содержится около 0,003 грамма.
5 Сплав 76% калия и 24% натрия жидкий и затвердевает при минус 12 градусов Цельсия.
Попробуйте ответить правильно на пять вопросов:
В этом видео вы узнаете как сварить яйца без огня.
Академик
Курнаков Николай Семенович
Советский химик. Разработал физико-химический анализ растворов и сплавов металлов. Для анализа состава сплавов он создал новые методы и приборы.
Чернов
Дмитрий Константинович
Русский металлург. Разработал в 1868 году наилучшие условия отливки, ковки и термической обработки стали. С тех пор стальные орудия вытеснили бронзовые. Предсказал преимущества применения кислородного дутья в конвекторном процессе.
Аносов
Павел Петрович
Русский металлург, горный инженер. Он был первым исследователем, применившим еще в 1831 году микроскоп для изучения структуры стали. Изобрел способ закалки стальных изделий в струе сжатого воздуха. Получил литую сталь и усовершенствовал многие заводские механизмы.