Химия: Химиялык реакция — различия между версиями
Admine2 (обсуждение | вклад) |
Admine2 (обсуждение | вклад) (→Химиялык реакциялардын ылдамдыгы) |
||
| Строка 70: | Строка 70: | ||
=== Химиялык реакциялардын ылдамдыгы === | === Химиялык реакциялардын ылдамдыгы === | ||
| − | {{center|[[file: | + | {{center|[[file:Skorost him reakciiKG.png|750px|Химиялык реакциялардын ылдамдыгынын ар түрдүү факторлордон болгон кɵз карандылыгы]]}} |
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
Версия 05:47, 5 сентября 2018
Бир заттын башка заттарга айлануу кубулушу химиялык реакция деп аталат. Химиялык реакцияга кирген баштапкы заттар реагенттер деп, ал эми реакциядан кийин пайда болгон заттар реакциянын продуктылары деп аталат.
- Химиялык теңдеме – бул химиялык белгилердин жана формулалардын жардамы менен химиялык реакцияларды шарттуу түрдө туюнтуп жазуу. Химиялык формулалар менен туюнтулган химиялык теңдеме оң жана сол жакка бөлүнөт. Тендеменин сол жагына реагенттер, ал эми оң жагына реакциянын продуктылары жазылат. Заттардын формуласында химиялык элементтин атомдорунун саны индекс аркылуу көрсөтүлөт.
-
H2SO4 H2SO3 Күкүрт кислотасы Күкүрттүү кислота Күчтүү Начар Туруктуу Туруктуу эмес Териге тийсе күйгүзөт Жарыктын таасири менен ажырайт Майланышкан суюктук Газдын суулуу эритмеси
Химиялык тендемелерде формулалардын алдына коэффициент жазылат, ал реакцияга катышкан молекулалардын санын көрсөтөт.
Адатта, химиялык реакция убагында энергия сиңирилип же бөлүнүп чыкса, теңдемеге барабардык жазылат. (Бул реакциянын жылуулук эффекти) 2Mg + O2 = 2MgO + 1203 кДж. Химиялык теңдемени жазууда реакциянын багытын көрсөтүүчу жебе (стрелка) колдонулат: SO2 + H2O ![]() H2SO3
H2SO3
Содержание
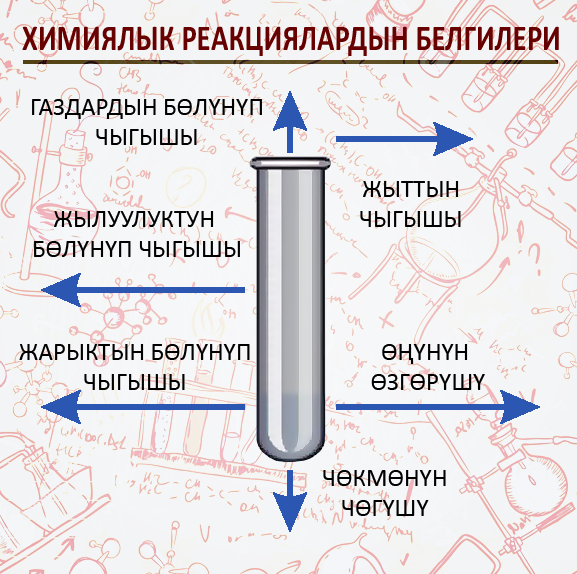
Химиялык реакциялардын белгилери
- Жылуулуктун бөлүнүп чыгышы
- Жарыктын чыгышы
- Чөкмөнүн чөгүшү
- Газдын бөлүнүп чыгышы
- Өңүнүн өзгөрүшү
- Жыттын пайда болушу
Химиялык реакциянын убагында заттарда болгон өзгөрүүлөр реакциянын жүргөндүгүн билдирет жана химиялык реакциянын белгилери болуп саналат.
Көпчүлүк заттар бири–бири менен өз алдынча аракеттене алышпайт. Реакциянын жүрүшү үчүн белгилүү бир шарттар түзүлүшү керек.
Химиялык реакциянын жүрүү шарттары
- 1. Майдалоо 2. Аралаштыруу 3. Ысытуу
Заттардын тийишүү беттерин көбөйтүү үчүн кесектерин майдалашат. Кээ бир заттарды сууда эритсек, эритме абалында алар бири–бири менен реакцияга жакшы кирет.
Көпчүлүк убакта бул жетишсиздик кылат, ошондуктан, реакцияга кирген заттарды ысытышат. Жыгачтын чычаласы, темир менен күкүрттүн аралашмасы, жез бөлмө температурасында реакцияга кирбейт, реакциянын жүрүшү үчүн аларды сөссүз ысытуу керек.
Кээ бир учурларда химиялык процесстин жүрүшү үчүн жарык талап кылынат. Дайыма жарыктын таасири астында жүргөн реакциялардын бири катары фотосинтезди белгилесек болот.
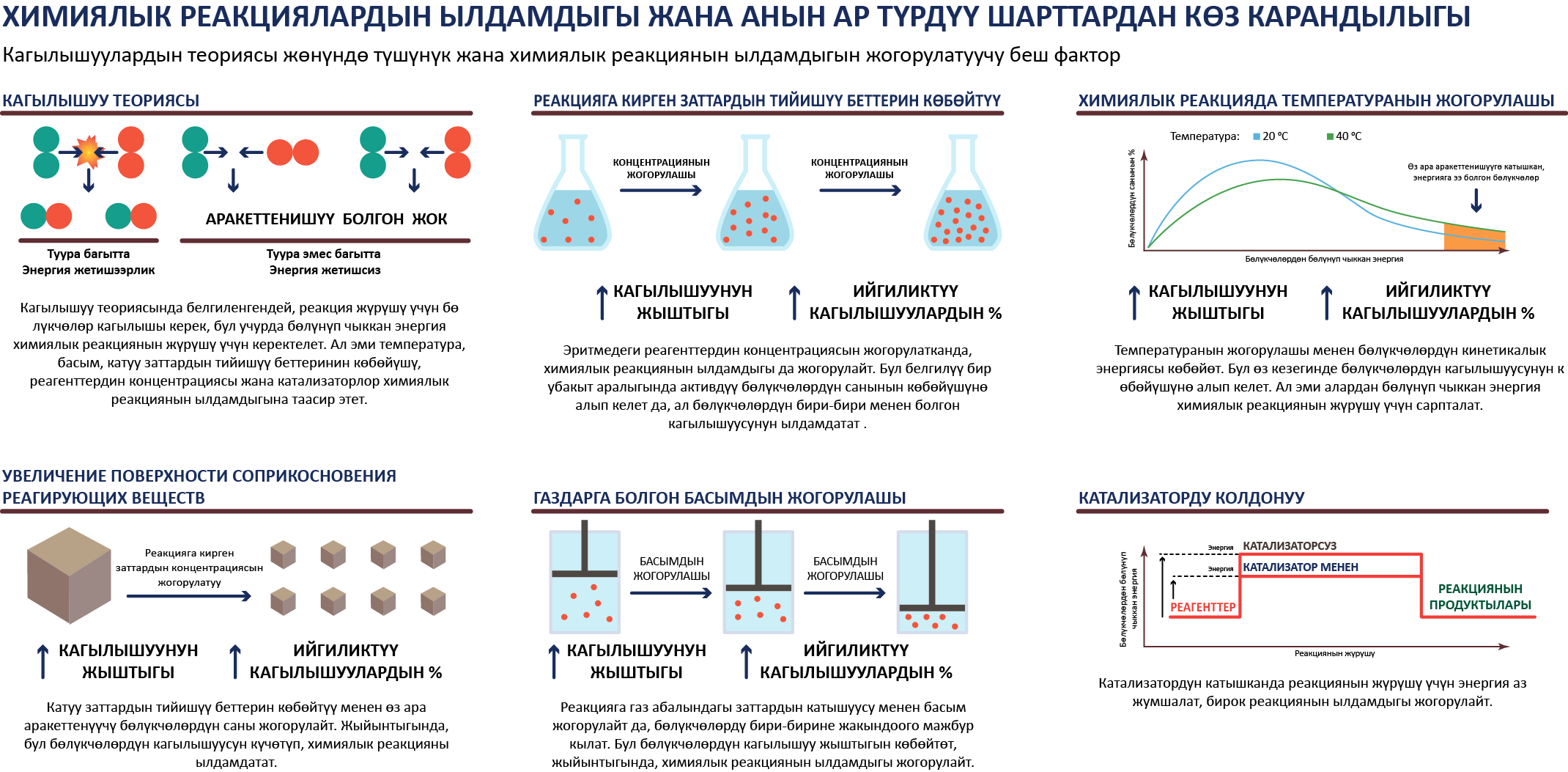
Химиялык реакциялардын ылдамдыгы
Химиялык реакциялардын классификациясы
left:20%; top:58%; left:25%; top:88%; left:34%; top:108%; left:48%; top:123%; left:62%; top:108%; left:72%; top:88%; left:76%; top:58%;






Жɵнɵкɵй жана татаал заттардын сандык жана сапаттык курамы ɵзгɵрбɵстɵн жүрүүчү химиялык реакциялар
Аллотропиялык ɵзгɵрүүлɵр жана изомерлешүү
Мисалы: Кычкылтектин озонго айланышы жана изомерлердин пайда болушу.
Бир элементтин бир нече жөнөкөй заттарды пайда кылуусу аллотропия деп аталат.. Аллотропия кубулушу бир эле заттын курамындагы атомдордун саны ар түрдүү болгондо (O2 –кычкылтек, O3 – озон), же кристаллдык торчодогу атомдор ар түрдүү формада болгон учурда пайда болот (алмаз, графит).
3O2 ![]() 2O3
2O3
Изомерлер – бул сапаттык жана сандык курамы бирдей, бирок молекулаларынын түзүлүшү жана касиеттери ар түрдүү болгон заттар.
Кайталанма реакция
Кайталанма жана кайталанбас реакция
Мисалы: суутектин иод менен болгон реакциясы жана аммонийдин дихроматынын ажыроо реакциясы.
Химиялык тең салмактуулукка алып келген реакция кайталанма реакция деп аталат. Кайталанма реакцияларда эки ылдамдыкты белгилөөгө болот: реакциянын продуктысы пайда болгон түз реакциянын ылдамдыгы. Ошондой эле пайда болгон заттар баштапкы заттарга ажыраган – кайталанма реакциянын ылдамдыгы. Качан гана түз жана кайталанма реакциялардын ылдамдыгы бири–бирине барабар болгондо, химиялык тең салмактуулук пайда болот. Бул, убакыт бирдигинде канча молекула ажыраса, ошончо молекула пайда болоорун билдирет.
H2 + I2 ![]() 2HI
2HI
Кайталанбас реакцияларда химиялык реакция бир тараптуу жүрɵт жана реакциянын натыйжасында чɵкмɵ, газ абалындагы зат же суу пайда болот.
(NH4)2Cr2O7 ![]() 2NH3↑ + H2O + 2CrO3
2NH3↑ + H2O + 2CrO3
Жылуулук энергиясы
Экзотермиялык жана эндотермиялык реакциялар
Мисалы: магнийдин күйүү жана сымаптын оксидинин ажыроо реакциялары
Экзотермиялык реакция–жылуулукту бөлүп чыгаруу менен жүргөн реакция. Кошулуу реакцияларынын көпчүлүгү экзотермиялык болуп саналат.
2Мg +O2 ![]() 2МgO + Q
2МgO + Q
Эндотермиялык реакция– жылуулукту сиңирип алуу менен жүргөн реакция. Ажыроо реакцияларынын көпчүлүгү эндотермиялык реакция болуп саналат.
2HgO ![]() 2Hg + O2 – Q
2Hg + O2 – Q
Химиялык реакция убагында бөлүнүп чыккан же сиңирип алынган жылуулуктун саны (Q), реакциянын жылуулук эффекти деп аталат.
Реакцияга кирүүчү заттардын баштапкы абалы
Гомогендүү жана гетерогендүү реакциялар
Мисалы: азоттун кычкылтек менен болгон реакциясы.
Гомогендүү реакция – агрегаттык абалдары бирдей болгон заттардын ортосунда жүргɵн реакция.
Гетерогендүү реакция – ар түрдүү агрегаттык абалдагы заттардын ортосунда болгон реакция. (Гомо – бирдей, гетеро – ар түрдүү).
N2 + O2 ![]() 2NO − Q.
2NO − Q.
Катализатор
Каталитиздик жана катализдик эмес реакциялар
Мисалы: катализатордун таасири астында аммиактын кычкылданышы жана аммиактын суу менен болгон реакциясы.
Каталитиздик реакция – катализатордун таасири астында гана жүргөн химиялык реакция. Реакцияга ар түрдүү катализаторлорду катыштыруу менен ар башка продуктыларды алууга болот.
4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
Катализатор – химиялык реакциянын жүрүшүн ылдамдаткан заттар.
Катализаторлор химиялык реакцияны ылдамдатат, бирок өзү реакцияга катышпайт.
Химиялык реакциянын жүрүшүн акырындаткан катализаторлор ингибиторлор деп аталат.
Катализаторду катыштырбай жүргөн химиялык реакциялар катализдик эмес реакциялар деп аталат.
NH3 + H2O ![]() NH4OH
NH4OH
Окистенүү–калыбына келүү реакциясы
Мисалы: Цинктин туз кислотасы менен болгон реакциясы жана кальций карбонатынын ажыроо реакциясы.
Окистенүү–калыбына келүү реакциясы – окистенүү даражаларынын өзгөрүшү менен жүргөн реакция.
Кошулуу жана алмашуу реакциялары көбүнчө окистенүү–калыбына келүү реакциялары болуп саналат.
Zn + 2HCl ![]() ZnCl2 + H2↑
ZnCl2 + H2↑
Бирок, окистенүү даражасы өзгөрбөй жүргөн да химиялык реакциялар болот.
CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
Реакцияга кирген жана реакциядан алынган заттардын катышы
Кошулуу, ажыроо, сүрүп чыгаруу жана алмашуу реакциялары
Мисалы: Кɵмүрдүн кычкылтекте күйүү реакциясы, суутектин ɵтɵ кычкылынын ажыроо реакциясы, жездин сымаптын нитраты менен болгон реакциясы жана күмүштүн нитратынын натрий хлориди менен болгон реакциясы.
Кошулуу реакциясы – эки же андан көп заттар кошулуп, жаңы затты пайда кылган реакция.
S + O2 ![]() SO2↑
SO2↑
CaO + H2O ![]() Ca(OH)2
Ca(OH)2
CaCO3 + CO2 + H2O ![]() Ca(HCO3)2
Ca(HCO3)2
Ажыроо реакциясы – бир татаал заттан эки же андан көп жөнөкөй же татаал зат пайда болгон реакция.
2HgO ![]() 2Hg + O2↑
2Hg + O2↑
Сu(OH)2 ![]() СuO + H2O
СuO + H2O
2AgNO3 ![]() 2Ag + 2NO2↑ + O2↑
2Ag + 2NO2↑ + O2↑
Сүрүп чыгаруу реакциясы – жөнөкөй жана татаал заттардын ортосунда болуп, жөнөкөй заттын атому татаал заттын атому менен орун алмашкан реакция. Мында, пайда болгон жаңы затта терс электрлүүлүгү жогору болгон атом, терс электрлүүлүгү төмөн болгон атом менен биригет. Ал эми ортодогу терс электрлүүлүктү көрсөткөн атомдор жөнөкөй зат катары бөлүнүп чыгат. Жыйынтыгынды, жаңы татаал жана жаңы жөнөкөй зат пайда болот.
Fe + CuSO4 ![]() FeSO4 + Cu↓
FeSO4 + Cu↓
Zn + 2HCl ![]() ZnCl2 + H2↑
ZnCl2 + H2↑
2KBr + Cl2 ![]() 2KCl + Br2
2KCl + Br2
Алмашуу реакциясы – эки татаал заттын ортосунда болуп, алардын курамдык бөлүктөрү алмашкан реакция. Реакцияга чейин биринчи жазылган бөлүгү, жаңы затта да биринчи болуп жазылат, экинчи жазылган элемент жаңы затта да экинчи болуп жазылат.
AgNO3 + NaCl ![]() AgCl↓ + NaNO3
AgCl↓ + NaNO3
NaOH + HCl ![]() NaCl + H2O
NaCl + H2O
FeCl3 + 3NaOH ![]() Fe(OH)3↓ + 3NaCl
Fe(OH)3↓ + 3NaCl
![]()
Глоссарий
- Ажыроо реакциясы – бир татаал заттан эки же андан көп жөнөкөй же татаал зат пайда болгон реакция.
- Аллотропия – бир элементтин бир нече жөнөкөй заттарды пайда кылуусу. Аллотропия кубулушу бир эле заттын курамындагы атомдордун саны ар түрдүү болгондо (O2 – кычкылтек, O3 – озон), же кристаллдык торчодогу атомдор ар түрдүү формада болгон учурда пайда болот (алмаз, графит).
- Гомогендүү реакция – агрегаттык абалдары бирдей болгон заттардын ортосунда жүргɵн реакция.
- Гетерогендүү реакция – ар түрдүү агрегаттык абалдагы заттардын ортосунда болгон реакция. (Гомо – бирдей, гетеро – ар түрдүү).
- Изомерлер – бул сапаттык жана сандык курамы бирдей, бирок молекулаларынын түзүлүшү жана касиеттери ар түрдүү болгон заттар.
- Химиялык тең салмактуулукка алып келген реакция кайталанма реакция деп аталат. Кайталанма реакцияларда эки ылдамдыкты белгилөөгө болот: реакциянын продуктысы пайда болгон түз реакциянын ылдамдыгы. Ошондой эле пайда болгон заттар баштапкы заттарга ажыраган – кайталанма реакциянын ылдамдыгы. Качан гана түз жана кайталанма реакциялардын ылдамдыгы бири–бирине барабар болгондо, химиялык тең салмактуулук пайда болот. Бул, убакыт бирдигинде канча молекула ажыраса, ошончо молекула пайда болоорун билдирет.
- Кайталанбас реакцияларда химиялык реакция бир тараптуу жүрɵт жана реакциянын натыйжасында чɵкмɵ, газ абалындагы зат же суу пайда болот.
- Катализатор – химиялык реакциянын жүрүшүн ылдамдаткан заттар.Катализаторлор химиялык реакцияны ылдамдатат, бирок өзү реакцияга катышпайт.
- Катализаторду катыштырбай жүргөн химиялык реакциялар катализдик эмес реакциялар деп аталат.
- Кошулуу реакциясы – эки же андан көп заттар кошулуп, жаңы затты пайда кылган реакция.
- Окистенүү–калыбына келүү реакциясы – окистенүү даражаларынын өзгөрүшү менен жүргөн реакция. Кошулуу жана алмашуу реакциялары көбүнчө окистенүү–калыбына келүү реакциялары болуп саналат.
- Сүрүп чыгаруу реакциясы – жөнөкөй жана татаал заттардын ортосунда болуп, жөнөкөй заттын атому татаал заттын атому менен орун алмашкан реакция. Мында, пайда болгон жаңы затта терс электрлүүлүгү жогору болгон атом, терс электрлүүлүгү төмөн болгон атом менен биригет. Ал эми ортодогу терс электрлүүлүктү көрсөткөн атомдор жөнөкөй зат катары бөлүнүп чыгат. Жыйынтыгынды, жаңы татаал жана жаңы жөнөкөй зат пайда болот.
- Химиялык реакция убагында бөлүнүп чыккан же сиңирип алынган жылуулуктун саны (Q), реакциянын жылуулук эффекти деп аталат.
- Экзотермиялык реакция – жылуулукту бөлүп чыгаруу менен жүргөн реакция. Кошулуу реакцияларынын көпчүлүгү экзотермиялык болуп саналат.
- Эндотермиялык реакция – жылуулукту сиңирип алуу менен жүргөн реакция. Ажыроо реакцияларынын көпчүлүгү эндотермиялык реакция болуп саналат.
Пайдалуу шилтемелер
Видеоурок «Качественные реакции в химии». Сайт «Видеоуроки в интернет» (Электронный ресурс). //URL:.https://www.youtube.com/watch?v=pk7UXWVBC9U&t=193s (дата обращения 07.03.18.)
Библиография
- Волков В. А., Вонский Е. В., Кузнецова Г. И. Выдающиеся химики мира. — М.: Высшая школа, 1991. — 656 с. — 100 000 экз. — ISBN 5-06-001568-8. (в пер.)
- Кособаева Б. – Использование компьютера в учебном процессе химии / Текст / Б. Кособаева, Н.Б. Арстанбекова // Абай атындагы Казак Улуттукпедагогикалык университеттинин Хабарши (Вестник) Жаратылыш таануу-география илимдери сериясынын 2012 №2 (32). – 68–71–бб.
- Стартовый эксперимент как форма включенности каждого ученика в учебный процесс / Текст / Б. Кособаева, Син Е.Е. // Химия в школе. – Москва, 2016. – №6.
- Дидактические особенности использования технологии обучения на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №6(48), С.155–160.
- Применение технологии системного усвоения знаний в обучении химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №7(49), С.152–159.
- Реализация межпредметных связей на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №10(52), С.136–139.
- Методологические аспекты обучения в современных условиях. / Текст / Б. Кособаева, Син Е.Е., Жакышова Б.Ш. // Проблемы современной науки и образования. – Иваново, 2016. – №13(55), С.104–108.
- Формирование системы понятий при обучении химии в школе. / Текст / Б. Кособаева, П.Э. Токомбаева // Вестник Кыргызского национального университета имени Ж. Баласагына. – Бишкек, 2017. – Специальный выпуск. С.77–81.
1868–жылы түзүлгɵн Орус химиялык коомунун демилгечилеринин бири болгон (А. А. Воскресенский, Н. Н. Зинин жана Д. И. Менделеев менен бирге), ал коомдун иш–кагаздарын алып барган. (1868–1891) жана «Журнала РХО» редактору болгон (1869–1900). 1869–ж. март айында Орус химиялык коомунун отурумунда (заседание) Меншуткин Менделеевдин атынан анын Мезгилдик закону жана химиялык элементтердин мезгилдик системасы жɵнүндɵ маалымат берген.
Меншуткиндин ишинин негизги багыты – органикалык бирикмелердин химиялык айланууларынын ылдамдыгын изилдɵɵ болгон.
Ал химиялык реакциянын ылдамдыгына эритмелерди суюлтуунун таасир эте тургандыгын байкаган. Меншуткиндин бул эмгектери химиялык кинетиканын негизин түзгɵн. 1886–1889 жж. Меншуткин эриткичтин жана температуранын, аминдерди жана кислоталардын амиддерин алууга таасир эте тургандыгын белгилеген.1890–ж. этерификация жана туздарды пайда кылуучу реакцияларга эриткичтердин катализатор катары таасир этээрин аныктаган.
6 г кɵмүртекти күйгүзүүгɵ канча кɵмүр кычкыл газы керектелет?
22 г
5 г 10% суутектин ɵтɵ кычкылын ажыратканда, канча кɵлɵм кычкылтек бɵлүнүп чыгат?
0,175 л
3,4 грамм күмүштүн нитратынын жана 0,585 грамм натрий хлоридинин эритмелерин аралаштырганда, канча грамм чɵкмɵ бɵлүнүп чыгат?
1, 435 г.
Эгерде термохимиялык теңдеме тɵмɵнкүдɵй жүрсɵ, 0,6 грамм салмактагы салюттун бир заряды күйгɵндɵ канча жылуулук бɵлүнүп чыгат?
2Mg + O2 ![]() 2MgO + 1203 кДж?
2MgO + 1203 кДж?
15,05 кДж
Эгерде 50 литр аммиакты катализаторду пайдалануу менен кычкылдандырганда 30 литр азоттун оксиди (II) пайда болсо, реакциядан пайда болгон заттын практикалык чыгышын аныктагыла.
60 %