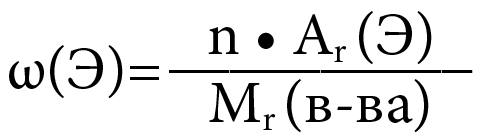Химия: Количественные соотношения — различия между версиями
Admine2 (обсуждение | вклад) (→Массовые отношения(массовая доля элемента)) |
Admine2 (обсуждение | вклад) (→Относительная атомная и молекулярная массы) |
||
| Строка 5: | Строка 5: | ||
== Относительная атомная и молекулярная массы == | == Относительная атомная и молекулярная массы == | ||
| − | Атомы имеют очень маленький размер и очень маленькую массу. Если выражать массу атома какого-нибудь химического элемента в граммах, то это будет число перед которым находится более двадцати нулей после запятой. Поэтому измерять массу атомов в граммах неудобно. | + | Атомы имеют очень маленький размер и очень маленькую массу. Если выражать массу атома какого-нибудь химического элемента в граммах, то это будет число, перед которым находится более двадцати нулей после запятой. Поэтому измерять массу атомов в граммах неудобно. |
Однако, если принять какую-либо очень малую массу за единицу, то все остальные малые массы можно выражать как отношение к этой единицы. В качестве единицы измерения массы атома была выбрана 1/12 часть массы атома углерода. | Однако, если принять какую-либо очень малую массу за единицу, то все остальные малые массы можно выражать как отношение к этой единицы. В качестве единицы измерения массы атома была выбрана 1/12 часть массы атома углерода. | ||
Версия 08:45, 29 апреля 2018
Закон сохранения массы Число Авогадро. Закон Авогадро
Содержание
Относительная атомная и молекулярная массы
Атомы имеют очень маленький размер и очень маленькую массу. Если выражать массу атома какого-нибудь химического элемента в граммах, то это будет число, перед которым находится более двадцати нулей после запятой. Поэтому измерять массу атомов в граммах неудобно.
Однако, если принять какую-либо очень малую массу за единицу, то все остальные малые массы можно выражать как отношение к этой единицы. В качестве единицы измерения массы атома была выбрана 1/12 часть массы атома углерода.
Относительной атомной массой является величина, равная отношению реальной массы атома конкретного химического элемента к 1/12 реальной массы атома углерода. Это безразмерная величина, так как делятся две массы.
Ar = mат. / (1/12)mугл.
Однако абсолютная атомная масса равна относительной по значению и имеет единицу измерения а.е.м.
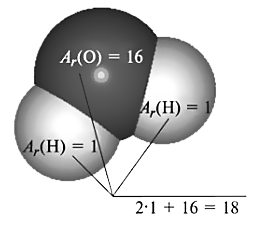
То есть относительная атомная масса показывает, во сколько раз масса конкретного атома больше 1/12 атома углерода. Если у атома Ar = 12, значит его масса в 12 раз больше 1/12 массы атома углерода, или, другими словами, в нем 12 атомных единиц массы. Такое может быть только у самого углерода (C). У атома водорода (H) Ar = 1. Это значит, что его масса равна массе 1/12 части от массы атома углерода. У кислорода (O) относительная атомная масса равна 16 а.е.м. Это значит, что атом кислорода в 16 раз массивнее 1/12 атома углерода, в нем 16 атомных единиц массы.
Самый легкий элемент — это водород. Его масса примерно равна 1 а.е.м. У самых тяжелых атомов масса приближается к 300 а.е.м.
Обычно для каждого химического элемента его значение абсолютной массы атомов, выраженных через а. е. м. округляют.
Значение атомных единиц массы записаны в таблице Менделеева.
Для молекул используется понятие относительной молекулярной массы (Mr). Относительная молекулярная масса показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Но поскольку масса молекулы равна сумме масс составляющих ее атомов, то относительную молекулярную массу можно найти, просто сложив относительные массы этих атомом. Например, в молекулу воды (H2O) входят два атома водорода с Ar = 1 и один атом кислорода с Ar = 16. Следовательно, Mr(Н2O) = 18.
Ряд веществ имеет немолекулярное строение, например металлы. В таком случае их относительную молекулярную массу считают равной их относительной атомной массе. В химии важным является величина, которая называется массовая доля химического элемента в молекуле или веществе. Она показывает, какая часть относительной молекулярной массы приходится на данный элемент. Например, в воде на водород приходится 2 доли (так как два атома), а на кислород 16. То есть, если смешать водород массой 1 кг и кислород массой 8 кг, то они прореагируют без остатка. Массовая доля водорода равна 2/18 = 1/9, а массовая доля кислорода 16/18 = 8/9.
Современные методы исследования позволяют определить чрезвычайно малые массы атомов с большой точностью. Так, например, масса атома углерода равна 1,993•10-26 кг. Это очень маленькая величина. Поэтому в химии используются не абсолютные значения атомных масс, а относительные. За единицу атомной массы принята атомная единица массы, равная 1/12 части массы атома углерода. Относительной атомной массой химического элемента называется величина, показывающая во сколько раз масса данного атома больше 1/12 массы атома углерода. Она обозначается буквой Аr.
Относительные атомные массы указаны в периодической таблице.
Стрелкой обозначена относительная атомная масса углерода
Например Аr(Н)=1, Аr(С)=12. Атомные массы округляем до целых величин, исключая атом хлора - Аr(Cl)=35,5.
Например Мr(H2SO4)=1•2+32+16•4=98.
Итак, чтобы узнать относительную молекулярную массу воды (Н2O) мы складываем относительные атомные массы с учётом индексов:
Относительная атомная масса водорода равна 1 (по таблице Менделеева) по формуле мы видим,что у нас есть 2 водорода (так как после водорода стоит индекс 2);
Относительная атомная масса кислорода равна 16 (по таблице Менделеева);
Рассчитаем относительную молекулярную массу:
Мr(Н2O)=1•2+16=16+2=18
(1•2) т.к у нас 2 водорода.
Количество вещества
- Моль – обозначается буквой ν (ню)
Массовые отношения(массовая доля элемента)
- Формула:
-
Где:
ω(Э) – массовая доля элемента Э в веществе
n – число атомов элемента Э в веществе (индекс)
Ar – относительная атомная масса элемента Э
Mr(в-ва) – относительная молекулярная масса вещества
Качественный состав молекулы показывает какие виды атомов входят в состав вещества.
Количественный состав показывает сколько атомов определённого вида входит в состав молекулы вещества.
Закон постоянства состава веществ
К основным законам химии относится закон постоянства состава:
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г.
Он писал: "От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь".
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
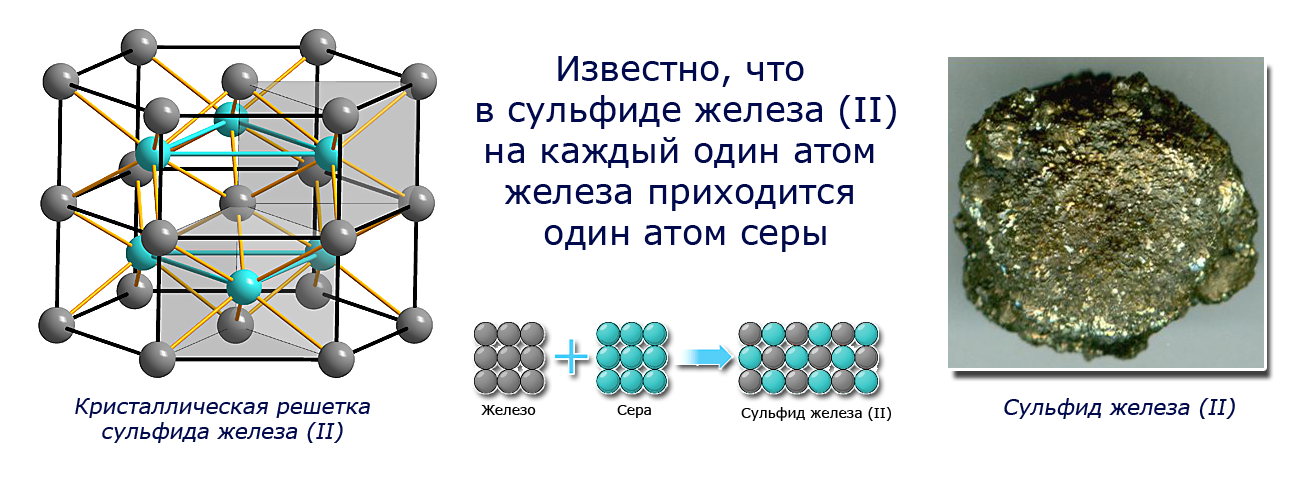
- Чтобы получить сульфид железа(II), мы смешивали железо и серу в соотношении 7:4. Посмотрите видео-эксперимент. Если смешать их в другой пропорции, например 10:4, то химическая реакция произойдет, но 3 г железа в реакцию не вступит. Почему наблюдается такая закономерность? Известно, что в сульфиде железа(II) на каждый один атом железа приходится один атом серы. Следовательно, для реакции нужно брать вещества в таких массовых соотношениях, чтобы сохранялось соотношение атомов железа и серы (1:1). Поскольку численные значения атомных масс Fe, S и их относительных атомных масс Ar(Fe), Ar(S) совпадают, можно записать:Ar(Fe):Ar(S) = 56:32 = 7:4.
Отношение 7:4 сохраняется постоянно, в каких бы единицах массы ни выражать массу веществ (г, кг, т, а.е.м.). Большинство химических веществ обладает постоянным составом.
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые - бертоллидами(в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н2О, НCl, ССl4, СO2. Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
В каких массовых отношениях соединяются химические элементы в серной кислоте, химическая формула которой H2SO4?
Решение: Используя периодическую систему химических элементов найдём относительные атомные массы химических элементов: Ar(H)=1, Ar(S)=32, Ar(O)=16.
Определим массовые отношения этих элементов в формуле H2SO4 m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2 : 32 : 64 = 1 : 16 : 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г - Н, 16 г - S и 32 г - О.
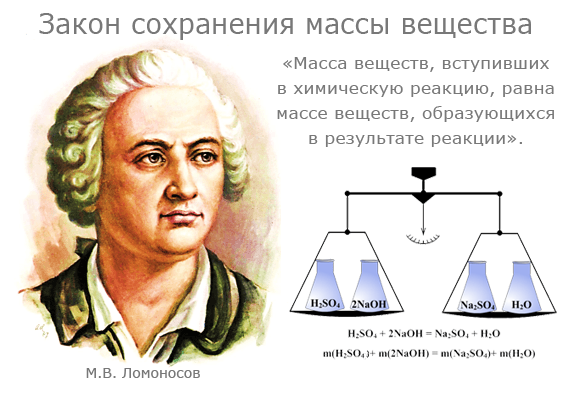
Закон сохранения массы веществ
Проблемный вопрос: изменится ли масса реагирующих веществ по сравнению с массой продуктов реакции?
Чтобы ответить на данный вопрос понаблюдайте за следующим экспериментом:
- Нагревание меди в закрытом сосуде
- Описание эксперимента:
В коническую колбу помесите 2 грамма измельченной меди. Плотно закройте колбу пробкой и взвесьте. Запомните массу колбы. Осторожно нагревайте колбу в течение 5 минут и наблюдайте за происходящими изменениями. Прекратите нагревание, и когда колба охладится, взвесьте её. Сравните массу колбы до нагревания с массой колбы после нагревания.
Вывод: Масса колбы после нагревания не изменилась.
Понаблюдаем за другими видео-экспериментами:
Вывод: Масса веществ до и после реакции не изменилась.
-
С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка.
Закон сохранения массы веществ является основным законом химии, все расчеты по химическим реакциям производятся на его основе. Именно с открытием этого закона связывают возникновение современной химии как точной науки.
Закон сохранения массы был теоретически открыт в 1748 году и экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым.
Французский учёный Антуан Лавуазье в 1789 году окончательно убедил учёный мир в универсальности этого закона. Как Ломоносов, так и Лавуазье пользовались в своих экспериментах очень точными весами. Они нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали исходные вещества и продукты реакции.
Химические уравнения
Закон сохранения массы веществ применяется при составлении уравнений химических реакций.
Посмотрим видео - эксперимент:
-
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
• Исходные вещества, принимающие участие в химических реакциях называются реагентами.
• Новые вещества, образующиеся в результате химической реакции называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Алгоритм составления уравнения химической реакции
Составим уравнение химической реакции взаимодействия фосфора и кислорода 1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку:
P + O2
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
P + O2P2O5
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
В данном случае это атомы кислорода.
Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов кислорода –10:
Находим коэффициенты путём деления наименьшего кратного на число атомов данного вида, полученные цифры ставим в уравнение реакции:
P + 5O22P2O5
Закон сохранения массы вещества не выполнен, так как число атомов фосфора в реагентах и продуктах реакции не равно, поступаем аналогично ситуации с кислородом:
Получаем окончательный вид уравнения химической реакции. Стрелку заменяем на знак равенства. Закон сохранения массы вещества выполнен:
4P + 5O22P2O5
Закон Авогадро. Молярный объём газов
Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Cледствия закона Авогадро:
1 следствие:
Так, 6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём равный 22,4 л.
Такой объём называется молярным объёмом и обозначается Vm
Молярный объём – это постоянная величина для веществ – газов при нормальных условиях (н.у.): Vm = 22,4 л/моль нормальные условия – это p (давление) = 1 амт (101325 Па) t (температура) = 0 ˚C (273 К)
2 следствие:
Эта величина называется относительной плотностью D
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества:
υ = V / Vm = N / Na = m / M
M = ρVm
Глоссарий
- Атомная единица массы (а.е.м.) - ровно 1/12 часть массы атома углерода–12, в ядре которого 6 протонов и 6 нейтронов, а в электронной оболочке 6 электронов. Другое название - углеродная единица. Единица, в которой измеряют массу атомов, молекул и субатомных частиц.
- Относительная атомная масса - обозначается символом Ar ("r" - от английского "relative" - относительный) - отношение массы атома к массе 1/12 атома углерода–12 (см. а.е.м.). В современной научной литературе наряду с термином относительная атомная масса используюется термин АТОМНЫЙ ВЕС (как синонимы).
- Относительная молекулярная масса (Mr) — величина, показывающая, во сколько раз масса молекулы данного вещества больше 1 / 12 массы атома углерода–12. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов, составляющих химическое соединение, с учетом индексов.
- Моль вещества (n) - количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится их в 12 г изотопа углерода 12C и равное 6,022 . 1023 структурных единиц данного вещества: молекул (если вещество состоит из молекул), атомов (если это атомарное вещество), ионов (если вещество является ионным соединением). Число 6,022 . 10 23 называется постоянной Авогадро или числом Авогадро.
- Молярная масса (M) - масса одного моля вещества в граммах называется молярной массой вещества или грамм-молем (размерность г/моль). Численное выражение молярной массы (грамм-моля) в граммах совпадает с молекулярным весом (или атомным, если вещество состоит из атомов) в единицах а.е.м. M = m / n
Нормальными условиями (н.у.) называют температуру 0 оС (273 K) и давление 1 атм (760 мм ртутного столба или 101 325 Па). Не путать со СТАНДАРТНЫМИ УСЛОВИЯМИ!
Полезные ссылки
class="biblio"|
class="biblio"|
class="biblio"|
Библиография:
НЕТУ
- Ахметов Н. С. Актуальные вопроса курса неорганической химии. — М.: Просвещение, 1991. — 224 с — ISBN 5-09-002630-0
Итальянский физик и химик Амедео Авогадро по образованию был юристом, однако известность его имени связана с открытиями в области физики и химии.
Он родился в Турине. Окончил юридический факультет Туринского университета в 1792 г., а с 1800 самостоятельно изучал математику и физику. В 1809 - 1819 гг. преподавал физику в лицее г. Верчелли. В 1820 - 1822 и 1834 - 1850 гг. был профессором физики Туринского университета.
В 1811 г. ученый открыл закон, согласно которому в одинаковых объемах газов при одинаковых температурах и давлениях содержится одинаковое количество молекул (закон Авогадро). Именем Авогадро названа также универсальная постоянная - число молекул в 1 моль идеального газа.
Авогадро создал (1811 г.) метод определения молекулярных масс, посредством которого по экспериментальным данным других исследователей первым правильно вычислил (1811-1820 г.) атомные массы кислорода, углерода, азота, хлора и ряда других элементов. Он установил количественный атомный состав молекул многих веществ (в частности, воды, водорода, кислорода, азота, аммиака, оксидов азота, хлора, фосфора, мышьяка, сурьмы), для которых он ранее был определен неправильно, указал (1814 г.) состав многих соединений щелочных и щелочноземельных металлов, метана, этилового спирта, этилена.
Авогадро первым обратил внимание на аналогию в свойствах азота, фосфора, мышьяка и сурьмы - химических элементов, составивших впоследствии VA-группу Периодической системы.
Однако результаты работ Авогадро по молекулярной теории были признаны лишь в 1860 г. на I Международном конгрессе химиков в Карлсруэ.
Авогадро вел правильный и размеренный образ жизни, он был отцом восьми детей, глубоко презирал роскошь и был равнодушен к своим заслугам и известности.
Родился 26 сентября 1754 в Анже в семье аптекаря. Учился в Парижском университете.
В 1775 г. был назначен на должность управляющего аптекой больницы Сальпетриер. В 1777 г. получил приглашение на кафедру химии и металлургии недавно основанной Королевской семинарии в Вергаре (Испания). В 1785 г. король Испании Карл III пригласил Пруста на должность профессора химии Артиллерийской школы в Сеговии. В дальнейшем Пруст руководил кафедрами химии в университетах Саламанки (1789 г.) и Мадрида (1791-1808 гг.), организовал лабораторию, собрал ценную коллекцию минералов и реактивов.
В 1808 г., во время вторжения войск Наполеона в Мадрид, лаборатория Пруста в его коллекция погибли, и Пруст возвратился во Францию. В 1816 г. ученый был избран членом Парижской академии наук.
В Испании Пруст занимался исследованием свойств и состава соединений различных металлов - олова, меди, железа, никеля и др. Доказал, что многие соединения представляют собой не оксиды, а гидроксиды; первым предложил термин "гидрат", выделил из виноградного сока глюкозу.
Исследование состава различных оксидов металлов, их хлоридов и сульфидов (1797-1809 гг.) послужило основой для открытия им закона постоянства состава химических соединений (1806 г.). Оппонентом Пруста выступил его соотечественник - известный химик К.Бертолле. Упорная дискуссия ученых продолжалась с 1801 г. по 1808 г. и закончилась в пользу Пруста.
Умер Пруст в Анже 5 июля 1826.
23 октября с 6:02 утра во всем мире отмечают День моля (или число Авогадро, которое равно 6.02•1023 моль–1). Традиционно в этот день организаторы на сайте Международного дня моля предлагают разные оригинальные конкурсы и задания. Например, придумать шутку в ответ на вопрос: «Что произойдет, если моль укусит собаку?». Или приготовить странные лакомства под названием печенье Молеассес, крем Авогадро или соус Тако-моль — и все это во имя науки!
А началось все в 80–х с небольшого послания для всех интересующихся химией в статье издания «The Science Teacher», что в итоге привело к основанию Международного фонда Дня моля в 1991 году.
Начиная с 2003 года, на конференции ChemEd вручается «Национальный моль года» тем, кто внес «наибольший вклад в становление Дня моля, а также в химическое образование», – сообщается на сайте Международного фонда Дня моля.
Так или иначе, моль является ключом к измерению количества вещества. Если вы знаете, как его использовать, и у вас есть под рукой периодическая таблица, вы можете конвертировать число атомов и молекул любого вещества в граммы и наоборот. Это важно тогда, когда вам нужно знать, сколько определенное вещество содержит частиц, которые могут вступать в реакцию с активными частицами другого вещества.
Таким образом, масса вещества выражается в граммах точно так же, как и его молярная масса. Например, молярная масса воды – 18,015, и один моль воды равен 18,015 граммов.
Там, где обычные люди сказали бы: «У меня есть 36,03 граммов воды», химики скажут: «Дайте мне подумать, куда мне поместить мои 2 моля воды, которые мне необходимы, чтобы произвести химическую реакцию».
До 1909 года, когда физик и лауреат Нобелевской премии Жан Перрен определил постоянное число Авогадро, ученые принимали определенное количество воды как 12.04•1023 молекул.
Перрен же вывел удобное постоянное число «Авогадро», именуемое в честь Амедео Авогадро, который на столетие раньше предположил, что существует связь между объемом газа и числом атомов или молекул в нем.
Задача 1. Какой объем (н.у.) занимает 5·10-3 кг углекислого газа?
Найдем молекулярную массу СО2:
Mr(CO2)= 12+2·16=44 г.
Tакже нам известен молярный объем газа, который равен 22,4 м3.
Составим следующую пропорцию:
44 кг СО2 занимает объем 22,4 м3
5·10-3 кг СО2 занимает объем – х
откуда х=(5·10-3·22,4)/44=2,5·10-3 м3
Таким образом, 5·10-3 кг углекислого газа занимает объем равный 2,5·10-3 м3.
Задача 2. Определить массу 0,9·10-3 м3 кислорода при 21 °С и давлении 96000 Па, если масса 10-3 м3 кислорода равна 1,5·10-3 кг при нормальных условиях.
Найдем температуру в Кельвинах Т=273+21=294 К;
Найдем объем газа, приведенный к н.у. по формуле
P1V1 / T1 = P2V2 / T2;
V1= T1P2V2 / T2P1=
=(273·96000·0.9·10-3) / (294·101325)=0.8·10-3 м3
Теперь рассчитаем массу вычисленного объема:
10-3 м3 кислорода имеют массу равную 1,5·10-3 кг
0,8·10-3 м3 кислорода имеют массу равную х
х = 0,8·10-3·1,5·10-3/10-3=1,2·10-3 кг
Таким образом, 0,8·10-3 м3 кислорода имеют массу равную 1,2·10-3 кг.
Задача 3. Рассчитайте объем атома железа, если его плотность равна 7900 кг/м3
Найдем молярный объем железа (M(Fe)=56 г.)
V=n/ρ=56/7900=7,1·10-3 м3
Условно примем, что атомы имеют форму шара и в кристалле касаются друг друга, то истинный объем будет составлять только 74% от общего объема:
V=0,071·0,74=5,25·10-3 м3
Тогда объем одно атома железа будет равен:
VА=5,25·10-3/6,02·1026=8,7·10-30 м3
Задача 4. Определить массу молекулы газа, если масса 10-3 м3 газа, при н.у., равна 0,3810-3 кг.
Число молекул 1 кмоль любого вещества равна числу Авогадро (6,02·1026 ), поэтому для начала определим 1 кмоль газа:
10-3 м3 газа имеют массу равную 0,3810-3 кг
22,4 м3 газа имеют массу равную — х
х=22,4·0,3810-3/10-3=7,6 кг,
Далее определяем массу молекулы газа:
m=7,6/6,02·1026=1,26·10-26 кг.
Задача 5. Рассчитайте молярную массу эквивалента металла, если при соединении 7,2 г. металла с хлором было получено 28,2 г. соли. Молярная масса эквивалента хлора равна 35,45 г/моль
Согласно закону эквивалента отношение массы металла и соли должно быть равно отношению их молярных масс эквивалентов. Обозначим молярную массу эквивалента металла через х, тогда:
7,2/28,2=х/(х+35,45)
Решая уравнение, находим, что х=12,15 г/моль.
Таким образом, молярная масса эквивалента металла Мэкв=12,15 г/моль.
Задача 6. Определение молярной массы эквивалента сложных веществ в реакциях обмена
Определите молярные массы эквивалентов H2SO4 в следующих реакциях:
А) H2SO4+2KOH = K2SO4+2H2O
Б) H2SO4+KOH = KHSO4+H2O
Значение эквивалента вещества зависит от того, в какой именно реакции оно участвует.
В реакции А) 1 моль H2SO4 взаимодействует с 2 моль KOH, а эквивалент H2SO4 с 2 эквивалентами KOH. Молярная масса эквивалента KOH равна его молекулярной массе, следовательно, молярная масса эквивалента H2SO4 равна половине ее молекулярной массы:
Мэкв=98/2=49 г/моль
В реакции Б) 1 моль H2SO4 взаимодействует с 1 моль KOH, а эквивалент H2SO4 с 1 эквивалентами KOH. Молярная масса эквивалента KOH равна его молекулярной массе, следовательно, молярная масса эквивалента H2SO4 равна ее молекулярной массе: 98 г/моль.
Задача 7. Рассчитайте молярную массу эквивалента кислоты, если на нейтрализацию 9 г. ее израсходовано 8 г. гидроксида натрия.
Молярная масса эквивалента гидроксида натрия равна его молекулярной массе Мэкв =40 г/моль.
Вещества взаимодействуют между собой в массах, пропорциональных из молярным массам эквивалента, т.е.:
Обозначим молярную массу эквивалента кислоты – х, тогда
9/8=х/40=45 г/моль
Задача 8. Найдите молекулярную формулу вещества, если относительная плотность паров этого вещества по водороду равна 67,5, а массовые доли элементов (%) в веществе следующие: серы – 23,7, кислорода – 23,7, хлора – 52.
Формулу искомого соединения можно представить как SxOyClz. Найдем соотношение между числом атомов S, O, Cl делением его содержания на его атомную массу:
x:y:z = 23,7/32 : 23,7/16 : 52/35,5 = 0,74 : 1,48 : 1,46
Делим все полученные соотношения на наименьшее, получаем:
x:y:z =1:2:2
Простейшая формула вещества SO2Cl2
Его молекулярная масса равна Mr = 32+16·2+35,5·2 = 135 г.
Теперь найдем молекулярную массу вещества по плотности паров этого вещества по водороду:
Mr = 2DH2= 2·67,5 = 135 г.
Следовательно, истинная формула вещества совпадает с простейшей: SO2Cl2
Задача 9. Рассчитайте молекулярную массу газа, если 7·10-3 кг. его при 20°С и 0,253·105 Па занимают объем 22,18·10-3 м3
В данном случае, вычислить молярную массу газа можно, используя уравнение Клапейрона – Менделеева:
pV = nRT = (m/M)RT;
R=8,3144·103 Дж/моль·К
Т=273+20=293 К
М=mRT/pV=7·10-3·8,3144·103293/(0,253·105·22,18·10-3)=30,35 г/моль
Молярная масса газа равна 30,35 г/моль
Задача 10. При 0°С в сосуде объемом 14·10-3 м3 содержится 0,8·10-3 кг водорода и 6,3·10-3 кг азота. Определите парциальное давление азота и общее давление смеси.
Найдем количества вещества водорода и азота:
n=m/Mn(H2)=0,8·10-3/2=0,4·10-3моль
n(N2)= 6,3·10-3/28=0,225·10-3моль
Далее, с помощью уравнения Клапейрона – Менделеева, найдем парциальное давление каждого газа в смеси:
pV = nRT = (m/M)RT;
p = nRT/V;
p(H2)=n(H2)
RT/V=0,4·10-3·8,3144·103·273/14·10-3=64,85·103Па
p(N2)= n(N2)
RT/V=0,225·10-3*8,3144·103·273/14·10-3=36,479·103Па
pобщ=p(H2)+p(N2)= 64,85·103+36,479·103=101329 Па
Задача 11. Газовая смесь составлена из 5·10-3 м3 метана под давлением 96000 Па, 2·10-3 м3 водорода под давлением 84000 Па и 3·10-3 м3 диоксида углерода под давлением 109000 Па. Объем смеси 8·10-3 м3. Определите парциальные давления газов в смеси и общее давление смеси.
Сначала найдем парциальное давление каждого из газов:
p(CH4)=P(CH4)·V(CH4)/Vобщ=96000·5·10-3/8·10-3=60000 Па
p(H2)=P(H2)·V(H2)/Vобщ=84000·2·10-3/8·10-3=21000 Па
p(CО2)=P(CО2)·V(CО2)/Vобщ=109000·3·10-3/8·10-3=40875 Па
Общее давление:
pобщ= p(CH4)+ p(H2)+ p(CО2)= 60000+21000+40875=121875 Па
Задача 12.Газовая смесь состоит из оксида и диоксида азота. Вычислите парциальные давления газов в смеси, если объемные доли газов соответственно равны (%) 37,5 и 62,5. Общее давление газовой смеси 106640 Па.
Парциальное давление газа в смеси равно произведению общего давления на его объемную долю в смеси:
p(NO)= pобщ·φNO=106640·0,375=39990 Па
p(NO2)= pобщ·φNO2=106640·0,625=66650 Па