Химия: Химиялык реакция — различия между версиями
Admine2 (обсуждение | вклад) (Новая страница: «{{lang|Химия: Химическая реакция}}») |
Admine2 (обсуждение | вклад) |
||
| Строка 1: | Строка 1: | ||
| + | {{Якорь|Начало}} | ||
| + | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | ||
| + | <div class="cutok">[[#Химиялык реакциялардын белгилери|Химиялык реакциялардын белгилери]] [[#Химиялык реакциянын жүрүү шарттары|Химиялык реакциянын жүрүү шарттары]] [[#Химиялык реакциялардын классификациясы|Химиялык реакциялардын классификациясы]]</div> | ||
| + | Бир заттын башка заттарга айлануу кубулушу '''химиялык реакция''' деп аталат. Химиялык реакцияга кирген баштапкы заттар реагенттер деп, ал эми реакциядан кийин пайда болгон заттар реакциянын продуктылары деп аталат. | ||
| + | |||
| + | <div class="textblock">'''Химиялык реакция''' – химиялык кубулуштун химиялык теңдеме менен туюнтулушу</div><br> | ||
| + | |||
| + | <ul class="small-block-grid-1 large-block-grid-2"> | ||
| + | <li>'''Химиялык теңдеме''' – бул химиялык белгилердин жана формулалардын жардамы менен химиялык реакцияларды шарттуу түрдө туюнтуп жазуу. Химиялык формулалар менен туюнтулган химиялык теңдеме оң жана сол жакка бөлүнөт. Тендеменин сол жагына реагенттер, ал эми оң жагына реакциянын продуктылары жазылат. Заттардын формуласында химиялык элементтин атомдорунун саны индекс аркылуу көрсөтүлөт. Бул заттын касиетине бир кыйла таасир этет:</li> | ||
| + | <li> | ||
| + | {| class="resettext mw-datatable" | ||
| + | |- | ||
| + | !H<sub>2</sub>SO<sub>4</sub> | ||
| + | !H<sub>2</sub>SO<sub>3</sub> | ||
| + | |- style="text-align:center;" | | ||
| + | |Күкүрт кислотасы | ||
| + | |Күкүрттүү кислота | ||
| + | |- | ||
| + | |Күчтүү | ||
| + | |Начар | ||
| + | |- | ||
| + | |Туруктуу | ||
| + | |Туруктуу эмес | ||
| + | |- | ||
| + | |Териге тийсе күйгүзөт | ||
| + | |Жарыктын таасири менен ажырайт | ||
| + | |- | ||
| + | |Майланышкан суюктук | ||
| + | |Газдын суулуу эритмеси | ||
| + | |} | ||
| + | </li> | ||
| + | </ul> | ||
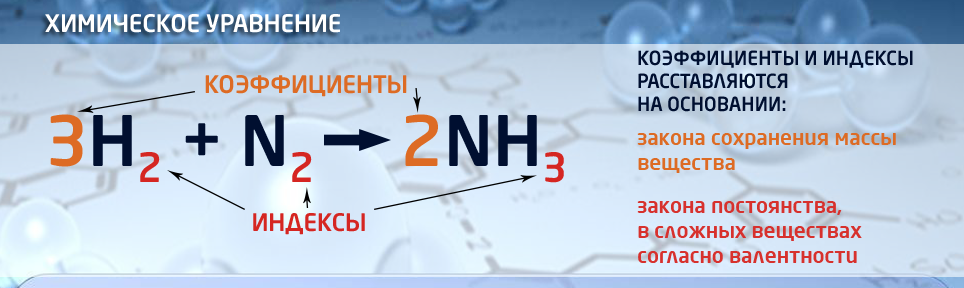
| + | {{center|[[file:Химическое Уравнение.png|550px|Индексы и коэффициенты в химических уравнениях]]}}<br> | ||
| + | |||
| + | Химиялык тендемелерде формулалардын алдына '''коэффициент''' жазылат, ал реакцияга катышкан молекулалардын санын көрсөтөт. | ||
| + | |||
| + | Адатта, химиялык реакция убагында энергия сиңирилип же бөлүнүп чыкса, теңдемеге барабардык жазылат. ''(Бул реакциянын жылуулук эффекти)'' 2Mg + O<sub>2</sub> = 2MgO + 1203 кДж. Химиялык теңдемени жазууда реакциянын багытын көрсөтүүчу жебе (стрелка) колдонулат: SO<sub>2</sub> + H<sub>2</sub>O {{arrowleft}} H<sub>2</sub>SO<sub>3</sub> | ||
| + | |||
| + | === Признаки химических реакций === | ||
| + | <ul class="small-block-grid-1 large-block-grid-3"> | ||
| + | <li>{{center|Жылуулуктун бөлүнүп чыгышы<br>'''Опыт № 54 или (горение костра)'''}}</li> | ||
| + | <li>{{center|Жарыктын чыгышы<br>'''Опыт № 3 (горение серы в кислороде)'''}}</li> | ||
| + | <li>{{center|Чөкмөнүн чөгүшү<br>'''Опыт № 77 (галогены с ионом серебра)'''}}</li> | ||
| + | <li>{{center|Газдын бөлүнүп чыгышы<br>'''Опыт № 37 (медь с конц. азотной кислотой –«лисий хвост»)'''}}</li> | ||
| + | <li>{{center|Өңүнүн өзгөрүшү<br>'''Опыт № 75 (хлорид кобальта с гидроксидом натрия – синий цвет)'''}}</li> | ||
| + | <li>{{center|Жыттын пайда болушу<br>'''(гниющий мусор)'''}}</li> | ||
| + | </ul> | ||
| + | {{right|[[Файл:Признаки химреакции.jpg|350px|class=show-for-large-up|Признаки химических реакций]]}} | ||
| + | {{center|[[Файл:Признаки химреакции.jpg|350px|class=hide-for-large-up|Признаки химических реакций]]}} | ||
| + | <big>'''Химиялык реакциянын убагында заттарда болгон өзгөрүүлөр реакциянын жүргөндүгүн билдирет жана химиялык реакциянын белгилери болуп саналат.'''</big> | ||
| + | |||
| + | Көпчүлүк заттар бири–бири менен өз алдынча аракеттене алышпайт. Реакциянын жүрүшү үчүн белгилүү бир шарттар түзүлүшү керек. | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | == Химиялык реакциянын жүрүү шарттары == | ||
| + | {{left-p|[[Файл:42 flame.gif|class=show-for-large-up|250px|Күйүү – жарыкты жана жылуулукту бөлүп чыгаруу менен жүргөн кубаттуу кычкылдануу]]}} | ||
| + | {{left|[[Файл:42 flame.gif|class=show-for-medium-only|250px|Күйүү – жарыкты жана жылуулукту бөлүп чыгаруу менен жүргөн кубаттуу кычкылдануу]]}} | ||
| + | {{center|[[Файл:42 flame.gif|250px|class=show-for-small-only|Күйүү – жарыкты жана жылуулукту бөлүп чыгаруу менен жүргөн кубаттуу кычкылдануу]]}} | ||
| + | :<big>'''1.''' Майдалоо '''2.''' Аралаштыруу '''3.''' Ысытуу</big> | ||
| + | |||
| + | Заттардын тийишүү беттерин көбөйтүү үчүн аларды майдалашат, газ абалына айландырылат. Кээ бир заттарды сууда эритсек, эритме абалында алар бири–бири менен реакцияга жакшы кирет. | ||
| + | |||
| + | Көпчүлүк убакта бул жетишсиздик кылат, ошондуктан, реакцияга кирген заттарды ысытышат. Жыгачтын чычаласы, темир менен күкүрттүн аралашмасы, жез бөлмө температурасында реакцияга кирбейт, реакциянын жүрүшү үчүн аларды сөссүз ысытуу керек. | ||
| + | |||
| + | Кээ бир учурларда химиялык процесстин жүрүшү үчүн жарык талап кылынат. Дайыма жарыктын таасири астында жүргөн реакциялардын бири катары, баарыбызга белгилүү фотосинтезди белгилесек болот. | ||
| + | |||
| + | === Скорость химической реакции === | ||
| + | {{center|[[file:Скорость хим реакции.png|750px|Зависимость скорости химической реакции от различных факторов]]}} | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | == Химиялык реакциялардын классификациясы == | ||
| + | {{KlassChemRe}} | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | == Глоссарий == | ||
| + | :{{bib|'''Аллотропией''' называется образование разных простых веществ одним элементом. Аллотропия возникает или из–за разного количества атомов в составе вещества ''(O<sub>2</sub> –кислород, O<sub>3</sub> – озон)'', или из–за разного соединения атомов в кристаллическую решетку ''(алмаз, графит)''.}} | ||
| + | :{{bib|'''Гомогенными''' называются реакции, в которых все реагирующие вещества, продукты реакции и катализатор тоже в каталитических реакциях, находятся в одном агрегатном состоянии. Если хотя бы одно из веществ имеет другое агрегатное состояние, то такая реакция называется '''гетерогенной'''. ''('''Гомо''' – одинаковый, '''гетеро''' – разный).''}} | ||
| + | :{{bib|'''Изомеры''' – это вещества одинакового качественного и количественного состава, но имеющие разное строение молекул и различные свойства.}} | ||
| + | :{{bib|'''Катализаторами''' называют вещества, которые влияют на скорость реакции, чаще всего, ускоряя скорость реакции. Катализаторы принимают непосредственное участие в химической реакции, но по окончании реакции высвобождаются.}} | ||
| + | :{{bib|Катализаторы, замедляющие скорость химических реакций называются '''ингибиторами'''.}} | ||
| + | :{{bib|'''Каталитическими реакциями''' называются такие реакции, которые идут только в присутствии катализатора. Использование различных катализаторов приводит к получению различных продуктов реакции.}} | ||
| + | :{{bib|'''Количество теплоты''', которое выделяется или поглощается при химический реакции, называется '''тепловым эффектом реакции'''.}} | ||
| + | :{{bib|'''Окислительно–восстановительными''' реакциями являются такие реакции, в которых у атомов, входящих в состав молекул, изменяются степени окисления по окончании реакции. Окислительно–восстановительными чаще бывают реакции соединения и замещения.}} | ||
| + | :{{bib|'''Реакцией замещения''' называется реакция между простым и сложным веществом, при которой атомы простого вещества замещают атомы в сложном веществе по принципу: в новом веществе атомы с наибольшей электроотрицательностью соединяются с атомами с наименьшей электроотрицательностью. Атомы элемента с промежуточной между ними электроотрицательностью высвобождаются в виде простого вещества. В результате образуются новое сложное и новое простое вещества.}} | ||
| + | :{{bib|'''Реакцией обмена''' называется реакция между двумя сложными веществами при которой они обмениваются своими составными частями. Причем та часть, что стояла первой, в новом веществе будет стоять первой, а та часть, что стояла второй и в новом веществе тоже будет стоять на втором месте.}} | ||
| + | :{{bib|'''Реакцией разложения''' называется реакция, в результате которой из одного вещества образуется два или нескольких новых веществ.}} | ||
| + | :{{bib|'''Реакцией соединения''' называется реакция, в результате которой из двух или нескольких веществ образуется одно новое вещество.}} | ||
| + | :{{bib|Реакции, приводящие к установлению химического равновесия, называются '''обратимые'''. У обратимых реакций две скорости – скорость прямой реакции, приводящая к образованию продукта реакции. И скорость обратной реакции – распад продукта реакции до исходных веществ. Когда скорости прямой и обратной реакций становятся равными, наступает '''химическое динамическое равновесие'''. Это означает, что в единицу времени образуется столько молекул, сколько их распадается за это же время.}} | ||
| + | :{{bib|У '''необратимых''' реакций только одна скорость и они протекают только в одну сторону, если продуктом реакции является осадок, газообразное вещество или вода.}} | ||
| + | :{{bib|Химические реакции, которые идут без участия катализаторов называются '''некаталитическими'''.}} | ||
| + | :{{bib|'''Экзотермическими реакциями''' называются реакции, идущие с выделением теплоты. Многие реакции соединения являются экзотермическими реакциями.}} | ||
| + | :{{bib|'''Эндотермическими реакциями''' называются такие реакции, которые идут с поглощением теплоты Эндотермическими реакциями являются многие реакции разложения.}} | ||
| + | |||
| + | == Пайдалуу шилтемелер == | ||
| + | <small>Видеоурок «Качественные реакции в химии». Сайт «Видеоуроки в интернет» (Электронный ресурс). [https://www.youtube.com/watch?v=pk7UXWVBC9U&t=193s //URL:.https://www.youtube.com/watch?v=pk7UXWVBC9U&t=193s] (дата обращения 07.03.18.)</small> | ||
| + | <br> | ||
| + | |||
| + | == Библиография == | ||
| + | * {{bib|Волков В. А., Вонский Е. В., Кузнецова Г. И. Выдающиеся химики мира. — М.: Высшая школа, 1991. — 656 с. — 100 000 экз. — ISBN 5-06-001568-8. (в пер.)}} | ||
| + | * {{bib|Кособаева Б. – Использование компьютера в учебном процессе химии / Текст / Б. Кособаева, Н.Б. Арстанбекова // Абай атындагы Казак Улуттукпедагогикалык университеттинин Хабарши (Вестник) Жаратылыш таануу-география илимдери сериясынын 2012 №2 (32). – 68–71–бб.}} | ||
| + | * {{bib|Стартовый эксперимент как форма включенности каждого ученика в учебный процесс / Текст / Б. Кособаева, Син Е.Е. // Химия в школе. – Москва, 2016. – №6.}} | ||
| + | * {{bib|Дидактические особенности использования технологии обучения на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №6(48), С.155–160.}} | ||
| + | * {{bib|Применение технологии системного усвоения знаний в обучении химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №7(49), С.152–159.}} | ||
| + | * {{bib|Реализация межпредметных связей на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №10(52), С.136–139.}} | ||
| + | * {{bib|Методологические аспекты обучения в современных условиях. / Текст / Б. Кособаева, Син Е.Е., Жакышова Б.Ш. // Проблемы современной науки и образования. – Иваново, 2016. – №13(55), С.104–108.}} | ||
| + | * {{bib|Формирование системы понятий при обучении химии в школе. / Текст / Б. Кособаева, П.Э. Токомбаева // Вестник Кыргызского национального университета имени Ж. Баласагына. – Бишкек, 2017. – Специальный выпуск. С.77–81.}} | ||
| + | |||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | </div> | ||
| + | |||
| + | <!-- Sidebar --> | ||
| + | <div class="large-4 medium-5 columns"> | ||
| + | <!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | ||
| + | <div class="sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Химия в лицах</div> | ||
| + | </div> | ||
| + | {{center-p|[[file:Menshutkin.jpg|400px|Николай Александрович Меншуткин]]}} | ||
| + | |||
| + | |||
| + | <span class="firstcharacter">Б</span>ыл одним из инициаторов основания в 1868 г. Русского химического общества (наряду с А. А. Воскресенским, Н. Н. Зининым и Д. И. Менделеевым), был его делопроизводителем (1868—1891) и первым редактором «Журнала РХО» (1869—1900). В марте 1869 г. на заседании Русского химического общества Меншуткин доложил от имени Менделеева его Периодический закон — периодическую систему элементов. | ||
| + | |||
| + | Основное направление работ Меншуткина — исследование скорости химических превращений органических соединений. | ||
| + | |||
| + | Меншуткин обнаружил влияние разбавления на скорость реакции. Эти работы Меншуткина легли в основу классической химической кинетики. В 1886—1889 гг. Меншуткин установил влияние природы растворителя и температуры на процессы образования и разложения аминов и амидов кислот. В 1890 г. установил каталитическое действие растворителей в реакциях этерификации и солеобразования. | ||
| + | </div> | ||
| + | |||
| + | |||
| + | <div class="sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Задачи</div> | ||
| + | </div> | ||
| + | Какая масса углекислого газа образуется при сжигании 6 г углерода? | ||
| + | <div class="mw-customtoggle-z1 resettext button17">Правильный ответ</div> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-z1"> | ||
| + | 22 г | ||
| + | ---- | ||
| + | </div> | ||
| + | |||
| + | |||
| + | Какой объем кислорода выделится при разложении 5 г 10% перекиси водорода? | ||
| + | <div class="mw-customtoggle-z2 resettext button17">Правильный ответ</div> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-z2"> | ||
| + | 0,175 л | ||
| + | ---- | ||
| + | </div> | ||
| + | |||
| + | |||
| + | Какова масса осадка, образованного при слиянии раствора содержащего 3.4 грамма нитрата серебра и раствора содержащего 0,585 грамма хлорида натрия? | ||
| + | <div class="mw-customtoggle-z3 resettext button17">Правильный ответ</div> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-z3"> | ||
| + | 1, 435 г. | ||
| + | ---- | ||
| + | </div> | ||
| + | |||
| + | |||
| + | Сколько тепла выделится при горении одного заряда салюта массой 0,6 граммов, если термохимическое уравнение<br>2Mg + O<sub>2</sub> {{Arrowleft}} 2MgO + 1203 кДж? | ||
| + | <div class="mw-customtoggle-z4 resettext button17">Правильный ответ</div> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-z4"> | ||
| + | 15,05 кДж | ||
| + | ---- | ||
| + | </div> | ||
| + | |||
| + | |||
| + | Определить практический выход продукта реакции, если из 50 литров аммиака при его каталитическом окислении образовалось 30 литров оксида азота (II). | ||
| + | <div class="mw-customtoggle-z5 resettext button17">Правильный ответ</div> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-z5"> | ||
| + | 60 % | ||
| + | ---- | ||
| + | </div> | ||
| + | </div> | ||
| + | |||
| + | |||
| + | <div class="shadow radius sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="background-color:lightgrey;"></div> | ||
| + | </div> | ||
| + | |||
| + | </div></div> | ||
{{lang|Химия: Химическая реакция}} | {{lang|Химия: Химическая реакция}} | ||
| + | [[Category:Средняя школа]] | ||
| + | [[Category:Химия]] | ||
Версия 11:08, 3 мая 2018
Бир заттын башка заттарга айлануу кубулушу химиялык реакция деп аталат. Химиялык реакцияга кирген баштапкы заттар реагенттер деп, ал эми реакциядан кийин пайда болгон заттар реакциянын продуктылары деп аталат.
- Химиялык теңдеме – бул химиялык белгилердин жана формулалардын жардамы менен химиялык реакцияларды шарттуу түрдө туюнтуп жазуу. Химиялык формулалар менен туюнтулган химиялык теңдеме оң жана сол жакка бөлүнөт. Тендеменин сол жагына реагенттер, ал эми оң жагына реакциянын продуктылары жазылат. Заттардын формуласында химиялык элементтин атомдорунун саны индекс аркылуу көрсөтүлөт. Бул заттын касиетине бир кыйла таасир этет:
-
H2SO4 H2SO3 Күкүрт кислотасы Күкүрттүү кислота Күчтүү Начар Туруктуу Туруктуу эмес Териге тийсе күйгүзөт Жарыктын таасири менен ажырайт Майланышкан суюктук Газдын суулуу эритмеси
Химиялык тендемелерде формулалардын алдына коэффициент жазылат, ал реакцияга катышкан молекулалардын санын көрсөтөт.
Адатта, химиялык реакция убагында энергия сиңирилип же бөлүнүп чыкса, теңдемеге барабардык жазылат. (Бул реакциянын жылуулук эффекти) 2Mg + O2 = 2MgO + 1203 кДж. Химиялык теңдемени жазууда реакциянын багытын көрсөтүүчу жебе (стрелка) колдонулат: SO2 + H2O ![]() H2SO3
H2SO3
Содержание
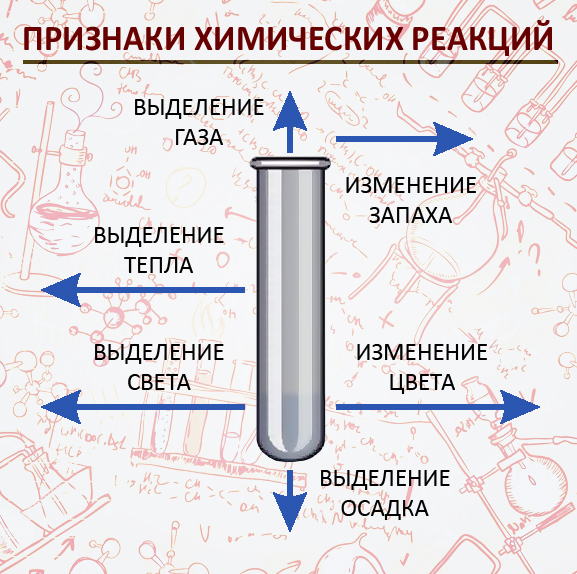
Признаки химических реакций
- Жылуулуктун бөлүнүп чыгышы
Опыт № 54 или (горение костра) - Жарыктын чыгышы
Опыт № 3 (горение серы в кислороде) - Чөкмөнүн чөгүшү
Опыт № 77 (галогены с ионом серебра) - Газдын бөлүнүп чыгышы
Опыт № 37 (медь с конц. азотной кислотой –«лисий хвост») - Өңүнүн өзгөрүшү
Опыт № 75 (хлорид кобальта с гидроксидом натрия – синий цвет) - Жыттын пайда болушу
(гниющий мусор)
Химиялык реакциянын убагында заттарда болгон өзгөрүүлөр реакциянын жүргөндүгүн билдирет жана химиялык реакциянын белгилери болуп саналат.
Көпчүлүк заттар бири–бири менен өз алдынча аракеттене алышпайт. Реакциянын жүрүшү үчүн белгилүү бир шарттар түзүлүшү керек.
Химиялык реакциянын жүрүү шарттары
- 1. Майдалоо 2. Аралаштыруу 3. Ысытуу
Заттардын тийишүү беттерин көбөйтүү үчүн аларды майдалашат, газ абалына айландырылат. Кээ бир заттарды сууда эритсек, эритме абалында алар бири–бири менен реакцияга жакшы кирет.
Көпчүлүк убакта бул жетишсиздик кылат, ошондуктан, реакцияга кирген заттарды ысытышат. Жыгачтын чычаласы, темир менен күкүрттүн аралашмасы, жез бөлмө температурасында реакцияга кирбейт, реакциянын жүрүшү үчүн аларды сөссүз ысытуу керек.
Кээ бир учурларда химиялык процесстин жүрүшү үчүн жарык талап кылынат. Дайыма жарыктын таасири астында жүргөн реакциялардын бири катары, баарыбызга белгилүү фотосинтезди белгилесек болот.
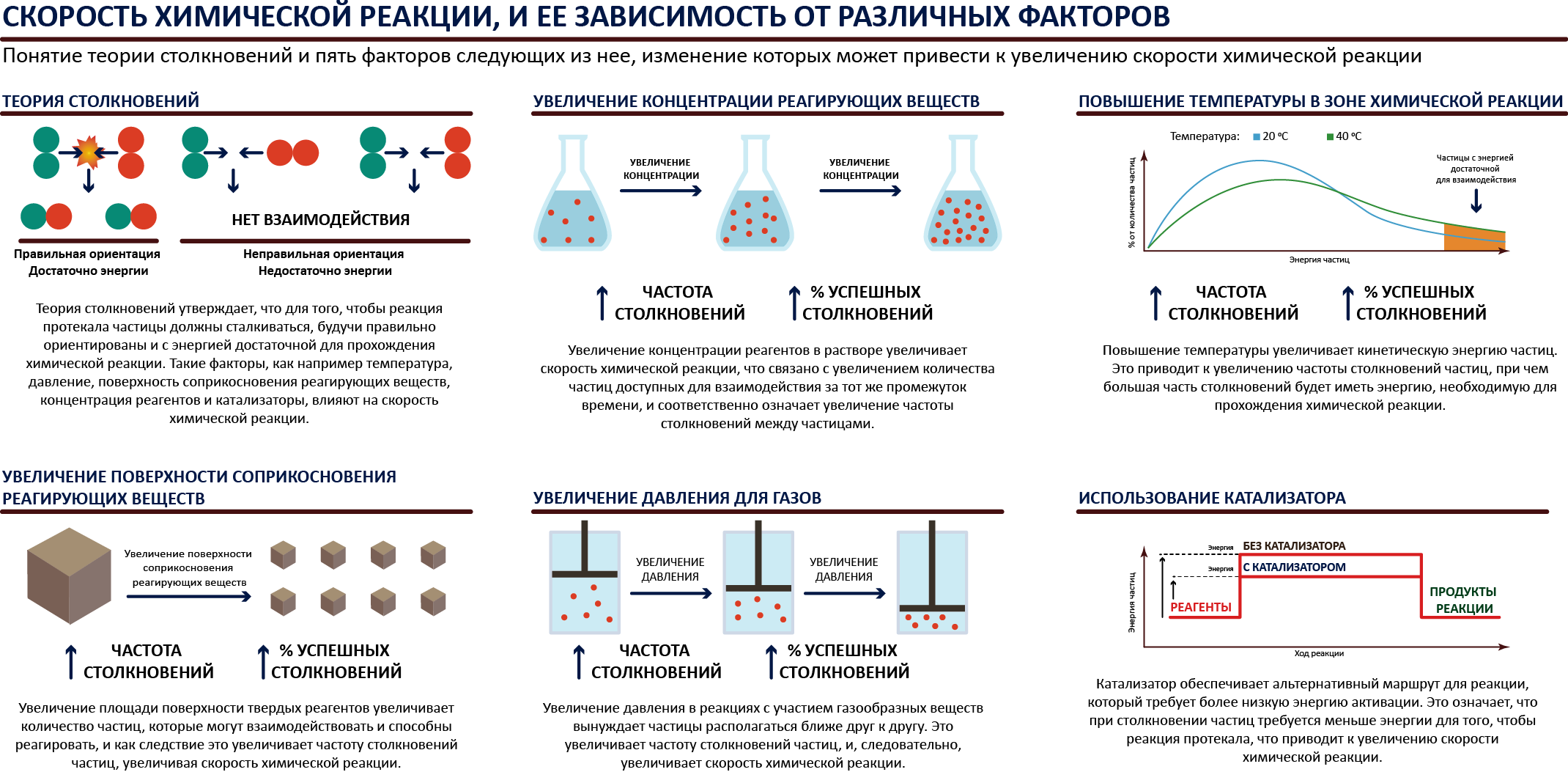
Скорость химической реакции
Химиялык реакциялардын классификациясы
left:20%; top:58%; left:25%; top:88%; left:34%; top:108%; left:48%; top:123%; left:62%; top:108%; left:72%; top:88%; left:76%; top:58%;






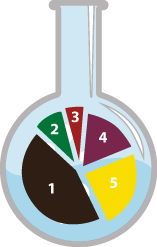
Реакции, протекающие без изменения качественного и количественного состава простых и сложных веществ
Аллотропные превращения и изомеризация
Например: Превращение кислорода в озон или образование изомеров
Образование разных простых веществ одним элементом называется аллотропией. Аллотропия возникает или из–за разного количества атомов в составе вещества (O2 –кислород, O3 – озон), или из–за разного соединения атомов в кристаллическую решетку (алмаз, графит).
3O2 ![]() 2O3
2O3
Изомеры – это вещества одинакового качественного и количественного состава, но имеющие разное строение молекул и различные свойства.
Обратимость реакции
Обратимые и необратимые реакции
Например: реакции водорода с иодом и разложение дихромата аммония
Реакции, приводящие к установлению химического равновесия, называются обратимые. У обратимых реакций две скорости – скорость прямой реакции, приводящая к образованию продукта реакции. И скорость обратной реакции – распад продукта реакции до исходных веществ. Когда скорости прямой и обратной реакций становятся равными, наступает химическое динамическое равновесие. Это означает, что в единицу времени образуется столько молекул, сколько их распадается за это же время.
H2 + I2 ![]() 2HI
2HI
У необратимых реакций только одна скорость и они протекают только в одну сторону, если продуктом реакции является осадок, газообразное вещество или вода.
(NH4)2Cr2O7 ![]() 2NH3↑ + H2O + 2CrO3
2NH3↑ + H2O + 2CrO3
Энергетический эффект
Экзотермические и эндотермические реакции
Например: реакции: горение магния и разложение оксида ртути
Экзотермическими реакциями называются реакции, идущие с выделением теплоты. Многие реакции соединения являются экзотермическими реакциями.
2Мg +O2 ![]() 2МgO + Q
2МgO + Q
Эндотермическими реакциями называются такие реакции, которые идут с поглощением теплоты Эндотермическими реакциями являются многие реакции разложения.
2HgO ![]() 2Hg + O2 – Q
2Hg + O2 – Q
Количество теплоты (Q), которое выделяется или поглощается при химический реакции, называется тепловым эффектом реакции.
Исходное состояние реагирующих систем
Гомогенные и гетерогенные реакции
Например: Соединение азота с кислородом.
Гомогенными называются реакции, в которых все реагирующие вещества, продукты реакции и катализатор тоже в каталитических реакциях, находятся в одном агрегатном состоянии. Если хотя бы одно из веществ имеет другое агрегатное состояние, то такая реакция называется гетерогенной. (Гомо – одинаковый, гетеро – разный).
N2 + O2 ![]() 2NO − Q.
2NO − Q.
Участие катализатора
Каталитические и некаталитические реакции
Например: каталитическое окисление аммиака и реакция аммиака с водой
Каталитическими реакциями называются такие реакции, которые идут только в присутствии катализатора. Использование различных катализаторов приводит к получению различных продуктов реакции.
4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
Катализаторами называют вещества, которые влияют на скорость реакции, чаще всего, ускоряя скорость реакции.
Катализаторы принимают непосредственное участие в химической реакции, но по окончании реакции высвобождаются.
Катализаторы, замедляющие скорость химических реакций называются ингибиторами.
Химические реакции, которые идут без участия катализаторов называются некаталитическими.
NH3 + H2O ![]() NH4OH
NH4OH
Наличие окислительно восстановительного процесса
Присутствует ли окислительно восстановительный процесс или нет.
Например: Реакции цинка с соляной кислотой и разложение карбоната кальция
Окислительно–восстановительными реакциями являются такие реакции, в которых у атомов, входящих в состав молекул, изменяются степени окисления по окончании реакции.
Окислительно–восстановительными чаще бывают реакции соединения и замещения.
Zn + 2HCl ![]() ZnCl2 + H2↑
ZnCl2 + H2↑
Бывают реакции, которые протекают без изменения степеней окисления элементов.
CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
Соотношение числа исходных и полученных веществ
Реакции соединения, разложения, замещения и обмена.
Например: Горение угля в кислороде, разложение перекиси водорода, реакции меди с нитратом ртути и нитрата серебра с хлоридом натрия.
Реакцией соединения называется реакция, в результате которой из двух или нескольких веществ образуется одно новое вещество.
S + O2 ![]() SO2↑
SO2↑
CaO + H2O ![]() Ca(OH)2
Ca(OH)2
CaCO3 + CO2 + H2O ![]() Ca(HCO3)2
Ca(HCO3)2
Реакцией разложения называется реакция, в результате которой из одного вещества образуется два или нескольких новых веществ.
2HgO ![]() 2Hg + O2↑
2Hg + O2↑
Сu(OH)2 ![]() СuO + H2O
СuO + H2O
2AgNO3 ![]() 2Ag + 2NO2↑ + O2↑
2Ag + 2NO2↑ + O2↑
Реакцией замещения называется реакция между простым и сложным веществом, при которой атомы простого вещества замещают атомы в сложном веществе по принципу: в новом веществе атомы с наибольшей электроотрицательностью соединяются с атомами с наименьшей электроотрицательностью. Атомы элемента с промежуточной между ними электроотрицательностью высвобождаются в виде простого вещества. В результате образуются новое сложное и новое простое вещества.
Fe + CuSO4 ![]() FeSO4 + Cu↓
FeSO4 + Cu↓
Zn + 2HCl ![]() ZnCl2 + H2↑
ZnCl2 + H2↑
2KBr + Cl2 ![]() 2KCl + Br2
2KCl + Br2
Реакцией обмена называется реакция между двумя сложными веществами при которой они обмениваются своими составными частями. Причем та часть, что стояла первой, в новом веществе будет стоять первой, а та часть, что стояла второй и в новом веществе тоже будет стоять на втором месте.
AgNO3 + NaCl ![]() AgCl↓ + NaNO3
AgCl↓ + NaNO3
NaOH + HCl ![]() NaCl + H2O
NaCl + H2O
FeCl3 + 3NaOH ![]() Fe(OH)3↓ + 3NaCl
Fe(OH)3↓ + 3NaCl
![]()
Глоссарий
- Аллотропией называется образование разных простых веществ одним элементом. Аллотропия возникает или из–за разного количества атомов в составе вещества (O2 –кислород, O3 – озон), или из–за разного соединения атомов в кристаллическую решетку (алмаз, графит).
- Гомогенными называются реакции, в которых все реагирующие вещества, продукты реакции и катализатор тоже в каталитических реакциях, находятся в одном агрегатном состоянии. Если хотя бы одно из веществ имеет другое агрегатное состояние, то такая реакция называется гетерогенной. (Гомо – одинаковый, гетеро – разный).
- Изомеры – это вещества одинакового качественного и количественного состава, но имеющие разное строение молекул и различные свойства.
- Катализаторами называют вещества, которые влияют на скорость реакции, чаще всего, ускоряя скорость реакции. Катализаторы принимают непосредственное участие в химической реакции, но по окончании реакции высвобождаются.
- Катализаторы, замедляющие скорость химических реакций называются ингибиторами.
- Каталитическими реакциями называются такие реакции, которые идут только в присутствии катализатора. Использование различных катализаторов приводит к получению различных продуктов реакции.
- Количество теплоты, которое выделяется или поглощается при химический реакции, называется тепловым эффектом реакции.
- Окислительно–восстановительными реакциями являются такие реакции, в которых у атомов, входящих в состав молекул, изменяются степени окисления по окончании реакции. Окислительно–восстановительными чаще бывают реакции соединения и замещения.
- Реакцией замещения называется реакция между простым и сложным веществом, при которой атомы простого вещества замещают атомы в сложном веществе по принципу: в новом веществе атомы с наибольшей электроотрицательностью соединяются с атомами с наименьшей электроотрицательностью. Атомы элемента с промежуточной между ними электроотрицательностью высвобождаются в виде простого вещества. В результате образуются новое сложное и новое простое вещества.
- Реакцией обмена называется реакция между двумя сложными веществами при которой они обмениваются своими составными частями. Причем та часть, что стояла первой, в новом веществе будет стоять первой, а та часть, что стояла второй и в новом веществе тоже будет стоять на втором месте.
- Реакцией разложения называется реакция, в результате которой из одного вещества образуется два или нескольких новых веществ.
- Реакцией соединения называется реакция, в результате которой из двух или нескольких веществ образуется одно новое вещество.
- Реакции, приводящие к установлению химического равновесия, называются обратимые. У обратимых реакций две скорости – скорость прямой реакции, приводящая к образованию продукта реакции. И скорость обратной реакции – распад продукта реакции до исходных веществ. Когда скорости прямой и обратной реакций становятся равными, наступает химическое динамическое равновесие. Это означает, что в единицу времени образуется столько молекул, сколько их распадается за это же время.
- У необратимых реакций только одна скорость и они протекают только в одну сторону, если продуктом реакции является осадок, газообразное вещество или вода.
- Химические реакции, которые идут без участия катализаторов называются некаталитическими.
- Экзотермическими реакциями называются реакции, идущие с выделением теплоты. Многие реакции соединения являются экзотермическими реакциями.
- Эндотермическими реакциями называются такие реакции, которые идут с поглощением теплоты Эндотермическими реакциями являются многие реакции разложения.
Пайдалуу шилтемелер
Видеоурок «Качественные реакции в химии». Сайт «Видеоуроки в интернет» (Электронный ресурс). //URL:.https://www.youtube.com/watch?v=pk7UXWVBC9U&t=193s (дата обращения 07.03.18.)
Библиография
- Волков В. А., Вонский Е. В., Кузнецова Г. И. Выдающиеся химики мира. — М.: Высшая школа, 1991. — 656 с. — 100 000 экз. — ISBN 5-06-001568-8. (в пер.)
- Кособаева Б. – Использование компьютера в учебном процессе химии / Текст / Б. Кособаева, Н.Б. Арстанбекова // Абай атындагы Казак Улуттукпедагогикалык университеттинин Хабарши (Вестник) Жаратылыш таануу-география илимдери сериясынын 2012 №2 (32). – 68–71–бб.
- Стартовый эксперимент как форма включенности каждого ученика в учебный процесс / Текст / Б. Кособаева, Син Е.Е. // Химия в школе. – Москва, 2016. – №6.
- Дидактические особенности использования технологии обучения на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №6(48), С.155–160.
- Применение технологии системного усвоения знаний в обучении химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №7(49), С.152–159.
- Реализация межпредметных связей на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №10(52), С.136–139.
- Методологические аспекты обучения в современных условиях. / Текст / Б. Кособаева, Син Е.Е., Жакышова Б.Ш. // Проблемы современной науки и образования. – Иваново, 2016. – №13(55), С.104–108.
- Формирование системы понятий при обучении химии в школе. / Текст / Б. Кособаева, П.Э. Токомбаева // Вестник Кыргызского национального университета имени Ж. Баласагына. – Бишкек, 2017. – Специальный выпуск. С.77–81.
Был одним из инициаторов основания в 1868 г. Русского химического общества (наряду с А. А. Воскресенским, Н. Н. Зининым и Д. И. Менделеевым), был его делопроизводителем (1868—1891) и первым редактором «Журнала РХО» (1869—1900). В марте 1869 г. на заседании Русского химического общества Меншуткин доложил от имени Менделеева его Периодический закон — периодическую систему элементов.
Основное направление работ Меншуткина — исследование скорости химических превращений органических соединений.
Меншуткин обнаружил влияние разбавления на скорость реакции. Эти работы Меншуткина легли в основу классической химической кинетики. В 1886—1889 гг. Меншуткин установил влияние природы растворителя и температуры на процессы образования и разложения аминов и амидов кислот. В 1890 г. установил каталитическое действие растворителей в реакциях этерификации и солеобразования.
Какая масса углекислого газа образуется при сжигании 6 г углерода?
22 г
Какой объем кислорода выделится при разложении 5 г 10% перекиси водорода?
0,175 л
Какова масса осадка, образованного при слиянии раствора содержащего 3.4 грамма нитрата серебра и раствора содержащего 0,585 грамма хлорида натрия?
1, 435 г.
Сколько тепла выделится при горении одного заряда салюта массой 0,6 граммов, если термохимическое уравнение
2Mg + O2 ![]() 2MgO + 1203 кДж?
2MgO + 1203 кДж?
15,05 кДж
Определить практический выход продукта реакции, если из 50 литров аммиака при его каталитическом окислении образовалось 30 литров оксида азота (II).
60 %