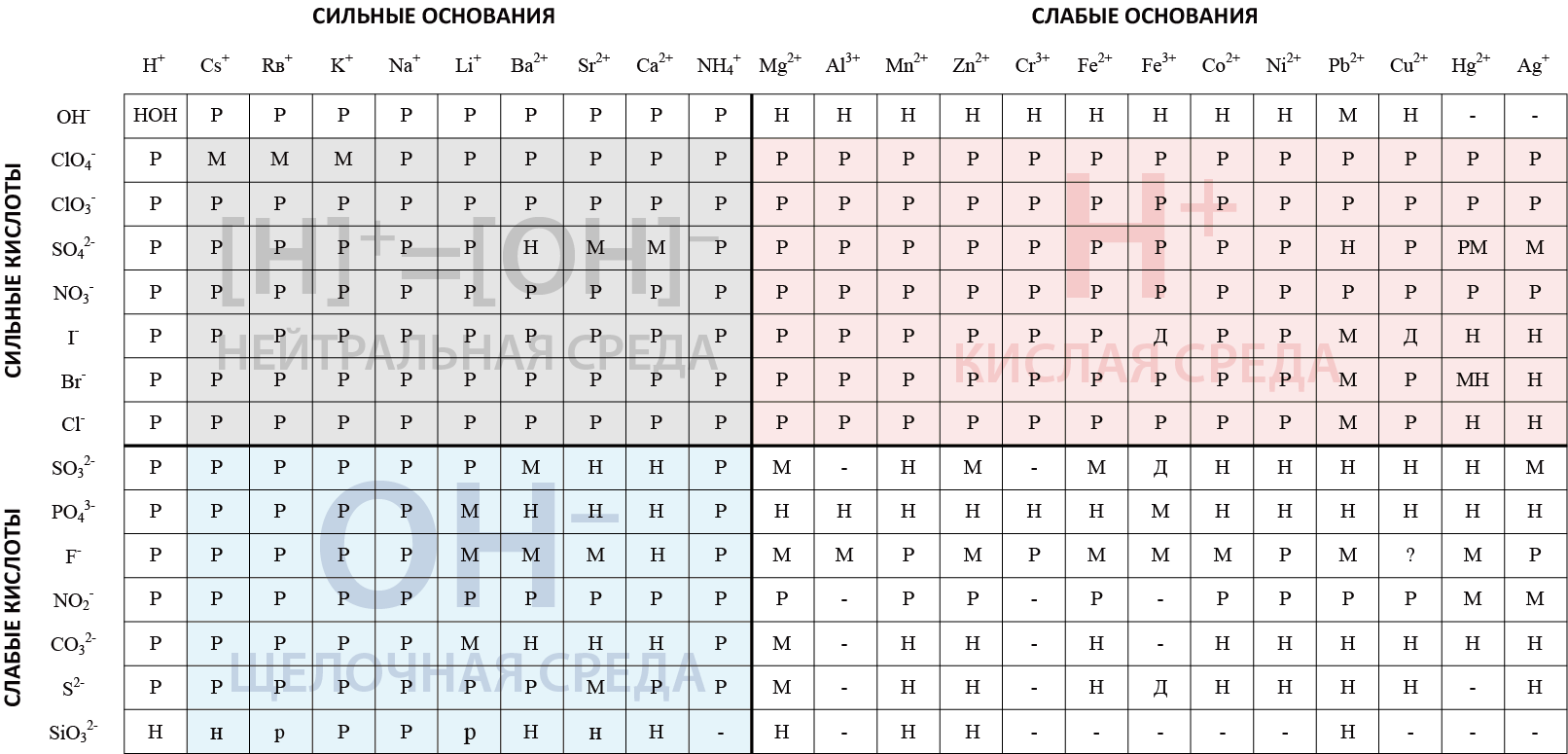
|
|
| Строка 91: |
Строка 91: |
| | <span class="notex">Ag(OH)</span> | | <span class="notex">Ag(OH)</span> |
| | <p>Не существует.</p> | | <p>Не существует.</p> |
| − | <div class='labelchem'>
| + | |
| − | <span>HClO<sub>4</sub></span>
| |
| − | <p>Хлорная кислота. Cильный окислитель, так как содержит хлор в высшей степени окисления +7.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>CsClO<sub>4</sub></span>
| |
| − | <p>Перхлорат цезия. Слабо растворим в воде примерно 2 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>Диссоциирует, образуя нейтральную среду.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>KClO<sub>4</sub></span>
| |
| − | <p>Перхлорат калия. Слабо растворим в воде примерно 2,1 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>Диссоциирует, образуя нейтральную среду.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>NaClO<sub>4</sub></span>
| |
| − | <p>Перхлорат натрия. Хорошо растворяется в воде примерно 211 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>Диссоциирует, образуя нейтральную среду.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>LiClO<sub>4</sub></span>
| |
| − | <p>Перхлорат лития. Растворим в воде примерно 58 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>Диссоциирует, образуя нейтральную среду.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Ba(ClO<sub>4</sub>)<sub>2</sub></span>
| |
| − | <p>Перхлорат бария. Хорошо растворяется в воде примерно 340 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>Диссоциирует, образуя нейтральную среду.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Sr(ClO<sub>4</sub>)<sub>2</sub></span>
| |
| − | <p>Перхлорат стронция. Нет данных.</p>
| |
| − | <p>Диссоциирует, образуя нейтральную среду.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Ca(ClO<sub>4</sub>)<sub>2</sub></span>
| |
| − | <p>Перхлорат кальция. Хорошо растворяется в воде примерно 188 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>Диссоциирует, образуя нейтральную среду.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>NH<sub>4</sub>ClO<sub>4</sub></span>
| |
| − | <p>Перхлорат аммония. Хорошо растворяется в воде примерно 24,5 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>Диссоциирует, образуя нейтральную среду.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Mg(ClO<sub>4</sub>)<sub>2</sub></span>
| |
| − | <p>Перхлорат магния. Хорошо растворяется в воде примерно 52 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>В результате гидролиза, образуется кислая среда.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Al(ClO<sub>4</sub>)<sub>3</sub></span>
| |
| − | <p>Перхлорат алюминия. Хорошо растворяется в воде примерно 135 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>В результате гидролиза, образуется кислая среда.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Mn(ClO<sub>4</sub>)<sub>2</sub></span>
| |
| − | <p>Перхлорат марганца. Хорошо растворяется в воде примерно 52 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>В результате гидролиза, образуется кислая среда.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Zn(ClO<sub>4</sub>)<sub>2</sub></span>
| |
| − | <p>Перхлорат цинка. Хорошо растворяется в воде примерно 112 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>В результате гидролиза, образуется кислая среда.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Cr(ClO<sub>4</sub>)<sub>3</sub></span>
| |
| − | <p>Перхлорат хрома. Хорошо растворяется в воде примерно 133 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>В результате гидролиза, образуется кислая среда.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Fe(ClO<sub>4</sub>)<sub>2</sub></span>
| |
| − | <p>Перхлорат железа (II). Хорошо растворяется в воде примерно 300 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>В результате гидролиза, образуется кислая среда.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Fe(ClO<sub>4</sub>)<sub>3</sub></span>
| |
| − | <p>Перхлорат железа (III). Хорошо растворяется в воде примерно 395 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>В результате гидролиза, образуется кислая среда.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Co(ClO<sub>4</sub>)<sub>2</sub></span>
| |
| − | <p>Перхлорат кобальта. Хорошо растворяется в воде примерно 110 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>В результате гидролиза, образуется кислая среда.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Ni(ClO<sub>4</sub>)<sub>2</sub></span>
| |
| − | <p>Перхлорат никеля. Хорошо растворяется в воде примерно 111 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>В результате гидролиза, образуется кислая среда.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Pb(ClO<sub>4</sub>)<sub>2</sub></span>
| |
| − | <p>Перхлорат свинца. Хорошо растворяется в воде примерно 80 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>В результате гидролиза, образуется кислая среда.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Cu(ClO<sub>4</sub>)<sub>2</sub></span>
| |
| − | <p>Перхлорат меди. Хорошо растворяется в воде примерно 150 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>В результате гидролиза, образуется кислая среда.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>Hg(ClO<sub>4</sub>)<sub>2</sub></span>
| |
| − | <p>Перхлорат ртути (II). Хорошо растворяется в воде примерно 290 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>В результате гидролиза, образуется кислая среда.</p>
| |
| − | </div>
| |
| − | <div class='labelchem'>
| |
| − | <span>AgClO<sub>4</sub></span>
| |
| − | <p>Перхлорат серебра. Хорошо растворяется в воде примерно 557 гр на 100 мл при температуре 25<sup>o</sup>C.</p>
| |
| − | <p>В результате гидролиза, образуется кислая среда.</p>
| |
| − | </div>
| |
| | | | |
| | </div> | | </div> |
HOH
Гидроксид водорода, соединение гидроксильной группы OH– и катиона H+
CsOH
Гидроксид цезия – сильнейшее основание.
RbOH
Гидроксид рубидия, является одним из наиболее сильных оснований.
KOH
Гидроксид калия. Сильное основание.
NaOH
Гидроксид натрия. Сильное основание.
LiOH
Гидроксид лития. Сильное основание.
Ba(OH)2
Гидроксид бария. Сильное основание.
Sr(OH)2
Гидроксид стронция. Сильное основание.
Ca(OH)2
Гидроксид кальция. Сильное основание.
NH4OH
Гидроксид аммония. Сильное основание.
Mg(OH)2
Гидроксид магния. Слабое основание. Не растворяется в воде.
Al(OH)3
Гидроксид магния. Слабое основание. Не растворяется в воде.
Mn(OH)2
Гидроксид марганца. Слабое основание. Не растворяется в воде.
Zn(OH)2
Гидроксид цинка. Слабое основание. Не растворяется в воде.
Cr(OH)3
Гидроксид хрома. Слабое основание. Не растворяется в воде.
Fe(OH)2
Гидроксид железа (II). Слабое основание. Не растворяется в воде.
Fe(OH)3
Гидроксид железа (III). Слабое основание. Не растворяется в воде.
Co(OH)2
Гидроксид кобальта. Слабое основание. Не растворяется в воде.
Ni(OH)2
Гидроксид никеля. Слабое основание. Не растворяется в воде.
Pb(OH)2
Гидроксид свинца. Слабое основание. Малорастворим в воде.
Cu(OH)2
Гидроксид меди. Слабое основание. Не растворяется в воде.
Hg(OH)2
Не существует в водном растворе.