Химия: Химическая реакция — различия между версиями
Admine2 (обсуждение | вклад) |
Admine2 (обсуждение | вклад) |
||
| (не показаны 62 промежуточные версии этого же участника) | |||
| Строка 1: | Строка 1: | ||
{{Якорь|Начало}} | {{Якорь|Начало}} | ||
<div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | ||
| − | + | ||
Превращение одних веществ в другие называется '''химической реакцией.''' Исходные вещества, которые вступают в химическую реакцию называются реагентами, а новые вещества, которые образуются в результате химической реакции называются продуктами реакции. | Превращение одних веществ в другие называется '''химической реакцией.''' Исходные вещества, которые вступают в химическую реакцию называются реагентами, а новые вещества, которые образуются в результате химической реакции называются продуктами реакции. | ||
| − | <div class="textblock">'''Химическая реакция''' | + | <div class="textblock">'''Химическая реакция''' – это химическое явление, которое можно записать с помощью '''химического уравнения.''' </div><br> |
| − | + | ||
<ul class="small-block-grid-1 large-block-grid-2"> | <ul class="small-block-grid-1 large-block-grid-2"> | ||
| + | <li>'''Химическое уравнение''' – это выражение химической реакции с помощью химических формул веществ, изображенных условными знаками. В химическом уравнении, изображенном с помощью химических формул, различают левую и правую части уравнения. В левой части указывают реагенты, в правой части - продукты реакции. В формулах веществ '''индексами''' показывают количество атомов химического элемента, входящего в состав данного вещества. Это существенно влияет на свойства веществ.</li> | ||
<li> | <li> | ||
| + | '''Сравните:''' | ||
| + | <br> | ||
{| class="resettext mw-datatable" | {| class="resettext mw-datatable" | ||
|- | |- | ||
| Строка 29: | Строка 32: | ||
|} | |} | ||
</li> | </li> | ||
| − | |||
</ul> | </ul> | ||
| + | {{center|[[file:Him uravnenie.png|550px|Индексы и коэффициенты в химических уравнениях]]}}<br> | ||
В химических уравнениях перед формулами записывают '''коэффициенты''', которые показывают количество молекул, принимающих участие в химической реакции. | В химических уравнениях перед формулами записывают '''коэффициенты''', которые показывают количество молекул, принимающих участие в химической реакции. | ||
| Строка 36: | Строка 39: | ||
Обычно в химическом уравнении равенство ставят тогда, когда указывают количество выделенной или поглощенной энергии. '''(Это тепловой эффект реакции)''' 2Mg + O<sub>2</sub> = 2MgO + 1203 кДж. При написании химических уравнений используют стрелку, показывающую направление реакции: SO<sub>2</sub> + H<sub>2</sub>O {{arrowleft}} H<sub>2</sub>SO<sub>3</sub> | Обычно в химическом уравнении равенство ставят тогда, когда указывают количество выделенной или поглощенной энергии. '''(Это тепловой эффект реакции)''' 2Mg + O<sub>2</sub> = 2MgO + 1203 кДж. При написании химических уравнений используют стрелку, показывающую направление реакции: SO<sub>2</sub> + H<sub>2</sub>O {{arrowleft}} H<sub>2</sub>SO<sub>3</sub> | ||
| − | === Признаки | + | === Признаки химических реакций === |
<ul class="small-block-grid-1 large-block-grid-3"> | <ul class="small-block-grid-1 large-block-grid-3"> | ||
| − | <li>{{center| | + | <li>{{center|'''Выделение тепла'''}}</li> |
| − | <li>{{center| | + | <li>{{center|'''Выделение света'''}}</li> |
| − | <li>{{center| | + | <li>{{center|'''Образование осадка'''}}</li> |
| − | <li>{{center| | + | <li>{{center|'''Выделение газа'''}}</li> |
| − | <li>{{center| | + | <li>{{center|'''Изменение цвета'''}}</li> |
| − | <li>{{center| | + | <li>{{center|'''Изменение запаха'''}}</li> |
</ul> | </ul> | ||
| − | + | ||
| − | + | {{center|[[file:Ролик-6 сайт.mp4|740px|start=5]]}} | |
| − | '''Изменения, происходящие с веществами, свидетельствуют о протекании химических реакций и являются признаками химических реакций.''' | + | |
| + | |||
| + | {{right|[[Файл:Priznaki reakcii.jpg|350px|class=show-for-large-up|Признаки химических реакций]]}} | ||
| + | {{center|[[Файл:Priznaki reakcii.jpg|350px|class=hide-for-large-up|Признаки химических реакций]]}} | ||
| + | <big>'''Изменения, происходящие с веществами, свидетельствуют о протекании химических реакций и являются признаками химических реакций.'''</big> | ||
Большинство веществ не могут взаимодействовать друг с другом самопроизвольно. Для протекания многих химических реакций необходимо создавать определенные условия. | Большинство веществ не могут взаимодействовать друг с другом самопроизвольно. Для протекания многих химических реакций необходимо создавать определенные условия. | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
== Условия, необходимые для начала химической реакции == | == Условия, необходимые для начала химической реакции == | ||
| − | + | {{left-p|[[Файл:42 flame.gif|class=show-for-large-up|250px|Горение – бурное окисление с выделением тепла и света]]}} | |
| − | + | {{left|[[Файл:42 flame.gif|class=show-for-medium-only|250px|Горение – бурное окисление с выделением тепла и света]]}} | |
| − | + | {{center|[[Файл:42 flame.gif|250px|class=show-for-small-only|Горение – бурное окисление с выделением тепла и света]]}} | |
:<big>'''1.''' Измельчить '''2.''' Перемешать '''3.''' Нагреть</big> | :<big>'''1.''' Измельчить '''2.''' Перемешать '''3.''' Нагреть</big> | ||
| Строка 62: | Строка 70: | ||
В некоторых случаях для начала химического процесса необходимо освещение. Одной из таких реакций, требующих постоянного освещения, является известная вам реакция фотосинтеза. | В некоторых случаях для начала химического процесса необходимо освещение. Одной из таких реакций, требующих постоянного освещения, является известная вам реакция фотосинтеза. | ||
| + | |||
| + | === Скорость химической реакции === | ||
| + | {{center|[[file:Skorost him reakcii.png|750px|Зависимость скорости химической реакции от различных факторов]]}} | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
== Классификация химических реакций == | == Классификация химических реакций == | ||
| − | + | {{center|[[file:Ролик-7 сайт.mp4|740px|start=5]]}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | {{KlassChemRe}} | |
| − | + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | |
| − | |||
| − | |||
| − | '''Реакцией замещения''' называется реакция между простым и сложным веществом, при которой атомы простого вещества замещают атомы в сложном веществе по принципу: в новом веществе атомы с наибольшей электроотрицательностью соединяются с атомами с наименьшей электроотрицательностью. Атомы элемента с промежуточной между ними электроотрицательностью высвобождаются в виде простого вещества. В результате образуются новое сложное и новое простое вещества. | + | == Глоссарий == |
| − | + | :{{bib|'''Аллотропией''' называется образование разных простых веществ одним элементом. Аллотропия возникает или из–за разного количества атомов в составе вещества ''(O<sub>2</sub> –кислород, O<sub>3</sub> – озон)'', или из–за разного соединения атомов в кристаллическую решетку ''(алмаз, графит)''.}} | |
| − | + | :{{bib|'''Гомогенными''' называются реакции, в которых все реагирующие вещества, продукты реакции и катализатор тоже в каталитических реакциях, находятся в одном агрегатном состоянии. Если хотя бы одно из веществ имеет другое агрегатное состояние, то такая реакция называется '''гетерогенной'''. ''('''Гомо''' – одинаковый, '''гетеро''' – разный).''}} | |
| − | + | :{{bib|'''Изомеры''' – это вещества одинакового качественного и количественного состава, но имеющие разное строение молекул и различные свойства.}} | |
| − | + | :{{bib|'''Катализаторами''' называют вещества, которые влияют на скорость реакции, чаще всего, ускоряя скорость реакции. Катализаторы принимают непосредственное участие в химической реакции, но по окончании реакции высвобождаются.}} | |
| − | + | :{{bib|Катализаторы, замедляющие скорость химических реакций называются '''ингибиторами'''.}} | |
| − | + | :{{bib|'''Каталитическими реакциями''' называются такие реакции, которые идут только в присутствии катализатора. Использование различных катализаторов приводит к получению различных продуктов реакции.}} | |
| + | :{{bib|'''Количество теплоты''', которое выделяется или поглощается при химический реакции, называется '''тепловым эффектом реакции'''.}} | ||
| + | :{{bib|'''Окислительно–восстановительными''' реакциями являются такие реакции, в которых у атомов, входящих в состав молекул, изменяются степени окисления по окончании реакции. Окислительно–восстановительными чаще бывают реакции соединения и замещения.}} | ||
| + | :{{bib|'''Реакцией замещения''' называется реакция между простым и сложным веществом, при которой атомы простого вещества замещают атомы в сложном веществе по принципу: в новом веществе атомы с наибольшей электроотрицательностью соединяются с атомами с наименьшей электроотрицательностью. Атомы элемента с промежуточной между ними электроотрицательностью высвобождаются в виде простого вещества. В результате образуются новое сложное и новое простое вещества.}} | ||
| + | :{{bib|'''Реакцией обмена''' называется реакция между двумя сложными веществами при которой они обмениваются своими составными частями. Причем та часть, что стояла первой, в новом веществе будет стоять первой, а та часть, что стояла второй и в новом веществе тоже будет стоять на втором месте.}} | ||
| + | :{{bib|'''Реакцией разложения''' называется реакция, в результате которой из одного вещества образуется два или нескольких новых веществ.}} | ||
| + | :{{bib|'''Реакцией соединения''' называется реакция, в результате которой из двух или нескольких веществ образуется одно новое вещество.}} | ||
| + | :{{bib|Реакции, приводящие к установлению химического равновесия, называются '''обратимые'''. У обратимых реакций две скорости – скорость прямой реакции, приводящая к образованию продукта реакции. И скорость обратной реакции – распад продукта реакции до исходных веществ. Когда скорости прямой и обратной реакций становятся равными, наступает '''химическое динамическое равновесие'''. Это означает, что в единицу времени образуется столько молекул, сколько их распадается за это же время.}} | ||
| + | :{{bib|У '''необратимых''' реакций только одна скорость и они протекают только в одну сторону, если продуктом реакции является осадок, газообразное вещество или вода.}} | ||
| + | :{{bib|Химические реакции, которые идут без участия катализаторов называются '''некаталитическими'''.}} | ||
| + | :{{bib|'''Экзотермическими реакциями''' называются реакции, идущие с выделением теплоты. Многие реакции соединения являются экзотермическими реакциями.}} | ||
| + | :{{bib|'''Эндотермическими реакциями''' называются такие реакции, которые идут с поглощением теплоты Эндотермическими реакциями являются многие реакции разложения.}} | ||
| − | + | == Полезные ссылки == | |
| − | + | <small>Видеоурок «Качественные реакции в химии». Сайт «Видеоуроки в интернет» (Электронный ресурс). [https://www.youtube.com/watch?v=pk7UXWVBC9U&t=193s //URL:.https://www.youtube.com/watch?v=pk7UXWVBC9U&t=193s] (дата обращения 07.03.18.)</small> | |
| − | + | <br> | |
| − | |||
| − | |||
| − | |||
| − | + | == Библиография == | |
| + | * {{bib|Волков В. А., Вонский Е. В., Кузнецова Г. И. Выдающиеся химики мира. — М.: Высшая школа, 1991. — 656 с. — 100 000 экз. — ISBN 5-06-001568-8. (в пер.)}} | ||
| + | * {{bib|Кособаева Б. – Использование компьютера в учебном процессе химии / Текст / Б. Кособаева, Н.Б. Арстанбекова // Абай атындагы Казак Улуттукпедагогикалык университеттинин Хабарши (Вестник) Жаратылыш таануу-география илимдери сериясынын 2012 №2 (32). – 68–71–бб.}} | ||
| + | * {{bib|Стартовый эксперимент как форма включенности каждого ученика в учебный процесс / Текст / Б. Кособаева, Син Е.Е. // Химия в школе. – Москва, 2016. – №6.}} | ||
| + | * {{bib|Дидактические особенности использования технологии обучения на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №6(48), С.155–160.}} | ||
| + | * {{bib|Применение технологии системного усвоения знаний в обучении химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №7(49), С.152–159.}} | ||
| + | * {{bib|Реализация межпредметных связей на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №10(52), С.136–139.}} | ||
| + | * {{bib|Методологические аспекты обучения в современных условиях. / Текст / Б. Кособаева, Син Е.Е., Жакышова Б.Ш. // Проблемы современной науки и образования. – Иваново, 2016. – №13(55), С.104–108.}} | ||
| + | * {{bib|Формирование системы понятий при обучении химии в школе. / Текст / Б. Кособаева, П.Э. Токомбаева // Вестник Кыргызского национального университета имени Ж. Баласагына. – Бишкек, 2017. – Специальный выпуск. С.77–81.}} | ||
| − | + | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | |
| + | </div> | ||
| − | + | <!-- Sidebar --> | |
| + | <div class="large-4 medium-5 columns"> | ||
| + | <!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | ||
| + | <div class="sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Химия в лицах</div> | ||
| + | </div> | ||
| + | {{center-p|[[file:Menshutkin.jpg|400px|Николай Александрович Меншуткин]]}} | ||
| − | |||
| − | + | <span class="firstcharacter">Б</span>ыл одним из инициаторов основания в 1868 г. Русского химического общества (наряду с А. А. Воскресенским, Н. Н. Зининым и Д. И. Менделеевым), был его делопроизводителем (1868—1891) и первым редактором «Журнала РХО» (1869—1900). В марте 1869 г. на заседании Русского химического общества Меншуткин доложил от имени Менделеева его Периодический закон — периодическую систему элементов. | |
| − | + | Основное направление работ Меншуткина — исследование скорости химических превращений органических соединений. | |
| − | + | Меншуткин обнаружил влияние разбавления на скорость реакции. Эти работы Меншуткина легли в основу классической химической кинетики. В 1886—1889 гг. Меншуткин установил влияние природы растворителя и температуры на процессы образования и разложения аминов и амидов кислот. В 1890 г. установил каталитическое действие растворителей в реакциях этерификации и солеобразования. | |
| + | </div> | ||
| − | + | <div class="sbstyle" style="margin-top:20px"> | |
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Задачи</div> | ||
| + | </div> | ||
| + | Какая масса углекислого газа образуется при сжигании 6 г углерода? | ||
| + | <div class="mw-customtoggle-z1 resettext button17">Правильный ответ</div> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-z1"> | ||
| + | 22 г | ||
| + | ---- | ||
| + | </div> | ||
| − | |||
| − | + | Какой объем кислорода выделится при разложении 5 г 10% перекиси водорода? | |
| + | <div class="mw-customtoggle-z2 resettext button17">Правильный ответ</div> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-z2"> | ||
| + | 0,175 л | ||
| + | ---- | ||
| + | </div> | ||
| − | |||
| − | + | Какова масса осадка, образованного при слиянии раствора содержащего 3.4 грамма нитрата серебра и раствора содержащего 0,585 грамма хлорида натрия? | |
| + | <div class="mw-customtoggle-z3 resettext button17">Правильный ответ</div> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-z3"> | ||
| + | 1, 435 г. | ||
| + | ---- | ||
| + | </div> | ||
| − | |||
| − | + | Сколько тепла выделится при горении одного заряда салюта массой 0,6 граммов, если термохимическое уравнение<br>2Mg + O<sub>2</sub> {{Arrowleft}} 2MgO + 1203 кДж? | |
| + | <div class="mw-customtoggle-z4 resettext button17">Правильный ответ</div> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-z4"> | ||
| + | 15,05 кДж | ||
| + | ---- | ||
| + | </div> | ||
| − | |||
| − | + | Определить практический выход продукта реакции, если из 50 литров аммиака при его каталитическом окислении образовалось 30 литров оксида азота (II). | |
| − | + | <div class="mw-customtoggle-z5 resettext button17">Правильный ответ</div> | |
| − | + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-z5"> | |
| − | + | 60 % | |
| − | + | ---- | |
| − | + | </div> | |
| − | |||
| − | < | ||
| − | |||
| − | = | ||
| − | |||
| − | |||
| − | |||
| − | <div class=" | ||
</div> | </div> | ||
| − | + | <div class="sbstyle" style="margin-top:20px"> | |
| − | <div class=" | ||
| − | |||
| − | |||
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric | + | <div class="large-10 small-10 large-centered small-centered columns rubric">Реакция нейтрализации</div> |
</div> | </div> | ||
| − | + | {{center|[[file:Ролик-10 сайт.mp4|start=5]]}} | |
</div> | </div> | ||
| − | + | <div class="sbstyle"> | |
| − | <div class=" | ||
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric" style=" | + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Пройди тестирование</div> |
</div> | </div> | ||
| − | + | ||
</div> | </div> | ||
| − | |||
| − | |||
| − | |||
</div> | </div> | ||
| − | + | {{lang|:KR:Химия: Химиялык реакция}} | |
| − | |||
[[Category:Средняя школа]] | [[Category:Средняя школа]] | ||
[[Category:Химия]] | [[Category:Химия]] | ||
Текущая версия на 09:43, 22 октября 2018
Превращение одних веществ в другие называется химической реакцией. Исходные вещества, которые вступают в химическую реакцию называются реагентами, а новые вещества, которые образуются в результате химической реакции называются продуктами реакции.
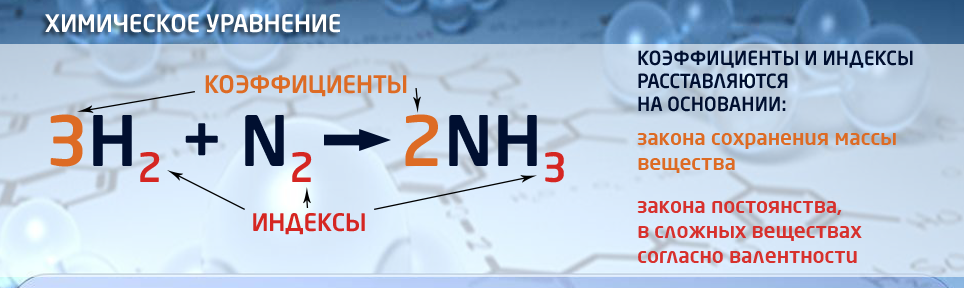
- Химическое уравнение – это выражение химической реакции с помощью химических формул веществ, изображенных условными знаками. В химическом уравнении, изображенном с помощью химических формул, различают левую и правую части уравнения. В левой части указывают реагенты, в правой части - продукты реакции. В формулах веществ индексами показывают количество атомов химического элемента, входящего в состав данного вещества. Это существенно влияет на свойства веществ.
-
Сравните:
H2SO4 H2SO3 Серная кислота Сернистая кислота Сильная Слабая Устойчивая Нестойкая Наносит сильные ожоги На свету разлагается Маслянистая жидкость Водный раствор газа
В химических уравнениях перед формулами записывают коэффициенты, которые показывают количество молекул, принимающих участие в химической реакции.
Обычно в химическом уравнении равенство ставят тогда, когда указывают количество выделенной или поглощенной энергии. (Это тепловой эффект реакции) 2Mg + O2 = 2MgO + 1203 кДж. При написании химических уравнений используют стрелку, показывающую направление реакции: SO2 + H2O ![]() H2SO3
H2SO3
Содержание
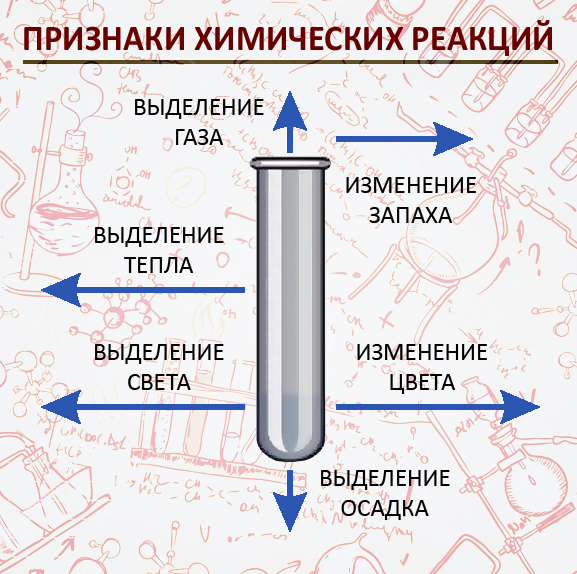
Признаки химических реакций
- Выделение тепла
- Выделение света
- Образование осадка
- Выделение газа
- Изменение цвета
- Изменение запаха
Изменения, происходящие с веществами, свидетельствуют о протекании химических реакций и являются признаками химических реакций.
Большинство веществ не могут взаимодействовать друг с другом самопроизвольно. Для протекания многих химических реакций необходимо создавать определенные условия.
Условия, необходимые для начала химической реакции
- 1. Измельчить 2. Перемешать 3. Нагреть
Для обеспечения лучшего контакта вещества измельчают, переводят в газообразное состояние. Многие вещества лучше реагируют друг с другом, если они растворены в воде.
Во многих случаях этого недостаточно, поэтому реагирующие вещества нагревают. Деревянная лучинка, смесь железа и серы, медь могут долгое время сохраняться при комнатной температуре, реакции начинаются только при их нагревании.
В некоторых случаях для начала химического процесса необходимо освещение. Одной из таких реакций, требующих постоянного освещения, является известная вам реакция фотосинтеза.
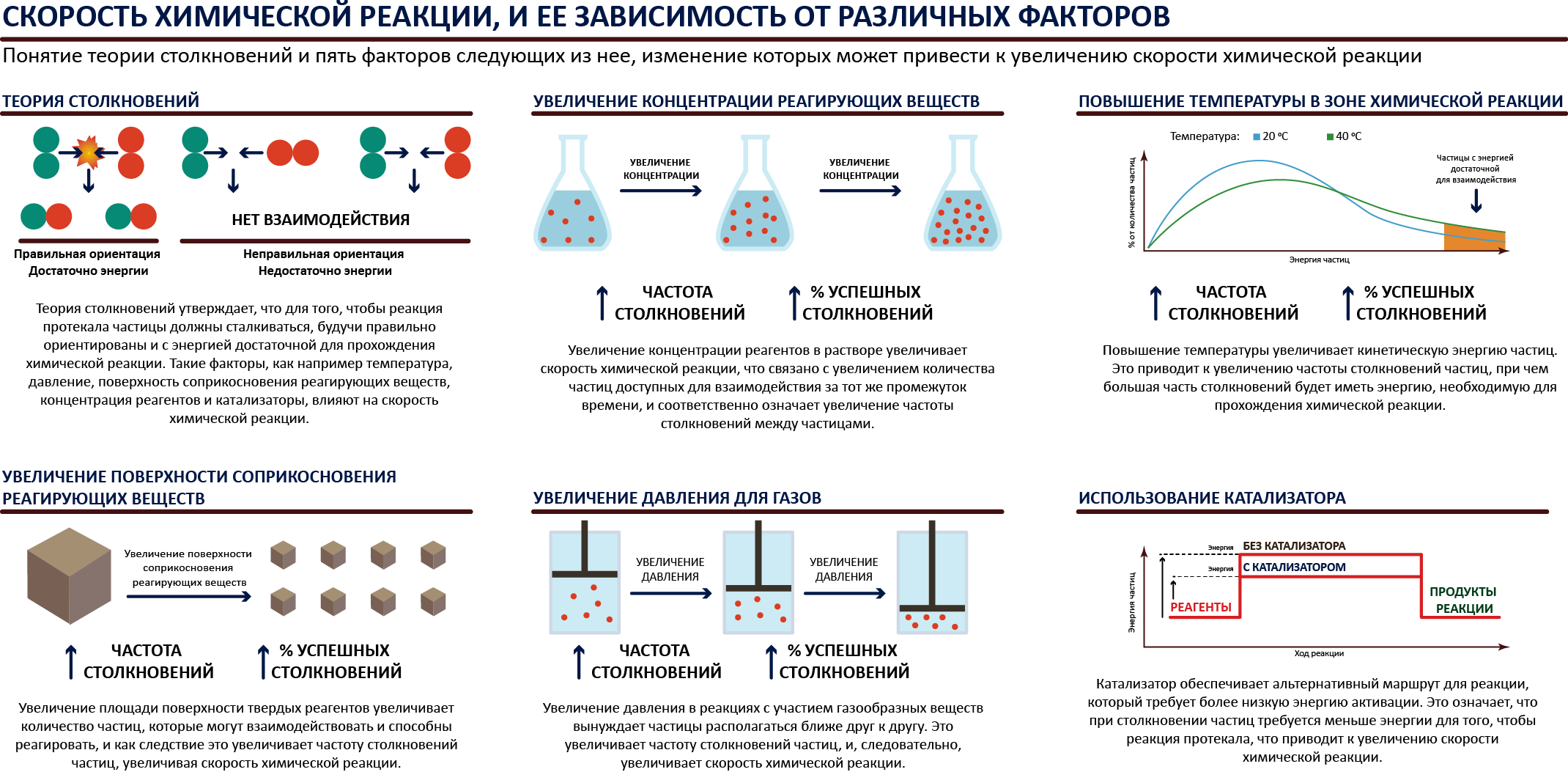
Скорость химической реакции
Классификация химических реакций
left:20%; top:58%; left:25%; top:88%; left:34%; top:108%; left:48%; top:123%; left:62%; top:108%; left:72%; top:88%; left:76%; top:58%;






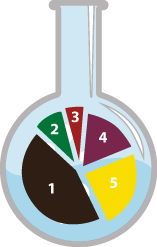
Реакции, протекающие без изменения качественного и количественного состава простых и сложных веществ
Аллотропные превращения и изомеризация
Например: Превращение кислорода в озон или образование изомеров
Образование разных простых веществ одним элементом называется аллотропией. Аллотропия возникает или из–за разного количества атомов в составе вещества (O2 –кислород, O3 – озон), или из–за разного соединения атомов в кристаллическую решетку (алмаз, графит).
3O2 ![]() 2O3
2O3
Изомеры – это вещества одинакового качественного и количественного состава, но имеющие разное строение молекул и различные свойства.
Обратимость реакции
Обратимые и необратимые реакции
Например: реакции водорода с иодом и разложение дихромата аммония
Реакции, приводящие к установлению химического равновесия, называются обратимые. У обратимых реакций две скорости – скорость прямой реакции, приводящая к образованию продукта реакции. И скорость обратной реакции – распад продукта реакции до исходных веществ. Когда скорости прямой и обратной реакций становятся равными, наступает химическое динамическое равновесие. Это означает, что в единицу времени образуется столько молекул, сколько их распадается за это же время.
H2 + I2 ![]() 2HI
2HI
У необратимых реакций только одна скорость и они протекают только в одну сторону, если продуктом реакции является осадок, газообразное вещество или вода.
(NH4)2Cr2O7 ![]() 2NH3↑ + H2O + 2CrO3
2NH3↑ + H2O + 2CrO3
Энергетический эффект
Экзотермические и эндотермические реакции
Например: реакции: горение магния и разложение оксида ртути
Экзотермическими реакциями называются реакции, идущие с выделением теплоты. Многие реакции соединения являются экзотермическими реакциями.
2Мg +O2 ![]() 2МgO + Q
2МgO + Q
Эндотермическими реакциями называются такие реакции, которые идут с поглощением теплоты Эндотермическими реакциями являются многие реакции разложения.
2HgO ![]() 2Hg + O2 – Q
2Hg + O2 – Q
Количество теплоты (Q), которое выделяется или поглощается при химический реакции, называется тепловым эффектом реакции.
Исходное состояние реагирующих систем
Гомогенные и гетерогенные реакции
Например: Соединение азота с кислородом.
Гомогенными называются реакции, в которых все реагирующие вещества, продукты реакции и катализатор тоже в каталитических реакциях, находятся в одном агрегатном состоянии. Если хотя бы одно из веществ имеет другое агрегатное состояние, то такая реакция называется гетерогенной. (Гомо – одинаковый, гетеро – разный).
N2 + O2 ![]() 2NO − Q.
2NO − Q.
Участие катализатора
Каталитические и некаталитические реакции
Например: каталитическое окисление аммиака и реакция аммиака с водой
Каталитическими реакциями называются такие реакции, которые идут только в присутствии катализатора. Использование различных катализаторов приводит к получению различных продуктов реакции.
4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
Катализаторами называют вещества, которые влияют на скорость реакции, чаще всего, ускоряя скорость реакции.
Катализаторы принимают непосредственное участие в химической реакции, но по окончании реакции высвобождаются.
Катализаторы, замедляющие скорость химических реакций называются ингибиторами.
Химические реакции, которые идут без участия катализаторов называются некаталитическими.
NH3 + H2O ![]() NH4OH
NH4OH
Наличие окислительно восстановительного процесса
Присутствует ли окислительно восстановительный процесс или нет.
Например: Реакции цинка с соляной кислотой и разложение карбоната кальция
Окислительно–восстановительными реакциями являются такие реакции, в которых у атомов, входящих в состав молекул, изменяются степени окисления по окончании реакции.
Окислительно–восстановительными чаще бывают реакции соединения и замещения.
Zn + 2HCl ![]() ZnCl2 + H2↑
ZnCl2 + H2↑
Бывают реакции, которые протекают без изменения степеней окисления элементов.
CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
Соотношение числа исходных и полученных веществ
Реакции соединения, разложения, замещения и обмена.
Например: Горение угля в кислороде, разложение перекиси водорода, реакции меди с нитратом ртути и нитрата серебра с хлоридом натрия.
Реакцией соединения называется реакция, в результате которой из двух или нескольких веществ образуется одно новое вещество.
S + O2 ![]() SO2↑
SO2↑
CaO + H2O ![]() Ca(OH)2
Ca(OH)2
CaCO3 + CO2 + H2O ![]() Ca(HCO3)2
Ca(HCO3)2
Реакцией разложения называется реакция, в результате которой из одного вещества образуется два или нескольких новых веществ.
2HgO ![]() 2Hg + O2↑
2Hg + O2↑
Сu(OH)2 ![]() СuO + H2O
СuO + H2O
2AgNO3 ![]() 2Ag + 2NO2↑ + O2↑
2Ag + 2NO2↑ + O2↑
Реакцией замещения называется реакция между простым и сложным веществом, при которой атомы простого вещества замещают атомы в сложном веществе по принципу: в новом веществе атомы с наибольшей электроотрицательностью соединяются с атомами с наименьшей электроотрицательностью. Атомы элемента с промежуточной между ними электроотрицательностью высвобождаются в виде простого вещества. В результате образуются новое сложное и новое простое вещества.
Fe + CuSO4 ![]() FeSO4 + Cu↓
FeSO4 + Cu↓
Zn + 2HCl ![]() ZnCl2 + H2↑
ZnCl2 + H2↑
2KBr + Cl2 ![]() 2KCl + Br2
2KCl + Br2
Реакцией обмена называется реакция между двумя сложными веществами при которой они обмениваются своими составными частями. Причем та часть, что стояла первой, в новом веществе будет стоять первой, а та часть, что стояла второй и в новом веществе тоже будет стоять на втором месте.
AgNO3 + NaCl ![]() AgCl↓ + NaNO3
AgCl↓ + NaNO3
NaOH + HCl ![]() NaCl + H2O
NaCl + H2O
FeCl3 + 3NaOH ![]() Fe(OH)3↓ + 3NaCl
Fe(OH)3↓ + 3NaCl
![]()
Глоссарий
- Аллотропией называется образование разных простых веществ одним элементом. Аллотропия возникает или из–за разного количества атомов в составе вещества (O2 –кислород, O3 – озон), или из–за разного соединения атомов в кристаллическую решетку (алмаз, графит).
- Гомогенными называются реакции, в которых все реагирующие вещества, продукты реакции и катализатор тоже в каталитических реакциях, находятся в одном агрегатном состоянии. Если хотя бы одно из веществ имеет другое агрегатное состояние, то такая реакция называется гетерогенной. (Гомо – одинаковый, гетеро – разный).
- Изомеры – это вещества одинакового качественного и количественного состава, но имеющие разное строение молекул и различные свойства.
- Катализаторами называют вещества, которые влияют на скорость реакции, чаще всего, ускоряя скорость реакции. Катализаторы принимают непосредственное участие в химической реакции, но по окончании реакции высвобождаются.
- Катализаторы, замедляющие скорость химических реакций называются ингибиторами.
- Каталитическими реакциями называются такие реакции, которые идут только в присутствии катализатора. Использование различных катализаторов приводит к получению различных продуктов реакции.
- Количество теплоты, которое выделяется или поглощается при химический реакции, называется тепловым эффектом реакции.
- Окислительно–восстановительными реакциями являются такие реакции, в которых у атомов, входящих в состав молекул, изменяются степени окисления по окончании реакции. Окислительно–восстановительными чаще бывают реакции соединения и замещения.
- Реакцией замещения называется реакция между простым и сложным веществом, при которой атомы простого вещества замещают атомы в сложном веществе по принципу: в новом веществе атомы с наибольшей электроотрицательностью соединяются с атомами с наименьшей электроотрицательностью. Атомы элемента с промежуточной между ними электроотрицательностью высвобождаются в виде простого вещества. В результате образуются новое сложное и новое простое вещества.
- Реакцией обмена называется реакция между двумя сложными веществами при которой они обмениваются своими составными частями. Причем та часть, что стояла первой, в новом веществе будет стоять первой, а та часть, что стояла второй и в новом веществе тоже будет стоять на втором месте.
- Реакцией разложения называется реакция, в результате которой из одного вещества образуется два или нескольких новых веществ.
- Реакцией соединения называется реакция, в результате которой из двух или нескольких веществ образуется одно новое вещество.
- Реакции, приводящие к установлению химического равновесия, называются обратимые. У обратимых реакций две скорости – скорость прямой реакции, приводящая к образованию продукта реакции. И скорость обратной реакции – распад продукта реакции до исходных веществ. Когда скорости прямой и обратной реакций становятся равными, наступает химическое динамическое равновесие. Это означает, что в единицу времени образуется столько молекул, сколько их распадается за это же время.
- У необратимых реакций только одна скорость и они протекают только в одну сторону, если продуктом реакции является осадок, газообразное вещество или вода.
- Химические реакции, которые идут без участия катализаторов называются некаталитическими.
- Экзотермическими реакциями называются реакции, идущие с выделением теплоты. Многие реакции соединения являются экзотермическими реакциями.
- Эндотермическими реакциями называются такие реакции, которые идут с поглощением теплоты Эндотермическими реакциями являются многие реакции разложения.
Полезные ссылки
Видеоурок «Качественные реакции в химии». Сайт «Видеоуроки в интернет» (Электронный ресурс). //URL:.https://www.youtube.com/watch?v=pk7UXWVBC9U&t=193s (дата обращения 07.03.18.)
Библиография
- Волков В. А., Вонский Е. В., Кузнецова Г. И. Выдающиеся химики мира. — М.: Высшая школа, 1991. — 656 с. — 100 000 экз. — ISBN 5-06-001568-8. (в пер.)
- Кособаева Б. – Использование компьютера в учебном процессе химии / Текст / Б. Кособаева, Н.Б. Арстанбекова // Абай атындагы Казак Улуттукпедагогикалык университеттинин Хабарши (Вестник) Жаратылыш таануу-география илимдери сериясынын 2012 №2 (32). – 68–71–бб.
- Стартовый эксперимент как форма включенности каждого ученика в учебный процесс / Текст / Б. Кособаева, Син Е.Е. // Химия в школе. – Москва, 2016. – №6.
- Дидактические особенности использования технологии обучения на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №6(48), С.155–160.
- Применение технологии системного усвоения знаний в обучении химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №7(49), С.152–159.
- Реализация межпредметных связей на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №10(52), С.136–139.
- Методологические аспекты обучения в современных условиях. / Текст / Б. Кособаева, Син Е.Е., Жакышова Б.Ш. // Проблемы современной науки и образования. – Иваново, 2016. – №13(55), С.104–108.
- Формирование системы понятий при обучении химии в школе. / Текст / Б. Кособаева, П.Э. Токомбаева // Вестник Кыргызского национального университета имени Ж. Баласагына. – Бишкек, 2017. – Специальный выпуск. С.77–81.
Был одним из инициаторов основания в 1868 г. Русского химического общества (наряду с А. А. Воскресенским, Н. Н. Зининым и Д. И. Менделеевым), был его делопроизводителем (1868—1891) и первым редактором «Журнала РХО» (1869—1900). В марте 1869 г. на заседании Русского химического общества Меншуткин доложил от имени Менделеева его Периодический закон — периодическую систему элементов.
Основное направление работ Меншуткина — исследование скорости химических превращений органических соединений.
Меншуткин обнаружил влияние разбавления на скорость реакции. Эти работы Меншуткина легли в основу классической химической кинетики. В 1886—1889 гг. Меншуткин установил влияние природы растворителя и температуры на процессы образования и разложения аминов и амидов кислот. В 1890 г. установил каталитическое действие растворителей в реакциях этерификации и солеобразования.
Какая масса углекислого газа образуется при сжигании 6 г углерода?
22 г
Какой объем кислорода выделится при разложении 5 г 10% перекиси водорода?
0,175 л
Какова масса осадка, образованного при слиянии раствора содержащего 3.4 грамма нитрата серебра и раствора содержащего 0,585 грамма хлорида натрия?
1, 435 г.
Сколько тепла выделится при горении одного заряда салюта массой 0,6 граммов, если термохимическое уравнение
2Mg + O2 ![]() 2MgO + 1203 кДж?
2MgO + 1203 кДж?
15,05 кДж
Определить практический выход продукта реакции, если из 50 литров аммиака при его каталитическом окислении образовалось 30 литров оксида азота (II).
60 %