Химия: Химические связи — различия между версиями
Admine2 (обсуждение | вклад) (→Сущность химической связи) |
Admine2 (обсуждение | вклад) |
||
| (не показано 59 промежуточных версий этого же участника) | |||
| Строка 1: | Строка 1: | ||
| − | |||
| − | |||
| − | |||
{{Якорь|Начало}} | {{Якорь|Начало}} | ||
| − | <div class="row | + | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> |
| − | <div class="large- | + | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Электроотрицательность химических элементов == | == Электроотрицательность химических элементов == | ||
<div class="show-for-large-up">{{right|[[file:Linus-Paulings-Electronegativity.png|450px|Электроотрицательность Лаймуса Полинга]]}}</div> | <div class="show-for-large-up">{{right|[[file:Linus-Paulings-Electronegativity.png|450px|Электроотрицательность Лаймуса Полинга]]}}</div> | ||
| Строка 24: | Строка 7: | ||
Все атомы, имеющие незаполненные электронные оболочки, способны к образованию химической связи. Если в образовании связи участвуют атомы разных химических элементов, то эта электронная пара будет смещена к одному из них. Способность атома к смещению электронной пары в свою сторону при образовании химической связи называется электроотрицательностью. | Все атомы, имеющие незаполненные электронные оболочки, способны к образованию химической связи. Если в образовании связи участвуют атомы разных химических элементов, то эта электронная пара будет смещена к одному из них. Способность атома к смещению электронной пары в свою сторону при образовании химической связи называется электроотрицательностью. | ||
| − | '''Электроотрицательность''' | + | '''Электроотрицательность''' – химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе электроны от атомов других элементов. Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. |
| − | Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. | ||
С точки зрения теории строения атомов принадлежность элементов к металлам и неметаллам определяется способностью их атомов отдавать или присоединять электроны при химических реакциях. | С точки зрения теории строения атомов принадлежность элементов к металлам и неметаллам определяется способностью их атомов отдавать или присоединять электроны при химических реакциях. | ||
| − | Наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко отдают электроны. Значения их электроотрицательностей малы (<span style="font-family:Times New Roman"><big>χ</big></span> ≤ 1). | + | Наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко отдают электроны. Значения их электроотрицательностей малы (<span style="font-family:Times New Roman"><big>χ</big></span> ≤ 1). Неметаллические свойства особенно выражены у тех элементов, атомы которых энергично присоединяют электроны. |
| − | Неметаллические свойства особенно выражены у тех элементов, атомы которых энергично присоединяют электроны. | ||
| − | В группе с увеличением числа электронных слоев электроотрицательность уменьшается, то есть происходит уменьшение электроотрицательности сверху вниз. Значит самым электроотрицательным элементом является '''фтор (F)''', а наименее электроотрицательным – | + | В группе с увеличением числа электронных слоев электроотрицательность уменьшается, то есть происходит уменьшение электроотрицательности сверху вниз. Значит, самым электроотрицательным элементом является '''фтор (F)''', а наименее электроотрицательным – ''франций (Fr)''. Чтобы сравнить электроотрицательности элементов, расположенных в разных периодах и группах, можно воспользоваться рассчитанными значениями электроотрицательностей. |
| − | Рассчитанные значения образуют '''шкалу электроотрицательностей'''. Наиболее распространенной является шкала известного '''американского химика Л. Полинга''' | + | Рассчитанные значения образуют '''шкалу электроотрицательностей'''. Наиболее распространенной является шкала известного '''американского химика Л. Полинга'''. |
| − | <div class="show-for-large-up">{{left|[[file: | + | <div class="show-for-large-up">{{left|[[file:Shkala.png|450px|Электроотрицательность элементов по Полингу]]}}</div> |
| − | <div class="hide-for-large-up">{{center|[[file: | + | <div class="hide-for-large-up">{{center|[[file:Shkala.png|450px|Электроотрицательность элементов по Полингу]]}}</div> |
| − | В результате смещения электронной пары на атоме, к которому произошло смещение, возникает частичный отрицательный заряд, а на атоме, связанном с ним – частичный положительный заряд. | + | В результате смещения электронной пары на атоме, к которому произошло смещение, возникает частичный отрицательный заряд, а на атоме, связанном с ним, – частичный положительный заряд. Если посчитать любое частичное смещение электронов полным, то на атомах будет либо полный положительный, либо полный отрицательный заряд. Результат этого допущения называется '''степенью окисления'''. |
<div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
== Сущность химической связи == | == Сущность химической связи == | ||
| − | '''1.''' Устойчивым является такое состояние атома, при котором его внешний энергетический уровень завершён до 8 электронов | + | '''1.''' Устойчивым является такое состояние атома, при котором его внешний энергетический уровень завершён до 8 электронов (Н, Не – до 2 электронов). |
'''2.''' Завершённый внешний уровень имеют атомы VIII A группы. | '''2.''' Завершённый внешний уровень имеют атомы VIII A группы. | ||
| − | '''3.''' [[file: | + | '''3.''' [[file:Obrazovanie him svyzi.png|250px|Образование химической связи]] |
'''<big>Главная причина образования химической связи – выделение энергии и повышение устойчивости системы.</big>''' | '''<big>Главная причина образования химической связи – выделение энергии и повышение устойчивости системы.</big>''' | ||
| − | '''4.''' Чем меньше запас энергии атома, тем более он устойчив в химическом отношении и его состояние наиболее энергетически выгодное. | + | '''4.''' Чем меньше запас энергии атома, тем более он устойчив в химическом отношении, и его состояние наиболее энергетически выгодное. |
'''5.''' Пути завершения внешнего уровня атомов: | '''5.''' Пути завершения внешнего уровня атомов: | ||
| Строка 56: | Строка 37: | ||
''• образование общих электронных пар'' | ''• образование общих электронных пар'' | ||
| − | ''• отдача или присоединение электронов'' | + | '''• отдача или присоединение электронов''' |
| − | ''• обобществление электронов.'' | + | '''• обобществление электронов.''' |
== Виды химической связи == | == Виды химической связи == | ||
| − | 1. | + | <div class="show-for-large-up">{{right|[[file:Vidy him reakcii.png|350px|Виды химической связи]]}}</div> |
| − | + | <div class="hide-for-large-up">{{center|[[file:Vidy him reakcii.png|350px|Виды химической связи]]}}</div> | |
| − | 2. | + | '''1.''' '''Ионная (∆ЭО > 1,7)''' – связь, осуществляемая за счёт сил электростатического притяжения ионов (Отдача или присоединение ионов). |
| − | + | Ме<sub>щ</sub> – О, Г, S; Ме<sub>щз</sub> – О, Г, S. | |
| − | + | ||
| − | + | '''2.''' '''Ковалентная (∆ЭО = 0 – 1,7)''' - связь осуществляемая путём образования общих электронных пар. | |
| − | + | *'''''неполярная(∆ЭО = 0)''''' – связь между одинаковыми атомами неметаллов. | |
| − | + | *'''''полярная(0<∆ЭО<1,7)''''' – связь между разными атомами неметаллов, или неметаллом и неактивным металлом (AlCl<sub>3</sub>). | |
| − | + | ||
| − | + | '''3.''' '''Металлическая''' – связь за счёт обобществления валентных электронов в кристаллической решётке металла. Это связь в металлах и сплавах (примерно в 3-4 раза слабее одинарной ковалентной) | |
| − | + | ||
| − | + | '''4.''' '''Водородная''' – связь между атомом водорода и сильноэлекроотрицательным элементом F, O, N, Cl. (примерно 15-20 раз слабее ковалентной) | |
| − | + | *'''''внутримолекулярная''''' – белки, полипептиды | |
| − | + | *'''''межмолекулярная''''' – вода, спирты, аммиак, аминокислоты и др. | |
| − | + | ||
| − | + | === Ковалентная связь === | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | 3. | ||
| − | 4. | ||
| − | |||
| − | |||
| − | |||
Связь, возникающая при взаимодействии электронов с образованием обобщенных электронных пар, называется ковалентной. | Связь, возникающая при взаимодействии электронов с образованием обобщенных электронных пар, называется ковалентной. | ||
| − | В случае если взаимодействующие атомы имеют равные значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, то есть находится на равном расстоянии от обоих атомов. Такая ковалентная связь называется неполярной. Она имеет место в простых веществах-неметаллах: | + | |
| + | {{left|[[file:Nepolyrnay.png|150px|Ковалентная неполярная связь]]}} | ||
| + | В случае если взаимодействующие атомы имеют равные значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, то есть находится на равном расстоянии от обоих атомов. Такая ковалентная связь называется неполярной. Она имеет место в простых веществах-неметаллах: H<sub>2</sub>, О<sub>2</sub>, N<sub>2</sub>, Cl<sub>2</sub>, P<sub>4</sub>, O<sub>3</sub>. | ||
| + | |||
| + | {{left|[[file:Polyrnay.png|150px|Ковалентная полярная связь]]}} | ||
При взаимодействии атомов, имеющих различные значения электроотрицательности, например водорода и хлора, общая электронная пара оказывается смещенной в сторону атома с большей электроотрицательностью, то есть в сторону хлора. | При взаимодействии атомов, имеющих различные значения электроотрицательности, например водорода и хлора, общая электронная пара оказывается смещенной в сторону атома с большей электроотрицательностью, то есть в сторону хлора. | ||
Атом хлора приобретает частичный отрицательный заряд, а атом водорода — частичный положительный. Это пример полярной ковалентной связи. | Атом хлора приобретает частичный отрицательный заряд, а атом водорода — частичный положительный. Это пример полярной ковалентной связи. | ||
| − | Молекула, в которой разделены центры положительного и отрицательного зарядов, называется диполем. Полярная связь имеет место между атомами с различной, но не сильно различающейся электроотрицательностью, например между различными неметаллами. Примерами соединений с полярными ковалентными связями являются соединения неметаллов друг с другом, а также различные ионы, содержащие атомы неметаллов ( | + | {{left|[[file:Water-molecule-polarnost.png|150px|Полярное представление молекулы воды]]}} |
| − | Характеристики ковалентной связи | + | Молекула, в которой разделены центры положительного и отрицательного зарядов, называется '''диполем'''. Полярная связь имеет место между атомами с различной, но не сильно различающейся электроотрицательностью, например между различными неметаллами. Примерами соединений с полярными ковалентными связями являются соединения неметаллов друг с другом, а также различные ионы, содержащие атомы неметаллов (NO<sub>3</sub><sup>–</sup>, CH<sub>3</sub>COO<sup>–</sup>). Особенно много ковалентных полярных соединений среди органических веществ. |
| − | ===== | + | <br clear=all /> |
| − | + | <div class="resettext" style="background-color:#bbcdff; padding:3px"> | |
| + | <h4>Характеристики ковалентной связи</h4> | ||
| + | <div class="mw-customtoggle-ppol button17">'''Полярность связи'''</div> <div class="mw-customtoggle-AO button17">'''Тип перекрывания АО и кратность связи'''</div> <div class="mw-customtoggle-NN button17">'''Направленность и насыщенность'''</div></div> <br> | ||
| + | |||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-ppol"> | ||
Полярность ковалентной химической связи показывает перераспределение электронной плотности вокруг ядер атомов в молекуле в сравнении с распределением электронной плотности в нейтральных атомах, образующих данную связь. | Полярность ковалентной химической связи показывает перераспределение электронной плотности вокруг ядер атомов в молекуле в сравнении с распределением электронной плотности в нейтральных атомах, образующих данную связь. | ||
| + | |||
Полярность связи зависит от видов атомов, образующих связь, и от эффективных зарядов на атомах. В органической химии эффективные заряды обозначаются +δ и –δ. Полярность связи имеет определяющее значение для механизма протекания реакции. Неполярная связь образуется между атомами с одинаковой электроотрицательностью. В молекулах с неполярной связью дипольный момент связи равен нулю. Полярная связи тем больше, чем больше разница электроотрицательностей элементов, ее образующих. | Полярность связи зависит от видов атомов, образующих связь, и от эффективных зарядов на атомах. В органической химии эффективные заряды обозначаются +δ и –δ. Полярность связи имеет определяющее значение для механизма протекания реакции. Неполярная связь образуется между атомами с одинаковой электроотрицательностью. В молекулах с неполярной связью дипольный момент связи равен нулю. Полярная связи тем больше, чем больше разница электроотрицательностей элементов, ее образующих. | ||
| − | + | ---- | |
| − | == | + | </div> |
| − | По типу перекрывания электронных орбиталей ковалентная химическая связь подразделяется на | + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-AO"> |
| − | + | По типу перекрывания электронных орбиталей ковалентная химическая связь подразделяется на σ– и π-связи. | |
| + | Греческие буквы σ и π соответствуют латинским буквам s и р, которые обозначают формы электронных орбиталей атомов, участвующих в образовании σ– и π-связей соответственно. σ-связь образуется в результате образования одной общей электронной пары (общей электронной плотности) за счет перекрывания электронных орбиталей s-s, s-p или р–р-типа. | ||
Такие варианты образования связи характерны для простых неорганических соединений. | Такие варианты образования связи характерны для простых неорганических соединений. | ||
| − | == | + | ---- |
| + | </div> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-NN"> | ||
Направленность связи обуславливает строение веществ и геометрическое строение их молекул. | Направленность связи обуславливает строение веществ и геометрическое строение их молекул. | ||
| − | Форма молекул определяется типом электронных облаков, участвующих в образовании связи, а также фактом наличия или отсутствия неподеленных электронных пар. Так, например, молекула | + | |
| + | Форма молекул определяется типом электронных облаков, участвующих в образовании связи, а также фактом наличия или отсутствия неподеленных электронных пар. Так, например, молекула СО<sub>2</sub> является линейной (нет неподеленных электронных пар), а Н<sub>2</sub>О и SO<sub>2</sub> — уголковыми (есть неподеленные пары). | ||
| + | |||
Насыщаемость связи характеризует способность каждого атома образовать ограниченное число связей, которое обусловлено количеством валентных орбиталей. | Насыщаемость связи характеризует способность каждого атома образовать ограниченное число связей, которое обусловлено количеством валентных орбиталей. | ||
| + | ---- | ||
| + | </div> | ||
| + | <div class="mw-customtoggle-SKS resettext" style="background-color:#bbcdff; padding:3px"><h4>Свойства ковалентной связи</h4></div> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-SKS"><br> | ||
| + | |||
| + | '''1.''' '''Длина''' – межъядерное расстояние | ||
| + | |||
| + | '''2.''' '''Энергия''' – энергия, выделяющаяся при образовании или поглощающаяся при разрыве химической связи.<br> | ||
| + | ''С увеличением кратности связи энергия увеличивается, длина связи уменьшается и химическая активность падает:''<br> | ||
| + | {| class="mw-datatable" | ||
| + | |- | ||
| + | |F – F | ||
| + | |O = O | ||
| + | |N ≡ N | ||
| + | |C ≡ O<br>Одна из трёх связей<br> О{{arrowleft}}С<br> по донорно-акцепторному механизму | ||
| + | |- | ||
| + | |155 кДж/моль | ||
| + | |498 кДж/моль | ||
| + | |946 кДж/моль | ||
| + | |1065 кДж/моль | ||
| + | |} | ||
| + | '''3.''' '''Насыщаемость''' – определяется способностью атомов образовывать ограниченное число связей:<br>Например, водород всегда одновалентен; азот может быть трехвалентен в молекуле аммиака NH<sub>3</sub> и четырёхвалентен в ионе аммония NH<sub>4</sub><sup>+</sup> (валентные возможности расширяются за счёт участия неподелённой электронной пары атома азота в образовании ковалентной связи по донорно-акцепторному механизму). | ||
| + | |||
| + | '''4.''' '''Направленность''' – обуславливает форму молекулы в пространстве.<br>Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов при образовании σ – связей. | ||
| + | </div> | ||
<div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | == Ионная связь == | + | === Ионная связь === |
| − | Это крайний случай ковалентной полярной связи: разница электроотрицательностей элементов настолько велика (>2), что один из них полностью "забирает" электрон у второго и превращается в отрицательно заряженный ион (анион), а второй, отдав электроны, превращается в положительно заряженный ион (катион). | + | Это крайний случай ковалентной полярной связи: разница электроотрицательностей элементов настолько велика (>2), что один из них полностью "забирает" электрон у второго и превращается в отрицательно заряженный ион '''(анион)''', а второй, отдав электроны, превращается в положительно заряженный ион '''(катион)'''. |
| − | + | <div class="textblock">Ионная связь (ИС) – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности. (Например, NaCl, K<sub>2</sub>O, LiF) </div> | |
| − | Запомни! Как правило, ионная связь образуется между атомами металлов и атомами неметаллов. | + | '''Запомни!''' Как правило, ионная связь образуется между атомами металлов и атомами неметаллов. |
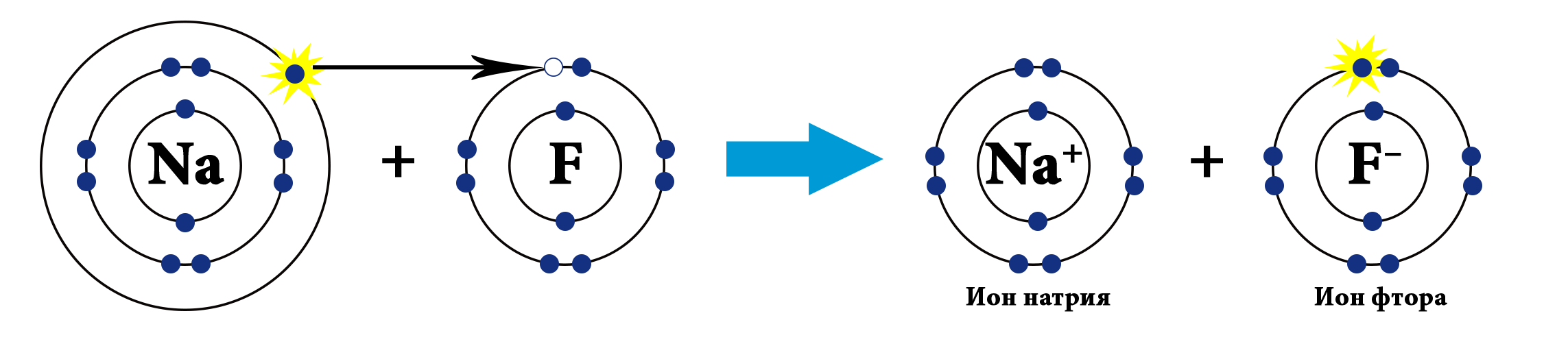
| − | Например, на рисунке сверху изображены атомы натрия и фтора. Натрий - щелочной металл, представитель IA группы, имеет всего 1 валентный электрон и проявляет восстановительные свойства (электроотрицательность по шкале Полинга χ(Na)=0,98). Фтор - представитель галогенов (VIIA группа), имеет 7 валентных электронов, является сильным окислителем (χ(F)=4,0). Фтор, будучи более электроотрицательным, "забирает" у атома натрия валентный электрон и превращается в анион, а атом натрия - в катион. | + | {{center|[[file:NaF.png|650px|Образование ионной связи между натрием и фтором]]}} |
| + | |||
| + | Например, на рисунке сверху изображены атомы натрия и фтора. Натрий - щелочной металл, представитель IA группы, имеет всего 1 валентный электрон и проявляет восстановительные свойства (электроотрицательность по шкале Полинга <span style="font-family:Times New Roman"><big>χ</big></span><sub>(Na)</sub>=0,98). Фтор - представитель галогенов (VIIA группа), имеет 7 валентных электронов, является сильным окислителем (<span style="font-family:Times New Roman"><big>χ</big></span><sub>(F)</sub>=4,0). Фтор, будучи более электроотрицательным, "забирает" у атома натрия валентный электрон и превращается в анион, а атом натрия - в катион. | ||
Ионная связь образуется за счет сил электростатического притяжения между разноименно заряженными частицами: катионами и анионами. | Ионная связь образуется за счет сил электростатического притяжения между разноименно заряженными частицами: катионами и анионами. | ||
| − | + | <div class="mw-customtoggle-HIB resettext" style="background-color:#bbcdff; padding:3px"><h4>Характеристики ионной связи</h4></div><br> | |
| − | + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-HIB"> | |
В отличие от ковалентной связи, ионная связь является ненасыщенной и ненаправленной. Это легко себе представить: ведь взаимодействие ионов в пространстве не зависит от направления, а каждый анион может притягивать к себе несколько катионов. | В отличие от ковалентной связи, ионная связь является ненасыщенной и ненаправленной. Это легко себе представить: ведь взаимодействие ионов в пространстве не зависит от направления, а каждый анион может притягивать к себе несколько катионов. | ||
| − | Следует подчеркнуть, что полностью ионной связи не существует. Корректнее говорить об "ионности", или ионном характере связи. В случае, если разница ЭО составляет более 2 (например, между щелочными металлами и галогенами), происходит почти полная "передача" электрона к более электроотрицательному элементу с образованием соответствующих ионов. | + | Следует подчеркнуть, что полностью ионной связи не существует. Корректнее говорить об "ионности", или ионном характере связи. В случае, если разница ЭО составляет более 2 (например, между щелочными металлами и галогенами), происходит почти полная "передача" электрона к более электроотрицательному элементу с образованием соответствующих ионов.<br> |
| − | + | </div> | |
===== Механизм образования ионной связи ===== | ===== Механизм образования ионной связи ===== | ||
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Происходит полная отдача (принятие) валентных электронов, перекрывание облаков отсутствует, обобществления электронов не наблюдается. | Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Происходит полная отдача (принятие) валентных электронов, перекрывание облаков отсутствует, обобществления электронов не наблюдается. | ||
| + | <ul class="small-block-grid-1 large-block-grid-2"> | ||
| + | <li>'''Ио́н (др.-греч. ἰόν — идущее)''' — частица, в которой общее число протонов не эквивалентно общему числу электронов.<br><br><br>{{center|[[file:Iony.png|350px]]}}</li> | ||
| + | <li>{{center|Названия ионов}}{{center|[[file:Nazvanie ionov.png|350px]]}}</li> | ||
| + | </ul> | ||
| − | + | Рассмотрим механизм образования молекулы фторида натрия: ''NaF – ис.'' | |
| − | Рассмотрим механизм образования молекулы фторида натрия: | ||
| − | NaF – ис. | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | {| class="resettext mw-datatable" style="float:left; margin-right:2em" | ||
| + | |- | ||
| + | ! colspan=2|Электронная схема образования молекулы NaF | ||
| + | |- | ||
| + | !Na<br>+11)2{{e}})8{{e}})1{{e}} | ||
| + | |[[file:IONA.png|150px]] | ||
| + | |- | ||
| + | !F<br>+9)2{{e}})7{{e}} | ||
| + | |[[file:IOF.png|150px]] | ||
| + | |} | ||
| − | В результате образования связи электронная пара полностью сместилась к атому фтора, разноименно заряженные | + | [[file:NAF-ionic-bond.png|250px]]<br>В результате образования связи электронная пара полностью сместилась к атому фтора, разноименно заряженные ионы натрия и фтора притягиваются за счёт электростатического взаимодействия. |
| − | + | <br clear=all /> | |
| − | + | <ul class="small-block-grid-1 large-block-grid-2"> | |
| − | + | <li> | |
| − | ''' | + | {{center|Механизм образования хлорида натрия:}} |
| − | + | {{center|[[file:Ionic BondsNaCl.gif|150px]]}} | |
| + | </li> | ||
| + | <li> | ||
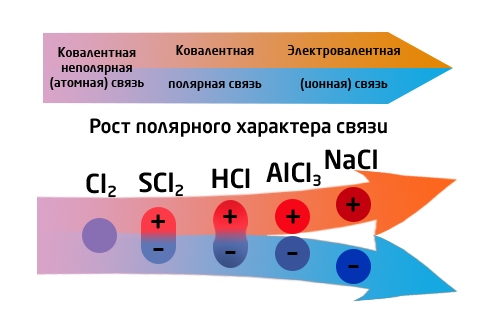
| + | '''Сравнительная характеристика ковалентной и ионной химической связи'''<br>{{center|[[file:Rost polyrnoi svyzi.png|400px|Рост полярного характера связи]]}} | ||
| + | </li> | ||
| + | </ul> | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | |||
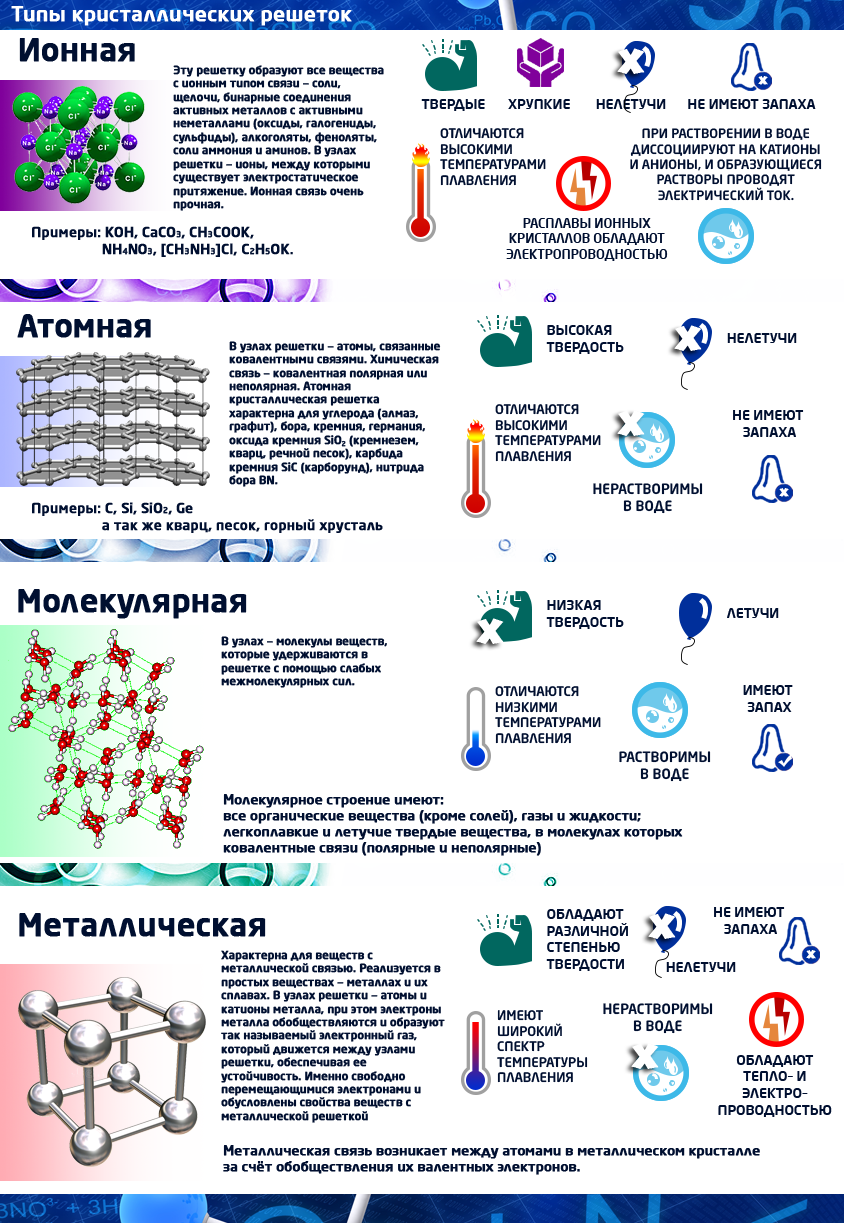
== Кристаллические решетки == | == Кристаллические решетки == | ||
Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение). | Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение). | ||
| − | Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка. Точки, в которых размещены частицы, называются узлами кристаллической решетки. | + | Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка. Точки, в которых размещены частицы, называются '''узлами кристаллической решетки'''. |
В узлах кристаллической решетки могут находиться ионы, атомы или молекулы. | В узлах кристаллической решетки могут находиться ионы, атомы или молекулы. | ||
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические. | В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические. | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | {{center|[[file:Tipy kristal reshotok.png|550px|Типы кристаллических решеток]]}} | ||
<div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | == | + | == Глоссарий == |
| − | :{{bib|''' | + | :{{bib|'''Анионы''' - отрицательно заряженные ионы.}} |
| − | :{{bib|'''Валентность''' – это способность химического элемента к образованию химической связи. | + | :{{bib|'''Валентность''' – это способность химического элемента к образованию химической связи.}} |
| + | :{{bib|'''Водородная связь''' - один из видов межмолекулярных связей. Обусловлена в основном электростатическими силами. Для возникновения водородной связи нужно, чтобы в молекуле был один или несколько атомов водорода, связанных с небольшими, но электроотрицательными атомами, например: O, N, F. Важно, чтобы у этих электроотрицательных атомов были неподеленные электронные пары. Водородные связи характерны для таких веществ, как вода H<sub>2</sub>O, аммиак NH<sub>3</sub> , фтороводород HF. Водородная связь приблизительно в 20 раз менее прочная, чем ковалентная. При её возникновении число связей, образуемых атомом водорода, превышает его формальную валентность.}} | ||
| + | :{{bib|'''Донорные свойства''' - способность атомов элемента отдавать свои электроны другим атомам. Количественной мерой донорных свойств атомов, образующих химическую связь, является их электроотрицательность.}} | ||
| + | :{{bib|'''Ионная связь''' образуется в результате электростатического притяжения ионов противоположного знака.}} | ||
| + | :{{bib|'''Ионы''' – частицы, у которых количество электронов больше или меньше положительного заряда ядра.}} | ||
| + | :{{bib|'''Катион''' – положительно заряженный ион}} | ||
| + | :{{bib|'''Ковалентная химическая связь''' – связь, которая возникает между атомами за счет образования общих электронных пар.}} | ||
| + | :{{bib|'''Кристаллическая решетка''' - кристаллическая структура характеризуется правильным (регулярным) расположением частиц в строго определенных точках пространства кристалла. При мысленном соединении этих точек линиями получается пространственный каркас, который называют кристаллической решеткой. Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах могут находиться ионы, атомы или молекулы. Кристаллическая решетка состоит из совершенно одинаковых элементарных ячеек.}} | ||
| + | :{{bib|'''Металлическая связь''' – связь в металлах или сплавах, обусловленная взаимодействием относительно свободных электронов с катионами в узлах кристаллической решетки.}} | ||
| + | :{{bib|'''Металлы''' – твердые при комнатной температуре вещества (за исключением ртути), с металлическим блеском, высокой тепло- и электропроводностью. Атомы металлов отдают электроны, образуя при этом положительно заряженные ионы.}} | ||
| + | :{{bib|'''Неметаллы''' – вещества, состоящие из молекул: газы, жидкости, летучие твердые вещества; не обладают металлическим блеском, имеют низкую тепло- и электропроводность. Атомы неметаллов принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы.}} | ||
| + | :{{bib|'''Степень окисления''' – формальный заряд атома, вычисленный исходя из предположения, что все связи между атомами в молекуле ионные.}} | ||
| + | :{{bib|'''Электроотрицательность''' – способность элемента оттягивать на себя электронную пару.}} | ||
== Полезные ссылки == | == Полезные ссылки == | ||
| − | {{bib|[http:// | + | {{bib|[http://maratakm.narod.ru/t1.files/t6.htm Химия, методика, психология]}} |
| − | + | {{bib|[https://sites.google.com/site/himulacom/zvonok-na-urok/11-klass---cetveertyj-god-obucenia/urok-no8-vidy-i-mehanizmy-obrazovania-himiceskoj-svazi-harakteristiki-himicesko Химуля. Уроки №8-№9.]}} | |
| + | {{bib|[http://files.school-collection.edu.ru/dlrstore/3c96a89b-aae9-11db-abbd-0800200c9a66/ch11_06_08.swf Анимация. Металлическа связь.]}} | ||
| + | {{bib|[http://files.school-collection.edu.ru/dlrstore/3c96a89c-aae9-11db-abbd-0800200c9a66/ch11_06_09.swf Анимация. Водородная связь.]}} | ||
| + | {{bib|[http://files.school-collection.edu.ru/dlrstore/3c96a895-aae9-11db-abbd-0800200c9a66/ch11_06_02.swf5 Анимация. Образование ионной связи.]}} | ||
| + | {{bib|[http://files.school-collection.edu.ru/dlrstore/3c96a898-aae9-11db-abbd-0800200c9a66/ch11_06_05.swf Анимация. Образование ковалентной неполярной связи.]}} | ||
| + | {{bib|[http://files.school-collection.edu.ru/dlrstore/3c96a899-aae9-11db-abbd-0800200c9a66/ch11_06_06.swf Анимация. Образование ковалентной полярной связи.]}} | ||
| + | {{bib|[http://files.school-collection.edu.ru/dlrstore/3c96a89d-aae9-11db-abbd-0800200c9a66/ch11_06_10.swf Тренажеры. Виды химической связи.]}} | ||
| + | {{bib|[http://files.school-collection.edu.ru/dlrstore/3c96a89a-aae9-11db-abbd-0800200c9a66/ch11_06_07.swf Тренажеры. Структурные формулы неорганических и органических веществ.]}} | ||
| + | {{bib|[https://foxford.ru/wiki/himiya/vzaimosvyaz-tipa-himicheskoy-svyazi-s-vidom-kristallicheskoy-reshetki Фоксфорд. Учебник.]}} | ||
| + | {{bib|[https://sites.google.com/site/himulacom/zvonok-na-urok/8-klass/urok-no52-ionnaa-svaz Химуля.Com. Урок №53.]}} | ||
| + | {{bib|[https://foxford.ru/uploads/tinymce_image/image/10215/%D0%B8%D0%BE%D0%BD%D0%BD%D0%B0%D1%8F_%D1%81%D0%B2%D1%8F%D0%B7%D1%8C_%D0%B0%D0%BD%D0%B8%D0%BC%D0%B0%D1%86%D0%B8%D1%8F.gif Ионная связь. Анимация.]}} | ||
| + | {{bib|[http://www.physchem.chimfak.rsu.ru/ Южный федеральный университет. Химический факультет.]}} | ||
<br> | <br> | ||
| − | |||
| − | |||
| − | |||
<div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| Строка 225: | Строка 224: | ||
<div class="large-4 medium-5 columns"> | <div class="large-4 medium-5 columns"> | ||
<!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | <!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | ||
| − | <div class=" | + | <div class="sbstyle"> |
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric | + | <div class="large-10 small-10 large-centered small-centered columns rubric">Химия в лицах</div> |
</div> | </div> | ||
| + | {{center-p|[[file:Richard Abegg.jpg|400px|Рихард Вильгельм Генрих Абегг]]}} | ||
| + | Немецкий физикохимик Рихард Вильгельм Генрих Абегг родился в Данциге (ныне Гданьск, Польша). | ||
| + | Областью научных интересов Абегга являлись неорганическая и физическая химия. Исследовал скорость диффузии в растворах солей и электропроводность расплавленных солей. Совместно с немецким химиком Ф. Ауэрбахом с 1905 г. начал издавать многотомный справочник «Руководство по неорганической химии». Главной заслугой Абегга стало создание первых представлений о связи между атомами, учитывающих сложное строение атома. В 1899 г. Абегг совместно со своим коллегой Гвидо Бодлендером высказал идею о сродстве атомов к электрону – способности атомов присоединять электрон. | ||
| + | |||
| + | На основе этого принципа электросродства Абегг в 1902–1904 гг. разрабатывает теорию электровалентности. Валентностью, по мнению Абегга, обладают ионы, и величина валентности равна заряду иона. Каждый элемент характеризуется двумя максимальными валентностями – положительной и отрицательной; сумма этих валентностей равна восьми (т.н. правило Абегга). Одна из них, производящая более сильное действие, «нормальная», другая – «контрвалентность». Принцип электросродства и теория электровалентности Абегга заложили основу для более поздних теорий химической связи, которые создали [http://www.physchem.chimfak.rsu.ru/Source/History/Persones/Kossel.html Вальтер Коссель], [http://www.physchem.chimfak.rsu.ru/Source/History/Persones/Lewis.html Джилберт Льюис] и [http://www.physchem.chimfak.rsu.ru/Source/History/Persones/Langmuir.html Ирвинг Ленгмюр]. | ||
</div> | </div> | ||
| − | <div class=" | + | <div class="sbstyle"> |
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric" style=" | + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Комиксы</div> |
</div> | </div> | ||
| − | + | {{center|[[file:CHcom1.png|400px|Комиксы]]}} | |
| + | {{center|[[file:CHcom2.png|400px|Комиксы]]}} | ||
| + | {{center|[[file:CHcom3.png|400px|Комиксы]]}} | ||
| + | {{center|[[file:CHcom4.png|400px|Комиксы]]}} | ||
| + | {{center|[[file:CHcom5.png|400px|Комиксы]]}} | ||
</div> | </div> | ||
| − | <div class=" | + | <div class="sbstyle"> |
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric" style=" | + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Пройди тестирование</div> |
| + | </div> | ||
| + | <div align="center" class="test_div_hover" style="width:300px; height:auto; float:non; text-indent:0"><span class="test_hover_state"></span> [[file:Corbis.jpg|class=testirovanie|Пройди тестирование|link=]]</div> | ||
| + | </div> | ||
</div> | </div> | ||
| − | + | {{lang|:KR:Химия: Химиялык байланыштар}} | |
| − | |||
[[Category:Средняя школа]] | [[Category:Средняя школа]] | ||
[[Category:Химия]] | [[Category:Химия]] | ||
Текущая версия на 09:44, 22 октября 2018
Содержание
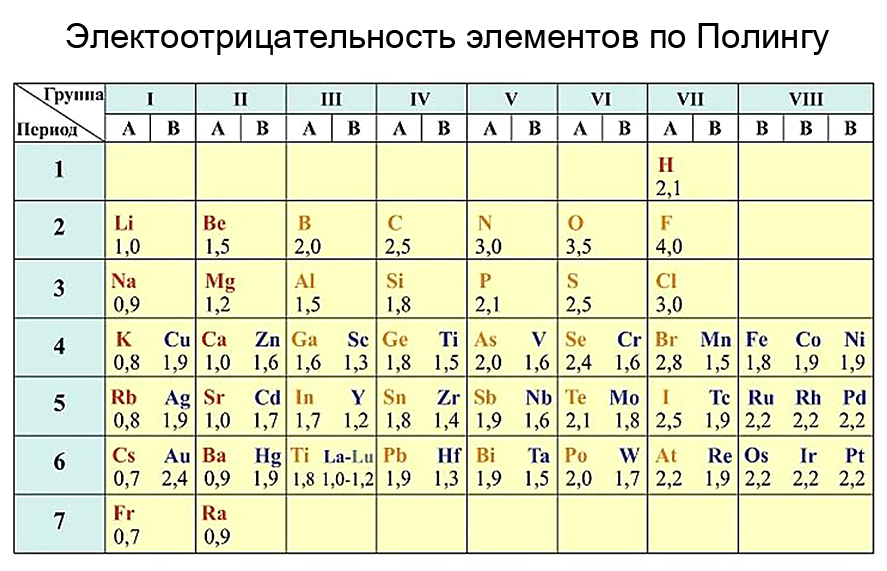
Электроотрицательность химических элементов
Все атомы, имеющие незаполненные электронные оболочки, способны к образованию химической связи. Если в образовании связи участвуют атомы разных химических элементов, то эта электронная пара будет смещена к одному из них. Способность атома к смещению электронной пары в свою сторону при образовании химической связи называется электроотрицательностью.
Электроотрицательность – химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе электроны от атомов других элементов. Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом.
С точки зрения теории строения атомов принадлежность элементов к металлам и неметаллам определяется способностью их атомов отдавать или присоединять электроны при химических реакциях.
Наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко отдают электроны. Значения их электроотрицательностей малы (χ ≤ 1). Неметаллические свойства особенно выражены у тех элементов, атомы которых энергично присоединяют электроны.
В группе с увеличением числа электронных слоев электроотрицательность уменьшается, то есть происходит уменьшение электроотрицательности сверху вниз. Значит, самым электроотрицательным элементом является фтор (F), а наименее электроотрицательным – франций (Fr). Чтобы сравнить электроотрицательности элементов, расположенных в разных периодах и группах, можно воспользоваться рассчитанными значениями электроотрицательностей.
Рассчитанные значения образуют шкалу электроотрицательностей. Наиболее распространенной является шкала известного американского химика Л. Полинга.
В результате смещения электронной пары на атоме, к которому произошло смещение, возникает частичный отрицательный заряд, а на атоме, связанном с ним, – частичный положительный заряд. Если посчитать любое частичное смещение электронов полным, то на атомах будет либо полный положительный, либо полный отрицательный заряд. Результат этого допущения называется степенью окисления.
Сущность химической связи
1. Устойчивым является такое состояние атома, при котором его внешний энергетический уровень завершён до 8 электронов (Н, Не – до 2 электронов).
2. Завершённый внешний уровень имеют атомы VIII A группы.
Главная причина образования химической связи – выделение энергии и повышение устойчивости системы.
4. Чем меньше запас энергии атома, тем более он устойчив в химическом отношении, и его состояние наиболее энергетически выгодное.
5. Пути завершения внешнего уровня атомов:
• образование общих электронных пар
• отдача или присоединение электронов
• обобществление электронов.
Виды химической связи
1. Ионная (∆ЭО > 1,7) – связь, осуществляемая за счёт сил электростатического притяжения ионов (Отдача или присоединение ионов). Мещ – О, Г, S; Мещз – О, Г, S.
2. Ковалентная (∆ЭО = 0 – 1,7) - связь осуществляемая путём образования общих электронных пар.
- неполярная(∆ЭО = 0) – связь между одинаковыми атомами неметаллов.
- полярная(0<∆ЭО<1,7) – связь между разными атомами неметаллов, или неметаллом и неактивным металлом (AlCl3).
3. Металлическая – связь за счёт обобществления валентных электронов в кристаллической решётке металла. Это связь в металлах и сплавах (примерно в 3-4 раза слабее одинарной ковалентной)
4. Водородная – связь между атомом водорода и сильноэлекроотрицательным элементом F, O, N, Cl. (примерно 15-20 раз слабее ковалентной)
- внутримолекулярная – белки, полипептиды
- межмолекулярная – вода, спирты, аммиак, аминокислоты и др.
Ковалентная связь
Связь, возникающая при взаимодействии электронов с образованием обобщенных электронных пар, называется ковалентной.
В случае если взаимодействующие атомы имеют равные значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, то есть находится на равном расстоянии от обоих атомов. Такая ковалентная связь называется неполярной. Она имеет место в простых веществах-неметаллах: H2, О2, N2, Cl2, P4, O3.
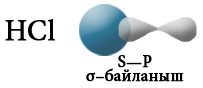
При взаимодействии атомов, имеющих различные значения электроотрицательности, например водорода и хлора, общая электронная пара оказывается смещенной в сторону атома с большей электроотрицательностью, то есть в сторону хлора.
Атом хлора приобретает частичный отрицательный заряд, а атом водорода — частичный положительный. Это пример полярной ковалентной связи.
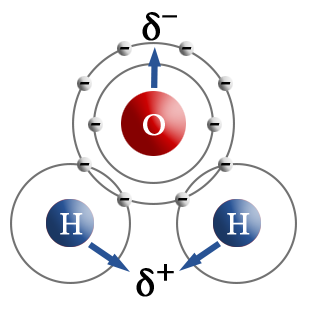
Молекула, в которой разделены центры положительного и отрицательного зарядов, называется диполем. Полярная связь имеет место между атомами с различной, но не сильно различающейся электроотрицательностью, например между различными неметаллами. Примерами соединений с полярными ковалентными связями являются соединения неметаллов друг с другом, а также различные ионы, содержащие атомы неметаллов (NO3–, CH3COO–). Особенно много ковалентных полярных соединений среди органических веществ.
Характеристики ковалентной связи
Полярность ковалентной химической связи показывает перераспределение электронной плотности вокруг ядер атомов в молекуле в сравнении с распределением электронной плотности в нейтральных атомах, образующих данную связь.
Полярность связи зависит от видов атомов, образующих связь, и от эффективных зарядов на атомах. В органической химии эффективные заряды обозначаются +δ и –δ. Полярность связи имеет определяющее значение для механизма протекания реакции. Неполярная связь образуется между атомами с одинаковой электроотрицательностью. В молекулах с неполярной связью дипольный момент связи равен нулю. Полярная связи тем больше, чем больше разница электроотрицательностей элементов, ее образующих.
По типу перекрывания электронных орбиталей ковалентная химическая связь подразделяется на σ– и π-связи.
Греческие буквы σ и π соответствуют латинским буквам s и р, которые обозначают формы электронных орбиталей атомов, участвующих в образовании σ– и π-связей соответственно. σ-связь образуется в результате образования одной общей электронной пары (общей электронной плотности) за счет перекрывания электронных орбиталей s-s, s-p или р–р-типа.
Такие варианты образования связи характерны для простых неорганических соединений.
Направленность связи обуславливает строение веществ и геометрическое строение их молекул.
Форма молекул определяется типом электронных облаков, участвующих в образовании связи, а также фактом наличия или отсутствия неподеленных электронных пар. Так, например, молекула СО2 является линейной (нет неподеленных электронных пар), а Н2О и SO2 — уголковыми (есть неподеленные пары).
Насыщаемость связи характеризует способность каждого атома образовать ограниченное число связей, которое обусловлено количеством валентных орбиталей.
Свойства ковалентной связи
1. Длина – межъядерное расстояние
2. Энергия – энергия, выделяющаяся при образовании или поглощающаяся при разрыве химической связи.
С увеличением кратности связи энергия увеличивается, длина связи уменьшается и химическая активность падает:
| F – F | O = O | N ≡ N | C ≡ O Одна из трёх связей О по донорно-акцепторному механизму |
| 155 кДж/моль | 498 кДж/моль | 946 кДж/моль | 1065 кДж/моль |
3. Насыщаемость – определяется способностью атомов образовывать ограниченное число связей:
Например, водород всегда одновалентен; азот может быть трехвалентен в молекуле аммиака NH3 и четырёхвалентен в ионе аммония NH4+ (валентные возможности расширяются за счёт участия неподелённой электронной пары атома азота в образовании ковалентной связи по донорно-акцепторному механизму).
4. Направленность – обуславливает форму молекулы в пространстве.
Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов при образовании σ – связей.
Ионная связь
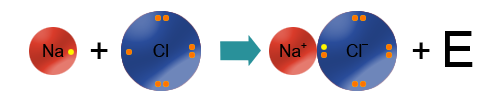
Это крайний случай ковалентной полярной связи: разница электроотрицательностей элементов настолько велика (>2), что один из них полностью "забирает" электрон у второго и превращается в отрицательно заряженный ион (анион), а второй, отдав электроны, превращается в положительно заряженный ион (катион).
Запомни! Как правило, ионная связь образуется между атомами металлов и атомами неметаллов.
Например, на рисунке сверху изображены атомы натрия и фтора. Натрий - щелочной металл, представитель IA группы, имеет всего 1 валентный электрон и проявляет восстановительные свойства (электроотрицательность по шкале Полинга χ(Na)=0,98). Фтор - представитель галогенов (VIIA группа), имеет 7 валентных электронов, является сильным окислителем (χ(F)=4,0). Фтор, будучи более электроотрицательным, "забирает" у атома натрия валентный электрон и превращается в анион, а атом натрия - в катион.
Ионная связь образуется за счет сил электростатического притяжения между разноименно заряженными частицами: катионами и анионами.
Характеристики ионной связи
В отличие от ковалентной связи, ионная связь является ненасыщенной и ненаправленной. Это легко себе представить: ведь взаимодействие ионов в пространстве не зависит от направления, а каждый анион может притягивать к себе несколько катионов.
Следует подчеркнуть, что полностью ионной связи не существует. Корректнее говорить об "ионности", или ионном характере связи. В случае, если разница ЭО составляет более 2 (например, между щелочными металлами и галогенами), происходит почти полная "передача" электрона к более электроотрицательному элементу с образованием соответствующих ионов.
Механизм образования ионной связи
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Происходит полная отдача (принятие) валентных электронов, перекрывание облаков отсутствует, обобществления электронов не наблюдается.
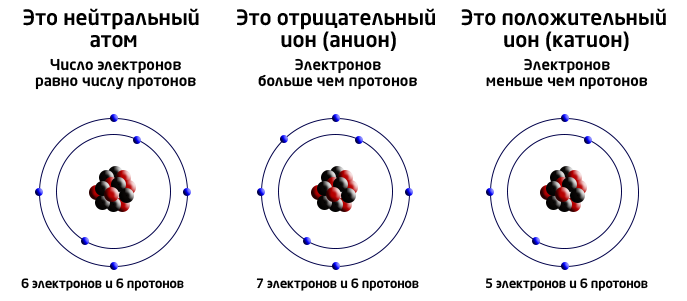
- Ио́н (др.-греч. ἰόν — идущее) — частица, в которой общее число протонов не эквивалентно общему числу электронов.
- Названия ионов
Рассмотрим механизм образования молекулы фторида натрия: NaF – ис.
| Электронная схема образования молекулы NaF | |
|---|---|
| Na +11)2ē)8ē)1ē |
|
| F +9)2ē)7ē |
|
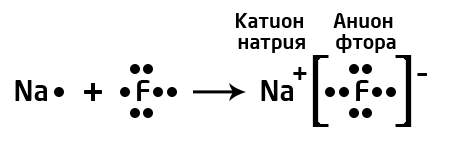
В результате образования связи электронная пара полностью сместилась к атому фтора, разноименно заряженные ионы натрия и фтора притягиваются за счёт электростатического взаимодействия.
-
Механизм образования хлорида натрия:
-
Сравнительная характеристика ковалентной и ионной химической связи
Кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение).
Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка. Точки, в которых размещены частицы, называются узлами кристаллической решетки.
В узлах кристаллической решетки могут находиться ионы, атомы или молекулы.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Глоссарий
- Анионы - отрицательно заряженные ионы.
- Валентность – это способность химического элемента к образованию химической связи.
- Водородная связь - один из видов межмолекулярных связей. Обусловлена в основном электростатическими силами. Для возникновения водородной связи нужно, чтобы в молекуле был один или несколько атомов водорода, связанных с небольшими, но электроотрицательными атомами, например: O, N, F. Важно, чтобы у этих электроотрицательных атомов были неподеленные электронные пары. Водородные связи характерны для таких веществ, как вода H2O, аммиак NH3 , фтороводород HF. Водородная связь приблизительно в 20 раз менее прочная, чем ковалентная. При её возникновении число связей, образуемых атомом водорода, превышает его формальную валентность.
- Донорные свойства - способность атомов элемента отдавать свои электроны другим атомам. Количественной мерой донорных свойств атомов, образующих химическую связь, является их электроотрицательность.
- Ионная связь образуется в результате электростатического притяжения ионов противоположного знака.
- Ионы – частицы, у которых количество электронов больше или меньше положительного заряда ядра.
- Катион – положительно заряженный ион
- Ковалентная химическая связь – связь, которая возникает между атомами за счет образования общих электронных пар.
- Кристаллическая решетка - кристаллическая структура характеризуется правильным (регулярным) расположением частиц в строго определенных точках пространства кристалла. При мысленном соединении этих точек линиями получается пространственный каркас, который называют кристаллической решеткой. Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах могут находиться ионы, атомы или молекулы. Кристаллическая решетка состоит из совершенно одинаковых элементарных ячеек.
- Металлическая связь – связь в металлах или сплавах, обусловленная взаимодействием относительно свободных электронов с катионами в узлах кристаллической решетки.
- Металлы – твердые при комнатной температуре вещества (за исключением ртути), с металлическим блеском, высокой тепло- и электропроводностью. Атомы металлов отдают электроны, образуя при этом положительно заряженные ионы.
- Неметаллы – вещества, состоящие из молекул: газы, жидкости, летучие твердые вещества; не обладают металлическим блеском, имеют низкую тепло- и электропроводность. Атомы неметаллов принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы.
- Степень окисления – формальный заряд атома, вычисленный исходя из предположения, что все связи между атомами в молекуле ионные.
- Электроотрицательность – способность элемента оттягивать на себя электронную пару.
Полезные ссылки
Немецкий физикохимик Рихард Вильгельм Генрих Абегг родился в Данциге (ныне Гданьск, Польша).
Областью научных интересов Абегга являлись неорганическая и физическая химия. Исследовал скорость диффузии в растворах солей и электропроводность расплавленных солей. Совместно с немецким химиком Ф. Ауэрбахом с 1905 г. начал издавать многотомный справочник «Руководство по неорганической химии». Главной заслугой Абегга стало создание первых представлений о связи между атомами, учитывающих сложное строение атома. В 1899 г. Абегг совместно со своим коллегой Гвидо Бодлендером высказал идею о сродстве атомов к электрону – способности атомов присоединять электрон.
На основе этого принципа электросродства Абегг в 1902–1904 гг. разрабатывает теорию электровалентности. Валентностью, по мнению Абегга, обладают ионы, и величина валентности равна заряду иона. Каждый элемент характеризуется двумя максимальными валентностями – положительной и отрицательной; сумма этих валентностей равна восьми (т.н. правило Абегга). Одна из них, производящая более сильное действие, «нормальная», другая – «контрвалентность». Принцип электросродства и теория электровалентности Абегга заложили основу для более поздних теорий химической связи, которые создали Вальтер Коссель, Джилберт Льюис и Ирвинг Ленгмюр.