Химия: Первоначальные химические представления — различия между версиями
Admine2 (обсуждение | вклад) (Новая страница: «__NOTOC__ <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> {{Якорь|Начало}} <div class="row show-for-la…») |
Admine2 (обсуждение | вклад) |
||
| (не показано 111 промежуточных версий 2 участников) | |||
| Строка 1: | Строка 1: | ||
| − | |||
| − | |||
| − | |||
{{Якорь|Начало}} | {{Якорь|Начало}} | ||
| − | <div class="row | + | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> |
| − | <div class="large- | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
==Что изучает химия?== | ==Что изучает химия?== | ||
<div class="textblock">{{center|'''Химия''' - ''наука о веществах, их свойствах, изменениях этих свойств и явлениях, сопровождающих эти изменения.''}}</div> | <div class="textblock">{{center|'''Химия''' - ''наука о веществах, их свойствах, изменениях этих свойств и явлениях, сопровождающих эти изменения.''}}</div> | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | <ul class="small-block-grid-1 large-block-grid-2"> | |
| − | + | <li> | |
| − | + | {{center|[[Файл:Predmet himii.mp4|400px]]}} | |
| − | + | </li> | |
| − | + | <li> | |
| − | + | {{center|[[Файл:Rolik1.mp4|400px|start=5]]}} | |
| − | + | </li> | |
| − | + | </ul> | |
| − | + | ||
| − | + | <div class="show-for-large-up">{{right-p|[[Файл:Kilo1.png|180px|Эталон килограмма – это брусок из сплава золота и иридия, хранящийся под стеклянным колпаком в Музее килограмма в г. Севр, 60 км от Парижа, Франция]]|Эталон килограмма – это брусок из сплава золота и иридия, хранящийся под стеклянным колпаком в Музее килограмма в г. Севр, 60 км от Парижа, Франция}}</div> | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Физические и химические явления == | == Физические и химические явления == | ||
==== Физические явления ==== | ==== Физические явления ==== | ||
Кроме физических свойств, каждое вещество обладает способностью к превращению. Что же такое превращение веществ? | Кроме физических свойств, каждое вещество обладает способностью к превращению. Что же такое превращение веществ? | ||
| − | Представьте, что мы нагрели воду и она испарилась. Произошло ли при этом превращение вещества? Нет, испарение воды – это физическое явление. Водяной пар – это химическое вещество вода, только не в жидком, а газообразном агрегатном состоянии. | + | Представьте, что мы нагрели воду, и она испарилась. Произошло ли при этом превращение вещества? Нет, испарение воды – это физическое явление. Водяной пар – это химическое вещество вода, только не в жидком, а газообразном агрегатном состоянии. |
Физические явления – это явления, при которых данные вещества не превращаются в другие, а только изменяется их агрегатное состояние или форма. | Физические явления – это явления, при которых данные вещества не превращаются в другие, а только изменяется их агрегатное состояние или форма. | ||
| − | <div class="show-for-small-only">{{center|[[Файл:Kilo1.png|180px]] | + | <div class="show-for-small-only">{{center-p|[[Файл:Kilo1.png|180px|Эталон килограмма – это брусок из сплава золота и иридия, хранящийся под стеклянным колпаком в Музее килограмма в г. Севр, 60 км от Парижа, Франция]]|Эталон килограмма – это брусок из сплава золота и иридия, хранящийся под стеклянным колпаком в Музее килограмма в г. Севр, 60 км от Парижа, Франция}}</div> |
==== Химические явления или химические реакции ==== | ==== Химические явления или химические реакции ==== | ||
Возьмем другой пример – ржавление железа. Железо ржавеет при взаимодействии с водой и кислородом. Ржавчина – хрупкое вещество бурого цвета. Таким образом, происходит превращение веществ – железа, кислорода и воды – в ржавчину. Это явление относится к химическим. Химические явления иначе называют химическими реакциями. | Возьмем другой пример – ржавление железа. Железо ржавеет при взаимодействии с водой и кислородом. Ржавчина – хрупкое вещество бурого цвета. Таким образом, происходит превращение веществ – железа, кислорода и воды – в ржавчину. Это явление относится к химическим. Химические явления иначе называют химическими реакциями. | ||
| Строка 73: | Строка 31: | ||
Вещества, получающиеся в результате реакции (в данном случае – ржавчина), называют продуктами реакции. | Вещества, получающиеся в результате реакции (в данном случае – ржавчина), называют продуктами реакции. | ||
| + | |||
| + | ====='''Вывод'''===== | ||
<div class="textblock"> | <div class="textblock"> | ||
| − | |||
При физическом явлении изменения вещества не происходит, а изменяется лишь его агрегатное состояние или форма. В результате химической реакции происходит превращение исходных веществ в продукты реакции. </div> | При физическом явлении изменения вещества не происходит, а изменяется лишь его агрегатное состояние или форма. В результате химической реакции происходит превращение исходных веществ в продукты реакции. </div> | ||
<br clear=all /> | <br clear=all /> | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Характеристика веществ == | == Характеристика веществ == | ||
| − | <div class=" | + | <div class="hide-for-small-only">{{right-p|[[Файл:Wertr.jpg|150px|Один из трех токамаков сохранился со времен Советского Союза в Бишкеке на Научной станции Российской Академии наук]]}}</div> |
| − | <div class="show-for- | + | <div class="show-for-small-only">{{center-p|[[Файл:Wertr.jpg|250px|Один из трех токамаков сохранился со времен Советского Союза в Бишкеке на Научной станции Российской Академии наук]]}}</div> |
| − | |||
'''Каждое химическое вещество имеет физические характеристики:''' | '''Каждое химическое вещество имеет физические характеристики:''' | ||
| − | : '''1.''' '''Агрегатное состояние.''' Твердое, жидкое, газообразное и состояние плазмы ( | + | : '''1.''' '''Агрегатное состояние.''' Твердое, жидкое, газообразное и состояние плазмы (токамак – прибор для получения плазмы). |
| − | : '''2.''' '''Цвет.''' У металлов цвет бывает от серебристо-светлого, до темно-серого, с синеватым отливом или красновато - желтого цвета | + | : '''2.''' '''Цвет.''' У металлов цвет бывает от серебристо-светлого, до темно-серого, с синеватым отливом, или красновато-желтого цвета. Неметаллы бывают бесцветные (кислород, азот), белые (фосфор), желтые, (сера, хлор) красноватые (фосфор), зеленоватые (фтор) или серо–фиолетовые (иод). |
| − | : '''3.''' '''Плотность.''' Среди металлов самый легкий литий – 0,53 г/см<sup>3</sup> , самый тяжелый – осмий - 22, 7 г/см<sup>3</sup> . | + | : '''3.''' '''Плотность.''' Среди металлов самый легкий литий – 0,53 г/см<sup>3</sup>, самый тяжелый – осмий - 22, 7 г/см<sup>3</sup>. |
| + | <div class="textblock">Легкими считают металлы с плотностью до 5 г/см<sup>3</sup>, тяжелыми – после 5 г/см<sup>3</sup></div> | ||
: '''4.''' '''Теплопроводность и электропроводность.''' На практике наиболее часто используют медь и алюминий, хотя у серебра и золота преимущества, но они дороги. | : '''4.''' '''Теплопроводность и электропроводность.''' На практике наиболее часто используют медь и алюминий, хотя у серебра и золота преимущества, но они дороги. | ||
: '''5.''' '''Температура плавления и кипения''' (смотри индивидуальные характеристики) | : '''5.''' '''Температура плавления и кипения''' (смотри индивидуальные характеристики) | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
== Чистые вещества и смеси == | == Чистые вещества и смеси == | ||
| − | Чистыми считают вещества, у которых постоянные физические характеристики ''( | + | Чистыми считают вещества, у которых постоянные физические характеристики ''(температуры плавления, кипения).'' |
Абсолютно чистых веществ не бывает в силу контакта их между собой. От степени очистки вещества зависят свойства этих веществ. | Абсолютно чистых веществ не бывает в силу контакта их между собой. От степени очистки вещества зависят свойства этих веществ. | ||
| Строка 116: | Строка 57: | ||
Определение понятия «смесь» было дано в XVII в. английским ученым '''Робертом Бойлем:''' ''«Смесь – целостная система, состоящая из разнородных компонентов».'' | Определение понятия «смесь» было дано в XVII в. английским ученым '''Робертом Бойлем:''' ''«Смесь – целостная система, состоящая из разнородных компонентов».'' | ||
| − | '''Смеси''' – бывают однородные, когда ни глазами, ни под микроскопом нельзя различить вещества, составляющие смесь (растворы) или '''неоднородные''', когда компоненты смеси можно различить глазами или с помощью приборов. | + | '''Смеси''' – бывают однородные, когда ни глазами, ни под микроскопом нельзя различить вещества, составляющие смесь (растворы), или '''неоднородные''', когда компоненты смеси можно различить глазами или с помощью приборов. |
'''Различают вещества:''' | '''Различают вещества:''' | ||
| Строка 130: | Строка 71: | ||
Хроматографически чистые - без следов других веществ. | Хроматографически чистые - без следов других веществ. | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | == Способы | + | == Способы разделения смесей химических веществ == |
| − | {{center|[[Файл: | + | {{center|[[Файл:Razdelenie smesei.mp4|750px]]}} |
<br> | <br> | ||
| − | {| | + | {{center|[[Файл:Razdel smesei Infographic.png|750px|Способы разделения смесей]]}} |
| − | | | + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | == Атомы и молекулы. Атомно–молекулярное учение == | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | == Атомы и молекулы. | ||
=== Возникновение представлений об атомах и молекулах === | === Возникновение представлений об атомах и молекулах === | ||
| − | + | {{left-p|[[file:Demokrit.jpg|150px|class=show-for-large-up|Древнегреческий философ Демокрит]]}} | |
| − | + | {{center-p|[[file:Demokrit.jpg|250px|class=hide-for-large-up|Древнегреческий философ Демокрит]]}} | |
| − | |||
Древнегреческий философ Демокрит 2500 лет назад высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов. Слово ''“атом”'' в переводе означает ''“неделимый”''. Позднее, в средние века, учение об атомах преследовалось религией, которая тормозила развитие науки в целом, и химии в частности. | Древнегреческий философ Демокрит 2500 лет назад высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов. Слово ''“атом”'' в переводе означает ''“неделимый”''. Позднее, в средние века, учение об атомах преследовалось религией, которая тормозила развитие науки в целом, и химии в частности. | ||
| − | Учение о молекулах и атомах было | + | Учение о молекулах и атомах было развито в середине XVIII века великим русским ученым Михаилом Васильевичем Ломоносовым (1711 – 1765 гг.) Он утверждал, что тела в природе состоят из корпускул (молекул), в состав которых входят элементы (атомы). |
<br clear=all /> | <br clear=all /> | ||
| + | |||
=== Молекулы и атомы === | === Молекулы и атомы === | ||
| − | + | {{right-p|[[file:Gidroliz vod2.png|220px|class=show-for-large-up|Схема аппарата для разложения воды (аппарат Гофмана)]]}} {{right-p|[[file:Gidroliz vod.png|200px|class=show-for-large-up|Схема аппарата для разложения воды (аппарат Гофмана)]]}} | |
| − | + | {{center|[[file:Gidroliz vod2.png|220px|class=hide-for-large-up|Схема аппарат для разложения воды (аппарат Гофмана)]]}} <br> {{center|[[file:Gidroliz vod.png|200px|class=hide-for-large-up|Схема аппарат для разложения воды (аппарат Гофмана)]]}} | |
| − | |||
То, что атомы действительно существуют, подтверждают многие химические реакции. Так, например, при пропускании постоянного тока через воду в одной из трубок прибора собирается газ, в котором тлеющая лучинка ярко вспыхивает. '''Это кислород.''' | То, что атомы действительно существуют, подтверждают многие химические реакции. Так, например, при пропускании постоянного тока через воду в одной из трубок прибора собирается газ, в котором тлеющая лучинка ярко вспыхивает. '''Это кислород.''' | ||
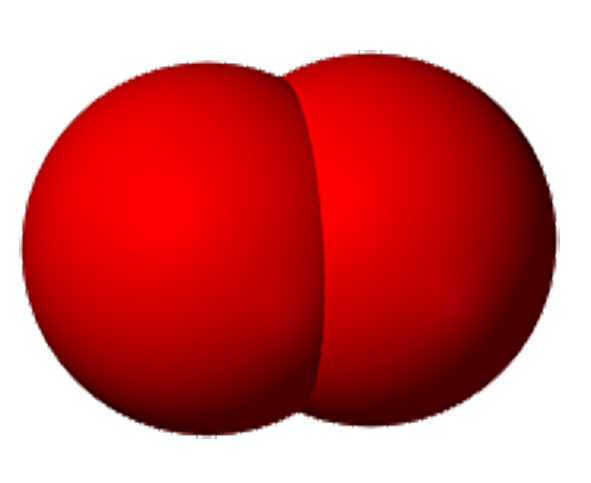
| Строка 180: | Строка 94: | ||
В другой трубке собирается вдвое больше газа, который от зажженной лучинки загорается. '''Это водород.''' | В другой трубке собирается вдвое больше газа, который от зажженной лучинки загорается. '''Это водород.''' | ||
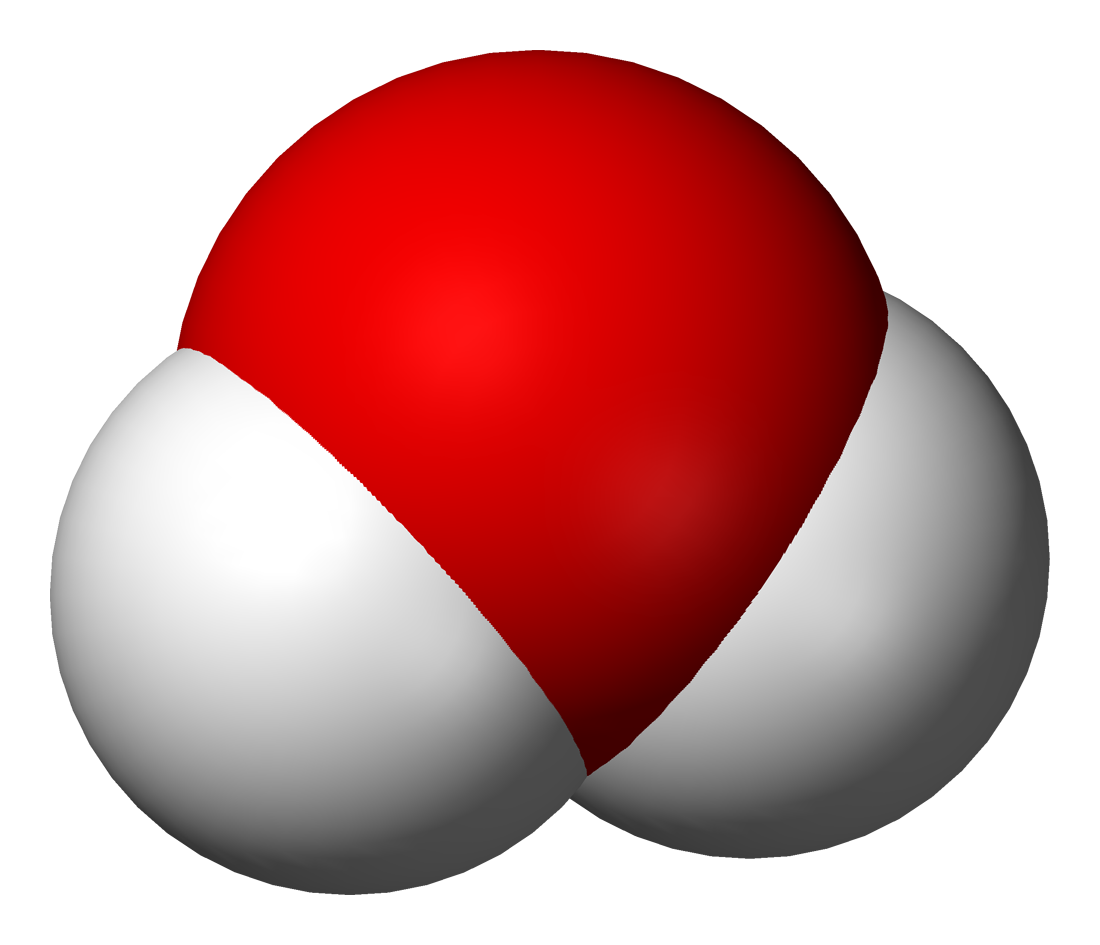
| − | {{center|[[file: | + | {{center|[[file:Molekula vod 2.png|500px|Модель молекулы воды]]}} |
| − | Объяснить это явление можно так. Мельчайшая частица воды – молекула состоит из 2 атомов водорода и одного атома кислорода. При пропускании постоянного тока через воду ее молекулы распадаются и образуются химически неделимые частицы – атомы кислорода и водорода. | + | Объяснить это явление можно так. Мельчайшая частица воды – молекула – состоит из 2 атомов водорода и одного атома кислорода. При пропускании постоянного тока через воду ее молекулы распадаются и образуются химически неделимые частицы – атомы кислорода и водорода. |
| − | Затем атомы соединяются по два, и из двух молекул воды образуется одна – двухатомная молекула кислорода и две водорода. | + | Затем атомы соединяются по два, и из двух молекул воды образуется одна – двухатомная молекула кислорода и две двухатомные молекулы водорода. |
| − | {{center|[[file: | + | {{center|[[file:Molekula vod 1.png|500px|Модель молекулы воды]]}} |
Итак, что такое молекулы и атомы? | Итак, что такое молекулы и атомы? | ||
| − | <div class="textblock">'''Молекулы''' – | + | <div class="textblock">'''Молекулы''' – наименьшие частицы вещества, сохраняющие его химические свойства. (У одной молекулы физических свойств еще нет.)</div> |
| + | <br> | ||
| + | <div class="textblock">'''Атомы''' – мельчайшие частицы, обладающие способностью вступать в химические реакции.</div> | ||
<br> | <br> | ||
| − | ''' | + | {{center|'''Молекула Атом Вещество'''}} |
| − | + | {{center|[[file:Atom veshestvo.mp4|500px]]}} | |
| − | {{center|[[file: | ||
=== Атомно-молекулярное учение === | === Атомно-молекулярное учение === | ||
| − | <div class="show-for-large-up">{{right|[[file: | + | <div class="show-for-large-up">{{right-p|[[file:Lomanosov.jpg|150px|Ломоносов, Михаил Васильевич]]}}</div> |
| − | <div class="show-for- | + | <div class="show-for-small-only">{{center-p|[[file:Lomanosov.jpg|250px|Ломоносов, Михаил Васильевич]]}}</div> |
| − | |||
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям. | Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям. | ||
| Строка 208: | Строка 122: | ||
'''4.''' Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов. | '''4.''' Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов. | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
== Простые и сложные вещества == | == Простые и сложные вещества == | ||
| + | По элементному составу различают простые вещества, состоящие из атомов одного элемента (H<sub>2</sub>, O<sub>2</sub>,Cl<sub>2</sub>, P<sub>4</sub>, Na, Cu, Au), и сложные вещества, состоящие из атомов разных элементов (H<sub>2</sub>O,NH<sub>3</sub>, OF<sub>2</sub>, H<sub>2</sub>SO<sub>4</sub>, MgCl<sub>2</sub>,K<sub>2</sub>SO<sub>4</sub>). | ||
| − | + | {{center-p|[[file:Gorenie saxaroz.png|550px|Процесс разложения сахарозы]]}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | При нагревании в пламени пробирки с сахарозой (C<sub>12</sub>H<sub>22</sub>O<sub>11</sub>) сначала сахароза плавится и темнеет, а затем разлагается и чернеет за счет образования угля. | |
| − | + | {{center-p|[[file:Prostoe i slojnoe vesh.png|550px|Простое и сложное вещество]]|Простое и сложное вещество}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
<div class="textblock><big>'''ВЫВОД:'''</big><br> | <div class="textblock><big>'''ВЫВОД:'''</big><br> | ||
| − | + | Сахароза - сложное вещество. Вода - сложное вещество. Уголь - простое вещество. Водород - простое вещество. Кислород - простое вещество.</div> | |
'''Простые''' – молекулы таких веществ состоят из атомов одного вида. В химических реакциях не могут разлагаться с образованием нескольких более простых веществ. | '''Простые''' – молекулы таких веществ состоят из атомов одного вида. В химических реакциях не могут разлагаться с образованием нескольких более простых веществ. | ||
| Строка 236: | Строка 140: | ||
<br clear=all /> | <br clear=all /> | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
== Понятие о химических элементах == | == Понятие о химических элементах == | ||
| + | В химии кроме терминов '''“атом”''' и '''“молекула”''' часто употребляется понятие '''“элемент”'''. | ||
| + | |||
| + | <div class="textblock">Химический элемент – это атомы одного и того же вида.</div> | ||
| + | |||
| + | Так, например, все атомы водорода – это элемент водород; все атомы кислорода и ртути – соответственно элементы кислород и ртуть. | ||
| + | |||
| + | В настоящее время известно 118 видов атомов, то есть более 118 химических элементов, которые образуют около 500 простых веществ. | ||
<ul class="large-block-grid-2 small-block-grid-1"> | <ul class="large-block-grid-2 small-block-grid-1"> | ||
| − | <li>{{center|[[file: | + | <li>{{center-p|[[file:Dalton.jpg|200px|Джон Дальтон]]}}</li> |
| − | <li>{{center|[[file: | + | <li>{{center-p|[[file:Simvol daltona.jpg|150px|Предложенная Дальтоном система обозначений]]}}</li> |
</ul> | </ul> | ||
Как и в любой науке, в химии существует своя система условных обозначений, свой язык. | Как и в любой науке, в химии существует своя система условных обозначений, свой язык. | ||
| − | В | + | В XIX в. появилась необходимость использования понятной для всех ученых символики. И одним из первых такую символику предложил Джон Дальтон. |
Но его обозначениями было неудобно пользоваться | Но его обозначениями было неудобно пользоваться | ||
| − | + | ||
=== Система обозначения химических элементов === | === Система обозначения химических элементов === | ||
<ul class="large-block-grid-2 small-block-grid-1"> | <ul class="large-block-grid-2 small-block-grid-1"> | ||
| − | <li>{{center|[[file: | + | <li>{{center-p|[[file:Bercelius.jpg|200px|Берцелиус, Йёнс Якоб]]}}</li> |
| − | <li>По предложению шведского химика Й.Я. Берцелиуса в начале | + | <li>По предложению шведского химика Й.Я. Берцелиуса в начале XIX века в качестве символов были приняты одна или две начальные буквы латинских названий химических элементов.</li> |
</ul> | </ul> | ||
<div class="textblock"> | <div class="textblock"> | ||
| Строка 262: | Строка 174: | ||
|- | |- | ||
|Водород | |Водород | ||
| − | | | + | |<span style="color:red">H</span>ydrogenium |
| − | |H | + | |<span style="color:red">H</span> |
|- | |- | ||
|Ртуть | |Ртуть | ||
| − | | | + | |<span style="color:red">H</span>ydrar<span style="color:red">g</span>yrum |
| − | |Hg | + | |<span style="color:red">Hg</span> |
|} | |} | ||
</li> | </li> | ||
| Строка 324: | Строка 236: | ||
|} | |} | ||
</li> | </li> | ||
| − | + | <li> | |
| + | <br> | ||
{|class="tbtext mw-datatable" align="center" | {|class="tbtext mw-datatable" align="center" | ||
|+Произношение некоторых знаков соответствует их латинскому названию: | |+Произношение некоторых знаков соответствует их латинскому названию: | ||
| Строка 351: | Строка 264: | ||
</ul> | </ul> | ||
| − | == | + | == Химические элементы == |
1) Отражение свойств: Водород - рождающий воду; Фосфор – несущий свет; Кислород – рождающий кислоты. | 1) Отражение свойств: Водород - рождающий воду; Фосфор – несущий свет; Кислород – рождающий кислоты. | ||
| Строка 362: | Строка 275: | ||
5) В честь ученых: Кюрий; Эйнштейний; Лоуренсий. | 5) В честь ученых: Кюрий; Эйнштейний; Лоуренсий. | ||
| − | <div class="textblock"> | + | <div class="textblock">Совокупность атомов с одинаковым зарядом ядра называется химическим элементом.</div> |
'''Различие понятий “химический элемент” и “простое вещество”''' | '''Различие понятий “химический элемент” и “простое вещество”''' | ||
| Строка 368: | Строка 281: | ||
Отличить понятия “химический элемент” и “простое вещество” можно при сравнении свойств простых и сложных веществ. Например, простое вещество – кислород – бесцветный газ, необходимый для дыхания, поддерживающий горение. Мельчайшая частица простого вещества кислорода – молекула, которая состоит из двух атомов. Кислород входит также в состав оксида углерода (угарный газ) и воды. | Отличить понятия “химический элемент” и “простое вещество” можно при сравнении свойств простых и сложных веществ. Например, простое вещество – кислород – бесцветный газ, необходимый для дыхания, поддерживающий горение. Мельчайшая частица простого вещества кислорода – молекула, которая состоит из двух атомов. Кислород входит также в состав оксида углерода (угарный газ) и воды. | ||
<ul class="large-block-grid-4 small-block-grid-2"> | <ul class="large-block-grid-4 small-block-grid-2"> | ||
| − | <li>{{center|[[file: | + | <li>{{center-p|[[file:Voda.png|110px|Вода]]}}</li> |
| − | <li>{{center|[[file: | + | <li>{{center-p|[[file:Vodorod.png|100px|Водород]]}}</li> |
| − | <li>{{center|[[file: | + | <li>{{center-p|[[file:Kislorod.png|100px|Кислород]]}}</li> |
| − | <li>{{center|[[file: | + | <li>{{center-p|[[file:Ugarni gaz.png|115px|Углекислый газ или оксид углерода (IV)]]}}</li> |
</ul> | </ul> | ||
| − | + | {{left-p|[[file:Kislorod v vode.jpg|250px|class=show-for-large-up|Кислород в воде]]}} | |
| − | + | {{center|[[file:Kislorod v vode.jpg|250px|class=hide-for-large-up|Кислород в воде]]}} | |
| − | |||
Однако, в состав воды и оксида углерода входит химически связанный кислород, который не обладает свойствами простого вещества, в частности он не может быть использован для дыхания. Рыбы, например, дышат не химически связанным кислородом, входящим в состав молекулы воды, а свободным, растворенным в ней. | Однако, в состав воды и оксида углерода входит химически связанный кислород, который не обладает свойствами простого вещества, в частности он не может быть использован для дыхания. Рыбы, например, дышат не химически связанным кислородом, входящим в состав молекулы воды, а свободным, растворенным в ней. | ||
| − | Поэтому, когда речь идет о составе | + | Поэтому, когда речь идет о составе каких–либо химических соединений, следует понимать, что в эти соединения входят не простые вещества, а атомы определенного вида, то есть соответствующие элементы. |
| − | При разложении сложных веществ, атомы могут выделяться в свободном состоянии и соединяясь, образовывать простые вещества. Простые вещества состоят из атомов одного элемента. Различие понятий «химический элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент может образовывать несколько простых веществ. Например, атомы элемента кислорода могут образовать двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно различные простые вещества. | + | При разложении сложных веществ, атомы могут выделяться в свободном состоянии и, соединяясь, образовывать простые вещества. Простые вещества состоят из атомов одного элемента. Различие понятий «химический элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент может образовывать несколько простых веществ. Например, атомы элемента кислорода могут образовать двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно различные простые вещества. |
<ul class="large-block-grid-2 small-block-grid-1"> | <ul class="large-block-grid-2 small-block-grid-1"> | ||
| − | <li>{{center|[[file: | + | <li>{{center-p|[[file:Kislorod.png|250px|Кислород]]}}</li> |
| − | <li>{{center|[[file: | + | <li>{{center-p|[[file:Ozon.png|250px|Озон]]}}</li> |
</ul> | </ul> | ||
Этим объясняется тот факт, что простых веществ известно гораздо больше, чем химических элементов. | Этим объясняется тот факт, что простых веществ известно гораздо больше, чем химических элементов. | ||
| − | |||
| − | Простыми | + | Пользуясь понятием '''«химический элемент»''', можно дать такое определение простым и сложным веществам: |
| + | <div class="textblock"> | ||
| + | Простыми веществами называются такие вещества, которые состоят из атомов одного химического элемента, их молекулы могут состоять из одного атома, например гелий (He), двух атомов - кислород (O2); трех атомов - озон (О3). </div> | ||
| − | Сложными называют такие вещества, которые состоят из атомов разных химических элементов. | + | Кислород и озон - это аллотропные видоизменения простого вещества, основанные на разном количестве атомов в составе молекулы и имеющие разные свойства. Явление аллотропии может возникать при различных кристаллических решетках в простых веществах, например, графит и алмаз. |
| + | <div class="textblock"> | ||
| + | Сложными называют такие вещества, которые состоят из атомов разных химических элементов. Сложные вещества часто называют химическими соединениями.</div> | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | |||
| − | |||
== Глоссарий== | == Глоссарий== | ||
| − | :{{bib|''' | + | :{{bib|'''Аллотропия''' — ''явление существования химического элемента в виде двух или нескольких простых веществ, различных по строению и свойствам. Эти простые вещества, различные по строению и свойствам, называются аллотропными формами или модификациями. Например, графит и алмаз — две аллотропные формы (модификации) углерода, молекулярный кислород и озон — две аллотропные модификации кислорода. При определенных условиях аллотропные модификации могут переходить друг в друга.''}} |
| − | :{{bib|''' | + | :{{bib|'''Атом''' - ''мельчайшая частица химического элемента, сохраняющая его химические свойства. Атом построен из субатомных частиц - протонов, нейтронов, электронов.''}} |
:{{bib|'''Вещество''' – ''материя в состоянии массы.''}} | :{{bib|'''Вещество''' – ''материя в состоянии массы.''}} | ||
| − | :{{bib|''' | + | :{{bib|'''Масса''' - ''свойство объекта. Вес - сила, с которой этот объект притягивается к центру планеты (на космическом корабле в космосе масса сохраняется, а вес стремится к 0 - состояние невесомости)''}} |
| + | :{{bib|'''Материя''' - ''то, из чего состоит окружающий мир.''}} | ||
| + | :{{bib|'''Молекула''' ''(новолат. '''molecula''', уменьшит. от лат. '''moles''' — масса)'' - ''наименьшая частица данного вещества, обладающая его основными химическими свойствами, способная к самостоятельному существованию и состоящая из атомов, соединенных химическими связями.''}} | ||
:{{bib|'''Наука''' – ''система знаний о закономерностях развития природы, общества и мышления.''}} | :{{bib|'''Наука''' – ''система знаний о закономерностях развития природы, общества и мышления.''}} | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
:{{bib|'''Простое вещество<sup>w</sup>''' — ''вещество, состоящее из атомов одного химического элемента: водород, кислород и т. д.''}} | :{{bib|'''Простое вещество<sup>w</sup>''' — ''вещество, состоящее из атомов одного химического элемента: водород, кислород и т. д.''}} | ||
| − | :{{bib|'''Свойства''' — ''совокупность признаков по которым одни вещества отличаются от других, они бывают химическими и физическими.''}} | + | :{{bib|'''Свойства''' — ''совокупность признаков, по которым одни вещества отличаются от других, они бывают химическими и физическими.''}} |
:{{bib|'''Сложное вещество<sup>w</sup>''' — ''вещество, состоящее из атомов разных химических элементов: кислоты, вода и др.''}} | :{{bib|'''Сложное вещество<sup>w</sup>''' — ''вещество, состоящее из атомов разных химических элементов: кислоты, вода и др.''}} | ||
:{{bib|'''Химический элемент''' — ''это определенный вид атомов с одинаковым положительным зарядом ядра.''}} | :{{bib|'''Химический элемент''' — ''это определенный вид атомов с одинаковым положительным зарядом ядра.''}} | ||
| + | :{{bib|'''Химия''' - ''наука о веществах, их свойствах, изменениях этих свойств и явлениях, сопровождающих эти изменения.''}} | ||
| + | :{{bib|'''Эталон''' - ''то, с чем сравнивают.''}} | ||
| + | :{{bib|'''Явления''' - ''изменения, происходящие в природе с веществами.''}} | ||
| + | |||
== Полезные ссылки == | == Полезные ссылки == | ||
| − | {{bib| | + | {{bib|«Химия как часть естествознания. Понятие о веществах»: Сайт "Химуля.com " [Электронный ресурс]//URL: https://sites.google.com/site/himulacom/zvonok-na-urok/8-klass (дата обращения: 04.03.2018)}} |
| − | + | {{bib|«100 интересных фактов о химии»: Сайт «100-Фактов.Ру» [Электронный ресурс]//URL: http://100-faktov.ru/100-interesnyx-faktov-o-ximii/ (дата обращения: 10.09.2017)}} | |
| − | {{bib| | + | {{bib|«Интересные факты о химии+Видео»: Сайт VSEfACTY.сом Интересные факты [Электронный ресурс]//URL: http://vsefacty.com/fact/interesnye-fakty-o-himii-video (дата обращения: 04.03.2018)}} |
| − | {{bib|http://vsefacty.com/fact/interesnye-fakty-o-himii-video}} | + | {{bib|Видео «Предмет химии Вещества» : Сайт «Видеоуроки в интернете» [Электронный ресурс]//URL: https://youtu.be/tL2xR-oqssU (дата обращения: 04. 03.2018)}} |
| − | {{bib|https://youtu.be/tL2xR-oqssU}} | + | {{bib|Видео «Разделение смесей»: Сайт «Chemistry Program» [Электронный ресурс]//URL: https://youtu.be/bzlLeGvEOpI (дата обращения: 04.03.2018)}} |
| − | {{bib|https://youtu.be/bzlLeGvEOpI}} | + | {{bib|Видео «Бумажная хромотография»: Сайт «Virtual Museum» [Электронный ресурс]//URL: https://youtu.be/Sl8TOBKVF1g (дата обращения: 04.03.2018)}} |
| − | {{bib|https://youtu.be/Sl8TOBKVF1g}} | + | {{bib|Видео "Разделение неоднородной смеси": Сайт «Eлектроннi книги «Ранок» [Электронный ресурс]//URL: https://youtu.be/CmMEGzN1hTg (дата обращения: 04.03.2018)}} |
| − | {{bib|https://youtu.be/CmMEGzN1hTg}} | + | {{bib|Видео «Опыты по химии. Смеси. Разделение смеси с помощью хроматографии»: Сайт «Видеопособия для школьников» [Электронный ресурс]//URL: https://youtu.be/N9ZgYZ094Jk (дата обращения: 04.03.2018)}} |
| − | {{bib|https://youtu.be/N9ZgYZ094Jk}} | + | {{bib|Видео «Дистилляция воды - физические опыты»: Сайт «Простая наука» [Электронный ресурс]//URL: https://youtu.be/Y-gW34yoWuY (дата обращения: 04.03.2018)}} |
| − | {{bib|https://youtu.be/Y-gW34yoWuY}} | + | {{bib|Видео «Опыты по химии. Разделение смеси веществ с помощью делительной воронки»: Сайт «Видеопособия для школьников» [Электронный ресурс]//URL: https://youtu.be/n5hdUadGi7c (дата обращения: 04.03.2018)}} |
| − | {{bib|https://youtu.be/n5hdUadGi7c}} | + | {{bib|Видео «Молекула Атом Вещество» Сайт « Валерий Бутаков» [Электронный ресурс]//URL: https://youtu.be/MPA-bDRfTLk (дата обращения: 04.03.2018)}} |
| − | {{bib|https://youtu.be/MPA-bDRfTLk}} | + | {{bib|Видео «Chemistry experiment 12 - Thermal decomposition (thermolysis)»: Сайт «koen2all» [Электронный ресурс]//URL:https://youtu.be/uAQFCDisLGg (дата обращения: 04.03.2018)}} |
| − | {{bib|https://youtu.be/uAQFCDisLGg}} | ||
== Бибилиография: == | == Бибилиография: == | ||
| Строка 438: | Строка 350: | ||
<div class="large-4 medium-5 columns"> | <div class="large-4 medium-5 columns"> | ||
<!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | <!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | ||
| − | <div class=" | + | <div class="sbstyle"> |
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric | + | <div class="large-10 small-10 large-centered small-centered columns rubric">Безопасность<br>превыше всего</div> |
</div> | </div> | ||
{{center|[[file:1beso.png|270px]]}}<br> | {{center|[[file:1beso.png|270px]]}}<br> | ||
| Строка 455: | Строка 367: | ||
</div> | </div> | ||
| − | <div class=" | + | <div class="sbstyle"> |
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric" style=" | + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Самые удивительные<br>химические реакции</div> |
</div> | </div> | ||
| − | {{center|[[file: | + | {{center|[[file:Udivit reakcii.mp4|270px]]}} |
</div> | </div> | ||
| − | <div class=" | + | <div class="sbstyle"> |
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric" style=" | + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">5 эффектных физических<br>и химических реакций</div> |
</div> | </div> | ||
| − | {{center|[[file:5 | + | {{center|[[file:5 fizich reakci.mp4|270px]]}} |
</div> | </div> | ||
| − | <div class=" | + | <div class="sbstyle"> |
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric" style=" | + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Любопытные факты</div> |
</div> | </div> | ||
| − | Если 100 млн атомов водорода расположить рядом друг с другом, то они образуют цепочку длиною всего лишь в 1 см. | + | *Если 100 млн атомов водорода расположить рядом друг с другом, то они образуют цепочку длиною всего лишь в 1 см. |
| + | |||
| + | *Шведский ученый Карл Шелле является рекордсменом по количеству открытых химических элементов. На его счету хлор, фтор, барий, вольфрам, кислород, марганец, молибден. | ||
| + | |||
| + | *Множество химических элементов получили своё название в честь стран или других географических объектов. Сразу 4 элемента — иттрий, иттербий, тербий и эрбий — были названы в честь шведской деревни Иттербю, около которой обнаружили крупное месторождение редкоземельных металлов. | ||
| + | |||
| + | *В лампочках используют аргон. | ||
| + | |||
| + | *Самым легким среди благородных газов считается гелий. | ||
| + | |||
| + | *В изумрудах содержится бериллий. | ||
| − | + | *Чтобы огонь покрасить в зеленый цвет, используют бор. | |
| − | + | *Азот может вызвать помутнение сознания. | |
| − | + | *Неон способен светиться красным цветом, когда через него пропустить ток. | |
| − | + | *В океане содержится большое количество натрия. | |
| + | |||
| + | *В компьютерных микросхемах используют кремний. | ||
| + | |||
| + | *Для изготовления спичек используют фосфор. | ||
| + | |||
| + | *Хлор может вызвать аллергические реакции органов дыхания. | ||
| + | </div> | ||
| + | <div class="sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Химия в жизни человека</div> | ||
| + | </div> | ||
| + | {{center|[[file:Chemistry-in-life.jpg|300px|Химия в жизни человека]]}} | ||
| + | Что такое химия? | ||
| − | + | Одна из множества естественных наук, скажет среднестатистический обыватель. Но кто бы мог подумать, проходя мимо полок в магазине, или проезжая мимо заводов и фабрик, что все это — самый настоящий результат химических превращений? | |
| − | + | Нескончаемый каскад реакций дает нам удивительные возможности делать жизнь более комфортной. | |
| + | *Баночки с кремами, тюбики с краской для волос или зубной пастой, йогурты, сыры, пиво — это все результат химических преобразований. | ||
| + | *Нефтедобывающая и нефтеперерабатывающая промышленности основаны на циклах превращений и переходов одних нефтяных компонентов в другие. Бензин имеет множество марок, машинные масла тоже бывают разных сортов. | ||
| + | *Одежда, предметы быта (вплоть до вилок и ножей) – все это – химия. Она дарит нам и красивые праздники, ведь салюты и прочие прелести пиротехники – это тоже химия. Она повсюду, везде и во всем. | ||
| + | *Отправляя космолеты к далеким планетам, первый вопрос, которым задаются ученые: какой химический состав поверхности планеты и её атмосферы? | ||
| + | *Знание химии в медицине является основополагающим. | ||
| + | Биохимический, электролитный, водно-солевой балансы организма – основные показатели и результат правильного течения химических реакций в организме. Наш организм — это большой биохимический реактор. Каждая его клетка может функционировать только при правильном составе элементов внутри себя. Наша ДНК — это набор нуклеотидов, а нуклеотиды – это аминокислоты, то есть химические соединения. Цвет глаз, форма губ, рост, запах – все это химия. | ||
| − | + | Фармакология и фармация — это разделы химии о лекарственных средствах. Лекарства, таблетки, мази и сиропы, даже витамины – все это химические соединения. | |
| − | + | Химия – это одна из наук, скажете вы? Химия – это жизнь, скажу я вам. | |
| + | </div> | ||
| + | <div class="sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">О роли продукции химической промышленности</div> | ||
| + | </div> | ||
| + | {{center|[[file:Chem-prom.jpg|300px|О роли продукции химической промышленности]]}} | ||
| + | Трудно переоценить значение продуктов химической промышленности в жизни современного человека. Многое из того, что нас окружает, чем мы привычно пользуемся в быту, произведено именно благодаря достижениям такой отрасли как химическая промышленность. Невозможно назвать также ни одну отрасль промышленности, где не применялась бы ее продукция: это строительство и машиностроение, легкая промышленность и сельское хозяйство, энергетика и транспорт. | ||
| − | + | <span style="font-weight: bolder;">'''Химическая промышленность и сельское хозяйство'''</span> | |
| − | + | Когда на нашем столе лежит румяная буханка хлеба, говорим «спасибо» хлеборобам, благодаря неустанному труду которых выращена пшеница, из которой он изготовлен. Но в каждой такой буханке хлеба есть и доля труда работников химической промышленности, ведь благодаря их усилиям созданы препараты, при помощи которых обрабатываются поля от сорняков, вредителей и болезней, а также в целях удобрения почвы, чтобы повысить ее урожайность. Только совместный труд химиков и работников сельского хозяйства позволяет получать большие урожаи, которые доходят до конечного потребителя в виде свежей булки, румяных фруктов и сочных овощей. Современное сельское хозяйство немыслимо без применения такой химической продукции, как гербициды (препараты, которые используются для борьбы с сорняками), фунгициды (с их помощью ведется борьба с паразитическими грибками), инсектициды (путем применения этих препаратов уничтожаются вредные насекомые), и многих других веществ, применяемых в качестве средств эффективной защиты культурных растений, выращиваемых на полях и в теплицах, от различных врагов. | |
| − | + | <span style="font-weight: bolder;">Инсектициды</span> | |
| − | + | В настоящее время выпускается три группы инсектицидов, которые различаются характером проникновения и поражения организма насекомого. Это – контактные, кишечные и системные инсектициды. Поражение насекомых контактными инсектицидами происходит благодаря внешнему контакту вредителя с обработанной частью поверхности. Действие кишечных инсектицидов основано на поражении органов питания насекомого ядовитыми составляющими препаратов. Системные инсектициды проникают в клетки обработанных растений и губительно воздействуют на насекомое при поедании отдельных частей растений. | |
| − | </div></div> | + | </div> |
| + | <div class="sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Пройди тестирование</div> | ||
| + | </div> | ||
| + | <div align="center" class="test_div_hover" style="width:300px; height:auto; float:non; text-indent:0"><span class="test_hover_state"></span> [[file:Corbis.jpg|class=testirovanie|Пройди тестирование|link=]]</div> | ||
| + | </div> | ||
| + | </div> | ||
| + | {{lang|:KR:Химия: Алгачкы химиялык түшүнүктɵр}} | ||
[[Category:Средняя школа]] | [[Category:Средняя школа]] | ||
[[Category:Химия]] | [[Category:Химия]] | ||
Текущая версия на 09:42, 22 октября 2018
Содержание
- 1 Что изучает химия?
- 2 Физические и химические явления
- 3 Характеристика веществ
- 4 Чистые вещества и смеси
- 5 Способы разделения смесей химических веществ
- 6 Атомы и молекулы. Атомно–молекулярное учение
- 7 Простые и сложные вещества
- 8 Понятие о химических элементах
- 9 Химические элементы
- 10 Глоссарий
- 11 Полезные ссылки
- 12 Бибилиография:
Что изучает химия?
Физические и химические явления
Физические явления
Кроме физических свойств, каждое вещество обладает способностью к превращению. Что же такое превращение веществ?
Представьте, что мы нагрели воду, и она испарилась. Произошло ли при этом превращение вещества? Нет, испарение воды – это физическое явление. Водяной пар – это химическое вещество вода, только не в жидком, а газообразном агрегатном состоянии.
Физические явления – это явления, при которых данные вещества не превращаются в другие, а только изменяется их агрегатное состояние или форма.
Химические явления или химические реакции
Возьмем другой пример – ржавление железа. Железо ржавеет при взаимодействии с водой и кислородом. Ржавчина – хрупкое вещество бурого цвета. Таким образом, происходит превращение веществ – железа, кислорода и воды – в ржавчину. Это явление относится к химическим. Химические явления иначе называют химическими реакциями.
Вещества, вступающие в химическую реакцию (в рассмотренном примере – это железо, кислород и вода), называют исходными веществами.
Вещества, получающиеся в результате реакции (в данном случае – ржавчина), называют продуктами реакции.
Вывод
Характеристика веществ
Каждое химическое вещество имеет физические характеристики:
- 1. Агрегатное состояние. Твердое, жидкое, газообразное и состояние плазмы (токамак – прибор для получения плазмы).
- 2. Цвет. У металлов цвет бывает от серебристо-светлого, до темно-серого, с синеватым отливом, или красновато-желтого цвета. Неметаллы бывают бесцветные (кислород, азот), белые (фосфор), желтые, (сера, хлор) красноватые (фосфор), зеленоватые (фтор) или серо–фиолетовые (иод).
- 3. Плотность. Среди металлов самый легкий литий – 0,53 г/см3, самый тяжелый – осмий - 22, 7 г/см3.
- 4. Теплопроводность и электропроводность. На практике наиболее часто используют медь и алюминий, хотя у серебра и золота преимущества, но они дороги.
- 5. Температура плавления и кипения (смотри индивидуальные характеристики)
Чистые вещества и смеси
Чистыми считают вещества, у которых постоянные физические характеристики (температуры плавления, кипения).
Абсолютно чистых веществ не бывает в силу контакта их между собой. От степени очистки вещества зависят свойства этих веществ.
Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем: «Смесь – целостная система, состоящая из разнородных компонентов».
Смеси – бывают однородные, когда ни глазами, ни под микроскопом нельзя различить вещества, составляющие смесь (растворы), или неоднородные, когда компоненты смеси можно различить глазами или с помощью приборов.
Различают вещества:
Чистые – 99%
Химически чистые – 99,9%
Чистые для анализа – 99,99%
Особенно чистые – 99,99 9%
Хроматографически чистые - без следов других веществ.
Способы разделения смесей химических веществ
Атомы и молекулы. Атомно–молекулярное учение
Возникновение представлений об атомах и молекулах
Древнегреческий философ Демокрит 2500 лет назад высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов. Слово “атом” в переводе означает “неделимый”. Позднее, в средние века, учение об атомах преследовалось религией, которая тормозила развитие науки в целом, и химии в частности.
Учение о молекулах и атомах было развито в середине XVIII века великим русским ученым Михаилом Васильевичем Ломоносовым (1711 – 1765 гг.) Он утверждал, что тела в природе состоят из корпускул (молекул), в состав которых входят элементы (атомы).
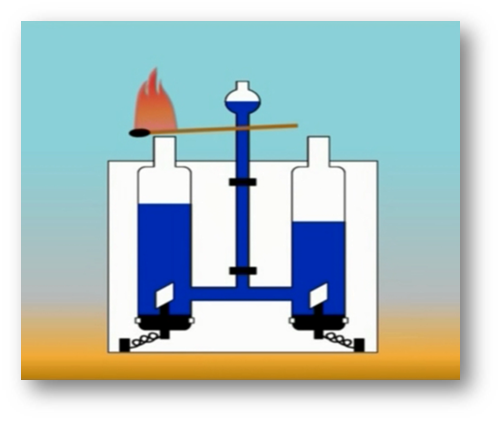
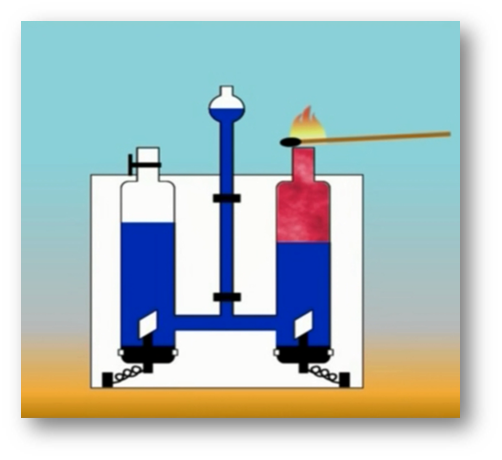
Молекулы и атомы
То, что атомы действительно существуют, подтверждают многие химические реакции. Так, например, при пропускании постоянного тока через воду в одной из трубок прибора собирается газ, в котором тлеющая лучинка ярко вспыхивает. Это кислород.
В другой трубке собирается вдвое больше газа, который от зажженной лучинки загорается. Это водород.
Объяснить это явление можно так. Мельчайшая частица воды – молекула – состоит из 2 атомов водорода и одного атома кислорода. При пропускании постоянного тока через воду ее молекулы распадаются и образуются химически неделимые частицы – атомы кислорода и водорода.
Затем атомы соединяются по два, и из двух молекул воды образуется одна – двухатомная молекула кислорода и две двухатомные молекулы водорода.
Итак, что такое молекулы и атомы?
Атомно-молекулярное учение
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
Простые и сложные вещества
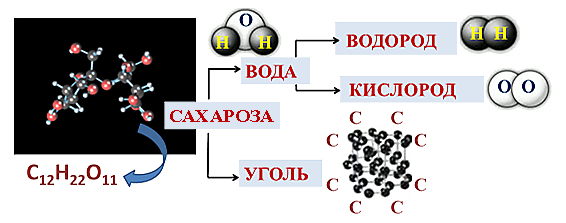
По элементному составу различают простые вещества, состоящие из атомов одного элемента (H2, O2,Cl2, P4, Na, Cu, Au), и сложные вещества, состоящие из атомов разных элементов (H2O,NH3, OF2, H2SO4, MgCl2,K2SO4).
При нагревании в пламени пробирки с сахарозой (C12H22O11) сначала сахароза плавится и темнеет, а затем разлагается и чернеет за счет образования угля.
Сахароза - сложное вещество. Вода - сложное вещество. Уголь - простое вещество. Водород - простое вещество. Кислород - простое вещество.
Простые – молекулы таких веществ состоят из атомов одного вида. В химических реакциях не могут разлагаться с образованием нескольких более простых веществ.
Сложные – молекулы таких веществ состоят из атомов разного вида. В химических реакциях могут разлагаться с образованием более простых веществ.
Понятие о химических элементах
В химии кроме терминов “атом” и “молекула” часто употребляется понятие “элемент”.
Так, например, все атомы водорода – это элемент водород; все атомы кислорода и ртути – соответственно элементы кислород и ртуть.
В настоящее время известно 118 видов атомов, то есть более 118 химических элементов, которые образуют около 500 простых веществ.
Как и в любой науке, в химии существует своя система условных обозначений, свой язык.
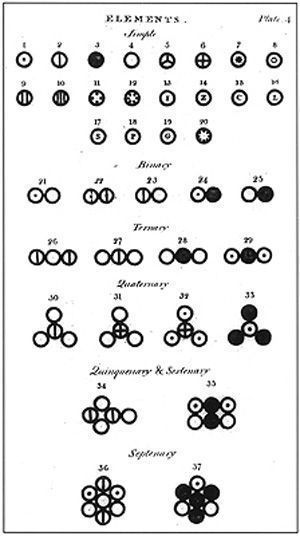
В XIX в. появилась необходимость использования понятной для всех ученых символики. И одним из первых такую символику предложил Джон Дальтон.
Но его обозначениями было неудобно пользоваться
Система обозначения химических элементов
- По предложению шведского химика Й.Я. Берцелиуса в начале XIX века в качестве символов были приняты одна или две начальные буквы латинских названий химических элементов.
-
Название Латинское название Символ Водород Hydrogenium H Ртуть Hydrargyrum Hg - Химический элемент водород (Hydrogenium) – Н. Если названия нескольких элементов начинались на одну и ту же букву, то в символе элемента указывали вторую или одну из последующих букв названия. Например, ртуть (Hydrargyrum) обозначается Hg.
-
Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: Название Символ Название Кислород О О Сера S Эс Азот N Эн Углерод С Це -
Знаки других элементов произносятся так же, как и называются сами элементы: Название Символ Название Натрий Na Натрий Калий K Калий Хлор Cl Хлор Фтор F Фтор -
Произношение некоторых знаков соответствует их латинскому названию: Название Символ Название Кремний Si силициум Ртуть Hg гидраргирум Медь Cu купрум Железо Fe феррум
Химические элементы
1) Отражение свойств: Водород - рождающий воду; Фосфор – несущий свет; Кислород – рождающий кислоты.
2) В честь небесных тел: Селен - Селена (луна); Теллур – Теллурис (Земля).
3) Заимствованы из мифологии: Тантал (сын Зевса)
4) В честь государств: Германий (Германия); Галлий (Франция); Полоний (Польша).
5) В честь ученых: Кюрий; Эйнштейний; Лоуренсий.
Различие понятий “химический элемент” и “простое вещество”
Отличить понятия “химический элемент” и “простое вещество” можно при сравнении свойств простых и сложных веществ. Например, простое вещество – кислород – бесцветный газ, необходимый для дыхания, поддерживающий горение. Мельчайшая частица простого вещества кислорода – молекула, которая состоит из двух атомов. Кислород входит также в состав оксида углерода (угарный газ) и воды.
Однако, в состав воды и оксида углерода входит химически связанный кислород, который не обладает свойствами простого вещества, в частности он не может быть использован для дыхания. Рыбы, например, дышат не химически связанным кислородом, входящим в состав молекулы воды, а свободным, растворенным в ней.
Поэтому, когда речь идет о составе каких–либо химических соединений, следует понимать, что в эти соединения входят не простые вещества, а атомы определенного вида, то есть соответствующие элементы.
При разложении сложных веществ, атомы могут выделяться в свободном состоянии и, соединяясь, образовывать простые вещества. Простые вещества состоят из атомов одного элемента. Различие понятий «химический элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент может образовывать несколько простых веществ. Например, атомы элемента кислорода могут образовать двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно различные простые вещества.
Этим объясняется тот факт, что простых веществ известно гораздо больше, чем химических элементов.
Пользуясь понятием «химический элемент», можно дать такое определение простым и сложным веществам:
Кислород и озон - это аллотропные видоизменения простого вещества, основанные на разном количестве атомов в составе молекулы и имеющие разные свойства. Явление аллотропии может возникать при различных кристаллических решетках в простых веществах, например, графит и алмаз.
Глоссарий
- Аллотропия — явление существования химического элемента в виде двух или нескольких простых веществ, различных по строению и свойствам. Эти простые вещества, различные по строению и свойствам, называются аллотропными формами или модификациями. Например, графит и алмаз — две аллотропные формы (модификации) углерода, молекулярный кислород и озон — две аллотропные модификации кислорода. При определенных условиях аллотропные модификации могут переходить друг в друга.
- Атом - мельчайшая частица химического элемента, сохраняющая его химические свойства. Атом построен из субатомных частиц - протонов, нейтронов, электронов.
- Вещество – материя в состоянии массы.
- Масса - свойство объекта. Вес - сила, с которой этот объект притягивается к центру планеты (на космическом корабле в космосе масса сохраняется, а вес стремится к 0 - состояние невесомости)
- Материя - то, из чего состоит окружающий мир.
- Молекула (новолат. molecula, уменьшит. от лат. moles — масса) - наименьшая частица данного вещества, обладающая его основными химическими свойствами, способная к самостоятельному существованию и состоящая из атомов, соединенных химическими связями.
- Наука – система знаний о закономерностях развития природы, общества и мышления.
- Простое веществоw — вещество, состоящее из атомов одного химического элемента: водород, кислород и т. д.
- Свойства — совокупность признаков, по которым одни вещества отличаются от других, они бывают химическими и физическими.
- Сложное веществоw — вещество, состоящее из атомов разных химических элементов: кислоты, вода и др.
- Химический элемент — это определенный вид атомов с одинаковым положительным зарядом ядра.
- Химия - наука о веществах, их свойствах, изменениях этих свойств и явлениях, сопровождающих эти изменения.
- Эталон - то, с чем сравнивают.
- Явления - изменения, происходящие в природе с веществами.
Полезные ссылки
Бибилиография:
- А. В. Мануйлов, В. И. Родионов.Основы химии. Интернет-учебник.
- Г.В. Пчелкина. Химуля
- 100 интересных фактов о химии.
- Толковый словарь по химии
- «Семьдесят богатырей», А. Ивич; Рис. Э. Беньяминсона, Б. Кыштымова, М. Дет. лит. 1986
химические реакции
и химических реакций
- Если 100 млн атомов водорода расположить рядом друг с другом, то они образуют цепочку длиною всего лишь в 1 см.
- Шведский ученый Карл Шелле является рекордсменом по количеству открытых химических элементов. На его счету хлор, фтор, барий, вольфрам, кислород, марганец, молибден.
- Множество химических элементов получили своё название в честь стран или других географических объектов. Сразу 4 элемента — иттрий, иттербий, тербий и эрбий — были названы в честь шведской деревни Иттербю, около которой обнаружили крупное месторождение редкоземельных металлов.
- В лампочках используют аргон.
- Самым легким среди благородных газов считается гелий.
- В изумрудах содержится бериллий.
- Чтобы огонь покрасить в зеленый цвет, используют бор.
- Азот может вызвать помутнение сознания.
- Неон способен светиться красным цветом, когда через него пропустить ток.
- В океане содержится большое количество натрия.
- В компьютерных микросхемах используют кремний.
- Для изготовления спичек используют фосфор.
- Хлор может вызвать аллергические реакции органов дыхания.
Что такое химия?
Одна из множества естественных наук, скажет среднестатистический обыватель. Но кто бы мог подумать, проходя мимо полок в магазине, или проезжая мимо заводов и фабрик, что все это — самый настоящий результат химических превращений?
Нескончаемый каскад реакций дает нам удивительные возможности делать жизнь более комфортной.
- Баночки с кремами, тюбики с краской для волос или зубной пастой, йогурты, сыры, пиво — это все результат химических преобразований.
- Нефтедобывающая и нефтеперерабатывающая промышленности основаны на циклах превращений и переходов одних нефтяных компонентов в другие. Бензин имеет множество марок, машинные масла тоже бывают разных сортов.
- Одежда, предметы быта (вплоть до вилок и ножей) – все это – химия. Она дарит нам и красивые праздники, ведь салюты и прочие прелести пиротехники – это тоже химия. Она повсюду, везде и во всем.
- Отправляя космолеты к далеким планетам, первый вопрос, которым задаются ученые: какой химический состав поверхности планеты и её атмосферы?
- Знание химии в медицине является основополагающим.
Биохимический, электролитный, водно-солевой балансы организма – основные показатели и результат правильного течения химических реакций в организме. Наш организм — это большой биохимический реактор. Каждая его клетка может функционировать только при правильном составе элементов внутри себя. Наша ДНК — это набор нуклеотидов, а нуклеотиды – это аминокислоты, то есть химические соединения. Цвет глаз, форма губ, рост, запах – все это химия.
Фармакология и фармация — это разделы химии о лекарственных средствах. Лекарства, таблетки, мази и сиропы, даже витамины – все это химические соединения.
Химия – это одна из наук, скажете вы? Химия – это жизнь, скажу я вам.
Трудно переоценить значение продуктов химической промышленности в жизни современного человека. Многое из того, что нас окружает, чем мы привычно пользуемся в быту, произведено именно благодаря достижениям такой отрасли как химическая промышленность. Невозможно назвать также ни одну отрасль промышленности, где не применялась бы ее продукция: это строительство и машиностроение, легкая промышленность и сельское хозяйство, энергетика и транспорт.
Химическая промышленность и сельское хозяйство
Когда на нашем столе лежит румяная буханка хлеба, говорим «спасибо» хлеборобам, благодаря неустанному труду которых выращена пшеница, из которой он изготовлен. Но в каждой такой буханке хлеба есть и доля труда работников химической промышленности, ведь благодаря их усилиям созданы препараты, при помощи которых обрабатываются поля от сорняков, вредителей и болезней, а также в целях удобрения почвы, чтобы повысить ее урожайность. Только совместный труд химиков и работников сельского хозяйства позволяет получать большие урожаи, которые доходят до конечного потребителя в виде свежей булки, румяных фруктов и сочных овощей. Современное сельское хозяйство немыслимо без применения такой химической продукции, как гербициды (препараты, которые используются для борьбы с сорняками), фунгициды (с их помощью ведется борьба с паразитическими грибками), инсектициды (путем применения этих препаратов уничтожаются вредные насекомые), и многих других веществ, применяемых в качестве средств эффективной защиты культурных растений, выращиваемых на полях и в теплицах, от различных врагов.
Инсектициды
В настоящее время выпускается три группы инсектицидов, которые различаются характером проникновения и поражения организма насекомого. Это – контактные, кишечные и системные инсектициды. Поражение насекомых контактными инсектицидами происходит благодаря внешнему контакту вредителя с обработанной частью поверхности. Действие кишечных инсектицидов основано на поражении органов питания насекомого ядовитыми составляющими препаратов. Системные инсектициды проникают в клетки обработанных растений и губительно воздействуют на насекомое при поедании отдельных частей растений.