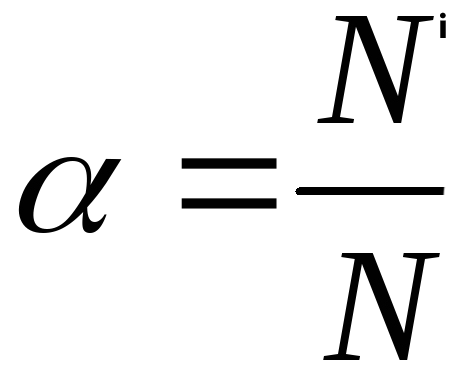Химия: Электролиттик диссоциация — различия между версиями
Admine2 (обсуждение | вклад) (→Иондук алмашуу реакциясы) |
Admine2 (обсуждение | вклад) |
||
| (не показаны 2 промежуточные версии этого же участника) | |||
| Строка 286: | Строка 286: | ||
Бул кɵрсɵткүчтɵрдүн тɵмɵндɵшү же жогорулашы ɵлүмгɵ алып келет. Буфердик эритмелер деп, бир аз ɵлчɵмдɵ кислотаны же щелочту кошсо, суюлтса да суутектик кɵрсɵткүчү '''рН''' ɵзгɵрбɵй, турактуу болгон эритмелерди айтабыз. Буфердик системалар начар негизден жана күчтүү кислотадан пайда болгон же начар кислотадан жана күчтүү негиздерден пайда болгон туздардан турат. | Бул кɵрсɵткүчтɵрдүн тɵмɵндɵшү же жогорулашы ɵлүмгɵ алып келет. Буфердик эритмелер деп, бир аз ɵлчɵмдɵ кислотаны же щелочту кошсо, суюлтса да суутектик кɵрсɵткүчү '''рН''' ɵзгɵрбɵй, турактуу болгон эритмелерди айтабыз. Буфердик системалар начар негизден жана күчтүү кислотадан пайда болгон же начар кислотадан жана күчтүү негиздерден пайда болгон туздардан турат. | ||
| − | {{center|[[file: | + | {{center|[[file:KlasifbufsystemKG.png|600px|Буфердик эритмелердин классификациясы]]}} |
| Строка 301: | Строка 301: | ||
== Гидролиздин мааниси жана колдонулушу == | == Гидролиздин мааниси жана колдонулушу == | ||
Туздардын суу менен болгон алмашуу реакциясы жаратылышта кеңири таралган. | Туздардын суу менен болгон алмашуу реакциясы жаратылышта кеңири таралган. | ||
| − | {{right-p|[[file: | + | {{right-p|[[file:Malahit.png|350px|class=show-for-large-up|Малахит минералы – табийгый карбонаттардын гидролизинен пайда болот]]}} |
Гидролиз кубулушу жер катмарынын химиялык кайрадан ɵзгɵрүүсү үчүн чоң роль ойнойт. Жер катмарындагы кɵптɵгɵн минералдар – металлдардын сульфиддери сууда начар эрийт, бирок, суу менен акырындап аракеттенише баштайт. Мындай процесстер Жердин үстүндɵ да жүрүп турат, бирок, жердин терең катмарында, жогорку температурада өтө кубаттуу жүрɵт. Жыйынтыгында, вулкан учурунда, жердин үстүнɵ кɵп ɵлчɵмдɵ күкүртүү суутек бɵлүнүп чыгат. Ал эми силикат тоо тектери акырындап, гидроксиддерге, андан соң металлдардын оксидине айлана баштайт. Жыйынтыгында, минералдардын гидролизи– алюмосиликаттар пайда болуп, тоо тектери бузула баштайт. | Гидролиз кубулушу жер катмарынын химиялык кайрадан ɵзгɵрүүсү үчүн чоң роль ойнойт. Жер катмарындагы кɵптɵгɵн минералдар – металлдардын сульфиддери сууда начар эрийт, бирок, суу менен акырындап аракеттенише баштайт. Мындай процесстер Жердин үстүндɵ да жүрүп турат, бирок, жердин терең катмарында, жогорку температурада өтө кубаттуу жүрɵт. Жыйынтыгында, вулкан учурунда, жердин үстүнɵ кɵп ɵлчɵмдɵ күкүртүү суутек бɵлүнүп чыгат. Ал эми силикат тоо тектери акырындап, гидроксиддерге, андан соң металлдардын оксидине айлана баштайт. Жыйынтыгында, минералдардын гидролизи– алюмосиликаттар пайда болуп, тоо тектери бузула баштайт. | ||
{{center|[[file:Малахит.png|350px|class=hide-for-large-up|Малахит минералы – табийгый карбонаттардын гидролизинен пайда болот]]}} | {{center|[[file:Малахит.png|350px|class=hide-for-large-up|Малахит минералы – табийгый карбонаттардын гидролизинен пайда болот]]}} | ||
| Строка 498: | Строка 498: | ||
<div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Тестти</div> | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Тестти</div> | ||
</div> | </div> | ||
| − | + | ||
</div> | </div> | ||
</div> | </div> | ||
{{lang|Химия: Электролитическая диссоциация}} | {{lang|Химия: Электролитическая диссоциация}} | ||
Текущая версия на 09:39, 22 октября 2018
Содержание
- 1 Электролиттер жана электролит эместер
- 2 Электролиттик диссоциация теориясы
- 3 Диссоциациянын механизми
- 4 Кислоталардын, негиздердин жана туздардын диссоциациясы
- 5 Диссоциация даражасы
- 6 Иондук алмашуу реакциясы
- 7 Суунун иондук кɵрсɵткүчү. Эритменин pH кɵрсɵткүчү
- 8 Туздардын гидролизи (суунун ажырашы)
- 9 Буфердик эритмелер
- 10 Гидролиздин мааниси жана колдонулушу
- 11 Глоссарий
- 12 Библиография
Электролиттер жана электролит эместер
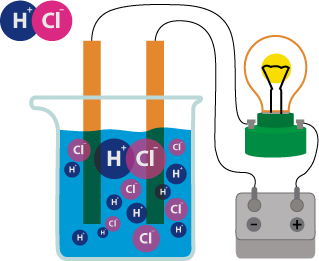
Кээ бир заттардын эриген же балкыган абалда электр тогун ɵткɵрɵ тургандыгы, ал эми башкалары электр тогун ɵткɵрбɵй тургандыгы белгилүү. Муну биз жɵнɵкɵй эле куралдын жардамы менен байкасак болот.
Ал электр тогу менен байланыштырылган кɵмүр электроддорунан турат. Чынжырга токтун бар же жок экендигин кɵрсɵтүүчү электр лампочкасы да туташтырылган. Эгерде электродду канттын эритмесине салсак, анда лампочка күйбɵйт. Ал эми электродду натрий хлоридинин эритмесине салсак, ал жарык болуп күйɵт. Эритмелери же балкыган эритиндилери электр тогунун таасири астында иондорго ажыраган заттар электролиттер деп аталат. Эритмелери электр тогунун таасири астында иондорго ажырабаган заттар электролит эместер деп аталат. Электролиттерге кислоталар, негиздер жана бардык туздар кирет, ал эми электролит эместерге кɵпчүлүк органикалык заттар кирет.
Электролиттик диссоциация теориясы
Электролиттердин эритмелеринин ɵзгɵчɵлүгүн түшүндүрүү максатында, 1887-жылы швед окумуштуусу С. Аррениус электролиттик диссоциация теориясын сунуш кылган. Кийинчерээк бул теория атомдордун түзүлүшү жана химиялык байланыштар жɵнүндɵгү окуунун негизинде, окумуштуулар тарабынан ɵнүктүрүлгɵн. Бул теориянын учурдагы мазмууну тɵмɵнкү үч жободо берилген:
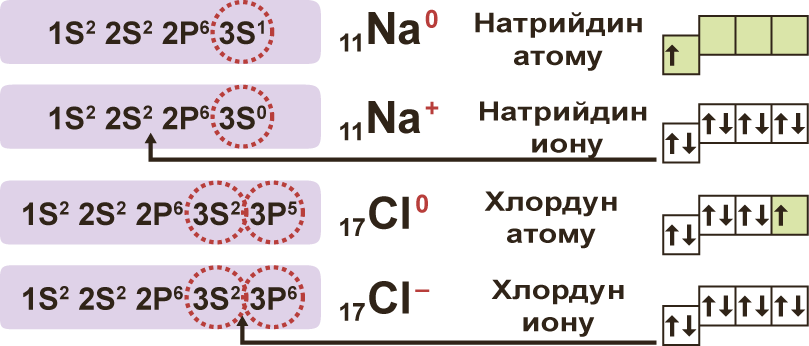
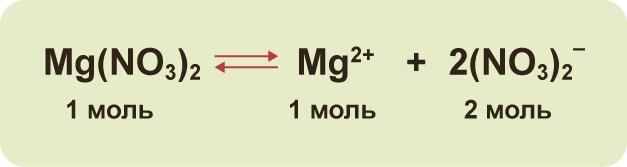
1. Электролиттер сууда эригенде оң жана терс заряддалган иондорго ажырашат (диссоциацияланат). Иондор атомго караганда туруктуу болгон электрондук абалда болушат.
Эгерде бир түрдүү атомдон турса, жɵнɵкɵй ион деп аталат (Na+, Mg2+, Аl3+ ж.б.) болушат. Ал эми ар түрдүү атомдон турса, татаал ион деп аталат (NО3–, SO42–, РО43– ж.б.).
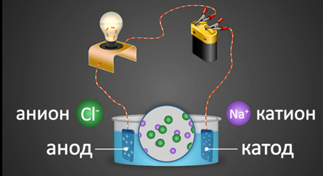
2. Электр тогунун таасири астында иондор багыттуу кыймылга келишет: оң заряддалган иондор катодго тартылат, терс заряддалган иондор анодго тартылат. Ошондуктан, оң заряддалган иондор-катиондор деп, терс заряддалган иондор–аниондор деп аталат. Иондордун багыттуу кыймылы алардын карама–каршы заряддалган электроддорго тартылуусунан келип чыгат.
3. Диссоциация – кайталанма процесс: молекулалардын иондорго ажырашы (диссоциация) менен катар эле иондордун биригүүсү (ассоциация) жүрүп турат. Ошондуктан, электролиттик диссоциациянын теңдемесинде барабардыктын ордуна карама–каршы багытталган жебелер (стрелка) жазылат. Мисалы:
Диссоциациянын механизми
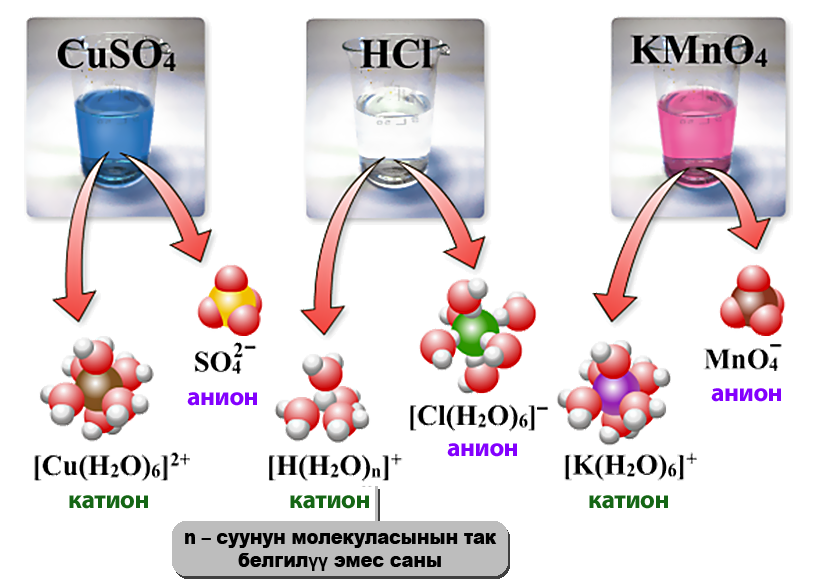
- Электролиттик диссоциациянын механизмин карап кɵрɵлү. Иондук байланыш менен байланышкан заттар жеңил диссоциацияланат, себеби, бул заттар иондордон турат. Алар эригенде, суунун диполу оң жана терс заряддалган иондордун айланасына багыт алат. Иондор менен суунун диполунун ортосунда тартылуу күчү пайда болот. Жыйынтыгында, иондордун ортосундагы байланыш начарлайт да, иондор кристаллдан эритмеге ɵтүшɵт.
Кислоталардын, негиздердин жана туздардын диссоциациясы
Электролиттик диссоциация теориясынын негизинде кислоталарга, негиздерге жана туздарга аныктама берилип, касиеттери белгиленет.
Кɵп негиздүү кислоталардын диссоциациясы биринчи баскычта жакшы жүрɵт, экинчи баскычта азыраак, ал эми үчүнчүдɵ бир аз гана жүрɵт. Ошондуктан, фосфор кислотасы диссоциацияланганда, H3РO4 молекуласынан башка иондорго да ажырайт (акырындык саны менен азаят).
| H3РO4 |
дигидрофосфат иону; (биринчи баскыч) |
| H2РO4– |
гидрофосфат иону; (экинчи баскыч) |
| РO42– |
фосфат иону; (үчүнчү баскыч) |
Диссоциация даражасы
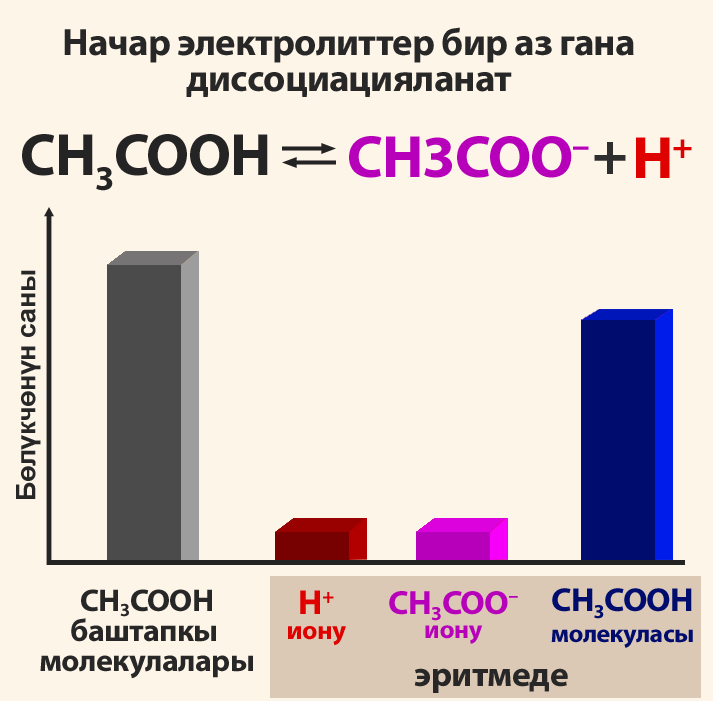
Электролиттик диссоциация – кайталанма процесс болгондуктан, электролиттердин эритмесинде иондордон сырткары молекулалар да болот. Ошондуктан, электролиттердин эритмеси диссоциация даражасы менен мүнɵздɵлɵт (грек тамгасы альфа α менен белгиленет.). Диссоциация даражасы – бул иондорго ажыраган молекулардын санынын Ni молекуланын жалпы санына N болгон катышына барабар:
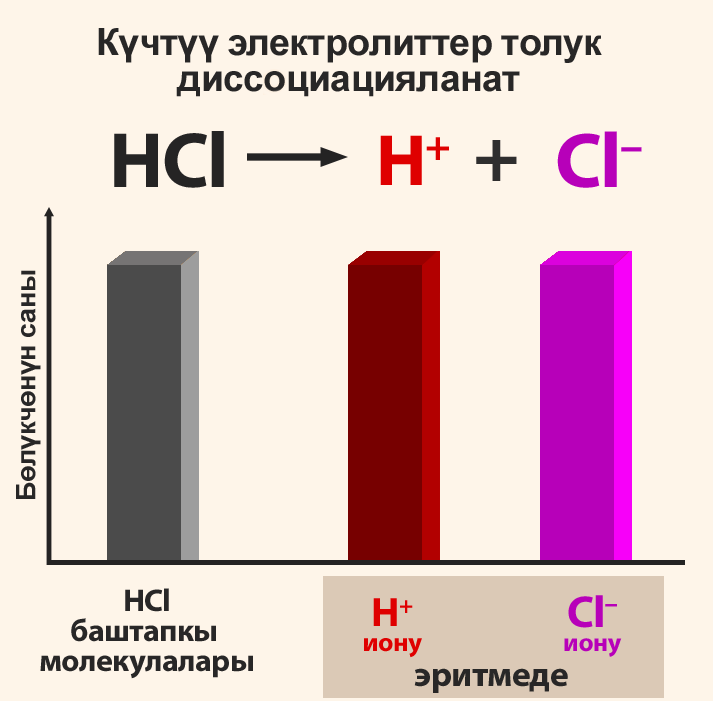
Электролиттердин диссоциация даражасы пайыздар менен туюнтулат. Эгерде α = 0 болсо, анда диссоциациянын болбогондугун билдирет, α = 1 же 100% болсо, анда электролит иондорго толугу менен ажырайт. Эгер α = 20% болсо, анда берилген электролиттин 100 молекуласынын 20 гана иондорго ажырагандыгын билдирет.
- Ар түрдүү электролиттердин диссоциация даражасы да ар башка болот. Тажрыйба кɵргɵзгɵндɵй, диссиоциация даражасы электролиттердин концентрациясынан жана температурадан кɵз каранды болот.
Иондук алмашуу реакциясы
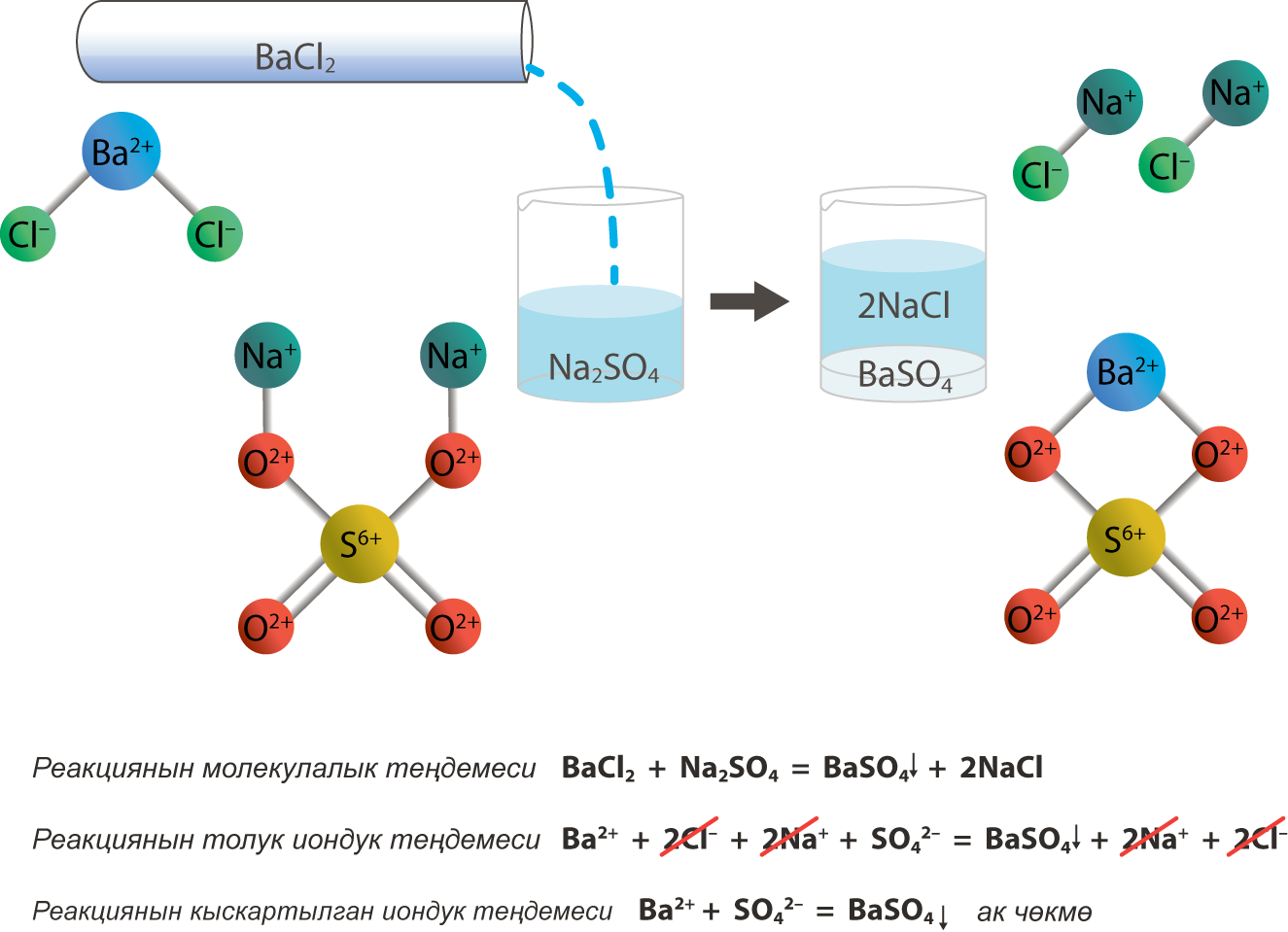
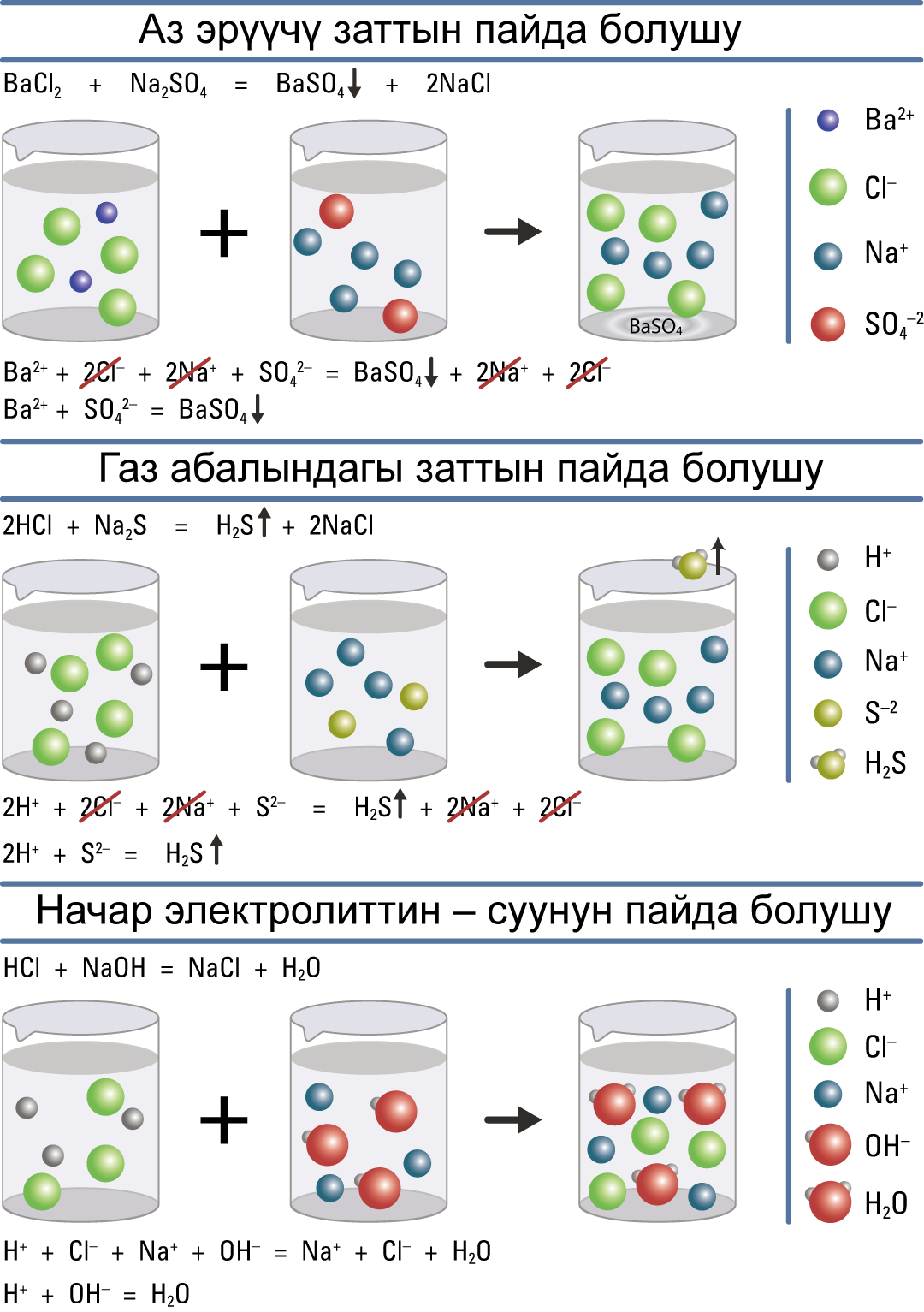
Электролиттик диссоциация теориясына ылайык, электролиттердин ортосунда жүргɵн бардык реакциялар иондук реакция болуп саналат. Алар иондук реакция деп, ал эми бул реакциялардын теңдемелери иондук теңдеме деп аталат. Алар молекулалык түрдɵ жазылган реакцияларга караганда жɵнɵкɵйүрɵɵк болушат.
Теңдемени жазганда, формуланын жанына ↓ белгиси коюлса, анда бул заттын чɵкмɵ түрүндɵ чɵккɵнүн билдирет. Ал эми ↑ белги заттын газ абалында бɵлүнүп чыккандыгын билдирет.
-
Күчтүү электролиттер толугу менен диссоциациялангандыктан, ион түрүндɵ жазылат. Теңдеменин сол жагындагы заряддардын суммасы оң жактагы заряддардын суммасына барабар болушу керек. Бул жоболорду бышыктоо үчүн мисалды карап кɵрɵлү.
Мисалы:
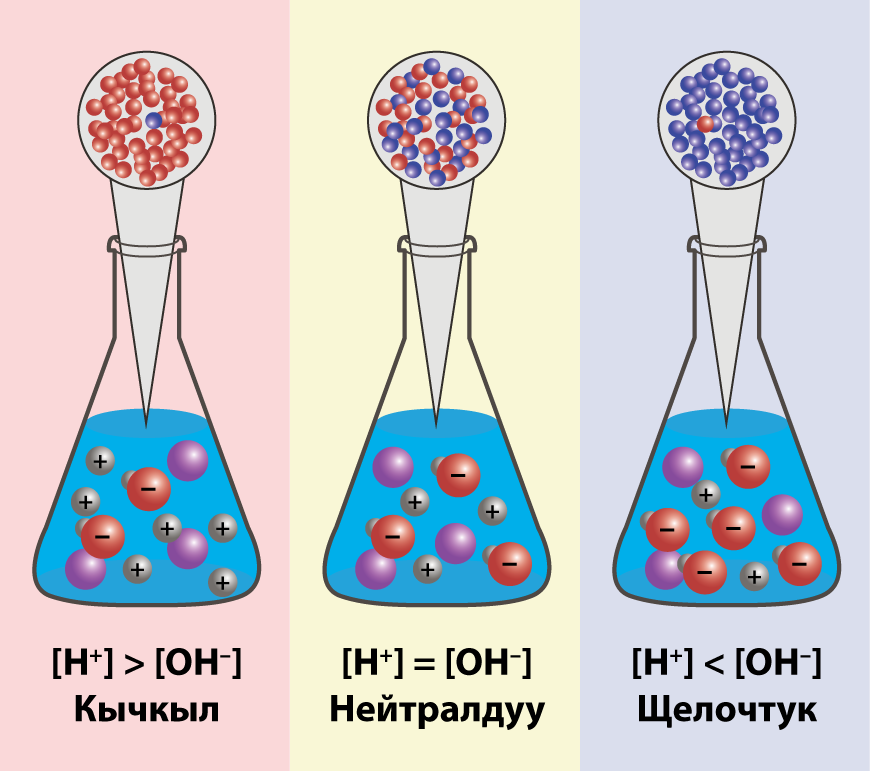
Суунун иондук кɵрсɵткүчү. Эритменин pH кɵрсɵткүчү
-
Суунун молекуласынын концентрациясынын диссоциация даражасы тɵмɵн болгондуктан, ал турактуу чоңдук (1000 г/л)/(18 г/моль) = 55,56 моль/л болуп саналат.
20 – 25 °C суунун диссоциация константасы 1,8•10−16 моль/л. барабар болот. Суу начар электролит (амфолит) болгондуктан, анын диссоциациясынын константасын–суунун диссоциацияланышын жазып кɵрɵлү.
K•[H2O] = [H+] [OH–]
Кɵрсɵткүчтү белгилейбиз K•[H2O] = Kс = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль2/л2 = [H+]·[OH−] (25 °C температурада).
Туздардын гидролизи (суунун ажырашы)
Туздардын гидролизи – бул туздар менен суунун ортосундагы алмашуу реакциялары.Туз эритмеде диссоциацияланганда, анын иондору суунун молекуласы менен аракеттенишет.
Гидролиздин жыйынтыгында, диссоциацияланбаган, начарыраак, бирок, гидролизденген тузга караганда туруктуу болгон электролит алынат. Гидролиз эгер туз начар кислотадан же начар негизден пайда болгон учурда ишке ашат Гидролиз – бул нейтралдашуу процессине карама–каршы жүргɵн процесс.
Гидролиз суюлтулган эритмелерде ылдам жана аягына чейин жүрɵт.
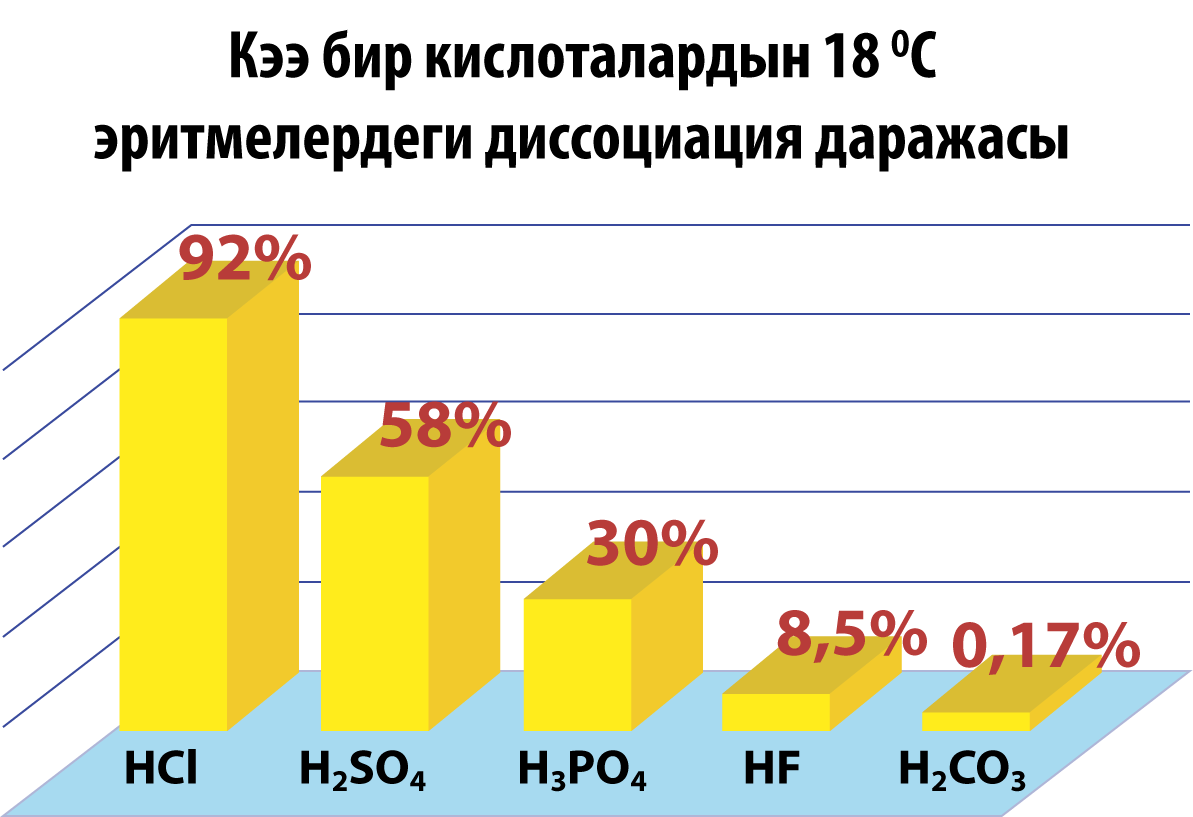
Диссоциация даражасына карата бардык кислоталар жана эрүүчү негиздер (щелочтор) күчтүү жана начар болуп, экиге бɵлүнүшɵт.
Күчтүү кислоталар: HClO4, HClO3, H2SO4, HNO3, HI, HBr, HCl.
Күчтүү негиздер (щелочтор): CsOH, RbOH, KOH, NaOH, LiOH, Ba(OH)2, Sr(OH)2, Ca(OH)2.
1) Күчтүү кислотадан жана күчтүү негизден пайда болгон туздар гидролизге учурабайт. Сууда эригенде алар толугу менен оң заряддалган катиондорго жана терс заряддалган аниондорго диссоциацияланат.
2) Күчтүү кислотадан жана начар негизден пайда болгон туздар кычкыл чɵйрɵнү рН≤7 пайда кылуу менен гидролизденет.
I баскыч:
CuCl2+HOH![]() Cu(OH)Cl+HCl
Cu(OH)Cl+HCl
Cu2+ + 2Cl– + HOH![]() CuOH+ + Cl– + H+ + Cl–
CuOH+ + Cl– + H+ + Cl–
Cu2++HOH![]() CuOH+ + H+
CuOH+ + H+
(рН < 7)
II баскыч
Cu(OH)Cl + HOH ![]() Cu(OH)2↓ + HCl
Cu(OH)2↓ + HCl
CuOH+ + Cl– + HOH ![]() Cu(OH)2↓ + H+ + Cl–
Cu(OH)2↓ + H+ + Cl–
CuOH+ + HOH ![]() Cu(OH)2↓ +H+
Cu(OH)2↓ +H+
(pH ≤ 7) – кычкыл чɵйрɵ
3) Күчтүү негизден жана начар кислотадан пайда болгон туздар щелочтуу чɵйрɵнү рН≥7 пайда кылуу менен гидролизденет.
I баскыч
K2S + HOH ![]() KHS + KOH
KHS + KOH
2K+ + S2– + HOH ![]() K+ + HS– + K+ + OH–
K+ + HS– + K+ + OH–
S2– +HOH ![]() HS– + OH–
HS– + OH–
(рН > 7)
II баскыч
KHS + HOH ![]() H2S↑ + KOH
H2S↑ + KOH
K+ + HS– + HOH ![]() H2S↑ + K+ + OH–
H2S↑ + K+ + OH–
HS– + HOH ![]() H2S↑ + OH–
H2S↑ + OH–
(pH ≥ 7) – щелочтуу чɵйрɵ
4) Начар кислотадан жана начар негизден пайда болгон туздар, эгер туз эрүүчү туз болсо гана, гидролизденет. Адатта мындай туздар:
- сууда эрибейт
- эриткенде ажырап кетет
2NH4+ + S2– ![]() 2NH3↑ + H2S↑
2NH3↑ + H2S↑
- Гидролизге учураганда, начар негиз жана начар кислота пайда болот.
CH3COONH4 + HOH ![]() CH3COOH + NH4OH
CH3COOH + NH4OH
CH3COO– + NH4+ + HOH ![]() CH3COOH + NH4OH
CH3COOH + NH4OH
Уксус кислотасынын диссоциация константасы CH3COOH = 1,8·10-5 барабар болот, ал эми аммоний гидроксидинин диссоциация константасы да NH4OH = 1,8·10-5 барабар болот. Б.а. бул заттардын сандык кɵрсɵткүчтɵрүнүн бири–бирине барабар болгондугу, аммоний ацетаты гидролизденгенде нейтралдуу чɵйрɵнүн пайда болгондугун кɵрсɵтɵт.
Ошондой эле кɵпкɵ чейин сактаганда, газ абалындагы зат катары аммиактын учмалыгын да белгилɵɵгɵ болот.
Туздардын гидролизи баскыч менен жүрүшү мүмкүн. Баскычтардын саны туздун курамындагы металлдын же кислота калдыгынын валенттүүлүгүнɵ барабар болот.
1–Мисал
I баскыч:
Na3PO4 + HOH ![]() Na2HPO4 + NaOH
Na2HPO4 + NaOH
3Na+ + PO43– + HOH ![]() 2Na+ + HPO42– + Na+ + OH–
2Na+ + HPO42– + Na+ + OH–
PO43– + HOH ![]() HPO42– + OH–
HPO42– + OH–
II баскыч
Na2HPO4 + HOH ![]() NaH2PO4 + NaOH
NaH2PO4 + NaOH
2Na+ + HPO42–+HOH ![]() Na+ + H2PO4– + Na+
+ OH–
Na+ + H2PO4– + Na+
+ OH–
HPO42– + HOH ![]() H2PO4– + OH–
H2PO4– + OH–
III баскыч Реакция жүрбɵйт,себеби, НРО4 – начар электролит болуп саналат.
2–Мисал
I баскыч
Al2(SO4)3 + 2HOH ![]() 2Al(OH)SO4+H2SO4
2Al(OH)SO4+H2SO4
2Al3+ + 3SO42– + 2HOH ![]() 2AlOH2+ + 2SO42– + 2H+ + SO42–
2AlOH2+ + 2SO42– + 2H+ + SO42–
2Al3+ + 2HOH ![]() 2AlOH2+ + 2H+
2AlOH2+ + 2H+
II баскыч
2Al(OH)SO4 + 2HOH ![]() [Al(OH)2]2SO4 + H2SO4
[Al(OH)2]2SO4 + H2SO4
2AlOH2+ + 2SO42– + 2HOH ![]() 2Al(OH)2+ + SO42– + 2H+ + SO42–
2Al(OH)2+ + SO42– + 2H+ + SO42–
2AlOH2+ + 2HOH ![]() 2Al(OH)2+ + 2H+
2Al(OH)2+ + 2H+
III баскыч
[Al(OH)2]2SO4 + 2HOH ![]() 2Al(OH)3↓ + H2SO4
2Al(OH)3↓ + H2SO4
2Al(OH)2+ + SO42– + 2HOH ![]() 2Al(OH)3↓ + 2H+ + SO42–
2Al(OH)3↓ + 2H+ + SO42–
2Al(OH)2+ + 2HOH ![]() 2Al(OH)3↓ + 2H+
2Al(OH)3↓ + 2H+
III баскычта реакция жүрбɵйт, себеби алынган зат кайра баштапкы заттарга ажырап, суутектин иондорунун ɵзүнчɵ топтолуусуна алып келет. Бирок, эритмени суюлтуу жана температураны жогорулатуу менен гидролиздин жүрүшүн күчɵтүүгɵ болот. Ошондуктан, гидролиз III баскычта да жүрүшү мүмкүн.
Ошентип, туздар эрүүчү болсо,алар күчтүү жана начар компоненттерден (катион же анион) пайда болсо, анда гидролизденет. Туздун курамында щелочтон алынган күчтүү катион болсо, гидролизден кийин щелочтуу чɵйрɵ түзүлɵт. Эгерде туз күчтүү кислотадан жана начар негизден пайда болсо, анда күчтүү анион гидролизден кийин кычкыл чɵйрɵнүн түзүлүшүнɵ алып келет. Б.а. «Ким күчтүү болсо, ошонуку туура!» деген эреже сакталат.
Туздардын эригичтүүлүгүнүн ɵзгɵртүлгɵн таблицасы, гидролизден кийинки рН чɵйрɵнү аныктоого багытталган.
HOH
Суутек гидроксиди, OH– гидроксил тобунун жана H+ катионунун бирикмеси
CsOH
Цезий гидроксиди – ɵтɵ күчтүү негиз
RbOH
Рубидий гидроксиди – эң күчтүү негиз
KOH
Калий гидроксиди. Күчтүү негиз
NaOH
Натрий гидроксиди. Күчтүү негиз
LiOH
Литий гидроксиди. Күчтүү негиз
Ba(OH)2
Барий гидроксиди. Күчтүү негиз
Sr(OH)2
Стронций гидроксиди. Күчтүү негиз
Ca(OH)2
Кальций оксиди. Күчтүү негиз
NH4OH
Аммоний гидроксиди. Күчтүү негиз
Mg(OH)2
Магний гидроксиди. Начар негиз. Сууда эрибейт.
Al(OH)3
Алюминий гидроксиди. Начар негиз. Сууда эрибейт.
Mn(OH)2
Марганец гидроксиди. Начар негиз. Сууда эрибейт.
Zn(OH)2
Цинк гидроксиди. Начар негиз. Сууда эрибейт.
Cr(OH)3
Хром гидроксиди. Начар негиз. Сууда эрибейт.
Fe(OH)2
Темир гидроксиди (II) Начар негиз. Сууда эрибейт.
Fe(OH)3
Темир гидроксиди (III) Начар негиз. Сууда эрибейт.
Co(OH)2
Кобальт гидроксиди. Начар негиз. Сууда эрибейт.
Ni(OH)2
Никель гидроксиди. Начар негиз. Сууда эрибейт.
Pb(OH)2
Коргошун гидроксиди. Начар негиз. Сууда бир аз эрийт.
Cu(OH)2
Жез гидроксиди. Начар негиз. Сууда эрибейт.
Hg(OH)2
Сымап гидроксиди. Суудагы эритмеси болбойт.
Ag(OH)
Күмүш гидроксиди. Суудагы эритмеси болбойт
HClO4
Хлор кислотасы. Хлордун кычкылдандыруучу даражасы эң жогорку +7 болгондуктан, күчтүү кычкылдандыргыч болуп саналат.
CsClO4
Цезий перхлораты. Сууда начар эрийт, болжол менен 25oC. 100 мл сууда 2гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
RbClO4
Рубидий перхлораты. Сууда начар эрийт.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат
KClO4
Калий перхлораты. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 2,1гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
NaClO4
Натрий перхлораты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 211 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
LiClO4
Литий перхлораты. 25oC 100 мл сууда 58 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Ba(ClO4)2
Барий перхлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 340 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Sr(ClO4)2
Стронций перхлораты. Маалыматтар жок.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Ca(ClO4)2
Кальций перхлораты. Сууда жакшы эрийт. 25oC 100 мл сууда болжол менен 188 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
NH4ClO4
Аммоний перхлораты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 25,4 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Mg(ClO4)2
Магний перхлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 52гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Al(ClO4)3
Алюминий перхлораты. сууда жакшы эрийт, болжол менен 25oC 100 мл сууда 135гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Mn(ClO4)2
Марганец перхлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 52гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Zn(ClO4)2
Цинк перхлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 112гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Cr(ClO4)3
Хром перхлораты. сууда жакшы эрийт, болжол менен 25oC 100 мл сууда 133гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Fe(ClO4)2
Темир перхлораты (II). Сууда жакшы эрийт. 25oC 100 мл сууда 300гр. Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Fe(ClO4)3
Темир перхлораты (III). Сууда жакшы эрийт. 25oC 100 мл сууда 395гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Co(ClO4)2
Кобальт перхлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 110гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Ni(ClO4)2
Никель перхлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 111гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Pb(ClO4)2
Коргошун перхлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 80гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Cu(ClO4)2
Жез перхлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 150гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Hg(ClO4)2
Сымап перхлораты (II). Сууда жакшы эрийт. 25oC 100 мл сууда 290гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
AgClO4
Күмүш перхлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 557гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
HClO3
Хлордуу кислота. Хлордун кычкылдануу даражасы +5 барабар, күчтүү кислота.
CsClO3
Цезий хлораты. 25oC 100 мл сууда болжол менен 9 гр эрийт.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
RbClO3
Рубидий хлораты. 25oC 100 мл сууда болжол менен 7 гр эрийт
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
KClO3
Калий хлораты. 25oC 100 мл сууда болжол менен 8 гр эрийт.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
NaClO3
Натрий хлораты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 100 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
LiClO3
Литий хлораты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 400 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Ba(ClO3)2
Барий хлораты. 25oC 100 мл сууда болжол менен 37 гр эрийт.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Sr(ClO3)2
Стронций хлораты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 185 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Ca(ClO3)2
Хлорат кальция. Хорошо растворяется в воде примерно 218 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
NH4ClO3
Аммоний хлораты. 25oC 100 мл сууда болжол менен 30 гр эрийт.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Mg(ClO3)2
Магний хлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 145 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Al(ClO3)3
Алюминий хлораты. сууда жакшы эрийт, болжол менен 25oC 100 мл сууда 77гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Mn(ClO3)2
Марганец хлораты. Так маалымат жок.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Zn(ClO3)2
Цинк хлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 218гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Cr(ClO3)3
Хром хлораты. сууда жакшы эрийт, болжол менен 25oC 100 мл сууда 142гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Fe(ClO3)2
Темир хлораты (II). Сууда жакшы эрийт. 25oC 100 мл сууда 210гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Fe(ClO3)3
Темир хлораты (III). Так маалымат жок.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Co(ClO3)2
Кобальт хлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 185гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Ni(ClO3)2
Никель хлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 145гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Pb(ClO3)2
Коргошун хлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 144гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Cu(ClO3)2
Жез хлораты. Сууда жакшы эрийт. 25oC 100 мл сууда 250гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Hg(ClO3)2
Сымап хлораты (II). 25oC 100 мл сууда 25 гр. эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
AgClO3
Күмүш хлораты. 25oC 100 мл сууда 18гр. эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
H2SO4
Күкүрт кислотасы. Күчтүү кислота, жогорку кычкылдануу даражасы +6 кɵрсɵтɵт.
Cs2SO4
Цезий сульфаты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 180 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Rb2SO4
Рубидий сульфаты. 25oC 100 мл сууда болжол менен 51 гр эрийт.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
K2SO4
Калий сульфаты. 25oC 100 мл сууда болжол менен 12 гр эрийт.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Na2SO4
Натрий сульфаты. 25oC 100 мл сууда болжол менен 30 гр эрийт.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Li2SO4
Литий сульфаты. 25oC 100 мл сууда болжол менен 34 гр эрийт.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
BaSO4
Барий сульфаты. Сууда эрибейт.
SrSO4
Стронций сульфаты. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 0,013 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
CaSO4
Кальций сульфаты. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 0,26 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
(NH4)2SO4
Аммоний сульфаты. Сууда жакшы эрийт. 25oC 100 мл сууда болжол менен 118гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
MgSO4
Магний сульфаты. 25oC 100 мл сууда болжол менен 36 гр эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Al2(SO4)3
Алюминий сульфаты. 25oC 100 мл сууда болжол менен 37 гр эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
MnSO4
Марганец сульфаты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 63 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
ZnSO4
Цинк сульфаты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 57 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Cr2(SO4)3
Хром сульфаты. Сууда жакшы эрийт. 25oC 100 мл сууда болжол менен 220 гр эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
FeSO4
Темир сульфаты (II). Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 53 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Fe2(SO4)3
Темир сульфаты (III). Сууда абдан жакшы эрийт. 25oC 100 мл сууда болжол менен 440 гр эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
CoSO4
Кобальт сульфаты. 25oC 100 мл сууда болжол менен 39 гр. эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
NiSO4
Никель сульфаты. 25oC 100 мл сууда болжол менен 45 гр. эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
PbSO4
Коргошун сульфаты. Cууда эрибейт.
CuSO4
Жез сульфаты. 25oC 100 мл сууда болжол менен 22 гр. эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
HgSO4
Cымап сульфаты.
Сууда такыр эрибейт. Кɵп ɵлчɵмдɵгү суу менен гидролизденет, натыйжада кычкыл чɵйрɵ пайда болот.
Ag2SO4
Күмүш сульфаты.
Сууда начар эрийт, 25oC 100 мл сууда болжол менен 0,84 гр. эрийт.Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
HNO3
Азот кислотасы. Күчтүү кычкылдандыргыч. Гидрат иону сууда гидролизге учурабайт.
CsNO3
Цезий нитраты. 25oC 100 мл сууда болжол менен 28гр. эрийт.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
RbNO3
Рубидий нитраты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 70гр. эрийт.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
KNO3
Калий нитраты. 25oC 100 мл сууда болжол менен 38гр. эрийт.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
NaNO3
Натрий нитраты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 90гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
LiNO3
Литий нитраты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 100гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Ba(NO3)2
Барий нитраты. 25oC 100 мл сууда болжол менен 10гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Sr(NO3)2
Стронций нитраты. 25oC 100 мл сууда болжол менен 74гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Ca(NO3)2
Кальций нитраты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 140гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
NH4NO3
Аммоний нитраты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 212гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Mg(NO3)2
Магний нитраты. 25oC 100 мл сууда болжол менен 72,7гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Al(NO3)3
Алюминий нитраты. 25oC 100 мл сууда болжол менен 78 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Mn(NO3)2
Марганец нитраты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 140 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Zn(NO3)2
Цинк нитраты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 130 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Cr(NO3)3
Хром нитраты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 145 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Fe(NO3)2
Темир нитраты (II). Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 150 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Fe(NO3)3
Темир нитраты (III). Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 160 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Co(NO3)2
Кобальт нитраты . Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 100 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Ni(NO3)2
Никель нитраты (II). Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 98 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Pb(NO3)2
Коргошун нитраты. 25oC 100 мл сууда болжол менен 56,5 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Cu(NO3)2
Жез нитраты . Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 145 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Hg(NO3)2
Сымап нитраты. Кычкыл суу эритмелерде эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
AgNO3
Күмүш нитраты. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 250 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
HI
Иоддуу суутек кислотасы. Күчтүү кычкылдандыргыч.
CsI
Цезий иодиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 90 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
RbI
Рубидий иодиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 150 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
KI
Калий иодиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 148 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
NaI
Натрий иодиди. Сууда жакшы эрийт, 25oC. 100 мл сууда болжол менен 90 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
LiI
Литий иодиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 167 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
BaI2
Барий иодиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 218 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
SrI2
Стронций иодиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 180 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
CaI2
Кальций иодиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 215 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
NH4I
Аммоний иодиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 176 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
MgI2
Магний иодиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 142 гр..
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
AlI3
Алюминий иодиди. Сууда жакшы эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
MnI2
Марганец иодиди. Сууда эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
ZnI2
Цинк иодиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 440 гр
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
CrI3
Хром иодиди. Сууда начар эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
FeI2
Темир иодиди (II). Сууда эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
FeI3
Темир иодиди (III). Сууда эригенде диспропорцияланат.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
CoI2
Кобальт иодиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 210 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
NiI2
Никель иодиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 150 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
PbI2
Коргошун иодиди. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 0,076 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
CuI2
Жез иодиди. Сууда эригенде диспропорцияланат.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
HgI2
Сымап иодиди. Сууда эрибейт.
AgI
Күмүш иодиди. Сууда эрибейт.
HBr
Бромдуу суутек кислотасы. Бир негиздүү күчтүү кислота.
CsBr
Цезий бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 110 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
RbBr
Рубидий бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 114 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
KBr
Калий бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 148 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
NaBr
Натий бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 94 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
LiBr
Литий бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 170 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Ba(Br)2
Барий бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 100 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Sr(Br)2
Стронций бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 107 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Ca(Br)2
Кальций бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 153 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
NH4Br
Аммоний бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 78 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
Mg(Br)2
Магний бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 103 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Al(Br)3
Алюминий бромиди. Сууда жакшы эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Mn(Br)2
Марганец бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 150 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Zn(Br)2
Цинк бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 470 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Cr(Br)3
Хром бромиди. Сууда жакшы эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Fe(Br)2
Темир бромиди (II). Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 120 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Fe(Br)3
Темир бромиди (III). Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 455 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Co(Br)2
Кобальт бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 115 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Ni(Br)2
Никель бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 134 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Pb(Br)2
Коргошун бромиди. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 0,97 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Cu(Br)2
Жез бромиди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 127 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
Hg(Br)2
Сымап бромиди. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 0,61 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
AgBr
Күмүш бромиди. Сууда эрибейт.
HCl
Туз кислотасы. Бир негиздүү күчтүү кислота.
CsCl
Цезий хлориди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 190 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
RbCl
Рубидий хлориди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 95 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
KCl
Калий хлориди. Сууда эрийт, 25oC 100 мл сууда болжол менен 36 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
NaCl
Натрий хлориди. Сууда эрийт, 25oC 100 мл сууда болжол менен 36 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
LiCl
Литий хлориди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 84,5 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
BaCl2
Барий хлориди. Сууда эрийт, 25oC 100 мл сууда болжол менен 37,4 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
SrCl2
Стронций хлориди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 56 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
CaCl2
Кальций хлориди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 77 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
NH4Cl
Аммоний хлориди. Сууда эрийт, 25oC 100 мл сууда болжол менен 39 гр.
Нейтралдык чɵйрɵнү пайда кылуу менен диссоциацияланат.
MgCl2
Магний хлориди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 55,5 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
AlCl3
Алюминий хлориди. Сууда эрийт. 25oC 100 мл сууда болжол менен 45 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
MnCl2
Марганец хлориди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 77 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
ZnCl2
Цинк хлориди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 408 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
CrCl3
Хром хлориди. Сууда эриткенде калыбына келтиргичтер (Cr2+, Fe2+) катышса эрийт.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
FeCl2
Темир хлориди (II). Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 64 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
FeCl3
Темир хлориди (III). Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 99 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
CoCl2
Кобальт хлориди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 56 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
NiCl2
Никель хлориди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 65 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
PbCl2
Коргошун хлориди. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 1,08 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
CuCl2
Жез хлориди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 76 гр.
Гидролиздин натыйжасында кычкыл чɵйрɵ пайда болот.
HgCl2
Сымап хлориди. Сууда эрибейт.
AgCl
Күмүш хлориди. Сууда эрибейт.
H2SO3
Күкүрттүү кислота. Эки негиздүү туруксуз кислота.
Cs2SO3
Цезий сульфити. Сууда эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Rb2SO3
Рубидий сульфити. Сууда эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
K2SO3
Калий сульфити. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 106 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Na2SO3
Натрий сульфити. Сууда эрийт, 25oC 100 мл сууда болжол менен 28 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Li2SO3
Литий сульфити. Сууда эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
BaSO3
Барий сульфити. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 0,02 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
SrSO3
Стронций сульфити. Сууда эрибейт.
CaSO3
Кальций сульфити. Сууда эрибейт.
(NH4)2SO3
Аммоний сульфити. Сууда эрийт, 25oC 100 мл сууда болжол менен 65 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
MgSO3
Магний сульфити. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 0,65 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Al2(SO3)3
Алюминий сульфити.
Толук гидролизденет, пайда болгон эки зат чɵкмɵ же газ абалында бɵлүнүп чыгат.
MnSO3
Марганец сульфити. Сууда эрибейт.
ZnSO3
Цинк сульфити. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 0,16 гр.
Толук гидролизденет, пайда болгон эки зат чɵкмɵ же газ абалында бɵлүнүп чыгат.
CrSO3
Хром сульфити. Сууда эрибейт.
FeSO3
Темир сульфити (II). Сууда начар эрийт.
Толук гидролизденет, пайда болгон эки зат чɵкмɵ же газ абалында бɵлүнүп чыгат.
Fe2(SO3)3
Темир сульфити (III). Сууда эригенде диспропорцияланат.
CoSO3
Кобальт сульфити. Сууда эрибейт.
NiSO3
Никель сульфити. Сууда эрибейт.
PbSO3
Коргошун сульфити. Сууда эрибейт.
CuSO3
Жез сульфити. Сууда эрибейт.
HgSO3
Сымап сульфити. Сууда эрибейт.
Ag2SO3
Күмүш сульфити. Сууда ɵтɵ начар эрийт. 25oC 100 мл сууда болжол менен 0,00005255 гр.
Толук гидролизденет, пайда болгон эки зат чɵкмɵ же газ абалында бɵлүнүп чыгат.
H3PO4
Ортофосфор кислотасы (фосфор кислотасы). 3 негиздүү орто кислота.
Cs3PO4
Цезий фосфаты. Сууда эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Rb3PO4
Рубидий фосфаты. Сууда эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
K3PO4
Калий фосфаты. Сууда эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Na3PO4
Натрий фосфаты. Сууда эрийт, 25oC 100 мл сууда болжол менен 14,5 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Li3PO4
Литий фосфаты. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 0,037 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Ba3(PO4)2
Барий фосфаты. Сууда эрибейт.
Sr3(PO4)2
Стронций фосфаты. Сууда эрибейт.
Ca3(PO4)2
Кальций фосфаты. Сууда эрибейт.
(NH4)3PO4
Аммоний фосфаты. Сууда эрийт, 25oC 100 мл сууда болжол менен 22 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Mg3(PO4)2
Магний фосфаты. Сууда эрибейт.
AlPO4
Алюминий фосфаты. Сууда эрибейт.
Mn3(PO4)2
Марганец фосфаты. Сууда эрибейт.
Zn3(PO4)2
Цинк фосфаты. Сууда эрибейт.
CrPO4
Хром фосфаты. Сууда эрибейт.
Fe3(PO4)2
Темир фосфаты (II). Сууда эрибейт.
FePO4
Темир фосфаты (III). Сууда ɵтɵ начар эрийт, 100oC 100 мл сууда болжол менен 0,67 гр.
Гидролизге учурабайт.
Co3(PO4)2
Кобальт фосфаты. Сууда эрибейт.
Ni3(PO4)2
Никель фосфаты. Сууда эрибейт.
Pb3(PO4)2
Коргошун фосфаты. Сууда эрибейт.
Cu3(PO4)2
Жез фосфаты. Сууда эрибейт.
Hg3(PO4)2
Сымап фосфаты. Сууда эрибейт.
Ag3PO4
Күмүш фосфаты. Сууда эрибейт.
HF
Плавик кислотасы (фтордуу суутек кислотасы).
CsF
Цезий фториди. Сууда ɵтɵ жакшы эрийт, 25oC 100 мл сууда болжол менен 322 гр.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
RbF
Рубидий фториди. Сууда ɵтɵ жакшы эрийт, 25oC 100 мл сууда болжол менен 300 гр.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
KF
Калий фториди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 100 гр.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
NaF
Натрий фториди. Сууда эрийт, 25oC 100 мл сууда болжол менен 4,3 гр.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
LiF
Литий фториди. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 0,13 гр.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
BaF2
Барий фториди. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 0,160 гр.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
SrF2
Стронций фториди. Сууда эрибейт.
CaF2
Кальций фториди. Сууда эрибейт.
NH4F
Аммоний фториди. Сууда эрийт, 25oC 100 мл сууда болжол менен 39 гр.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
MgF2
Магний фториди. Сууда ɵтɵ начар эрийт, 25oC 100 мл сууда болжол менен 0,0078 гр.
AlF3
Алюминий фториди. Сууда начар эрийт. 25oC 100 мл сууда болжол менен 0,5 гр.
MnF2
Марганец фториди. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 1,06 гр.
ZnF2
Цинк фториди. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 1,06 гр.
CrF3
Хром фториди. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 4 гр.
FeF2
Темир фториди (II). Сууда ɵтɵ начар эрийт.
FeF3
Темир фториди (III). Сууда ɵтɵ начар эрийт. 25oC 100 мл сууда болжол менен 0,091гр.
CoF2
Кобальт фториди. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 1,5 гр.
NiF2
Никель фториди. Сууда эрийт, 25oC 100 мл сууда болжол менен 2,6 гр.
PbF2
Коргошун фториди. Сууда начар эрийт, 25oC 100 мл сууда болжол менен 0,068 гр.
CuF2
Жез фториди. Сууда 25oC 100 мл сууда болжол менен 4,75гр. эрийт.
Температураны жогорулатканда, суу буусу менен кошо ажырайт.
HgF2
Сымап фториди.
Эритме абалында болбойт.
AgF
Күмүш фториди. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 180 гр.
HNO2
Азоттуу кислота. Бир негиздүү начар кислота.
CsNO2
Цезий нитрити. Сууда эрийт.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
RbNO2
Рубидий нитрити. Сууда эрийт.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
KNO2
Калий нитрити. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 312гр. эрийт.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
NaNO2
Натрий нитрити. Сууда эрийт, 25oC 100 мл сууда болжол менен 84гр.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
LiNO2
Литий нитрити. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 105гр.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
Ba(NO2)2
Барий нитрити. Сууда эрийт, 25oC 100 мл сууда болжол менен 74гр.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
Sr(NO2)2
Стронций нитрити. Сууда эрийт, 25oC 100 мл сууда болжол менен 77гр.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
Ca(NO2)2
Кальций нитрити. Сууда эрийт, 25oC 100 мл сууда болжол менен 77 гр.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
NH4NO2
Аммоний нитрити. Сууда жакшы эрийт, 25oC 100 мл сууда болжол менен 200 гр.
Щелочтук чɵйрɵнү пайда кылуу менен диссоциацияланат.
Mg(NO2)2
Магний нитрити. Сууда эрийт.
Гидролиздин натыйжасында начар щелочтук чɵйрɵ түзүлɵт.
Al(NO2)3
Алюминий нитрити. Сууда эрийт, 25oC 100 мл сууда болжол менен 63,7 гр.
Mn(NO2)2
Марганец нитрити. Сууда эрийт.
Чɵйрɵ нейтралдуу болот.
Zn(NO2)2
Цинк нитрити. Сууда эрийт.
Чɵйрɵ нейтралдуу болот.
Cr(NO2)3
Хром нитрити.
Эритмеси болбойт.
Fe(NO2)2
Темир нитрити (II).
Сууда эрийт.
Fe(NO2)3
Темир нитрити (III).
Эритмеси болбойт.
Co(NO2)2
Кобальт нитрити.
Сууда эрийт.
Ni(NO2)2
Никель нитрити.
Сууда эрийт.
Pb(NO2)2
Коргошун нитрити.
Сууда эрийт.
Cu(NO2)2
Жез нитрити.
Сууда эрийт.
Hg(NO2)2
Сымап нитрити.
Сууда начар эрийт.
AgNO2
Күмүш нитрити.
Сууда начар эрийт.
H2CO3
Кɵмүр кислотасы.
Эки негиздүү начар кислота.
Cs2CO3
Цезий карбонаты. Сууда эрийт, 20oC 100 мл сууда болжол менен 75,5 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Rb2CO3
Рубидий карбонаты. Сууда жакшы эрийт, 20oC 100 мл сууда болжол менен 223 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
K2CO3
Калий карбонаты. Сууда жакшы эрийт, 20oC 100 мл сууда болжол менен 112 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Na2CO3
Натрий карбонаты. Сууда эрийт, 25oC 100 мл сууда болжол менен 29,4 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Li2CO3
Литий карбонаты. Сууда эрийт. 25oC 100 мл сууда болжол менен 1,27 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
BaCO3
Барий карбонаты.
Сууда эрибейт.
SrCO3
Стронций карбонаты.
Сууда эрибейт.
CaCO3
Кальций карбонаты.
Сууда эрибейт.
(NH4)2CO3
Аммоний карбонаты. Сууда жакшы эрийт, 15oC 100 мл сууда болжол менен 100 гр.
MgCO3
Магний карбонаты. Сууда начар эрийт.
Al2(CO3)3
Алюминий карбонаты.
Эритме болбойт.
MnCO3
Марганец карбонаты.
Сууда эрибейт.
ZnCO3
Цинк карбонаты.
Сууда эрибейт.
Cr2(CO3)3
Хром карбонаты.
Эритмеси болбойт.
FeCO3
Темир карбонаты (II).
Сууда эрибейт.
Fe2(CO3)3
Темир карбонаты(III).
Эритмеси болбойт.
CoCO3
Кобальт карбонаты.
Сууда эрибейт.
NiCO3
Никель карбонаты.
Сууда эрибейт.
PbCO3
Коргошун карбонаты.
Сууда эрибейт.
CuCO3
Жез карбонаты.
Сууда эрибейт.
HgCO3
Сымап карбонаты.
Сууда эрибейт.
Ag2CO3
Күмүш карбонаты.
Сууда эрибейт.
H2S
Күкүрттүү суутек кислотасы.
Эки негиздүү, начар кислота.
Cs2S
Цезий сульфиди. Сууда эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Rb2S
Рубидий сульфиди. Сууда эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
K2S
Калий сульфиди. Суу менен реакцияга кирет.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Na2S
Натрий сульфиди. Сууда эрийт, 20oC 100 мл сууда болжол менен 20 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Li2S
Литий сульфиди. Сууда жакшы эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
BaS
Барий сульфиди. Сууда эрийт, 20oC 100 мл сууда болжол менен 9 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
SrS
Стронций сульфиди. Сууда начар эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
CaS
Кальций сульфиди. Сууда начар эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
(NH4)2S
Аммоний сульфиди. Сууда жакшы эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
MgS
Магний cульфиди. Сууда начар эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Al2S3
Алюминий сульфиди.
Эритмеси болбойт.
MnS
Марганец сульфиди Сууда эрибейт.
ZnS
Цинк сульфиди. Сууда эрибейт.
Cr2S3
Хром сульфиди.
Эритмеси болбойт.
FeS
Темир сульфиди (II). Сууда эрибейт.
Fe2S3
Темир сульфиди (III). Сууда эригенде диспропорцияланат.
CoS
Кобальт сульфиди. Сууда эрибейт.
NiS
Никель сульфиди. Сууда эрибейт.
PbS
Коргошун сульфиди. Сууда эрибейт.
CuS
Жез сульфиди. Сууда эрибейт.
HgS
Сымап сульфиди.
Эритмеси болбойт.
Ag2S
Күмүш сульфиди. Сууда эрибейт.
H2SiO3
Метакремний кислотасы.
Өтɵ начар кислота.
Cs2SiO3
Цезий силикаты.
Сууда эрибейт.
Rb2SiO3
Рубидий силикаты. Сууда эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵ түзүлɵт.
K2SiO3
Калий силикаты.. Сууда эрийт.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Na2SiO3
Натрий силикаты.. Сууда эрийт, 20oC 100 мл сууда болжол менен 22 гр.
Гидролиздин натыйжасында щелочтук чɵйрɵнү түзɵт.
Li2SiO3
Литий силикаты.
Сууда эрибейт.
BaSiO3
Барий силикаты.
Сууда эрибейт.
SrSiO3
Стронций силикаты.
Сууда эрибейт.
CaSiO3
Кальций силикаты.
Сууда эрибейт.
(NH4)2SiO3
Аммоний силикаты.
Эритмеси болбойт.
MgSiO3
Магний силикаты.
Сууда эрибейт.
Al2(SiO3)3
Алюминий силикаты.
Эритмеси болбойт.
MnSiO3
Марганец силикаты.
Сууда эрибейт.
ZnSiO3
Цинк силикаты.
Эритмеси болбойт.
Cr2(SiO3)3
Хром силикаты .
Эритмеси болбойт.
FeSiO3
Темир силикаты (II).
Эритмеси болбойт.
Fe2(SiO3)3
Темир силикаты (III).
Эритмеси болбойт.
CoSiO3
Кобальт силикаты.
Эритмеси болбойт.
NiSiO3
Никель силикаты.
Эритмеси болбойт.
PbSiO3
Коргошун силикаты.
Сууда эрибейт.
CuSiO3
Жез силикаты.
Эритмеси болбойт.
HgSiO3
Сымап силикаты.
Эритмеси болбойт.
Ag2SiO3
Күмүш силикаты.
Эритмеси болбойт.
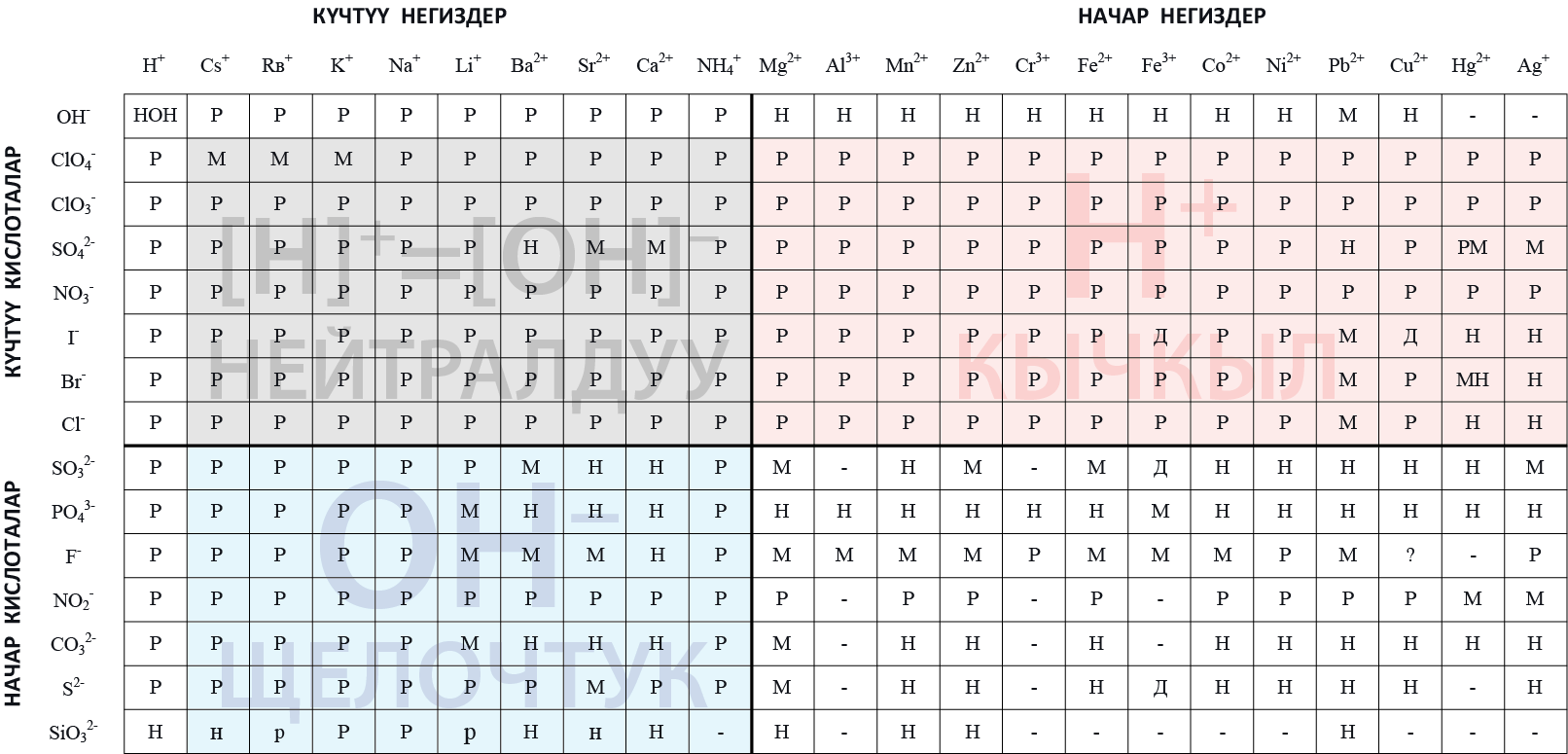
Бул таблицадагы тузду гидролиздин негизинде мүнɵздɵп жазууга болот.
Эгерде туз таблицада тɵмɵнкү түстɵр менен белгиленсе, анда:
мындай туз диссоциацияланат жана гидролизге учурабайт.
гидролизденет, кычкыл чɵйрɵ түзүлɵт, рН <7 болот.
гидролизден кийин щелочтук чɵйрɵ түзүлɵт, мында суутектик кɵрсɵткүчтүн рН мааниси 7 ден чоң болот.
: туз бул сектордогу башка туздардай эле эрибейт же сууда эригенде ажырап кетет. Туз эрүүчү болсо, анда гидролиздин натыйжасында, нейтралдуу чɵйрɵ рН=7,0 түзүлɵт.
Буфердик эритмелер
Буфердик системанын болушу менен организм кандын ж.б. суюктуктардын курамынын туруктуулугун сактоого жɵндɵмдүү болот. Кычкылдуулугу жана щелочтуулугу ар түрдүү болгон кɵптɵгɵн заттар организмге сырттан кирет жана анда иштелип чыгат, бирок, H+ жана OH– иондорунун концентрациясын ɵзгɵртүү менен кан үчүн туруктуу (pH = 7,37 – 7,44) чɵйрɵ сакталат.
Бул кɵрсɵткүчтɵрдүн тɵмɵндɵшү же жогорулашы ɵлүмгɵ алып келет. Буфердик эритмелер деп, бир аз ɵлчɵмдɵ кислотаны же щелочту кошсо, суюлтса да суутектик кɵрсɵткүчү рН ɵзгɵрбɵй, турактуу болгон эритмелерди айтабыз. Буфердик системалар начар негизден жана күчтүү кислотадан пайда болгон же начар кислотадан жана күчтүү негиздерден пайда болгон туздардан турат.
Мисалы: NH4OH + NH4Cl pH = 9,2 же CH3COOH + CH3COONa pH=4,7
Кислотаны кошуу менен суутектин иондору, ал эми щелочту кошуу менен гидроксид иондору менен байланышат, эритменин чɵйрɵсү pH бир аз гана ɵзгɵрɵт. Буфердик эритмелердеги чɵйрɵ рН буфердик ченем (емкость) аркылуу жɵнгɵ салынат.
Организмдин ар бир клеткасында ички чɵйрɵнүн туруктуулугун сактаган ар түрдүү буфердик система иштейт.
Гидролиздин мааниси жана колдонулушу
Туздардын суу менен болгон алмашуу реакциясы жаратылышта кеңири таралган.
Гидролиз кубулушу жер катмарынын химиялык кайрадан ɵзгɵрүүсү үчүн чоң роль ойнойт. Жер катмарындагы кɵптɵгɵн минералдар – металлдардын сульфиддери сууда начар эрийт, бирок, суу менен акырындап аракеттенише баштайт. Мындай процесстер Жердин үстүндɵ да жүрүп турат, бирок, жердин терең катмарында, жогорку температурада өтө кубаттуу жүрɵт. Жыйынтыгында, вулкан учурунда, жердин үстүнɵ кɵп ɵлчɵмдɵ күкүртүү суутек бɵлүнүп чыгат. Ал эми силикат тоо тектери акырындап, гидроксиддерге, андан соң металлдардын оксидине айлана баштайт. Жыйынтыгында, минералдардын гидролизи– алюмосиликаттар пайда болуп, тоо тектери бузула баштайт.
Бизге белгилүү болгон малахит (Cu2(OH)2CO2) – табийгый карбонаттардын гидролизинен пайда болгон.
Дүйнɵлүк океанда туздар суу менен кубаттуу аракеттенишет. Дарыялар менен агып чыккан кальцийдин жана магнийдин гидрокарбонаттары деңиз сууларына кошулуп, аларда начар шелочтук чɵйрɵнү түзɵт. Жээктеги суулардын мына ушундай начар щелочтук чɵйрɵсүндɵ рН 9га барабар болот, ошондуктан, деңиз ɵсүмдүктɵрүндɵ фотосинтез кубаттуу жүрɵт жана деңиз жаныбарлары да ылдам чоңоюшат. Сүт эмүүчүлɵрдүн, анын ичинен адамдын канындагы рН бирдейлигин билүү менен силер, Жердеги жаныбарлар дүйнɵсүнүн биримдиги жɵнүндɵ жыйынтык чыгара аласыңар.
Гидролиз мунайчыларды бир топ түйшүккɵ салды. Бизге белгилүү болгондой, нефтте суунун жана кɵптɵгɵн туздардын аралашмасы, ɵзгɵчɵ кальцийдин жана магнийдин хлориди кɵп болот. Нефтини кайра иштеткен учурда, аны 250 oС ысытканда, хлориддер суунун буусу менен кубаттуу аракеттенишет. Бɵлүнүп чыккан газ абалындагы хлордуу суутек жабдуулар жасалган металл менен реакцияга кирип, аны бузат, бул нефть продуктыларынын баасынын жогорулашына алып келет. Бирок, гидролиздин пайдасын да айтпай коюуга болбойт. Мисалы, алюминий сульфатынын суу менен аракеттенишинен пайда болгон алюминий гидроксидинин чɵкмɵсү кылымдардан бери боёк катары колдонулуп келе жатат. Кездемеге сиңирилгенден кийин алюминий гидроксиди боёкторду жеңил адсорбциялайт жана жууса да кетпеген боёктордун катмарын пайда кылат. Бул жол менен кездемени боёочу сапаттуу боёктор алынат. Ушул эле процесс ичүүчү сууну жана ɵнɵр жай калдыктарын тазалоодо да колдонулат. Алюминийдин гидроксидинин кɵпшɵк, аморфтуу чɵкмɵсүн топуракта тоголоктошот да, аларды адсорбциялоо менен зыяндуу, уу заттарды чɵктүрүп, бɵлүп алышат. Ушундай эле жол менен табият суулары алюминийдин бирикмелеринен турган чопо менен тазаланат.
Натрий карбонатынын Na2CO3 жана натрий фосфатынын Na3PO4 гидролизи сууну тазалоо жана аны жумшартуу үчүн колдонулат.
Топурактын кычкылдуулугун азайтуу максатында акиташтоо да гидролиздɵɵ реакциясына негизделген:
CO32-+HOH![]() HCO3-+OH+
HCO3-+OH+
Гидролиз аркылуу ɵнɵр жайда азык–түлүк эмес чийки заттардан (жыгач, пахтанын кабыгы, күн карама шакелдери, саман) бир катар баалуу продуктылар: этил спирти, белок ачыткылары, глюкоза, кургак муз иштелип чыгат.
Глоссарий
- Аквакомплекстер – суунун молекуласынын курамына кирген комплекстер же кристаллогидраттар
- Буфер, буфердик система (англ. buffer, buff деген сɵздɵн алынган – «соккуну акырындатуу») – суутектин же гидроксид ионунун белгилүү бир туруктуу концентрациясынан турган эритмелер.
Библиография
- Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. – С. 244
- Ефимов А.И. и др. Свойства неорганических соединений. Справочник. - Л.: Химия, 1983. – С. 140-141
- Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. - Мн.: Современная школа, 2005. - 608 с ISBN 985-6751-04-7.
Швед физик–химиги Сванте Август Аррениус Упсаладан алыс эмес жердеги Вейк имениесинде туулган.
Аррениус ар түрдүү типтеги эритмелер аркылуу электр тогунун ɵтүшүн изилдеген. Ал кээ бир заттардын молекулалары сууда эригенде диссоциациялана тургандыгын, б.а. эки же андан кɵп бɵлүкчɵлɵргɵ–иондорго ажырай тургандыгын божомолдогон. «Бирок, ар бир бүтүн молекула электронейтралдуу болсо да, анын бɵлүкчɵлɵрү бир аз электр зарядына ээ болот, ал бɵлүкчɵнүн жаратылышына карата, же оң, же терс болушу мүмкүн. Мисалы, натрий хлоридин (туз) сууда эриткенде, ал оң заряддалган натрийдин атомуна жана терс заряддалган хлордун атомуна ажырайт. Бул заряддалган атомдор, молекуланын активдүү курамдык бɵлүгү катары эритмелерде гана пайда болот жана электр тогунун ɵтүшү үчүн шарт түзɵт. Электр тогу ɵз кезегинде активдүү курамдык бɵлүктɵрдү карама–каршы заряддалган электроддорго багыттайт».
1884–ж. Аррениус Упсаль Университетинде докторлук диссертациясын жактаганда, мына ушул гипотезалар менен чыккан. Ал мезгилде кɵптɵгɵн окумуштуулар эритмеде карама–каршы заряддалган бɵлүкчɵлɵрдүн болооруна ишенишкен эмес. Ошондуктан, факультет кеңеши диссертацияны ɵз деңгээлинде баалаган эмес.
1903–ж. гана Аррениуска «химия илимин ɵнүктүрүүдɵ анын электролиттик диссоциация теориясынын ɵзгɵчɵ маанисин таануу максатында»Нобель сыйлыгы ыйгарылган.Швеция королевствосунун Илимдер академиясынын атынан чыккан X.Р.Тернеблад Аррениустун иондор теориясы «математика менен жакындашып», электрохимиянын ɵнүгүшүнɵ жол салгандыгын баса кɵрсɵткɵн. «Аррениустун теориясынын маанилүү натыйжаларынын бири, химия боюнча биринчи Нобель сыйлыгын алган Вант–Гоффтун эмгегин жыйынтыктагандыгы болуп саналат», – деген Тернеблад.
Кир жуучу машинада сода менен кантип кир жууйбуз? Ал үчүн барабандын ɵзүнɵ жарым стакан сода салып, кадимки режимде жууш керек. Эгерде кир буюмдар кɵп болсо, анда содадан бир стакан салуу керек. Ал эми ага дагы бир стакан ак уксустун эритмесин кошсок, соданын эффективдүүлүгү андан да жогорулайт.
Сода менен тактарды кетирүү
Тактарды сода менен кетирүүчү бир нече ыкмаларды сунуш кылабыз:
- Такты кетирүү үчүн, сода пастасын даярдап алалы: бир чоң кашык соданы сууга аралаштырабыз. Суунун ордуна суутектин ɵтɵ кычкылын же уксусту колдонсо да болот. Алынган пастаны кир такка сүрүп, 15 мүнɵттɵн кийин жууп салабыз. Эгерде так кетпесе, процедураны кайталайбыз. Так абдан терең болсо,анда тиш щетка менен сүрүп кетирсек болот. Бирок, сода пастасын ɵтɵ назик, жука кездемелерге колдонууга болбойт;
- Соданы буюмдарды кургак жол менен тазалоого да колдонууга болот. Ал үчүн соданы кир тактын үстүнɵ жука кылып себелɵɵ керек( электи колдонсо ыңгайлуу болот), анан пакетке аба киргизбей ороп, 2 саатка коёбуз. Андан кийин кийимди кагып, 40 мүнɵт эшикке жайып коюу керек;
- Жагымсыз жытты кетирүү үчүн соданы таза носкиге салып, оозун байлап койгула. Андан кийин аны кийим салынган пакетке салып туруп, аба киргизбей кургак, салкын жерге түнү менен коюп койсо болот. Эртең менен пакетти ачып, соданы кийимден кагып түшүргүлɵ.Андан соң кийимди бир нече саатка чейин эшикке күнгɵ жайып койгула. Эгерде жыт кетпесе, процедураны кайталагыла;
- Килемдин бетиндеги же дасторкондогу такты соданы уксус менен ɵчүрүп алып, тазалоо керек. Ал үчүн адегенде соданы кир такка себелейбиз, андан соң чүпүрɵктү уксус менен нымдап туруп, ортосунан четти кɵздɵй такты сүрɵбүз. Бул процедураны бир нече жолу кайталап, аягында таза суу менен чайкап коёбуз.
Сода менен агартуу
Кирди сода менен жууп жана агартууга болобу? Ооба, ал үчүн соданы нашатыр спирти менен аралаштыруу керек. 5 литр таза сууга 5 кашык сода жана 2 кашык нашатыр спиртин кошуу керек. Алынган эритмеге ак түстүү кирлерди 2–3 саатка чейин чылап койгула. Андан кийин гана жуугула. Эгерде чылагандан кийин кирлерди ушул эритмеге кайнатсак, алардын саргыч түсү кетет.
Кальцийлештирген сода менен кантип кир жууганга болот?
Соданын экинчи түрү–кальцийлештирилген сода, тамак–аш содасына караганда бир канча эффективдүү. Аны турмуш–тиричилик химия бɵлүмдɵрүнɵн сатып алууга болот. Кальцийлештирген соданын колдонулушу:
- Кир жуугуч машинанын тетиктеринен кеберди( накип) жана аны туура эмес пайдалануудан пайда болгон жагымсыз жытты кетирүү үчүн колдонулат. Ал үчүн соданы бирдей ɵлчɵмдɵ суу менен аралаштырып, аралашма менен барабанды жана кир жуугуч каражат салынуучу лотокко салып, 30 мүнɵттɵн кийин чүпүрɵк менен сүрүп коюу керек. Андан кийин автомат машинага кир салбай туруп, «тез жууган» режимде иштеткиле;
- Сууну жакшы жумшартат. Ал үчүн кир жуугуч порошокко 2 чоң кашык сода кошулат (суунун катуулугу жогору болсо, 5 кашыкка чейин кошуу керек). Суунун температурасы 50 градустан тɵмɵн болбошу керек, бул кебердин болушунун да алдын алат. Бирок, жибек жана жүн кийимдерди мындай аралашма менен жууганга болбойт;
- Кирлерди чылап коюу үчүн 3 чоң кашык соданы 40 градуска чейин жылытылган 10 литр сууга кошкула. Эритмеге кийимдерди салып, чылап койгула. 2–3 сааттан кийин жуусаңар болот;
- Ашканадагы майлыктарды таза жууш үчүн тɵмɵнкү эрежени колдонсок болот: бир ууч соданы майдаланган (теркада) кир самын менен аралаштырып, эмаль чаканын жарымынан суу куюп туруп, салып койгула. Самын эригенден кийин, сууга майлыктарды салып, жай отко 20 мүнɵт кайнаткыла. Андан кийин машинада кадимкидей жууп койгула;
- Майлыктагы майдын тактарын кетирүү үчүн соданы ɵсүмдүк майы, агартуучу каражат жана порошок менен аралаштыруу керек. Ар бир ингредиенттен 3 чоң кашыктан алып, чакадагы кайнак сууга салгыла да кир кол арчыгычтарды, майлыктарды салып койгула. Алар суу муздаганча чыланып турсун. Түнү бою калтырып коюуга да болот. Андан соң аларды таза, жылуу сууга чайкагыла да, машинкада жууп койгула.
Сода кошулган универсалдык тазалоочу каражат
Идиш–аяктарды жууш үчүн жана сантехниканы тазалоо үчүн каражаттарды ɵзүбүз даярдап алсак да болот. Ал үчүн тɵмɵнкүлɵр керек:
- «детское» самыны сүргүчтү (терка), колдонуу менен майдаланылат,
- ага 1 стакан суу кошулуп, аралаштырылат,
- аралашмага дагы бир стакан суу куюп, үстүнɵ 250 гр сода акырындык менен кошулат да аралаштырылат.
Мындай паста менен акиташты да кетирүүгɵ болот.
Сода кошулган башка тазалоочу каражаттар
Соданы пайдалануу менен тɵмɵнкүлɵрдү даярдасак болот:
- идиш–аяк жуугуч аралашма;
- кир кетирүүчү гель;
- ваннаны тазалоочу каражат.
Идиш–аяктарды жуучу гелди даярдоо үчүн кир самын (25 грамм), 100 грамм тамак–аш содасы, жарым литр ысык суу, 4 кашык глицерин, бир кашык арак же суюлтулган спиртти даярдап алгыла. Кир самынды теркадан ɵткɵрүп, бир аз суу куйгула да кичине толкундуу мешке (микроволновая печ) койгула. Эритмени аралаштырып, калган сууну акырындык менен куйгула. Самын эригенден кийин муздаткыла да, ага глицеринди, аракты кошуп, аралаштыргыла. Пайда болгон кɵбүктɵрдү башка идишке куюп алып, пайдалана бергиле.
Кир кетирүүчү гелди даярдоо үчүн 1 литр суу, 50 грамм теркадан ɵткɵрүлгɵн кир самын жана 45 грамм кальцийлештирилген сода керектелет. Кайнап жаткан сууга майдаланган самынды салып, жакшылап аралаштыргыла. Андан кийин аралашмага соданы кошуп койгула. 5 килограмм кир кийимдерди жууганга 2 чоң кашык гелди барабанга куюп, кир жуусаңар болот.
Ваннаны тазалоочу каражатты даярдоо үчүн аралашмага жарым стакан сода, суюк самын жана 5 тамчы розмариндин же лаванданын майы кошулат. Соданы самын менен аралаштырып, майды кошкула. Аралашма кургап кетпеши үчүн ага бир чай кашык глицерин кошуп, идиштин оозун бекем жаап коюу керек.
Бүт дүйнɵ жүзүндɵ 22 мартта Суу ресурстарынын күнү белгиленет. Бул майрам Бириккен Улуттар Уюмунун Генералдык Ассамблеясынын чечими менен, жалпы адамзатка айлана– чɵйрɵгɵ жана коомдун ɵнүгүшү үчүн суу ресурстарынын маанилүүлүгүн эстетүү максатында белгиленген.
Азыркы мезгилде биздин планетанын территориясынын 70% суудан турат. Бирок, бул суунун 1% гана ичүүгɵ болот. Жыл ɵткɵн сайын суу ресурстарынын проблемалары күчɵɵдɵ. Акыркы 50 жылда гана суу менен байланышкан 507 чыр–чатак болуп, анын 21 согушка алып келген. Суу – планетадагы эң жɵнɵкɵй зат. Бирок, ошол эле учурда сууда, бизге белгисиз болгон табышмактар да бар. Окумуштуулар азыркыга чейин сууну изилдеп, кызыктуу кɵп фактыларды табышууда.
Силер билесиңерби?
Эң таза суунун Финляндияда экендигин?
ЮНЕСКОнун маалыматы боюнча, эң таза суу Финляндияда экен. Алар 122 ɵлкɵнүн табийгый таза сууларын изилдеген. Ал эми дүйнɵ жүзү боюнча 1 млрд адамдын таза сууну колдонууга мүмкүнчүлүгү таптакыр жок экен.
Муз ысык суудан тез алынабы?
Эгерде логикалык жактан ойлоп кɵрсɵк, муз албетте, муздак суудан алынат. Ысык суу биринчи муздашы, анан тоңушу керек, ал эми муздак сууну ошол замат эле тоңдурабыз.Бирок, тажрыйбаларда кɵрсɵткɵндɵй, ысык суу музга тез айланат экен.
Эмне үчүн ысык суунун муздак сууга караганда тез тоңо тургандыгынын себеби, азыркыга чейин белгисиз. Балким, себеби муздатууда, буулантууда, муздун пайда болушунда эмес, суюлтулган газдардын ысык жана муздак сууга тийгизген таасириндедир.
Суунун ɵтɵ катуу тоңо тургандыгын?
Суунун 0 градуста тоңуп, 100 градуста кайнай тургандыгы физика курсунан бардыгына белгилүү. Бирок, кээ бир суулардын андан да тɵмɵнкү температурада гана тоңо тургандыгы айтылып жүрɵт. Мындай касиетке аралашмасы жок эң таза суу ээ болот. 0 градуска чейин муздатса да, мындай суу суюк абалда калат. Белгилүү бир тɵмɵнкү температурада гана суу музга айланат же кайнайт экен.
Суунун 3 кɵп агрегаттык абалы бар экендигин?
Суунун үч агрегаттык абалда: суюк, катуу жана газ абалда болоору бардыгыбызга белгилүү. Бирок, окумуштуулар суунун 5 суюк абалы жана 14 тоңгон катуу абалы бар экендигин белгилешкен. Эгерде тоңгон таза сууну дагы муздата берсек эмне болот? Сууда укмуштуудай айлануулар башталат. Цельсий шкаласы боюнча минус 120 градуста суу ɵтɵ илээшкек, созулгуч болсо, ал эми минус 135 градуста суу айнектей абалга келет. «Айнек»суу – бул кристаллдык түзүлүшкɵ ээ эмес, айнектей катуу зат.
Эл аралык классификация боюнча кардын түрлɵрү
© А. К. Дюнин, В царстве снега, Издательство «Наука», Новосибирск, 1983
-

Пластинкалар
Кар бүртүкчɵлɵрүнүн ичинен эң жɵнɵкɵйү – алты бурчтуу жалпак призмалар -

Жылдызчалар
Пластинкалар сыяктуу эле жылдызчалар да алты бурчтуу, жалпак жана жука болушат -

Мамыча
Ичи кɵңдɵй, карандаш сымал формада болот -

Ийнелер
Узун жана ичке кристаллдар, кээде бир нече бутакчалардан турат -

Мейкиндиктик дендриттер
Өтɵ чоң кɵлɵмдɵгү кар бүртүкчɵлɵрү, бир нече кристаллдар бириккенде пайда болот -

Өзгɵргɵн мамычалар
Мамычалар башка шартка туура келгенде пайда болот жана бул учурда кристаллдар ɵсүү багытын ɵзгɵртүшɵт -

Туура эмес кристаллдар
Эң кеңири таралган тип. Кар бүртүкчɵлɵрү бузулганда пайда болот
© Kichigin | Shutterstock.com