Химия: Органикалык эмес бирикмелердин класстары — различия между версиями
Admine2 (обсуждение | вклад) (→Библиография) |
Admine2 (обсуждение | вклад) |
||
| (не показано 6 промежуточных версий этого же участника) | |||
| Строка 253: | Строка 253: | ||
</div> | </div> | ||
</div> | </div> | ||
| − | {{center|[[file: | + | {{center|[[file:Shkala electrootricKG.png|Химиялык элементтердин терс электрлүүлүк шкаласы]]}}<br> |
<div id="KNS-conteinersrs"> | <div id="KNS-conteinersrs"> | ||
| Строка 260: | Строка 260: | ||
=== Жɵнɵкɵй жана татаал заттар === | === Жɵнɵкɵй жана татаал заттар === | ||
'''Бардык химиялык заттар жɵнɵкɵй жана татаал заттарга бɵлүнɵт''' | '''Бардык химиялык заттар жɵнɵкɵй жана татаал заттарга бɵлүнɵт''' | ||
| − | {{center|[[file: | + | {{center|[[file:Prostie slojnie veshKG.png|Жɵнɵкɵй жана татаал заттар|link=]]}} |
'''Жɵнɵкɵй''' заттарга бир гана химиялык элементтин атомдорунан турган заттар кирет. | '''Жɵнɵкɵй''' заттарга бир гана химиялык элементтин атомдорунан турган заттар кирет. | ||
| Строка 277: | Строка 277: | ||
=== Металлдар жана металл эместер === | === Металлдар жана металл эместер === | ||
Бардык элементтер шарттуу түрдɵ металлдарга жана металл эместерге бɵлүнɵт. | Бардык элементтер шарттуу түрдɵ металлдарга жана металл эместерге бɵлүнɵт. | ||
| − | {{left|[[file: | + | {{left|[[file:KNSKG.png|250px|class=show-for-large-up|Металлдар жана металл эместер|link=]]}} |
'''Металлдар''' – сырткы электрондук катмарындагы 1,2,3 электрондорун башка атомго оңой берген элементтер. | '''Металлдар''' – сырткы электрондук катмарындагы 1,2,3 электрондорун башка атомго оңой берген элементтер. | ||
| Строка 679: | Строка 679: | ||
<div id="kompleks"> | <div id="kompleks"> | ||
'''Комплекстик туздар''' – металлдын борбордук атомунан–комплекс түзүүчүдɵн жана аны курчаган '''лигандалардан''' – карама–каршы багытталган иондордон турат. Ал комплекстик '''туздун ички катмарынан жана ага карама–каршы багытталган сырткы катмардан турат'''. | '''Комплекстик туздар''' – металлдын борбордук атомунан–комплекс түзүүчүдɵн жана аны курчаган '''лигандалардан''' – карама–каршы багытталган иондордон турат. Ал комплекстик '''туздун ички катмарынан жана ага карама–каршы багытталган сырткы катмардан турат'''. | ||
| − | {{center-p|[[file: | + | {{center-p|[[file:GeksacnaferatkaliaKG.png|Калийдин гексацианоферрат (III)]]}} |
</div> | </div> | ||
| Строка 991: | Строка 991: | ||
Натрий гидроксидинин NaOH басымдуу бɵлүгү нефтини тазалоо үчүн колдонулат. | Натрий гидроксидинин NaOH басымдуу бɵлүгү нефтини тазалоо үчүн колдонулат. | ||
| − | {{center|[[File: | + | {{center|[[File:Granat sok.jpg|Анардын ширеси кычкылдуулуктун мыкты кɵрсɵткүчү боло алат]]}} |
Адамдын организминдеги эң жогорку кычкылдуулук анын ашказанында болот, себеби, андагы PH бирге чейин жетет. | Адамдын организминдеги эң жогорку кычкылдуулук анын ашказанында болот, себеби, андагы PH бирге чейин жетет. | ||
| Строка 1033: | Строка 1033: | ||
<div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Тестти</div> | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Тестти</div> | ||
</div> | </div> | ||
| − | + | ||
</div> | </div> | ||
</div> | </div> | ||
Текущая версия на 09:38, 22 октября 2018

Татаал заттар оксиддерге, негиздерге жана туздарга бɵлүнɵт. Бирикмелердин ар бир классы ɵз кезегинде дагы бир нече түрлɵргɵ бɵлүнɵт.
Оксиддер негизги, амфотердик, туз пайда кылбоочу жана кислоталык оксиддерге бɵлүнɵт.
Гидроксиддер щелочторго (сууда эрүүчү негиздер), негиздерге, амфотердүү негиздерге жана кислоталарга бɵлүнɵт.
Туздар нормалдуу же орто туздар, кычкыл, негиздик, комплекстүү же кош туздар жана аралаш туздарга бɵлүнɵт.
Бардык бирикмелердин активдүүлүгү солдон оңго карай азаят.
Таблицаны пайдалануунун эрежелери:
1) Формулалары ар башка, кызыл жана кɵк түскɵ боёлгон заттардын ортосунда реакция жакшы жүрɵт.
2) Сыя кɵк түскɵ боёлгон заттар формулалары кɵк жана кызыл түскɵ боёлгон заттар менен ɵз ара аракеттенишет.
3) Формулалары бирдей түс менен жазылган заттар ɵз ара аракеттенишпейт.
4) Оксиддер жɵнɵкɵй заттар жана гидроксиддер менен реакцияга кирет, ал эми туздар менен реакцияга кирбейт.
5) Гидроксиддер оксиддер жана туздар менен реакцияга кирет.
6) Туздар гидроксиддер менен гана аракеттенишет.
Жогоруда аталган топтор ɵзүнчɵ ачык тилкелерде белгиленген. Металлдар, металл эместер жана татаал заттар активдүүлүгүнɵ жараша белгилүү бир ирээттүүлүктɵ жайгашкан. Заттардын ортосундагы генетикалык байланыштын белгилүү бир түстɵрдɵ берилиши, кайсы заттардын ɵз ара аракеттенише же аракеттенишпей тургандыгын кɵрсɵтүп турат.
Содержание
Органикалык эмес бирикмелердин классификациясы
H3AlO3 → HAlO2 + H2O; H2ZnO2; H3FeO3 → HFeO2 + H2O;
H3CrO3 → HCrO2 + H2O; H4PbO4 → H2PbO3 + H2O; H4SnO4 → H2O + H2SnO3
Жɵнɵкɵй жана татаал заттар
Бардык химиялык заттар жɵнɵкɵй жана татаал заттарга бɵлүнɵт

Жɵнɵкɵй заттарга бир гана химиялык элементтин атомдорунан турган заттар кирет.
Жɵнɵкɵй заттын курамындагы атомдордун санына же кристаллдык торчолордун түзүлүшүнɵ карата алар ар түрдүү аллотропиялык ɵзгɵрүүлɵрдү пайда кылат (мисалы,О2 – кычкылтек жана О3 – озон; алмаз жана графит).
Эки же андан кɵп химиялык элементтин атомдорунан турган заттар татаал заттар деп аталат.
Эки элементтин ɵз ара аракеттенишүүсүнɵн бинардык бирикмелер пайда болот.Бинардык бирикмелердин аталышы – ид деген мүчɵ менен аяктайт.
Мисалы: Mg3N2 – магний нитриди.
Биз бинардык бирикмелердин ичинен – эң маанилүүсү – оксиддерди карап кɵрɵлү.
Металлдар жана металл эместер
Бардык элементтер шарттуу түрдɵ металлдарга жана металл эместерге бɵлүнɵт.

Металлдар – сырткы электрондук катмарындагы 1,2,3 электрондорун башка атомго оңой берген элементтер.
Металл эместер – сырткы электрондук катмарында 4 тɵн кɵп электрону бар элементтер (ошондой эле сырткы электрондук катмарында 3 электрону бар борду кошууга болот).
Бирок, металл эместердин арасында газ абалындагы, молекуласы бир гана атомдон турган элементтердин тобу бар. Алар– инерттүү же асыл газдар болуп саналат (VIII – A группа). Ал эми металлдардын арасында, бирикмелери кислоталык да, негиздик да касиетти алып жүргɵн элементтер бар. Ошондуктан, аларды амфотердүү– «кош касиетке ээ» деп аташат.
(«Амфос» деген сɵздүн уңгусун салыштырсак, – амфора деп, эки кармагычы бар вазаны аташат. Амфибия деп – сууда да, кургакта да дем алган жаныбарларды аташат, мисалы, бака).
Берилген таблицада металлдык касиетке ээ болгон элементтер жана алардын бирикмелери кɵк түс менен белгиленген. Ал эми металл эместик касиетке ээ болгон элементтер жана алардын бирикмелери кызыл түс менен белгиленген. Амфотердүү заттар кош касиетти алып жүргɵндүктɵн, сыя–кɵк түс менен белгиленген, себеби, сыя–кɵк түс кызыл түс менен кɵк түстү аралашмасы.
Оксиддер

Оксиддерди аталышында биринчи элементтин аты , андан соң «оксиди» деген сɵз кошулуп айтылат.
Мисалы: ВаО – барий оксиди.
Оксиддин курамындагы ɵзгɵрмɵлүү валенттүүлүккɵ ээ болгон элементтердин валенттүүлүгү сɵзсүз жазылат, мисалын: СuO – жез оксиди (II) же Cu2O – жез оксиди (I).
Оксиддер 4 топко бɵлүнɵт – туз пайда кылбоочу, негиздик, амфотердик жана кислоталык.
Туз пайда кылбоочу оксиддерге окистенүү даражасы +1 жана +2 болгон металл эместердин оксиддери кирет (H2O, CO, SiO, NO, N2O).
Негиздик оксиддерге окистенүү даражасы +1 жана +2 болгон металлдардын оксиддери кирет (K2O, Na2O, BaO, CaO, MgO, FeO, CrO, MnO, VO, PbO, SnO, CuO). Негиздик оксиддерге негиздер жана сууда эрүүчү негиздер–щелочтор туура келет.
Амфотердүү оксиддерге окистенүү даражасы +3 жана +4 барабар болгон металлдын оксиддери туура келет (Al2O3, ZnO, Fe2O3, Cr2O3, MnO2, V2O3, PbO2, SnO2). Амфотердүү оксиддерге амфотердүү негиздер туура келет.
Кислоталык оксиддерге окистенүү даражасы +3, +4, +5, +6, +7 болгон металл эместердин оксиддери (Cl2O7, SO3, N2O5, P2O5, SO2↑, N2O3, P2O3, CO2↑, SiO2↓).
(Cl, Br, I– окистенүү даражалары +1 барабар) (Cl2O), жана окистенүү даражасы +5, +6, +7 болгон металлдардын оксиддери (CrO3, Mn2O7, V2O5) кирет. Кислоталык оксиддерге кислоталар туура келет.
Туз пайда кылбоочу оксиддер
Алынышы
1) Туз пайда кылбоочу оксиддер металл эместерди окистендирүү жолу менен алынат (кычкылтек аз ɵлчɵмдɵ катышат).
2С + О2 ![]() 2CO
2CO
2) Түз синтездɵɵ аркылуу (реакция абада чагылган болгондо) жүрɵт.
N2 +O2 t=2000→ 2NO — Q
3) Күйүп жаткан кɵмүртек (кɵмүр) аркылуу кɵмүр кычкыл газын өткɵрүүдɵн.
СО2 + С ![]() 2CO
2CO
4) Заттарды термикалык же каталитикалык жол менен ажыратуудан.
НСООН t, H2SO4→ H2O + CO
5) Окистенүү – калыбына келүү реакцияларынын натыйжасында.
3Cu + 8HNO3(суюл) ![]() 3Cu(NO3)2 + 2NO + 4H2O
3Cu(NO3)2 + 2NO + 4H2O
4Mg + 10HNO3(суюл) ![]() 4Mg(NO3)2 + N2O + 5H2O
4Mg(NO3)2 + N2O + 5H2O
Химиялык касиеттери
1) 1) Кадимки температурада суу активдүү металлдар менен реакцияга кирет.
2H2O + 2Na ![]() 2NaOH + H2↑
2NaOH + H2↑
2) Туз пайда кылбоочу оксиддер кычкылтек менен реакцияга кирип, кислоталык оксиддерге чейин кычкылданышат.
2CO + O2 ![]() 2CO2
2CO2
2NO + O2 ![]() 2NO2
2NO2
2SiO + O2 ![]() 2SiO2
2SiO2
3) Кɵмүртектин оксиди (II) менен реакцияга кирип, металлдарды калыбына келтирет.
CO + FeO ![]() Fe + CO2
Fe + CO2
2CO + SnO2 ![]() Sn + 2CO2
Sn + 2CO2
Мүнɵздɵмɵсү
CO – кɵмүртек оксиди (II), ис газы, түссүз, даамсыз, жытсыз, уулуу газ, 0,2% концентрациясы ɵлүмгɵ алып келет. Ал кандагы гемоглобин менен биригип, организм боюнча тарайт. t(кайн) = –192 0С, t(эрүү) = –2030С барабар. Күйүүгɵ жɵндɵмдүү, тамекинин түтүнүндɵ болот.
N2O – азот оксиди (I), «кɵңүл кɵтɵрүүчү газ» – бул сууда жакшы эриген анестезиялык зат, кычкылтек менен болгон аралашмасы хирургиялык операция болоор алдында наркоз катары колдонулат, аны менен дем алганда, адам күлɵ баштайт. Ал жогорку температурада ажырайт:
2N2O ![]() 2N2 +O2 +39 Ккал.
2N2 +O2 +39 Ккал.
NO – азот оксиди (II) – түссүз, жытсыз газ, сууда начар эрийт, абада чагылгандын учкундарынан эндотермиялык реакциянын натыйжасында пайда болгон жалгыз оксид.
N2 + O2 t=2000→ 2NO — Q.
Негиздик оксиддер
Алынышы
1) Металлдарды окистендирүүдөн алынат (ысытуусуз):
2Fe + O2 ![]() 2FeO
2FeO
2) Бир негиздик оксидге активдүү металлды таасир этүү менен башка негиздик оксид алынат:
CuO + Mg ![]() MgO +Cu
MgO +Cu
3) Активдүү металлдар менен калыбына келтирүүдɵн алынат:
Fe2O3 + Mg ![]() 2FeO + MgO
2FeO + MgO
4) Негиздик оксиддер кɵмүртек оксиди менен калыбына келтирүүдɵн алынат:
Fe2O3 + C ![]() 2FeO + CO
2FeO + CO
5) Негиздик оксиддерди кɵмүртек оксиди (II) менен калыбына келтирүүдɵн алынат:
Fe2O3 + CO ![]() 2FeO + CO2
2FeO + CO2
6) Негиздик оксиддер амфотердик оксиддерди суутек менен калыбына келтирүүдɵн алынат:
Fe2O3 + H2 ![]() 2FeO + H2O
2FeO + H2O
7) Кислоталык оксиддер металлдар менен калыбына келтирүүдɵн алынат:
CrO3 + 2Mg ![]() CrO + 2MgO
CrO + 2MgO
8) Кислоталык оксиддерди кɵмүртек менен калыбына келтирүүдɵн алынат:
CrO3 + 2C ![]() CrO + 2CO
CrO + 2CO
9) Кислоталык оксиддерди кɵмүртек оксиди (II) менен калыбына келтирүүдɵн алынат:
CrO3 + 2CO ![]() CrO + 2CO2
CrO + 2CO2
10) Кислоталык оксиддерди суутек менен калыбына келтирүүдɵн алынат:
CrO3 + 2H2 ![]() CrO + 2H2O
CrO + 2H2O
11) Сууда эрибɵɵчү негиздерди ысытып, ажыратуу жолу менен алынат (щелочтордон алууга мүмкүн эмес):
Cu(OH)2 ![]() CuO + H2O
CuO + H2O
12) Газ абалындагы кислоталык оксиддерден пайда болгон туздарды термикалык ажыратуудан алынат:
CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
CuSO3 ![]() CuO + SO2↑
CuO + SO2↑
Негиздик оксиддердин химиялык касиеттери
1) Негиздик оксиддер активдүү металлдар менен реакцияга кирип, калыбына келет:
MgO + Ba ![]() BaO + Mg
BaO + Mg
2) Активдүүлүк катарында суутектен кийин турган металлдардын негиздик оксиддери суутек менен реакцияга кирип, калыбына келет:
CuO + H2 ![]() Cu + H2O
Cu + H2O
Металлдардын активдүүлүк катарында алюминийден кийин турган металлдардын негиздик оксиддери кокс кɵмүрү (C) же кɵмүртек оксиди (II) менен калыбына келет:
FeO + C ![]() Fe + CO↑
Fe + CO↑
SnO + CO ![]() Sn + CO2↑
Sn + CO2↑
Өзгɵрмɵлүү валенттүүлүккɵ ээ болгон металлдардын негиздик оксиддери кычкылтекке чейин калыбына келет.
4FeO + O2 ![]() 2Fe2O3
2Fe2O3
3) Щелочтуу жана щелочтуу жер металлдардын негиздик оксиддери суу менен аракеттенишип, щелочту пайда кылат:
Na2O + H2O ![]() 2NaOH
2NaOH
4) Негиздик оксиддер балкытып эриткенде амфотердик оксиддер менен аракеттенишет:
Na2O + ZnO ![]() Na2ZnO2
Na2ZnO2
5) Негиздик оксиддер кислоталык оксиддер менен реакцияга кирип, туздарды пайда кылат:
CaO + CO2 ![]() CaCO3
CaCO3
6) Негиздик оксиддер кислоталар менен реакцияга кирип, туздарды пайда кылат:
BaO + 2HCl ![]() BaCl2 + H2O
BaCl2 + H2O
7) Негиздик оксиддер амфотердик негиздер менен аракеттенишип, туздарды пайда кылат:
Na2O + Zn(OH)2 ![]() Na2ZnO2 + H2O
Na2ZnO2 + H2O
8) Негиздик оксиддер кычкыл туздарды нейтралдаштырат:
Na2O + 2NaHCO3 ![]() 2Na2CO3 + H2O
2Na2CO3 + H2O
Мүнɵздɵмɵсү
CaO – кальций оксиди, ɵчүрүлбɵгɵн акиташ – ак түстɵгү катуу зат, суу менен жылуулукту бɵлүп чыгаруу менен кубаттуу реакцияга кирет (акиташты ɵчүрɵт), t(эрүү) = 26300С.
CaO + H2O ![]() Сa(OH)2 + Q
Сa(OH)2 + Q
CuO – жез оксиди (II) кара түстɵгү катуу, морт зат,сууда эрибейт, 800 0С жогорку температурада Cu2O – жез оксидин (I), пайда кылуу менен ажырайт, тыгыздыгы –6,45 г/см3 барабар.
Cu2(ОН)2CO3 ![]() CuO + CO2↑ + H2O
CuO + CO2↑ + H2O
Амфотердик оксиддер
Алынышы
1) Амфотердик оксиддер металлдарды окистендирүү жолу менен алынат:
4Al + 3O2 ![]() 2Al2O3
2Al2O3
2) Негиздик оксиддерди металлдар менен окистендирүү аркылуу алууга болот:
4FeO + O2 ![]() 2Fe2O3
2Fe2O3
3) Бир амфотердик оксидге активдүү металлды таасир этүү менен башка амфотердик оксидди алууга болот:
Fe2O3 + 2Al ![]() Al2O3 + 2Fe
Al2O3 + 2Fe
4) Кислоталык оксиддерди калыбына келтирүү менен алынат:
V2O5 + 2H2 ![]() V2O3 + 2H2O
V2O3 + 2H2O
5) Амфотердик негиздерди ысытуу менен ажыратуу менен алууга болот:
Zn(OH)2 ![]() ZnO + H2O
ZnO + H2O
6) Газ абалындагы кислоталык оксиддер менен амфотердик металлдын реакциялашуусунун негизинде пайда болгон туздарды ысытуу менен ажыратуудан да алууга болот:
ZnCO3![]() ZnO + CO2↑
ZnO + CO2↑
7) Амфотердик металлдардан пайда болгон кычкыл туздарды ысытуу менен ажыратуудан алынат:
2Al(HCO3)3 ![]() Al2O3 + 6CO2↑ + 3H2O
Al2O3 + 6CO2↑ + 3H2O
Амфотердик оксиддердин химиялык касиети
1) Амфотердик оксиддерге активдүү металлды таасир эткенде, металлга чейин калыбына келет:
MnO2 + 2Mg ![]() Mn + 2MgO
Mn + 2MgO
2) Активдүүлүк катарында суутектен кийин турган металлдардын амфотердик оксиддери суутек менен реакцияга кирип, негиздик оксидге чейин калыбына келет:
Fe2O3 + H2 ![]() 2FeO + H2O
2FeO + H2O
3) Активдүүлүк катарында алюминийден кийин турган металлдардын амфотердик оксиддери кокс кɵмүрү (С) же кɵмүртек оксиди (II) менен реакцияга кирип, негиздик оксидге чейин калыбына келет:
Fe2O3 + C ![]() 2FeO + CO↑
2FeO + CO↑
2Fe2O3 + 3C ![]() 4Fe + 3CO2↑
4Fe + 3CO2↑
ZnO + CO ![]() Zn + CO2↑
Zn + CO2↑
4) Өзгɵрмɵлүү валенттүү металлдардын амфотердик оксиддери кычкылтектин атому менен аракеттенишип, кислоталык оксидге чейин кычкылданат:
Cr2O3 + 3[О] ![]() 2CrO3
2CrO3
5) Амфотердик оксиддер балкып эригенде негиздик оксиддер менен реакцияга кирип, туздарды пайда кылат:
ZnO + Na2O ![]() Na2ZnO2
Na2ZnO2
CaO + ZnO ![]() СaZnO2
СaZnO2
6 ) Амфотердик оксиддер күчтүү кислоталык оксиддер менен реакцияга кирип, туздарды пайда кылат:
ZnO + N2O5 ![]() Zn(NO3)2
Zn(NO3)2
7) Амфотердик оксиддер негиздер менен реакцияга кирип, тузду жана сууну пайда кылат:
ZnO + Сa(OН)2 ![]() СaZnO2 + H2O
СaZnO2 + H2O
8) Амфотердик оксиддер күчтүү кислоталар менен реакцияга кирип, тузду жана сууну пайда кылат:
ZnO + 2НNO3 ![]() Zn(NO3)2 + H2O
Zn(NO3)2 + H2O
Мүнɵздɵмɵсү
ZnO — цинк оксиди – ак түстɵгү кристаллдык зат, сууда эрибейт, t(эрүү) = 1975 0С барабар. Ак боёкко кошулуучу зат катары колдонулат.
Кислоталык оксиддер
Алынышы
1) Кислоталык оксиддер окистенүү – калыбына келүү реакциясына катышып, металлдын атомардык кычкылтек менен кычкылдануусунан алынат:
Cr + 3[O] ![]() CrO3
CrO3
2) Металл эместин түздɵн–түз окистенүүсүнөн же күйүүсүнɵн алынат:
4P + 5O2 ![]() 2P2O5
2P2O5
3) Туз пайда кылбоочу оксиддерди окистендирүү жолу менен алууга болот:
2CO + O2 ![]() 2CO2
2CO2
4) Негиздик оксиддер атомардык кычкылтек менен окистендирүү аркылуу алынат:
CrO + 2[O] ![]() CrO3
CrO3
5) Кислоталык оксидди амфотердик оксидди атомардык кычкылтек менен окистендирүүдөн алууга болот:
Cr2O3 + 3[O] ![]() 2CrO3
2CrO3
6) Кислоталык оксидди кошумча окистендирүүдөн алынат:
P2O3 + O2 ![]() P2O5
P2O5
7) Газ абалындагы оксиддерден алынган орто туздарды ысытуу менен ажыратуудан алынат:
CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
8) Газ абалындагы оксиддерден пайда болгон кычкыл туздарды ысытуу менен ажыратуудан алынат:
2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
Кислоталык оксиддердин химиялык касиети
1) Кислоталык оксиддер активдүү металлдар менен реакцияга кирет:
SiO2 + 2Mg ![]() 2MgO + Si (аморфтук кремний алынат)
2MgO + Si (аморфтук кремний алынат)
2) Кислоталык оксиддер суутек менен реакцияга кирет:
SiO2 + 2H2 ![]() 2H2O + Si (аморфтук кремний алынат)
2H2O + Si (аморфтук кремний алынат)
3) Кислоталык оксиддер кɵмүртек менен реакцияга кирет:
SiO2 + C ![]() CO2 + Si (кристаллдык кремний алынат, С – кристаллдарды пайда кылуучу зат катары колдонулат)
CO2 + Si (кристаллдык кремний алынат, С – кристаллдарды пайда кылуучу зат катары колдонулат)
4) Кɵмүртек оксиди (II) менен реакцияга кирет:
SiO2 + 2CO ![]() 2CO2 + Si
2CO2 + Si
5) Кислоталык оксиддер кычкылтек менен окистенет:
P2O3 + О2 ![]() P2O5
P2O5
6) Кислоталык оксиддер суу менен реакцияга кирип, кислоталарды пайда кылат:
SO3 + H2O ![]() Н2SO4
Н2SO4
7) Кислоталык оксиддер амфотердик оксиддер менен реакцияга кирип, туздарды пайда кылат:
N2O5 + ZnO ![]() Zn(NO3)2
Zn(NO3)2
8) Щелочтор менен реакцияга кирип, туздарды пайда кылат:
SO2 + NaOH ![]() NaHSO3
NaHSO3
SO2 + 2NaOH ![]() Na2SO3 + H2O
Na2SO3 + H2O
9) Кислоталык оксиддер амфотердик негиздер менен реакцияга кирип, тузду жана сууну пайда кылат:
3N2O5 + 2Al(OH)3 ![]() 2Al(NO3)3 + 3 H2O
2Al(NO3)3 + 3 H2O
10) Газ абалындагы активдүүлүгү жогору болгон кислоталык оксиддер, кислоталардын жана туздардын курамындагы активдүүлүгү тɵмɵн болгон оксиддерди сүрүп чыгарат:
H2CO3 + SO2 ![]() H2SO3 + CO2↑
H2SO3 + CO2↑
Na2CO3 + SO2 ![]() Na2SO3 + CO2↑
Na2SO3 + CO2↑
11) Кислоталык оксиддер негиздик туздарды нейтралдаштырат:
N2O5 + 2Ca(OH)NO3 ![]() 2Ca(NO3)2 + H2O
2Ca(NO3)2 + H2O
Мүнɵздɵмɵсү
SO3 — күкүрт оксиди (IV), күкүрт ангидриди – түссүз, учма суюктук, tэрүү. 16,8 0С барабар, катализаторду катыштырып, күкүрт оксидин SO2 окистендирүү жолу менен алынат, күчтүү окистендирүүчү касиетке ээ.
2SO2 + О2 ![]() 2SO3
2SO3
Р2O5 —ак түстɵгү, гигроскоптуу, порошок сымал зат, 359 0С, газ абалына ɵтɵт, нымдуулукту соруп алуучу каражат катары колдонулат.
Туздар
Туздар – металлдардын атомунан жана кислота калдыктарынан турган татаал заттар.
Туздар орто (нормалдуу), кычкыл, негиздик, комплекстүү жана аралаш болуп бɵлүнɵт.
Орто же нормалдуу туздар – суутектин атомдору металлдын атомдору менен толук орун алмашкан жана гидроксил топтору кислота калдыктары менен орун алмашкан туздар.
Кычкыл туздар – суутектин атому металлдын атомдору менен толук орун алмашпаган туздар.
Негиздик туздар – курамында кислоталык оксиддер менен катар гидроксил тобу болгон туздар.
Кош туздар – суутектин атомдору эки башка металлдын атомдору менен орун алмашкан туздар.
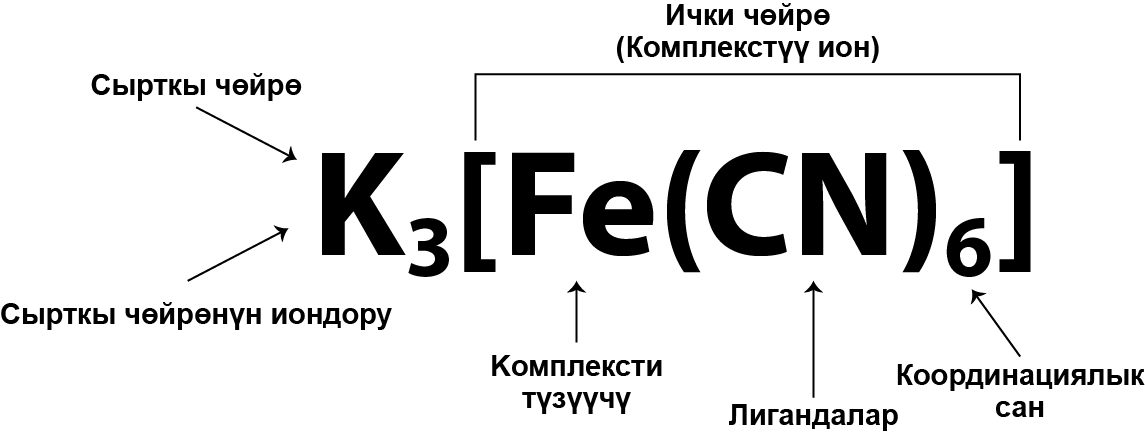
Комплекстик туздар – металлдын борбордук атомунан–комплекс түзүүчүдɵн жана аны курчаган лигандалардан – карама–каршы багытталган иондордон турат. Ал комплекстик туздун ички катмарынан жана ага карама–каршы багытталган сырткы катмардан турат.
Аралаш туздар – металлдын бир атому эки кислота калдыгы менен байланышкан туздар. Ca(OCl)Cl – кальций гипохлорити (хлор акиташы).
Туздардын алынышы
1) Металлдар металл эместер менен реакцияга киргенде, туздар алынат:
2Na + Cl2 ![]() 2NaCl
2NaCl
Fe + S ![]() FeS
FeS
2) Металлдар кислоталар менен реакцияга киргенде туздар пайда болот:
Zn + 2HCl ![]() ZnCl2 + H2 ↑
ZnCl2 + H2 ↑
3) Туздар активдүү металлдар менен реакцияга киргенде, жаңы туздар алынат:
Fe + CuSO4 ![]() FeSO4 + Cu
FeSO4 + Cu
4) Негиздик жана амфотердик оксиддерди балкытып эриткенде туздар алынат:
K2O + ZnO ![]() K2ZnO2
K2ZnO2
5) Негиздик жана кислоталык оксиддер ɵз ара аракеттенишкенде, туздар пайда болот:
CaO + CO2 ![]() CaCO3
CaCO3
6) Туздар амфотердик жана кислоталык оксиддерди балкытып эриткенде алынат:
Al2O3 + P2O5 ![]() 2AlPO4
2AlPO4
7) Негиздик оксиддер кислоталар менен аракеттенишкенде туздар пайда болот:
CuO + H2SO4 ![]() CuSO4 + H2O
CuSO4 + H2O
8) Кислоталык оксиддер щелочтор менен реакцияга киргенде, орто жана кычкыл туздар пйда болот:
СO2 + NaOH ![]() + NaHСO3
+ NaHСO3
СO2 + 2NaOH ![]() + Na2СO3 + H2O
+ Na2СO3 + H2O
9) Газ абалындагы активдүү оксиддер туздар менен реакцияга киргенде, жаңы туздар пайда болот:
SO2 + Na2CO3 ![]() Na2SO3 + CO2↑
Na2SO3 + CO2↑
10) Негиздер менен кислоталар аракеттенишип, нейтралдашуу реакциясына катышканда, орто, кычкыл жана негиздик туздар пайда болот:
Ba(OH)2 + H2SO4 ![]() BaSO4↓ + 2H2O
BaSO4↓ + 2H2O
NaOH + H2SO4 ![]() NaHSO4 + H2O
NaHSO4 + H2O
Ba(OH)2 + HCl ![]() Ba(OH)Cl + H2O
Ba(OH)Cl + H2O
11) Негиздер менен туздар ɵз ара аракеттенишкенде, жаңы туз пайда болот:
Ca(OH)2 + 2Na3PO4 ![]() Ca3(PO4)2↓ + 3NaOH
Ca3(PO4)2↓ + 3NaOH
Туздардын химиялык касиеттери
1. Туздар активдүү металлдар менен орун алмашуу реакциясына кирет:
3K + AlCl3![]() 3KCl + Al
3KCl + Al
Fe + CuSO4 ![]() FeSO4 + Cu
FeSO4 + Cu
2. Туздар эрүүчү негиздер (щелочтор) менен реакцияга кирип, жаңы тузду жана жаңы негизди пайда кылат:
2NaOH + CuSO4 ![]() Cu(OH)2 ↓ + Na2(SO4)2
Cu(OH)2 ↓ + Na2(SO4)2
3. Туздар кислоталар менен реакцияга кирип, жаңы тузду жана жаңы кислотаны пайда кылат:
Na3PO4 + 3HCl ![]() 3NaCl + H3PO4
3NaCl + H3PO4
4. Туздар бири–бири менен аракеттенишкенде, аз диссоциациялануучу, жаңы тузду пайда кылат.
BaCl2 + Na2(SO4)2 ![]() BaSO4↓ + 2NaCl
BaSO4↓ + 2NaCl
Туздар – металлдын атомдорунан жана кислота калдыктарынан турган татаал заттар. Туздардын курамына металлдын атомдорунан сырткары, донор–акцептордук байланыштын натыйжасында пайда болгон аммоний йондору да болушу мүмкүн.
Негиздер
Негиздер – металлдын атомдорунан жана алар менен байланышкан бир же бир нече гидроксил топторунан турган татаал заттар.Негиздер сууда эрүүчү жана эрибɵɵчү болуп бɵлүнɵт. Эрүүчү негиздер – щелочтор деп аталат.
Эрүүчү негиздерге – щелочторго, валенттүүлүгү I барабар болгон металлдар, ошондой эле барий, стронций жана кальций гидроксиддери кирет. Негиздердин ичинен кош касиетке ээ болгон, амфотердүү негиздерди белгилеп кетели., Курамында III, IV валенттүү металлдар болгон негиздер жана цинк гидроксиди амфотердүү негиздерге кирет. Бардык амфотердик негиздер сууда эрибейт. Бир эле амфотердик негиздин формуласы ар түрдүү болушу мүмкүн. Мисалы, Al(OH)3 жана H3ALO3. Химиялык реакцияларда зат чɵйрɵгɵ карата ɵзгɵрɵт. Эгер алюминий гидроксиди кислота менен реакцияга кирсе, формуласы – Al(OH)3, ал эми щелочтор менен реакцияга киргенде, формуласы: H3ALO3 ортоалюминий кислотасы деп белгиленет.Бардык амфотердик негиздер щелочтор менен реакцияга киргенде, суу бɵлүнүп чыгат, [Zn(OH)2] башкасы), HAlO2 (метаалюминий кислотасы) да бɵлүнүп чыгыш мүмкүн.
Щелочтордун жана негиздердин алынышы
1. Активдүү металлдар суу менен аракеттенишкенде щелочтор алынат:
2Na + 2H2O → 2NaOH + H2↑
2. Активдүү металлдардын оксиддери суу менен реакцияга киргенде щелочтор пайда болот:
СaO + H2O → Ca(OH)2
3. Туздар менен щелочтор алмашуу реакциясына киргенде, сууда эрибɵɵчү негиздер, анын ичинен– амфотердүү негиздер алынат:
MgCl2 + 2KOH → Mg(OH)2 ↓ + 2KCl
ZnSO4 + 2NaOH → Zn(OH)2 ↓ + Na2SO4
FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
4. Калий жана натрий гидроксиди алардын туздарынын эритмелерин электролиздɵɵдɵ, хлорид катары кɵп ɵлчɵмдɵ алынат
2KCl + 2H2O ![]() 2KOH + H2↑ + Cl2↑
2KOH + H2↑ + Cl2↑
Негиздердин химиялык касиеттери
1. Щелочтор кɵмүртек оксиди (II) менен реакцияга кирип, щелочтуу металлдын формиатын пайда кылат:
NaOH + CO ![]() HCOONa
HCOONa
2. Щелочтор амфотердик оксиддер менен реакцияга кирип, туздарды пайда кылат:
2NaOH + ZnO ![]() Na2ZnO2 + H2O
Na2ZnO2 + H2O
6NaOH + Al2O3 ![]() 2Na3AlO3 + 3H2O
2Na3AlO3 + 3H2O
2NaOH + Al2O3 ![]() 2NaAlO2 + H2O (эң кɵп кездешкен реакция)
2NaAlO2 + H2O (эң кɵп кездешкен реакция)
3. Щелочтор кɵмүртек оксиди (IV), менен реакцияга кирип, эки түрдүү туздарды пайда кылат:
NaOH + CO2 ![]() NaHCO3
NaHCO3
NaOH + CO2 ![]() Na2CO3 + H2O
Na2CO3 + H2O
4. Щелочтор амфотердик гидроксиддер менен аракеттенишип, туздарды пайда кылат:
2NaOH + Zn(OH)2 ![]() Na2ZnO2 + 2H2O
Na2ZnO2 + 2H2O
3NaOH + Al(OH)3 ![]() Na3AlO3 + 3H2O
Na3AlO3 + 3H2O
NaOH + Al(OH)3 ![]() NaAlO2 + 2H2O
NaAlO2 + 2H2O
5. Щелочтор жана сууда эрибɵɵчү негиздер кислоталар менен реакцияга кирет:
NaOH + HCl ![]() NaCl + H2O
NaCl + H2O
Fe(OH)3 + 3HCl ![]() FeCl3 + 3H2O
FeCl3 + 3H2O
Сууда эрибɵɵчү амфотердик негиздер күчтүү кислоталар менен реакцияга киргенде, эрүүчү туздарды пайда кылат.
Негиздердин жана кислоталардын ортосунда жүрүп, тузду жана сууну пайда кылган реакция, нейтралдашуу реакциясы деп аталат.
6. Эгерде негиз кислотанын ортосунда жүргɵн нейтралдашуу реакциясы аягына чейин жүрбɵсɵ, анда негиздик туздар пайда болот.
Ba(OH)2 + HNO3 ![]() Ba(OH)NO3 + H2O
Ba(OH)NO3 + H2O
7. Щелочтор туздар менен аракеттенишип, жаңы негиздерди жана жаңы туздарды пайда кылат:
FeCl3 + 3NaOH ![]() Fe(OH)3↓ + 3NaCl
Fe(OH)3↓ + 3NaCl
CuSO4 + 2KOH ![]() Cu(OH)2↓ + K2SO4
Cu(OH)2↓ + K2SO4
Кислоталар
Кислоталар деп, металлдын атомдору менен орун алмашууга жɵндɵмдүү болгон суутектин атомдорунан жана кислота калдыктарынан турган татаал заттар аталат. Кислотанын негиздүүлүгү анын курамындагы суутектин атомунун санына жараша болот. Негиздүүлүгүнɵ карата кислоталар бир негиздүү, эки негиздүү жана кɵп негиздүү болуп бɵлүнɵт. Мындан сырткары кислоталар кычкылтексиз (HI, HBr, HCl, HF, H2S↑, HCN) жана кычкылтектүү (HClO4, H2SO4, HNO3, H4P2O7, H2SO3↑, H3PO4, HNO2, H2CO3↑) болуп да бɵлүнɵт.
Кислоталардын алынышы
1) Кычкылтексиз кислоталар металл эместерден түз (суутектен) синтездɵɵ жолу менен алынат:
H2 + Cl2 ![]() 2HCl
2HCl
H2 + S ![]() H2S
H2S
2) Галогендүү кислоталар терс электрлүүлүгү жогору болгон галогендин, терс электрлүүлүгү тɵмɵн галогенди сүрүп чыгаруусунан алынат:
2HI + Cl2 ![]() 2HCl + I2↓
2HCl + I2↓
3) Кычкылтектүү кислоталар кислоталык оксиддер суу менен реакцияга киргенде алынат:
P2O5 + 3H2O ![]() 2H3PO4
2H3PO4
4) Кислоталарды аягына чейин окистендирүү менен жаңы кислотаны алууга болот:
2H2SO3 + O2 ![]() 2H2SO4
2H2SO4
5) Активдүүлүгү жогору болгон кислоталык оксиддердин, активдүүлүгү тɵмɵн оксидди сүрүп чыгаруусу менен кислоталарды алууга болот. (ɵзгɵчɵ газ абалындагы кислоталык оксиддерге мүнɵздүү):
H2CO3 + SO2 ![]() H2SO3 + CO2↑
H2SO3 + CO2↑
6) Кислоталар туздар менен башка күчтүү кислоталардын ортосундагы алмашуу реакциясынын натыйжасында да алынат:
Ba(NO3)2 + H2SO4 ![]() BaSO4↓ + 2HNO3
BaSO4↓ + 2HNO3
Кислоталардын химиялык касиеттери
1) Кислоталар активдүү амфотердик металлдар менен реакцияга кирип, суутекти бɵлүп чыгарат:
2HCl + Zn ![]() ZnCl2 + H2↑
ZnCl2 + H2↑
H2SO4(суюл) + Mn ![]() MnSO4 + H2↑
MnSO4 + H2↑
2) Концентрацияланган күкүрт жана азот кислоталары күчтүү кычкылдандыргыч болуп саналат, алар металлдар менен реакцияга киргенде, күкүрттүү газ, күкүрттүү суутек, күкүрт, азоттун оксиди же аммиак бɵлүнүп чыгат:
3) Галогендүү кислота үчүн активдүү галогендин, активдүүлүгү тɵмɵн галогенди сүрүп чыгаруусу мүнɵздүү болот:
2HI + Cl2 ![]() 2HCl + I2 ↓
2HCl + I2 ↓
4) Кислоталар негиздик оксиддер менен аракеттенишип, сууну жана тузду пайда кылат:
H2SO4(суюл) + BaO ![]() BaSO4↓ + H2O
BaSO4↓ + H2O
5) Кислоталар амфотердик оксиддер менен реакцияга кирип, тузду жана тузду пайда кылат:
2HNO3 + ZnO ![]() Zn(NO3)2 + H2O
Zn(NO3)2 + H2O
6) Кислоталар активдүү кислоталык оксиддер менен реакцияга кирип, жаңы кислотаны жана активдүүлүгү тɵмɵн болгон оксидди пайда кылат. Газ абалындагы оксиддер менен реакция жакшы жүрɵт:
H2CO3 + SO2 ![]() H2SO3 + CO2↑
H2SO3 + CO2↑
7) Кислоталар эрүүчү (щелочтор) жана эрибɵɵчү негиздер нейтралдаштыруу реакцияларына кирет. Реакциянын натыйжасында орто туздар жана кычкыл туздар пайда болот.
2NaOH + H2SO4 ![]() Na2SO4 + 2H2O
Na2SO4 + 2H2O
NaOH + H2SO4 ![]() NaHSO4 + H2O
NaHSO4 + H2O
8) Кислоталардын ортосунда окистенүү–калыбына келүү реакциялары жүрɵт.
H2SO4 + HBr ![]() Br2 + SO2↑ + H2O
Br2 + SO2↑ + H2O
9) Кислоталар туздар менен алмашуу реакциясына кирет да жаңы кислотаны жана жаңы тузду пайда кылат.
H2SO4(конц) + Ba(NO3)2 ![]() BaSO4↓ + 2HNO3
BaSO4↓ + 2HNO3
10) Кислоталар негиздик туздарды кычкыл туздарга чейин нейтралдаштырат.
Mg(OH)Cl + HCl ![]() MgCl2 + H2O
MgCl2 + H2O
11) Күчтүү кислоталар туздарды газ абалындагы оксиддерге чейин ажыратат.
CaSO3 + 2HCl ![]() CaCl2 + SO2↑
CaCl2 + SO2↑
Кислоталардын мүнɵздɵмɵсү
HNO3 азот кислотасы. Бул – түссүз, кескин жыттуу суюктук, оңой бууланат tкай = 860С жана суу менен каалагандай катышта аралашат. Башка кислоталардан күчтүү окистендиргич касиети менен айрымаланат. Кɵпкɵ чейин сакталып турса, ɵңү сары түскɵ ɵзгɵрүп, күрɵң түстɵгү газ – азот оксидин (IV) – NO2 бɵлүп чыгаруу менен ажырайт. Күйүп жаткан чычаланы концентрацияланган азот кислотасына жакындатканда, бɵлүнүп чыккан кычкылтектин таасири менен ал от алып күйɵт.
4HNO3 hv→ 2H2O + 4NO2 + O2↑
Сатыкка чыгарылган кислоталар 63% концентрацияга жана 1,4г/см3 тыгыздыкка ээ болот. Чачырап кетсе, белок менен аракеттенишип, сары такты пайда кылат жана теринин күйүшүнɵ алып келет. Аны кɵп ɵлчɵмдɵгү суу менен жууп, соданын эритмеси менен нейтралдоо керек.
H2SO4 күкүрт кислотасы – бул түссүз, жытсыз майланышкан суюктук, t крист +10,50C. Күкүрт кислотасын мурун «олеум» деп, ал эми суусуз H2SO4 «купорос майы» деп аташкан. Күкүрт кислотасы күчтүү окистендиргич, ал кислоталарга мүнɵздүү бардык касиеттерге ээ болот. Бул эки негиздүү кислота, кычкыл жана орто тузду пайда кылуу менен баскычтуу диссоциацияланат. Күкүрт кислотасынын концентрациясы 70% тɵмɵн болсо, «суюлтулган», ал эми 70% жогору болсо «концентрацияланган эритме», деп аталат. Концентрацияланган күкүрт кислотасы тамчылап кетсе, терини күйгүзɵт, ошондуктан, мындай учурда аны суу менен жууп, тамак–аш содасынын эритмеси менен сүртүү керек.
HCl туз кислотасы – хлордуу суутектин суудагы эритмеси – түссүз, нымдуу абада бууланат, t(эрүү) = – 1140С, t(кай) = – 850С барабар. Суутекти хлордо күйгүзүп жана аны сууда эритүү жолу менен алууга болот. Азыркы учурда сатыкка чыккан туз кислотасында хлордуу суутектин массалык үлүшү 37%, эритменин тыгыздыгы 1,19г/см3 барабар болот. Туз кислотасы туздарды алууда, металлдарды чегүүгɵ, тамак–аш ɵнɵр жайында, медицинада жана химиялык анализге колдонулат. Ал карын зилинин курамына да кирет.
Н3РО4 фосфор же ортофосфор кислотасы. Бул – түссүз кристаллдык зат, t(эрүү) = 420С. Үч негиздүү, сууда жакшы эриген, уулуу эмес, начар кислота. Тамак–аш ɵнɵр жайында ширелерди жасоодо колдонулат. Фосфор кислотасын ɵнɵр жайда экстрациялык метод менен, фосфориттерди жана аппатиттерди концентрацияланган кислота менен иштетүү жолу менен алынат.
Ca3(PO4)2 + 3H2SO4 ![]() 3CaSO4↓ + 2H3PO4
3CaSO4↓ + 2H3PO4
Глоссарий
- Амфотердүү металлдар деп, бирикмелери кислоталык да, негиздик да касиетти алып жүргɵн элементтер саналат, ошондуктан, аларды амфотердүү – «кош касиетке ээ» деп аташат. («Амфос» деген сɵздүн уңгусун салыштырсак, – амфора деп, эки кармагычы бар вазаны аташат. Амфибия – сууда да, кургакта да дем алган жаныбарларды атайбыз, мисалы, бака).
- Амфотердик оксиддер деп, окистенүү даражасы +3 жана +4 барабар болгон металлдын оксиддери аталат (Al2O3, Fe2O3, Cr2O3, MnO2, V2O3, PbO2, SnO2 и ZnO). Амфотердик оксиддерге амфотердүү негиздер туура келет.
- Бинардык бирикмелер эки элементтин атомдорунан турат.Бинардык бирикмелердин аталышы –ид деген мүчɵ менен аяктайт. Мисалы: Mg3N2 – магний нитриди.
- Жɵнɵкɵй заттар деп, молекуласы бир гана химиялык элементтин атомдорунан турган заттар аталат . Жɵнɵкɵй заттын курамындагы атомдордун санына же кристаллдык торчолордун түзүлүшүнɵ жараша жɵнɵкɵй заттар ар түрдүү аллотропиялык ɵзгɵрүүлɵрдү пайда кылат (мисалы, О2 – кычкылтек жана О3 – озон; алмаз жана графит).
- Инерттүү же асыл газдар (VIII – A группа) – бул газ абалындагы, молекуласы бир гана атомдон турган элементтердин тобу.
- Кислоталык оксиддер деп, окистенүү даражасы +3, +4, +5, +6, +7 болгон металл эместердин оксиддери аталат (Cl2O7, SO3, N2O5, P2O5, SO2↑, N2O3, P2O3, CO2↑, SiO2↓), (Cl, Br, I– окистенүү даражалары +1 барабар)(Cl2O), жана окистенүү даражасы +5, +6, +7 болгон металлдардын оксиддери (CrO3, Mn2O7, V2O5) кирет. Кислоталык оксиддерге кислоталар туура келет.
- Металлдар деп, сырткы электрондук катмарындагы 1,2,3 электрондорун башка атомго оңой берген элементтерди айтабыз.
- Металл эместер деп, сырткы электрондук катмарында 4 тɵн кɵп электрону бар элементтерди айтабыз (ошондой эле сырткы электрондук катмарында 3 электрону бар борду кошууга болот).
- Негиздик оксиддер – окистенүү даражасы +1 жана +2 болгон металлдардын оксиддери. (H2O, CO, SiO, NO, N2O).
- Оксиддер – эки элементтен турган, алардын бирɵɵ кычкылтек болгон татаал заттар. Оксиддерди аталышында биринчи элементтин аты, андан соң «оксиди» деген сɵз кошулуп айтылат. Мисалы: ВаО – барий оксиди. Оксиддин курамындагы ɵзгɵрмɵлүү валенттүүлүккɵ ээ болгон элементтердин валенттүүлүгү сɵзсүз жазылат, мисалы: СuO – жез оксиди (II) же Cu2O – жез оксиди (I).
- Туз пайда кылбоочу оксиддерге окистенүү даражасы + 1 жана +2 болгон металл эместердин оксиддери кирет (H2O, CO, SiO, NO, N2O).
- Татаал заттар деп, эки же андан кɵп химиялык элементтин атомдорунан турган заттарды айтабыз.
Пайдалуу шилтемелер
Видеоурок «Качественные реакции в химии». Сайт «Видеоуроки в интернет» (Электронный ресурс). //URL:.https://www.youtube.com/watch?v=pk7UXWVBC9U&t=193s (дата обращения 07.03.18.)
Библиография
- Кособаева Б. – Использование компьютера в учебном процессе химии / Текст / Б. Кособаева, Н.Б. Арстанбекова // Абай атындагы Казак Улуттукпедагогикалык университеттинин Хабарши (Вестник) Жаратылыш таануу-география илимдери сериясынын 2012 №2 (32). – 68–71–бб.
- Стартовый эксперимент как форма включенности каждого ученика в учебный процесс / Текст / Б. Кособаева, Син Е.Е. // Химия в школе. – Москва, 2016. – №6.
- Дидактические особенности использования технологии обучения на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №6(48), С.155–160.
- Применение технологии системного усвоения знаний в обучении химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №7(49), С.152–159.
- Реализация межпредметных связей на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №10(52), С.136–139.
- Методологические аспекты обучения в современных условиях. / Текст / Б. Кособаева, Син Е.Е., Жакышова Б.Ш. // Проблемы современной науки и образования. – Иваново, 2016. – №13(55), С.104–108.
- Формирование системы понятий при обучении химии в школе. / Текст / Б. Кособаева, П.Э. Токомбаева // Вестник Кыргызского национального университета имени Ж. Баласагына. – Бишкек, 2017. – Специальный выпуск. С.77–81.
- Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.
- Р.А. Лидин Справочник по общей и неорганической химии. М. «Просвещение» 1997г.
- И.Т. Гороновский, Ю.П. Назаренко, Е.Ф. Некряч. Киев, «Наукова думка», 1974г.
- Джейн Верзейм, Крис Окслейд и д-р Джон Ватерхаус .Химия. Школьный иллюстрированный справочник (пер. с англ.), М. «Росмэн», 1995г.
- Л.Л.Андреева, Д.Ю. Добротин, О.С. Габриелян и др. ХИМИЯ, «Большой справочник для школьников и поступающих в вузы», М. «Дрофа», 2004г.
- Химия. Справочник школьника. Центр гуманитарных наук при факультете журналистики МГУ им. М.В. Ломоносова. М. 1997 г.
- «Хочу все знать» Сб. Ленинград»Детская литература».1987 г.
- «Что такое. Кто такой». Изд. «Педагогика» М. 1990 г.
- «Энциклопедия для детей». Химия т. 17 Изд. дом «Аванта».2000г.
Бир килограммдык баштыктагы кристаллдык же кир жуугуч соданын (Na2CO3 • 10H2O) 370 граммы гана активдүү зат, ал эми калганы, – кристаллдык суу болуп саналат.
Натрий гидроксидинин NaOH басымдуу бɵлүгү нефтини тазалоо үчүн колдонулат.
Адамдын организминдеги эң жогорку кычкылдуулук анын ашказанында болот, себеби, андагы PH бирге чейин жетет.
Кыргызстанда Кара–Кечедеги кɵмүрлɵрдү суу кошуп ысытуу аркылуу газ абалына (CO + H2) айландыруу жана газ түтүктɵрү аркылуу Бишкекке жеткирүү ыңгайлуу болот.
C + H2O ![]() CO + H2
CO + H2
Бул методду таза суутекти алууга да колдонсо да болот.
9C + 7H2O + O2 ![]() 9CO + 7H2
9CO + 7H2
Кɵмүр абада күйүп, андагы температура 800оС ашкан учурда, кɵмүртектин бирикмелери абанын курамындагы азот менен биригип, ɵтɵ уулуу газ дицианды (CN≡NC) пайда кылышы мүмкүн.