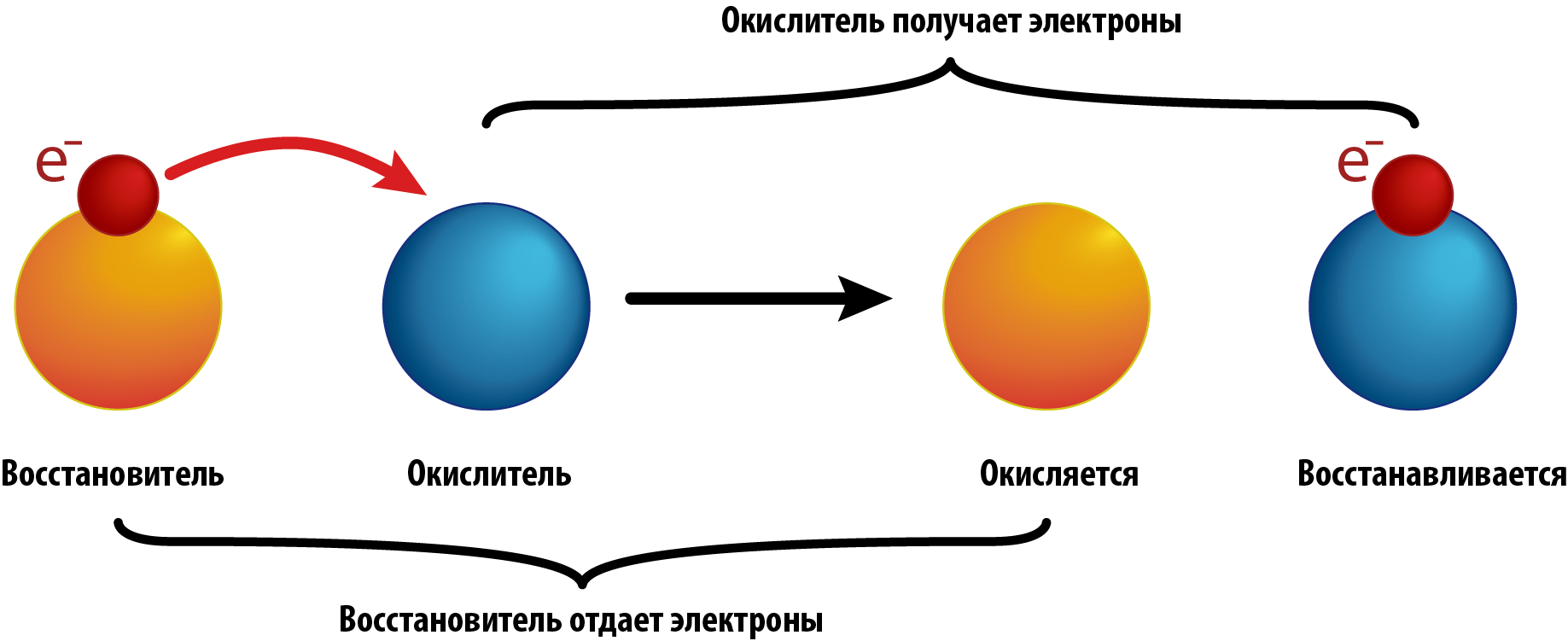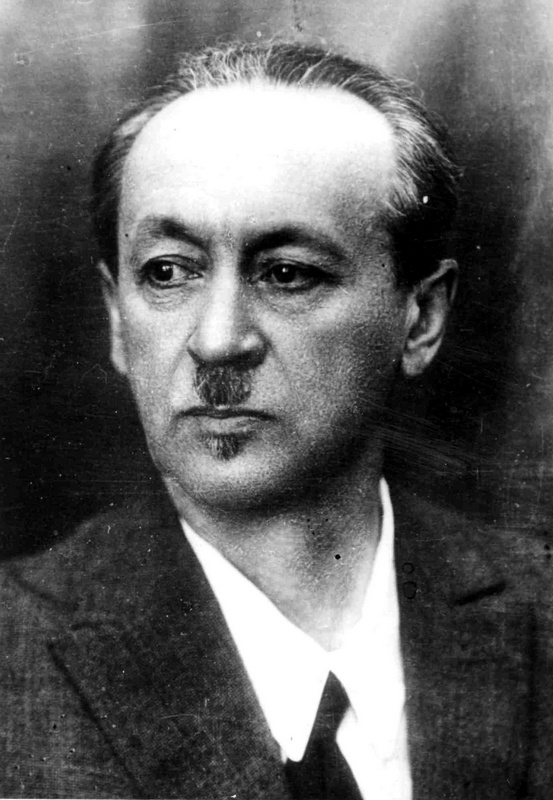Химия: Окислительно-восстановительные реакции — различия между версиями
Admine2 (обсуждение | вклад) (→Художественная литература) |
Admine2 (обсуждение | вклад) |
||
| (не показано 59 промежуточных версий этого же участника) | |||
| Строка 1: | Строка 1: | ||
{{Якорь|Начало}} | {{Якорь|Начало}} | ||
<div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | ||
| − | |||
| − | |||
| − | + | <span class = "firstcharacter">О</span>кислительно-восстановительными реакциями являются такие реакции, в которых у атомов, входящих в состав молекул изменяются степени окисления по окончании реакции. | |
| − | + | Отдельно не существует процесса окисления или процесса восстановления. Есть процесс передачи электронов от атомов одного элемента к атомам другого элемента. В реакциях самоокисления – самовосстановления участвуют атомы одного элемента, только часть из них отдает электроны, а другая часть их принимает. | |
| − | + | <div class="textblock">{{center|Атом, который отдает электроны, является восстановителем, он приобретает положительный заряд. А атом, который принимает электроны, получает отрицательный заряд и является окислителем.}}</div> | |
| − | |||
| − | + | {{center-p|[[file:OVR.png|600px|Окислительно-восстановительный процесс]]}} | |
| − | + | Окислители всегда имеют наибольшее значение электроотрицательности. В формулах сложных веществ всегда есть как окислители, так и восстановители. Окислитель в формуле вещества всегда один – это атом с наибольшей электроотрицательностью, он заряжен отрицательно. | |
| − | + | Восстановителей в формуле сложного вещества может быть 1, 2, 3, они все имеют положительный заряд. В формуле вещества количество отрицательных зарядов на атомах окислителя равно сумме положительных зарядов на атомах всех восстановителей. В целом атом - электронейтральная частица. На этом балансе электронов основано решение окислительно-восстановительных уравнений. | |
| − | + | == Классификация ОВР == | |
| − | + | {{center|[[file:KlassifikaciaOVR.png|Классификация окислительно-восстановительных реакций]]}} | |
| − | |||
| − | + | == Решение межмолекулярных ОВР == | |
| + | В классических вариантах окислительно-восстановительных реакций всегда есть три действующих компонента: | ||
| + | |||
| + | '''вещество, на которое направлен процесс,''' | ||
| + | |||
| + | '''вещество окислитель''' | ||
| + | |||
| + | '''вещество - подкислитель''' (чаще всего эти реакции идут в кислой среде) – обычно оно богато главным и самым распространенным окислителем – кислородом. | ||
5H<sub>2</sub>S + 2KMnO<sub>4</sub> + 3H<sub>2</sub>SO<sub>4</sub>{{arrowleft}}K<sub>2</sub>SO<sub>4</sub> + 2MnSO<sub>4</sub> + 5S{{arrowdown}} + 8H<sub>2</sub>O | 5H<sub>2</sub>S + 2KMnO<sub>4</sub> + 3H<sub>2</sub>SO<sub>4</sub>{{arrowleft}}K<sub>2</sub>SO<sub>4</sub> + 2MnSO<sub>4</sub> + 5S{{arrowdown}} + 8H<sub>2</sub>O | ||
| − | H<sub>2</sub>S | + | В данном уравнении: |
| + | |||
| + | '''H<sub>2</sub>S''' – вещество, на которое направлен процесс, | ||
| − | KMnO<sub>4</sub> – вещество окислитель | + | '''KMnO<sub>4</sub>''' – вещество окислитель |
| − | H<sub>2</sub>SO<sub>4</sub>– вещество | + | '''H<sub>2</sub>SO<sub>4</sub>''' – вещество – подкислитель. |
| − | В результате реакции 5 молей сероводорода окисляется до 5 молей серы, при этом молекула окислителя разрушается и металлы калий и марганец получают кислотные остатки от молекулы подкислителя | + | <div class="textblock">В результате реакции 5 молей сероводорода окисляется до 5 молей серы, при этом молекула окислителя разрушается и металлы калий и марганец получают кислотные остатки от молекулы подкислителя – серной кислоты. Все остатки атомов кислорода и водорода превращаются в воду.</div> |
| − | 1. Определить степени окисления атомов в формулах всех веществ | + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-ovr1"> |
| + | '''1. Определить степени окисления атомов в формулах всех веществ:''' | ||
| − | +1-2 | + | <span class="el" data-title="+1">H</span><sub>2</sub><span class="el" data-title="-2">S</span> + <span class="el" data-title="+1">K</span><span class="el" data-title="+7">Mn</span><span class="el" data-title="-2">O</span><sub>4</sub> + <span class="el" data-title="+1">H</span><sub>2</sub><span class="el" data-title="+6">S</span><span class="el" data-title="-2">O</span><sub>4</sub>{{arrowleft}}<span class="el" data-title="+1">K</span><sub>2</sub><span class="el" data-title="+6">S</span><span class="el" data-title="-2">O</span><sub>4</sub> + <span class="el" data-title="+2">Mn</span><span class="el" data-title="+6">S</span><span class="el" data-title="-2">O</span><sub>4</sub> + <span class="el" data-title="0">S</span>{{arrowdown}} + <span class="el" data-title="+1">H</span><sub>2</sub><span class="el" data-title="-2">O</span> |
| − | + | '''2. Подчеркнуть элементы, изменившие степени окисления до реакции и после реакции:''' | |
| − | 2 | + | <span class="el" data-title="+1">H</span><sub>2</sub><span class="el" data-title="-2">S</span> + <span class="el" data-title="+1">K</span><span class="el" data-title="+7"><ins>Mn</ins></span><span class="el" data-title="-2">O</span><sub>4</sub> + <span class="el" data-title="+1">H</span><sub>2</sub><span class="el" data-title="+6">S</span><span class="el" data-title="-2">O</span><sub>4</sub>{{arrowleft}}<span class="el" data-title="+1">K</span><sub>2</sub><span class="el" data-title="+6">S</span><span class="el" data-title="-2">O</span><sub>4</sub> + <span class="el" data-title="+2"><ins>Mn</ins></span><span class="el" data-title="+6">S</span><span class="el" data-title="-2">O</span><sub>4</sub> + <span class="el" data-title="0">S</span>{{arrowdown}} + <span class="el" data-title="+1">H</span><sub>2</sub><span class="el" data-title="-2">O</span> |
| − | + | '''3. В уравнение электронного баланса выписать данные с указанием степеней окисления до и после реакции:''' | |
| − | + | Mn <sup>+7 -5e</sup> {{arrowleft}} Mn <sup>2+</sup> | 5 | 2 | |
| − | + | S <sup>+2 +2e</sup> {{arrowleft}} S <sup>0</sup> | 2 | 5 | |
| − | + | <p style="display:inline; padding:3px; background-color:yellow;">'''Уравнение электронного баланса'''</p> | |
| − | S +2 | ||
| − | |||
| − | 4. В уравнение переносим коэффициенты, полученные в электронном балансе, 2 к Mn, 5 к S в правой стороне уравнения | + | '''4. В уравнение переносим коэффициенты, полученные в электронном балансе, 2 к Mn, 5 к S в правой стороне уравнения:''' |
H<sub>2</sub>S + K<ins>Mn</ins>O<sub>4</sub> + H<sub>2</sub>SO<sub>4</sub>{{arrowleft}}K<sub>2</sub>SO<sub>4</sub> + 2<ins>Mn</ins>SO<sub>4</sub> + 5<ins>S</ins>{{arrowdown}} + H<sub>2</sub>O | H<sub>2</sub>S + K<ins>Mn</ins>O<sub>4</sub> + H<sub>2</sub>SO<sub>4</sub>{{arrowleft}}K<sub>2</sub>SO<sub>4</sub> + 2<ins>Mn</ins>SO<sub>4</sub> + 5<ins>S</ins>{{arrowdown}} + H<sub>2</sub>O | ||
| − | Проставим | + | Проставим эти же коэффициенты в левую часть уравнения |
5H<sub>2</sub><ins>S</ins> + 2K<ins>Mn</ins>O<sub>4</sub> + H<sub>2</sub>SO<sub>4</sub>{{arrowleft}}K<sub>2</sub>SO<sub>4</sub> + 2<ins>Mn</ins>SO<sub>4</sub> + 5<ins>S</ins>{{arrowdown}} + H<sub>2</sub>O | 5H<sub>2</sub><ins>S</ins> + 2K<ins>Mn</ins>O<sub>4</sub> + H<sub>2</sub>SO<sub>4</sub>{{arrowleft}}K<sub>2</sub>SO<sub>4</sub> + 2<ins>Mn</ins>SO<sub>4</sub> + 5<ins>S</ins>{{arrowdown}} + H<sub>2</sub>O | ||
| − | Уравниваем металлы. Калия по два атома слева и справа, следовательно у формулы K<sub>2</sub>SO<sub>4</sub> стоит коэффициент 1. | + | '''5. Уравниваем металлы. Калия по два атома слева и справа, следовательно у формулы K<sub>2</sub>SO<sub>4</sub> стоит коэффициент 1.''' |
5H<sub>2</sub><ins>S</ins> + 2K<ins>Mn</ins>O<sub>4</sub> + H<sub>2</sub>SO<sub>4</sub>{{arrowleft}}1K<sub>2</sub>SO<sub>4</sub> + 2<ins>Mn</ins>SO<sub>4</sub> + 5<ins>S</ins>{{arrowdown}} + H<sub>2</sub>O | 5H<sub>2</sub><ins>S</ins> + 2K<ins>Mn</ins>O<sub>4</sub> + H<sub>2</sub>SO<sub>4</sub>{{arrowleft}}1K<sub>2</sub>SO<sub>4</sub> + 2<ins>Mn</ins>SO<sub>4</sub> + 5<ins>S</ins>{{arrowdown}} + H<sub>2</sub>O | ||
| − | + | '''6. Уравниваем неметаллы. В правой части уравнения у всех веществ, содержащих серу, стоят коэффициенты. Сумма атомов серы равна 8. В левой части уравнения у сероводорода коэффициент равен 5, следовательно, надо добавить 3 серы, которая есть в серной кислоте. Ставим коэффициент 3 к молекуле серной кислоты.''' | |
5H<sub>2</sub><ins>S</ins> + 2K<ins>Mn</ins>O<sub>4</sub> + 3H<sub>2</sub>SO<sub>4</sub>{{arrowleft}}1K<sub>2</sub>SO<sub>4</sub> + 2<ins>Mn</ins>SO<sub>4</sub> + 5<ins>S</ins>{{arrowdown}} + 8H<sub>2</sub>O | 5H<sub>2</sub><ins>S</ins> + 2K<ins>Mn</ins>O<sub>4</sub> + 3H<sub>2</sub>SO<sub>4</sub>{{arrowleft}}1K<sub>2</sub>SO<sub>4</sub> + 2<ins>Mn</ins>SO<sub>4</sub> + 5<ins>S</ins>{{arrowdown}} + 8H<sub>2</sub>O | ||
| − | + | '''7.Считаем количество атомов водорода в левой части уравнения. У сероводорода 10 атомов и в серной кислоте 6 атомов. В сумме 16 атомов водорода. В правой части уравнения водород только в воде. В составе воды два водорода. Чтобы его количество соответствовало 16, делим на 2 и ставим к воде коэффициент равный 8..''' | |
| + | |||
| + | '''8. Проверяем количество атомов кислорода в левой и правой частях уравнения:''' | ||
| + | |||
| + | 2 • 4 + 3 • 4 = 4 + 2 • 4 + 8 | 20 = 20 | ||
| − | + | '''9. Если количество атомов кислорода в левой части уравнения равно количеству атомов кислорода в правой части уравнения, решение правильное.''' | |
| − | + | </div> | |
| + | <div class="mw-customtoggle-ovr1 resettext" style="background-color:#bbcdff; padding:3px">'''Решение этого уравнения производится по алгоритму:''' >></div> <br> | ||
| − | + | В межмолекулярных уравнениях бывает в левой части уравнения только два «действующих лица» и тогда происходит «совмещение функций». В этом уравнении азотная кислота и окислитель и подкислитель. | |
| − | В межмолекулярных уравнениях бывает в левой части уравнения только два «действующих лица» и тогда происходит «совмещение функций». В этом уравнении азотная кислота и окислитель и подкислитель. | ||
| − | |||
| − | + | 3Cu + 8HNO<sub>3</sub>(разб) {{arrowleft}} 3Cu(NO<sub>3</sub>)<sub>2</sub> + 2NO + 4H<sub>2</sub>O | |
| − | + | В уравнении 2KMnO<sub>4</sub> +16HCl {{arrowT}} 5Cl<sub>2</sub>{{ArrowUp}} + 2MnCl<sub>2</sub> + 2KCl + 8H<sub>2</sub>O молекулы хлороводородной кислоты окисляются до хлора в количестве 10, а 6 молекул являются подкислителями. | |
| + | == Внутримолекулярные ОВР == | ||
| + | Чаще всего это реакции разложения, идущие при нагревании. | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-ovr2"> | ||
2KMnO<sub>4</sub> {{arrowT}} K<sub>2</sub>MnO<sub>4</sub> + MnO<sub>2</sub> + O<sub>2</sub>{{ArrowUp}} | 2KMnO<sub>4</sub> {{arrowT}} K<sub>2</sub>MnO<sub>4</sub> + MnO<sub>2</sub> + O<sub>2</sub>{{ArrowUp}} | ||
| Строка 94: | Строка 104: | ||
2H<sub>2</sub>O<sub>2</sub> <sup><ins>'''MnO<sub>2</sub>'''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→ </span> 2H<sub>2</sub>O + O<sub>2</sub>{{ArrowUp}} | 2H<sub>2</sub>O<sub>2</sub> <sup><ins>'''MnO<sub>2</sub>'''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→ </span> 2H<sub>2</sub>O + O<sub>2</sub>{{ArrowUp}} | ||
| − | Среди реакций самоокисления – самовосстановления много интересных: | + | '''Среди реакций самоокисления – самовосстановления много интересных:''' |
4KClO<sub>3</sub> {{arrowT}} 3KClO<sub>4</sub> + KCl | 4KClO<sub>3</sub> {{arrowT}} 3KClO<sub>4</sub> + KCl | ||
| Строка 100: | Строка 110: | ||
3S<sup>o</sup> + 6NaOH {{arrowleft}} 2Na2S<sup>-2</sup> +Na<sub>2</sub>S<sup>+4</sup>O<sub>3</sub> + 3H<sub>2</sub>O | 3S<sup>o</sup> + 6NaOH {{arrowleft}} 2Na2S<sup>-2</sup> +Na<sub>2</sub>S<sup>+4</sup>O<sub>3</sub> + 3H<sub>2</sub>O | ||
| − | Уравнение электронного баланса | + | <p style="display:inline; padding:3px; background-color:yellow;">'''Уравнение электронного баланса'''</p> |
S<sup>о</sup> <sup>+2e</sup> → S<sup>-2</sup> | 2 | 1 | 2 | S<sup>о</sup> <sup>+2e</sup> → S<sup>-2</sup> | 2 | 1 | 2 | ||
| Строка 109: | Строка 119: | ||
SO<sub>2</sub> + 2H<sub>2</sub>S {{arrowleft}} 3S{{arrowdown}} + 2H<sub>2</sub>O | SO<sub>2</sub> + 2H<sub>2</sub>S {{arrowleft}} 3S{{arrowdown}} + 2H<sub>2</sub>O | ||
| + | </div> | ||
| + | <div class="mw-customtoggle-ovr2 resettext" style="background-color:#bbcdff; padding:3px">'''Показать примеры »'''</div> <br> | ||
| − | + | '''Особое место среди ОВР занимает реакция использования черного пороха, где степени окисления изменяют сразу три элемента:''' | |
| − | |||
| − | Особое место среди ОВР занимает реакция использования черного пороха, где степени окисления изменяют сразу три элемента: | ||
3C + S + 2KNO<sub>3</sub> {{arrowleft}} K<sub>2</sub>S + 3CO<sub>2</sub>{{ArrowUp}} + N<sub>2</sub>{{ArrowUp}} | 3C + S + 2KNO<sub>3</sub> {{arrowleft}} K<sub>2</sub>S + 3CO<sub>2</sub>{{ArrowUp}} + N<sub>2</sub>{{ArrowUp}} | ||
| − | Уравнение электронного баланса | + | <p style="display:inline; padding:3px; background-color:yellow;">'''Уравнение электронного баланса'''</p><br clear=all> |
| − | + | <div style="display:inline; margin-right:10px; float:left;"> | |
| − | + | С<sup>о</sup> <sup>-4e</sup> → С<sup>+4</sup> | |
| − | С<sup>о</sup> <sup>-4e</sup> → С<sup>+4</sup> | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | S<sup>о</sup> <sup>+2e</sup> → S<sup>-2</sup> | ||
| + | 2N<sup>+5</sup> <sup>-10e</sup> → N<sub>2</sub> <sup>0</sup> | ||
| + | </div> | ||
| + | <div style="display:inline; position:relative;"> | ||
| + | | –4 | | 4 | 12 | 3 | ||
| + | | +2 | | 12 | 4 | 1 | ||
| + | <div style="position:absolute; bottom:-5px; left:19px;">12</div> | ||
| + | | +10 | | 12 | 4 | 1 | ||
| + | </div> | ||
| + | <br clear=all> | ||
| + | '''В этом уравнении окислителей два''' – азот и сера, поэтому их электроны суммируются, а далее, сократившись, цифра ставятся к углероду. После сокращения коэффициент углерода 1 ставится к двум элементам - сере и азоту. Затем коэффициенты переносятся в уравнение реакции. | ||
| + | {{center-p|[[file:OVR deistvie.png|600px|Окислительно-восстановительные свойства некоторых элементов]]}} | ||
| + | '''Окислителями могут быть вещества, в составе которых элементы, изменяющие степени окисления, находятся в высшей степени окисления:''' | ||
| + | (N +5) HNO<sub>3</sub>; (Mn +7) KMnO<sub>4</sub>, HMnO<sub>4</sub>; (Cr +6) K<sub>2</sub>CrO<sub>7</sub>. CrO<sub>3</sub> ; (Pb +4) PbO<sub>2</sub>; (F<sup>0</sup> ) F<sub>2</sub>; (S +6) H<sub>2</sub>SO<sub>4</sub>. | ||
| + | '''Восстановителями могут быть вещества, в составе которых элементы, изменяющие степени окисления, находятся в низшей степени окисления:''' | ||
| + | (N -3) NH<sub>3</sub>; (S -2)H<sub>2</sub>S; (F. Cl, Br. I -1) HF. HCl, HBr. HI ; (P -3) РH<sub>3</sub>; (H -1) гидриды металлов; (все металлы в виде простого вещества) Na, Al, Mg…. | ||
| − | + | '''Окислителями и восстановителями могут быть вещества, в составе которых элементы, изменяющие степени окисления, находятся в промежуточной степени окисления''' | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | (N = 0, +3): N<sub>2</sub>, HNO<sub>2</sub>; (S=0) S; (Fe +2): FeSO<sub>4</sub>, FeCl<sub>2</sub>. | |
| − | |||
| − | |||
| − | + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-Resh"> | |
| − | + | ---- | |
| − | + | <big>'''Расставьте коэффициенты в окислительно–восстановительных реакциях методом электронного баланса.'''</big> | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | <div class=" | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | < | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | Расставьте коэффициенты в окислительно–восстановительных реакциях методом электронного баланса. | ||
<small>Zn + H<sub>2</sub>SO<sub>4</sub><small>(очень разбав)</small> {{arrowleft}} ZnSO<sub>4</sub> + H<sub>2</sub>S{{ArrowUp}} + H<sub>2</sub>O</small> | <small>Zn + H<sub>2</sub>SO<sub>4</sub><small>(очень разбав)</small> {{arrowleft}} ZnSO<sub>4</sub> + H<sub>2</sub>S{{ArrowUp}} + H<sub>2</sub>O</small> | ||
| Строка 270: | Строка 224: | ||
<small>5As<sub>2</sub>S<sub>3</sub> + 28KMnO<sub>4</sub> + 27H<sub>2</sub>SO<sub>4</sub> {{arrowleft}} 10H<sub>3</sub>AsO<sub>4</sub> + 14K<sub>2</sub>SO<sub>4</sub> + 28MnSO<sub>4</sub> + 12H<sub>2</sub>O</small></div> | <small>5As<sub>2</sub>S<sub>3</sub> + 28KMnO<sub>4</sub> + 27H<sub>2</sub>SO<sub>4</sub> {{arrowleft}} 10H<sub>3</sub>AsO<sub>4</sub> + 14K<sub>2</sub>SO<sub>4</sub> + 28MnSO<sub>4</sub> + 12H<sub>2</sub>O</small></div> | ||
<div class="mw-customtoggle-Z15 resettext" style="background-color:#bbcdff; padding:3px">'''Показать решение »'''</div> <br> | <div class="mw-customtoggle-Z15 resettext" style="background-color:#bbcdff; padding:3px">'''Показать решение »'''</div> <br> | ||
| + | </div> | ||
| + | <div class="mw-customtoggle-Resh resettext" style="background-color:#26505c; padding:3px; color:white;">'''Проверьте себя'''</div> <br> | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | == Глоссарий == | ||
| + | :{{bib|'''Восстановителями''' называют атомы, молекулы или ионы, которые отдают электроны в процессе окисления.}} | ||
| + | :{{bib|'''Восстановление''' – процесс присоединения электронов.}} | ||
| + | :{{bib|'''Окисление''' - процесс отдачи электронов}} | ||
| + | :{{bib|'''Окислителями''' называются атомы, молекулы или ионы, которые присоединяют электроны в процессе восстановления.}} | ||
| + | :{{bib| '''Окислительно-восстановительными реакциями''' называются химические реакции, которые протекают с изменением степеней окисления атомов в молекулах реагирующих веществ.}} | ||
| + | :{{bib|'''Подкислитель''' – это какая – либо кислота.}} | ||
| + | :{{bib|'''Электронные уравнения''' – уравнения, которые выражают процессы окисления и восстановления.}} | ||
| + | |||
| + | == Библиография == | ||
| + | * {{bib|Д.Д.Дзудцова, Л.Б.Бестаева «Окислительно – восстановительные реакции». Дрофа. М. 2005 г.}} | ||
| + | * {{bib|Химия .Пособие – репетитор. Ростов - на – Дону. 1997г.}} | ||
| + | * {{bib|Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;}} | ||
| + | * {{bib|Л.И. Асанова, Е.Н. Стрельникова «Окислительно–восстановительные реакции». Практикум по химии. Москва. «ВАКО». 2018 г.}} | ||
| + | === Художественная литература === | ||
| + | * {{bib|Рафаэль Сабатини «Одиссея капитана Блада» Впервые издана в 1922 году.}} | ||
| + | * {{bib|Шадерло де Лакло «Опасные связи» Наука 1965 г. «Литературные памятники»}} | ||
| + | * {{bib|Фенимор Купер «Следопыт, Зверобой, Последний из могикан, Пионеры, Чингачгук» . Пенталогия Бинезун, 2014г.}} | ||
| + | * {{bib|Фенимор Купер, 31 книга. Медиакнига, 2014 г.}} | ||
| + | * {{bib|Анна и Серж Голон «Анжелика в Новом свете», «Дорога надежды», «Анжелика и ее победа», «Анжелика в Квебеке», Ташкент, 1993 г.}} | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | </div> | ||
| + | |||
| + | <!-- Sidebar --> | ||
| + | <div class="large-4 medium-5 columns"> | ||
| + | <!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | ||
| + | <div class="sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Химия в лицах</div> | ||
| + | </div> | ||
| + | {{center-p|[[file:Lev Pisarzhevsky.JPG|400px|Лев Владимирович Писаржевский]]}} | ||
| + | |||
| + | Лев Владимирович Писаржевский (1874-1938) - выдающийся ученый в области физической химии, академик АН СССР, лауреат Премии им.Ленина. | ||
| + | |||
| + | Писаржевский создал основы электронной теории окислительно-восстановительных реакций, предложил теорию гальванического элемента, которая объяснила происхождение электродных потенциалов, создал электронную теорию катализа. В учебнике "Введение в химию" (1926 год) впервые весь материал был изложен с позиции электронной теории строения атомов и молекул. | ||
| + | </div> | ||
| − | </div></div> | + | <div class="sbstyle" style="margin-top:20px;"> |
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Почему Америка стала англоязычной?</div> | ||
| + | </div> | ||
| + | <span class="firstcharacter">О</span>ткрыли Америку – ''(Новый свет)'' испанцы, обследовали испанцы и португальцы. Осваивали ее французы, которые отправляли туда всех своих заключенных. Французы строили форты, охотились, начали заниматься земледелием. А в Англии правила Елизавета I, которая поощряла морской разбой, имея хороший флот. И не только поощряла пиратов, а даже давала им дворянские звания. За это они платили Англии дань из своих награбленных богатств. | ||
| + | {{center-p|[[file:Lineynyy-korabl ch.jpg|400px|Линейный корабль британской империи]]}} | ||
| + | Война никогда не была объявлена, но велась на море и на суше в Северной Америке. Английские пиратские суда топили французские корабли, которые везли порох или компоненты пороха, особенно калийную селитру, из Франции. Достаточно было одного ядра из пушки пиратского корабля, чтобы судно с порохом взлетело от взрыва. Во французских фортах возник острый дефицит пороха. Форты были хорошо укреплены, были солдаты, было оружие. Не было возможности выстрелить. И форты выкидывали белый флаг на милость английской армии. Захват происходил практически бескровно. Так французы потерпели поражение, а территорию Северной Америки захватили англичане. | ||
| + | </div> | ||
| + | |||
| + | <div class="sbstyle" style="margin-top:20px;"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Немного истории</div> | ||
| + | </div> | ||
| + | В давние времена, когда люди не знали химии, они не могли написать уравнение реакции растворения жемчужины в виноградном уксусе: | ||
| + | |||
| + | <small>CaCO<sub>3</sub> + 2CH<sub>3</sub>COOH {{Arrowleft}} Ca(CH<sub>3</sub>COO)<sub>2</sub> + H<sub>2</sub>O + CO<sub>2</sub></small> | ||
| + | |||
| + | или даже более простой реакции сгорания алмаза на воздухе под действием солнечных лучей: | ||
| + | |||
| + | <small>C + O<sub>2</sub> {{Arrowleft}} CO<sub>2</sub></small> | ||
| + | |||
| + | И уж тем более никто не смог бы разъяснить, что вторая реакция намного сложнее первой: ведь при ней происходит перемещение электронов от одного атома к другому, а значит, она относится к окислительно–восстановительным реакциям. Ученые полагали, что окисление – это потеря флогистона (особого невидимого горючего вещества), а восстановление – его приобретение. Но после создания А. Лавуазье кислородной теории горения к началу XIX в. химики стали считать окислением взаимодействие веществ с кислородом, а восстановлением их превращения под действием водорода. | ||
| + | |||
| + | Но вот простейшая реакция железа с соляной кислотой: | ||
| + | |||
| + | <small>Fe + 2HCl {{Arrowleft}} FeCl<sub>2</sub> + H<sub>2</sub>{{ArrowUp}}</small> | ||
| + | |||
| + | Здесь нет кислорода, и тем не менее железо окисляется. В этой реакции окислитель – ион водорода, а железо выступает в роли восстановителя. | ||
| + | |||
| + | Разобраться в этом удалось лишь с введением в химию электронных представлений. Теперь мы знаем, что '''окислитель – вещество, которое приобретает электроны''', а '''восстановитель – вещество, которое их отдает.''' | ||
| + | </div> | ||
| + | <div class="sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Пройди тестирование</div> | ||
| + | </div> | ||
| + | |||
| + | </div> | ||
| + | |||
| + | </div> | ||
| + | {{lang|:KR:Химия: Окистенүү–калыбына келүү реакциялары}} | ||
[[Category:Средняя школа]] | [[Category:Средняя школа]] | ||
[[Category:Химия]] | [[Category:Химия]] | ||
Текущая версия на 09:45, 22 октября 2018
Окислительно-восстановительными реакциями являются такие реакции, в которых у атомов, входящих в состав молекул изменяются степени окисления по окончании реакции.
Отдельно не существует процесса окисления или процесса восстановления. Есть процесс передачи электронов от атомов одного элемента к атомам другого элемента. В реакциях самоокисления – самовосстановления участвуют атомы одного элемента, только часть из них отдает электроны, а другая часть их принимает.
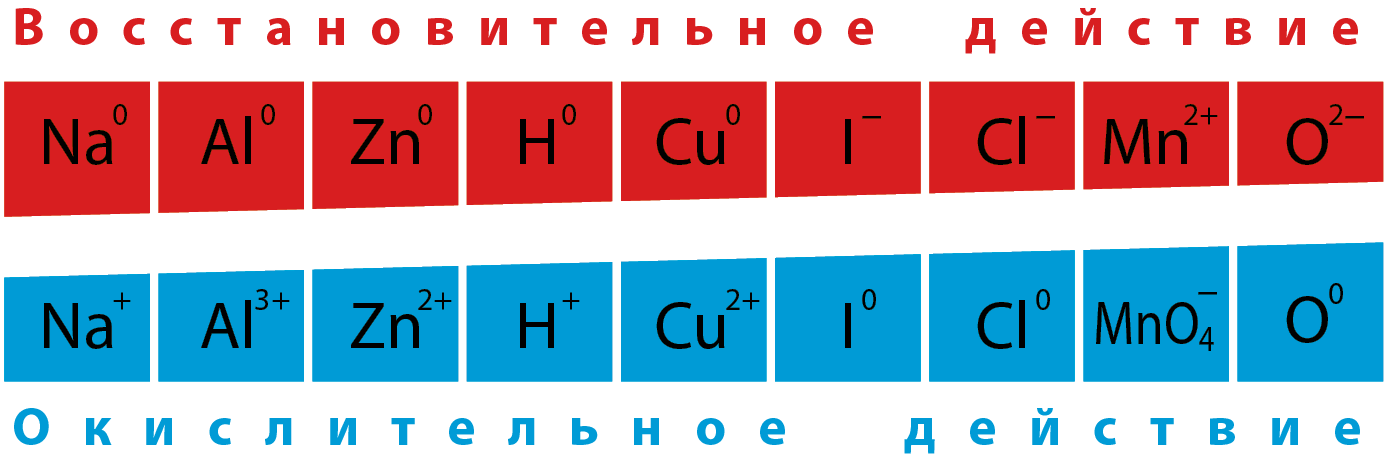
Окислители всегда имеют наибольшее значение электроотрицательности. В формулах сложных веществ всегда есть как окислители, так и восстановители. Окислитель в формуле вещества всегда один – это атом с наибольшей электроотрицательностью, он заряжен отрицательно.
Восстановителей в формуле сложного вещества может быть 1, 2, 3, они все имеют положительный заряд. В формуле вещества количество отрицательных зарядов на атомах окислителя равно сумме положительных зарядов на атомах всех восстановителей. В целом атом - электронейтральная частица. На этом балансе электронов основано решение окислительно-восстановительных уравнений.
Содержание
Классификация ОВР
Решение межмолекулярных ОВР
В классических вариантах окислительно-восстановительных реакций всегда есть три действующих компонента:
вещество, на которое направлен процесс,
вещество окислитель
вещество - подкислитель (чаще всего эти реакции идут в кислой среде) – обычно оно богато главным и самым распространенным окислителем – кислородом.
5H2S + 2KMnO4 + 3H2SO4![]() K2SO4 + 2MnSO4 + 5S↓ + 8H2O
K2SO4 + 2MnSO4 + 5S↓ + 8H2O
В данном уравнении:
H2S – вещество, на которое направлен процесс,
KMnO4 – вещество окислитель
H2SO4 – вещество – подкислитель.
1. Определить степени окисления атомов в формулах всех веществ:
H2S + KMnO4 + H2SO4![]() K2SO4 + MnSO4 + S↓ + H2O
K2SO4 + MnSO4 + S↓ + H2O
2. Подчеркнуть элементы, изменившие степени окисления до реакции и после реакции:
H2S + KMnO4 + H2SO4![]() K2SO4 + MnSO4 + S↓ + H2O
K2SO4 + MnSO4 + S↓ + H2O
3. В уравнение электронного баланса выписать данные с указанием степеней окисления до и после реакции:
Mn +7 -5e ![]() Mn 2+ | 5 | 2
Mn 2+ | 5 | 2
S +2 +2e ![]() S 0 | 2 | 5
S 0 | 2 | 5
Уравнение электронного баланса
4. В уравнение переносим коэффициенты, полученные в электронном балансе, 2 к Mn, 5 к S в правой стороне уравнения:
H2S + KMnO4 + H2SO4![]() K2SO4 + 2MnSO4 + 5S↓ + H2O
K2SO4 + 2MnSO4 + 5S↓ + H2O
Проставим эти же коэффициенты в левую часть уравнения
5H2S + 2KMnO4 + H2SO4![]() K2SO4 + 2MnSO4 + 5S↓ + H2O
K2SO4 + 2MnSO4 + 5S↓ + H2O
5. Уравниваем металлы. Калия по два атома слева и справа, следовательно у формулы K2SO4 стоит коэффициент 1.
5H2S + 2KMnO4 + H2SO4![]() 1K2SO4 + 2MnSO4 + 5S↓ + H2O
1K2SO4 + 2MnSO4 + 5S↓ + H2O
6. Уравниваем неметаллы. В правой части уравнения у всех веществ, содержащих серу, стоят коэффициенты. Сумма атомов серы равна 8. В левой части уравнения у сероводорода коэффициент равен 5, следовательно, надо добавить 3 серы, которая есть в серной кислоте. Ставим коэффициент 3 к молекуле серной кислоты.
5H2S + 2KMnO4 + 3H2SO4![]() 1K2SO4 + 2MnSO4 + 5S↓ + 8H2O
1K2SO4 + 2MnSO4 + 5S↓ + 8H2O
7.Считаем количество атомов водорода в левой части уравнения. У сероводорода 10 атомов и в серной кислоте 6 атомов. В сумме 16 атомов водорода. В правой части уравнения водород только в воде. В составе воды два водорода. Чтобы его количество соответствовало 16, делим на 2 и ставим к воде коэффициент равный 8..
8. Проверяем количество атомов кислорода в левой и правой частях уравнения:
2 • 4 + 3 • 4 = 4 + 2 • 4 + 8 | 20 = 20
9. Если количество атомов кислорода в левой части уравнения равно количеству атомов кислорода в правой части уравнения, решение правильное.
В межмолекулярных уравнениях бывает в левой части уравнения только два «действующих лица» и тогда происходит «совмещение функций». В этом уравнении азотная кислота и окислитель и подкислитель.
3Cu + 8HNO3(разб) ![]() 3Cu(NO3)2 + 2NO + 4H2O
3Cu(NO3)2 + 2NO + 4H2O
В уравнении 2KMnO4 +16HCl ![]() 5Cl2↑ + 2MnCl2 + 2KCl + 8H2O молекулы хлороводородной кислоты окисляются до хлора в количестве 10, а 6 молекул являются подкислителями.
5Cl2↑ + 2MnCl2 + 2KCl + 8H2O молекулы хлороводородной кислоты окисляются до хлора в количестве 10, а 6 молекул являются подкислителями.
Внутримолекулярные ОВР
Чаще всего это реакции разложения, идущие при нагревании.
2KMnO4 ![]() K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
4KMnO4 ![]() 2K2O + 4MnO2 + 3O2↑ (При очень высокой температуре)
2K2O + 4MnO2 + 3O2↑ (При очень высокой температуре)
2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
2NaNO3 ![]() 2NaNO2 + O2↑
2NaNO2 + O2↑
2HgO ![]() 2Hg +O2↑
2Hg +O2↑
2H2O2 MnO2→ 2H2O + O2↑
Среди реакций самоокисления – самовосстановления много интересных:
4KClO3 ![]() 3KClO4 + KCl
3KClO4 + KCl
3So + 6NaOH ![]() 2Na2S-2 +Na2S+4O3 + 3H2O
2Na2S-2 +Na2S+4O3 + 3H2O
Уравнение электронного баланса
Sо +2e → S-2 | 2 | 1 | 2
Sо -4e → S+4 | 4 | 2 | 1
2Н2S + H2SO3 ![]() 3S↓ + 3H2O
3S↓ + 3H2O
SO2 + 2H2S ![]() 3S↓ + 2H2O
3S↓ + 2H2O
Особое место среди ОВР занимает реакция использования черного пороха, где степени окисления изменяют сразу три элемента:
3C + S + 2KNO3 ![]() K2S + 3CO2↑ + N2↑
K2S + 3CO2↑ + N2↑
Уравнение электронного баланса
Со -4e → С+4
Sо +2e → S-2
2N+5 -10e → N2 0
| –4 | | 4 | 12 | 3
| +2 | | 12 | 4 | 1
| +10 | | 12 | 4 | 1
В этом уравнении окислителей два – азот и сера, поэтому их электроны суммируются, а далее, сократившись, цифра ставятся к углероду. После сокращения коэффициент углерода 1 ставится к двум элементам - сере и азоту. Затем коэффициенты переносятся в уравнение реакции.
Окислителями могут быть вещества, в составе которых элементы, изменяющие степени окисления, находятся в высшей степени окисления:
(N +5) HNO3; (Mn +7) KMnO4, HMnO4; (Cr +6) K2CrO7. CrO3 ; (Pb +4) PbO2; (F0 ) F2; (S +6) H2SO4.
Восстановителями могут быть вещества, в составе которых элементы, изменяющие степени окисления, находятся в низшей степени окисления:
(N -3) NH3; (S -2)H2S; (F. Cl, Br. I -1) HF. HCl, HBr. HI ; (P -3) РH3; (H -1) гидриды металлов; (все металлы в виде простого вещества) Na, Al, Mg….
Окислителями и восстановителями могут быть вещества, в составе которых элементы, изменяющие степени окисления, находятся в промежуточной степени окисления
(N = 0, +3): N2, HNO2; (S=0) S; (Fe +2): FeSO4, FeCl2.
Расставьте коэффициенты в окислительно–восстановительных реакциях методом электронного баланса.
Zn + H2SO4(очень разбав) ![]() ZnSO4 + H2S↑ + H2O
ZnSO4 + H2S↑ + H2O
4Zn + 5H2SO4(очень разбав) ![]() 4ZnSO4 + H2S↑ + 4H2O
4ZnSO4 + H2S↑ + 4H2O
Cu + HNO3(разбав) ![]() Cu(NO3)2 + NO↑ + H2O
Cu(NO3)2 + NO↑ + H2O
3Cu + 8HNO3(разбав) ![]() 3Cu(NO3)2 + 2NO↑ + 4H2O
3Cu(NO3)2 + 2NO↑ + 4H2O
KI + MnO2 + H2SO4 ![]() K2SO4 + MnI2 + I2 + H2O
K2SO4 + MnI2 + I2 + H2O
4KI + MnO2 + 2H2SO4 ![]() 2K2SO4 + MnI2 + I2 + 2H2O
2K2SO4 + MnI2 + I2 + 2H2O
HCl + MnO2 ![]() Cl2↑ + MnCl2 + H2O
Cl2↑ + MnCl2 + H2O
4HCl + MnO2 ![]() Cl2↑ + MnCl2 + 2H2O
Cl2↑ + MnCl2 + 2H2O
S + HNO3(конц) ![]() H2SO4 + NO2 + H2O
H2SO4 + NO2 + H2O
S + 6HNO3(конц) ![]() H2SO4 + 6NO2 + 2H2O
H2SO4 + 6NO2 + 2H2O
Усложненные
FeCl2 + KMnO4 + HCl ![]() FeCl3 + MnCl2 + KCl + H2O
FeCl3 + MnCl2 + KCl + H2O
5FeCl2 + KMnO4 + 8HCl ![]() 5FeCl3 + MnCl2 + KCl + 4H2O
5FeCl3 + MnCl2 + KCl + 4H2O
FeS2 + O2 ![]() SO2↑ + Fe2O3
SO2↑ + Fe2O3
4FeS2 + 11O2 ![]() 8SO2↑ + 2Fe2O3
8SO2↑ + 2Fe2O3
Cu2O + H2SO4 ![]() CuSO4 + Cu + H2O + O2↑
CuSO4 + Cu + H2O + O2↑
3Cu2O + H2SO4 ![]() CuSO4 + 5Cu + H2O + O2↑
CuSO4 + 5Cu + H2O + O2↑
PbO2 + MnSO4 + HNO3 ![]() PbSO4 + HMnO4 +Pb(NO3)2 + H2O
PbSO4 + HMnO4 +Pb(NO3)2 + H2O
5PbO2 + 2MnSO4 + 6HNO3 ![]() 2PbSO4 + 2HMnO4 +3 Pb(NO3)2 + 2H2O
2PbSO4 + 2HMnO4 +3 Pb(NO3)2 + 2H2O
As2S3 + KMnO4 + H2SO4 ![]() H3AsO4 + K2SO4 + MnSO4 + H2O
H3AsO4 + K2SO4 + MnSO4 + H2O
Глоссарий
- Восстановителями называют атомы, молекулы или ионы, которые отдают электроны в процессе окисления.
- Восстановление – процесс присоединения электронов.
- Окисление - процесс отдачи электронов
- Окислителями называются атомы, молекулы или ионы, которые присоединяют электроны в процессе восстановления.
- Окислительно-восстановительными реакциями называются химические реакции, которые протекают с изменением степеней окисления атомов в молекулах реагирующих веществ.
- Подкислитель – это какая – либо кислота.
- Электронные уравнения – уравнения, которые выражают процессы окисления и восстановления.
Библиография
- Д.Д.Дзудцова, Л.Б.Бестаева «Окислительно – восстановительные реакции». Дрофа. М. 2005 г.
- Химия .Пособие – репетитор. Ростов - на – Дону. 1997г.
- Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;
- Л.И. Асанова, Е.Н. Стрельникова «Окислительно–восстановительные реакции». Практикум по химии. Москва. «ВАКО». 2018 г.
Художественная литература
- Рафаэль Сабатини «Одиссея капитана Блада» Впервые издана в 1922 году.
- Шадерло де Лакло «Опасные связи» Наука 1965 г. «Литературные памятники»
- Фенимор Купер «Следопыт, Зверобой, Последний из могикан, Пионеры, Чингачгук» . Пенталогия Бинезун, 2014г.
- Фенимор Купер, 31 книга. Медиакнига, 2014 г.
- Анна и Серж Голон «Анжелика в Новом свете», «Дорога надежды», «Анжелика и ее победа», «Анжелика в Квебеке», Ташкент, 1993 г.
Лев Владимирович Писаржевский (1874-1938) - выдающийся ученый в области физической химии, академик АН СССР, лауреат Премии им.Ленина.
Писаржевский создал основы электронной теории окислительно-восстановительных реакций, предложил теорию гальванического элемента, которая объяснила происхождение электродных потенциалов, создал электронную теорию катализа. В учебнике "Введение в химию" (1926 год) впервые весь материал был изложен с позиции электронной теории строения атомов и молекул.
Открыли Америку – (Новый свет) испанцы, обследовали испанцы и португальцы. Осваивали ее французы, которые отправляли туда всех своих заключенных. Французы строили форты, охотились, начали заниматься земледелием. А в Англии правила Елизавета I, которая поощряла морской разбой, имея хороший флот. И не только поощряла пиратов, а даже давала им дворянские звания. За это они платили Англии дань из своих награбленных богатств.
Война никогда не была объявлена, но велась на море и на суше в Северной Америке. Английские пиратские суда топили французские корабли, которые везли порох или компоненты пороха, особенно калийную селитру, из Франции. Достаточно было одного ядра из пушки пиратского корабля, чтобы судно с порохом взлетело от взрыва. Во французских фортах возник острый дефицит пороха. Форты были хорошо укреплены, были солдаты, было оружие. Не было возможности выстрелить. И форты выкидывали белый флаг на милость английской армии. Захват происходил практически бескровно. Так французы потерпели поражение, а территорию Северной Америки захватили англичане.
В давние времена, когда люди не знали химии, они не могли написать уравнение реакции растворения жемчужины в виноградном уксусе:
CaCO3 + 2CH3COOH ![]() Ca(CH3COO)2 + H2O + CO2
Ca(CH3COO)2 + H2O + CO2
или даже более простой реакции сгорания алмаза на воздухе под действием солнечных лучей:
C + O2 ![]() CO2
CO2
И уж тем более никто не смог бы разъяснить, что вторая реакция намного сложнее первой: ведь при ней происходит перемещение электронов от одного атома к другому, а значит, она относится к окислительно–восстановительным реакциям. Ученые полагали, что окисление – это потеря флогистона (особого невидимого горючего вещества), а восстановление – его приобретение. Но после создания А. Лавуазье кислородной теории горения к началу XIX в. химики стали считать окислением взаимодействие веществ с кислородом, а восстановлением их превращения под действием водорода.
Но вот простейшая реакция железа с соляной кислотой:
Fe + 2HCl ![]() FeCl2 + H2↑
FeCl2 + H2↑
Здесь нет кислорода, и тем не менее железо окисляется. В этой реакции окислитель – ион водорода, а железо выступает в роли восстановителя.
Разобраться в этом удалось лишь с введением в химию электронных представлений. Теперь мы знаем, что окислитель – вещество, которое приобретает электроны, а восстановитель – вещество, которое их отдает.