Dissociation — различия между версиями
Admine2 (обсуждение | вклад) |
Admine2 (обсуждение | вклад) |
||
| (не показано 8 промежуточных версий этого же участника) | |||
| Строка 46: | Строка 46: | ||
<div class='labelchem'> | <div class='labelchem'> | ||
<span>Al(OH)<sub>3</sub></span> | <span>Al(OH)<sub>3</sub></span> | ||
| − | <p>Гидроксид | + | <p>Гидроксид алюминия. Слабое основание. Не растворяется в воде.</p> |
</div> | </div> | ||
<div class='labelchem'> | <div class='labelchem'> | ||
| Строка 765: | Строка 765: | ||
<div class='labelchem'> | <div class='labelchem'> | ||
<span>Hg(Br)<sub>2</sub></span> | <span>Hg(Br)<sub>2</sub></span> | ||
| − | <p>Бромид | + | <p>Бромид ртути. Плохо растворяется в воде, примерно 0,61 гр на 100 мл при температуре 25<sup>o</sup>C.</p> |
<p>В результате гидролиза, образуется кислая среда.</p> | <p>В результате гидролиза, образуется кислая среда.</p> | ||
</div> | </div> | ||
<div class='labelchem'> | <div class='labelchem'> | ||
<span>AgBr</span> | <span>AgBr</span> | ||
| − | <p>Бромид | + | <p>Бромид серебра. Не растворяется в воде.</p> |
</div> | </div> | ||
<div class='labelchem'> | <div class='labelchem'> | ||
| Строка 881: | Строка 881: | ||
</div> | </div> | ||
<div class='labelchem'> | <div class='labelchem'> | ||
| − | <span>AgCl | + | <span>AgCl</span> |
<p>Хлорид серебра. Не растворяется в воде.</p> | <p>Хлорид серебра. Не растворяется в воде.</p> | ||
</div> | </div> | ||
| Строка 1084: | Строка 1084: | ||
</div> | </div> | ||
<div class='labelchem'> | <div class='labelchem'> | ||
| − | <span>Ag<sub>3</sub> | + | <span>Ag<sub>3</sub>PO<sub>4</sub></span> |
<p>Фосфат серебра. Не растворяется в воде.</p> | <p>Фосфат серебра. Не растворяется в воде.</p> | ||
</div> | </div> | ||
| Строка 1123: | Строка 1123: | ||
<div class='labelchem'> | <div class='labelchem'> | ||
<span>SrF<sub>2</sub></span> | <span>SrF<sub>2</sub></span> | ||
| − | <p>Фторид стронция. | + | <p>Фторид стронция. Плохо растворяется в воде, примерно 0,021 гр на 100 мл при температуре 25<sup>o</sup>C.</p> |
</div> | </div> | ||
<div class='labelchem'> | <div class='labelchem'> | ||
| Строка 1218: | Строка 1218: | ||
</div> | </div> | ||
<div class='labelchem'> | <div class='labelchem'> | ||
| − | <span>Ba(NO<sub>2)<sub>2</sub></span> | + | <span>Ba(NO<sub>2</sub>)<sub>2</sub></span> |
<p>Нитрит бария. Растворяется в воде, примерно 74 гр на 100 мл при температуре 25<sup>o</sup>C.</p> | <p>Нитрит бария. Растворяется в воде, примерно 74 гр на 100 мл при температуре 25<sup>o</sup>C.</p> | ||
<p>В результате гидролиза, образуется щелочная среда.</p> | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
</div> | </div> | ||
<div class='labelchem'> | <div class='labelchem'> | ||
| − | <span>Sr(NO<sub>2)<sub>2</sub></span> | + | <span>Sr(NO<sub>2</sub>)<sub>2</sub></span> |
<p>Нитрит стронция. Растворяется в воде, примерно 77 гр на 100 мл при температуре 25<sup>o</sup>C.</p> | <p>Нитрит стронция. Растворяется в воде, примерно 77 гр на 100 мл при температуре 25<sup>o</sup>C.</p> | ||
<p>В результате гидролиза, образуется щелочная среда.</p> | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
</div> | </div> | ||
<div class='labelchem'> | <div class='labelchem'> | ||
| − | <span>Ca(NO<sub>2)<sub>2</sub></span> | + | <span>Ca(NO<sub>2</sub>)<sub>2</sub></span> |
<p>Нитрит кальция. Растворяется в воде, примерно 77 гр на 100 мл при температуре 25<sup>o</sup>C.</p> | <p>Нитрит кальция. Растворяется в воде, примерно 77 гр на 100 мл при температуре 25<sup>o</sup>C.</p> | ||
<p>В результате гидролиза, образуется щелочная среда.</p> | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| Строка 1297: | Строка 1297: | ||
</div> | </div> | ||
<div class='labelchem'> | <div class='labelchem'> | ||
| − | <span> | + | <span>AgNO<sub>2</sub></span> |
<p>Нитрит серебра.</p> | <p>Нитрит серебра.</p> | ||
<p>Плохо растворяется в воде.</p> | <p>Плохо растворяется в воде.</p> | ||
</div> | </div> | ||
| − | + | <div class='labelchem'> | |
| − | </div> | + | <span>H<sub>2</sub>CO<sub>3</sub></span> |
| − | + | <p>Угольная кислота.</p> | |
| − | <div class="info show-for-large-up"> | + | <p>Cлабая двухосновная кислота.</p> |
| − | <imagemap> | + | </div> |
| − | Файл: | + | <div class='labelchem'> |
| − | rect 128 96 191 141 [[label1]] | + | <span>Cs<sub>2</sub>CO<sub>3</sub></span> |
| − | rect 191 96 255 141 [[label2]] | + | <p>Карбонат цезия. Растворяется в воде, примерно 75,5 гр на 100 мл при температуре 20<sup>o</sup>C.</p> |
| − | rect 255 96 320 141 [[label3]] | + | <p>В результате гидролиза, образуется щелочная среда.</p> |
| − | rect 320 96 385 141 [[label4]] | + | </div> |
| − | rect 385 96 450 141 [[label5]] | + | <div class='labelchem'> |
| − | rect 450 96 515 141 [[label6]] | + | <span>Rb<sub>2</sub>CO<sub>3</sub></span> |
| − | rect 515 96 580 141 [[label7]] | + | <p>Карбонат рубидия. Хорошо растворяется в воде, примерно 223 гр на 100 мл при температуре 20<sup>o</sup>C.</p> |
| − | rect 580 96 645 141 [[label8]] | + | <p>В результате гидролиза, образуется щелочная среда.</p> |
| − | rect 645 96 710 141 [[label9]] | + | </div> |
| − | rect 710 96 775 141 [[label10]] | + | <div class='labelchem'> |
| − | rect 775 96 840 141 [[label11]] | + | <span>K<sub>2</sub>CO<sub>3</sub></span> |
| − | rect 840 96 905 141 [[label12]] | + | <p>Карбонат калия. Хорошо растворяется в воде, примерно 112 гр на 100 мл при температуре 20<sup>o</sup>C.</p> |
| − | rect 905 96 970 141 [[label13]] | + | <p>В результате гидролиза, образуется щелочная среда.</p> |
| − | rect 970 96 1035 141 [[label14]] | + | </div> |
| + | <div class='labelchem'> | ||
| + | <span>Na<sub>2</sub>CO<sub>3</sub></span> | ||
| + | <p>Карбонат натрия. Растворяется в воде, примерно 29,4 гр на 100 мл при температуре 25<sup>o</sup>C.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>Li<sub>2</sub>CO<sub>3</sub></span> | ||
| + | <p>Карбонат лития. Растворяется в воде, примерно 1,27 гр на 100 мл при температуре 25<sup>o</sup>C.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>BaCO<sub>3</sub></span> | ||
| + | <p>Карбонат бария.</p> | ||
| + | <p>Не растворяется в воде</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>SrCO<sub>3</sub></span> | ||
| + | <p>Карбонат стронция.</p> | ||
| + | <p>Не растворяется в воде</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>CaCO<sub>3</sub></span> | ||
| + | <p>Карбонат кальция.</p> | ||
| + | <p>Не растворяется в воде</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>(NH<sub>4</sub>)<sub>2</sub>CO<sub>3</sub></span> | ||
| + | <p>Карбонат аммония. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 15<sup>o</sup>C.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>MgCO<sub>3</sub></span> | ||
| + | <p>Карбонат магния. Плохо растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>Al<sub>2</sub>(CO<sub>3</sub>)<sub>3</sub></span> | ||
| + | <p>Карбонат алюминия.</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>MnCO<sub>3</sub></span> | ||
| + | <p>Карбонат марганца.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>ZnCO<sub>3</sub></span> | ||
| + | <p>Карбонат цинка.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>Cr<sub>2</sub>(CO<sub>3</sub>)<sub>3</sub></span> | ||
| + | <p>Карбонат хрома.</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>FeCO<sub>3</sub></span> | ||
| + | <p>Карбонат железа (II).</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>Fe<sub>2</sub>(CO<sub>3</sub>)<sub>3</sub></span> | ||
| + | <p>Карбонат железа (III).</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>CoCO<sub>3</sub></span> | ||
| + | <p>Карбонат кобальта.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>NiCO<sub>3</sub></span> | ||
| + | <p>Карбонат никеля.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>PbCO<sub>3</sub></span> | ||
| + | <p>Карбонат свинца.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>CuCO<sub>3</sub></span> | ||
| + | <p>Карбонат меди.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>HgCO<sub>3</sub></span> | ||
| + | <p>Карбонат ртути.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>Ag<sub>2</sub>CO<sub>3</sub></span> | ||
| + | <p>Карбонат серебра.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>H<sub>2</sub>S</span> | ||
| + | <p>Сероводородная кислота.</p> | ||
| + | <p>Cлабая, двухосновная кислота.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>Cs<sub>2</sub>S</span> | ||
| + | <p>Сульфид цезия. Растворяется в воде.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>Rb<sub>2</sub>S</span> | ||
| + | <p>Сульфид рубидия. Растворяется в воде.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>K<sub>2</sub>S</span> | ||
| + | <p>Сульфид калия. Реагирует с водой.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>Na<sub>2</sub>S</span> | ||
| + | <p>Сульфид натрия. Растворяется в воде, примерно 20 гр на 100 мл при температуре 20<sup>o</sup>C.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>Li<sub>2</sub>S</span> | ||
| + | <p>Сульфид лития. Хорошо растворяется в воде.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>BaS</span> | ||
| + | <p>Сульфид бария. Растворяется в воде, примерно 9 гр на 100 мл при температуре 20<sup>o</sup>C.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>SrS</span> | ||
| + | <p>Сульфид стронция. Плохо растворяется в воде.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>CaS</span> | ||
| + | <p>Сульфид кальция. Растворяется в воде.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>(NH<sub>4</sub>)<sub>2</sub>S</span> | ||
| + | <p>Сульфид аммония. Хорошо растворяется в воде.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>MgS</span> | ||
| + | <p>Сульфид магния. Плохо растворяется в воде.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>Al<sub>2</sub>S<sub>3</sub></span> | ||
| + | <p>Сульфид алюминия.</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>MnS</span> | ||
| + | <p>Сульфид марганца. Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>ZnS</span> | ||
| + | <p>Сульфид цинка. Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>Cr<sub>2</sub>S<sub>3</sub></span> | ||
| + | <p>Сульфид хрома.</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>FeS</span> | ||
| + | <p>Сульфид железа (II). Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>Fe<sub>2</sub>S<sub>3</sub></span> | ||
| + | <p>Сульфид железа (III). Диспропорционирует при растворении в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>CoS</span> | ||
| + | <p>Сульфид кобальта. Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>NiS</span> | ||
| + | <p>Сульфид никеля. Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>PbS</span> | ||
| + | <p>Сульфид свинца. Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>CuS</span> | ||
| + | <p>Сульфид меди. Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>HgS</span> | ||
| + | <p>Сульфид ртути.</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>Ag<sub>2</sub>S</span> | ||
| + | <p>Сульфид серебра. Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>H<sub>2</sub>SiO<sub>3</sub></span> | ||
| + | <p>Метакремниевая кислота.</p> | ||
| + | <p>Очень слабая кислота.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>Cs<sub>2</sub>SiO<sub>3</sub></span> | ||
| + | <p>Силикат цезия.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>Rb<sub>2</sub>SiO<sub>3</sub></span> | ||
| + | <p>Силикат рубидия. Растворяется в воде.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>K<sub>2</sub>SiO<sub>3</sub></span> | ||
| + | <p>Силикат калия. Растворяется в воде.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>Na<sub>2</sub>SiO<sub>3</sub></span> | ||
| + | <p>Силикат натрия. Растворяется в воде, примерно 22 гр на 100 мл при температуре 20<sup>o</sup>C.</p> | ||
| + | <p>В результате гидролиза, образуется щелочная среда.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>Li<sub>2</sub>SiO<sub>3</sub></span> | ||
| + | <p>Силикат лития.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>BaSiO<sub>3</sub></span> | ||
| + | <p>Силикат бария.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>SrSiO<sub>3</sub></span> | ||
| + | <p>Силикат стронция.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>CaSiO<sub>3</sub></span> | ||
| + | <p>Силикат кальция.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>(NH<sub>4</sub>)<sub>2</sub>SiO<sub>3</sub></span> | ||
| + | <p>Силикат аммония.</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>MgSiO<sub>3</sub></span> | ||
| + | <p>Силикат магния.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>Al<sub>2</sub>(SiO<sub>3</sub>)<sub>3</sub></span> | ||
| + | <p>Силикат алюминия.</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>MnSiO<sub>3</sub></span> | ||
| + | <p>Силикат марганца.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>ZnSiO<sub>3</sub></span> | ||
| + | <p>Силикат цинка.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>Cr<sub>2</sub>(SiO<sub>3</sub>)<sub>3</sub></span> | ||
| + | <p>Силикат хрома.</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>FeSiO<sub>3</sub></span> | ||
| + | <p>Силикат железа (II).</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>Fe<sub>2</sub>(SiO<sub>3</sub>)<sub>3</sub></span> | ||
| + | <p>Силикат железа (III).</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>CoSiO<sub>3</sub></span> | ||
| + | <p>Силикат кобальта.</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>NiSiO<sub>3</sub></span> | ||
| + | <p>Силикат никеля.</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span>PbSiO<sub>3</sub></span> | ||
| + | <p>Силикат свинца.</p> | ||
| + | <p>Не растворяется в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>CuSiO<sub>3</sub></span> | ||
| + | <p>Силикат меди.</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>HgSiO<sub>3</sub></span> | ||
| + | <p>Силикат ртути.</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | <div class='labelchem'> | ||
| + | <span class='notex'>Ag<sub>2</sub>SiO<sub>3</sub></span> | ||
| + | <p>Силикат серебра.</p> | ||
| + | <p>Не существует в воде.</p> | ||
| + | </div> | ||
| + | </div> | ||
| + | |||
| + | <div class="info show-for-large-up"> | ||
| + | <imagemap> | ||
| + | Файл:Tableofdissaciation.png|700px | ||
| + | rect 128 96 191 141 [[label1]] | ||
| + | rect 191 96 255 141 [[label2]] | ||
| + | rect 255 96 320 141 [[label3]] | ||
| + | rect 320 96 385 141 [[label4]] | ||
| + | rect 385 96 450 141 [[label5]] | ||
| + | rect 450 96 515 141 [[label6]] | ||
| + | rect 515 96 580 141 [[label7]] | ||
| + | rect 580 96 645 141 [[label8]] | ||
| + | rect 645 96 710 141 [[label9]] | ||
| + | rect 710 96 775 141 [[label10]] | ||
| + | rect 775 96 840 141 [[label11]] | ||
| + | rect 840 96 905 141 [[label12]] | ||
| + | rect 905 96 970 141 [[label13]] | ||
| + | rect 970 96 1035 141 [[label14]] | ||
| + | rect 1035 96 1100 141 [[label15]] | ||
| + | rect 1100 96 1165 141 [[label16]] | ||
| + | rect 1165 96 1230 141 [[label17]] | ||
| + | rect 1230 96 1295 141 [[label18]] | ||
| + | rect 1295 96 1360 141 [[label19]] | ||
| + | rect 1360 96 1425 141 [[label20]] | ||
| + | rect 1425 96 1490 141 [[label21]] | ||
| + | rect 1490 96 1555 141 [[label22]] | ||
| + | rect 1555 96 1620 141 [[label23]] | ||
| + | rect 128 141 191 187 [[label24]] | ||
| + | rect 191 141 255 187 [[label25]] | ||
| + | rect 255 141 320 187 [[label26]] | ||
| + | rect 320 141 385 187 [[label27]] | ||
| + | rect 385 141 450 187 [[label28]] | ||
| + | rect 450 141 515 187 [[label29]] | ||
| + | rect 515 141 580 187 [[label30]] | ||
| + | rect 580 141 645 187 [[label31]] | ||
| + | rect 645 141 710 187 [[label32]] | ||
| + | rect 710 141 775 187 [[label33]] | ||
| + | rect 775 141 840 187 [[label34]] | ||
| + | rect 840 141 905 187 [[label35]] | ||
| + | rect 905 141 970 187 [[label36]] | ||
| + | rect 970 141 1035 187 [[label37]] | ||
| + | rect 1035 141 1100 187 [[label38]] | ||
| + | rect 1100 141 1165 187 [[label39]] | ||
| + | rect 1165 141 1230 187 [[label40]] | ||
| + | rect 1230 141 1295 187 [[label41]] | ||
| + | rect 1295 141 1360 187 [[label42]] | ||
| + | rect 1360 141 1425 187 [[label43]] | ||
| + | rect 1425 141 1490 187 [[label44]] | ||
| + | rect 1490 141 1555 187 [[label45]] | ||
| + | rect 1555 141 1620 187 [[label46]] | ||
| + | rect 128 187 191 232 [[label47]] | ||
| + | rect 191 187 255 232 [[label48]] | ||
| + | rect 255 187 320 232 [[label49]] | ||
| + | rect 320 187 385 232 [[label50]] | ||
| + | rect 385 187 450 232 [[label51]] | ||
| + | rect 450 187 515 232 [[label52]] | ||
| + | rect 515 187 580 232 [[label53]] | ||
| + | rect 580 187 645 232 [[label54]] | ||
| + | rect 645 187 710 232 [[label55]] | ||
| + | rect 710 187 775 232 [[label56]] | ||
| + | rect 775 187 840 232 [[label57]] | ||
| + | rect 840 187 905 232 [[label58]] | ||
| + | rect 905 187 970 232 [[label59]] | ||
| + | rect 970 187 1035 232 [[label60]] | ||
| + | rect 1035 187 1100 232 [[label61]] | ||
| + | rect 1100 187 1165 232 [[label62]] | ||
| + | rect 1165 187 1230 232 [[label63]] | ||
| + | rect 1230 187 1295 232 [[label64]] | ||
| + | rect 1295 187 1360 232 [[label65]] | ||
| + | rect 1360 187 1425 232 [[label66]] | ||
| + | rect 1425 187 1490 232 [[label67]] | ||
| + | rect 1490 187 1555 232 [[label68]] | ||
| + | rect 1555 187 1620 232 [[label69]] | ||
| + | rect 128 232 191 277 [[label70]] | ||
| + | rect 191 232 255 277 [[label71]] | ||
| + | rect 255 232 320 277 [[label72]] | ||
| + | rect 320 232 385 277 [[label73]] | ||
| + | rect 385 232 450 277 [[label74]] | ||
| + | rect 450 232 515 277 [[label75]] | ||
| + | rect 515 232 580 277 [[label76]] | ||
| + | rect 580 232 645 277 [[label77]] | ||
| + | rect 645 232 710 277 [[label78]] | ||
| + | rect 710 232 775 277 [[label79]] | ||
| + | rect 775 232 840 277 [[label80]] | ||
| + | rect 840 232 905 277 [[label81]] | ||
| + | rect 905 232 970 277 [[label82]] | ||
| + | rect 970 232 1035 277 [[label83]] | ||
| + | rect 1035 232 1100 277 [[label84]] | ||
| + | rect 1100 232 1165 277 [[label85]] | ||
| + | rect 1165 232 1230 277 [[label86]] | ||
| + | rect 1230 232 1295 277 [[label87]] | ||
| + | rect 1295 232 1360 277 [[label88]] | ||
| + | rect 1360 232 1425 277 [[label89]] | ||
| + | rect 1425 232 1490 277 [[label90]] | ||
| + | rect 1490 232 1555 277 [[label91]] | ||
| + | rect 1555 232 1620 277 [[label92]] | ||
| + | rect 128 277 191 322 [[label93]] | ||
| + | rect 191 277 255 322 [[label94]] | ||
| + | rect 255 277 320 322 [[label95]] | ||
| + | rect 320 277 385 322 [[label96]] | ||
| + | rect 385 277 450 322 [[label97]] | ||
| + | rect 450 277 515 322 [[label98]] | ||
| + | rect 515 277 580 322 [[label99]] | ||
| + | rect 580 277 645 322 [[label100]] | ||
| + | rect 645 277 710 322 [[label101]] | ||
| + | rect 710 277 775 322 [[label102]] | ||
| + | rect 775 277 840 322 [[label103]] | ||
| + | rect 840 277 905 322 [[label104]] | ||
| + | rect 905 277 970 322 [[label105]] | ||
| + | rect 970 277 1035 322 [[label106]] | ||
| + | rect 1035 277 1100 322 [[label107]] | ||
| + | rect 1100 277 1165 322 [[label108]] | ||
| + | rect 1165 277 1230 322 [[label109]] | ||
| + | rect 1230 277 1295 322 [[label110]] | ||
| + | rect 1295 277 1360 322 [[label111]] | ||
| + | rect 1360 277 1425 322 [[label112]] | ||
| + | rect 1425 277 1490 322 [[label113]] | ||
| + | rect 1490 277 1555 322 [[label114]] | ||
| + | rect 1555 277 1620 322 [[label115]] | ||
| + | rect 128 322 191 367 [[label116]] | ||
| + | rect 191 322 255 367 [[label117]] | ||
| + | rect 255 322 320 367 [[label118]] | ||
| + | rect 320 322 385 367 [[label119]] | ||
| + | rect 385 322 450 367 [[label120]] | ||
| + | rect 450 322 515 367 [[label121]] | ||
| + | rect 515 322 580 367 [[label122]] | ||
| + | rect 580 322 645 367 [[label123]] | ||
| + | rect 645 322 710 367 [[label124]] | ||
| + | rect 710 322 775 367 [[label125]] | ||
| + | rect 775 322 840 367 [[label126]] | ||
| + | rect 840 322 905 367 [[label127]] | ||
| + | rect 905 322 970 367 [[label128]] | ||
| + | rect 970 322 1035 367 [[label129]] | ||
| + | rect 1035 322 1100 367 [[label130]] | ||
| + | rect 1100 322 1165 367 [[label131]] | ||
| + | rect 1165 322 1230 367 [[label132]] | ||
| + | rect 1230 322 1295 367 [[label133]] | ||
| + | rect 1295 322 1360 367 [[label134]] | ||
| + | rect 1360 322 1425 367 [[label135]] | ||
| + | rect 1425 322 1490 367 [[label136]] | ||
| + | rect 1490 322 1555 367 [[label137]] | ||
| + | rect 1555 322 1620 367 [[label138]] | ||
| + | rect 128 367 191 412 [[label139]] | ||
| + | rect 191 367 255 412 [[label140]] | ||
| + | rect 255 367 320 412 [[label141]] | ||
| + | rect 320 367 385 412 [[label142]] | ||
| + | rect 385 367 450 412 [[label143]] | ||
| + | rect 450 367 515 412 [[label144]] | ||
| + | rect 515 367 580 412 [[label145]] | ||
| + | rect 580 367 645 412 [[label146]] | ||
| + | rect 645 367 710 412 [[label147]] | ||
| + | rect 710 367 775 412 [[label148]] | ||
| + | rect 775 367 840 412 [[label149]] | ||
| + | rect 840 367 905 412 [[label150]] | ||
| + | rect 905 367 970 412 [[label151]] | ||
| + | rect 970 367 1035 412 [[label152]] | ||
| + | rect 1035 367 1100 412 [[label153]] | ||
| + | rect 1100 367 1165 412 [[label154]] | ||
| + | rect 1165 367 1230 412 [[label155]] | ||
| + | rect 1230 367 1295 412 [[label156]] | ||
| + | rect 1295 367 1360 412 [[label157]] | ||
| + | rect 1360 367 1425 412 [[label158]] | ||
| + | rect 1425 367 1490 412 [[label159]] | ||
| + | rect 1490 367 1555 412 [[label160]] | ||
| + | rect 1555 367 1620 412 [[label161]] | ||
| + | rect 128 412 191 457 [[label162]] | ||
| + | rect 191 412 255 457 [[label163]] | ||
| + | rect 255 412 320 457 [[label164]] | ||
| + | rect 320 412 385 457 [[label165]] | ||
| + | rect 385 412 450 457 [[label166]] | ||
| + | rect 450 412 515 457 [[label167]] | ||
| + | rect 515 412 580 457 [[label168]] | ||
| + | rect 580 412 645 457 [[label169]] | ||
| + | rect 645 412 710 457 [[label170]] | ||
| + | rect 710 412 775 457 [[label171]] | ||
| + | rect 775 412 840 457 [[label172]] | ||
| + | rect 840 412 905 457 [[label173]] | ||
| + | rect 905 412 970 457 [[label174]] | ||
| + | rect 970 412 1035 457 [[label175]] | ||
| + | rect 1035 412 1100 457 [[label176]] | ||
| + | rect 1100 412 1165 457 [[label177]] | ||
| + | rect 1165 412 1230 457 [[label178]] | ||
| + | rect 1230 412 1295 457 [[label179]] | ||
| + | rect 1295 412 1360 457 [[label180]] | ||
| + | rect 1360 412 1425 457 [[label181]] | ||
| + | rect 1425 412 1490 457 [[label182]] | ||
| + | rect 1490 412 1555 457 [[label183]] | ||
| + | rect 1555 412 1620 457 [[label184]] | ||
| + | rect 128 457 191 502 [[label185]] | ||
| + | rect 191 457 255 502 [[label186]] | ||
| + | rect 255 457 320 502 [[label187]] | ||
| + | rect 320 457 385 502 [[label188]] | ||
| + | rect 385 457 450 502 [[label189]] | ||
| + | rect 450 457 515 502 [[label190]] | ||
| + | rect 515 457 580 502 [[label191]] | ||
| + | rect 580 457 645 502 [[label192]] | ||
| + | rect 645 457 710 502 [[label193]] | ||
| + | rect 710 457 775 502 [[label194]] | ||
| + | rect 775 457 840 502 [[label195]] | ||
| + | rect 840 457 905 502 [[label196]] | ||
| + | rect 905 457 970 502 [[label197]] | ||
| + | rect 970 457 1035 502 [[label198]] | ||
| + | rect 1035 457 1100 502 [[label199]] | ||
| + | rect 1100 457 1165 502 [[label200]] | ||
| + | rect 1165 457 1230 502 [[label201]] | ||
| + | rect 1230 457 1295 502 [[label202]] | ||
| + | rect 1295 457 1360 502 [[label203]] | ||
| + | rect 1360 457 1425 502 [[label204]] | ||
| + | rect 1425 457 1490 502 [[label205]] | ||
| + | rect 1490 457 1555 502 [[label206]] | ||
| + | rect 1555 457 1620 502 [[label207]] | ||
| + | rect 128 502 191 547 [[label208]] | ||
| + | rect 191 502 255 547 [[label209]] | ||
| + | rect 255 502 320 547 [[label210]] | ||
| + | rect 320 502 385 547 [[label211]] | ||
| + | rect 385 502 450 547 [[label212]] | ||
| + | rect 450 502 515 547 [[label213]] | ||
| + | rect 515 502 580 547 [[label214]] | ||
| + | rect 580 502 645 547 [[label215]] | ||
| + | rect 645 502 710 547 [[label216]] | ||
| + | rect 710 502 775 547 [[label217]] | ||
| + | rect 775 502 840 547 [[label218]] | ||
| + | rect 840 502 905 547 [[label219]] | ||
| + | rect 905 502 970 547 [[label220]] | ||
| + | rect 970 502 1035 547 [[label221]] | ||
| + | rect 1035 502 1100 547 [[label222]] | ||
| + | rect 1100 502 1165 547 [[label223]] | ||
| + | rect 1165 502 1230 547 [[label224]] | ||
| + | rect 1230 502 1295 547 [[label225]] | ||
| + | rect 1295 502 1360 547 [[label226]] | ||
| + | rect 1360 502 1425 547 [[label227]] | ||
| + | rect 1425 502 1490 547 [[label228]] | ||
| + | rect 1490 502 1555 547 [[label229]] | ||
| + | rect 1555 502 1620 547 [[label230]] | ||
| + | rect 128 547 191 592 [[label231]] | ||
| + | rect 191 547 255 592 [[label232]] | ||
| + | rect 255 547 320 592 [[label233]] | ||
| + | rect 320 547 385 592 [[label234]] | ||
| + | rect 385 547 450 592 [[label235]] | ||
| + | rect 450 547 515 592 [[label236]] | ||
| + | rect 515 547 580 592 [[label237]] | ||
| + | rect 580 547 645 592 [[label238]] | ||
| + | rect 645 547 710 592 [[label239]] | ||
| + | rect 710 547 775 592 [[label240]] | ||
| + | rect 775 547 840 592 [[label241]] | ||
| + | rect 840 547 905 592 [[label242]] | ||
| + | rect 905 547 970 592 [[label243]] | ||
| + | rect 970 547 1035 592 [[label244]] | ||
| + | rect 1035 547 1100 592 [[label245]] | ||
| + | rect 1100 547 1165 592 [[label246]] | ||
| + | rect 1165 547 1230 592 [[label247]] | ||
| + | rect 1230 547 1295 592 [[label248]] | ||
| + | rect 1295 547 1360 592 [[label249]] | ||
| + | rect 1360 547 1425 592 [[label250]] | ||
| + | rect 1425 547 1490 592 [[label251]] | ||
| + | rect 1490 547 1555 592 [[label252]] | ||
| + | rect 1555 547 1620 592 [[label253]] | ||
| + | rect 128 592 191 637 [[label254]] | ||
| + | rect 191 592 255 637 [[label255]] | ||
| + | rect 255 592 320 637 [[label256]] | ||
| + | rect 320 592 385 637 [[label257]] | ||
| + | rect 385 592 450 637 [[label258]] | ||
| + | rect 450 592 515 637 [[label259]] | ||
| + | rect 515 592 580 637 [[label260]] | ||
| + | rect 580 592 645 637 [[label261]] | ||
| + | rect 645 592 710 637 [[label262]] | ||
| + | rect 710 592 775 637 [[label263]] | ||
| + | rect 775 592 840 637 [[label264]] | ||
| + | rect 840 592 905 637 [[label265]] | ||
| + | rect 905 592 970 637 [[label266]] | ||
| + | rect 970 592 1035 637 [[label267]] | ||
| + | rect 1035 592 1100 637 [[label268]] | ||
| + | rect 1100 592 1165 637 [[label269]] | ||
| + | rect 1165 592 1230 637 [[label270]] | ||
| + | rect 1230 592 1295 637 [[label271]] | ||
| + | rect 1295 592 1360 637 [[label272]] | ||
| + | rect 1360 592 1425 637 [[label273]] | ||
| + | rect 1425 592 1490 637 [[label274]] | ||
| + | rect 1490 592 1555 637 [[label275]] | ||
| + | rect 1555 592 1620 637 [[label276]] | ||
| + | rect 128 637 191 682 [[label277]] | ||
| + | rect 191 637 255 682 [[label278]] | ||
| + | rect 255 637 320 682 [[label279]] | ||
| + | rect 320 637 385 682 [[label280]] | ||
| + | rect 385 637 450 682 [[label281]] | ||
| + | rect 450 637 515 682 [[label282]] | ||
| + | rect 515 637 580 682 [[label283]] | ||
| + | rect 580 637 645 682 [[label284]] | ||
| + | rect 645 637 710 682 [[label285]] | ||
| + | rect 710 637 775 682 [[label286]] | ||
| + | rect 775 637 840 682 [[label287]] | ||
| + | rect 840 637 905 682 [[label288]] | ||
| + | rect 905 637 970 682 [[label289]] | ||
| + | rect 970 637 1035 682 [[label290]] | ||
| + | rect 1035 637 1100 682 [[label291]] | ||
| + | rect 1100 637 1165 682 [[label292]] | ||
| + | rect 1165 637 1230 682 [[label293]] | ||
| + | rect 1230 637 1295 682 [[label294]] | ||
| + | rect 1295 637 1360 682 [[label295]] | ||
| + | rect 1360 637 1425 682 [[label296]] | ||
| + | rect 1425 637 1490 682 [[label297]] | ||
| + | rect 1490 637 1555 682 [[label298]] | ||
| + | rect 1555 637 1620 682 [[label299]] | ||
| + | rect 128 682 191 727 [[label300]] | ||
| + | rect 191 682 255 727 [[label301]] | ||
| + | rect 255 682 320 727 [[label302]] | ||
| + | rect 320 682 385 727 [[label303]] | ||
| + | rect 385 682 450 727 [[label304]] | ||
| + | rect 450 682 515 727 [[label305]] | ||
| + | rect 515 682 580 727 [[label306]] | ||
| + | rect 580 682 645 727 [[label307]] | ||
| + | rect 645 682 710 727 [[label308]] | ||
| + | rect 710 682 775 727 [[label309]] | ||
| + | rect 775 682 840 727 [[label310]] | ||
| + | rect 840 682 905 727 [[label311]] | ||
| + | rect 905 682 970 727 [[label312]] | ||
| + | rect 970 682 1035 727 [[label313]] | ||
| + | rect 1035 682 1100 727 [[label314]] | ||
| + | rect 1100 682 1165 727 [[label315]] | ||
| + | rect 1165 682 1230 727 [[label316]] | ||
| + | rect 1230 682 1295 727 [[label317]] | ||
| + | rect 1295 682 1360 727 [[label318]] | ||
| + | rect 1360 682 1425 727 [[label319]] | ||
| + | rect 1425 682 1490 727 [[label320]] | ||
| + | rect 1490 682 1555 727 [[label321]] | ||
| + | rect 1555 682 1620 727 [[label322]] | ||
| + | rect 128 727 191 772 [[label323]] | ||
| + | rect 191 727 255 772 [[label324]] | ||
| + | rect 255 727 320 772 [[label325]] | ||
| + | rect 320 727 385 772 [[label326]] | ||
| + | rect 385 727 450 772 [[label327]] | ||
| + | rect 450 727 515 772 [[label328]] | ||
| + | rect 515 727 580 772 [[label329]] | ||
| + | rect 580 727 645 772 [[label330]] | ||
| + | rect 645 727 710 772 [[label331]] | ||
| + | rect 710 727 775 772 [[label332]] | ||
| + | rect 775 727 840 772 [[label333]] | ||
| + | rect 840 727 905 772 [[label334]] | ||
| + | rect 905 727 970 772 [[label335]] | ||
| + | rect 970 727 1035 772 [[label336]] | ||
| + | rect 1035 727 1100 772 [[label337]] | ||
| + | rect 1100 727 1165 772 [[label338]] | ||
| + | rect 1165 727 1230 772 [[label339]] | ||
| + | rect 1230 727 1295 772 [[label340]] | ||
| + | rect 1295 727 1360 772 [[label341]] | ||
| + | rect 1360 727 1425 772 [[label342]] | ||
| + | rect 1425 727 1490 772 [[label343]] | ||
| + | rect 1490 727 1555 772 [[label344]] | ||
| + | rect 1555 727 1620 772 [[label345]] | ||
| + | desc none | ||
| + | </imagemap> | ||
| + | </div> | ||
| + | |||
| + | <div class="info hide-for-large-up"> | ||
| + | <imagemap> | ||
| + | Файл:Tableofdissaciation.png|400px | ||
| + | rect 128 96 191 141 [[label1]] | ||
| + | rect 191 96 255 141 [[label2]] | ||
| + | rect 255 96 320 141 [[label3]] | ||
| + | rect 320 96 385 141 [[label4]] | ||
| + | rect 385 96 450 141 [[label5]] | ||
| + | rect 450 96 515 141 [[label6]] | ||
| + | rect 515 96 580 141 [[label7]] | ||
| + | rect 580 96 645 141 [[label8]] | ||
| + | rect 645 96 710 141 [[label9]] | ||
| + | rect 710 96 775 141 [[label10]] | ||
| + | rect 775 96 840 141 [[label11]] | ||
| + | rect 840 96 905 141 [[label12]] | ||
| + | rect 905 96 970 141 [[label13]] | ||
| + | rect 970 96 1035 141 [[label14]] | ||
rect 1035 96 1100 141 [[label15]] | rect 1035 96 1100 141 [[label15]] | ||
rect 1100 96 1165 141 [[label16]] | rect 1100 96 1165 141 [[label16]] | ||
| Строка 1652: | Строка 2337: | ||
rect 1490 727 1555 772 [[label344]] | rect 1490 727 1555 772 [[label344]] | ||
rect 1555 727 1620 772 [[label345]] | rect 1555 727 1620 772 [[label345]] | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
desc none | desc none | ||
</imagemap> | </imagemap> | ||
</div> | </div> | ||
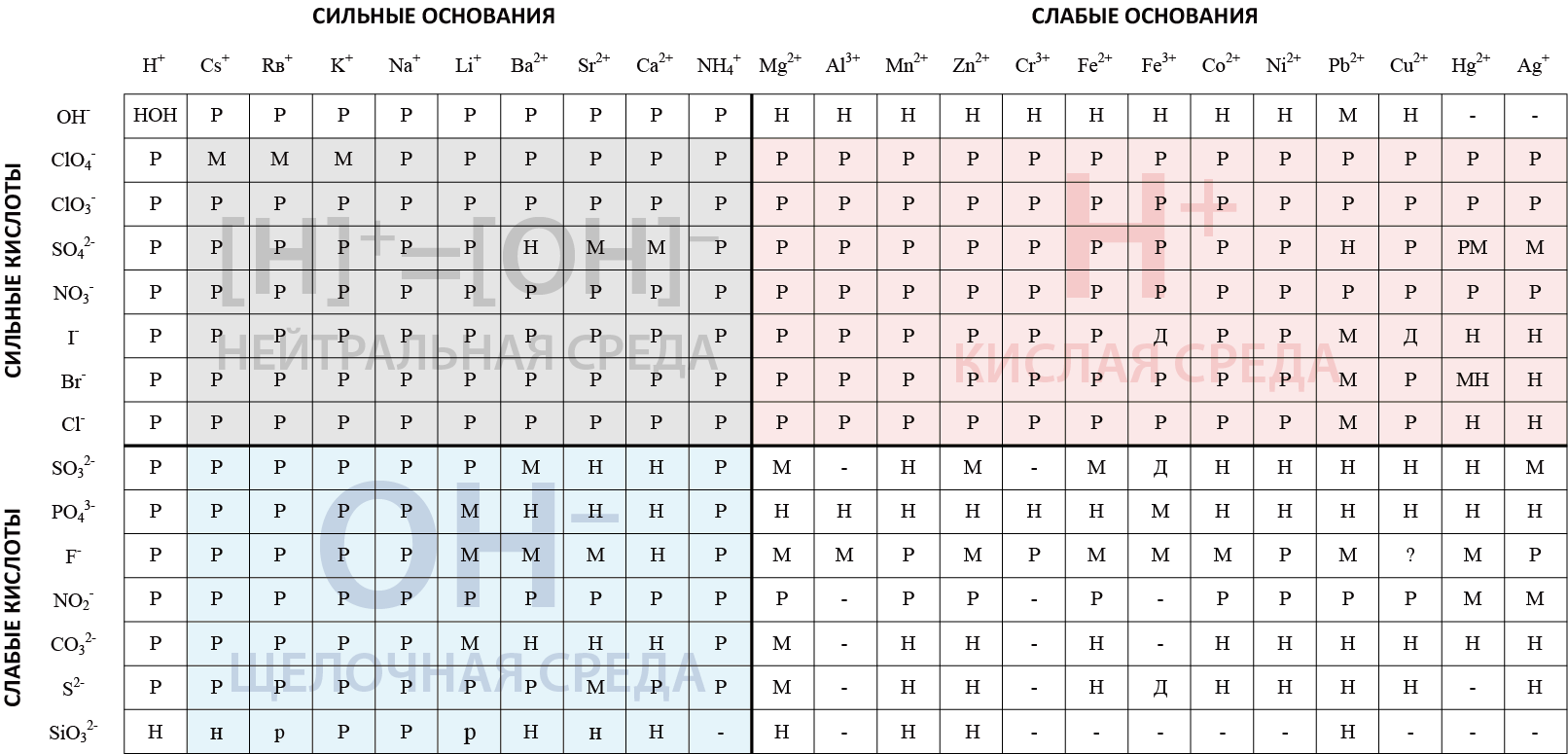
Текущая версия на 06:38, 5 сентября 2018
HOH
Гидроксид водорода, соединение гидроксильной группы OH– и катиона H+
CsOH
Гидроксид цезия – сильнейшее основание.
RbOH
Гидроксид рубидия, является одним из наиболее сильных оснований.
KOH
Гидроксид калия. Сильное основание.
NaOH
Гидроксид натрия. Сильное основание.
LiOH
Гидроксид лития. Сильное основание.
Ba(OH)2
Гидроксид бария. Сильное основание.
Sr(OH)2
Гидроксид стронция. Сильное основание.
Ca(OH)2
Гидроксид кальция. Сильное основание.
NH4OH
Гидроксид аммония. Сильное основание.
Mg(OH)2
Гидроксид магния. Слабое основание. Не растворяется в воде.
Al(OH)3
Гидроксид алюминия. Слабое основание. Не растворяется в воде.
Mn(OH)2
Гидроксид марганца. Слабое основание. Не растворяется в воде.
Zn(OH)2
Гидроксид цинка. Слабое основание. Не растворяется в воде.
Cr(OH)3
Гидроксид хрома. Слабое основание. Не растворяется в воде.
Fe(OH)2
Гидроксид железа (II). Слабое основание. Не растворяется в воде.
Fe(OH)3
Гидроксид железа (III). Слабое основание. Не растворяется в воде.
Co(OH)2
Гидроксид кобальта. Слабое основание. Не растворяется в воде.
Ni(OH)2
Гидроксид никеля. Слабое основание. Не растворяется в воде.
Pb(OH)2
Гидроксид свинца. Слабое основание. Малорастворим в воде.
Cu(OH)2
Гидроксид меди. Слабое основание. Не растворяется в воде.
Hg(OH)2
Не существует в водном растворе.
Ag(OH)
Не существует.
HClO4
Хлорная кислота. Cильный окислитель, так как содержит хлор в высшей степени окисления +7.
CsClO4
Перхлорат цезия. Слабо растворим в воде примерно 2 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
RbClO4
Перхлорат рубидия. Слабо растворим в воде.
Диссоциирует, образуя нейтральную среду.
KClO4
Перхлорат калия. Слабо растворим в воде примерно 2,1 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
NaClO4
Перхлорат натрия. Хорошо растворяется в воде примерно 211 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
LiClO4
Перхлорат лития. Растворим в воде примерно 58 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
Ba(ClO4)2
Перхлорат бария. Хорошо растворяется в воде примерно 340 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
Sr(ClO4)2
Перхлорат стронция. Нет данных.
Диссоциирует, образуя нейтральную среду.
Ca(ClO4)2
Перхлорат кальция. Хорошо растворяется в воде примерно 188 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
NH4ClO4
Перхлорат аммония. Хорошо растворяется в воде примерно 24,5 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
Mg(ClO4)2
Перхлорат магния. Хорошо растворяется в воде примерно 52 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al(ClO4)3
Перхлорат алюминия. Хорошо растворяется в воде примерно 135 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Mn(ClO4)2
Перхлорат марганца. Хорошо растворяется в воде примерно 52 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Zn(ClO4)2
Перхлорат цинка. Хорошо растворяется в воде примерно 112 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr(ClO4)3
Перхлорат хрома. Хорошо растворяется в воде примерно 133 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(ClO4)2
Перхлорат железа (II). Хорошо растворяется в воде примерно 300 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(ClO4)3
Перхлорат железа (III). Хорошо растворяется в воде примерно 395 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Co(ClO4)2
Перхлорат кобальта. Хорошо растворяется в воде примерно 110 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Ni(ClO4)2
Перхлорат никеля. Хорошо растворяется в воде примерно 111 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Pb(ClO4)2
Перхлорат свинца. Хорошо растворяется в воде примерно 80 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cu(ClO4)2
Перхлорат меди. Хорошо растворяется в воде примерно 150 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Hg(ClO4)2
Перхлорат ртути (II). Хорошо растворяется в воде примерно 290 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AgClO4
Перхлорат серебра. Хорошо растворяется в воде примерно 557 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HClO3
Хлорноватая кислота. сильная кислота, в которой хлор имеет степень окисления +5.
Заменить.
CsClO3
Хлорат цезия. Растворяется в воде примерно 9 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
RbClO3
Хлорат рубидия. Растворяется в воде примерно 7 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
KClO3
Хлорат калия. Растворяется в воде примерно 8 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
NaClO3
Хлорат натрия. Хорошо растворяется в воде примерно 100 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
LiClO3
Хлорат лития. Хорошо растворяется в воде примерно 400 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Ba(ClO3)2
Хлорат бария. Растворяется в воде примерно 37 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Sr(ClO3)2
Хлорат стронция. Хорошо растворяется в воде примерно 185 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Ca(ClO3)2
Хлорат кальция. Хорошо растворяется в воде примерно 218 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
NH4ClO3
Хлорат аммония. Растворяется в воде примерно 30 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Mg(ClO3)2
Хлорат магния. Хорошо растворяется в воде примерно 145 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al(ClO3)3
Хлорат алюминия. Растворяется в воде примерно 77 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Mn(ClO3)2
Хлорат марганца. Нет данных
В результате гидролиза, образуется кислая среда.
Zn(ClO3)2
Хлорат цинка. Хорошо растворяется в воде примерно 218 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr(ClO3)3
Хлорат хрома. Хорошо растворяется в воде примерно 142 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(ClO3)2
Хлорат железа (II). Хорошо растворяется в воде примерно 210 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(ClO3)3
Хлорат железа (III). Нет данных
В результате гидролиза, образуется кислая среда.
Co(ClO3)2
Хлорат кобальта. Хорошо растворяется в воде примерно 185 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Ni(ClO3)2
Хлорат никеля. Хорошо растворяется в воде примерно 145 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Pb(ClO3)2
Хлорат свинца. Хорошо растворяется в воде примерно 144 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cu(ClO3)2
Хлорат меди. Хорошо растворяется в воде примерно 250 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Hg(ClO3)2
Хлорат ртути. Растворяется в воде примерно 25 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AgClO3
Хлорат серебра. Растворяется в воде примерно 18 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
H2SO4
Серная кислота. сильная кислота, отвечающая высшей степени окисления серы (+6)
Cs2SO4
Сульфат цезия. Хорошо растворяется в воде примерно 180 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Rb2SO4
Сульфат рубидия. Растворяется в воде примерно 51 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
K2SO4
Сульфат калия. Растворяется в воде примерно 12 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Na2SO4
Сульфат натрия. Растворяется в воде примерно 30 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Li2SO4
Сульфат лития. Растворяется в воде примерно 34 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
BaSO4
Сульфат бария. Не растворяется в воде.
SrSO4
Сульфат стронция. Плохо растворяется в воде, примерно 0,013 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
CaSO4
Сульфат кальция. Плохо растворяется в воде, примерно 0,26 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
(NH4)2SO4
Сульфат аммония. Хорошо растворяется в воде, примерно 118 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
MgSO4
Сульфат магния. Растворяется в воде, примерно 36 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al2(SO4)3
Сульфат алюминия. Растворяется в воде, примерно 37 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
MnSO4
Сульфат марганца. Хорошо растворяется в воде, примерно 63 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
ZnSO4
Сульфат цинка. Хорошо растворяется в воде, примерно 57 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr2(SO4)3
Сульфат хрома. Хорошо растворяется в воде, примерно 220 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
FeSO4
Сульфат железа (II). Хорошо растворяется в воде, примерно 53 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe2(SO4)3
Сульфат железа (III). Очень хорошо растворяется в воде, примерно 440 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CoSO4
Сульфат кобальта. Растворяется в воде, примерно 39 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
NiSO4
Сульфат никеля. Растворяется в воде, примерно 45 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
PbSO4
Сульфат свинца. Не растворяется в воде.
CuSO4
Сульфат меди. Растворяется в воде, примерно 22 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HgSO4
Сульфат ртути. Почти не растворим.
Гидролизуется большим количеством воды, образуя кислую среду.
Ag2SO4
Сульфат серебра. Плохо растворяется в воде, примерно 0,84 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HNO3
Азотная кислота. Cильный окислитель. Нитрат-ион в воде не гидролизуется.
CsNO3
Нитрат цезия. Растворяется в воде, примерно 28 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
RbNO3
Нитрат рубидия. Хорошо растворяется в воде, примерно 70 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
KNO3
Нитрат калия. Растворяется в воде, примерно 38 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NaNO3
Нитрат натрия. Хорошо растворяется в воде, примерно 90 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
LiNO3
Нитрат лития. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Ba(NO3)2
Нитрат бария. Растворяется в воде, примерно 10 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Sr(NO3)2
Нитрат стронция. Растворяется в воде, примерно 74 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Ca(NO3)2
Нитрат кальция. Хорошо растворяется в воде, примерно 140 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NH4NO3
Нитрат аммония. Хорошо растворяется в воде, примерно 212 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Mg(NO3)2
Нитрат магния. Растворяется в воде, примерно 72,7 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al(NO3)3
Нитрат алюминия. Растворяется в воде, примерно 78 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Mn(NO3)2
Нитрат марганца. Хорошо растворяется в воде, примерно 140 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Zn(NO3)2
Нитрат цинка. Хорошо растворяется в воде, примерно 130 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr(NO3)3
Нитрат хрома. Хорошо растворяется в воде, примерно 145 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(NO3)2
Нитрат железа (II). Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(NO3)3
Нитрат железа (III). Хорошо растворяется в воде, примерно 160 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Co(NO3)2
Нитрат кобальта. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Ni(NO3)2
Нитрат никеля. Хорошо растворяется в воде, примерно 98 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Pb(NO3)2
Нитрат свинца. Растворяется в воде, примерно 56,5 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cu(NO3)2
Нитрат меди. Хорошо растворяется в воде, примерно 145 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Hg(NO3)2
Нитрат ртути. Растворим в кислых водных растворах.
В результате гидролиза, образуется кислая среда.
AgNO3
Нитрат серебра. Хорошо растворяется в воде, примерно 250 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HI
Иодоводородная кислота. Сильный окислитель.
CsI
Иодид цезия. Хорошо растворяется в воде, примерно 90 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
RbI
Иодид рубидия. Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
KI
Иодид калия. Хорошо растворяется в воде, примерно 148 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NaI
Иодид натрия. Хорошо растворяется в воде, примерно 184 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
LiI
Иодид лития. Хорошо растворяется в воде, примерно 167 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
BaI2
Иодид бария. Хорошо растворяется в воде, примерно 218 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
SrI2
Иодид стронция. Хорошо растворяется в воде, примерно 180 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
CaI2
Иодид кальция. Хорошо растворяется в воде, примерно 215 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NH4I
Иодид аммония. Хорошо растворяется в воде, примерно 176 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
MgI2
Иодид магния. Хорошо растворяется в воде, примерно 142 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AlI3
Иодид алюминия. Хорошо растворяется в воде.
В результате гидролиза, образуется кислая среда.
MnI2
Иодид марганца. Растворяется в воде.
В результате гидролиза, образуется кислая среда.
ZnI2
Иодид цинка. Хорошо растворяется в воде, примерно 440 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CrI3
Иодид хрома. Плохо растворяется в воде.
В результате гидролиза, образуется кислая среда.
FeI2
Иодид железа (II). Растворяется в воде.
В результате гидролиза, образуется кислая среда.
FeI3
Иодид железа (III). Диспропорционирует при растворении в воде.
В результате гидролиза, образуется кислая среда.
CoI2
Иодид кобальта. Хорошо растворяется в воде, примерно 210 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
NiI2
Иодид никеля. Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
PbI2
Иодид свинца. Плохо растворяется в воде, примерно 0,076 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CuI2
Иодид меди. Диспропорционирует при растворении в воде.
В результате гидролиза, образуется кислая среда.
HgI2
Иодид ртути. Не растворяется в воде.
AgI
Иодид серебра. Не растворяется в воде.
HBr
Бромоводородная кислота. Сильная одноосновная кислота.
CsBr
Бромид цезия. Хорошо растворяется в воде, примерно 110 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
RbBr
Бромид рубидия. Хорошо растворяется в воде, примерно 114 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
KBr
Бромид калия. Растворяется в воде, примерно 68 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NaBr
Бромид натрия. Хорошо растворяется в воде, примерно 94 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
LiBr
Бромид лития. Хорошо растворяется в воде, примерно 170 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Ba(Br)2
Бромид бария. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Sr(Br)2
Бромид стронция. Хорошо растворяется в воде, примерно 107 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Ca(Br)2
Бромид кальция. Хорошо растворяется в воде, примерно 153 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NH4Br
Бромид аммония. Хорошо растворяется в воде, примерно 78 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Mg(Br)2
Бромид магния. Хорошо растворяется в воде, примерно 103 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al(Br)3
Бромид алюминия. Хорошо растворяется в воде.
В результате гидролиза, образуется кислая среда.
Mn(Br)2
Бромид марганца. Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Zn(Br)2
Бромид цинка. Хорошо растворяется в воде, примерно 470 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr(Br)3
Бромид хрома. Растворяется в воде.
В результате гидролиза, образуется кислая среда.
Fe(Br)2
Бромид железа (II). Хорошо растворяется в воде, примерно 120 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(Br)3
Бромид железа (III). Хорошо растворяется в воде, примерно 455 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Co(Br)2
Бромид кобальта. Хорошо растворяется в воде, примерно 115 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Ni(Br)2
Бромид никеля. Хорошо растворяется в воде, примерно 134 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Pb(Br)2
Бромид свинца. Плохо растворяется в воде, примерно 0,97 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cu(Br)2
Бромид меди. Хорошо растворяется в воде, примерно 127 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Hg(Br)2
Бромид ртути. Плохо растворяется в воде, примерно 0,61 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AgBr
Бромид серебра. Не растворяется в воде.
HCl
Соляная кислота. Сильная одноосновная кислота.
CsCl
Хлорид цезия. Хорошо растворяется в воде, примерно 190 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
RbCl
Хлорид рубидия. Хорошо растворяется в воде, примерно 95 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
KCl
Хлорид калия. Растворяется в воде, примерно 36 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NaCl
Хлорид натрия. Растворяется в воде, примерно 36 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
LiCl
Хлорид лития. Хорошо растворяется в воде, примерно 84,5 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
BaCl2
Хлорид бария. Растворяется в воде, примерно 37,4 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
SrCl2
Хлорид стронция. Хорошо растворяется в воде, примерно 56 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
CaCl2
Хлорид кальция. Хорошо растворяется в воде, примерно 77 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NH4Cl
Хлорид аммония. Растворяется в воде, примерно 39 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
MgCl2
Хлорид магния. Хорошо растворяется в воде, примерно 55,5 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AlCl3
Хлорид алюминия. Растворяется в воде, примерно 45 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
MnCl2
Хлорид марганца. Хорошо растворяется в воде, примерно 77 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
ZnCl2
Хлорид цинка. Хорошо растворяется в воде, примерно 408 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CrCl3
Хлорид хрома. В воде растворим в присутствии восстановителей (Cr2+, Fe2+).
В результате гидролиза, образуется кислая среда.
FeCl2
Хлорид железа (II). Хорошо растворяется в воде, примерно 64 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
FeCl3
Хлорид железа (IIШ). Хорошо растворяется в воде, примерно 99 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CoCl2
Хлорид кобальта. Хорошо растворяется в воде, примерно 56 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
NiCl2
Хлорид никеля. Хорошо растворяется в воде, примерно 65 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
PbCl2
Хлорид свинца. Плохо растворяется в воде, примерно 1,08 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CuCl2
Хлорид меди. Хорошо растворяется в воде, примерно 76 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HgCl2
Хлорид ртути. Не растворяется в воде.
AgCl
Хлорид серебра. Не растворяется в воде.
H2SO3
Сернистая кислота. Неустойчивая двухосновная кислота средней силы.
Cs2SO3
Сульфит цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Rb2SO3
Сульфит рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
K2SO3
Сульфит калия. Хорошо растворяется в воде, примерно 106 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Na2SO3
Сульфит натрия. Растворяется в воде, примерно 28 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Li2SO3
Сульфит лития. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
BaSO3
Сульфит бария. Плохо растворяется в воде, примерно 0,02 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
SrSO3
Сульфит стронция. Не растворяется в воде.
CaSO3
Сульфит кальция. Не растворяется в воде.
(NH4)2SO3
Сульфит аммония. Растворяется в воде, примерно 65 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
MgSO3
Сульфит магния. Плохо растворяется в воде, примерно 0,65 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Al2(SO3)3
Сульфит алюминия.
Гидролиз протекает практически полностью, оба продукта реакции уходят из зоны реакции в виде осадка или газа.
MnSO3
Сульфит марганца. Не растворяется в воде.
ZnSO3
Сульфит цинка. Плохо растворяется в воде, примерно 0.16 гр на 100 мл при температуре 25oC.
Гидролиз протекает практически полностью, оба продукта реакции уходят из зоны реакции в виде осадка или газа.
CrSO3
Сульфит хрома. Не растворяется в воде.
FeSO3
Сульфит железа (II). Плохо растворяется в воде.
Гидролиз протекает практически полностью, оба продукта реакции уходят из зоны реакции в виде осадка или газа.
Fe2(SO3)3
Сульфит железа (III). Диспропорционирует при растворении в воде.
CoSO3
Сульфит кобальта. Не растворяется в воде.
NiSO3
Сульфит никеля. Не растворяется в воде.
PbSO3
Сульфит свинца. Не растворяется в воде.
CuSO3
Сульфит меди. Не растворяется в воде.
HgSO3
Сульфит ртути. Не растворяется в воде.
Ag2SO3
Сульфит серебра. Очень плохо растворяется в воде, примерно 0.00005255 гр на 100 мл при температуре 25oC.
Гидролиз протекает практически полностью, оба продукта реакции уходят из зоны реакции в виде осадка или газа.
H3PO4
Ортофо́сфорная кислота (фо́сфорная кислота). Трёхосновная кислота средней силы.
Cs3PO4
Фосфат цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Rb3PO4
Фосфат рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
K3PO4
Фосфат калия. Хорошо растворяется в воде, примерно 106 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Na3PO4
Фосфат натрия. Растворяется в воде, примерно 14,5 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Li3PO4
Фосфат лития. Плохо растворяется в воде, примерно 0,037 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Ba3(PO4)2
Фосфат бария. Не растворяется в воде.
Sr3(PO4)2
Фосфат стронция. Не растворяется в воде.
Ca3(PO4)2
Фосфат кальция. Не растворяется в воде.
(NH4)3PO4
Фосфат аммония. Растворяется в воде, примерно 22 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Mg3(PO4)2
Фосфат магния. Не растворяется в воде.
AlPO4
Фосфат алюминия. Не растворяется в воде.
Mn3(PO4)2
Фосфат марганца. Не растворяется в воде.
Zn3(PO4)2
Фосфат цинка. Не растворяется в воде.
CrPO4
Фосфат хрома. Не растворяется в воде.
Fe3(PO4)2
Фосфат железа (II). Не растворяется в воде.
FePO4
Фосфат железа (III). Очень плохо растворяется в воде, примерно 0,67 гр на 100 мл при температуре 100oC.
Гидролиз не протекает.
Co3(PO4)2
Фосфат кобальта. Не растворяется в воде.
Ni3(PO4)2
Фосфат никеля. Не растворяется в воде.
Pb3(PO4)2
Фосфат свинца. Не растворяется в воде.
Cu3(PO4)2
Фосфат меди. Не растворяется в воде.
Hg3(PO4)2
Фосфат ртути. Не растворяется в воде.
Ag3PO4
Фосфат серебра. Не растворяется в воде.
HF
Плавиковая кислота (фтороводородная кислота). Кислота средней силы.
CsF
Фторид цезия. Очень хорошо растворяется в воде, примерно 322 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
RbF
Фторид рубидия. Очень хорошо растворяется в воде, примерно 300 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
KF
Фторид калия. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
NaF
Фторид натрия. Растворяется в воде, примерно 4,3 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
LiF
Фторид лития. Плохо растворяется в воде, примерно 0,13 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
BaF2
Фторид бария. Плохо растворяется в воде, примерно 0,160 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
SrF2
Фторид стронция. Плохо растворяется в воде, примерно 0,021 гр на 100 мл при температуре 25oC.
CaF2
Фторид кальция. Не растворяется в воде.
NH4F
Фторид аммония. Хорошо растворяется в воде, примерно 84,5 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
MgF2
Фторид магния. Очень плохо растворяется в воде, примерно 0,0078 гр на 100 мл при температуре 25oC.
AlF3
Фторид алюминия. Плохо растворяется в воде, примерно 0,5 гр на 100 мл при температуре 25oC.
MnF2
Фторид марганца. Плохо растворяется в воде, примерно 1,06 гр на 100 мл при температуре 25oC.
ZnF2
Фторид цинка. Плохо растворяется в воде, примерно 1,6 гр на 100 мл при температуре 25oC.
CrF3
Фторид хрома. Плохо растворяется в воде, примерно 4 гр на 100 мл при температуре 25oC.
FeF2
Фторид железа (II). Очень плохо растворяется в воде.
FeF3
Фторид железа (III). Очень плохо растворяется в воде, примерно 0,091 гр на 100 мл при температуре 25oC.
CoF2
Фторид кобальта. Плохо растворяется в воде, примерно 1,5 гр на 100 мл при температуре 25oC.
NiF2
Фторид никеля. Растворяется в воде, примерно 2,6 гр на 100 мл при температуре 25oC.
PbF2
Фторид свинца. Плохо растворяется в воде, примерно 0,068 гр на 100 мл при температуре 25oC.
CuF2
Фторид меди. Растворяется в воде, примерно 4,75 гр на 100 мл при температуре 25oC.
При повышении температуры разлагается парами воды.
HgF2
Фторид ртути.
Не существует в водной среде.
AgF
Фторид серебра. Хорошо растворяется в воде, примерно 180 гр на 100 мл при температуре 25oC.
HNO2
Азо́тистая кислота. Слабая одноосновная кислота.
CsNO2
Нитрит цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
RbNO2
Нитрит рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
KNO2
Нитрит калия. Хорошо растворяется в воде, примерно 312 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
NaNO2
Нитрит натрия. Растворяется в воде, примерно 84 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
LiNO2
Нитрит лития. Хорошо растворяется в воде, примерно 105 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Ba(NO2)2
Нитрит бария. Растворяется в воде, примерно 74 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Sr(NO2)2
Нитрит стронция. Растворяется в воде, примерно 77 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Ca(NO2)2
Нитрит кальция. Растворяется в воде, примерно 77 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
NH4NO2
Нитрит аммония. Растворяется в воде, примерно 200 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Mg(NO2)2
Нитрит магния. Растворяется в воде.
В результате гидролиза, образуется слабощелочная среда.
Al(NO2)3
Нитрит алюминия. Растворяется в воде, примерно 63,7 гр на 100 мл при температуре 25oC.
Mn(NO2)2
Нитрит марганца. Растворяется в воде.
Раствор имеет нейтральную среду.
Zn(NO2)2
Нитрит цинка. Растворяется в воде.
Раствор имеет нейтральную среду.
Cr(NO2)3
Нитрит хрома.
Не существует в воде.
Fe(NO2)2
Нитрит железа (II).
Растворяется в воде.
Fe(NO2)3
Нитрит железа (III).
Не существует в воде.
Co(NO2)2
Нитрит кобальта.
Растворяется в воде.
Ni(NO2)2
Нитрит никеля.
Растворяется в воде.
Pb(NO2)2
Нитрит свинца.
Растворяется в воде.
Cu(NO2)2
Нитрит меди.
Растворяется в воде.
Hg(NO2)2
Нитрит ртути.
Плохо растворяется в воде.
AgNO2
Нитрит серебра.
Плохо растворяется в воде.
H2CO3
Угольная кислота.
Cлабая двухосновная кислота.
Cs2CO3
Карбонат цезия. Растворяется в воде, примерно 75,5 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
Rb2CO3
Карбонат рубидия. Хорошо растворяется в воде, примерно 223 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
K2CO3
Карбонат калия. Хорошо растворяется в воде, примерно 112 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
Na2CO3
Карбонат натрия. Растворяется в воде, примерно 29,4 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Li2CO3
Карбонат лития. Растворяется в воде, примерно 1,27 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
BaCO3
Карбонат бария.
Не растворяется в воде
SrCO3
Карбонат стронция.
Не растворяется в воде
CaCO3
Карбонат кальция.
Не растворяется в воде
(NH4)2CO3
Карбонат аммония. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 15oC.
MgCO3
Карбонат магния. Плохо растворяется в воде.
Al2(CO3)3
Карбонат алюминия.
Не существует в воде.
MnCO3
Карбонат марганца.
Не растворяется в воде.
ZnCO3
Карбонат цинка.
Не растворяется в воде.
Cr2(CO3)3
Карбонат хрома.
Не существует в воде.
FeCO3
Карбонат железа (II).
Не растворяется в воде.
Fe2(CO3)3
Карбонат железа (III).
Не существует в воде.
CoCO3
Карбонат кобальта.
Не растворяется в воде.
NiCO3
Карбонат никеля.
Не растворяется в воде.
PbCO3
Карбонат свинца.
Не растворяется в воде.
CuCO3
Карбонат меди.
Не растворяется в воде.
HgCO3
Карбонат ртути.
Не растворяется в воде.
Ag2CO3
Карбонат серебра.
Не растворяется в воде.
H2S
Сероводородная кислота.
Cлабая, двухосновная кислота.
Cs2S
Сульфид цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Rb2S
Сульфид рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
K2S
Сульфид калия. Реагирует с водой.
В результате гидролиза, образуется щелочная среда.
Na2S
Сульфид натрия. Растворяется в воде, примерно 20 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
Li2S
Сульфид лития. Хорошо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
BaS
Сульфид бария. Растворяется в воде, примерно 9 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
SrS
Сульфид стронция. Плохо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
CaS
Сульфид кальция. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
(NH4)2S
Сульфид аммония. Хорошо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
MgS
Сульфид магния. Плохо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Al2S3
Сульфид алюминия.
Не существует в воде.
MnS
Сульфид марганца. Не растворяется в воде.
ZnS
Сульфид цинка. Не растворяется в воде.
Cr2S3
Сульфид хрома.
Не существует в воде.
FeS
Сульфид железа (II). Не растворяется в воде.
Fe2S3
Сульфид железа (III). Диспропорционирует при растворении в воде.
CoS
Сульфид кобальта. Не растворяется в воде.
NiS
Сульфид никеля. Не растворяется в воде.
PbS
Сульфид свинца. Не растворяется в воде.
CuS
Сульфид меди. Не растворяется в воде.
HgS
Сульфид ртути.
Не существует в воде.
Ag2S
Сульфид серебра. Не растворяется в воде.
H2SiO3
Метакремниевая кислота.
Очень слабая кислота.
Cs2SiO3
Силикат цезия.
Не растворяется в воде.
Rb2SiO3
Силикат рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
K2SiO3
Силикат калия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Na2SiO3
Силикат натрия. Растворяется в воде, примерно 22 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
Li2SiO3
Силикат лития.
Не растворяется в воде.
BaSiO3
Силикат бария.
Не растворяется в воде.
SrSiO3
Силикат стронция.
Не растворяется в воде.
CaSiO3
Силикат кальция.
Не растворяется в воде.
(NH4)2SiO3
Силикат аммония.
Не существует в воде.
MgSiO3
Силикат магния.
Не растворяется в воде.
Al2(SiO3)3
Силикат алюминия.
Не существует в воде.
MnSiO3
Силикат марганца.
Не растворяется в воде.
ZnSiO3
Силикат цинка.
Не растворяется в воде.
Cr2(SiO3)3
Силикат хрома.
Не существует в воде.
FeSiO3
Силикат железа (II).
Не существует в воде.
Fe2(SiO3)3
Силикат железа (III).
Не существует в воде.
CoSiO3
Силикат кобальта.
Не существует в воде.
NiSiO3
Силикат никеля.
Не существует в воде.
PbSiO3
Силикат свинца.
Не растворяется в воде.
CuSiO3
Силикат меди.
Не существует в воде.
HgSiO3
Силикат ртути.
Не существует в воде.
Ag2SiO3
Силикат серебра.
Не существует в воде.