Химия: Химические связи — различия между версиями
Admine2 (обсуждение | вклад) (→Кристаллические решетки) |
Admine2 (обсуждение | вклад) (→Кристаллические решетки) |
||
| Строка 203: | Строка 203: | ||
{{center|[[file:Типы кристаллических решеток.png|550px|Типы кристаллических решеток]]}} | {{center|[[file:Типы кристаллических решеток.png|550px|Типы кристаллических решеток]]}} | ||
| − | |||
| − | |||
<div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
Версия 15:00, 13 декабря 2017
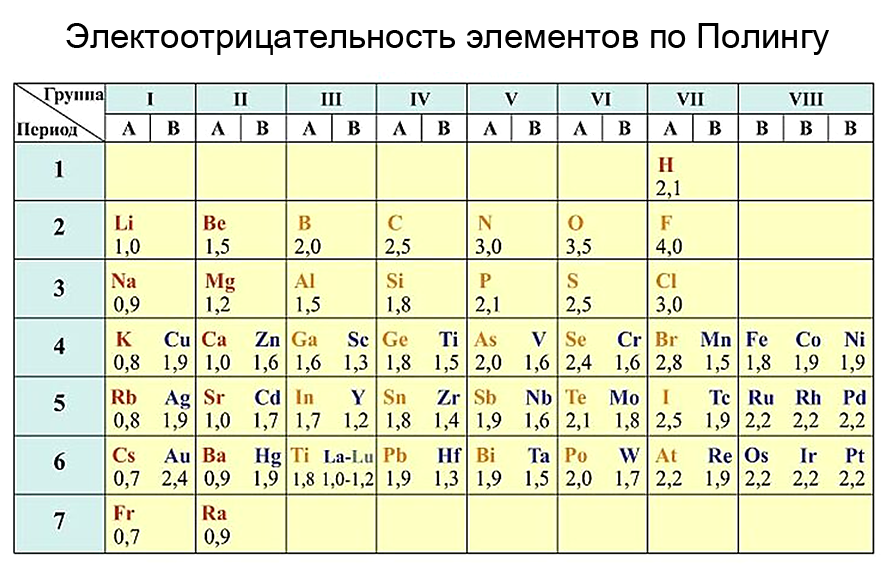
Электроотрицательность химических элементов
Все атомы, имеющие незаполненные электронные оболочки, способны к образованию химической связи. Если в образовании связи участвуют атомы разных химических элементов, то эта электронная пара будет смещена к одному из них. Способность атома к смещению электронной пары в свою сторону при образовании химической связи называется электроотрицательностью.
Электроотрицательность — химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе электроны от атомов других элементов. Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом.
С точки зрения теории строения атомов принадлежность элементов к металлам и неметаллам определяется способностью их атомов отдавать или присоединять электроны при химических реакциях.
Наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко отдают электроны. Значения их электроотрицательностей малы (χ ≤ 1). Неметаллические свойства особенно выражены у тех элементов, атомы которых энергично присоединяют электроны.
В группе с увеличением числа электронных слоев электроотрицательность уменьшается, то есть происходит уменьшение электроотрицательности сверху вниз. Значит самым электроотрицательным элементом является фтор (F), а наименее электроотрицательным – франций (Fr). Чтобы сравнить электроотрицательности элементов, расположенных в разных периодах и группах, можно воспользоваться рассчитанными значениями электроотрицательностей.
Рассчитанные значения образуют шкалу электроотрицательностей. Наиболее распространенной является шкала известного американского химика Л. Полинга
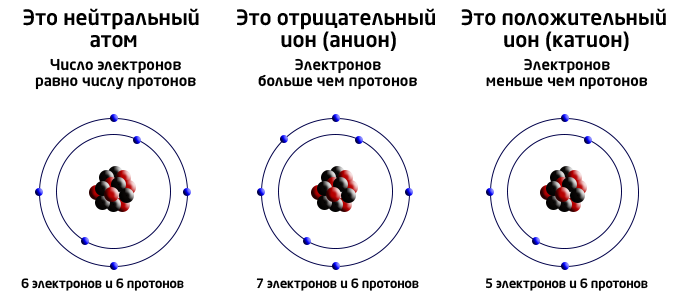
В результате смещения электронной пары на атоме, к которому произошло смещение, возникает частичный отрицательный заряд, а на атоме, связанном с ним – частичный положительный заряд. Если посчитать любое частичное смещение электронов полным, то на атомах будет либо полный положительный, либо полный отрицательный заряд. Результат этого допущения называется степенью окисления.
Сущность химической связи
1. Устойчивым является такое состояние атома, при котором его внешний энергетический уровень завершён до 8 электронов (Н, Не – до 2 электронов).
2. Завершённый внешний уровень имеют атомы VIII A группы.
Главная причина образования химической связи – выделение энергии и повышение устойчивости системы.
4. Чем меньше запас энергии атома, тем более он устойчив в химическом отношении и его состояние наиболее энергетически выгодное.
5. Пути завершения внешнего уровня атомов:
• образование общих электронных пар
• отдача или присоединение электронов
• обобществление электронов.
Виды химической связи
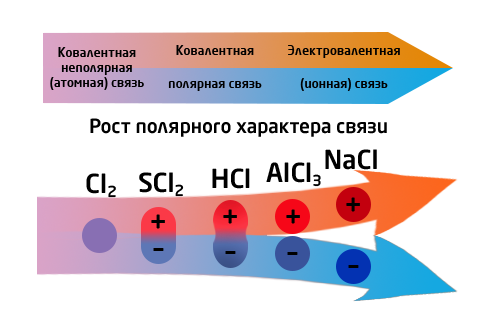
1. Ионная (∆ЭО > 1,7) – связь, осуществляемая за счёт сил электростатического притяжения ионов (Отдача или присоединение ионов). Мещ – О, Г, S; Мещз – О, Г, S.
2. Ковалентная (∆ЭО = 0 – 1,7) - связь осуществляемая путём образования общих электронных пар.
- неполярная(∆ЭО = 0) – связь между одинаковыми атомами неметаллов.
- полярная(0<∆ЭО<1,7) – связь между разными атомами неметаллов, или неметаллом и неактивным металлом (AlCl3).
3. Металлическая – связь за счёт обобществления валентных электронов в кристаллической решётке металла. Это связь в металлах и сплавах (примерно в 3-4 раза слабее одинарной ковалентной)
4. Водородная – связь между атомом водорода и сильноэлекроотрицательным элементом F, O, N, Cl. (примерно 15-20 раз слабее ковалентной)
- внутримолекулярная – белки, полипептиды
- межмолекулярная – вода, спирты, аммиак, аминокислоты и др.
Ковалентная связь
Связь, возникающая при взаимодействии электронов с образованием обобщенных электронных пар, называется ковалентной.
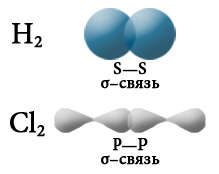
В случае если взаимодействующие атомы имеют равные значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, то есть находится на равном расстоянии от обоих атомов. Такая ковалентная связь называется неполярной. Она имеет место в простых веществах-неметаллах: H2, О2, N2, Cl2, P4, O3.
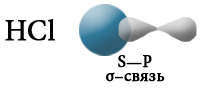
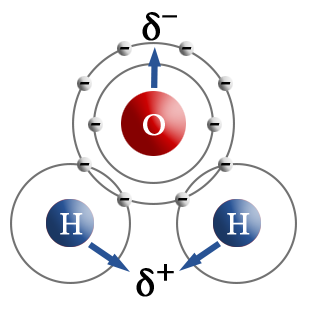
При взаимодействии атомов, имеющих различные значения электроотрицательности, например водорода и хлора, общая электронная пара оказывается смещенной в сторону атома с большей электроотрицательностью, то есть в сторону хлора.
Атом хлора приобретает частичный отрицательный заряд, а атом водорода — частичный положительный. Это пример полярной ковалентной связи.
Молекула, в которой разделены центры положительного и отрицательного зарядов, называется диполем. Полярная связь имеет место между атомами с различной, но не сильно различающейся электроотрицательностью, например между различными неметаллами. Примерами соединений с полярными ковалентными связями являются соединения неметаллов друг с другом, а также различные ионы, содержащие атомы неметаллов (NO3–, CH3COO–). Особенно много ковалентных полярных соединений среди органических веществ.
Характеристики ковалентной связи
Полярность ковалентной химической связи показывает перераспределение электронной плотности вокруг ядер атомов в молекуле в сравнении с распределением электронной плотности в нейтральных атомах, образующих данную связь.
Полярность связи зависит от видов атомов, образующих связь, и от эффективных зарядов на атомах. В органической химии эффективные заряды обозначаются +δ и –δ. Полярность связи имеет определяющее значение для механизма протекания реакции. Неполярная связь образуется между атомами с одинаковой электроотрицательностью. В молекулах с неполярной связью дипольный момент связи равен нулю. Полярная связи тем больше, чем больше разница электроотрицательностей элементов, ее образующих.
По типу перекрывания электронных орбиталей ковалентная химическая связь подразделяется на σ– и π-связи.
Греческие буквы σ и π соответствуют латинским буквам s и р, которые обозначают формы электронных орбиталей атомов, участвующих в образовании σ– и π-связей соответственно. σ-связь образуется в результате образования одной общей электронной пары (общей электронной плотности) за счет перекрывания электронных орбиталей s-s, s-p или р–р-типа.
Такие варианты образования связи характерны для простых неорганических соединений.
Направленность связи обуславливает строение веществ и геометрическое строение их молекул.
Форма молекул определяется типом электронных облаков, участвующих в образовании связи, а также фактом наличия или отсутствия неподеленных электронных пар. Так, например, молекула СО2 является линейной (нет неподеленных электронных пар), а Н2О и SO2 — уголковыми (есть неподеленные пары).
Насыщаемость связи характеризует способность каждого атома образовать ограниченное число связей, которое обусловлено количеством валентных орбиталей.
Свойства ковалентной связи
1. Длина – межъядерное расстояние
2. Энергия – энергия, выделяющаяся при образовании или поглощающаяся при разрыве химической связи.
С увеличением кратности связи энергия увеличивается, длина связи уменьшается и химическая активность падает:
| F – F | O = O | N ≡ N | C ≡ O Одна из трёх связей О по донорно-акцепторному механизму |
| 155 кДж/моль | 498 кДж/моль | 946 кДж/моль | 1065 кДж/моль |
3. Насыщаемость – определяется способностью атомов образовывать ограниченное число связей:
Например, водород всегда одновалентен; азот может быть трехвалентен в молекуле аммиака NH3 и четырёхвалентен в ионе аммония NH4+ (валентные возможности расширяются за счёт участия неподелённой электронной пары атома азота в образовании ковалентной связи по донорно-акцепторному механизму).
4. Направленность – обуславливает форму молекулы в пространстве.
Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов при образовании σ – связей.
Ионная связь
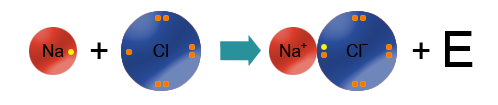
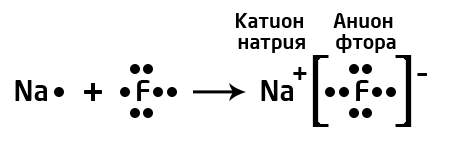
Это крайний случай ковалентной полярной связи: разница электроотрицательностей элементов настолько велика (>2), что один из них полностью "забирает" электрон у второго и превращается в отрицательно заряженный ион (анион), а второй, отдав электроны, превращается в положительно заряженный ион (катион).
Запомни! Как правило, ионная связь образуется между атомами металлов и атомами неметаллов.
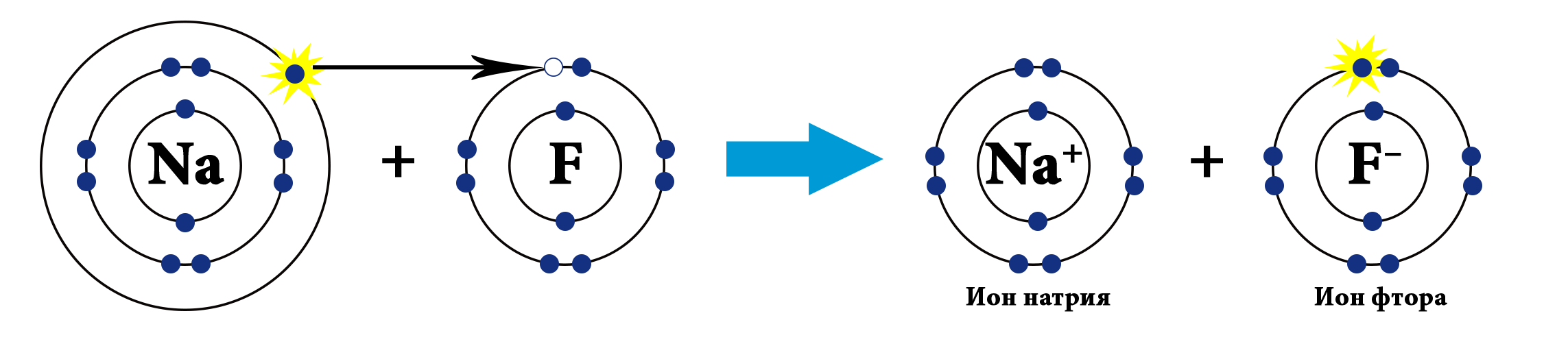
Например, на рисунке сверху изображены атомы натрия и фтора. Натрий - щелочной металл, представитель IA группы, имеет всего 1 валентный электрон и проявляет восстановительные свойства (электроотрицательность по шкале Полинга χ(Na)=0,98). Фтор - представитель галогенов (VIIA группа), имеет 7 валентных электронов, является сильным окислителем (χ(F)=4,0). Фтор, будучи более электроотрицательным, "забирает" у атома натрия валентный электрон и превращается в анион, а атом натрия - в катион.
Ионная связь образуется за счет сил электростатического притяжения между разноименно заряженными частицами: катионами и анионами.
Характеристики ионной связи
В отличие от ковалентной связи, ионная связь является ненасыщенной и ненаправленной. Это легко себе представить: ведь взаимодействие ионов в пространстве не зависит от направления, а каждый анион может притягивать к себе несколько катионов.
Следует подчеркнуть, что полностью ионной связи не существует. Корректнее говорить об "ионности", или ионном характере связи. В случае, если разница ЭО составляет более 2 (например, между щелочными металлами и галогенами), происходит почти полная "передача" электрона к более электроотрицательному элементу с образованием соответствующих ионов.
Механизм образования ионной связи
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Происходит полная отдача (принятие) валентных электронов, перекрывание облаков отсутствует, обобществления электронов не наблюдается.
- Ио́н (др.-греч. ἰόν — идущее) — частица, в которой общее число протонов не эквивалентно общему числу электронов.
- Названия ионов
Рассмотрим механизм образования молекулы фторида натрия: NaF – ис.
| Электронная схема образования молекулы NaF | |
|---|---|
| Na +11)2ē)8ē)1ē |
|
| F +9)2ē)7ē |
|
В результате образования связи электронная пара полностью сместилась к атому фтора, разноименно заряженные ионы натрия и фтора притягиваются за счёт электростатического взаимодействия.
-
Механизм образования хлорида натрия:
-
Сравнительная характеристика ковалентной и ионной химической связи
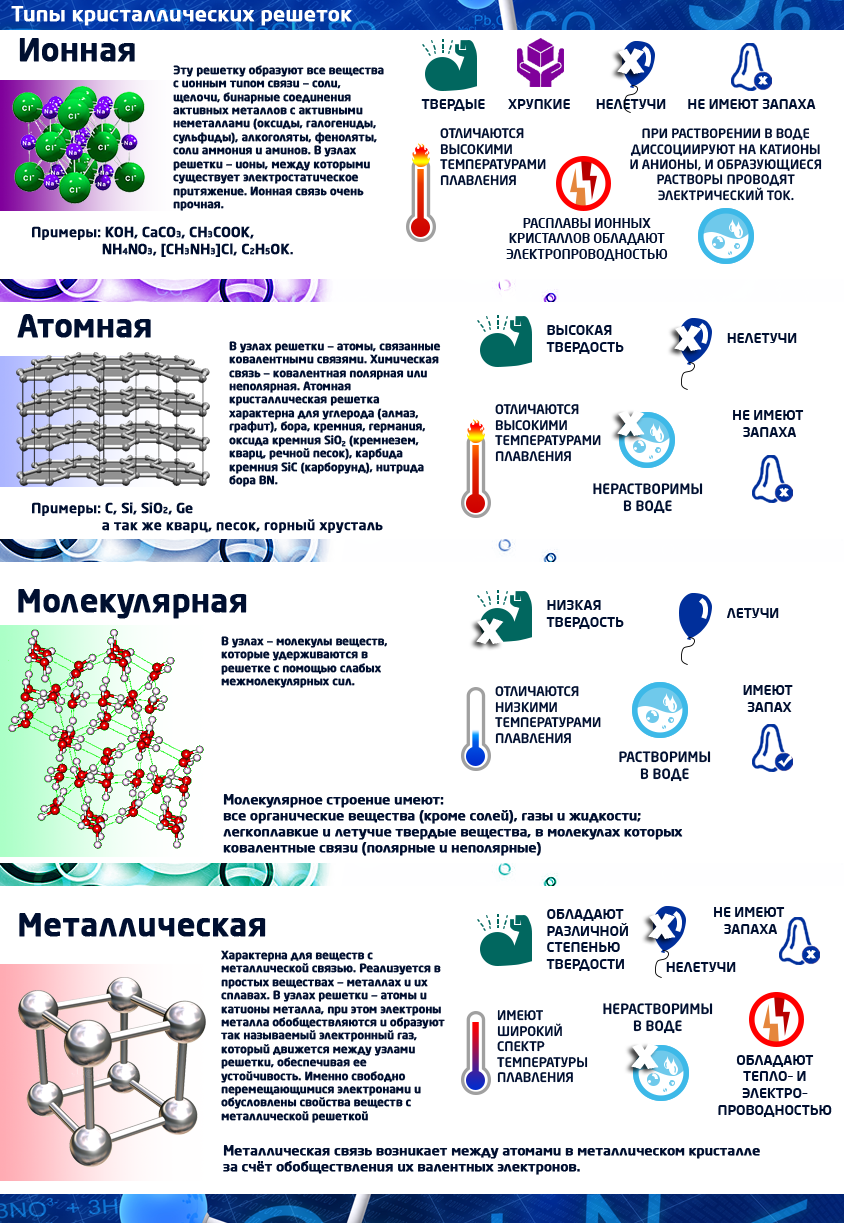
Кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение).
Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка. Точки, в которых размещены частицы, называются узлами кристаллической решетки.
В узлах кристаллической решетки могут находиться ионы, атомы или молекулы.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Глассарий
- Степень окисления – это условный заряд который возник бы на атоме в случае, когда все полярные ковалентные связи считались бы ионными.
- Валентность – это способность химического элемента к образованию химической связи. Рассмотрим формулы водородных соединений элементов второго периода: HF, H2O, NH3, CH4.
Полезные ссылки
Бибилиография
нету
- Ахметов Н. С. Актуальные вопроса курса неорганической химии. — М.: Просвещение, 1991. — 224 с — ISBN 5-09-002630-0