Химия: Строение атомов химических элементов — различия между версиями
Admine2 (обсуждение | вклад) (→Изотопы) |
Admine2 (обсуждение | вклад) |
||
| Строка 133: | Строка 133: | ||
Например, алмаз состоит из элемента углерода. Если бы удалось изготовить два совершенно одинаковых брильянта из углерода с массовым числом 12 и углерода с массовым числом 13, то оба кристалла в химическом отношении были бы одним и тем же элементом углеродом (заряд ядра + 6), но их масса была бы немного разной. Правда, стоимость брильянтов из чистого углерода-12 и чистого углерода-13 была бы во много раз выше, чем у обычных. Дело в том, что разделять изотопы чрезвычайно трудно из-за того, что их химические и физические свойства очень близки. | Например, алмаз состоит из элемента углерода. Если бы удалось изготовить два совершенно одинаковых брильянта из углерода с массовым числом 12 и углерода с массовым числом 13, то оба кристалла в химическом отношении были бы одним и тем же элементом углеродом (заряд ядра + 6), но их масса была бы немного разной. Правда, стоимость брильянтов из чистого углерода-12 и чистого углерода-13 была бы во много раз выше, чем у обычных. Дело в том, что разделять изотопы чрезвычайно трудно из-за того, что их химические и физические свойства очень близки. | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | == Радиоактивность == | ||
| + | 1896 г. Французский физик А. Беккерель, изучая явление люминесценции солей урана, установил, что урановая соль испускает лучи неизвестного типа, которые проходят через бумагу, дерево, тонкие металлические пластины, ионизируют воздух. | ||
| + | |||
| + | |||
| + | 1897-98 г. Мария Склодовская-Кюри и Пьер Кюри, исследуя урановые руды, обнаружила новые химические элементы: полоний, радий. Явление самопроизвольного превращения неустойчивых изотопов в устойчивые, сопровождающееся испусканием частиц и излучением энергии, называется естественной радиоактивностью. Все химические элементы, начиная с порядкового номера 83, являются радиоактивными. | ||
| + | |||
| + | |||
| + | === Виды радиоактивных излучений === | ||
| + | 1898 г. подвергая радиоактивное излучение действию магнитного поля, Э. Резерфорд выделил два вида лучей: α-лучи — тяжелые положительно заряженные частицы (ядра атомов гелия) и β-лучи — легкие отрицательно заряженные частицы (тождественны электронам). | ||
| + | |||
| + | В 1900 г. П. Виллард открыл гамма-лучи — нейтральное излучение, где масса покоя равна нулю (аналогично свойствам света, но ). После установления Резерфордом структуры атома стало ясно, что радиоактивность представляет собой ядерный процесс.1902 г. Э. Резерфорд и Ф. Содди доказали, что в результате радиоактивного распада происходит превращение атомов одного химического элемента в атомы другого химического элемента, сопровождаемое испусканием различных частиц и сформулировали правила смещения. | ||
| + | |||
| + | === Строение атома === | ||
| + | |||
| + | Гипотеза о том, что все вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий тому назад. Сторонники атомистической теории (Демокрит, Левкипп, Анаксагор, Анаксимандр, Эпикур, Лукреций Кар) рассматривали атом как мельчайшую неделимую частицу и считали, что все многообразие мира есть не что иное, как сочетание неизменных частиц — атомов. Демокрит: существует предел деления атома. Аристотель: делимость вещества бесконечна. Париж, 1626 г.: учение об атоме запрещено под страхом смерти. Сторонниками атомистической теории были М.В. Ломоносов, Ж. Гей-Люссак, Д. Дальтон и др. | ||
| + | |||
| + | Толчком к подробному изучению строения атома послужили: | ||
| + | - открытие рентгеновского излучения (1895 г., В.К. Рентген); | ||
| + | |||
| + | - открытие радиоактивности и новых радиоактивных элементов (1896 г., А. Беккерель, М. и П. Кюри); | ||
| + | |||
| + | - открытие электрона (1896 г., Дж. Дж. Томсон). | ||
| + | |||
| + | Мысль об электронном строении атома, впервые высказанную В. Вебером в 1896 г., развил X. Лоренц: электроны входят в состав атома. Опираясь на эти открытия, Дж. Томсон в 1898 г. предложил модель атома в виде положительно заряженного шара радиусом 10-10 м. в котором плавают электроны, нейтрализующие положительный заряд. | ||
| + | |||
| + | === Ядерная модель атома === | ||
| + | |||
| + | Экспериментальная проверка модели Томсона была осуществлена в 1911 г. английским физиком Э. Резерфордом. | ||
| + | |||
| + | Идея опыта заключалась в изучении рассеяния α-частиц (заряд +2е, масса 6,64.10-27 кг) на атомах. α-частицы были выбраны, т.к. их кинетическая энергия много больше кинетической энергии электронов (β-лучи) и, в отличие от γ-лучей они имеют электрический заряд. | ||
| + | |||
| + | Пучок α-частиц пропускался через тонкую золотую фольгу. Золото было выбрано как очень пластичный материал, из которого можно получить фольгу толщиной практически в один атомный слой. Опыты были повторены и на других материалах | ||
| + | |||
| + | Э. Резерфорд и его помощники Г. Гейгер и Э. Марсден обнаружили, что какая-то частьa-частиц отклоняется на довольно значительный угол от своего первоначального направления, а небольшая часть отражается от фольги. Но согласно модели атома Томсона эти a-частицы при взаимодействии с атомами фольги отклоняются на малые углы, порядка 2°. | ||
| + | |||
| + | Резерфорд показал, что модель Томсона находится в противоречии с его опытами. Обобщая результаты своих опытов, Резерфорд предложил ядерную (планетарную) модель строения атома: | ||
| + | |||
| + | Атом имеет ядро, размеры которого малы по сравнению с размерами самого атома (~ 10-15 м). | ||
| + | |||
| + | В ядре сконцентрирована почти вся масса атома. | ||
| + | |||
| + | Отрицательный заряд всех электронов распределен по всему объему атома и компенсирует положительный заряд ядра. | ||
| + | |||
| + | |||
| + | |||
| + | Расчеты показали, что a-частицы, которые взаимодействуют с электронами в веществе, почти не отклоняются. | ||
| + | |||
| + | Только некоторые a-частицы проходят вблизи ядра и испытывают резкие отклонения. Если между зарядами действует кулоновская сила или потенциальная энергия системыa-частица - ядро и , то α-частица будет отброшена назад. | ||
| + | |||
| + | При расчете учитывают, что , где e - заряд электрона; , где Z - зарядовое число, равное количеству электронов в атоме; диаметр ядра 10-15 - 10-14 м, атома 10-10 м. | ||
| + | |||
| + | |||
| + | Однако предложенная модель строения атома не позволила объяснить устойчивость атома: | ||
| + | |||
| + | - ускоренное движение электрона согласно теории Максвелла сопровождается электромагнитным излучением, поэтому энергия электрона уменьшается, и он движется по спирали, приближаясь к ядру. Казалось бы, электрон должен упасть на ядро (расчет показывает, что это должно произойти за 10-8 с), так как при движении по спирали уменьшается энергия электрона, в действительности атомы являются устойчивыми системами; | ||
| + | |||
| + | - спектр излучения при этом должен быть непрерывным (должны присутствовать все длины волн). На опыте спектр получается линейчатым; | ||
| + | |||
| + | - нет ответа на вопрос о строении ядра. Если в него входят только положительные частицы, то почему они не отталкиваются? | ||
<div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | |||
| + | |||
== Глоссарий== | == Глоссарий== | ||
Версия 09:07, 28 ноября 2017
Состав атомного ядра
Атом — наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. В 1911 г англ. учёный Э. Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами.
Общий заряд свободного атома равен нулю, так как заряды ядра и электронной оболочки уравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен −1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц – нейтронов, не имеющих заряда. Обобщенные характеристики элементарных частиц в составе атома можно представить в виде таблицы:
| Название частицы | Обозначение | Заряд | Масса |
|---|---|---|---|
| протон | p | +1 | 1 |
| нейтрон | n | 0 | 1 |
| электрон | e− | −1 | принимается равной 0 |
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 − 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями – ква́нтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем — высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле: N = 2n2, где N — максимальное число электронов на уровне, n — номер уровня.
Тогда для первого уровня N = 2 x 12 = 2,
для второго N = 2 x 22 = 8 и т. д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень важно понимать, что уровни читаются снизу вверх, что соответствует их энергии. Поэтому столбик цифр в клеточке с натрием:
1
8
2
cледует читать так:
на 1-м уровне — 2 электрона,
на 2-м уровне — 8 электронов,
на 3-м уровне — 1 электрон
Распределение электронов по уровням можно представить в виде схемы: ![]()
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
- максимальным количеством электронов: на 1-м уровне не больше 2 e−,
- на 2-м — 8 e−,
- на внешнем уровне — 8 e−;
число электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
Тогда для натрия ход рассуждений будет следующий:
- Общее число электронов равно 11, следовательно, первый уровень заполнен и содержит 2 e−;
- Третий, наружный уровень содержит 1 e− (I группа)
- Второй уровень содержит остальные электроны: 11 − (2 + 1) = 8 (заполнен полностью)
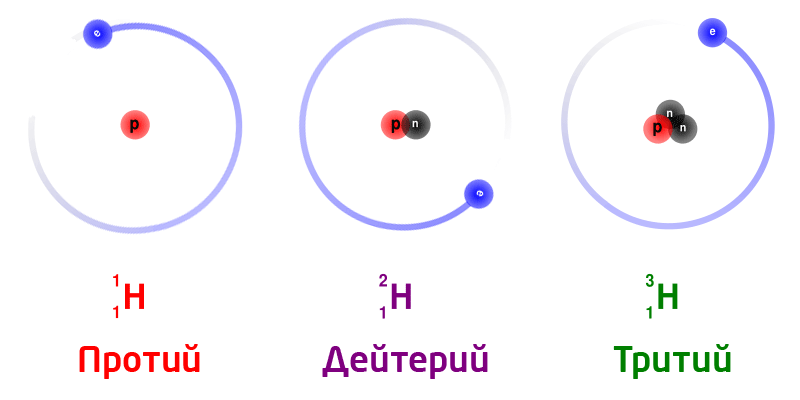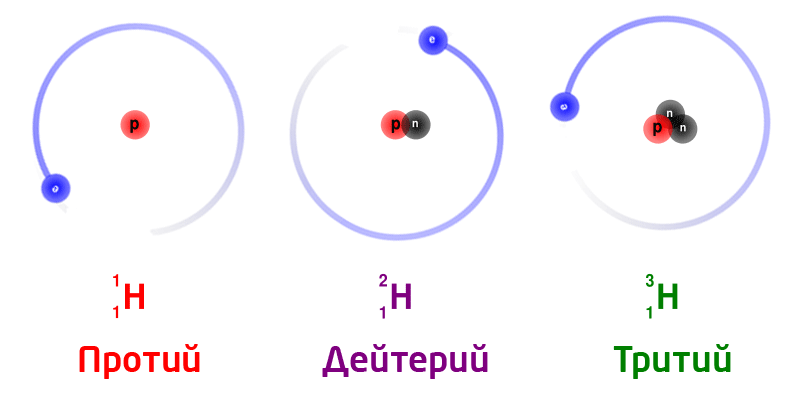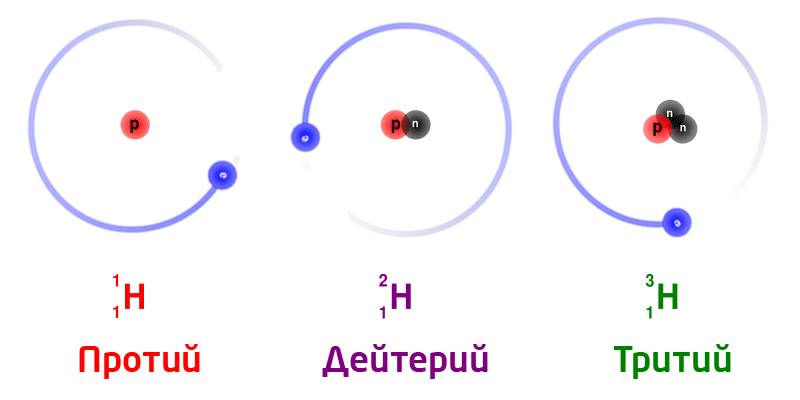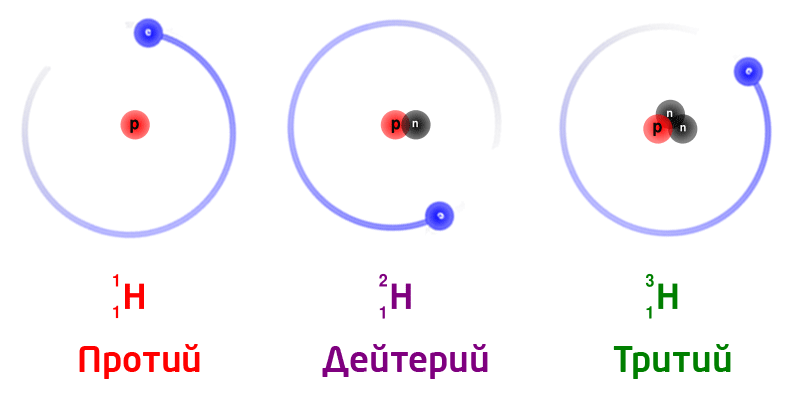
Изотопы
Изотопы – разновидность атомов одного и того же химического элемента, отличающиеся друг от друга только своей массой.
Обозначение изотопов: слева от символа элемента указывают массовое число (вверху) и порядковый номер элемента (внизу)
Изотопы природного водорода:
Изотопы одного и того же химического элемента имеют разную массу, так как в ядрах содержится разное количество нейтронов.
Химический элемент – это вид атомов с одинаковым зарядом ядра.
В природе химические элементы существуют в виде смесей изотопов. Изотопный состав одного и того же химического элемента выражают в атомных долях (ωат.), которые указывают какую часть составляет число атомов данного изотопа от общего числа атомов всех изотопов данного элемента, принятого за единицу или 100%.
Например:
ωат (35Сl) = 0,754 или 75,4%
ωат (37Сl) = 0,246 или 24,6%
В таблице Менделеева приведены средние значения относительных атомных масс химических элементов с учётом их изотопного состава. Поэтому Ar , указанные в таблице являются дробными.
Ar средняя= ωат.(1) x Ar(1) + … + ωат.(n) x Ar(n)
Например:
Ar средняя(Cl) = 0,754 x 35 + 0,246 x 37 = 35,453
Почему у изотопов разная масса?
• Изотопы имеют разную массу из-за различного числа нейтронов в их ядрах.
• В природе химические элементы существуют в виде смесей изотопов.
• В таблице Менделеева приведены средние значения относительных атомных масс химических элементов с учётом их изотопного состава. Поэтому Ar , указанные в таблице являются дробными.Природа устроена так, что один и тот же элемент может существовать в виде двух или нескольких изотопов. Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Изотопами называются вещества, состоящие из атомов с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре. Изотопы отличаются друг от друга только массовым числом. Все элементы состоят из одного или нескольких изотопов.
Например, алмаз состоит из элемента углерода. Если бы удалось изготовить два совершенно одинаковых брильянта из углерода с массовым числом 12 и углерода с массовым числом 13, то оба кристалла в химическом отношении были бы одним и тем же элементом углеродом (заряд ядра + 6), но их масса была бы немного разной. Правда, стоимость брильянтов из чистого углерода-12 и чистого углерода-13 была бы во много раз выше, чем у обычных. Дело в том, что разделять изотопы чрезвычайно трудно из-за того, что их химические и физические свойства очень близки.
Радиоактивность
1896 г. Французский физик А. Беккерель, изучая явление люминесценции солей урана, установил, что урановая соль испускает лучи неизвестного типа, которые проходят через бумагу, дерево, тонкие металлические пластины, ионизируют воздух.
1897-98 г. Мария Склодовская-Кюри и Пьер Кюри, исследуя урановые руды, обнаружила новые химические элементы: полоний, радий. Явление самопроизвольного превращения неустойчивых изотопов в устойчивые, сопровождающееся испусканием частиц и излучением энергии, называется естественной радиоактивностью. Все химические элементы, начиная с порядкового номера 83, являются радиоактивными.
Виды радиоактивных излучений
1898 г. подвергая радиоактивное излучение действию магнитного поля, Э. Резерфорд выделил два вида лучей: α-лучи — тяжелые положительно заряженные частицы (ядра атомов гелия) и β-лучи — легкие отрицательно заряженные частицы (тождественны электронам).
В 1900 г. П. Виллард открыл гамма-лучи — нейтральное излучение, где масса покоя равна нулю (аналогично свойствам света, но ). После установления Резерфордом структуры атома стало ясно, что радиоактивность представляет собой ядерный процесс.1902 г. Э. Резерфорд и Ф. Содди доказали, что в результате радиоактивного распада происходит превращение атомов одного химического элемента в атомы другого химического элемента, сопровождаемое испусканием различных частиц и сформулировали правила смещения.
Строение атома
Гипотеза о том, что все вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий тому назад. Сторонники атомистической теории (Демокрит, Левкипп, Анаксагор, Анаксимандр, Эпикур, Лукреций Кар) рассматривали атом как мельчайшую неделимую частицу и считали, что все многообразие мира есть не что иное, как сочетание неизменных частиц — атомов. Демокрит: существует предел деления атома. Аристотель: делимость вещества бесконечна. Париж, 1626 г.: учение об атоме запрещено под страхом смерти. Сторонниками атомистической теории были М.В. Ломоносов, Ж. Гей-Люссак, Д. Дальтон и др.
Толчком к подробному изучению строения атома послужили:
- открытие рентгеновского излучения (1895 г., В.К. Рентген);
- открытие радиоактивности и новых радиоактивных элементов (1896 г., А. Беккерель, М. и П. Кюри);
- открытие электрона (1896 г., Дж. Дж. Томсон).
Мысль об электронном строении атома, впервые высказанную В. Вебером в 1896 г., развил X. Лоренц: электроны входят в состав атома. Опираясь на эти открытия, Дж. Томсон в 1898 г. предложил модель атома в виде положительно заряженного шара радиусом 10-10 м. в котором плавают электроны, нейтрализующие положительный заряд.
Ядерная модель атома
Экспериментальная проверка модели Томсона была осуществлена в 1911 г. английским физиком Э. Резерфордом.
Идея опыта заключалась в изучении рассеяния α-частиц (заряд +2е, масса 6,64.10-27 кг) на атомах. α-частицы были выбраны, т.к. их кинетическая энергия много больше кинетической энергии электронов (β-лучи) и, в отличие от γ-лучей они имеют электрический заряд.
Пучок α-частиц пропускался через тонкую золотую фольгу. Золото было выбрано как очень пластичный материал, из которого можно получить фольгу толщиной практически в один атомный слой. Опыты были повторены и на других материалах
Э. Резерфорд и его помощники Г. Гейгер и Э. Марсден обнаружили, что какая-то частьa-частиц отклоняется на довольно значительный угол от своего первоначального направления, а небольшая часть отражается от фольги. Но согласно модели атома Томсона эти a-частицы при взаимодействии с атомами фольги отклоняются на малые углы, порядка 2°.
Резерфорд показал, что модель Томсона находится в противоречии с его опытами. Обобщая результаты своих опытов, Резерфорд предложил ядерную (планетарную) модель строения атома:
Атом имеет ядро, размеры которого малы по сравнению с размерами самого атома (~ 10-15 м).
В ядре сконцентрирована почти вся масса атома.
Отрицательный заряд всех электронов распределен по всему объему атома и компенсирует положительный заряд ядра.
Расчеты показали, что a-частицы, которые взаимодействуют с электронами в веществе, почти не отклоняются.
Только некоторые a-частицы проходят вблизи ядра и испытывают резкие отклонения. Если между зарядами действует кулоновская сила или потенциальная энергия системыa-частица - ядро и , то α-частица будет отброшена назад.
При расчете учитывают, что , где e - заряд электрона; , где Z - зарядовое число, равное количеству электронов в атоме; диаметр ядра 10-15 - 10-14 м, атома 10-10 м.
Однако предложенная модель строения атома не позволила объяснить устойчивость атома:
- ускоренное движение электрона согласно теории Максвелла сопровождается электромагнитным излучением, поэтому энергия электрона уменьшается, и он движется по спирали, приближаясь к ядру. Казалось бы, электрон должен упасть на ядро (расчет показывает, что это должно произойти за 10-8 с), так как при движении по спирали уменьшается энергия электрона, в действительности атомы являются устойчивыми системами;
- спектр излучения при этом должен быть непрерывным (должны присутствовать все длины волн). На опыте спектр получается линейчатым;
- нет ответа на вопрос о строении ядра. Если в него входят только положительные частицы, то почему они не отталкиваются?
Глоссарий
- Атомный номер — то же, что порядковый номер элемента в периодической системе Д.И.Менделеева. атомный номер численно равен положительному заряду ядра этого элемента, т.е. числу протонов в ядре данного элемента.
- Периодический закон Д.И. Менделеева – свойства простых веществ, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра элементов.
- Периодическая система химических элементов Д.И. Менделеева – упорядоченное множество химических элементов, их естественная классификация, которая является графическим выражением периодического закона химических элементов.
- Химический элемент – это определенный вид атомов, характеризующийся определенной совокупностью свойств (зарядом ядра, массой и др.).
- Щелочноземельные элементы (щелочноземельные металлы) – химические элементы кальций, стронций, барий и радий.
- Щелочные элементы (щелочные металлы) – элементы гл подгруппы первой группы (IА-группы) литий, натрий, калий, рубидий, цезий, франций.
- Электроотрицательность – способность элемента оттягивать на себя электронную пару.
- Элемент - вещество, состоящее из атомов одного вида (из атомов с одинаковым зарядом ядра). Часто элемент содержит в своем составе несколько ИЗОТОПОВ.
Полезные ссылки
Бибилиография:
- Ахметов Н. С. Актуальные вопроса курса неорганической химии. — М.: Просвещение, 1991. — 224 с — ISBN 5-09-002630-0
- Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — 271 с.
- Менделеев Д. И. Основы химии, т. 2. М.: Госхимиздат, 1947. 389 c.
- Менделеев Д.И. Периодическая законность химических элементов // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.).
- Г.В. Пчелкина.Химуля. Уроки.
Элемент № 96 - кюрий назван в честь супругов Кюри.
Элемент № 99 - эйнштейний назван в честь выдающегося физика Альберта Эйнштейна.
Элемент № 100 - фермий назван по имени изобретателя первого атомного реактора Энрико Ферми.
Элемент № 101 названы менделеевием в честь гениального автора периодического закона элементов Дмитрия Ивановича Менделеева.
Элемент № 102 - нобелий назван группой ученых института Нобеля в Стокгольме в честь Альфреда Нобеля. Но проверка в 1957 г. не подтвердила открытие этого элемента. Только в 1958 г. в Дубне в лаборатории Объединенного института ядерных исследований под руководством Г. М. Флерова был осуществлен ядерный синтез элемента № 102.
Элемент № 103 - лоуренсий назван в честь изобретателя циклотрона, основателя и директора радиационной лаборатории в Беркли Лоуренса.
Элемент № 104 - курчатовий, который был синтезирован в Дубне, назван в честь выдающегося советского физика, основателя института атомной энергии в СССР И. В. Курчатова.
Создание периодической системы позволило Д. И. Менделееву предсказать существование двенадцати неизвестных в то время элементов: скандия (экабору), галлия (экаалюминием), германия (экасилицию), технеция (экамарганца), гафния (аналога циркония), полония (экателлуру), астата (экайоду), франция (экацезию), радия (экабарию), актиния (экалантану) протактиния (экатанталу). Д. И. Менделеев вычислил атомные веса этих элементов и описал свойства скандия, галлия и германия.
Названия государств и материков имеют элементы: рутений (Россия латыни - Рутения), полоний (Польша), галлий (Талия - старинное название Франции), скандий (Скандинавия), америций (Америка), европий (Европа).
Названия рек отражено в названиях таких элементов: рений, платина. Медь - купрум - названа по названию острова Кипра.
Названия городов имеют следующие элементы: лютеций (старинное название Парижа), гафний (старинное название Копенгагена). Элементы иттрий, эрбий, иттербий, тербий назван по имени города иттербий в Швеции, где был найден минерал, содержащий эти элементы. Берклий происходит от названия города Беркли, в котором он был открыт. Калифорний - от названия штата, где находится университет, в котором этот элемент был искусственно получен.
Некоторые элементы имеют названия, связанные с их свойствами. Например, Йод - получил название от греческого слова, означающего фиолетовый; Бром - от греческого слова, означающего вонь; Фтор - от греческого слова, означающего разрушительный; Хлор - от греческого слова, означающего зеленый; Иридий - от греческого слова, означающего радуга; Родий - от греческого слова, означающего роза (растворы некоторых соединений родия имеют розовый цвет); Осмий - от греческого слова, означающего запах; Хром - от греческого слова, означающего краска (его соли имеют разнообразную окраску); Фосфор - гречески означает носитель света; Водород - от латинского слова гидрогениум - то, что рождает воду; Кислород - от латинского слова оксигениум - то, что рождает кислоту; Ртуть - от латинского слова гидраргирум - серебряная вода.
Торий назван Берцелиусом в честь скандинавского бога войны и грома Тора.
Ванадий назван в честь скандинавской богини красоты Ванадис.
Титан был назван в честь сказочной царицы эльфов Титания с древненемецкого эпоса. Через некоторое время после открытия титана этим именем астрономы назвали третий спутник планеты Уран.
Элемент прометий назван в честь мифического героя Прометея, который, якобы, украл с неба огонь и передал его людям.
Лантан гречески означает «прятаться». Это название дал лантану шведский химик Мозандер, открывший его в 1839 г. Только через столетия разделили лантаноиды и выделили лантан.
Элемент ниобий назван в честь Ниобеи - дочери Тантала. Это название обусловлено сходством ниобия с танталом.
Название теллура происходит от латинского слова - земля; селена - от греческого названия месяца; уран, нептуний, плутоний - получили названия также по названиям соответствующих планет. Церий назван в честь малой планеты Цереры.
Название гелия происходит от греческого слова Гелиос - солнце.
Названия некоторых элементов связаны с названиями минералов. Например, название элемента циркония происходит от названия минерала циркона, бария - от минерала барита, стронция - от стронцианита, бериллия - от берилла, вольфрама - от вольфрамита. Бор происходит от старого названия буры - борак, кальций - от греческого слова калькс, т.е. мягкий камень, литий - от греческого слова литеос - камень.
• Дмитрий был самым младшим ребенком в семье Менделеевых, аж семнадцатым. Правда семнадцати детей одновременно в доме никогда не было, так как 8 детей умерло еще во младенчестве, а сестра маша умерла в возрасте 14 лет от чахотки.
• Также широко бытует мнение, что Менделеев увидел свою будущую таблицу во сне, а когда проснулся, то нарисовал ее. Даже сам ученый отшучивался — «Я может над ней лет двадцать думал, а вы думаете, что так вот сел и придумал».
• Посмеивались и над образом жизни ученого, а особенно над тем, что Менделеев оборудовал свою лабораторию в дупле огромного дуба.
• Большинство людей знает Менделеева как химика, но на самом деле химии посвящено не более 10% всех его работ.
• Кроме различных наук, Дмитрий Иванович увлекался тем, что делал чемоданы. В двух столицах он даже был известен как лучший чемоданный мастер. Чемоданы у него были действительно хорошие и качественные. В этом ему помог который он сам придумал ., исследовав перед этим свойства других клеев. Клей был просто потрясающий, но рецепт его приготовления умер вместе с великим ученым.
• В 1955 году был получен искусственный химический элемент, которому был присвоен №101. Этот элемент назвали в честь великого ученого — Менделевий.
• 892 году Менделеев создал рецепт бездымного пороха, но тогда его не успели запатентовать и этим рецептом начали активно пользоваться американцы. В 1914 году Россия даже закупала бездымный порох, придуманный нашим ученым, у США.
• Историки говорят, что Дмитрий Иванович принимал экзамен по химии у Петра Столыпина, и даже поставил ему пятерку.
• Дмитрий Иванович несколько раз номинировался на нобелевскую премию, но так ни разу не стал ее лауреатом. Один раз в 1906 году он был объявлен победителем, но Шведская королевская академия наук пересмотрела и отменила данное решение, тем самым удостоив премии француза Анри Муассана.
• Великий русский ученый кроме всего прочего является организатором и первым директором палаты мер и весов.
• В начале 1907 года Дмитрий Иванович сильно простудился и сначала ему поставили диагноз плеврит, но потом оказалось, что это воспаление легких. Через непродолжительное время он умер.
Дочитаем всю страницу…
Имена координат
Даст отгадка двух шарад.
I.
Три буквы плода треугольного,
Две буквы от стола, от школьного,
"П" между этими фрагментами…
Все вместе - столбик с элементами!
Группа
II.
Птичий мех, но не пух, и без букв последних двух,
Плюс раствор для смазки ссадин, что сажают дети за день;
Вместе - ряд горизонтальный получаем моментально.
Период
Предупреждаю вас заранее:
Я непригоден для дыхания!
Но все как будто бы не слышат
И постоянно мною дышат.
yt
...
Я светоносный элемент.
Я спичку вам зажгу в момент.
Сожгут меня - и под водой
Оксид мой станет кислотой.
Фосфор?
...
У меня дурная слава:
Я - известная отрава.
Даже имя говорит,
Что я страшно ядовит.
yt