Химия: Удивительный мир органических веществ — различия между версиями
Admine2 (обсуждение | вклад) (→Полезные ссылки) |
Admine2 (обсуждение | вклад) |
||
| (не показана 71 промежуточная версия этого же участника) | |||
| Строка 1: | Строка 1: | ||
{{Якорь|Начало}} | {{Якорь|Начало}} | ||
<div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | ||
| − | |||
| − | + | <div class="blocktext">{{center|<big>Органическая химия – изучает соединения углерода.</big>}}</div> | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | == | + | == Теория химического строения органических соединений (ТХС) == |
| + | <ul class="large-block-grid-2 small-block-grid-1"> | ||
| + | <li> | ||
| + | <p>Главные положения своей теории А. М. Бутлеров изложил в докладе «О химическом строении вещества», прочитанном в химической секции Съезд немецких естествоиспытателей и врачей в Шпейере (сентябрь 1861).</p> | ||
| + | <p>'''1. Атомы в молекулах соединены между собой в определенной последовательности химическими связями, в соответствии с их валентностью. Порядок связи атомов называется их химическим строением. Углерод во всех органических соединениях четырехвалентен.''' </p> | ||
| + | <p>'''2. Свойства веществ определяются не только качественным и количественным составом молекул, но и их строением.'''</p> | ||
| + | <p>'''3. Атомы или группы атомов взаимно влияют друг на друга, от чего зависит реакционная способность молекулы.'''</p> | ||
| + | <p>'''4. Строение молекул может быть установлено на основании изучения их химических свойств.''' </p> | ||
| + | </li> | ||
| + | <li>{{center-p|[[file:Butlerof.png|1861 год А. М. Бутлеров.]]}}</li> | ||
| + | </ul> | ||
| + | Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому её развитию. Опираясь на положение теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них. | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | == | + | == Строение органических веществ == |
| − | + | Многообразие органических веществ на планете и разнообразие их строения можно объяснить характерными особенностями атомов углерода. | |
| − | + | {{center-p|[[Файл:Vidy cepei.png|600px|Виды углеродных цепей]]}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | Вы помните, что атомы углерода способны образовывать очень прочные связи друг с другом, соединяясь в цепочки. В результате получаются устойчивые молекулы. То, как именно атомы углерода соединяются в цепь (располагаются зигзагом), является одной из ключевых особенностей ее строения. Углерод может объединяться как в открытые цепи, так и в замкнутые ''(циклические)'' цепочки. | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | === Изомерия-основная причина разнообразия и многочисленности органических веществ === | ||
| − | == | + | {{center|[[Файл:Izomeria.png|600px|]]}} |
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | + | === Классификация органических соединений === | |
| − | + | <ul class="large-block-grid-2 small-block-grid-1 medium-block-grid-1"> | |
| − | + | <li> | |
| − | + | {{center|Классификацию углеводородов проводят по следующим структурным признакам, определяющим свойства этих соединений:}} | |
| − | <ul class="large-block-grid-2 small-block-grid-1"> | + | {{center|[[Файл:KlOSpoC C.png|400px|Классификация органических соединений по строению углеродной цепи]]}} |
| − | <li>{{center|[[Файл: | ||
</li> | </li> | ||
| − | <li>{{center|[[Файл: | + | <li> |
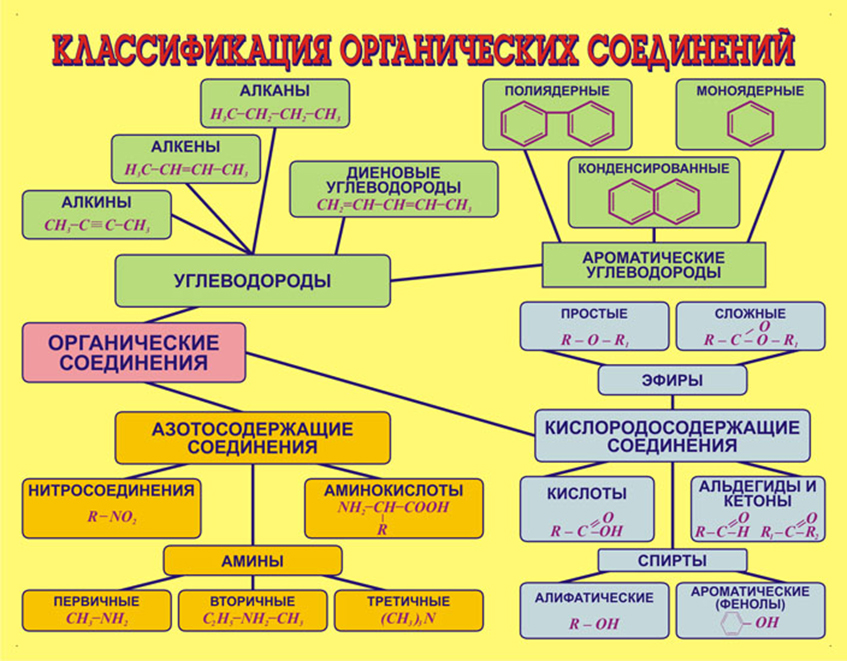
| + | {{center|Другим классификационным признаком является тип функциональной группы, входящей в состав молекулы органического веществ.}} | ||
| + | {{center|[[Файл:Klasificacia org soedinenii.jpg|400px|Классификация органических соединений]]}} | ||
</li> | </li> | ||
</ul> | </ul> | ||
| + | <div class="blocktext">{{center|Между всеми классами органических соединений существует генетическая связь, опираясь на которую можно осуществлять взаимные превращения веществ.}}</div> | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | == | + | === Значение органической химии === |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | == | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | <div class="blocktext">{{center|Органическая химия – это удивительный и бесконечный мир веществ, созданных Природой и Человеком. Чтобы этот мир был дружественным , каждому, кто живет в современном обществе и пользуется благами цивилизации, важно иметь представление о свойствах органических соединений и области их применения.}}</div> | |
| − | + | {{right-p|[[Файл:Znachenie organiki.png|400px|Применение органических веществ]]}} | |
| − | |||
| − | |||
| − | |||
Органическая химия имеет исключительно важное научное и практическое значение. Объектом её исследований является огромное число соединений синтетического и природного происхождения. Поэтому органическая химия стала крупнейшим и важным разделом современной химии. | Органическая химия имеет исключительно важное научное и практическое значение. Объектом её исследований является огромное число соединений синтетического и природного происхождения. Поэтому органическая химия стала крупнейшим и важным разделом современной химии. | ||
| − | '''Природные''' органические вещества и их превращения лежит в основе явлений Жизни. Поэтому органическая химия является химическим фундаментом биологической химии и молекулярной биологии – наук, изучающих процессы происходящие в клетках организмов на молекулярном уровне. | + | '''Природные''' органические вещества и их превращения лежит в основе явлений Жизни. Поэтому органическая химия является химическим фундаментом биологической химии и молекулярной биологии – наук, изучающих процессы происходящие в клетках организмов на молекулярном уровне. Исследования в этой области позволяют глубже понять суть явлений живой природы. |
| − | Множество '''синтетических''' органических соединений производится промышленностью для использования самых разных отраслях человеческой деятельности. | + | Множество '''синтетических''' органических соединений производится промышленностью для использования в самых разных отраслях человеческой деятельности. |
| − | Это – нефтепродукты, горючее для различных двигателей, полимерные материалы (каучуки, пластмассы,волокна, пленки,лаки, клетки и.т.д.) красители, средства защиты растений, лекарственные препараты, вкусовые и парфюмерные вещества и т.п.) Без | + | Это – нефтепродукты, горючее для различных двигателей, полимерные материалы (каучуки, пластмассы,волокна, пленки,лаки, клетки и.т.д.) красители, средства защиты растений, лекарственные препараты, вкусовые и парфюмерные вещества и т.п.) Без знания основ органической химии человек не способен экологически грамотно использовать все эти продукты цивилизации. |
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | + | == Природные источники углеводорода == | |
| − | |||
| − | == | ||
=== Каменный уголь === | === Каменный уголь === | ||
| − | На земном шаре известно больше '''36 тысяч''' угольных бассейнов и месторождений, которые в совокупности занимают '''15%''' территории | + | На земном шаре известно больше '''36 тысяч''' угольных бассейнов и месторождений, которые в совокупности занимают '''15%''' его территории. Угольные бассейны могут тянуться на тысячи километров. Всего общегеологические запасы угля на земном шаре составляют '''5 трлн. 500 млрд. тонн''', в том числе разведанные месторождения –'''1 трлн. 750 млрд. тонн.''' |
| + | |||
'''Различают три главных вида ископаемых углей'''. При горении бурого угля, антрацита – пламя невидимое, сгорание бездымное, а каменный уголь при горении издаёт громкий треск. | '''Различают три главных вида ископаемых углей'''. При горении бурого угля, антрацита – пламя невидимое, сгорание бездымное, а каменный уголь при горении издаёт громкий треск. | ||
''Антрацит'' – самый древний из ископаемых углей. Отличается большой плотностью и блеском. Содержит до 95% углерода. | ''Антрацит'' – самый древний из ископаемых углей. Отличается большой плотностью и блеском. Содержит до 95% углерода. | ||
| − | <ul class="large-block-grid-3 small-block-grid-1"> | + | <ul class="large-block-grid-3 small-block-grid-1 medium-block-grid-1"> |
| − | <li>{{center|[[Файл: | + | <li>{{center-p|[[Файл:Ugol1.jpg|250px|Антрацит]]}} |
| − | |||
</li> | </li> | ||
| − | <li>{{center|[[Файл: | + | <li>{{center-p|[[Файл:Ugol2.jpg|250px|Каменный уголь]]}} |
| − | |||
</li> | </li> | ||
| − | <li>{{center|[[Файл: | + | <li>{{center-p|[[Файл:Ugol3.jpg|250px|Бурый уголь]]}} |
| − | |||
</li> | </li> | ||
</ul> | </ul> | ||
| Строка 95: | Строка 78: | ||
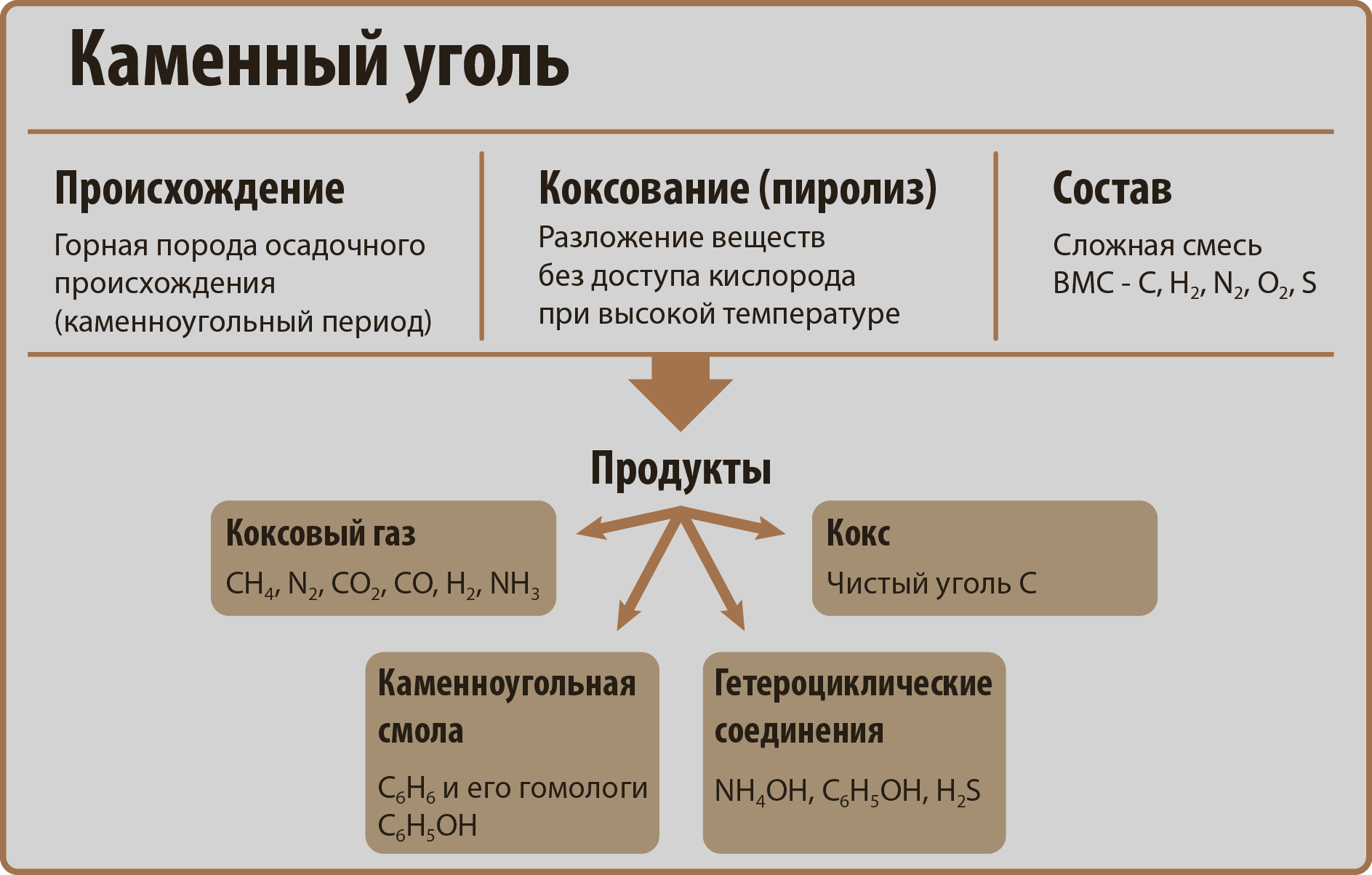
''Каменный уголь'' – содержит до 99% углерода. Из всех ископаемых углей находит самое широкое применение. ''Бурый уголь'' – содержит до 72% углерода. Имеет бурый цвет. Как самый молодой из ископаемых углей, часто сохраняет следы структуры дерева, из которого он образовался. | ''Каменный уголь'' – содержит до 99% углерода. Из всех ископаемых углей находит самое широкое применение. ''Бурый уголь'' – содержит до 72% углерода. Имеет бурый цвет. Как самый молодой из ископаемых углей, часто сохраняет следы структуры дерева, из которого он образовался. | ||
| − | {{center|[[file: | + | {{center-p|[[file:Kamenniy ugol.png|600px|Происхождение и применение каменного угля]]}} |
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
=== Нефть === | === Нефть === | ||
| − | + | {{left-p|[[file:Neft.png|200px|Молекула нефти]]}} | |
| − | {{ | + | Нефть известна человечеству с древних времён. На берегу Евфрата она добывалась 6-7 тыс. лет до нашей эры, использовалась для освещения жилищ, для приготовления строительных растворов, в качестве лекарств и мазей, при бальзамировании. Нефть в древнем мире была грозным оружием: огненные реки лились на головы штурмующих крепостные стены, горящие стрелы, смоченные в нефти, летели в осаждённые города. Нефть являлась составной частью зажигательного средства, вошедшего в историю под названием “греческого огня”. В средние века она использовалась главным образом для освещения улиц. |
| − | |||
| − | Нефть известна человечеству с древних времён. На берегу Евфрата она добывалась 6-7 тыс. лет до нашей эры | ||
<ul class="large-block-grid-2 small-block-grid-1"> | <ul class="large-block-grid-2 small-block-grid-1"> | ||
| − | <li> | + | <li> |
| + | В каждой капле нефти содержится более 900 различных химических соединений, более половины химических элементов Периодической системы. Это действительно чудо природы, основа нефтехимической промышленности. Примерно 90% всей добываемой нефти используется в качестве топлива. Несмотря на “свои 10%”, нефтехимический синтез обеспечивает получение многих тысяч органических соединений, которые удовлетворяют насущные потребности современного общества. Недаром люди уважительно называют нефть “чёрным золотом”, “кровью Земли” | ||
</li> | </li> | ||
| − | <li>{{center|[[Файл: | + | <li> |
| + | {{center|'''Процесс переработки нефти'''}}<br> | ||
| + | {{center|[[Файл:Pererabotka Nefti.mp4|300px|start=1]]}} | ||
</li> | </li> | ||
</ul> | </ul> | ||
| − | |||
| − | |||
<ul class="large-block-grid-2 small-block-grid-1"> | <ul class="large-block-grid-2 small-block-grid-1"> | ||
| − | <li>{{center|[[Файл: | + | <li>{{center-p|[[Файл:Neft3.jpg|350px|Процессы переработки нефти]]}} |
</li> | </li> | ||
| − | <li>{{center|[[Файл: | + | <li>{{center-p|[[Файл:Vidy i funkcii uglevodorodov.png|350px|Виды и функции углеводородов]]}} |
</li> | </li> | ||
</ul> | </ul> | ||
| − | + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | == | ||
| − | |||
| − | |||
| − | |||
| + | == Углеводы == | ||
| + | {{left-p|[[file:Uglevody.jpg|200px|Молекула сахарозы]]}} | ||
<div class="textblock">{{center|'''''Углеводы''' – сложные органические вещества, состоящие из углерода, водорода и кислорода.''}}</div> | <div class="textblock">{{center|'''''Углеводы''' – сложные органические вещества, состоящие из углерода, водорода и кислорода.''}}</div> | ||
| − | |||
Углеводы входят в состав клеток и тканей всех растительных и животных организмов и по массе составляют основную часть органического вещества на Земле. На долю углеводов приходится около 80% сухого вещества растений и около 20% животных. Растения синтезируют углеводы из неорганических соединений - углекислого газа и воды (СО<sub>2</sub> и Н<sub>2</sub>О) в процессе фотосинтеза: | Углеводы входят в состав клеток и тканей всех растительных и животных организмов и по массе составляют основную часть органического вещества на Земле. На долю углеводов приходится около 80% сухого вещества растений и около 20% животных. Растения синтезируют углеводы из неорганических соединений - углекислого газа и воды (СО<sub>2</sub> и Н<sub>2</sub>О) в процессе фотосинтеза: | ||
| − | |||
<div class="blocktext" style="text-align:center">6СО<sub>2</sub> + 6Н<sub>2</sub>О <ins>''<sup>свет, хлорофилл</sup>''</ins><span style="font-famili:georgia; font-size:1.5em;">→</span> C<sub>6</sub>H<sub>12</sub>O<sub>6</sub> + 6O<sub>2</sub> | <div class="blocktext" style="text-align:center">6СО<sub>2</sub> + 6Н<sub>2</sub>О <ins>''<sup>свет, хлорофилл</sup>''</ins><span style="font-famili:georgia; font-size:1.5em;">→</span> C<sub>6</sub>H<sub>12</sub>O<sub>6</sub> + 6O<sub>2</sub> | ||
| Строка 138: | Строка 113: | ||
Углеводы имеют общую формулу C<sub>n</sub>(H<sub>2</sub>O)<sub>m</sub>, откуда и возникло название этих природных соединений. | Углеводы имеют общую формулу C<sub>n</sub>(H<sub>2</sub>O)<sub>m</sub>, откуда и возникло название этих природных соединений. | ||
| + | <ul class="large-block-grid-2 small-block-grid-1"> | ||
| + | <li> | ||
| + | {{center|[[file:Klasificacii uglevodov.jpg|500px|Классификация углеводов]]}} | ||
| + | </li> | ||
| + | <li> | ||
| + | {{center|[[file:Okislenie Glukozy.mp4|500px|start=1]]}} | ||
| + | </li></ul> | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | + | == Белки == | |
| + | '''Белки''' ''(полипептиды)'' – биополимеры построенные из остатков аминокислот, соединенных пептидными ''(амидными)'' связями. | ||
| − | + | <ul class="large-block-grid-2 small-block-grid-1"> | |
| − | + | <li>{{center-p|[[file:Belki.jpg|500px|Схема строения белка]]}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | <ul class="large-block-grid- | ||
| − | <li>{{center|[[ | ||
</li> | </li> | ||
| − | <li>{{center|[[Файл: | + | <li> |
| + | {{center|'''Белки - из чего состоит все живое на Земле'''}} | ||
| + | {{center|[[Файл:Белки- из чего состоит все живое на Земле.mp4|500px|start=1]]}} | ||
</li> | </li> | ||
| − | <li>{{center|[[Файл: | + | <li>{{center-p|[[Файл:Belki2.jpg|270px|Общий вид белка]]}} |
</li> | </li> | ||
| − | < | + | <li>{{center-p|[[Файл:Belok.png|400px|Структура белка]]}} |
| − | |||
| − | |||
| − | |||
| − | {{center | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
</li> | </li> | ||
</ul> | </ul> | ||
| Строка 200: | Строка 140: | ||
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д. Как видно, функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. | Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д. Как видно, функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. | ||
| − | + | === Роль белков в организме === | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | == Роль белков в организме == | ||
| − | |||
Функции белков в организме разнообразны. Они в значительной мере обусловлены сложностью и разнообразием форм и состава самих белков. | Функции белков в организме разнообразны. Они в значительной мере обусловлены сложностью и разнообразием форм и состава самих белков. | ||
| − | |||
* Белки - незаменимый строительный материал. | * Белки - незаменимый строительный материал. | ||
| − | |||
* Многие белки обладают сократительной функцией. | * Многие белки обладают сократительной функцией. | ||
| − | |||
* Велика роль белков в транспорте веществ в организме. | * Велика роль белков в транспорте веществ в организме. | ||
| − | |||
* Еще одна функция белка – запасная. | * Еще одна функция белка – запасная. | ||
| − | |||
* Регуляторную функцию выполняют белки – гормоны. | * Регуляторную функцию выполняют белки – гормоны. | ||
| − | + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | |
== Полезные ссылки == | == Полезные ссылки == | ||
| − | + | {{bib|”Удивительный мир органических веществ”: Сайт Тutor.Оnlinе (Электронный ресурс) //URL: https://www.tutoronline.ru/blog/organicheskie-veshhestva (дата обращения: 10.03.2018)}} | |
| + | {{bib|“Значение органической химии”:Сайт“Интерактивный мультимедиа учебник” (Электронный ресурс) //URL: http://orgchem.ru/(дата обращения: 10.03.2018)}} | ||
| + | {{bib|“Первоначальные сведения о строении органических веществ. Основные положения теории строения органических соединений А. М. Бутлерова”: Сайт"Химуля.com (Электронный ресурс) //URL: https://sites.google.com/site/himulacom/zvonok-na-urok/9-klass---vtoroj-god-obucenia (дата обращения: 10.03.2018)}} | ||
| + | {{bib|«Изомерия. Упрощенная классификация органических соединений”: Сайт «Химуля.com» (Электронный ресурс) //URL: https://sites.google.com/site/himulacom/zvonok-na-urok/9-klass---vtoroj-god-obucenia (дата обращения: 10.03.18).}} | ||
| + | {{bib|Природные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха от загрязнения.: Сайт “Химуля. com“ (Электронный ресурс) //URL: https://sites.google.com/site/himulacom/zvonok-na-urok/9-klass---vtoroj-god-obucenia (дата обращения: 10.03.18.)}} | ||
| + | {{bib|“Рубрика Хозяйке на заметку” Сайт “ Занимательная химия” (Электронный ресурс) //URL: http://www.alto-lab.ru/(дата обращения: 10.03.18.)}} | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | + | == Глоссарий == | |
| − | + | :{{bib|'''Белки''' – сложные высокомолекулярные природные соединения, состоящие из a-аминокислот, соединенных пептидной связью}} | |
| − | + | :{{bib|'''Гомологи''' – вещества с химическим одинаковым строением, но отличающиеся по составу на одну или несколько групп СН<sub>2</sub>.}} | |
| − | + | :{{bib|'''Изомеры''' – вещества, имеющие одинаковый состав и одинаковую молекулярную массу, но различное строение молекул, а потому обладающие разными свойствами.}} | |
| − | + | :{{bib|'''Органическая химия''' – это химия соединений углерода, а точнее, химия углеводородов и их производных. Органические соединения обязательно включают в себя атомы углерода и водорода.}} | |
| − | + | :{{bib|'''Углеводы''' – органические соединения, содержащие карбонильные и гидроксильные группировки атомов, имеющие общую формулу '''C<sub>n</sub>(H<sub>2</sub>O)'''<sub>m</sub>, (где n и m>3).}} | |
| − | + | :{{bib|'''Циклические соединения''' – соединения, в которых углеродные атомы образуют циклы.}} | |
| − | + | </div> | |
| − | + | <!-- Sidebar --> | |
| − | + | <div class="large-4 medium-5 columns"> | |
| − | + | <!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | |
| − | + | <div class="sbstyle"> | |
| − | + | <div class="row"> | |
| − | + | <div class="large-10 small-10 large-centered small-centered columns rubric">Углеводы – простые и сложные</div> | |
| − | + | </div> | |
| − | + | {{center|[[file:Prostie uglevody.jpg|500px]]}} | |
| − | == | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | {{center|[[file:Slojnie uglevody.jpg|600px]]}} | ||
| + | '''Глюкоза C<sub>6</sub>H<sub>12</sub>O<sub>6</sub> – наиболее важный из всех моносахаридов''', так как она является структурной единицей большинства пищевых ди- и полисахаридов. | ||
| + | <ul class="large-block-grid-3 small-block-grid-1"> | ||
| + | <li>{{center-p|[[Файл:Stroenie gluk.jpg|200px|строение глюкозы ]]}} | ||
| + | </li> | ||
| + | <li>{{center-p|[[Файл:Molekula.jpg|250px|молекула]]}} | ||
| + | </li> | ||
| + | <li>{{center-p|[[Файл:Vinograd.jpg|250px|виноград]]}} | ||
| + | </li> | ||
| + | </ul> | ||
| + | |||
| + | Она содержится в плодах и ягодах и необходима для снабжения энергией и образования в печени гликогена (запасной углевод человека и животных). Особенно её много в виноградном соке, поэтому глюкозу иногда называют виноградным сахаром. Мёд в основном состоит из смеси глюкозы с фруктозой. Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.). Большое значение имеют процессы брожения глюкозы. | ||
| + | {{center-p|[[file:Klubnika.jpg|300px]]}} | ||
| + | '''Фруктоза – C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>''' является одним из самых распространенных углеводов фруктов, содержится в мёде. В отличие от глюкозы она может без участия инсулина проникать из крови в клетки тканей. По этой причине фруктоза рекомендуется в качестве наиболее безопасного источника углеводов для больных диабетом. | ||
| + | '''Сахароза – С<sub>12</sub>Н<sub>22</sub>О<sub>11</sub>''', образована молекулами глюкозы и фруктозы. Содержание сахарозы в сахаре 99,5%. Сахар часто называют «носителем пустых калорий», так как сахар – это чистый углевод и не содержит других питательных веществ, таких, как, например, витамины, минеральные соли. Сахароза содержится в сахарном тростнике и сахарной свекле, а также в сладостях. | ||
| + | {{center-p|[[file:Saharoza.jpg|300px]]}} | ||
| + | '''Крахмал – (С<sub>6</sub>Н<sub>10</sub>О<sub>5</sub>)<sub>n</sub>''' природный полимер, он накапливается в виде зерен, главным образом в клетках семян, луковиц, клубней, а также в листьях и стеблях. Крахмал – белый порошок, нерастворимый в холодной воде. В горячей воде он набухает и образует клейстер. Крахмал применяют для накрахмаливания белья. Крахмал и его производные применяются при производстве бумаги, текстильных изделий, в литейном и других производствах, в фармацевтической промышленности. | ||
| + | {{center-p|[[file:Krahmal.jpg|400px]]}} | ||
| + | {{center-p|[[file:Krahmal1.jpg|500px]]}} | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
</div> | </div> | ||
| − | <!-- | + | <!-- Второй элемент сайдбара --> |
| − | <div class=" | + | <div class="sbstyle" style="margin-top:20px;"> |
| − | |||
| − | |||
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric | + | <div class="large-10 small-10 large-centered small-centered columns rubric">О важной роли белков</div> |
</div> | </div> | ||
| − | + | {{center-p|[[file:Produkty belki.jpg|700px]]}} | |
| + | |||
| + | Белковый обмен в организме человека весьма сложен. В зависимости от состояния организма необходимое количество тех или иных белков постоянно изменяется, белки расщепляются, синтезируются, одни аминокислоты переходят в другие или распадаются, выделяя энергию. В результате жизнедеятельности организма часть белков теряется, это обычно около 25-30 г белка в сутки. Поэтому белки должны постоянно присутствовать в рационе человека в нужном количестве. Необходимое для человека количество белка в пище зависит от различных факторов: от того, находится ли человек в покое или выполняет тяжелую работу, каково его эмоциональное состояние и г.п. Рекомендуемая суточная норма потребления белка составляет 0,75-0,80 г качественного белка на 1 кг веса для взрослого человека. Детям, особенно совсем маленьким, требуется больше белка (до 1,9 г на 1 кг веса в сутки), так как их организм интенсивно растет. | ||
| − | + | {{center|[[file:Produkty belki2.jpg|700px]]}} | |
| + | </div> | ||
| + | <div class="sbstyle" style="margin-top:20px;"> | ||
<div class="row"> | <div class="row"> | ||
| − | <div class="large- | + | <div class="large-10 small-10 large-centered small-centered columns rubric">Высокомолекулярные соединения</div> |
| − | |||
| − | |||
| − | |||
</div> | </div> | ||
| − | + | Особую очень важную группу органических веществ составляют высокомолекулярные соединения (полимеры). Масса их молекул достигает нескольких десятков тысяч и даже миллионов атомных единиц массы. | |
| − | |||
| − | + | '''Какова роль этих соединений?''' | |
| − | + | Полимерные вещества являются основой Жизни на земле. | |
| − | + | Органические природные полимеры биополимеры – обеспечивают процессы жизнедеятельности всех животных и растительных организмов. Природа выбрала всего 4 типа полимеров: | |
| − | + | {{center|[[file:Lifihak.jpg|280px]]}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | {{ | ||
| − | + | Во-вторых благодаря только для них характерным свойствам полимеры (синтетические, искусственные и некоторые природные) широко используются при изготовлении самых разнообразных материалов: | |
| − | {{ | + | {{center|[[file:Lifihak1.jpg|280px]]}} |
| − | + | ''Молекула полимера называется '''макромолекулой''' (от греч. «макрос» – большой. длинный)'' | |
| − | {{ | + | {{center|[[file:Polimery 1.jpg|280px]]}} |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | | | ||
| − | |||
| − | |||
| − | |||
| − | + | '''''Применение полимеров''''' | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | { | + | {{center|[[file:Polimery.jpg|300px]]}} |
| − | | | ||
| − | |||
| − | |||
| − | |||
| − | { | + | {{center|[[file:DrevesCompositMatChem.gif|300px]]}} |
| − | | | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
</div> | </div> | ||
| − | <div class=" | + | <div class="sbstyle"> |
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric" style=" | + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Пройди тестирование</div> |
</div> | </div> | ||
| − | < | + | <a href="/docs/Tests/Chemistry/Rus/Органическая химия/res/index.html" class="test_hover" onclick="this.target='_blank'"> <div align="center" class="test_div_hover" style="width:300px; height:auto; float:non; text-indent:0"><span class="test_hover_state"></span> [[file:Corbis.jpg|class=testirovanie|Пройди тестирование|link=]]</div> |
| − | |||
</div> | </div> | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
</div> | </div> | ||
| + | {{lang|:KR:Химия: Органикалык заттардын ажайып дүйнɵсү}} | ||
Текущая версия на 09:46, 22 октября 2018
Содержание
Теория химического строения органических соединений (ТХС)
-
Главные положения своей теории А. М. Бутлеров изложил в докладе «О химическом строении вещества», прочитанном в химической секции Съезд немецких естествоиспытателей и врачей в Шпейере (сентябрь 1861).
1. Атомы в молекулах соединены между собой в определенной последовательности химическими связями, в соответствии с их валентностью. Порядок связи атомов называется их химическим строением. Углерод во всех органических соединениях четырехвалентен.
2. Свойства веществ определяются не только качественным и количественным составом молекул, но и их строением.
3. Атомы или группы атомов взаимно влияют друг на друга, от чего зависит реакционная способность молекулы.
4. Строение молекул может быть установлено на основании изучения их химических свойств.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому её развитию. Опираясь на положение теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
Строение органических веществ
Многообразие органических веществ на планете и разнообразие их строения можно объяснить характерными особенностями атомов углерода.
Вы помните, что атомы углерода способны образовывать очень прочные связи друг с другом, соединяясь в цепочки. В результате получаются устойчивые молекулы. То, как именно атомы углерода соединяются в цепь (располагаются зигзагом), является одной из ключевых особенностей ее строения. Углерод может объединяться как в открытые цепи, так и в замкнутые (циклические) цепочки.
Изомерия-основная причина разнообразия и многочисленности органических веществ
Классификация органических соединений
-
Классификацию углеводородов проводят по следующим структурным признакам, определяющим свойства этих соединений:
-
Другим классификационным признаком является тип функциональной группы, входящей в состав молекулы органического веществ.
Значение органической химии
Органическая химия имеет исключительно важное научное и практическое значение. Объектом её исследований является огромное число соединений синтетического и природного происхождения. Поэтому органическая химия стала крупнейшим и важным разделом современной химии.
Природные органические вещества и их превращения лежит в основе явлений Жизни. Поэтому органическая химия является химическим фундаментом биологической химии и молекулярной биологии – наук, изучающих процессы происходящие в клетках организмов на молекулярном уровне. Исследования в этой области позволяют глубже понять суть явлений живой природы.
Множество синтетических органических соединений производится промышленностью для использования в самых разных отраслях человеческой деятельности.
Это – нефтепродукты, горючее для различных двигателей, полимерные материалы (каучуки, пластмассы,волокна, пленки,лаки, клетки и.т.д.) красители, средства защиты растений, лекарственные препараты, вкусовые и парфюмерные вещества и т.п.) Без знания основ органической химии человек не способен экологически грамотно использовать все эти продукты цивилизации.
Природные источники углеводорода
Каменный уголь
На земном шаре известно больше 36 тысяч угольных бассейнов и месторождений, которые в совокупности занимают 15% его территории. Угольные бассейны могут тянуться на тысячи километров. Всего общегеологические запасы угля на земном шаре составляют 5 трлн. 500 млрд. тонн, в том числе разведанные месторождения –1 трлн. 750 млрд. тонн.
Различают три главных вида ископаемых углей. При горении бурого угля, антрацита – пламя невидимое, сгорание бездымное, а каменный уголь при горении издаёт громкий треск. Антрацит – самый древний из ископаемых углей. Отличается большой плотностью и блеском. Содержит до 95% углерода.
Каменный уголь – содержит до 99% углерода. Из всех ископаемых углей находит самое широкое применение. Бурый уголь – содержит до 72% углерода. Имеет бурый цвет. Как самый молодой из ископаемых углей, часто сохраняет следы структуры дерева, из которого он образовался.
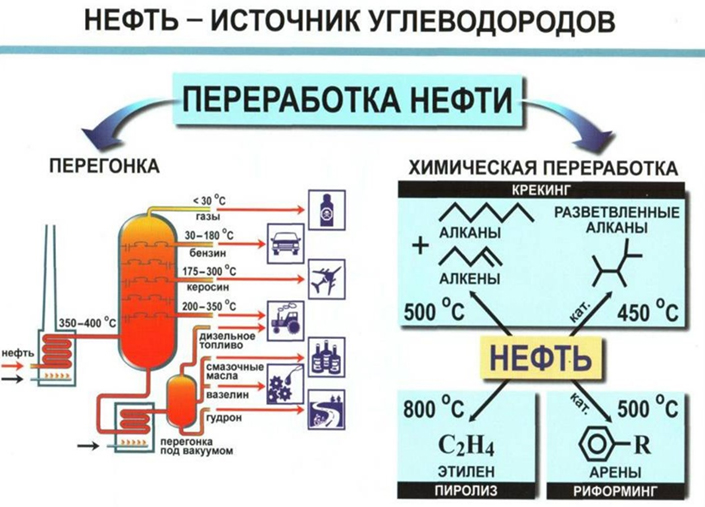
Нефть
Нефть известна человечеству с древних времён. На берегу Евфрата она добывалась 6-7 тыс. лет до нашей эры, использовалась для освещения жилищ, для приготовления строительных растворов, в качестве лекарств и мазей, при бальзамировании. Нефть в древнем мире была грозным оружием: огненные реки лились на головы штурмующих крепостные стены, горящие стрелы, смоченные в нефти, летели в осаждённые города. Нефть являлась составной частью зажигательного средства, вошедшего в историю под названием “греческого огня”. В средние века она использовалась главным образом для освещения улиц.
- В каждой капле нефти содержится более 900 различных химических соединений, более половины химических элементов Периодической системы. Это действительно чудо природы, основа нефтехимической промышленности. Примерно 90% всей добываемой нефти используется в качестве топлива. Несмотря на “свои 10%”, нефтехимический синтез обеспечивает получение многих тысяч органических соединений, которые удовлетворяют насущные потребности современного общества. Недаром люди уважительно называют нефть “чёрным золотом”, “кровью Земли”
-
Процесс переработки нефти
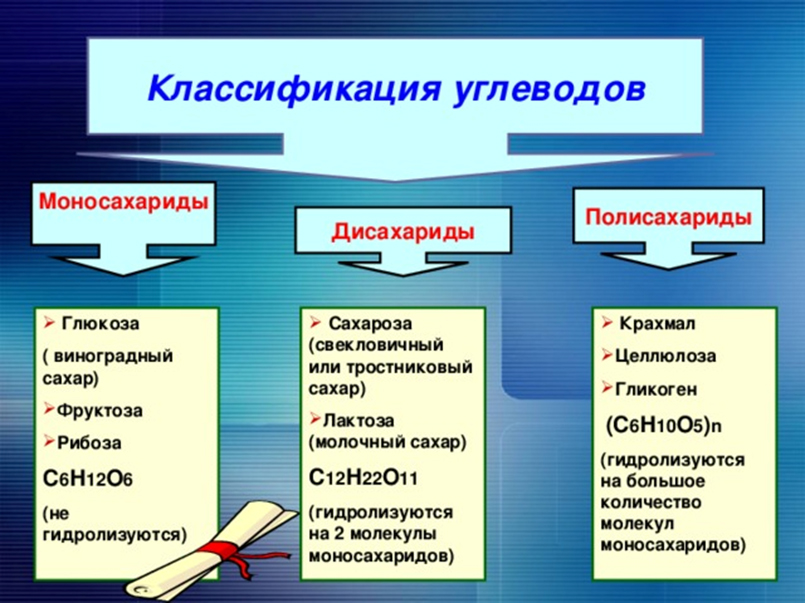
Углеводы
Углеводы входят в состав клеток и тканей всех растительных и животных организмов и по массе составляют основную часть органического вещества на Земле. На долю углеводов приходится около 80% сухого вещества растений и около 20% животных. Растения синтезируют углеводы из неорганических соединений - углекислого газа и воды (СО2 и Н2О) в процессе фотосинтеза:
Углеводы имеют общую формулу Cn(H2O)m, откуда и возникло название этих природных соединений.
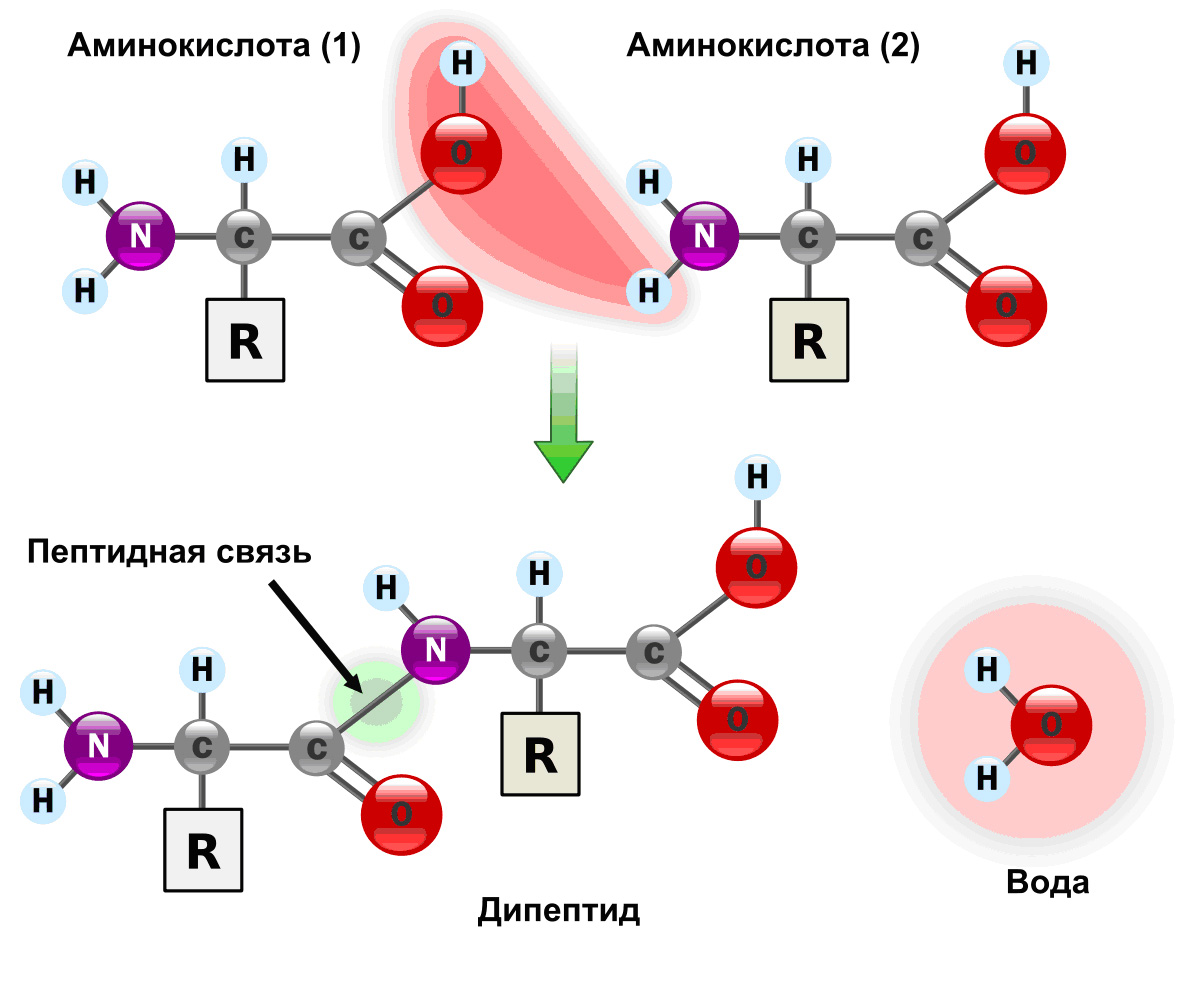
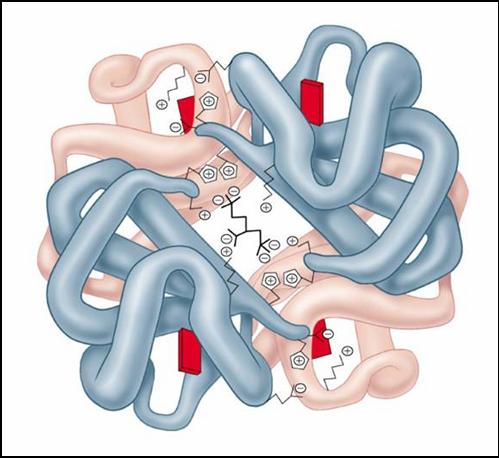
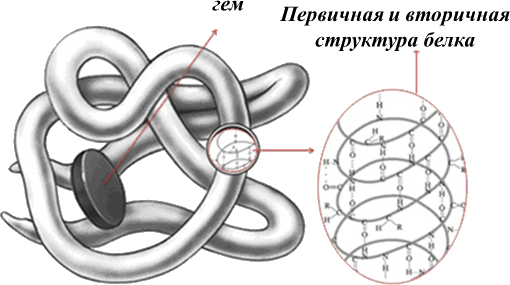
Белки
Белки (полипептиды) – биополимеры построенные из остатков аминокислот, соединенных пептидными (амидными) связями.
-
Белки - из чего состоит все живое на Земле
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д. Как видно, функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д.
Роль белков в организме
Функции белков в организме разнообразны. Они в значительной мере обусловлены сложностью и разнообразием форм и состава самих белков.
- Белки - незаменимый строительный материал.
- Многие белки обладают сократительной функцией.
- Велика роль белков в транспорте веществ в организме.
- Еще одна функция белка – запасная.
- Регуляторную функцию выполняют белки – гормоны.
Полезные ссылки
Глоссарий
- Белки – сложные высокомолекулярные природные соединения, состоящие из a-аминокислот, соединенных пептидной связью
- Гомологи – вещества с химическим одинаковым строением, но отличающиеся по составу на одну или несколько групп СН2.
- Изомеры – вещества, имеющие одинаковый состав и одинаковую молекулярную массу, но различное строение молекул, а потому обладающие разными свойствами.
- Органическая химия – это химия соединений углерода, а точнее, химия углеводородов и их производных. Органические соединения обязательно включают в себя атомы углерода и водорода.
- Углеводы – органические соединения, содержащие карбонильные и гидроксильные группировки атомов, имеющие общую формулу Cn(H2O)m, (где n и m>3).
- Циклические соединения – соединения, в которых углеродные атомы образуют циклы.
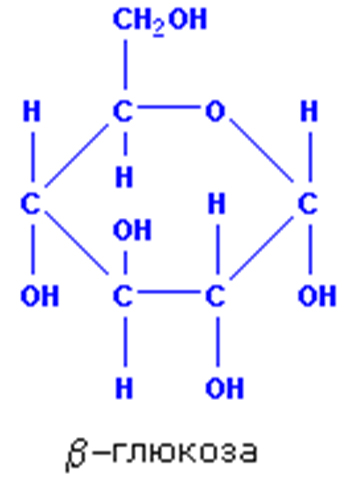
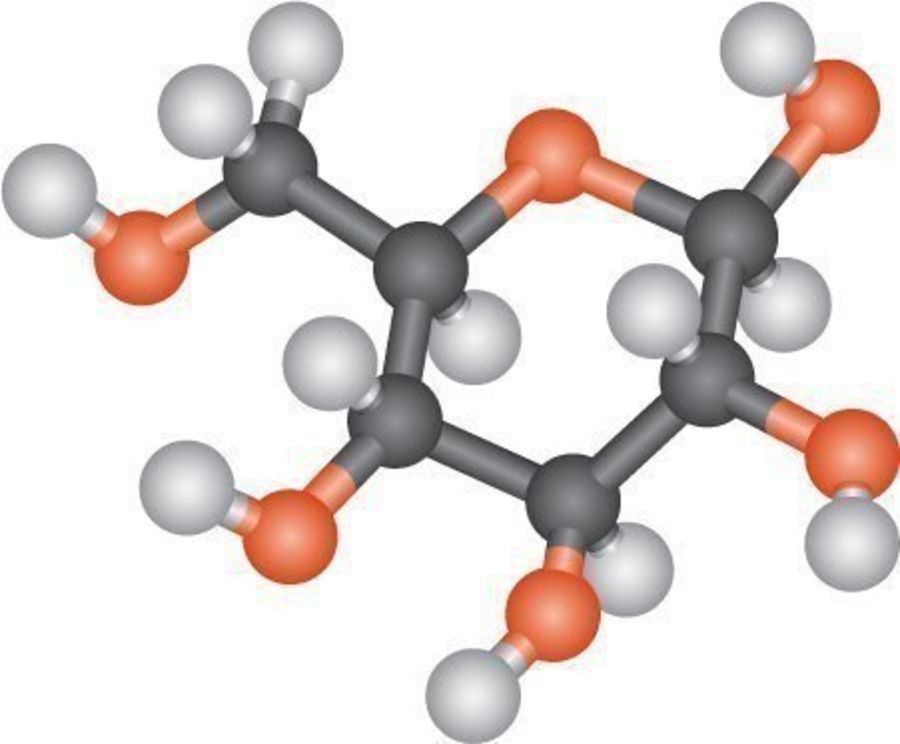
Глюкоза C6H12O6 – наиболее важный из всех моносахаридов, так как она является структурной единицей большинства пищевых ди- и полисахаридов.
Она содержится в плодах и ягодах и необходима для снабжения энергией и образования в печени гликогена (запасной углевод человека и животных). Особенно её много в виноградном соке, поэтому глюкозу иногда называют виноградным сахаром. Мёд в основном состоит из смеси глюкозы с фруктозой. Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.). Большое значение имеют процессы брожения глюкозы.
Фруктоза – C6H12O6 является одним из самых распространенных углеводов фруктов, содержится в мёде. В отличие от глюкозы она может без участия инсулина проникать из крови в клетки тканей. По этой причине фруктоза рекомендуется в качестве наиболее безопасного источника углеводов для больных диабетом.
Сахароза – С12Н22О11, образована молекулами глюкозы и фруктозы. Содержание сахарозы в сахаре 99,5%. Сахар часто называют «носителем пустых калорий», так как сахар – это чистый углевод и не содержит других питательных веществ, таких, как, например, витамины, минеральные соли. Сахароза содержится в сахарном тростнике и сахарной свекле, а также в сладостях.
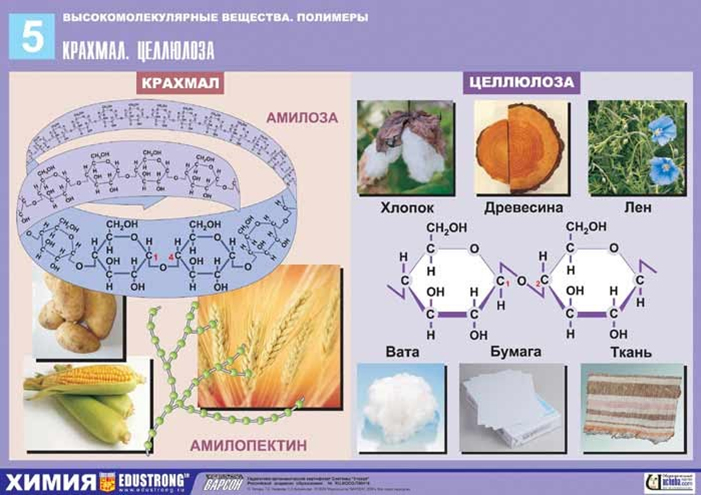
Крахмал – (С6Н10О5)n природный полимер, он накапливается в виде зерен, главным образом в клетках семян, луковиц, клубней, а также в листьях и стеблях. Крахмал – белый порошок, нерастворимый в холодной воде. В горячей воде он набухает и образует клейстер. Крахмал применяют для накрахмаливания белья. Крахмал и его производные применяются при производстве бумаги, текстильных изделий, в литейном и других производствах, в фармацевтической промышленности.
Белковый обмен в организме человека весьма сложен. В зависимости от состояния организма необходимое количество тех или иных белков постоянно изменяется, белки расщепляются, синтезируются, одни аминокислоты переходят в другие или распадаются, выделяя энергию. В результате жизнедеятельности организма часть белков теряется, это обычно около 25-30 г белка в сутки. Поэтому белки должны постоянно присутствовать в рационе человека в нужном количестве. Необходимое для человека количество белка в пище зависит от различных факторов: от того, находится ли человек в покое или выполняет тяжелую работу, каково его эмоциональное состояние и г.п. Рекомендуемая суточная норма потребления белка составляет 0,75-0,80 г качественного белка на 1 кг веса для взрослого человека. Детям, особенно совсем маленьким, требуется больше белка (до 1,9 г на 1 кг веса в сутки), так как их организм интенсивно растет.
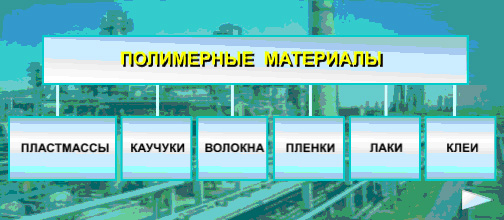
Особую очень важную группу органических веществ составляют высокомолекулярные соединения (полимеры). Масса их молекул достигает нескольких десятков тысяч и даже миллионов атомных единиц массы.
Какова роль этих соединений?
Полимерные вещества являются основой Жизни на земле.
Органические природные полимеры биополимеры – обеспечивают процессы жизнедеятельности всех животных и растительных организмов. Природа выбрала всего 4 типа полимеров:
Во-вторых благодаря только для них характерным свойствам полимеры (синтетические, искусственные и некоторые природные) широко используются при изготовлении самых разнообразных материалов:
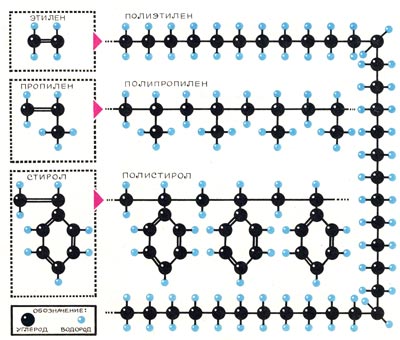
Молекула полимера называется макромолекулой (от греч. «макрос» – большой. длинный)
Применение полимеров