Химия: Металлы — различия между версиями
Admine2 (обсуждение | вклад) (→Железо) |
Admine2 (обсуждение | вклад) |
||
| (не показана 31 промежуточная версия этого же участника) | |||
| Строка 1: | Строка 1: | ||
{{Якорь|Начало}} | {{Якорь|Начало}} | ||
<div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | ||
| − | + | ||
==Общие свойства металлов== | ==Общие свойства металлов== | ||
| − | К металлам относят элементы, имеющие 1, 2, 3 электрона на внешнем уровне. (Кроме водорода, гелия и бора. Металлы располагаются в главных и побочных подгруппах ПСЭ). Им свойственны высокая тепло- и электропроводность, пластичность, т.е. они подвергаются ковке, прокатке и вытягиванию в проволоку. Все металлы при обычной температуре твердые, кроме ртути, имеют металлический блеск и окрашены в золотисто-красноватые, серебристо-серые, тона и даже с синеватым отливом. | + | К металлам относят элементы, имеющие 1, 2, 3 электрона на внешнем уровне. (Кроме водорода, гелия и бора). Металлы располагаются в главных и побочных подгруппах ПСЭ). Им свойственны высокая тепло- и электропроводность, пластичность, т.е. они подвергаются ковке, прокатке и вытягиванию в проволоку. Все металлы при обычной температуре твердые, кроме ртути, имеют металлический блеск и окрашены в золотисто-красноватые, серебристо-серые, тона и даже с синеватым отливом. |
{{center-p|[[file:Metally demonstracia.png|600px|center|Внешний вид различных металлов]]}} | {{center-p|[[file:Metally demonstracia.png|600px|center|Внешний вид различных металлов]]}} | ||
| − | + | Причина этих свойств кроется в строении атомов металлов и природе их кристаллических решеток, в узлах которых располагаются как нейтральные атомы, так и положительно заряженные ионы. А электроны, оторванные от ионов (электронный газ), располагаются в межузловом пространстве. Типичные металлы- восстановители, но могут проявлять и амфотерные свойства. Металлы объединяют по свойствам в щелочные (<span class="metall">Li, Na, K, Rb,Cs, Fr</span>), щелочно-земельные (<span class="metall">Ca, Sr, Ba,Ra</span>), цветные (<span class="metall">Ag, Au, Cu, Mn, Co, Ni, Cr</span>), черные <span class="metall">Fe</span> и его сплавы), благородные (<span class="metall">Ag, Au, Pt,Ru, Rh,Pd, Os, Ir</span>), легкие с плотностью ниже 5 г/см<sup>3</sup> и тяжелые, если плотность выше. Плотность металлов колеблется в пределах 0, 53 г/см<sup>3</sup> у лития до 22, 7 г/см<sup>3</sup> у осмия. | |
| − | Причина этих свойств кроется в строении атомов металлов и | + | |
Наибольшее значение приобретают сплавы металлов различного типа - смеси нескольких металлов и неметаллов, в которых резко меняются индивидуальные свойства металлов. Могут быть твердые растворы, интерметаллиды, механические смеси. Сплавы прочнее, более тугоплавки, или температура плавления сильно падает, кислото-щелочеупорные, устойчивы к истиранию или приобретают иные свойства. | Наибольшее значение приобретают сплавы металлов различного типа - смеси нескольких металлов и неметаллов, в которых резко меняются индивидуальные свойства металлов. Могут быть твердые растворы, интерметаллиды, механические смеси. Сплавы прочнее, более тугоплавки, или температура плавления сильно падает, кислото-щелочеупорные, устойчивы к истиранию или приобретают иные свойства. | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| Строка 16: | Строка 16: | ||
Металлы <span class="metall">'''Li, Na, К , Rb, Cs, Fr'''</span> называются щелочными, так как при реакции с водой атомы этих металлов образуют щелочи – растворимые в воде основания. У всех щелочных металлов заполняется S- электронный слой по 1<big class="elektron" data-title="–">е</big>, поэтому проявляются только металлические свойства восстановителей, степень окисления элементов равна '''+1''' и валентность равна '''1'''. Температуры плавления t(<small>пл</small>) низки, цезий способен расплавится от тепла человеческой руки t(<small>пл</small>) = 28,5 <sup>о</sup>С. | Металлы <span class="metall">'''Li, Na, К , Rb, Cs, Fr'''</span> называются щелочными, так как при реакции с водой атомы этих металлов образуют щелочи – растворимые в воде основания. У всех щелочных металлов заполняется S- электронный слой по 1<big class="elektron" data-title="–">е</big>, поэтому проявляются только металлические свойства восстановителей, степень окисления элементов равна '''+1''' и валентность равна '''1'''. Температуры плавления t(<small>пл</small>) низки, цезий способен расплавится от тепла человеческой руки t(<small>пл</small>) = 28,5 <sup>о</sup>С. | ||
| − | Соли этих металлов окрашивают пламя в характерные цвета (разноцветие салюта): литий - алый, натрий - | + | Соли этих металлов окрашивают пламя в характерные цвета (разноцветие салюта): литий - алый, натрий - желтый, калий – фиолетовый, рубидий – красный, цезий - голубой. |
{{center-p|[[file:Img10.jpg|400px|center|Окрашивание пламени разными металлами]]}} | {{center-p|[[file:Img10.jpg|400px|center|Окрашивание пламени разными металлами]]}} | ||
| Строка 24: | Строка 24: | ||
Щелочные металлы в свободном виде не встречаются из-за высокой реакционной способности, а только в виде солей. Самая распространенная из них NaCl (каменная соль, поваренная соль, галит). А вот соду (Na<small>2</small>CO<small>3</small>) человечество знало издревле, о ней упоминается даже в Библии. Огромную роль в истории человечества сыграла калийная селитра (KNO<small>3</small>), так как входила в состав пороха. | Щелочные металлы в свободном виде не встречаются из-за высокой реакционной способности, а только в виде солей. Самая распространенная из них NaCl (каменная соль, поваренная соль, галит). А вот соду (Na<small>2</small>CO<small>3</small>) человечество знало издревле, о ней упоминается даже в Библии. Огромную роль в истории человечества сыграла калийная селитра (KNO<small>3</small>), так как входила в состав пороха. | ||
Щелочные металлы получают электролизом расплава хлоридов или гидроксидов этих металлов. | Щелочные металлы получают электролизом расплава хлоридов или гидроксидов этих металлов. | ||
| − | <div class="blocktext | + | <div class="blocktext">2NaCl <sup><ins>''Электролиз''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→</span> Na + Cl<small>2</small><span style="font-famili:georgia; font-size:1.5em;">↑</span>, 4NaOH <sup><ins>''Электролиз''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→</span> 4Na + 2H<small>2</small>O + O<small>2</small>{{ArrowUp}}</div> |
| − | <div class="show-for-large-up">{{right-p|[[file: | + | <div class="show-for-large-up">{{right-p|[[file:Shelochnye.jpg|250px|Щелочные металлы]]}}</div> |
| − | <div class="show-for-small-only">{{center|[[file: | + | <div class="show-for-small-only">{{center|[[file:Shelochnye.jpg|250px|Щелочные металлы]]}}</div> |
| − | Все металлы очень мягкие, имеют небольшую плотность. Литий (0,53 г/см<sup>3</sup>) и натрий (0,97 г/см<sup>3</sup>) легче воды и плавают на ее поверхности, реагируя с ней. | + | Все щелочные металлы очень мягкие, имеют небольшую плотность. Литий (0,53 г/см<sup>3</sup>) и натрий (0,97 г/см<sup>3</sup>) легче воды и плавают на ее поверхности, реагируя с ней. |
| − | Все металлы серебристо белого цвета, хорошо проводят тепло и электрический ток. Мягкие, режутся ножом. | + | Все щелочные металлы серебристо белого цвета, хорошо проводят тепло и электрический ток. Мягкие, режутся ножом. |
| − | Все металлы очень реакционноспособны. Поэтому их хранят под слоем керосина. | + | Все щелочные металлы очень реакционноспособны. Поэтому их хранят под слоем керосина. |
| − | + | Щелочные металлы реагируют с водородом, серой, углеродом и хлором. Калий и натрий с кислородом образуют пероксиды (Na<sub>2</sub>O<sub>2</sub>), а калий даже сверхоксид (KO<sub>2</sub>); при реакции с водой образуют гидроксиды - щелочи (LiOH, NaOH, KOH). | |
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
==Щелочноземельные металлы== | ==Щелочноземельные металлы== | ||
| − | {{center-p|[[file: | + | {{center-p|[[file:Shelochnozemelnye.jpg|600px|Щелочноземельные металлы: Mg – магний, Ca – кальций, Sr – стронций, Ba – барий соответственно.]]}} |
| − | <span class="metall">'''Ca, Sr, Ba, Ra'''</span> называют щелочноземельными металлами, так как их гидроксиды в водном растворе обладают щелочными свойствами | + | <span class="metall">'''Ca, Sr, Ba, Ra'''</span> называют щелочноземельными металлами, так как их гидроксиды в водном растворе обладают щелочными свойствами, а их оксиды по своей тугоплавкости сходны с оксидами тяжелых металлов, называвшихся «землями». |
<span class="metall">(Mg)</span> –магний, <span class="metall">(Ca)</span> – кальций, <span class="metall">(Sr)</span> – стронций, <span class="metall">(Ba)</span> – барий проявляют свойства типичных металлов. Все металлы серебристо-белого цвета, тепло- и электропроводны, их плотность увеличивается сверху вниз, а температура плавления уменьшается. Их хранят под слоем керосина, как щелочные металлы, чтобы предохранить от быстрого окисления кислородом воздуха. Металлы мягкие, режутся ножом. Окрашивают пламя в характерные цвета. | <span class="metall">(Mg)</span> –магний, <span class="metall">(Ca)</span> – кальций, <span class="metall">(Sr)</span> – стронций, <span class="metall">(Ba)</span> – барий проявляют свойства типичных металлов. Все металлы серебристо-белого цвета, тепло- и электропроводны, их плотность увеличивается сверху вниз, а температура плавления уменьшается. Их хранят под слоем керосина, как щелочные металлы, чтобы предохранить от быстрого окисления кислородом воздуха. Металлы мягкие, режутся ножом. Окрашивают пламя в характерные цвета. | ||
{{center|[[file:Sequence 01 1.mp4|350px]] [[file:Ca.mp4|350px]]}} | {{center|[[file:Sequence 01 1.mp4|350px]] [[file:Ca.mp4|350px]]}} | ||
| − | <div class="blocktext">В свободном виде металлы в природе не встречаются, встречаются в виде солей CaCO<sub>3</sub> • MgCO<sub>3</sub> – доломит, CaCO<sub>3</sub> – мел, известняк, мрамор, CaSO<sub>4</sub> • 2H<sub>2</sub>O – природный гипс, Ca<sub>3</sub> (PO<sub>4</sub>)<sub>2</sub> – фосфорит. Кальций и Магний получают электролизом из их хлоридов, а стронций и барий получают алюминотермически. У всех металлов на внешнем электронном уровне по 2<big>е</big> и поэтому все они сильные восстановители, отдающие 2<big>е</big>, степень их окисления равна '''+2''', .металлические свойства увеличиваются сверху вниз. | + | <div class="blocktext">В свободном виде металлы в природе не встречаются, встречаются в виде солей CaCO<sub>3</sub> • MgCO<sub>3</sub> – доломит, CaCO<sub>3</sub> – мел, известняк, мрамор, CaSO<sub>4</sub> • 2H<sub>2</sub>O – природный гипс, Ca<sub>3</sub> (PO<sub>4</sub>)<sub>2</sub> – фосфорит. Кальций и Магний получают электролизом из их хлоридов, а стронций и барий получают алюминотермически. У всех металлов на внешнем электронном уровне по 2<big class="elektron" data-title="–">е</big> и поэтому все они сильные восстановители, отдающие 2<big class="elektron" data-title="–">е</big>, степень их окисления равна '''+2''', .металлические свойства увеличиваются сверху вниз. |
Реагируют с водородом, кислородом, серой, хлором. Бурно реагируют с водой.</div> | Реагируют с водородом, кислородом, серой, хлором. Бурно реагируют с водой.</div> | ||
Оксид кальция при реакции с водой образует гашеную известь, широко применяемую в строительстве | Оксид кальция при реакции с водой образует гашеную известь, широко применяемую в строительстве | ||
| − | Щелочноземельные металлы образуют '''''«Жесткость воды»''''' – совокупность свойств, обусловленных содержанием в воде катионов кальция (Ca<sup>2+</sup>) и магния (Mg<sup>2+</sup>). В жесткой воде, с высоким содержанием (Ca<sup>2+</sup>) и ( Mg<sup>2+</sup>) плохо пенится мыло, образуя нерастворимые соли высших карбоновых кислот, плохо заваривается чай и разваривается мясо. Жесткая вода не пригодна для | + | Щелочноземельные металлы образуют '''''«Жесткость воды»''''' – совокупность свойств, обусловленных содержанием в воде катионов кальция (Ca<sup>2+</sup>) и магния (Mg<sup>2+</sup>). В жесткой воде, с высоким содержанием (Ca<sup>2+</sup>) и ( Mg<sup>2+</sup>) плохо пенится мыло, образуя нерастворимые соли высших карбоновых кислот, плохо заваривается чай и разваривается мясо. Жесткая вода не пригодна для охлаждения двигателей внутреннего сгорания и питания паровых котлов, так как в них образуется накипь. При использовании жесткой воды в пищу могут образовываться камни в почках. Умягчают жесткую воду кипячением, добавлением гашеной извести или соды. Современный способ умягчения воды основан на использовании ионно-обменных смол - катионитов, способных обменивать ионы натрия на ионы кальция и задерживать их. |
Кальций – основной компонент костных тканей и зубов. | Кальций – основной компонент костных тканей и зубов. | ||
| Строка 56: | Строка 56: | ||
==Алюминий== | ==Алюминий== | ||
| − | {{right|[[file: | + | {{right|[[file:Al.jpg|150px|link=]]}} |
| − | '''Алюминий <span class="metall">(Al)</span> - элемент - III А группы,''' | + | '''Алюминий <span class="metall">(Al)</span> - элемент - III А группы,''' содержащий 3<big>е</big> на внешнем электронном уровне проявляет валентность равную трем и степень окисления '''+3''', электроотрицательность равную '''1,5''', и амфотерные свойства, то есть его соединения проявляют свойства как кислот, так и оснований. Алюминий - типичный и самый распространенный в земной коре металл (8,8%). В свободном виде в природе не встречается, а только в виде алюмосиликатов: Na<sub>2</sub>O • AL<sub>2</sub>O<sub>3</sub> • 2SiO<sub>2</sub> - нефелин, K<sub>2</sub>O • Al<sub>2</sub>O<sub>3</sub> • 6SiO<sub>2</sub> - ортоклаз (полевой шпат), Al<sub>2</sub>O<sub>3</sub> • 2SiO<sub>2</sub> • 2H<sub>2</sub>O - каолинит (глина), Al<sub>2</sub>O<sub>3</sub> • nH<sub>2</sub>O - боксит, Al<sub>2</sub>O<sub>3</sub> - корунд (глинозем), Na<sub>3</sub>AlF<sub>6</sub> - криолит. |
{{right-p|[[file:Aljuminij-v-prirode.png|350px|Алюминий в природе]]}} | {{right-p|[[file:Aljuminij-v-prirode.png|350px|Алюминий в природе]]}} | ||
'''Корунды, окрашенные солями других металлов являются драгоценными камнями, это – сапфиры, рубины.''' | '''Корунды, окрашенные солями других металлов являются драгоценными камнями, это – сапфиры, рубины.''' | ||
| − | Алюминий легкий серебристо - белый пластичный металл, очень хорошо проводящий электрический ток и тепло. С температурой плавления t(<small>пл</small>) = 660<sup>о</sup>С. | + | Алюминий – легкий серебристо-белый пластичный металл, очень хорошо проводящий электрический ток и тепло. С температурой плавления t(<small>пл</small>) = 660<sup>о</sup>С. |
Алюминий получают электролизом Al<sub>2</sub>O<sub>3</sub> в расплаве криолита | Алюминий получают электролизом Al<sub>2</sub>O<sub>3</sub> в расплаве криолита | ||
| − | <div class="blocktext | + | <div class="blocktext">2Al<sub>2</sub>O<sub>3</sub> <sup><ins>'''''Электролиз, t=950, Na3AlF6'''''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→</span> 4Al+ 3O<sub>2</sub><span style="font-famili:georgia; font-size:1.5em;">↑</span> |
| − | 2Al<sub>2</sub>O<sub>3</sub> <sup><ins>'''''Электролиз, t=950, Na3AlF6'''''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→</span> 4Al+ 3O<sub>2</sub><span style="font-famili:georgia; font-size:1.5em;">↑</span> | ||
</div> | </div> | ||
{{left|[[file:Sequence 01.mp4|300px]]}} | {{left|[[file:Sequence 01.mp4|300px]]}} | ||
| − | На поверхности алюминия образуется защитная пленка его оксида Al<sub>2</sub>O<sub>3</sub> толщиной 10<sup>–5</sup>м, однако она столь прочна, что предохраняет алюминий от дальнейшего окисления, т. к. Al<sub>2</sub>O<sub>3</sub> не реагирует с водой. Лишенный оксидной пленки, что достигается использованием амальгамы алюминия (сплава алюминия с ртутью), реагирует с кислородом, водородом, хлором, серой и углеродом, а также с водой. | + | На поверхности алюминия образуется защитная пленка его оксида Al<sub>2</sub>O<sub>3</sub> толщиной 10<sup>–5</sup>м, однако она столь прочна, что предохраняет алюминий от дальнейшего окисления, т. к. Al<sub>2</sub>O<sub>3</sub> не реагирует с водой. Лишенный оксидной пленки, что достигается использованием амальгамы алюминия (сплава алюминия с ртутью), алюминий реагирует с кислородом, водородом, хлором, серой и углеродом, а также с водой. |
Как амфотерный металл алюминий реагирует с щелочью | Как амфотерный металл алюминий реагирует с щелочью | ||
| Строка 85: | Строка 84: | ||
<ul class="small-block-grid-1 large-block-grid-2"> | <ul class="small-block-grid-1 large-block-grid-2"> | ||
<li>Железо является четвертым элементом по распространенности среди химических элементов по массовой доле (4,7-6,0%) и вторым среди металлов, уступая лишь алюминию. Железо относится к металлам, известным с глубокой древности. Сначала с ним познакомились в Египте, Месопотамии во 2 тысячелетии до нашей эры, затем в Закавказье, Малой Азии, и Древней Греции. Самородное железо – редкость, в основном метеоритного происхождения.</li> | <li>Железо является четвертым элементом по распространенности среди химических элементов по массовой доле (4,7-6,0%) и вторым среди металлов, уступая лишь алюминию. Железо относится к металлам, известным с глубокой древности. Сначала с ним познакомились в Египте, Месопотамии во 2 тысячелетии до нашей эры, затем в Закавказье, Малой Азии, и Древней Греции. Самородное железо – редкость, в основном метеоритного происхождения.</li> | ||
| − | <li>{{center-p|[[file: | + | <li>{{center-p|[[file:Meteorit.png|300px|Железный самородок космического происхождения]]}}</li> |
| + | <li>{{center|[[file:Ролик-5 сайт.mp4]]}}</li> | ||
| + | <li>{{center-p|[[file:Fe.jpg|300px|Сталелитейный цех]]}}</li> | ||
</ul> | </ul> | ||
| − | + | ||
В природе железо находится в связанном виде, входит в состав горных пород, а также содержится в живых организмах. | В природе железо находится в связанном виде, входит в состав горных пород, а также содержится в живых организмах. | ||
Fe<sub>2</sub>O<sub>3</sub> • 3H<sub>2</sub>O – бурый железняк, лимонит ; Fe<sub>2</sub>O<sub>3</sub> – красный железняк, гематит; Fe<sub>3</sub>O<sub>4</sub> – магнитный железняк, магнетит; FeS<sub>2</sub> – железный колчедан, пирит. | Fe<sub>2</sub>O<sub>3</sub> • 3H<sub>2</sub>O – бурый железняк, лимонит ; Fe<sub>2</sub>O<sub>3</sub> – красный железняк, гематит; Fe<sub>3</sub>O<sub>4</sub> – магнитный железняк, магнетит; FeS<sub>2</sub> – железный колчедан, пирит. | ||
| − | Железо – серебристо-белый, пластичный, относительно мягкий металл tпл 1539<sup>о</sup>С, плотность при 20<sup>о</sup>С – 7,87 г/см<sup>3</sup> При t<sup>o</sup> ниже 768<sup>о</sup>С железо ферромагнитно, хорошо подвергается сварке, ковке, прокатке. Проявляет степени окисления''': +2, +3, +6'''. Во влажном воздухе железо окисляется (ржавеет),образуя соединения Fe<sup>+2</sup> и Fe<sup>+3</sup>. Железо | + | Железо – серебристо-белый, пластичный, относительно мягкий металл tпл 1539<sup>о</sup>С, плотность при 20<sup>о</sup>С – 7,87 г/см<sup>3</sup> При t<sup>o</sup> ниже 768<sup>о</sup>С железо ферромагнитно, хорошо подвергается сварке, ковке, прокатке. Проявляет степени окисления''': +2, +3, +6'''. Во влажном воздухе железо окисляется (ржавеет),образуя соединения Fe<sup>+2</sup> и Fe<sup>+3</sup>. Железо – металл амфотерный. |
{{left|[[file:P8 1.png|300px|link=]]}} | {{left|[[file:P8 1.png|300px|link=]]}} | ||
С разбавленными кислотами железо образует соединения со степенью окисления '''+2''', концентрированная азотная кислота железо пассивирует, Взаимодействует с неметаллами: кислородом, хлором, серой. | С разбавленными кислотами железо образует соединения со степенью окисления '''+2''', концентрированная азотная кислота железо пассивирует, Взаимодействует с неметаллами: кислородом, хлором, серой. | ||
| − | Для определения железа используют реактивы, дающие с ним характерную окраску, с | + | Для определения железа используют реактивы, дающие с ним характерную окраску, с Fe<sup>3+</sup> образуется изумрудный оттенок берлинской лазури, с Fe<sup>2+</sup> - комплекс синего цвета - турнбулевая синь. С роданидом калия или аммония трехвалентное железо образует комплекс темно–красного цвета часто используемый в кино под названием «кровь дракона». |
Железо и его сплавы относятся к черным металлам. Это чугун, содержащий более 2% углерода и сталь - сплав железа с содержанием углерода 0,02 – 2.0%. Различают стали, которые содержат примеси Mn, Si, S, P и др. элементов. Они повышают коррозионные свойства сталей. Процесс выплавления железа основан на способности углерода и угарного газа в специальных печах – домнах восстанавливать железо из оксидов железа. | Железо и его сплавы относятся к черным металлам. Это чугун, содержащий более 2% углерода и сталь - сплав железа с содержанием углерода 0,02 – 2.0%. Различают стали, которые содержат примеси Mn, Si, S, P и др. элементов. Они повышают коррозионные свойства сталей. Процесс выплавления железа основан на способности углерода и угарного газа в специальных печах – домнах восстанавливать железо из оксидов железа. | ||
| Строка 126: | Строка 127: | ||
:{{bib|'''Прокатка''' – горячая обработка металла путем давления, обжима его между вращающимися валами в особых станах для придания ему нужной формы.}} | :{{bib|'''Прокатка''' – горячая обработка металла путем давления, обжима его между вращающимися валами в особых станах для придания ему нужной формы.}} | ||
:{{bib|'''Реакционноспособный''' - характеристика относительной химической активности молекул, атомов, ионов.}} | :{{bib|'''Реакционноспособный''' - характеристика относительной химической активности молекул, атомов, ионов.}} | ||
| − | |||
:{{bib|'''Сварка''' – соединение, заполнением промежутков расплавленным металлом.}} | :{{bib|'''Сварка''' – соединение, заполнением промежутков расплавленным металлом.}} | ||
:{{bib|'''Сплавы''' – системы, состоящие из двух или более металлов и неметаллов, обладающие характерными свойствами металлов.}} | :{{bib|'''Сплавы''' – системы, состоящие из двух или более металлов и неметаллов, обладающие характерными свойствами металлов.}} | ||
| + | :{{bib|'''Теплопроводность''' - свойство тел передавать тепло.}} | ||
:{{bib|'''Ферромагнитный материал''' — магнитный материал Металлический материал в твердом состоянии, способный намагничиваться под действием внешнего магнитного поля и частично сохранять приобретенную намагниченность после удаления внешнего поля.}} | :{{bib|'''Ферромагнитный материал''' — магнитный материал Металлический материал в твердом состоянии, способный намагничиваться под действием внешнего магнитного поля и частично сохранять приобретенную намагниченность после удаления внешнего поля.}} | ||
:{{bib|'''Щелочные металлы''' называют так, потому что при реакции с водой они образуют щелочи - растворимые основания.}} | :{{bib|'''Щелочные металлы''' называют так, потому что при реакции с водой они образуют щелочи - растворимые основания.}} | ||
| Строка 149: | Строка 150: | ||
* {{bib|«Энциклопедия для детей». Химия т. 17 Изд. дом «Аванта».2000г.}} | * {{bib|«Энциклопедия для детей». Химия т. 17 Изд. дом «Аванта».2000г.}} | ||
==== Книги ==== | ==== Книги ==== | ||
| − | |||
| − | |||
* {{bib|В.А.Волков, Е.В. Вонский, Г.И. Кузнецова. «Выдающиеся химики мира», М. «Высшая школа», 1991 г.}} | * {{bib|В.А.Волков, Е.В. Вонский, Г.И. Кузнецова. «Выдающиеся химики мира», М. «Высшая школа», 1991 г.}} | ||
| − | * {{bib| | + | * {{bib|В.А.Крицман «Книга для чтения по неорганической химии», М. «Просвещение», 1974 г.}} |
| − | * {{bib| | + | * {{bib|Варкентина Н.А., Дженлода Р.Х. «Химические элементы в школьном курсе химии». «Азиятехнографика». Бишкек, 2010 г.}} |
* {{bib|Книга для чтения по химии. 1 ч. Гос. Изд. Минпроса РСФСР, М. 1960 г.}} | * {{bib|Книга для чтения по химии. 1 ч. Гос. Изд. Минпроса РСФСР, М. 1960 г.}} | ||
* {{bib|Книга для чтения по химии. 2 ч. Гос. Изд. Минпроса РСФСР, М. 1961 г.}} | * {{bib|Книга для чтения по химии. 2 ч. Гос. Изд. Минпроса РСФСР, М. 1961 г.}} | ||
| − | * {{bib| | + | * {{bib|М. Фримантл. «Химия в действии», 2 ч. М. «Мир», 1991г.}} |
| + | * {{bib|П.Р. Таубе, Е.И.Руденко. «От водорода до …?» «Высшая школа», 1964 г.}} | ||
| + | * {{bib|Популярная библиотека химических элементов. Ред. Акад. И.В. Петрянов – Соколов. М. «Наука», 1983 г.}} | ||
* {{bib|Э. Гроссе, Х. Вайсмантель «Химия для пюбознательных» Ленинград. «Химия» 1985 г.}} | * {{bib|Э. Гроссе, Х. Вайсмантель «Химия для пюбознательных» Ленинград. «Химия» 1985 г.}} | ||
| + | * {{bib|Ю.И. Соловьев,Д.Н. Трифонов, А.Н. Шамин «История химии», М. «Просвещение», 1984 г.}} | ||
* {{bib|«Я познаю мир». Детская энциклопедия. Химия. М. АСТ 1995 г.}} | * {{bib|«Я познаю мир». Детская энциклопедия. Химия. М. АСТ 1995 г.}} | ||
| − | |||
====Учебные пособия==== | ====Учебные пособия==== | ||
| Строка 170: | Строка 171: | ||
<div class="large-4 medium-5 columns"> | <div class="large-4 medium-5 columns"> | ||
<!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | <!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | ||
| − | <div class=" | + | <div class="sbstyle"> |
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric | + | <div class="large-10 small-10 large-centered small-centered columns rubric">Химия в лицах</div> |
</div> | </div> | ||
| − | <span class="firstcharacter">А</span>нглийский торговец Бэйкер завещал свое состояние Королевскому научному обществу на выплату тому, кто прочтет «доклад о выдающемся открытии» В ноябре 1807 года Гэмфри Дэви | + | <span class="firstcharacter">А</span>нглийский торговец Бэйкер завещал свое состояние Королевскому научному обществу на выплату тому, кто прочтет «доклад о выдающемся открытии». В ноябре 1807 года эту премию получил Гэмфри Дэви после доклада о получении калия и натрия путем разложения щелочей действием электрического тока. Позже он выделил и получил барий, магний, кальций и стронций. Дэви стал основателем электрохимии. |
| − | Он сумел | + | Он сумел доказать опьяняющее действие веселящего газа на организм. |
| − | + | {{center-p|[[файл:Gemfi devi.jpg|220px|Гемфри Дэви на портрете работы Томаса Филлипса]]}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
Из практических изобретений надо выделить безопасную для взрыва метана шахтерскую лампу, которой пользовались долгие годы до введения в шахтах электрического освещения. | Из практических изобретений надо выделить безопасную для взрыва метана шахтерскую лампу, которой пользовались долгие годы до введения в шахтах электрического освещения. | ||
| Строка 193: | Строка 188: | ||
Похоронен в Вестминстерском аббатстве в Лондоне, на месте захоронения выдающихся людей Англии. В его честь Лондонское Королевское общество учредило награду для учёных — медаль Дэви. | Похоронен в Вестминстерском аббатстве в Лондоне, на месте захоронения выдающихся людей Англии. В его честь Лондонское Королевское общество учредило награду для учёных — медаль Дэви. | ||
| + | </div> | ||
| + | <div class="sbstyle" style="margin-top:20px;"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Химия в лицах</div> | ||
| + | </div> | ||
| + | {{center-p|[[file:Kurnakov.jpg|280px|Академик Курнаков Николай Семенович]]}} | ||
| + | |||
| + | |||
| + | Советский химик. Разработал физико-химический анализ растворов и сплавов металлов. Для анализа состава сплавов он создал новые методы и приборы. | ||
| + | ---- | ||
| + | {{center-p|[[file:Chernov.jpg|280px|Заслуги Дмитрия Константиновича Чернова перед наукой огромны. Он выражал новые, передовые идеи в области металлургии.]]}} | ||
| + | |||
| + | |||
| + | Русский металлург. Разработал в 1868 году наилучшие условия отливки, ковки и термической обработки стали. С тех пор стальные орудия вытеснили бронзовые. Предсказал преимущества применения кислородного дутья в конвекторном процессе. | ||
| + | ---- | ||
| + | {{center-p|[[file:Anosov.jpg|280px|Павел Петрович Аносов в чине генерал-майора. Портрет 1851 года.]]}} | ||
| + | |||
| + | |||
| + | Русский металлург, горный инженер. Он был первым исследователем, применившим еще в 1831 году микроскоп для изучения структуры стали. Изобрел способ закалки стальных изделий в струе сжатого воздуха. Получил литую сталь и усовершенствовал многие заводские механизмы. | ||
</div> | </div> | ||
<!-- Второй элемент сайдбара --> | <!-- Второй элемент сайдбара --> | ||
| Строка 201: | Строка 215: | ||
{{step |symb=1 }}Из 1 кг гидрида лития можно получить 2800 литров водорода, столько его содержит 40 кг баллон под давлением 120-150 атмосфер. | {{step |symb=1 }}Из 1 кг гидрида лития можно получить 2800 литров водорода, столько его содержит 40 кг баллон под давлением 120-150 атмосфер. | ||
| − | {{step |symb=2 }}Солью, извлеченной из морской воды можно было бы засыпать всю сушу | + | {{step |symb=2 }}Солью, извлеченной из морской воды можно было бы засыпать всю сушу слоем в 130 метров. |
{{step |symb=3 }}В состав жидкого мыла входит калий. | {{step |symb=3 }}В состав жидкого мыла входит калий. | ||
| Строка 208: | Строка 222: | ||
{{step |symb=5 }}Сплав 76% калия и 24% натрия жидкий и затвердевает при минус 12 градусов Цельсия. | {{step |symb=5 }}Сплав 76% калия и 24% натрия жидкий и затвердевает при минус 12 градусов Цельсия. | ||
| + | |||
| + | {{step |symb=5 }}Известно, что при использовании сильных окислителей была достигнута степень окисления железа +8. | ||
</div> | </div> | ||
<!-- третий элемент сайдбара викторины игры тесты --> | <!-- третий элемент сайдбара викторины игры тесты --> | ||
| Строка 247: | Строка 263: | ||
</quiz> | </quiz> | ||
</div> | </div> | ||
| − | <div class=" | + | |
| + | <div class="sbstyle" style="margin-top:20px;"> | ||
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric | + | <div class="large-10 small-10 large-centered small-centered columns rubric">В этом видео вы узнаете как сварить яйца без огня</div> |
</div> | </div> | ||
| − | |||
{{center|[[file:Lifehack.mp4|280px]]}} | {{center|[[file:Lifehack.mp4|280px]]}} | ||
</div> | </div> | ||
| − | <div class=" | + | |
| + | <div class="sbstyle"> | ||
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric" style=" | + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Пройди тестирование</div> |
| + | </div> | ||
| + | <div align="center" class="test_div_hover" style="width:300px; height:auto; float:non; text-indent:0"><span class="test_hover_state"></span> [[file:Corbis.jpg|class=testirovanie|Пройди тестирование|link=]]</div>> | ||
</div> | </div> | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
</div> | </div> | ||
| + | {{lang|:KR:Химия: Металлдар}} | ||
Текущая версия на 09:45, 22 октября 2018
Содержание
Общие свойства металлов
К металлам относят элементы, имеющие 1, 2, 3 электрона на внешнем уровне. (Кроме водорода, гелия и бора). Металлы располагаются в главных и побочных подгруппах ПСЭ). Им свойственны высокая тепло- и электропроводность, пластичность, т.е. они подвергаются ковке, прокатке и вытягиванию в проволоку. Все металлы при обычной температуре твердые, кроме ртути, имеют металлический блеск и окрашены в золотисто-красноватые, серебристо-серые, тона и даже с синеватым отливом.
Причина этих свойств кроется в строении атомов металлов и природе их кристаллических решеток, в узлах которых располагаются как нейтральные атомы, так и положительно заряженные ионы. А электроны, оторванные от ионов (электронный газ), располагаются в межузловом пространстве. Типичные металлы- восстановители, но могут проявлять и амфотерные свойства. Металлы объединяют по свойствам в щелочные (), щелочно-земельные (), цветные (), черные и его сплавы), благородные (), легкие с плотностью ниже 5 г/см3 и тяжелые, если плотность выше. Плотность металлов колеблется в пределах 0, 53 г/см3 у лития до 22, 7 г/см3 у осмия.
Наибольшее значение приобретают сплавы металлов различного типа - смеси нескольких металлов и неметаллов, в которых резко меняются индивидуальные свойства металлов. Могут быть твердые растворы, интерметаллиды, механические смеси. Сплавы прочнее, более тугоплавки, или температура плавления сильно падает, кислото-щелочеупорные, устойчивы к истиранию или приобретают иные свойства.
Щелочные металлы
Металлы называются щелочными, так как при реакции с водой атомы этих металлов образуют щелочи – растворимые в воде основания. У всех щелочных металлов заполняется S- электронный слой по 1е, поэтому проявляются только металлические свойства восстановителей, степень окисления элементов равна +1 и валентность равна 1. Температуры плавления t(пл) низки, цезий способен расплавится от тепла человеческой руки t(пл) = 28,5 оС.
Соли этих металлов окрашивают пламя в характерные цвета (разноцветие салюта): литий - алый, натрий - желтый, калий – фиолетовый, рубидий – красный, цезий - голубой.
Франций – радиоактивный элемент с нестабильными изотопами.
Щелочные металлы в свободном виде не встречаются из-за высокой реакционной способности, а только в виде солей. Самая распространенная из них NaCl (каменная соль, поваренная соль, галит). А вот соду (Na2CO3) человечество знало издревле, о ней упоминается даже в Библии. Огромную роль в истории человечества сыграла калийная селитра (KNO3), так как входила в состав пороха. Щелочные металлы получают электролизом расплава хлоридов или гидроксидов этих металлов.
Все щелочные металлы очень мягкие, имеют небольшую плотность. Литий (0,53 г/см3) и натрий (0,97 г/см3) легче воды и плавают на ее поверхности, реагируя с ней.
Все щелочные металлы серебристо белого цвета, хорошо проводят тепло и электрический ток. Мягкие, режутся ножом.
Все щелочные металлы очень реакционноспособны. Поэтому их хранят под слоем керосина.
Щелочные металлы реагируют с водородом, серой, углеродом и хлором. Калий и натрий с кислородом образуют пероксиды (Na2O2), а калий даже сверхоксид (KO2); при реакции с водой образуют гидроксиды - щелочи (LiOH, NaOH, KOH).
Щелочноземельные металлы
называют щелочноземельными металлами, так как их гидроксиды в водном растворе обладают щелочными свойствами, а их оксиды по своей тугоплавкости сходны с оксидами тяжелых металлов, называвшихся «землями».
–магний, – кальций, – стронций, – барий проявляют свойства типичных металлов. Все металлы серебристо-белого цвета, тепло- и электропроводны, их плотность увеличивается сверху вниз, а температура плавления уменьшается. Их хранят под слоем керосина, как щелочные металлы, чтобы предохранить от быстрого окисления кислородом воздуха. Металлы мягкие, режутся ножом. Окрашивают пламя в характерные цвета.
Оксид кальция при реакции с водой образует гашеную известь, широко применяемую в строительстве
Щелочноземельные металлы образуют «Жесткость воды» – совокупность свойств, обусловленных содержанием в воде катионов кальция (Ca2+) и магния (Mg2+). В жесткой воде, с высоким содержанием (Ca2+) и ( Mg2+) плохо пенится мыло, образуя нерастворимые соли высших карбоновых кислот, плохо заваривается чай и разваривается мясо. Жесткая вода не пригодна для охлаждения двигателей внутреннего сгорания и питания паровых котлов, так как в них образуется накипь. При использовании жесткой воды в пищу могут образовываться камни в почках. Умягчают жесткую воду кипячением, добавлением гашеной извести или соды. Современный способ умягчения воды основан на использовании ионно-обменных смол - катионитов, способных обменивать ионы натрия на ионы кальция и задерживать их.
Кальций – основной компонент костных тканей и зубов.
Алюминий

Алюминий - элемент - III А группы, содержащий 3е на внешнем электронном уровне проявляет валентность равную трем и степень окисления +3, электроотрицательность равную 1,5, и амфотерные свойства, то есть его соединения проявляют свойства как кислот, так и оснований. Алюминий - типичный и самый распространенный в земной коре металл (8,8%). В свободном виде в природе не встречается, а только в виде алюмосиликатов: Na2O • AL2O3 • 2SiO2 - нефелин, K2O • Al2O3 • 6SiO2 - ортоклаз (полевой шпат), Al2O3 • 2SiO2 • 2H2O - каолинит (глина), Al2O3 • nH2O - боксит, Al2O3 - корунд (глинозем), Na3AlF6 - криолит.
Корунды, окрашенные солями других металлов являются драгоценными камнями, это – сапфиры, рубины.
Алюминий – легкий серебристо-белый пластичный металл, очень хорошо проводящий электрический ток и тепло. С температурой плавления t(пл) = 660оС.
Алюминий получают электролизом Al2O3 в расплаве криолита
На поверхности алюминия образуется защитная пленка его оксида Al2O3 толщиной 10–5м, однако она столь прочна, что предохраняет алюминий от дальнейшего окисления, т. к. Al2O3 не реагирует с водой. Лишенный оксидной пленки, что достигается использованием амальгамы алюминия (сплава алюминия с ртутью), алюминий реагирует с кислородом, водородом, хлором, серой и углеродом, а также с водой.
Как амфотерный металл алюминий реагирует с щелочью
образуя метаалюминат натрия.
Образует AlH3 - гидрид алюминия, Al2O3 - оксид алюминия, Al(OH)3 - гидроксид алюминия.
Особенно ценны сплавы алюминия, которые широко используются в авиастроении, машиностроении и судостроении: дюралюмин (Al + 5%Cu + 2%Mg), силумин (Al + Si), «Термит» - смесь оксида (Fe3O4) с порошком алюминия. При его использовании выделяется огромная температура, это свойство используется при термитной сварке металлов. 8Al +3Fe3O4 = 4Al2O3 + 9Fe + ΔH 853,5 кДж/моль
Железо
- Железо является четвертым элементом по распространенности среди химических элементов по массовой доле (4,7-6,0%) и вторым среди металлов, уступая лишь алюминию. Железо относится к металлам, известным с глубокой древности. Сначала с ним познакомились в Египте, Месопотамии во 2 тысячелетии до нашей эры, затем в Закавказье, Малой Азии, и Древней Греции. Самородное железо – редкость, в основном метеоритного происхождения.
В природе железо находится в связанном виде, входит в состав горных пород, а также содержится в живых организмах.
Fe2O3 • 3H2O – бурый железняк, лимонит ; Fe2O3 – красный железняк, гематит; Fe3O4 – магнитный железняк, магнетит; FeS2 – железный колчедан, пирит.
Железо – серебристо-белый, пластичный, относительно мягкий металл tпл 1539оС, плотность при 20оС – 7,87 г/см3 При to ниже 768оС железо ферромагнитно, хорошо подвергается сварке, ковке, прокатке. Проявляет степени окисления: +2, +3, +6. Во влажном воздухе железо окисляется (ржавеет),образуя соединения Fe+2 и Fe+3. Железо – металл амфотерный.
С разбавленными кислотами железо образует соединения со степенью окисления +2, концентрированная азотная кислота железо пассивирует, Взаимодействует с неметаллами: кислородом, хлором, серой.
Для определения железа используют реактивы, дающие с ним характерную окраску, с Fe3+ образуется изумрудный оттенок берлинской лазури, с Fe2+ - комплекс синего цвета - турнбулевая синь. С роданидом калия или аммония трехвалентное железо образует комплекс темно–красного цвета часто используемый в кино под названием «кровь дракона».
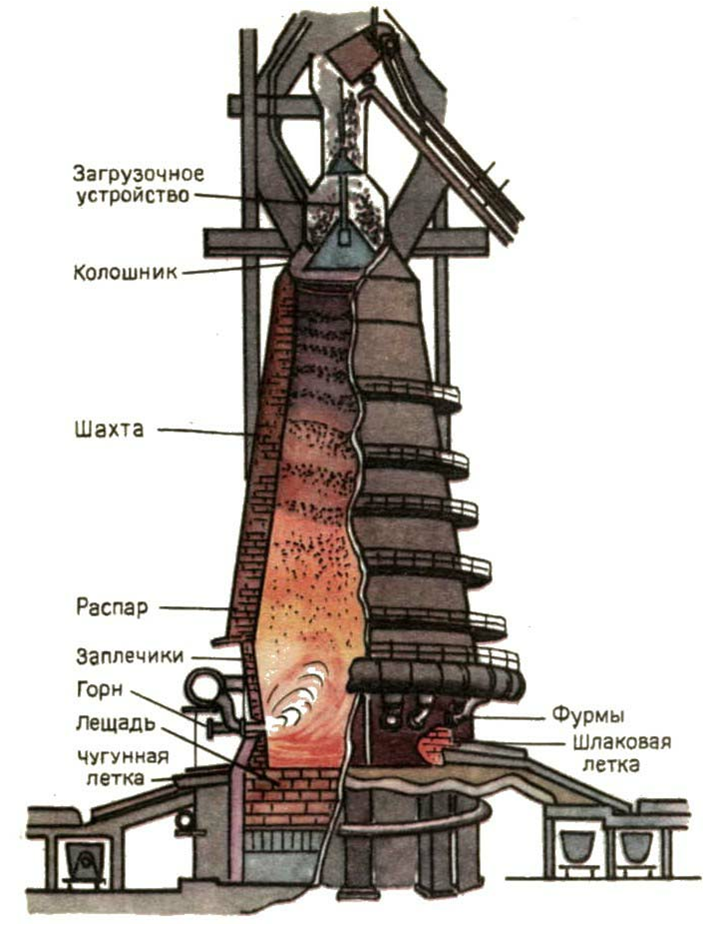
Железо и его сплавы относятся к черным металлам. Это чугун, содержащий более 2% углерода и сталь - сплав железа с содержанием углерода 0,02 – 2.0%. Различают стали, которые содержат примеси Mn, Si, S, P и др. элементов. Они повышают коррозионные свойства сталей. Процесс выплавления железа основан на способности углерода и угарного газа в специальных печах – домнах восстанавливать железо из оксидов железа.
Полезные ссылки
Глоссарий
- Аквакомплексы – комплексы, включающие в состав молекулы воды – или кристаллогидраты.
- «Алкали» по арабски – «зола», «щелочь».
- Алюминотермия - способ получения металлов и неметаллов восстановлением их окислов металлическим алюминием.
- Амфотерность - способность проявлять как кислотные, так и основные свойства.
- Благородные металлы – золото, платина, серебро, рутений, родий, палладий, осмий, иридий.
- Гидроксиды – неорганические соединения, содержащие в составе гидроксильную группу. Производные оксидов и воды.
- Интерметаллиды – химические соединения металлов друг с другом, не подчиняющиеся законам постоянства состава.
- Ковка - придавать форму ударами молота., усиливается при нагревании.
- Кокс - твердый пористый продукт, полученный прокаливанием каменного угля без доступа воздуха. Применяется для выплавки чугуна.
- Коррозия металлов - разрушение металлов под воздействием окружающей среды.
- Металлы – простые вещества и сплавы, обладающие особым блеском, ковкостью, хорошей теплопроводностью и электропроводностью и имеющие 1,2, 3 электрона на внешнем уровне.
- Намагничиваемость - магнитная восприимчивость.
- Неметаллы – химически простое вещество не имеющие характерных для металлов свойств.
- Основания – вещества, молекулы которых состоят из атомов металлов и одной или нескольких гидроксильных групп.
- Опаловый – имеющий молочно-белый цвет с радужными оттенками.
- Пассивирование металлов - образование на повехности металла защитного слоя при действии окислителя.
- Пластичность - способность изменять форму под давлением при обычных и повышенных температурах не разрушаясь.
- Пероксиды – химические соединения, в которых атомы кислорода связаны друг с другом и с атомом другого элемента.
- Плотность - отношение массы к объему.
- Прокатка – горячая обработка металла путем давления, обжима его между вращающимися валами в особых станах для придания ему нужной формы.
- Реакционноспособный - характеристика относительной химической активности молекул, атомов, ионов.
- Сварка – соединение, заполнением промежутков расплавленным металлом.
- Сплавы – системы, состоящие из двух или более металлов и неметаллов, обладающие характерными свойствами металлов.
- Теплопроводность - свойство тел передавать тепло.
- Ферромагнитный материал — магнитный материал Металлический материал в твердом состоянии, способный намагничиваться под действием внешнего магнитного поля и частично сохранять приобретенную намагниченность после удаления внешнего поля.
- Щелочные металлы называют так, потому что при реакции с водой они образуют щелочи - растворимые основания.
- Щелочи - растворимые основания.
- Щелочноземельные металлы – от слов «щелочной», «землями» называли руды металлов.
- Электролиз – разложение веществ при прохождении через них постоянного электрического тока.
- Электропроводность – способность проводить электричество.
Библиография
Справочники
- Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.
- Р.А. Лидин Справочник по общей и неорганической химии. М. «Просвещение» 1997г.
- И.Т. Гороновский, Ю.П. Назаренко, Е.Ф. Некряч. Киев, «Наукова думка», 1974г.
- Джейн Верзейм, Крис Окслейд и д-р Джон Ватерхаус .Химия. Школьный иллюстрированный справочник (пер. с англ.), М. «Росмэн», 1995г.
- Л.Л.Андреева, Д.Ю. Добротин, О.С. Габриелян и др. ХИМИЯ, «Большой справочник для школьников и поступающих в вузы», М. «Дрофа», 2004г.
- Химия. Справочник школьника. Центр гуманитарных наук при факультете журналистики МГУ им. М.В. Ломоносова. М. 1997 г.
- «Хочу все знать» Сб. Ленинград»Детская литература».1987 г.
- «Что такое. Кто такой». Изд. «Педагогика» М. 1990 г.
- «Энциклопедия для детей». Химия т. 17 Изд. дом «Аванта».2000г.
Книги
- В.А.Волков, Е.В. Вонский, Г.И. Кузнецова. «Выдающиеся химики мира», М. «Высшая школа», 1991 г.
- В.А.Крицман «Книга для чтения по неорганической химии», М. «Просвещение», 1974 г.
- Варкентина Н.А., Дженлода Р.Х. «Химические элементы в школьном курсе химии». «Азиятехнографика». Бишкек, 2010 г.
- Книга для чтения по химии. 1 ч. Гос. Изд. Минпроса РСФСР, М. 1960 г.
- Книга для чтения по химии. 2 ч. Гос. Изд. Минпроса РСФСР, М. 1961 г.
- М. Фримантл. «Химия в действии», 2 ч. М. «Мир», 1991г.
- П.Р. Таубе, Е.И.Руденко. «От водорода до …?» «Высшая школа», 1964 г.
- Популярная библиотека химических элементов. Ред. Акад. И.В. Петрянов – Соколов. М. «Наука», 1983 г.
- Э. Гроссе, Х. Вайсмантель «Химия для пюбознательных» Ленинград. «Химия» 1985 г.
- Ю.И. Соловьев,Д.Н. Трифонов, А.Н. Шамин «История химии», М. «Просвещение», 1984 г.
- «Я познаю мир». Детская энциклопедия. Химия. М. АСТ 1995 г.
Учебные пособия
- Химия. Пособие-репетитор для поступающих в вузы. Ред. В.Н. Чернышов, А.С.Егоров, Ростов-на-Дону, «Феникс»,1997г.
Методические пособия
- М.В. Горский. Обучение основам общей химии. М. «Просвещение», 1991 г.
Английский торговец Бэйкер завещал свое состояние Королевскому научному обществу на выплату тому, кто прочтет «доклад о выдающемся открытии». В ноябре 1807 года эту премию получил Гэмфри Дэви после доклада о получении калия и натрия путем разложения щелочей действием электрического тока. Позже он выделил и получил барий, магний, кальций и стронций. Дэви стал основателем электрохимии.
Он сумел доказать опьяняющее действие веселящего газа на организм.
Из практических изобретений надо выделить безопасную для взрыва метана шахтерскую лампу, которой пользовались долгие годы до введения в шахтах электрического освещения.
Дэви работал в Пневматическом институте в Бристоле, и хотя у него было только среднее образование, он стал с 1802 профессором Королевского института.
В 1805 году Французская академия наук присудила ему премию в 3000 франков. В 1812 году Дэви в возрасте 34 лет за научные работы был посвящён в рыцари. Член множества научных организаций, в том числе иностранный почётный член Петербургской АН (1826 год).
В 1826 году Дэви поразил первый апоплексический удар, а 29 мая 1829 года на пути в Англию из Европы Дэви поразил второй удар, от которого он и умер на пятьдесят первом году жизни в Женеве.
Похоронен в Вестминстерском аббатстве в Лондоне, на месте захоронения выдающихся людей Англии. В его честь Лондонское Королевское общество учредило награду для учёных — медаль Дэви.
Советский химик. Разработал физико-химический анализ растворов и сплавов металлов. Для анализа состава сплавов он создал новые методы и приборы.
Русский металлург. Разработал в 1868 году наилучшие условия отливки, ковки и термической обработки стали. С тех пор стальные орудия вытеснили бронзовые. Предсказал преимущества применения кислородного дутья в конвекторном процессе.
Русский металлург, горный инженер. Он был первым исследователем, применившим еще в 1831 году микроскоп для изучения структуры стали. Изобрел способ закалки стальных изделий в струе сжатого воздуха. Получил литую сталь и усовершенствовал многие заводские механизмы.
1 Из 1 кг гидрида лития можно получить 2800 литров водорода, столько его содержит 40 кг баллон под давлением 120-150 атмосфер.
2 Солью, извлеченной из морской воды можно было бы засыпать всю сушу слоем в 130 метров.
3 В состав жидкого мыла входит калий.
4 Каждую секунду в организме человека распадается 5000 атомов радиоактивного изотопа калия, которого в нем содержится около 0,003 грамма.
5 Сплав 76% калия и 24% натрия жидкий и затвердевает при минус 12 градусов Цельсия.
5 Известно, что при использовании сильных окислителей была достигнута степень окисления железа +8.
Попробуйте ответить правильно на пять вопросов: