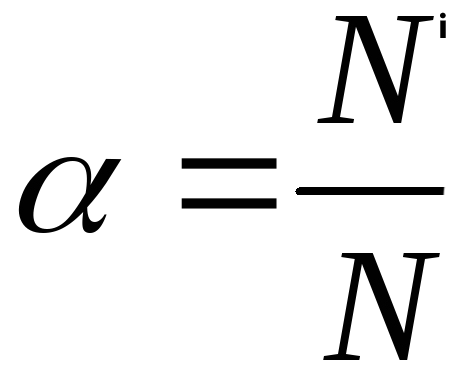Химия: Электролитическая диссоциация — различия между версиями
Admine2 (обсуждение | вклад) (→Буферные растворы) |
Admine2 (обсуждение | вклад) |
||
| (не показаны 84 промежуточные версии этого же участника) | |||
| Строка 1: | Строка 1: | ||
{{Якорь|Начало}} | {{Якорь|Начало}} | ||
<div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | ||
| − | + | ||
== Электролиты и неэлектролиты == | == Электролиты и неэлектролиты == | ||
| − | Хорошо известно, что одни вещества в растворенном или | + | Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора. |
{{left-p|[[file:Apparat ch.png|200px|class=show-for-large-up|Прибор для определения электрической проводимости растворов]]}} | {{left-p|[[file:Apparat ch.png|200px|class=show-for-large-up|Прибор для определения электрической проводимости растворов]]}} | ||
| Строка 21: | Строка 21: | ||
<ul class="large-block-grid-2 small-block-grid-1"> | <ul class="large-block-grid-2 small-block-grid-1"> | ||
| − | <li>{{center-p|[[Файл: | + | <li>{{center-p|[[Файл:Haotich dvijenie.jpg|425px|Хаотическое движение ионов]]}} |
</li> | </li> | ||
| − | <li>{{center-p|[[Файл: | + | <li>{{center-p|[[Файл:Napravlenoe dvij ionov.jpg|425px|Направленное движение ионов]]}} |
</li> | </li> | ||
</ul> | </ul> | ||
| Строка 31: | Строка 31: | ||
{{center|[[file:DissociationMgNo3.png|300px|class=hide-for-large-up|Процесс диссоциации на примере нитрата магния]]}} | {{center|[[file:DissociationMgNo3.png|300px|class=hide-for-large-up|Процесс диссоциации на примере нитрата магния]]}} | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
== Механизм диссоциации == | == Механизм диссоциации == | ||
| Строка 36: | Строка 37: | ||
<li>Существенным является вопрос о механизме электролитической диссоциации. '''Легче всего диссоциируют вещества с ионной связью.''' Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. | <li>Существенным является вопрос о механизме электролитической диссоциации. '''Легче всего диссоциируют вещества с ионной связью.''' Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. | ||
</li> | </li> | ||
| − | <li>{{center-p|[[Файл: | + | <li>{{center-p|[[Файл:Mehanizm disaciacii.png|450px|Механизм электролитической диссоциации (растворение в воде)]]}} |
</li> | </li> | ||
</ul> | </ul> | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
== Диссоциация кислот, оснований и солей в водных растворах == | == Диссоциация кислот, оснований и солей в водных растворах == | ||
| Строка 44: | Строка 47: | ||
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей. | С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей. | ||
| − | <div class="blocktext">Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода | + | <div class="blocktext">Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода</div> |
| − | {{center|H<sub>3</sub>РO<sub>4</sub> {{ArrowLR}} 3H<sup>+</sup> + РO<sub>4</sub><sup>3–</sup> – фосфат ион}} | + | {{center|H<sub>3</sub>РO<sub>4</sub> {{ArrowLR}} 3H<sup>+</sup> + РO<sub>4</sub><sup>3–</sup> – фосфат ион}} |
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами H<sub>3</sub>РO<sub>4</sub> имеются ионы (в последовательно уменьшающихся количествах) | Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами H<sub>3</sub>РO<sub>4</sub> имеются ионы (в последовательно уменьшающихся количествах) | ||
| Строка 61: | Строка 64: | ||
|} | |} | ||
<div class="blocktext">Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например: KOH = K + OH</div> | <div class="blocktext">Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например: KOH = K + OH</div> | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
== Степень диссоциации == | == Степень диссоциации == | ||
| − | {{left-p|[[Файл: | + | {{left-p|[[Файл:Stependisaciacii.png|class=show-for-large-up|150px|Степень диссоциации]]}} |
Поскольку электролитическая диссоциация – процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа '''α'''). Степень диссоциации — это отношение числа распавшихся на ионы молекул N<sup>i</sup> к общему числу растворенных молекул N: | Поскольку электролитическая диссоциация – процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа '''α'''). Степень диссоциации — это отношение числа распавшихся на ионы молекул N<sup>i</sup> к общему числу растворенных молекул N: | ||
| − | {{center|[[Файл: | + | {{center|[[Файл:Stependisaciacii.png|class=hide-for-large-up|150px|Степень диссоциации]]}} |
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если '''α = 0''', то диссоциация отсутствует, а если '''α = 1''' или 100%, то электролит полностью распадается на ионы. Если же '''α = 20%''', то это означает, что из 100 молекул данного электролита 20 распалось на ионы. | Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если '''α = 0''', то диссоциация отсутствует, а если '''α = 1''' или 100%, то электролит полностью распадается на ионы. Если же '''α = 20%''', то это означает, что из 100 молекул данного электролита 20 распалось на ионы. | ||
<ul class="small-block-grid-1 large-block-grid-2"> | <ul class="small-block-grid-1 large-block-grid-2"> | ||
| Строка 75: | Строка 80: | ||
<li>Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита.</li> | <li>Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита.</li> | ||
</ul> | </ul> | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
== Реакции ионного обмена == | == Реакции ионного обмена == | ||
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций — ионными уравнениями. Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер. | Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций — ионными уравнениями. Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер. | ||
| − | <div class="blocktext">При составлении ионных уравнений реакций следует руководствоваться тем, что вещества: | + | <div class="blocktext">При составлении ионных уравнений реакций следует руководствоваться тем, что вещества:*малодиссоциированные (вода),*малорастворимые (выпадающие в осадок)*газообразные записываются в молекулярной форме. </div> |
| − | *малодиссоциированные (вода), | + | {{right-p|[[Файл:Reackcii.png|400px|class=show-for-large-up|Пример реакций с выделением веществ]]}} |
| − | *малорастворимые (выпадающие в осадок) | ||
| − | *газообразные | ||
| − | |||
| − | записываются в молекулярной форме. </div> | ||
| − | {{right-p|[[Файл: | ||
Знак {{Arrowdown}} стоящий при формуле вещества, обозначает, что это вещество уходит из сферы реакции в виде осадка, знак {{ArrowUp}} обозначает, что вещество удаляется из сферы реакции в виде газа. | Знак {{Arrowdown}} стоящий при формуле вещества, обозначает, что это вещество уходит из сферы реакции в виде осадка, знак {{ArrowUp}} обозначает, что вещество удаляется из сферы реакции в виде газа. | ||
| − | {{center|[[Файл: | + | {{center|[[Файл:Reackcii.png|400px|class=hide-for-large-up|Пример реакций с выделением веществ]]}} |
<ul class="small-block-grid-1 large-block-grid-2"> | <ul class="small-block-grid-1 large-block-grid-2"> | ||
<li> | <li> | ||
| Строка 95: | Строка 97: | ||
<li>{{center|[[Файл:IOinfo.png|600px|Реакции ионного обмена]]}}</li> | <li>{{center|[[Файл:IOinfo.png|600px|Реакции ионного обмена]]}}</li> | ||
</ul> | </ul> | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
== Ионное произведение воды. pH раствора == | == Ионное произведение воды. pH раствора == | ||
| Строка 111: | Строка 115: | ||
</ul> | </ul> | ||
<div class="blocktext">Константа K<sub>в</sub>, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и K<sub>в</sub>, при понижении температуры – наоборот. При диссоциации воды на каждый ион Н<sup>+</sup> образуется один ион ОН<sup>–</sup>, следовательно, в чистой воде концентрации этих ионов одинаковы: [Н<sup>+</sup>] = [ОН<sup>–</sup>].</div> | <div class="blocktext">Константа K<sub>в</sub>, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и K<sub>в</sub>, при понижении температуры – наоборот. При диссоциации воды на каждый ион Н<sup>+</sup> образуется один ион ОН<sup>–</sup>, следовательно, в чистой воде концентрации этих ионов одинаковы: [Н<sup>+</sup>] = [ОН<sup>–</sup>].</div> | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
== Гидролиз солей (разложение водой) == | == Гидролиз солей (разложение водой) == | ||
| − | Гидролиз солей – это обменное разложение солей водой. | + | '''''Гидролиз солей – это обменное разложение солей водой. Гидролизу подвергаются только растворимые в воде соли''''' |
<div class="blocktext">Соль – это электролит, который диссоциирует в растворе и его ионы взаимодействуют с молекулами воды. Катионы соли получают от воды ионы OH<sup>–</sup>, а анионы соли получают ионы Н<sup>+</sup>. </div> | <div class="blocktext">Соль – это электролит, который диссоциирует в растворе и его ионы взаимодействуют с молекулами воды. Катионы соли получают от воды ионы OH<sup>–</sup>, а анионы соли получают ионы Н<sup>+</sup>. </div> | ||
| − | В процессе гидролиза | + | В процессе гидролиза образуется электролит более слабый, недиссоциируемый, следовательно, более устойчивый, чем гидролизуемая соль. Гидролиз практически возможен лишь в том случае, если один из получаемых электролитов (кислота или основание) более слабый, чем гидролизуемая соль. Гидролиз – это процесс обратный процессу нейтрализации |
{{center|Cu(OH)<sub>2</sub>+H<sub>2</sub>SO<sub>4</sub> [[file:ArrowNG.png|50px]] CuSO<sub>4</sub>+2H<sub>2</sub>O}} | {{center|Cu(OH)<sub>2</sub>+H<sub>2</sub>SO<sub>4</sub> [[file:ArrowNG.png|50px]] CuSO<sub>4</sub>+2H<sub>2</sub>O}} | ||
| Строка 146: | Строка 152: | ||
'''''II ступень''''' | '''''II ступень''''' | ||
| − | Cu(OH) + HOH {{Arrowleft}} Cu(OH)<sub>2</sub>{{Arrowdown}} + HCl | + | Cu(OH)Cl + HOH {{Arrowleft}} Cu(OH)<sub>2</sub>{{Arrowdown}} + HCl |
CuOH<sup>+</sup> + <span class="ion">Cl<sup>–</sup></span> + HOH {{Arrowleft}} Cu(OH)<sub>2</sub>{{Arrowdown}} + H<sup>+</sup> + <span class="ion">Cl<sup>–</sup></span> | CuOH<sup>+</sup> + <span class="ion">Cl<sup>–</sup></span> + HOH {{Arrowleft}} Cu(OH)<sub>2</sub>{{Arrowdown}} + H<sup>+</sup> + <span class="ion">Cl<sup>–</sup></span> | ||
| Строка 200: | Строка 206: | ||
'''Гидролиз солей может протекать ступенчато. Количество ступеней равно валентности металла в составе соли или валентности кислотного остатка.''' | '''Гидролиз солей может протекать ступенчато. Количество ступеней равно валентности металла в составе соли или валентности кислотного остатка.''' | ||
| − | + | <div class="mw-customtoggle-pr1 resettext" style="background-color:#bbcdff; padding:3px"><h4>'''Пример (1):'''</h4></div><br> | |
| − | '''Пример (1):''' | + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-pr1"> |
| − | |||
''I ступень'' | ''I ступень'' | ||
Na<sub>3</sub>PO<sub>4</sub> + HOH {{Arrowleft}} Na<sub>2</sub>HPO<sub>4</sub> + NaOH | Na<sub>3</sub>PO<sub>4</sub> + HOH {{Arrowleft}} Na<sub>2</sub>HPO<sub>4</sub> + NaOH | ||
| Строка 220: | Строка 225: | ||
''III ступень'' Не идет, т.к. НРО<sub>4</sub> – электролит средней силы | ''III ступень'' Не идет, т.к. НРО<sub>4</sub> – электролит средней силы | ||
| − | + | ---- | |
| − | '''Пример (2):''' | + | </div> |
| − | + | <div class="mw-customtoggle-pr2 resettext" style="background-color:#bbcdff; padding:3px"><h4>'''Пример (2):'''</h4></div><br> | |
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-pr2"> | ||
''I ступень'' | ''I ступень'' | ||
| Строка 235: | Строка 241: | ||
2Al(OH)SO<sub>4</sub> + 2HOH {{Arrowleft}} [Al(OH)<sub>2</sub>]<sub>2</sub>SO<sub>4</sub> + H<sub>2</sub>SO<sub>4</sub> | 2Al(OH)SO<sub>4</sub> + 2HOH {{Arrowleft}} [Al(OH)<sub>2</sub>]<sub>2</sub>SO<sub>4</sub> + H<sub>2</sub>SO<sub>4</sub> | ||
| − | 2AlOH<sup>2+</sup> + <span class="ion">2SO<sub>4</sub><sup>2–</sup></span> + 2HOH {{Arrowleft}} 2Al(OH)<sub>2</sub> + <span class="ion">SO<sub>4</sub><sup>2–</sup></span> + 2H<sup>+</sup> + <span class="ion">SO<sub>4</sub><sup>2–</sup></span> | + | 2AlOH<sup>2+</sup> + <span class="ion">2SO<sub>4</sub><sup>2–</sup></span> + 2HOH {{Arrowleft}} 2Al(OH)<sub>2</sub><sup>+</sup> + <span class="ion">SO<sub>4</sub><sup>2–</sup></span> + 2H<sup>+</sup> + <span class="ion">SO<sub>4</sub><sup>2–</sup></span> |
2AlOH<sup>2+</sup> + 2HOH {{Arrowleft}} 2Al(OH)<sup>2+</sup> + 2H<sup>+</sup> | 2AlOH<sup>2+</sup> + 2HOH {{Arrowleft}} 2Al(OH)<sup>2+</sup> + 2H<sup>+</sup> | ||
| Строка 241: | Строка 247: | ||
''III ступень'' | ''III ступень'' | ||
| − | [Al(OH)<sub>2</sub>]<sub>2</sub>SO<sub>4</sub> + 2HOH {{Arrowleft}} 2Al(OH)<sub>3</sub> + H<sub>2</sub>SO<sub>4</sub> | + | [Al(OH)<sub>2</sub>]<sub>2</sub>SO<sub>4</sub> + 2HOH {{Arrowleft}} 2Al(OH)<sub>3</sub>{{Arrowdown}} + H<sub>2</sub>SO<sub>4</sub> |
| − | 2Al(OH)<sup>2+</sup> + <span class="ion">SO<sub>4</sub><sup>2–</sup></span> + 2HOH {{Arrowleft}} 2Al(OH)<sub>3</sub> + 2H<sup>+</sup> + <span class="ion">SO<sub>4</sub><sup>2–</sup></span> | + | 2Al(OH)<sup>2+</sup> + <span class="ion">SO<sub>4</sub><sup>2–</sup></span> + 2HOH {{Arrowleft}} 2Al(OH)<sub>3</sub>{{Arrowdown}} + 2H<sup>+</sup> + <span class="ion">SO<sub>4</sub><sup>2–</sup></span> |
| − | 2Al(OH)<sup>2+</sup> + 2HOH {{Arrowleft}} 2Al(OH)<sub>3</sub> + 2H<sup>+</sup> | + | 2Al(OH)<sup>2+</sup> + 2HOH {{Arrowleft}} 2Al(OH)<sub>3</sub>{{Arrowdown}} + 2H<sup>+</sup> |
''Реакция по III ступени практически не проходит. Т.к. происходит накопление ионов водорода, поэтому процесс смещается в сторону исходных веществ. Но разбавлением раствора и повышением температуры можно усилить гидролиз. Поэтому может проходить гидролиз и по III ступени.'' | ''Реакция по III ступени практически не проходит. Т.к. происходит накопление ионов водорода, поэтому процесс смещается в сторону исходных веществ. Но разбавлением раствора и повышением температуры можно усилить гидролиз. Поэтому может проходить гидролиз и по III ступени.'' | ||
| + | ---- | ||
| + | </div> | ||
<div class = "textblock"> | <div class = "textblock"> | ||
| − | Таким образом, гидролизуются соли если они растворимы и образованы сильным и слабым компонентами соли (катионом или анионом). | + | Таким образом, гидролизуются соли, если они растворимы и образованы сильным и слабым компонентами соли (катионом или анионом). При наличии в составе соли сильного катиона, полученного из щелочи, гидролиз соли приведет к образованию щелочной среды. Если соль образована сильной кислотой и слабым основанием, то сильный анион приведет к образованию кислой среды при гидролизе соли. Т.е. работает закон: «Кто сильный, тот и прав!».</div> |
| − | + | Представленная модифицированная таблица растворимости солей ориентирована на определение '''рН''' среды, которая образуется при гидролизе соли. | |
| − | + | {{Dissociation}} | |
| − | |||
| − | |||
| − | |||
| − | |||
Нахождение соли в определенной части таблицы описывает результат гидролиза. | Нахождение соли в определенной части таблицы описывает результат гидролиза. | ||
| − | '''Если соль находится в секторе таблицы, обозначенной | + | '''Если соль находится в секторе таблицы, обозначенной цветом:''' |
| − | + | <span style="background-color:#e5e5e5; width:30px; height:1em; margin-right:10px; display:inline-block; border:1px solid black;"></span> такая соль будет диссоциировать и не будет подвергаться гидролизу. | |
| − | + | <span style="background-color:#fbe8e8; width:30px; height:1em; margin-right:10px; display:inline-block; border:1px solid black;"></span> гидролиз соли пройдет по кислотному типу и '''рН''' будет '''<7'''. | |
| − | + | <span style="background-color:#e5f5fb; width:30px; height:1em; margin-right:10px; display:inline-block; border:1px solid black;"></span> гидролиз соли пройдет по щелочному типу и '''рН''' при этом будет '''больше 7'''. | |
| − | + | <span style="background-color:#ffffff; width:30px; height:1em; margin-right:10px; display:inline-block; border:1px solid black;"></span> требует анализа: соль или нерастворима, как большинство солей в этом секторе таблицы или разлагается при растворении в воде. Если соль растворима, то обычно гидролиз приводит к образованию нейтральной среды, когда '''рН=7,0''' | |
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
== Буферные растворы == | == Буферные растворы == | ||
| Строка 277: | Строка 283: | ||
Буферными называются растворы, обладающие способностью сохранять практически постоянное значение '''pH''' при добавлении небольших количеств кислоты или щелочи, а также при разбавлении. Буферные системы состоят из слабого основания и его соли, образованной сильной кислотой. Или из слабой кислоты и ее соли, образованной сильным основанием. | Буферными называются растворы, обладающие способностью сохранять практически постоянное значение '''pH''' при добавлении небольших количеств кислоты или щелочи, а также при разбавлении. Буферные системы состоят из слабого основания и его соли, образованной сильной кислотой. Или из слабой кислоты и ее соли, образованной сильным основанием. | ||
| − | {{center|[[file: | + | {{center|[[file:Klasifbufsystem.png|600px|Классификация буферных систем]]}} |
| − | '''Примеры:''' NH<sub>4</sub>OH + NH<sub>4</sub>Cl pH = 9,2 '''или''' CH<sub>3</sub>COOH + CH<sub>3</sub> | + | |
| + | '''Примеры:''' NH<sub>4</sub>OH + NH<sub>4</sub>Cl '''''pH = 9,2''''' '''или''' CH<sub>3</sub>COOH + CH<sub>3</sub>COONa '''''pH=4,7''''' | ||
При добавлении кислоты будут связываться ионы водорода, а при добавлении щелочи – ионы гидроксила. '''pH''' раствора изменится незначительно. Способность регулировать '''pH''' у буферных растворов регулируется буферной емкостью. | При добавлении кислоты будут связываться ионы водорода, а при добавлении щелочи – ионы гидроксила. '''pH''' раствора изменится незначительно. Способность регулировать '''pH''' у буферных растворов регулируется буферной емкостью. | ||
| Строка 286: | Строка 293: | ||
В каждой клетке организма работают разные буферные системы, поддерживающие постоянство внутренней среды. | В каждой клетке организма работают разные буферные системы, поддерживающие постоянство внутренней среды. | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
| − | == | + | == Роль и практическое применение гидролиза == |
| − | Роль и практическое применение гидролиза Обменные реакции между солями и водой широко распространены в природе. | + | Обменные реакции между солями и водой широко распространены в природе. |
| − | + | {{right-p|[[file:Malahit.png|350px|class=show-for-large-up|Минерал малахит – продукт гидролиза природных карбонатов.]]}} | |
Явление гидролиза играет огромную роль в химическом преобразовании земной коры. Многие минералы земной коры - это сульфиды металлов, которые хотя и плохо растворимы в воде, постепенно взаимодействуют с ней. Такие процессы идут и на поверхности Земли, и особенно интенсивно в ее глубинах при повышенной температуре. В результате образуется огромное количество сероводорода, который выбрасывается на поверхность при вулканической деятельности. А силикатные породы постепенно переходят в гидроксиды, а затем в оксиды металлов. В результате гидролиза минералов – алюмосиликатов – происходит разрушение горных пород. | Явление гидролиза играет огромную роль в химическом преобразовании земной коры. Многие минералы земной коры - это сульфиды металлов, которые хотя и плохо растворимы в воде, постепенно взаимодействуют с ней. Такие процессы идут и на поверхности Земли, и особенно интенсивно в ее глубинах при повышенной температуре. В результате образуется огромное количество сероводорода, который выбрасывается на поверхность при вулканической деятельности. А силикатные породы постепенно переходят в гидроксиды, а затем в оксиды металлов. В результате гидролиза минералов – алюмосиликатов – происходит разрушение горных пород. | ||
| + | {{center|[[file:Malahit.png|350px|class=hide-for-large-up|Минерал малахит – продукт гидролиза природных карбонатов.]]}} | ||
| + | Известный нам малахит '''(Cu<sub>2</sub>(OH)<sub>2</sub>CO<sub>2</sub>)''' – не что иное, как продукт гидролиза природных карбонатов. | ||
| − | + | В Мировом океане соли также интенсивно взаимодействуют с водой. Выносимые речной водой гидрокарбонаты кальция и магния придают морской воде слабощелочную реакцию. Именно в такой слабощелочной среде прибрежных вод рН приблизительно равно 9, наиболее интенсивно протекает фотосинтез в морских растениях и наиболее быстро развиваются морские животные. А если вспомнить о составе рН крови млекопитающих, в том числе и человека, то вы сможете не только сделать вывод о единстве животного мира на Земле, но и сформулировать и некоторые гипотезы о происхождении жизни на планете. | |
| − | + | Гидролиз доставляет немало хлопот нефтяникам. Как известно, в нефти имеются примеси воды и многих солей, особенно хлоридов кальция и магния. При нагревании нефти в процессе ее переработки до 250 <sup>o</sup>С и выше происходит интенсивное взаимодействие указанных хлоридов с водяным паром. Образующийся при этом газообразный хлороводород вступает в реакцию с металлом, из которого сделано оборудование, разрушает его, что резко увеличивает стоимость нефтепродуктов. | |
| − | + | Впрочем, на счету гидролиза немало и добрых дел. Например, образующийся при взаимодействии сульфата алюминия с водой мелкодисперсный осадок гидроксида алюминия уже несколько веков используется в качестве протравы при крашении. Оседая на ткань и прочно соединяясь с ней, гидроксид алюминия затем легко адсорбирует красители и образует весьма устойчивые красящие слои, которые выдерживают многократную стирку ткани. Без протравы качественной окраски тканей не получится. | |
| − | |||
| − | |||
Этот же процесс используют для очистки питьевой воды и промышленных стоков: рыхлый аморфный осадок гидроксида алюминия обволакивает частички грязи и адсорбирует вредные примеси, увлекая все это на дно. Примерно таков же механизм очистки природной воды глинами, которые представляют собой соединения алюминия. | Этот же процесс используют для очистки питьевой воды и промышленных стоков: рыхлый аморфный осадок гидроксида алюминия обволакивает частички грязи и адсорбирует вредные примеси, увлекая все это на дно. Примерно таков же механизм очистки природной воды глинами, которые представляют собой соединения алюминия. | ||
| − | Гидролиз солей Na<sub>2</sub>CO<sub>3</sub> | + | Гидролиз солей Na<sub>2</sub>CO<sub>3</sub>, Na<sub>3</sub>PO<sub>4</sub> применяется для очистки воды и уменьшения ее жесткости. |
Известкование почв с целью понижения их кислотности также основано на реакции гидролиза | Известкование почв с целью понижения их кислотности также основано на реакции гидролиза | ||
| Строка 308: | Строка 317: | ||
CO<sub>3</sub><sup>2</sup><sup>-</sup>+HOH{{ArrowLR}}HCO<sub>3</sub><sub>-</sub>+OH<sup>+</sup> | CO<sub>3</sub><sup>2</sup><sup>-</sup>+HOH{{ArrowLR}}HCO<sub>3</sub><sub>-</sub>+OH<sup>+</sup> | ||
| − | Посредством гидролиза в промышленности из непищевого сырья (древесины, хлопковой шелухи, подсолнечной лузги, соломы вырабатывается ряд ценных продуктов: этиловый спирт, белковые дрожжи, глюкоза, сухой лед. | + | Посредством гидролиза в промышленности из непищевого сырья ''(древесины, хлопковой шелухи, подсолнечной лузги, соломы)'' вырабатывается ряд ценных продуктов: '''этиловый спирт, белковые дрожжи, глюкоза, сухой лед (CO<sub>2</sub>).''' |
| − | + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | |
| − | == | ||
| − | В | ||
| − | |||
| − | |||
<br clear=all /> | <br clear=all /> | ||
| − | |||
| − | |||
| − | |||
==Глоссарий== | ==Глоссарий== | ||
:{{bib|'''Аквакомплексы''' – комплексы, включающие в состав молекулы воды – или кристаллогидраты.}} | :{{bib|'''Аквакомплексы''' – комплексы, включающие в состав молекулы воды – или кристаллогидраты.}} | ||
| + | :{{bib|'''Буфер, буферная система''' ''(англ. buffer, от buff – смягчать удар)'' – растворы с определённой устойчивой концентрацией водородных или гидроксид-ионов.}} | ||
| − | |||
== Библиография == | == Библиография == | ||
* {{bib|Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.}} | * {{bib|Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.}} | ||
| − | + | * {{bib|Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. – С. 244}} | |
| + | * {{bib|Ефимов А.И. и др. Свойства неорганических соединений. Справочник. - Л.: Химия, 1983. – С. 140-141}} | ||
| + | * {{bib|Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. - Мн.: Современная школа, 2005. - 608 с ISBN 985-6751-04-7.}} | ||
</div> | </div> | ||
| Строка 331: | Строка 335: | ||
<div class="large-4 medium-5 columns"> | <div class="large-4 medium-5 columns"> | ||
<!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | <!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | ||
| − | <div class=" | + | <div class="sbstyle"> |
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric | + | <div class="large-10 small-10 large-centered small-centered columns rubric">Химия в лицах</div> |
</div> | </div> | ||
| − | <span class="firstcharacter"> | + | {{center-p|[[file:88a.jpg|400px|Сванте Август Аррениус]]}} |
| + | <span class="firstcharacter">Ш</span>ведский физикохимик Сванте Август Аррениус родился в имении Вейк, недалеко от Упсалы. | ||
| − | Он | + | Аррениус исследовал прохождение электрического тока через многие типы растворов. Он выдвинул предположение, что молекулы некоторых веществ при растворении в жидкости диссоциируют, или распадаются, на две или более частиц, которые он назвал ионами. Несмотря на то, что каждая целая молекула электронейтральна, ее частицы несут небольшой электрический заряд – либо положительный, либо отрицательный, в зависимости от природы частицы. Например, молекулы хлорида натрия (соль) при растворении в воде '''распадаются на положительно заряженные ионы натрия и отрицательно заряженные ионы хлора'''. Эти заряженные атомы, активные составные части молекулы, образуются только в растворе и создают возможность для прохождения электрического тока. Электрический ток в свою очередь направляет активные составные части к противоположно заряженным электродам. |
| − | <div | + | |
| − | <div class=" | + | Эта гипотеза составила основу докторской диссертации Аррениуса, которую он в 1884 г. представил к защите в Упсальском университете. В то время, однако, многие ученые сомневались в том, что в растворе могут сосуществовать противоположно заряженные частицы, и совет факультета не оценил его диссертацию по достоинству. |
| + | |||
| + | Только в 1903 г. Аррениусу была присуждена Нобелевская премия по химии, «как факт признания особого значения его теории электролитической диссоциации для развития химии». Выступая от имени Шведской королевской академии наук, X. Р. Тернеблад подчеркнул, что теория ионов Аррениуса заложила качественную основу электрохимии, «позволив применять к ней математический подход». «Одним из наиболее важных результатов теории Аррениуса, – сказал Тернеблад, – является завершение колоссального обобщения, за которое первая Нобелевская премия по химии была присуждена Вант-Гоффу». | ||
| + | </div> | ||
| + | <div class="sbstyle" style="margin-top:20px;"> | ||
<div class="row"> | <div class="row"> | ||
| − | <div class="large- | + | <div class="large-10 small-10 large-centered small-centered columns rubric">Сода и ее применение</div> |
| − | |||
</div> | </div> | ||
| − | </ | + | {{center|<big>'''Можно ли стирать содой в машинке-автомат?'''</big>}} |
| − | + | Как стирать содой в стиральной машине? Для этого нужно прямо в барабан насыпать полстакана соды и стирать в обычном режиме. Если белья очень много, можно увеличить объем до стакана. А если добавить еще и стакан белого уксуса, то это усилит дезодорирующий эффект соды. | |
| + | {{center|[[file:Stirka-belya-1.jpg|400px|Можно ли стирать содой в машинке-автомат?]]}} | ||
| + | <big>'''Выведение пятен при помощи соды'''</big> | ||
| + | |||
| + | Предлагаем вашему вниманию несколько действенных методик по применению соды для устранения загрязнений: | ||
| + | |||
| + | *Чтобы вывести пятно, надо приготовить содовую пасту: столовую ложку средства перемешать с водой. Можно также вместо воды добавить перекись водорода или уксус. Полученную пасту нанесите на пятно и подождите пятнадцать минут, затем смыть. Если загрязнение не исчезло, повторите процедуру. Можно также попробовать удалить пасту старой зубной щеткой, если пятно сильно въелось. Не стоит только использовать соду из пасты на деликатных тканях; | ||
| + | *Соду можно использовать и для очищения вещей, предназначенных только для сухой чистки. Для этого следует нанести тонкий слой средства на вещь (для удобства хорошо подойдет сито), после этого упаковать в герметичный пакет и оставить на 2 часа. После струсите соду и оставьте вещь на 40 минут на свежем воздухе; | ||
| + | *Чтобы просто избавиться от неприятного запаха и при этом не наносить соду непосредственно на одежду, можно насыпать ее в чистый носок, завязать его, положить в пакет с одеждой, загерметизировать и оставить на ночь в сухом прохладном месте. Утром раскройте пакет и вытряхните соду. Желательно повесить после этого вещь сушиться на солнце и на свежем воздухе на несколько часов. Если необходимо, повторите процедуру; | ||
| + | *Пятна на ковре или скатерти хорошо удаляет сода, гашеная уксусом. Для этого сначала посыпьте ее на пятно, затем смочите тряпочку в уксусе и круговыми движениями от середины к краям разотрите загрязненный участок. Если есть необходимость, повторите процедуру, после чего ополосните обработанное место в чистой воде. | ||
| + | |||
| + | <big>'''Отбеливание с помощью соды'''</big> | ||
| + | |||
| + | Можно ли постирать содой и при этом отбелить вещь? Да, для этого идеально подходит смесь: сода и нашатырный спирт. Нужно взять пять литров чистой воды, и развести в ней пять ложек соды и две ложки нашатыря. Замочите в этом растворе вещи белого цвета на три-четыре часа. Потом прополощите и постирайте любым способом. Если после замачивания белье прокипятить в этом растворе полчаса, то это поможет к тому же удалить желтизну. | ||
| + | |||
| + | <big>'''Как стирать кальцинированной содой?'''</big> | ||
| + | {{center|[[file:Soda-stirka.jpg|400px|Как стирать кальцинированной содой?]]}} | ||
| + | Обычно, когда упоминается сода, многие думают, что речь идет о пищевой добавке, но есть еще и кальцинированная сода, которая гораздо эффективнее первой. Приобрести ее можно в отделе бытовой химии. Использование кальцинированной соды: | ||
| + | *Для удаления накипи и известкового налета на деталях стиральной машины, а также от неприятного запаха, возникающего при неправильной ее эксплуатации. Для этого нужно смешать средство с водой в соотношении один к одному, нанести полученную смесь на манжету, барабан и лоток для порошка на тридцать минут и убрать с помощью тряпки. Далее включите режим быстрой стирки, не загружая белья; | ||
| + | *Хорошо смягчает воду. Для этого необходимо добавить в порошок две столовые ложки средства (при большой степени жесткости можно использовать пять ложек). Температура воды при этом должна быть не ниже пятидесяти градусов. Эта процедура к тому же предотвратит образование накипи. Только это не подходит для стирки шелковых и шерстяных вещей; | ||
| + | *Для замачивания белья. Возьмите 3 столовые ложки средства и растворите их в десяти литрах воды температурой сорок градусов. Положите вещи в получившийся раствор. Через два-три часа постирайте любым способом; | ||
| + | *Для эффективной стирки кухонных полотенец отлично подходит следующий рецепт: горсть средства смешать с тертым хозяйственным мылом и положить смесь в эмалированное ведро, наполовину наполненное водой. После растворения смеси положите туда полотенца и закипятите на медленном огне минут двадцать. Потом постирайте в машинке как обычно; | ||
| + | *Еще более эффективно отстирать жирные пятна на полотенцах поможет смесь соды, растительного масла, отбеливателя и порошка. Возьмите по 3 столовые ложки каждого ингредиента, засыпьте в ведро с кипятком воды и положите туда полотенца. Пусть они полежат там до полного остывания. Можно оставить и на ночь. Ополосните в чистой теплой воде и постирайте в машинке. | ||
| + | |||
| + | <big>'''Универсальное чистящее средство с содой'''</big> | ||
| + | {{center|[[file:Soda-dlya-stirki-i-mytya.jpg|400px|Универсальное чистящее средство с содой]]}} | ||
| + | Можно самим сделать средство впрок, которое подойдет как для мытья посуды, так и для чистки сантехники. Для этого нужно: | ||
| + | *детское мыло, натертое на терке, | ||
| + | *налить стакан воды, | ||
| + | *потом взбить, | ||
| + | *добавить еще стакан, и постепенно добавляя 250 граммов соды, | ||
| + | *опять взбить. | ||
| + | Полученной пастой можно удалять даже известь. | ||
| + | |||
| + | <big>'''Другие рецепты различных чистящих средств на основе соды'''</big> | ||
| − | + | С использованием средства можно приготовить также: | |
| + | *смесь для мытья посуды; | ||
| + | *гель для стирки; | ||
| + | *средство для чистки ванны. | ||
| + | Чтобы сделать гель для мытья посуды, возьмите хозяйственное мыло (двадцать пять граммов), 100 грамм пищевой соды, пол-литра горячей воды, четыре ложки глицерина и одну ложку водки или разведенного спирта. Натрите мыло на терке, влейте небольшое количество воды и поставьте в микроволновку. Постоянно помешивая, вливайте оставшуюся воду. После растворения мыла, дайте ему остыть, добавьте глицерин с водкой и перемешайте. Снимите образовавшуюся пену, влейте в специальную емкость и пользуйтесь. | ||
| − | + | Для получения геля для стирки надо взять литр воды, пятьдесят граммов тертого хозяйственного мыла и сорок пять граммов кальцинированной соды. Поместите в кипящую воду мыльную стружку, хорошо перемешивая ее при этом. Затем добавьте соду, и тоже все перемешайте, пока она не растворится. На пять килограммов белья берется две столовые ложки готового геля и помещается в барабан. | |
| − | + | Средство для чистки ванны можно изготовить из смеси половины стакана соды, жидкого мыла и пяти капель масла розмарина или лаванды. Перемешайте соду с мылом и добавьте масло. Чтобы смесь не засохла, нужно добавить туда чайную ложку глицерина и плотно закрыть. | |
| − | + | {{center|'''Таким образом, ответить на вопрос, можно ли стирать вещи содой, однозначно легко: можно и даже нужно. Стирать содой – отличная идея для тех, кто хочет эффективно справиться с различными загрязнениями натуральными средствами, при этом еще и значительно сэкономив деньги.'''}} | |
</div> | </div> | ||
| − | + | <div class="sbstyle" style="margin-top:20px;"> | |
| − | <div class=" | ||
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric | + | <div class="large-10 small-10 large-centered small-centered columns rubric">Водный мир</div> |
</div> | </div> | ||
| − | |||
| − | + | 22 марта во всем мире отмечается '''День водных ресурсов'''. Этот праздник был установлен по решению Генеральной Ассамблеи Организации Объединенных Наций, чтобы напомнить человечеству о важности водных ресурсов для окружающей среды и развития общества. | |
| − | + | В настоящее время 70% территории нашей планеты покрыты водой. При этом пить можно только 1% этой воды. С каждым годом проблема доступа к водным ресурсам становится острее. За последние 50 лет в мире произошло целых 507 конфликтов, связанных с доступом к воде. 21 спор привел к военным действиям. | |
| − | {{ | + | Вода – самое простое и привычное вещество на планете. Но в то же время она таит в себе множество загадок. Ее до сих пор продолжают исследовать ученые, находя все больше интересных данных о воде. |
| + | {{center-p|[[file:Voda-ch.jpg|300px|Водный мир]]}} | ||
| + | <big>'''Знаете ли вы, что'''</big> | ||
| − | + | '''самая чистая вода в Финляндии?''' | |
| − | + | ||
| − | + | По данным ЮНЕСКО, самая чистая вода находится в Финляндии. Всего в исследовании свежей природной воды принимало участие 122 страны. При этом 1 млрд людей по всему миру вообще не имеет доступа к безопасной воде. | |
| − | + | ||
| − | + | '''лед быстрее получить из горячей воды?''' | |
| − | + | ||
| − | + | Если рассуждать логически, то, конечно, холодная. Ведь горячей нужно сначала остыть, а потом уже замерзнуть, а вот холодной остывать не нужно. Однако опыты показывают, что в лед быстрее превращается именно горячая вода. | |
| − | + | ||
| − | + | Точного ответа на вопрос, почему все-таки горячая вода замерзает быстрее холодной, до сих пор не существует. Возможно, дело в разнице в переохлаждении, испарении, образовании льда, конвекции, либо причина в воздействии разжиженных газов на горячую и холодную воду. | |
| − | { | + | {{center-p|[[file:Lednik ch.jpg|300px|Ледники в океане]]}} |
| − | | | + | '''существует сверхохлаждение воды?''' |
| − | |||
| − | |||
| − | |||
| − | + | Все хорошо помнят из школьного курса физики, что вода замерзает при 0 градусов, а при 100 градусах закипает. Однако существует так называемое сверхохлаждение воды. Таким свойством обладает очень чистая вода – без примесей. Даже при охлаждении ниже точки замерзания такая вода остается жидкой. Но и в том, и в другом случае существуют температуры, при которых вода станет льдом или закипит. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | '''у воды более 3 агрегатных состояний?''' | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | Еще со школы все знают, что у воды есть 3 агрегатных состояния: твердое, жидкое и газообразное. Однако ученые выделяют 5 различных состояний воды в жидком виде и 14 состояний в замерзшем виде. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | Что будет, если, например, взять замерзшую чистую воду и продолжить охлаждение? С водой произойдут чудесные превращения. При минус 120 градусах по Цельсию вода становится сверхвязкой или тягучей, а при температуре ниже минус 135 градусов она превращается в "'''стеклянную'''" воду. "Стеклянная" вода – это твердое вещество, в котором отсутствует кристаллическая структура, как в стекле. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
</div> | </div> | ||
| − | <div class=" | + | <div class="sbstyle" style="margin-top:20px;"> |
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric | + | <div class="large-10 small-10 large-centered small-centered columns rubric">Такие разные снежинки</div> |
</div> | </div> | ||
| − | < | + | <big>'''Классы снежинок по Международной классификации снега.'''</big> |
| − | + | ||
| + | <small style="color:grey;">© А. К. Дюнин, В царстве снега, Издательство «Наука», Новосибирск, 1983</small> | ||
| + | <ul class="example-orbit" data-orbit data-options="animation:slide; pause_on_hover:true;animation_speed:500;navigation_arrows:true; resume_on_mouseout: true; timer_speed:4500;"> | ||
| + | <li class="active"> | ||
| + | [[Image:Sn1.jpg|Пластинки]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Пластинки'''<br> | ||
| + | <small>Самые простые из снежинок — плоские шестиугольные призмы.</small> | ||
</div> | </div> | ||
| − | <div class=" | + | </li> |
| + | <li> | ||
| + | [[Image:Sn2.jpg|Звезды]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Звезды'''<br> | ||
| + | <small>Как и пластинки, звезды обычно плоские и тонкие, с шестью лучами.</small> | ||
| + | </div> | ||
| + | </li> | ||
| + | <li> | ||
| + | [[Image:Sn3.jpg|Столбики]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Столбики'''<br> | ||
| + | <small>Полые внутри, могут иметь форму карандаша.</small> | ||
| + | </div> | ||
| + | </li> | ||
| + | <li> | ||
| + | [[Image:Sn4.jpg|Иглы]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Иглы'''<br> | ||
| + | <small>Длинные и тонкие кристаллы, иногда состоят из нескольких веточек.</small> | ||
| + | </div> | ||
| + | </li> | ||
| + | <li> | ||
| + | [[Image:Sn5.jpg|Пространственные дендриты]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Пространственные дендриты'''<br> | ||
| + | <small>Объемные снежинки, образуются при срастании нескольких кристаллов.</small> | ||
| + | </div> | ||
| + | </li> | ||
| + | <li> | ||
| + | [[Image:Sn6.jpg|Увенчанные столбики]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Увенчанные столбики'''<br> | ||
| + | <small>Образуются в случае, если столбики попадают в иные условия, и кристаллы меняют направление роста.</small> | ||
| + | </div> | ||
| + | </li> | ||
| + | <li> | ||
| + | [[Image:Sn7.jpg|Неправильные кристаллы]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Неправильные кристаллы'''<br> | ||
| + | <small>Самый распространенный тип. Образуется при повреждении снежинки.</small> | ||
| + | </div> | ||
| + | </li> | ||
| + | </ul> | ||
| + | <small style="color:grey;">© Kichigin | Shutterstock.com</small> | ||
| + | </div> | ||
| + | <div class="sbstyle"> | ||
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric" style=" | + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Пройди тестирование</div> |
| + | </div> | ||
| + | <div align="center" class="test_div_hover" style="width:300px; height:auto; float:non; text-indent:0"><span class="test_hover_state"></span> [[file:Corbis.jpg|class=testirovanie|Пройди тестирование|link=]]</div>> | ||
</div> | </div> | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
</div> | </div> | ||
| + | {{lang|:KR:Химия: Электролиттик диссоциация}} | ||
Текущая версия на 09:45, 22 октября 2018
Содержание
- 1 Электролиты и неэлектролиты
- 2 Теория электролитической диссоциации
- 3 Механизм диссоциации
- 4 Диссоциация кислот, оснований и солей в водных растворах
- 5 Степень диссоциации
- 6 Реакции ионного обмена
- 7 Ионное произведение воды. pH раствора
- 8 Гидролиз солей (разложение водой)
- 9 Буферные растворы
- 10 Роль и практическое применение гидролиза
- 11 Глоссарий
- 12 Библиография
Электролиты и неэлектролиты
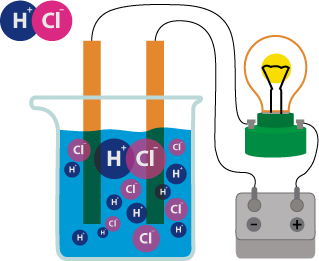
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора.
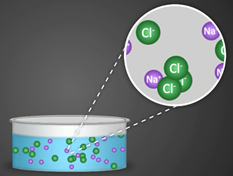
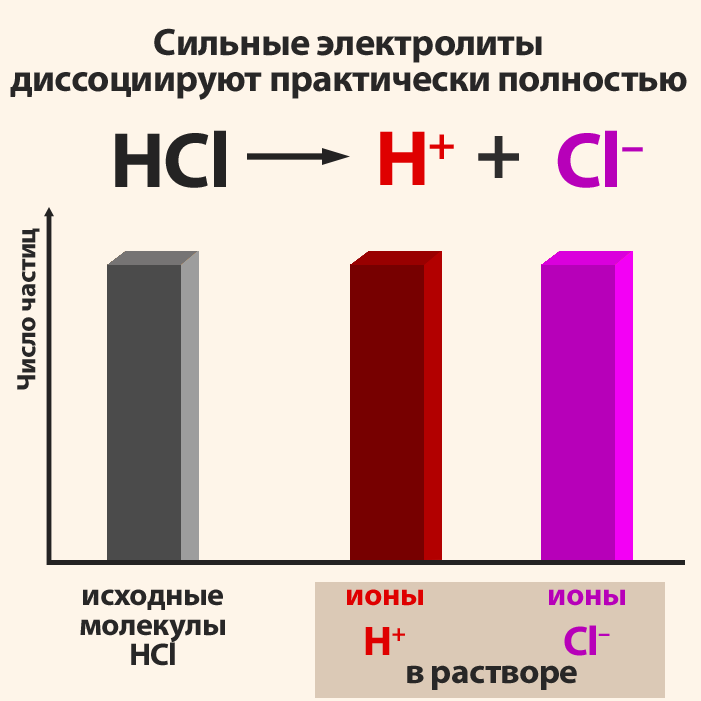
Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия. Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами. Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами. К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений.
Теория электролитической диссоциации
Для объяснения особенностей водных растворов электролитов шведским ученым С.Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трем положениям:
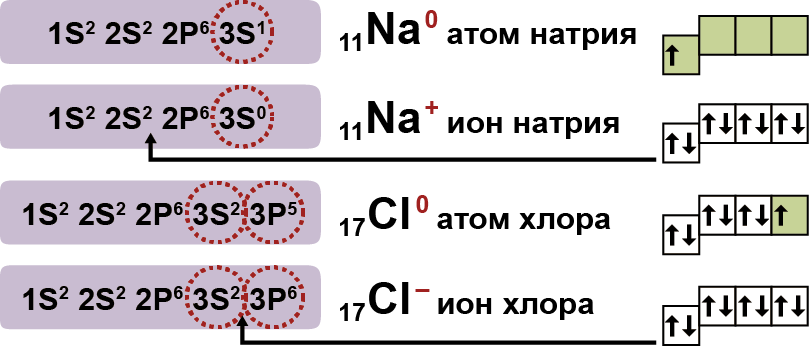
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные. Ионы находятся в более устойчивых электронных состояниях, чем атомы.
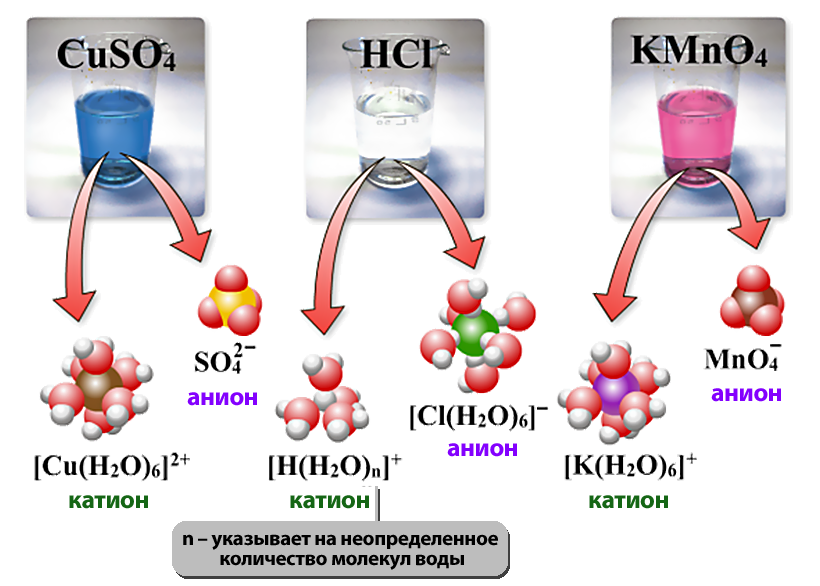
Они могут состоять из одного атома — это простые ионы (Na+, Mg2+, Аl3+ и т.д.) — или из нескольких атомов — это сложные ионы (NО3–, SO42– , РО43– и т.д.).
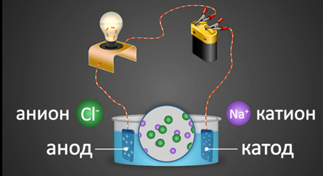
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами, вторые – анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
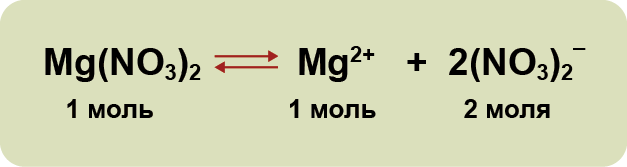
3. Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например:
Механизм диссоциации
- Существенным является вопрос о механизме электролитической диссоциации. Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор.
Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами H3РO4 имеются ионы (в последовательно уменьшающихся количествах)
| H3РO4 |
дигидрофосфат ион; (первая ступень) |
| H2РO4– |
гидрофосфат ион; (вторая ступень) |
| РO42– |
фосфат ион; (третья ступень) |
Степень диссоциации
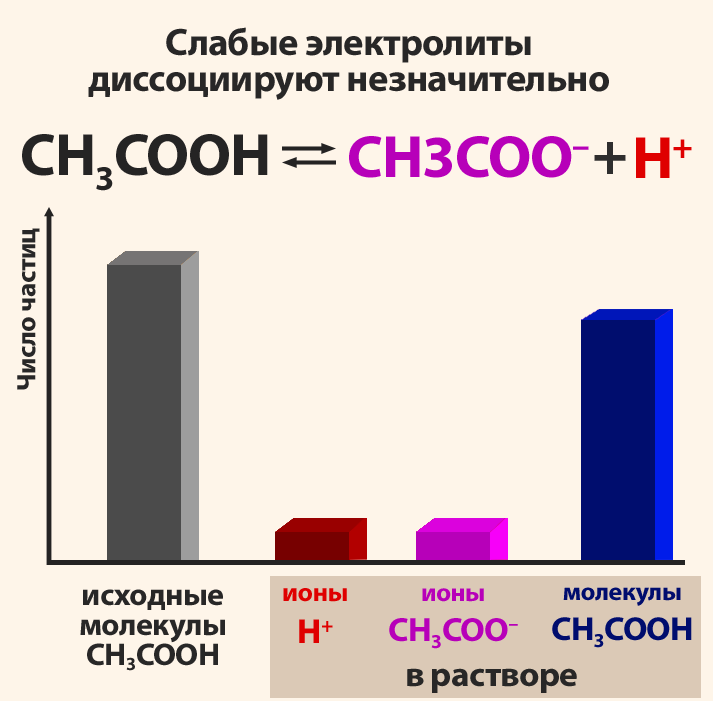
Поскольку электролитическая диссоциация – процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа α). Степень диссоциации — это отношение числа распавшихся на ионы молекул Ni к общему числу растворенных молекул N:
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
- Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита.
Реакции ионного обмена
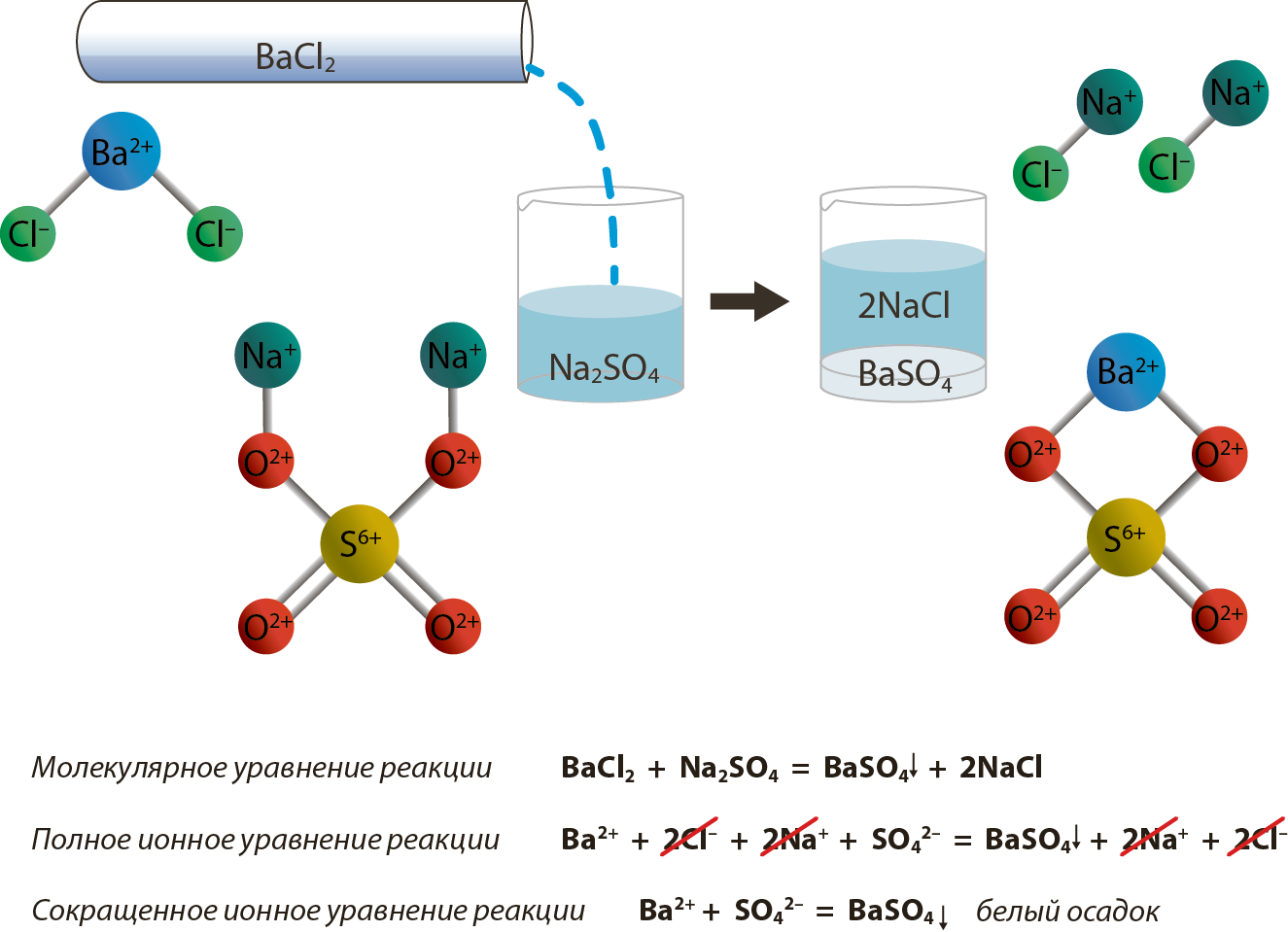
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций — ионными уравнениями. Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер.
Знак ↓ стоящий при формуле вещества, обозначает, что это вещество уходит из сферы реакции в виде осадка, знак ↑ обозначает, что вещество удаляется из сферы реакции в виде газа.
-
Сильные электролиты, как полностью диссоциированные, записывают в виде ионов.Сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части. Для закрепления этих положений рассмотрим пример.
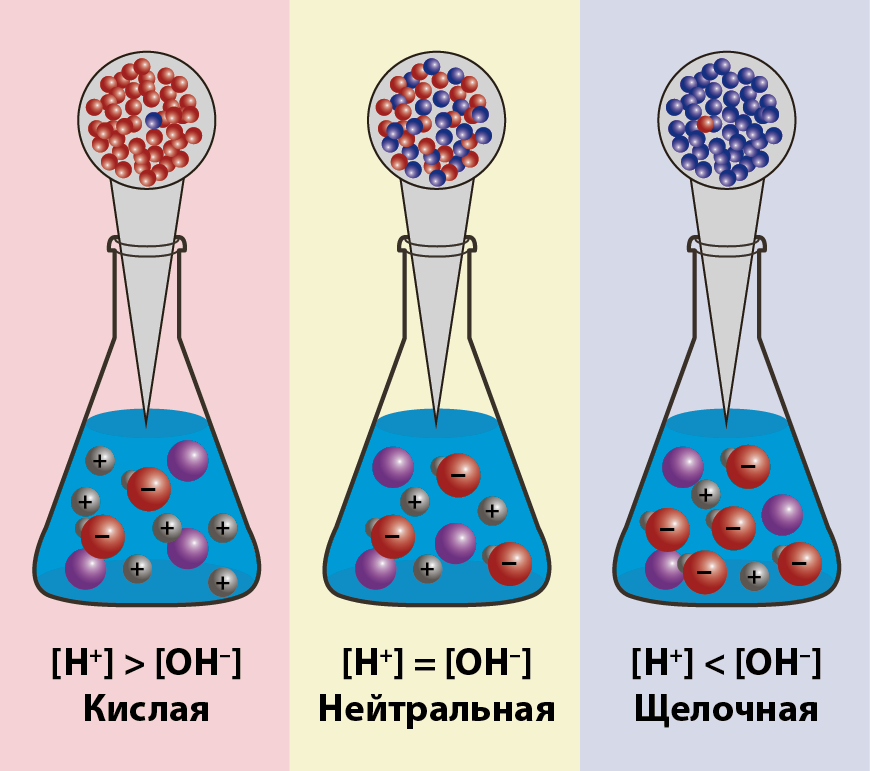
Ионное произведение воды. pH раствора
-
Концентрация молекул воды, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 20 - 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Так как вода является слабым электролитом ( амфолитом ), можно записать для неё константу диссоциации из, непосредственно - диссоциации воды
K•[H2O] = [H+] [OH–]
Обозначим произведение K•[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль2/л2 = [H+]·[OH−] (при 25 °C).
Гидролиз солей (разложение водой)
Гидролиз солей – это обменное разложение солей водой. Гидролизу подвергаются только растворимые в воде соли
В процессе гидролиза образуется электролит более слабый, недиссоциируемый, следовательно, более устойчивый, чем гидролизуемая соль. Гидролиз практически возможен лишь в том случае, если один из получаемых электролитов (кислота или основание) более слабый, чем гидролизуемая соль. Гидролиз – это процесс обратный процессу нейтрализации
Наиболее быстро и полно гидролиз происходит в разбавленных растворах.
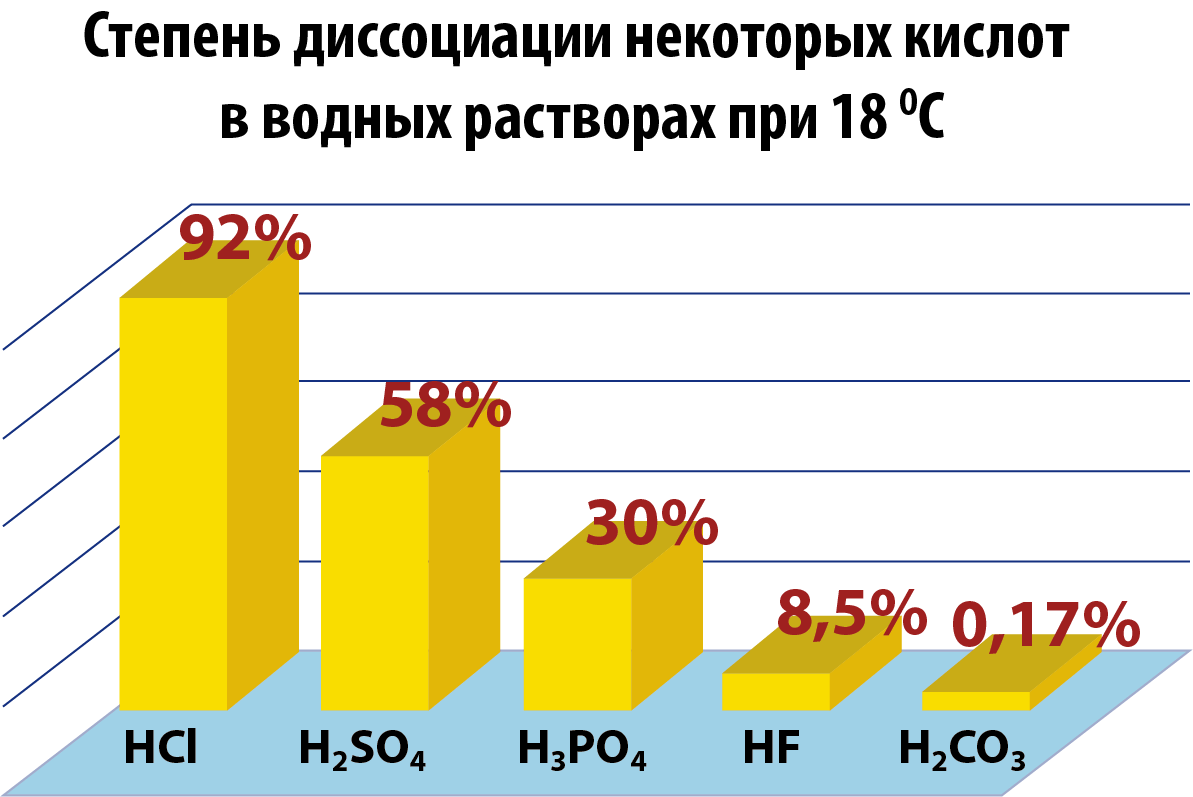
По степени диссоциации все кислоты и растворимые основания (щелочи) разделяют на сильные и слабые.
Сильные кислоты: HClO4, HClO3, H2SO4, HNO3, HI, HBr, HCl.
Сильные основания (щелочи): CsOH, RbOH, KOH, NaOH, LiOH, Ba(OH)2, Sr(OH)2, Ca(OH)2.
1) Соли, образованные сильной кислотой и сильным основанием гидролизу не подвергаются. При растворении в воде они полностью диссоциируют на положительно заряженные катионы и отрицательно заряженные анионы.
2) Соли, образованные сильной кислотой и слабым основанием гидролизуются с получением кислой среды, рН≤7.
I ступень
CuCl2+HOH![]() Cu(OH)Cl+HCl
Cu(OH)Cl+HCl
Cu2+ + 2Cl– + HOH![]() CuOH+ + Cl– + H+ + Cl–
CuOH+ + Cl– + H+ + Cl–
Cu2++HOH![]() CuOH+ + H+
CuOH+ + H+
(рН < 7)
II ступень
Cu(OH)Cl + HOH ![]() Cu(OH)2↓ + HCl
Cu(OH)2↓ + HCl
CuOH+ + Cl– + HOH ![]() Cu(OH)2↓ + H+ + Cl–
Cu(OH)2↓ + H+ + Cl–
CuOH+ + HOH ![]() Cu(OH)2↓ +H+
Cu(OH)2↓ +H+
(pH ≤ 7) – кислая среда
3) Соли, образованные сильным основанием и слабой кислотой гидролизуются с получением щелочной среды, рН≥7.
I ступень
K2S + HOH ![]() KHS + KOH
KHS + KOH
2K+ + S2– + HOH ![]() K+ + HS– + K+ + OH–
K+ + HS– + K+ + OH–
S2– +HOH ![]() HS– + OH–
HS– + OH–
(рН > 7)
II ступень
KHS + HOH ![]() H2S↑ + KOH
H2S↑ + KOH
K+ + HS– + HOH ![]() H2S↑ + K+ + OH–
H2S↑ + K+ + OH–
HS– + HOH ![]() H2S↑ + OH–
H2S↑ + OH–
(pH ≥ 7) – щелочная среда
4) Соли, образованные слабым основанием и слабой кислотой гидролизуются, если соль растворима. Обычно такие соли
- нерастворимы
- разлагаются при растворении
2NH4+ + S2– ![]() 2NH3↑ + H2S↑
2NH3↑ + H2S↑
- при гидролизе образуется слабое основание и слабая кислота:
CH3COONH4 + HOH ![]() CH3COOH + NH4OH
CH3COOH + NH4OH
CH3COO– + NH4+ + HOH ![]() CH3COOH + NH4OH
CH3COOH + NH4OH
Константа диссоциации для уксусной кислоты CH3COOH = 1,8·10-5, константа диссоциации для гидроксида аммония также равна NH4OH = 1,8·10-5. Т.е. численные показатели этих веществ равны, что говорит о получении нейтральной среды при гидролизе ацетата аммония.
Еще рассматривается летучесть аммиака, как газообразного вещества при длительном хранении вещества.
Гидролиз солей может протекать ступенчато. Количество ступеней равно валентности металла в составе соли или валентности кислотного остатка.
Пример (1):
I ступень
Na3PO4 + HOH ![]() Na2HPO4 + NaOH
Na2HPO4 + NaOH
3Na+ + PO43– + HOH ![]() 2Na+ + HPO42– + Na+ + OH–
2Na+ + HPO42– + Na+ + OH–
PO43– + HOH ![]() HPO42– + OH–
HPO42– + OH–
II ступень
Na2HPO4 + HOH ![]() NaH2PO4 + NaOH
NaH2PO4 + NaOH
2Na+ + HPO42–+HOH ![]() Na+ + H2PO4– + Na+
+ OH–
Na+ + H2PO4– + Na+
+ OH–
HPO42– + HOH ![]() H2PO4– + OH–
H2PO4– + OH–
III ступень Не идет, т.к. НРО4 – электролит средней силы
Пример (2):
I ступень
Al2(SO4)3 + 2HOH ![]() 2Al(OH)SO4+H2SO4
2Al(OH)SO4+H2SO4
2Al3+ + 3SO42– + 2HOH ![]() 2AlOH2+ + 2SO42– + 2H+ + SO42–
2AlOH2+ + 2SO42– + 2H+ + SO42–
2Al3+ + 2HOH ![]() 2AlOH2+ + 2H+
2AlOH2+ + 2H+
II ступень
2Al(OH)SO4 + 2HOH ![]() [Al(OH)2]2SO4 + H2SO4
[Al(OH)2]2SO4 + H2SO4
2AlOH2+ + 2SO42– + 2HOH ![]() 2Al(OH)2+ + SO42– + 2H+ + SO42–
2Al(OH)2+ + SO42– + 2H+ + SO42–
2AlOH2+ + 2HOH ![]() 2Al(OH)2+ + 2H+
2Al(OH)2+ + 2H+
III ступень
[Al(OH)2]2SO4 + 2HOH ![]() 2Al(OH)3↓ + H2SO4
2Al(OH)3↓ + H2SO4
2Al(OH)2+ + SO42– + 2HOH ![]() 2Al(OH)3↓ + 2H+ + SO42–
2Al(OH)3↓ + 2H+ + SO42–
2Al(OH)2+ + 2HOH ![]() 2Al(OH)3↓ + 2H+
2Al(OH)3↓ + 2H+
Реакция по III ступени практически не проходит. Т.к. происходит накопление ионов водорода, поэтому процесс смещается в сторону исходных веществ. Но разбавлением раствора и повышением температуры можно усилить гидролиз. Поэтому может проходить гидролиз и по III ступени.
Представленная модифицированная таблица растворимости солей ориентирована на определение рН среды, которая образуется при гидролизе соли.
HOH
Гидроксид водорода, соединение гидроксильной группы OH– и катиона H+
CsOH
Гидроксид цезия – сильнейшее основание.
RbOH
Гидроксид рубидия, является одним из наиболее сильных оснований.
KOH
Гидроксид калия. Сильное основание.
NaOH
Гидроксид натрия. Сильное основание.
LiOH
Гидроксид лития. Сильное основание.
Ba(OH)2
Гидроксид бария. Сильное основание.
Sr(OH)2
Гидроксид стронция. Сильное основание.
Ca(OH)2
Гидроксид кальция. Сильное основание.
NH4OH
Гидроксид аммония. Сильное основание.
Mg(OH)2
Гидроксид магния. Слабое основание. Не растворяется в воде.
Al(OH)3
Гидроксид алюминия. Слабое основание. Не растворяется в воде.
Mn(OH)2
Гидроксид марганца. Слабое основание. Не растворяется в воде.
Zn(OH)2
Гидроксид цинка. Слабое основание. Не растворяется в воде.
Cr(OH)3
Гидроксид хрома. Слабое основание. Не растворяется в воде.
Fe(OH)2
Гидроксид железа (II). Слабое основание. Не растворяется в воде.
Fe(OH)3
Гидроксид железа (III). Слабое основание. Не растворяется в воде.
Co(OH)2
Гидроксид кобальта. Слабое основание. Не растворяется в воде.
Ni(OH)2
Гидроксид никеля. Слабое основание. Не растворяется в воде.
Pb(OH)2
Гидроксид свинца. Слабое основание. Малорастворим в воде.
Cu(OH)2
Гидроксид меди. Слабое основание. Не растворяется в воде.
Hg(OH)2
Не существует в водном растворе.
Ag(OH)
Не существует.
HClO4
Хлорная кислота. Cильный окислитель, так как содержит хлор в высшей степени окисления +7.
CsClO4
Перхлорат цезия. Слабо растворим в воде примерно 2 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
RbClO4
Перхлорат рубидия. Слабо растворим в воде.
Диссоциирует, образуя нейтральную среду.
KClO4
Перхлорат калия. Слабо растворим в воде примерно 2,1 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
NaClO4
Перхлорат натрия. Хорошо растворяется в воде примерно 211 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
LiClO4
Перхлорат лития. Растворим в воде примерно 58 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
Ba(ClO4)2
Перхлорат бария. Хорошо растворяется в воде примерно 340 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
Sr(ClO4)2
Перхлорат стронция. Нет данных.
Диссоциирует, образуя нейтральную среду.
Ca(ClO4)2
Перхлорат кальция. Хорошо растворяется в воде примерно 188 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
NH4ClO4
Перхлорат аммония. Хорошо растворяется в воде примерно 24,5 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
Mg(ClO4)2
Перхлорат магния. Хорошо растворяется в воде примерно 52 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al(ClO4)3
Перхлорат алюминия. Хорошо растворяется в воде примерно 135 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Mn(ClO4)2
Перхлорат марганца. Хорошо растворяется в воде примерно 52 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Zn(ClO4)2
Перхлорат цинка. Хорошо растворяется в воде примерно 112 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr(ClO4)3
Перхлорат хрома. Хорошо растворяется в воде примерно 133 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(ClO4)2
Перхлорат железа (II). Хорошо растворяется в воде примерно 300 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(ClO4)3
Перхлорат железа (III). Хорошо растворяется в воде примерно 395 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Co(ClO4)2
Перхлорат кобальта. Хорошо растворяется в воде примерно 110 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Ni(ClO4)2
Перхлорат никеля. Хорошо растворяется в воде примерно 111 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Pb(ClO4)2
Перхлорат свинца. Хорошо растворяется в воде примерно 80 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cu(ClO4)2
Перхлорат меди. Хорошо растворяется в воде примерно 150 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Hg(ClO4)2
Перхлорат ртути (II). Хорошо растворяется в воде примерно 290 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AgClO4
Перхлорат серебра. Хорошо растворяется в воде примерно 557 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HClO3
Хлорноватая кислота. сильная кислота, в которой хлор имеет степень окисления +5.
Заменить.
CsClO3
Хлорат цезия. Растворяется в воде примерно 9 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
RbClO3
Хлорат рубидия. Растворяется в воде примерно 7 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
KClO3
Хлорат калия. Растворяется в воде примерно 8 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
NaClO3
Хлорат натрия. Хорошо растворяется в воде примерно 100 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
LiClO3
Хлорат лития. Хорошо растворяется в воде примерно 400 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Ba(ClO3)2
Хлорат бария. Растворяется в воде примерно 37 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Sr(ClO3)2
Хлорат стронция. Хорошо растворяется в воде примерно 185 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Ca(ClO3)2
Хлорат кальция. Хорошо растворяется в воде примерно 218 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
NH4ClO3
Хлорат аммония. Растворяется в воде примерно 30 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Mg(ClO3)2
Хлорат магния. Хорошо растворяется в воде примерно 145 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al(ClO3)3
Хлорат алюминия. Растворяется в воде примерно 77 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Mn(ClO3)2
Хлорат марганца. Нет данных
В результате гидролиза, образуется кислая среда.
Zn(ClO3)2
Хлорат цинка. Хорошо растворяется в воде примерно 218 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr(ClO3)3
Хлорат хрома. Хорошо растворяется в воде примерно 142 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(ClO3)2
Хлорат железа (II). Хорошо растворяется в воде примерно 210 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(ClO3)3
Хлорат железа (III). Нет данных
В результате гидролиза, образуется кислая среда.
Co(ClO3)2
Хлорат кобальта. Хорошо растворяется в воде примерно 185 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Ni(ClO3)2
Хлорат никеля. Хорошо растворяется в воде примерно 145 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Pb(ClO3)2
Хлорат свинца. Хорошо растворяется в воде примерно 144 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cu(ClO3)2
Хлорат меди. Хорошо растворяется в воде примерно 250 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Hg(ClO3)2
Хлорат ртути. Растворяется в воде примерно 25 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AgClO3
Хлорат серебра. Растворяется в воде примерно 18 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
H2SO4
Серная кислота. сильная кислота, отвечающая высшей степени окисления серы (+6)
Cs2SO4
Сульфат цезия. Хорошо растворяется в воде примерно 180 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Rb2SO4
Сульфат рубидия. Растворяется в воде примерно 51 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
K2SO4
Сульфат калия. Растворяется в воде примерно 12 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Na2SO4
Сульфат натрия. Растворяется в воде примерно 30 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Li2SO4
Сульфат лития. Растворяется в воде примерно 34 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
BaSO4
Сульфат бария. Не растворяется в воде.
SrSO4
Сульфат стронция. Плохо растворяется в воде, примерно 0,013 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
CaSO4
Сульфат кальция. Плохо растворяется в воде, примерно 0,26 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
(NH4)2SO4
Сульфат аммония. Хорошо растворяется в воде, примерно 118 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
MgSO4
Сульфат магния. Растворяется в воде, примерно 36 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al2(SO4)3
Сульфат алюминия. Растворяется в воде, примерно 37 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
MnSO4
Сульфат марганца. Хорошо растворяется в воде, примерно 63 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
ZnSO4
Сульфат цинка. Хорошо растворяется в воде, примерно 57 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr2(SO4)3
Сульфат хрома. Хорошо растворяется в воде, примерно 220 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
FeSO4
Сульфат железа (II). Хорошо растворяется в воде, примерно 53 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe2(SO4)3
Сульфат железа (III). Очень хорошо растворяется в воде, примерно 440 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CoSO4
Сульфат кобальта. Растворяется в воде, примерно 39 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
NiSO4
Сульфат никеля. Растворяется в воде, примерно 45 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
PbSO4
Сульфат свинца. Не растворяется в воде.
CuSO4
Сульфат меди. Растворяется в воде, примерно 22 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HgSO4
Сульфат ртути. Почти не растворим.
Гидролизуется большим количеством воды, образуя кислую среду.
Ag2SO4
Сульфат серебра. Плохо растворяется в воде, примерно 0,84 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HNO3
Азотная кислота. Cильный окислитель. Нитрат-ион в воде не гидролизуется.
CsNO3
Нитрат цезия. Растворяется в воде, примерно 28 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
RbNO3
Нитрат рубидия. Хорошо растворяется в воде, примерно 70 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
KNO3
Нитрат калия. Растворяется в воде, примерно 38 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NaNO3
Нитрат натрия. Хорошо растворяется в воде, примерно 90 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
LiNO3
Нитрат лития. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Ba(NO3)2
Нитрат бария. Растворяется в воде, примерно 10 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Sr(NO3)2
Нитрат стронция. Растворяется в воде, примерно 74 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Ca(NO3)2
Нитрат кальция. Хорошо растворяется в воде, примерно 140 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NH4NO3
Нитрат аммония. Хорошо растворяется в воде, примерно 212 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Mg(NO3)2
Нитрат магния. Растворяется в воде, примерно 72,7 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al(NO3)3
Нитрат алюминия. Растворяется в воде, примерно 78 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Mn(NO3)2
Нитрат марганца. Хорошо растворяется в воде, примерно 140 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Zn(NO3)2
Нитрат цинка. Хорошо растворяется в воде, примерно 130 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr(NO3)3
Нитрат хрома. Хорошо растворяется в воде, примерно 145 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(NO3)2
Нитрат железа (II). Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(NO3)3
Нитрат железа (III). Хорошо растворяется в воде, примерно 160 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Co(NO3)2
Нитрат кобальта. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Ni(NO3)2
Нитрат никеля. Хорошо растворяется в воде, примерно 98 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Pb(NO3)2
Нитрат свинца. Растворяется в воде, примерно 56,5 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cu(NO3)2
Нитрат меди. Хорошо растворяется в воде, примерно 145 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Hg(NO3)2
Нитрат ртути. Растворим в кислых водных растворах.
В результате гидролиза, образуется кислая среда.
AgNO3
Нитрат серебра. Хорошо растворяется в воде, примерно 250 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HI
Иодоводородная кислота. Сильный окислитель.
CsI
Иодид цезия. Хорошо растворяется в воде, примерно 90 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
RbI
Иодид рубидия. Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
KI
Иодид калия. Хорошо растворяется в воде, примерно 148 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NaI
Иодид натрия. Хорошо растворяется в воде, примерно 184 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
LiI
Иодид лития. Хорошо растворяется в воде, примерно 167 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
BaI2
Иодид бария. Хорошо растворяется в воде, примерно 218 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
SrI2
Иодид стронция. Хорошо растворяется в воде, примерно 180 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
CaI2
Иодид кальция. Хорошо растворяется в воде, примерно 215 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NH4I
Иодид аммония. Хорошо растворяется в воде, примерно 176 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
MgI2
Иодид магния. Хорошо растворяется в воде, примерно 142 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AlI3
Иодид алюминия. Хорошо растворяется в воде.
В результате гидролиза, образуется кислая среда.
MnI2
Иодид марганца. Растворяется в воде.
В результате гидролиза, образуется кислая среда.
ZnI2
Иодид цинка. Хорошо растворяется в воде, примерно 440 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CrI3
Иодид хрома. Плохо растворяется в воде.
В результате гидролиза, образуется кислая среда.
FeI2
Иодид железа (II). Растворяется в воде.
В результате гидролиза, образуется кислая среда.
FeI3
Иодид железа (III). Диспропорционирует при растворении в воде.
В результате гидролиза, образуется кислая среда.
CoI2
Иодид кобальта. Хорошо растворяется в воде, примерно 210 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
NiI2
Иодид никеля. Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
PbI2
Иодид свинца. Плохо растворяется в воде, примерно 0,076 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CuI2
Иодид меди. Диспропорционирует при растворении в воде.
В результате гидролиза, образуется кислая среда.
HgI2
Иодид ртути. Не растворяется в воде.
AgI
Иодид серебра. Не растворяется в воде.
HBr
Бромоводородная кислота. Сильная одноосновная кислота.
CsBr
Бромид цезия. Хорошо растворяется в воде, примерно 110 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
RbBr
Бромид рубидия. Хорошо растворяется в воде, примерно 114 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
KBr
Бромид калия. Растворяется в воде, примерно 68 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NaBr
Бромид натрия. Хорошо растворяется в воде, примерно 94 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
LiBr
Бромид лития. Хорошо растворяется в воде, примерно 170 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Ba(Br)2
Бромид бария. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Sr(Br)2
Бромид стронция. Хорошо растворяется в воде, примерно 107 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Ca(Br)2
Бромид кальция. Хорошо растворяется в воде, примерно 153 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NH4Br
Бромид аммония. Хорошо растворяется в воде, примерно 78 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Mg(Br)2
Бромид магния. Хорошо растворяется в воде, примерно 103 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al(Br)3
Бромид алюминия. Хорошо растворяется в воде.
В результате гидролиза, образуется кислая среда.
Mn(Br)2
Бромид марганца. Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Zn(Br)2
Бромид цинка. Хорошо растворяется в воде, примерно 470 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr(Br)3
Бромид хрома. Растворяется в воде.
В результате гидролиза, образуется кислая среда.
Fe(Br)2
Бромид железа (II). Хорошо растворяется в воде, примерно 120 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(Br)3
Бромид железа (III). Хорошо растворяется в воде, примерно 455 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Co(Br)2
Бромид кобальта. Хорошо растворяется в воде, примерно 115 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Ni(Br)2
Бромид никеля. Хорошо растворяется в воде, примерно 134 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Pb(Br)2
Бромид свинца. Плохо растворяется в воде, примерно 0,97 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cu(Br)2
Бромид меди. Хорошо растворяется в воде, примерно 127 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Hg(Br)2
Бромид ртути. Плохо растворяется в воде, примерно 0,61 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AgBr
Бромид серебра. Не растворяется в воде.
HCl
Соляная кислота. Сильная одноосновная кислота.
CsCl
Хлорид цезия. Хорошо растворяется в воде, примерно 190 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
RbCl
Хлорид рубидия. Хорошо растворяется в воде, примерно 95 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
KCl
Хлорид калия. Растворяется в воде, примерно 36 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NaCl
Хлорид натрия. Растворяется в воде, примерно 36 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
LiCl
Хлорид лития. Хорошо растворяется в воде, примерно 84,5 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
BaCl2
Хлорид бария. Растворяется в воде, примерно 37,4 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
SrCl2
Хлорид стронция. Хорошо растворяется в воде, примерно 56 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
CaCl2
Хлорид кальция. Хорошо растворяется в воде, примерно 77 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NH4Cl
Хлорид аммония. Растворяется в воде, примерно 39 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
MgCl2
Хлорид магния. Хорошо растворяется в воде, примерно 55,5 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AlCl3
Хлорид алюминия. Растворяется в воде, примерно 45 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
MnCl2
Хлорид марганца. Хорошо растворяется в воде, примерно 77 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
ZnCl2
Хлорид цинка. Хорошо растворяется в воде, примерно 408 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CrCl3
Хлорид хрома. В воде растворим в присутствии восстановителей (Cr2+, Fe2+).
В результате гидролиза, образуется кислая среда.
FeCl2
Хлорид железа (II). Хорошо растворяется в воде, примерно 64 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
FeCl3
Хлорид железа (IIШ). Хорошо растворяется в воде, примерно 99 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CoCl2
Хлорид кобальта. Хорошо растворяется в воде, примерно 56 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
NiCl2
Хлорид никеля. Хорошо растворяется в воде, примерно 65 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
PbCl2
Хлорид свинца. Плохо растворяется в воде, примерно 1,08 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CuCl2
Хлорид меди. Хорошо растворяется в воде, примерно 76 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HgCl2
Хлорид ртути. Не растворяется в воде.
AgCl
Хлорид серебра. Не растворяется в воде.
H2SO3
Сернистая кислота. Неустойчивая двухосновная кислота средней силы.
Cs2SO3
Сульфит цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Rb2SO3
Сульфит рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
K2SO3
Сульфит калия. Хорошо растворяется в воде, примерно 106 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Na2SO3
Сульфит натрия. Растворяется в воде, примерно 28 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Li2SO3
Сульфит лития. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
BaSO3
Сульфит бария. Плохо растворяется в воде, примерно 0,02 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
SrSO3
Сульфит стронция. Не растворяется в воде.
CaSO3
Сульфит кальция. Не растворяется в воде.
(NH4)2SO3
Сульфит аммония. Растворяется в воде, примерно 65 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
MgSO3
Сульфит магния. Плохо растворяется в воде, примерно 0,65 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Al2(SO3)3
Сульфит алюминия.
Гидролиз протекает практически полностью, оба продукта реакции уходят из зоны реакции в виде осадка или газа.
MnSO3
Сульфит марганца. Не растворяется в воде.
ZnSO3
Сульфит цинка. Плохо растворяется в воде, примерно 0.16 гр на 100 мл при температуре 25oC.
Гидролиз протекает практически полностью, оба продукта реакции уходят из зоны реакции в виде осадка или газа.
CrSO3
Сульфит хрома. Не растворяется в воде.
FeSO3
Сульфит железа (II). Плохо растворяется в воде.
Гидролиз протекает практически полностью, оба продукта реакции уходят из зоны реакции в виде осадка или газа.
Fe2(SO3)3
Сульфит железа (III). Диспропорционирует при растворении в воде.
CoSO3
Сульфит кобальта. Не растворяется в воде.
NiSO3
Сульфит никеля. Не растворяется в воде.
PbSO3
Сульфит свинца. Не растворяется в воде.
CuSO3
Сульфит меди. Не растворяется в воде.
HgSO3
Сульфит ртути. Не растворяется в воде.
Ag2SO3
Сульфит серебра. Очень плохо растворяется в воде, примерно 0.00005255 гр на 100 мл при температуре 25oC.
Гидролиз протекает практически полностью, оба продукта реакции уходят из зоны реакции в виде осадка или газа.
H3PO4
Ортофо́сфорная кислота (фо́сфорная кислота). Трёхосновная кислота средней силы.
Cs3PO4
Фосфат цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Rb3PO4
Фосфат рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
K3PO4
Фосфат калия. Хорошо растворяется в воде, примерно 106 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Na3PO4
Фосфат натрия. Растворяется в воде, примерно 14,5 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Li3PO4
Фосфат лития. Плохо растворяется в воде, примерно 0,037 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Ba3(PO4)2
Фосфат бария. Не растворяется в воде.
Sr3(PO4)2
Фосфат стронция. Не растворяется в воде.
Ca3(PO4)2
Фосфат кальция. Не растворяется в воде.
(NH4)3PO4
Фосфат аммония. Растворяется в воде, примерно 22 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Mg3(PO4)2
Фосфат магния. Не растворяется в воде.
AlPO4
Фосфат алюминия. Не растворяется в воде.
Mn3(PO4)2
Фосфат марганца. Не растворяется в воде.
Zn3(PO4)2
Фосфат цинка. Не растворяется в воде.
CrPO4
Фосфат хрома. Не растворяется в воде.
Fe3(PO4)2
Фосфат железа (II). Не растворяется в воде.
FePO4
Фосфат железа (III). Очень плохо растворяется в воде, примерно 0,67 гр на 100 мл при температуре 100oC.
Гидролиз не протекает.
Co3(PO4)2
Фосфат кобальта. Не растворяется в воде.
Ni3(PO4)2
Фосфат никеля. Не растворяется в воде.
Pb3(PO4)2
Фосфат свинца. Не растворяется в воде.
Cu3(PO4)2
Фосфат меди. Не растворяется в воде.
Hg3(PO4)2
Фосфат ртути. Не растворяется в воде.
Ag3PO4
Фосфат серебра. Не растворяется в воде.
HF
Плавиковая кислота (фтороводородная кислота). Кислота средней силы.
CsF
Фторид цезия. Очень хорошо растворяется в воде, примерно 322 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
RbF
Фторид рубидия. Очень хорошо растворяется в воде, примерно 300 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
KF
Фторид калия. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
NaF
Фторид натрия. Растворяется в воде, примерно 4,3 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
LiF
Фторид лития. Плохо растворяется в воде, примерно 0,13 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
BaF2
Фторид бария. Плохо растворяется в воде, примерно 0,160 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
SrF2
Фторид стронция. Плохо растворяется в воде, примерно 0,021 гр на 100 мл при температуре 25oC.
CaF2
Фторид кальция. Не растворяется в воде.
NH4F
Фторид аммония. Хорошо растворяется в воде, примерно 84,5 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
MgF2
Фторид магния. Очень плохо растворяется в воде, примерно 0,0078 гр на 100 мл при температуре 25oC.
AlF3
Фторид алюминия. Плохо растворяется в воде, примерно 0,5 гр на 100 мл при температуре 25oC.
MnF2
Фторид марганца. Плохо растворяется в воде, примерно 1,06 гр на 100 мл при температуре 25oC.
ZnF2
Фторид цинка. Плохо растворяется в воде, примерно 1,6 гр на 100 мл при температуре 25oC.
CrF3
Фторид хрома. Плохо растворяется в воде, примерно 4 гр на 100 мл при температуре 25oC.
FeF2
Фторид железа (II). Очень плохо растворяется в воде.
FeF3
Фторид железа (III). Очень плохо растворяется в воде, примерно 0,091 гр на 100 мл при температуре 25oC.
CoF2
Фторид кобальта. Плохо растворяется в воде, примерно 1,5 гр на 100 мл при температуре 25oC.
NiF2
Фторид никеля. Растворяется в воде, примерно 2,6 гр на 100 мл при температуре 25oC.
PbF2
Фторид свинца. Плохо растворяется в воде, примерно 0,068 гр на 100 мл при температуре 25oC.
CuF2
Фторид меди. Растворяется в воде, примерно 4,75 гр на 100 мл при температуре 25oC.
При повышении температуры разлагается парами воды.
HgF2
Фторид ртути.
Не существует в водной среде.
AgF
Фторид серебра. Хорошо растворяется в воде, примерно 180 гр на 100 мл при температуре 25oC.
HNO2
Азо́тистая кислота. Слабая одноосновная кислота.
CsNO2
Нитрит цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
RbNO2
Нитрит рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
KNO2
Нитрит калия. Хорошо растворяется в воде, примерно 312 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
NaNO2
Нитрит натрия. Растворяется в воде, примерно 84 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
LiNO2
Нитрит лития. Хорошо растворяется в воде, примерно 105 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Ba(NO2)2
Нитрит бария. Растворяется в воде, примерно 74 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Sr(NO2)2
Нитрит стронция. Растворяется в воде, примерно 77 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Ca(NO2)2
Нитрит кальция. Растворяется в воде, примерно 77 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
NH4NO2
Нитрит аммония. Растворяется в воде, примерно 200 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Mg(NO2)2
Нитрит магния. Растворяется в воде.
В результате гидролиза, образуется слабощелочная среда.
Al(NO2)3
Нитрит алюминия. Растворяется в воде, примерно 63,7 гр на 100 мл при температуре 25oC.
Mn(NO2)2
Нитрит марганца. Растворяется в воде.
Раствор имеет нейтральную среду.
Zn(NO2)2
Нитрит цинка. Растворяется в воде.
Раствор имеет нейтральную среду.
Cr(NO2)3
Нитрит хрома.
Не существует в воде.
Fe(NO2)2
Нитрит железа (II).
Растворяется в воде.
Fe(NO2)3
Нитрит железа (III).
Не существует в воде.
Co(NO2)2
Нитрит кобальта.
Растворяется в воде.
Ni(NO2)2
Нитрит никеля.
Растворяется в воде.
Pb(NO2)2
Нитрит свинца.
Растворяется в воде.
Cu(NO2)2
Нитрит меди.
Растворяется в воде.
Hg(NO2)2
Нитрит ртути.
Плохо растворяется в воде.
AgNO2
Нитрит серебра.
Плохо растворяется в воде.
H2CO3
Угольная кислота.
Cлабая двухосновная кислота.
Cs2CO3
Карбонат цезия. Растворяется в воде, примерно 75,5 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
Rb2CO3
Карбонат рубидия. Хорошо растворяется в воде, примерно 223 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
K2CO3
Карбонат калия. Хорошо растворяется в воде, примерно 112 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
Na2CO3
Карбонат натрия. Растворяется в воде, примерно 29,4 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Li2CO3
Карбонат лития. Растворяется в воде, примерно 1,27 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
BaCO3
Карбонат бария.
Не растворяется в воде
SrCO3
Карбонат стронция.
Не растворяется в воде
CaCO3
Карбонат кальция.
Не растворяется в воде
(NH4)2CO3
Карбонат аммония. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 15oC.
MgCO3
Карбонат магния. Плохо растворяется в воде.
Al2(CO3)3
Карбонат алюминия.
Не существует в воде.
MnCO3
Карбонат марганца.
Не растворяется в воде.
ZnCO3
Карбонат цинка.
Не растворяется в воде.
Cr2(CO3)3
Карбонат хрома.
Не существует в воде.
FeCO3
Карбонат железа (II).
Не растворяется в воде.
Fe2(CO3)3
Карбонат железа (III).
Не существует в воде.
CoCO3
Карбонат кобальта.
Не растворяется в воде.
NiCO3
Карбонат никеля.
Не растворяется в воде.
PbCO3
Карбонат свинца.
Не растворяется в воде.
CuCO3
Карбонат меди.
Не растворяется в воде.
HgCO3
Карбонат ртути.
Не растворяется в воде.
Ag2CO3
Карбонат серебра.
Не растворяется в воде.
H2S
Сероводородная кислота.
Cлабая, двухосновная кислота.
Cs2S
Сульфид цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Rb2S
Сульфид рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
K2S
Сульфид калия. Реагирует с водой.
В результате гидролиза, образуется щелочная среда.
Na2S
Сульфид натрия. Растворяется в воде, примерно 20 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
Li2S
Сульфид лития. Хорошо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
BaS
Сульфид бария. Растворяется в воде, примерно 9 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
SrS
Сульфид стронция. Плохо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
CaS
Сульфид кальция. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
(NH4)2S
Сульфид аммония. Хорошо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
MgS
Сульфид магния. Плохо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Al2S3
Сульфид алюминия.
Не существует в воде.
MnS
Сульфид марганца. Не растворяется в воде.
ZnS
Сульфид цинка. Не растворяется в воде.
Cr2S3
Сульфид хрома.
Не существует в воде.
FeS
Сульфид железа (II). Не растворяется в воде.
Fe2S3
Сульфид железа (III). Диспропорционирует при растворении в воде.
CoS
Сульфид кобальта. Не растворяется в воде.
NiS
Сульфид никеля. Не растворяется в воде.
PbS
Сульфид свинца. Не растворяется в воде.
CuS
Сульфид меди. Не растворяется в воде.
HgS
Сульфид ртути.
Не существует в воде.
Ag2S
Сульфид серебра. Не растворяется в воде.
H2SiO3
Метакремниевая кислота.
Очень слабая кислота.
Cs2SiO3
Силикат цезия.
Не растворяется в воде.
Rb2SiO3
Силикат рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
K2SiO3
Силикат калия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Na2SiO3
Силикат натрия. Растворяется в воде, примерно 22 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
Li2SiO3
Силикат лития.
Не растворяется в воде.
BaSiO3
Силикат бария.
Не растворяется в воде.
SrSiO3
Силикат стронция.
Не растворяется в воде.
CaSiO3
Силикат кальция.
Не растворяется в воде.
(NH4)2SiO3
Силикат аммония.
Не существует в воде.
MgSiO3
Силикат магния.
Не растворяется в воде.
Al2(SiO3)3
Силикат алюминия.
Не существует в воде.
MnSiO3
Силикат марганца.
Не растворяется в воде.
ZnSiO3
Силикат цинка.
Не растворяется в воде.
Cr2(SiO3)3
Силикат хрома.
Не существует в воде.
FeSiO3
Силикат железа (II).
Не существует в воде.
Fe2(SiO3)3
Силикат железа (III).
Не существует в воде.
CoSiO3
Силикат кобальта.
Не существует в воде.
NiSiO3
Силикат никеля.
Не существует в воде.
PbSiO3
Силикат свинца.
Не растворяется в воде.
CuSiO3
Силикат меди.
Не существует в воде.
HgSiO3
Силикат ртути.
Не существует в воде.
Ag2SiO3
Силикат серебра.
Не существует в воде.
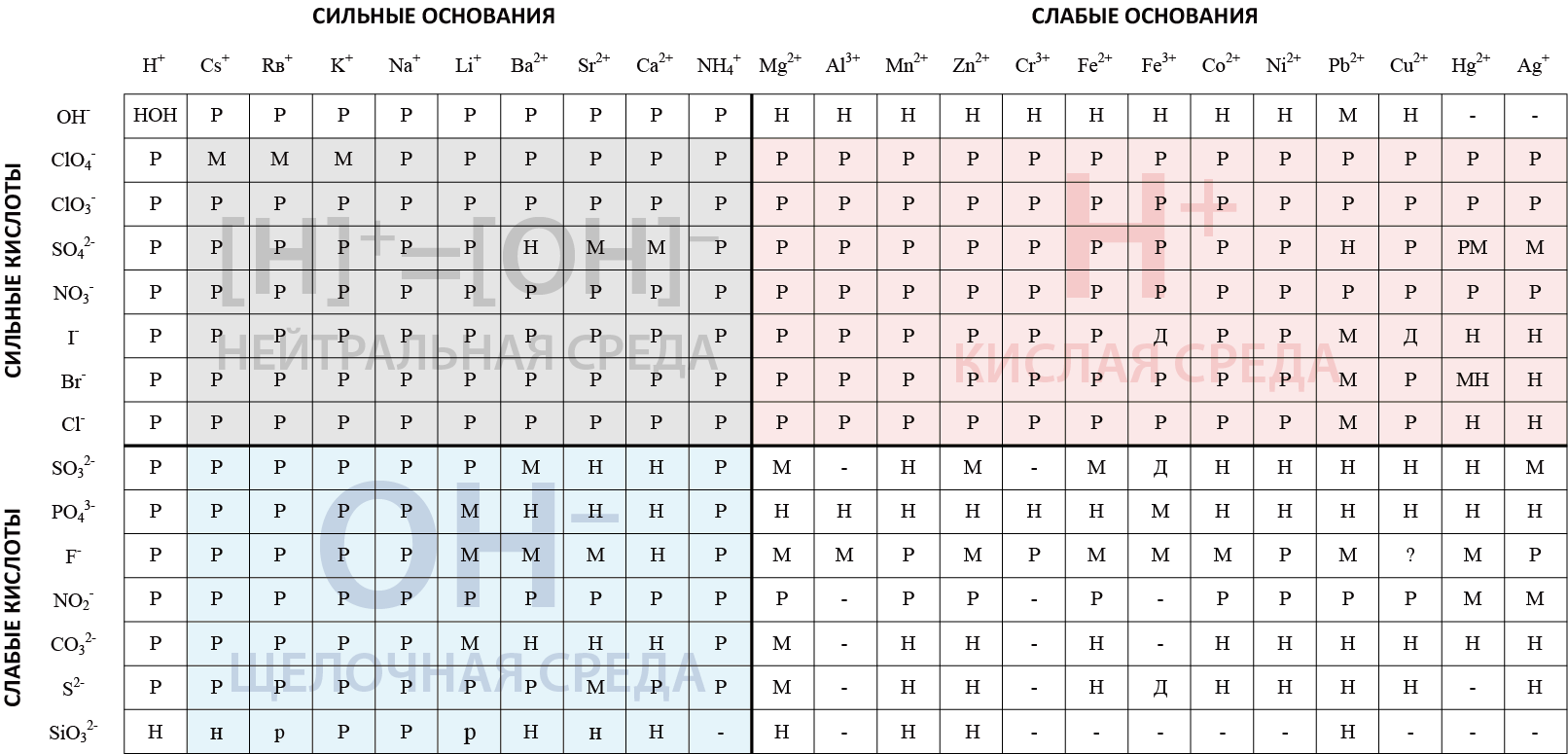
Нахождение соли в определенной части таблицы описывает результат гидролиза.
Если соль находится в секторе таблицы, обозначенной цветом:
такая соль будет диссоциировать и не будет подвергаться гидролизу.
гидролиз соли пройдет по кислотному типу и рН будет <7.
гидролиз соли пройдет по щелочному типу и рН при этом будет больше 7.
требует анализа: соль или нерастворима, как большинство солей в этом секторе таблицы или разлагается при растворении в воде. Если соль растворима, то обычно гидролиз приводит к образованию нейтральной среды, когда рН=7,0
Буферные растворы
Способность организма сохранять постоянство состава крови и других жидкостей происходит в результате функционирования буферных систем. В организм поступает и в нем производится множество веществ с различной кислотностью и щелочностью, но сохраняется способность изменять концентрацию ионов H+ и OH- в постоянных пределах pH = 7,37 – 7,44 для крови. Снижение или увеличение этих показателей может привести к смерти.
Буферными называются растворы, обладающие способностью сохранять практически постоянное значение pH при добавлении небольших количеств кислоты или щелочи, а также при разбавлении. Буферные системы состоят из слабого основания и его соли, образованной сильной кислотой. Или из слабой кислоты и ее соли, образованной сильным основанием.
Примеры: NH4OH + NH4Cl pH = 9,2 или CH3COOH + CH3COONa pH=4,7
При добавлении кислоты будут связываться ионы водорода, а при добавлении щелочи – ионы гидроксила. pH раствора изменится незначительно. Способность регулировать pH у буферных растворов регулируется буферной емкостью.
В каждой клетке организма работают разные буферные системы, поддерживающие постоянство внутренней среды.
Роль и практическое применение гидролиза
Обменные реакции между солями и водой широко распространены в природе.
Явление гидролиза играет огромную роль в химическом преобразовании земной коры. Многие минералы земной коры - это сульфиды металлов, которые хотя и плохо растворимы в воде, постепенно взаимодействуют с ней. Такие процессы идут и на поверхности Земли, и особенно интенсивно в ее глубинах при повышенной температуре. В результате образуется огромное количество сероводорода, который выбрасывается на поверхность при вулканической деятельности. А силикатные породы постепенно переходят в гидроксиды, а затем в оксиды металлов. В результате гидролиза минералов – алюмосиликатов – происходит разрушение горных пород.
Известный нам малахит (Cu2(OH)2CO2) – не что иное, как продукт гидролиза природных карбонатов.
В Мировом океане соли также интенсивно взаимодействуют с водой. Выносимые речной водой гидрокарбонаты кальция и магния придают морской воде слабощелочную реакцию. Именно в такой слабощелочной среде прибрежных вод рН приблизительно равно 9, наиболее интенсивно протекает фотосинтез в морских растениях и наиболее быстро развиваются морские животные. А если вспомнить о составе рН крови млекопитающих, в том числе и человека, то вы сможете не только сделать вывод о единстве животного мира на Земле, но и сформулировать и некоторые гипотезы о происхождении жизни на планете.
Гидролиз доставляет немало хлопот нефтяникам. Как известно, в нефти имеются примеси воды и многих солей, особенно хлоридов кальция и магния. При нагревании нефти в процессе ее переработки до 250 oС и выше происходит интенсивное взаимодействие указанных хлоридов с водяным паром. Образующийся при этом газообразный хлороводород вступает в реакцию с металлом, из которого сделано оборудование, разрушает его, что резко увеличивает стоимость нефтепродуктов.
Впрочем, на счету гидролиза немало и добрых дел. Например, образующийся при взаимодействии сульфата алюминия с водой мелкодисперсный осадок гидроксида алюминия уже несколько веков используется в качестве протравы при крашении. Оседая на ткань и прочно соединяясь с ней, гидроксид алюминия затем легко адсорбирует красители и образует весьма устойчивые красящие слои, которые выдерживают многократную стирку ткани. Без протравы качественной окраски тканей не получится.
Этот же процесс используют для очистки питьевой воды и промышленных стоков: рыхлый аморфный осадок гидроксида алюминия обволакивает частички грязи и адсорбирует вредные примеси, увлекая все это на дно. Примерно таков же механизм очистки природной воды глинами, которые представляют собой соединения алюминия.
Гидролиз солей Na2CO3, Na3PO4 применяется для очистки воды и уменьшения ее жесткости.
Известкование почв с целью понижения их кислотности также основано на реакции гидролиза
CO32-+HOH![]() HCO3-+OH+
HCO3-+OH+
Посредством гидролиза в промышленности из непищевого сырья (древесины, хлопковой шелухи, подсолнечной лузги, соломы) вырабатывается ряд ценных продуктов: этиловый спирт, белковые дрожжи, глюкоза, сухой лед (CO2).
Глоссарий
- Аквакомплексы – комплексы, включающие в состав молекулы воды – или кристаллогидраты.
- Буфер, буферная система (англ. buffer, от buff – смягчать удар) – растворы с определённой устойчивой концентрацией водородных или гидроксид-ионов.
Библиография
- Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. – С. 244
- Ефимов А.И. и др. Свойства неорганических соединений. Справочник. - Л.: Химия, 1983. – С. 140-141
- Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. - Мн.: Современная школа, 2005. - 608 с ISBN 985-6751-04-7.
Шведский физикохимик Сванте Август Аррениус родился в имении Вейк, недалеко от Упсалы.
Аррениус исследовал прохождение электрического тока через многие типы растворов. Он выдвинул предположение, что молекулы некоторых веществ при растворении в жидкости диссоциируют, или распадаются, на две или более частиц, которые он назвал ионами. Несмотря на то, что каждая целая молекула электронейтральна, ее частицы несут небольшой электрический заряд – либо положительный, либо отрицательный, в зависимости от природы частицы. Например, молекулы хлорида натрия (соль) при растворении в воде распадаются на положительно заряженные ионы натрия и отрицательно заряженные ионы хлора. Эти заряженные атомы, активные составные части молекулы, образуются только в растворе и создают возможность для прохождения электрического тока. Электрический ток в свою очередь направляет активные составные части к противоположно заряженным электродам.
Эта гипотеза составила основу докторской диссертации Аррениуса, которую он в 1884 г. представил к защите в Упсальском университете. В то время, однако, многие ученые сомневались в том, что в растворе могут сосуществовать противоположно заряженные частицы, и совет факультета не оценил его диссертацию по достоинству.
Только в 1903 г. Аррениусу была присуждена Нобелевская премия по химии, «как факт признания особого значения его теории электролитической диссоциации для развития химии». Выступая от имени Шведской королевской академии наук, X. Р. Тернеблад подчеркнул, что теория ионов Аррениуса заложила качественную основу электрохимии, «позволив применять к ней математический подход». «Одним из наиболее важных результатов теории Аррениуса, – сказал Тернеблад, – является завершение колоссального обобщения, за которое первая Нобелевская премия по химии была присуждена Вант-Гоффу».
Как стирать содой в стиральной машине? Для этого нужно прямо в барабан насыпать полстакана соды и стирать в обычном режиме. Если белья очень много, можно увеличить объем до стакана. А если добавить еще и стакан белого уксуса, то это усилит дезодорирующий эффект соды.
Выведение пятен при помощи соды
Предлагаем вашему вниманию несколько действенных методик по применению соды для устранения загрязнений:
- Чтобы вывести пятно, надо приготовить содовую пасту: столовую ложку средства перемешать с водой. Можно также вместо воды добавить перекись водорода или уксус. Полученную пасту нанесите на пятно и подождите пятнадцать минут, затем смыть. Если загрязнение не исчезло, повторите процедуру. Можно также попробовать удалить пасту старой зубной щеткой, если пятно сильно въелось. Не стоит только использовать соду из пасты на деликатных тканях;
- Соду можно использовать и для очищения вещей, предназначенных только для сухой чистки. Для этого следует нанести тонкий слой средства на вещь (для удобства хорошо подойдет сито), после этого упаковать в герметичный пакет и оставить на 2 часа. После струсите соду и оставьте вещь на 40 минут на свежем воздухе;
- Чтобы просто избавиться от неприятного запаха и при этом не наносить соду непосредственно на одежду, можно насыпать ее в чистый носок, завязать его, положить в пакет с одеждой, загерметизировать и оставить на ночь в сухом прохладном месте. Утром раскройте пакет и вытряхните соду. Желательно повесить после этого вещь сушиться на солнце и на свежем воздухе на несколько часов. Если необходимо, повторите процедуру;
- Пятна на ковре или скатерти хорошо удаляет сода, гашеная уксусом. Для этого сначала посыпьте ее на пятно, затем смочите тряпочку в уксусе и круговыми движениями от середины к краям разотрите загрязненный участок. Если есть необходимость, повторите процедуру, после чего ополосните обработанное место в чистой воде.
Отбеливание с помощью соды
Можно ли постирать содой и при этом отбелить вещь? Да, для этого идеально подходит смесь: сода и нашатырный спирт. Нужно взять пять литров чистой воды, и развести в ней пять ложек соды и две ложки нашатыря. Замочите в этом растворе вещи белого цвета на три-четыре часа. Потом прополощите и постирайте любым способом. Если после замачивания белье прокипятить в этом растворе полчаса, то это поможет к тому же удалить желтизну.
Как стирать кальцинированной содой?
Обычно, когда упоминается сода, многие думают, что речь идет о пищевой добавке, но есть еще и кальцинированная сода, которая гораздо эффективнее первой. Приобрести ее можно в отделе бытовой химии. Использование кальцинированной соды:
- Для удаления накипи и известкового налета на деталях стиральной машины, а также от неприятного запаха, возникающего при неправильной ее эксплуатации. Для этого нужно смешать средство с водой в соотношении один к одному, нанести полученную смесь на манжету, барабан и лоток для порошка на тридцать минут и убрать с помощью тряпки. Далее включите режим быстрой стирки, не загружая белья;
- Хорошо смягчает воду. Для этого необходимо добавить в порошок две столовые ложки средства (при большой степени жесткости можно использовать пять ложек). Температура воды при этом должна быть не ниже пятидесяти градусов. Эта процедура к тому же предотвратит образование накипи. Только это не подходит для стирки шелковых и шерстяных вещей;
- Для замачивания белья. Возьмите 3 столовые ложки средства и растворите их в десяти литрах воды температурой сорок градусов. Положите вещи в получившийся раствор. Через два-три часа постирайте любым способом;
- Для эффективной стирки кухонных полотенец отлично подходит следующий рецепт: горсть средства смешать с тертым хозяйственным мылом и положить смесь в эмалированное ведро, наполовину наполненное водой. После растворения смеси положите туда полотенца и закипятите на медленном огне минут двадцать. Потом постирайте в машинке как обычно;
- Еще более эффективно отстирать жирные пятна на полотенцах поможет смесь соды, растительного масла, отбеливателя и порошка. Возьмите по 3 столовые ложки каждого ингредиента, засыпьте в ведро с кипятком воды и положите туда полотенца. Пусть они полежат там до полного остывания. Можно оставить и на ночь. Ополосните в чистой теплой воде и постирайте в машинке.
Универсальное чистящее средство с содой
Можно самим сделать средство впрок, которое подойдет как для мытья посуды, так и для чистки сантехники. Для этого нужно:
- детское мыло, натертое на терке,
- налить стакан воды,
- потом взбить,
- добавить еще стакан, и постепенно добавляя 250 граммов соды,
- опять взбить.
Полученной пастой можно удалять даже известь.
Другие рецепты различных чистящих средств на основе соды
С использованием средства можно приготовить также:
- смесь для мытья посуды;
- гель для стирки;
- средство для чистки ванны.
Чтобы сделать гель для мытья посуды, возьмите хозяйственное мыло (двадцать пять граммов), 100 грамм пищевой соды, пол-литра горячей воды, четыре ложки глицерина и одну ложку водки или разведенного спирта. Натрите мыло на терке, влейте небольшое количество воды и поставьте в микроволновку. Постоянно помешивая, вливайте оставшуюся воду. После растворения мыла, дайте ему остыть, добавьте глицерин с водкой и перемешайте. Снимите образовавшуюся пену, влейте в специальную емкость и пользуйтесь.
Для получения геля для стирки надо взять литр воды, пятьдесят граммов тертого хозяйственного мыла и сорок пять граммов кальцинированной соды. Поместите в кипящую воду мыльную стружку, хорошо перемешивая ее при этом. Затем добавьте соду, и тоже все перемешайте, пока она не растворится. На пять килограммов белья берется две столовые ложки готового геля и помещается в барабан.
Средство для чистки ванны можно изготовить из смеси половины стакана соды, жидкого мыла и пяти капель масла розмарина или лаванды. Перемешайте соду с мылом и добавьте масло. Чтобы смесь не засохла, нужно добавить туда чайную ложку глицерина и плотно закрыть.
22 марта во всем мире отмечается День водных ресурсов. Этот праздник был установлен по решению Генеральной Ассамблеи Организации Объединенных Наций, чтобы напомнить человечеству о важности водных ресурсов для окружающей среды и развития общества.
В настоящее время 70% территории нашей планеты покрыты водой. При этом пить можно только 1% этой воды. С каждым годом проблема доступа к водным ресурсам становится острее. За последние 50 лет в мире произошло целых 507 конфликтов, связанных с доступом к воде. 21 спор привел к военным действиям.
Вода – самое простое и привычное вещество на планете. Но в то же время она таит в себе множество загадок. Ее до сих пор продолжают исследовать ученые, находя все больше интересных данных о воде.
Знаете ли вы, что
самая чистая вода в Финляндии?
По данным ЮНЕСКО, самая чистая вода находится в Финляндии. Всего в исследовании свежей природной воды принимало участие 122 страны. При этом 1 млрд людей по всему миру вообще не имеет доступа к безопасной воде.
лед быстрее получить из горячей воды?
Если рассуждать логически, то, конечно, холодная. Ведь горячей нужно сначала остыть, а потом уже замерзнуть, а вот холодной остывать не нужно. Однако опыты показывают, что в лед быстрее превращается именно горячая вода.
Точного ответа на вопрос, почему все-таки горячая вода замерзает быстрее холодной, до сих пор не существует. Возможно, дело в разнице в переохлаждении, испарении, образовании льда, конвекции, либо причина в воздействии разжиженных газов на горячую и холодную воду.
существует сверхохлаждение воды?
Все хорошо помнят из школьного курса физики, что вода замерзает при 0 градусов, а при 100 градусах закипает. Однако существует так называемое сверхохлаждение воды. Таким свойством обладает очень чистая вода – без примесей. Даже при охлаждении ниже точки замерзания такая вода остается жидкой. Но и в том, и в другом случае существуют температуры, при которых вода станет льдом или закипит.
у воды более 3 агрегатных состояний?
Еще со школы все знают, что у воды есть 3 агрегатных состояния: твердое, жидкое и газообразное. Однако ученые выделяют 5 различных состояний воды в жидком виде и 14 состояний в замерзшем виде.
Что будет, если, например, взять замерзшую чистую воду и продолжить охлаждение? С водой произойдут чудесные превращения. При минус 120 градусах по Цельсию вода становится сверхвязкой или тягучей, а при температуре ниже минус 135 градусов она превращается в "стеклянную" воду. "Стеклянная" вода – это твердое вещество, в котором отсутствует кристаллическая структура, как в стекле.
Классы снежинок по Международной классификации снега.
© А. К. Дюнин, В царстве снега, Издательство «Наука», Новосибирск, 1983
-

Пластинки
Самые простые из снежинок — плоские шестиугольные призмы. -

Звезды
Как и пластинки, звезды обычно плоские и тонкие, с шестью лучами. -

Столбики
Полые внутри, могут иметь форму карандаша. -

Иглы
Длинные и тонкие кристаллы, иногда состоят из нескольких веточек. -

Пространственные дендриты
Объемные снежинки, образуются при срастании нескольких кристаллов. -

Увенчанные столбики
Образуются в случае, если столбики попадают в иные условия, и кристаллы меняют направление роста. -

Неправильные кристаллы
Самый распространенный тип. Образуется при повреждении снежинки.
© Kichigin | Shutterstock.com