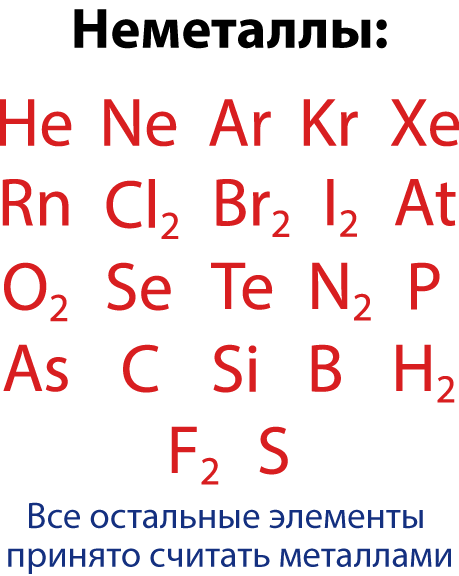Химия: Классы неорганических соединений — различия между версиями
Admine2 (обсуждение | вклад) (→Химические свойства кислот) |
Admine2 (обсуждение | вклад) |
||
| (не показаны 122 промежуточные версии этого же участника) | |||
| Строка 1: | Строка 1: | ||
{{Якорь|Начало}} | {{Якорь|Начало}} | ||
<div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | ||
| − | + | {{right|[[file:Neorganicheskie-veshestva.png|350px|class=show-for-large-up|link=]]}} | |
| − | + | <span class="firstcharacter">П</span>редставленная таблица «Класификация неорганических соединений» содержит информацию о всех, изучаемых в курсе средней школы классах неорганических соединений. Вещества делятся на простые и сложные, причем простые вещества делятся на благородные газы, металлы и неметаллы. Выделение благородных газов в отдельную группу веществ, подчеркивает их исключительные свойства инертности – невозможности создавать химические связи в нормальных условиях. Типичные металлы в таблице окрашены в синий цвет, неметаллы в красный цвет. {{center|[[file:Neorganicheskie-veshestva.png|class=hide-for-large-up|link=]]}} Металлы с амфотерными свойствами окрашены в фиолетовый цвет, который включает и синий и красный цвета. | |
| − | + | <div class="textblock">Свойство амфотерности – двойственности проявляется в способности к созданию химических соединений. Это дает возможность амфотерным соединениям проявлять свойства металлов в реакциях с неметаллами и свойства неметаллов в реакциях с типичными металлами. </div> | |
| − | + | Сложные вещества делятся на '''оксиды''', '''гидроксиды''' и '''соли'''. Каждый класс соединений, в свою очередь, делится на виды соединений. | |
| − | + | Оксиды включают '''несолеобразующие''', '''основные''', '''амфотерные''' и '''кислотные''' оксиды. | |
| − | + | Гидроксиды делятся на '''щелочи''' (растворимые основания), '''основания''', '''амфотерные основания''' и '''кислоты'''. | |
| − | + | Соли включают '''нормальные''' или '''средние''' соли, '''кислые''', '''основные''', '''комплексные''' или '''двойные''', и '''смешанные''' соли. | |
| − | + | '''Все соединения располагаются в порядке уменьшения их реагирующей способности слева направо.''' | |
| − | Для | + | {{center|[[file:Ролик-2 сайт.mp4|740px|start=5]]}} |
| + | |||
| + | Для объяснения принципов использования таблицы разработаны правила: | ||
| + | <div style="color:#004c5d; text-indent:0;"> | ||
| + | <p>'''1)''' Легче всего химические реакции происходят между веществами, формулы которых окрашены в противоположные цвета – <span style="display:inline-block; width:15px; height:10px; background-color:#0e1466;"></span> синий и <span style="display:inline-block; width:15px; height:10px; background-color:#db0000;"></span> красный.</p> | ||
| − | == | + | <p>'''2)''' Вещества, формулы которых окрашены в <span style="display:inline-block; width:15px; height:10px; background-color:#660a66;"></span> фиолетовый цвет, способны реагировать с веществами, формулы которых окрашены как в <span style="display:inline-block; width:15px; height:10px; background-color:#0e1466;"></span> синий, так и в <span style="display:inline-block; width:15px; height:10px; background-color:#db0000;"></span> красный цвет.</p> |
| − | + | <p>'''3)''' Вещества, формулы которых окрашены в одинаковый цвет между собой не реагируют.</p> | |
| − | + | <p>'''4)''' Оксиды реагируют с простыми веществами и гидроксидами и не могут реагировать с солями.</p> | |
| − | |||
| − | ''' | ||
| − | ''' | + | <p>'''5)''' Гидроксиды реагируют с оксидами и солями.</p> |
| − | + | <p>'''6)''' Соли могут реагировать только с гидроксидами.</p> | |
| + | </div> | ||
| + | Для подтверждения этих правил, все названные группы веществ сгруппированы в широкие полоски. Расположение металлов, неметаллов и сложных веществ в определенном порядке подчиняется свойству активности веществ. Сохранение генетической связи элемента с его соединениями выполненное в цвете, позволяет быстро научить разбираться, какие группы веществ будут реагировать с друг с другом , а какие не будут. | ||
| − | ( | + | == Классификация неогранических соединений == |
| + | <br> | ||
| + | <div class="kns-content"> | ||
| + | |||
| + | <div class="forin"> | ||
| + | <div class="line"> | ||
| + | <div class="klas" style="padding-top:5px;">Благородные газы</div> | ||
| + | <div class="bgaz tkras">Rn</div> | ||
| + | <div class="bgaz tkras">Xe</div> | ||
| + | <div class="bgaz tkras">Kr</div> | ||
| + | <div class="bgaz tkras">Ar</div> | ||
| + | <div class="bgaz tkras">Ne</div> | ||
| + | <div class="bgaz tkras">He</div> | ||
| + | </div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz tsin">Li</div> | ||
| + | <div class="bgaz tsin">Rb</div> | ||
| + | <div class="bgaz tsin">K</div> | ||
| + | <div class="bgaz tsin">Cs</div> | ||
| + | <div class="bgaz tsin">Ba</div> | ||
| + | <div class="bgaz tsin">Ca</div> | ||
| + | <div class="bgaz tsin">Na</div> | ||
| + | <div class="bgaz tsin">Mg</div> | ||
| + | <div class="bgaz amfot">Al</div> | ||
| + | <div class="bgaz amfot">Mn<sup>2+</sup></div> | ||
| + | <div class="bgaz amfot">Zn</div> | ||
| + | <div class="bgaz amfot">Cr<sup>3+</sup></div> | ||
| + | <div class="bgaz tsin">Fe<sup>2+</sup></div> | ||
| + | <div class="bgaz tsin">Ni</div> | ||
| + | <div class="bgaz amfot">Sn</div> | ||
| + | <div class="bgaz amfot">Pb</div> | ||
| + | <div class="bgaz amfot">Fe<sup>3+</sup></div> | ||
| + | <div class="bgaz kras">| H<sub>2</sub> |</div> | ||
| + | <div class="bgaz tsin">Cu</div> | ||
| + | <div class="bgaz tsin">Ag</div> | ||
| + | <div class="bgaz tsin">Hg<sup>2+</sup></div> | ||
| + | <div class="bgaz tsin">Pt</div> | ||
| + | <div class="bgaz tsin">Au</div> | ||
| + | </div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz kras">H<sub>2</sub></div> | ||
| + | <div class="bgaz kras">C</div> | ||
| + | <div class="bgaz kras">O<sub>2</sub></div> | ||
| + | <div class="bgaz kras">Cl<sub>2</sub></div> | ||
| + | <div class="bgaz kras">Br<sub>2</sub></div> | ||
| + | <div class="bgaz kras">I<sub>2</sub></div> | ||
| + | <div class="bgaz kras">N<sub>2</sub></div> | ||
| + | <div class="bgaz kras">P</div> | ||
| + | <div class="bgaz kras">Si</div> | ||
| + | <div class="bgaz kras">S</div> | ||
| + | </div> | ||
| + | </div> | ||
| + | <br claer="all"> | ||
| + | |||
| + | <div class="forin"> | ||
| + | <div class="line"> | ||
| + | Безразличные (несолеобразующие) | ||
| + | <div class="bgaz golub">H<sub>2</sub>O</div> | ||
| + | <div class="bgaz golub">CO</div> | ||
| + | <div class="bgaz golub">SiO</div> | ||
| + | <div class="bgaz golub">NO</div> | ||
| + | <div class="bgaz golub">N<sub>2</sub>O</div> | ||
| + | </div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz tsin">K<sub>2</sub>O</div> | ||
| + | <div class="bgaz tsin">Na<sub>2</sub>O</div> | ||
| + | <div class="bgaz tsin">BaO</div> | ||
| + | <div class="bgaz tsin">CaO</div> | ||
| + | <div class="bgaz tsin">MgO</div> | ||
| + | <div class="bgaz tsin">FeO</div> | ||
| + | <div class="bgaz tsin">CrO</div> | ||
| + | <div class="bgaz tsin">MnO</div> | ||
| + | <div class="bgaz tsin">VO</div> | ||
| + | <div class="bgaz tsin">PbO</div> | ||
| + | <div class="bgaz tsin">SnO</div> | ||
| + | <div class="bgaz tsin">CuO</div> | ||
| + | </div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz amfot">Al<sub>2</sub>O<sub>3</sub></div> | ||
| + | <div class="bgaz amfot">ZnO</div> | ||
| + | <div class="bgaz amfot">Fe<sub>2</sub>O<sub>3</sub></div> | ||
| + | <div class="bgaz amfot">Cr<sub>2</sub>O<sub>3</sub></div> | ||
| + | <div class="bgaz amfot">MnO<sub>2</sub></div> | ||
| + | <div class="bgaz amfot">V<sub>2</sub>O<sub>3</sub></div> | ||
| + | <div class="bgaz amfot">PbO<sub>2</sub></div> | ||
| + | <div class="bgaz amfot">SnO<sub>2</sub></div> | ||
| + | </div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz kras">Cl<sub>2</sub>O<sub>7</sub></div> | ||
| + | <div class="bgaz kras">SO<sub>3</sub></div> | ||
| + | <div class="bgaz kras">N<sub>2</sub>O<sub>5</sub></div> | ||
| + | <div class="bgaz kras">P<sub>2</sub>O<sub>5</sub></div> | ||
| + | <div class="bgaz kras">SO<sub>2</sub>{{arrowUp}}</div> | ||
| + | <div class="bgaz kras">N<sub>2</sub>O<sub>3</sub></div> | ||
| + | <div class="bgaz kras">P<sub>2</sub>O<sub>3</sub></div> | ||
| + | <div class="bgaz kras">CO<sub>2</sub>{{arrowUp}}</div> | ||
| + | <div class="bgaz kras">SiO<sub>2</sub>{{arrowdown}}</div> | ||
| + | <div class="bgaz kras">CrO<sub>3</sub></div> | ||
| + | <div class="bgaz kras">Mn<sub>2</sub>O<sub>7</sub></div> | ||
| + | <div class="bgaz kras">V<sub>2</sub>O<sub>5</sub></div> | ||
| + | </div> | ||
| + | </div> | ||
| + | <br claer="all"> | ||
| + | |||
| + | <div class="forin"> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz tsin">CsOH</div> | ||
| + | <div class="bgaz tsin">RbOH</div> | ||
| + | <div class="bgaz tsin">KOH</div> | ||
| + | <div class="bgaz tsin">NaOH</div> | ||
| + | <div class="bgaz tsin">LiOH</div> | ||
| + | </div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz tsin">Ba(OH)<sub>2</sub></div> | ||
| + | <div class="bgaz tsin">Ca(OH)<sub>2</sub></div> | ||
| + | <div class="bgaz tsin">Mg(OH)<sub>2</sub>{{arrowdown}}</div> | ||
| + | <div class="bgaz tsin">Cu(OH)<sub>2</sub>{{arrowdown}}</div> | ||
| + | <div class="bgaz tsin">Fe(OH)<sub>2</sub>{{arrowdown}}</div> | ||
| + | <div class="bgaz tsin">Cr(OH)<sub>2</sub>{{arrowdown}}</div> | ||
| + | <div class="bgaz tsin">NH<sub>4</sub>OH</div> <small style="font-size:60%">Самое слабое основание</small> | ||
| + | </div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz amfot">Al(OH)<sub>3</sub></div> | ||
| + | <div class="bgaz amfot">Zn(OH)<sub>2</sub></div> | ||
| + | <div class="bgaz amfot">Fe(OH)<sub>3</sub></div> | ||
| + | <div class="bgaz amfot">Cr(OH)<sub>3</sub></div> | ||
| + | <div class="bgaz amfot">Pb(OH)<sub>4</sub></div> | ||
| + | <div class="bgaz amfot">Sn(OH)<sub>4</sub></div> | ||
| + | <p style="display:block"> <small style="font-size:65%">H<sub>3</sub>AlO<sub>3</sub> → HAlO<sub>2</sub> + H<sub>2</sub>O; H<sub>2</sub>ZnO<sub>2</sub>; H<sub>3</sub>FeO<sub>3</sub> → HFeO<sub>2</sub> + H<sub>2</sub>O;</small></p> | ||
| + | <p style="display:block"><small style="font-size:65%">H<sub>3</sub>CrO<sub>3</sub> → HCrO<sub>2</sub> + H<sub>2</sub>O; H<sub>4</sub>PbO<sub>4</sub> → H<sub>2</sub>PbO<sub>3</sub> + H<sub>2</sub>O; H<sub>4</sub>SnO<sub>4</sub> → H<sub>2</sub>O + H<sub>2</sub>SnO<sub>3</sub></small></p> | ||
| + | </div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz kras">HClO<sub>4</sub></div> | ||
| + | <div class="bgaz kras">H<sub>2</sub>SO<sub>4</sub></div> | ||
| + | <div class="bgaz kras">HNO<sub>3</sub></div> | ||
| + | <div class="bgaz kras">HI</div> | ||
| + | <div class="bgaz kras">HBr</div> | ||
| + | <div class="bgaz kras">HCl</div> | ||
| + | <div class="bgaz kras">H<sub>4</sub>P<sub>2</sub>O<sub>7</sub></div> | ||
| + | <div class="bgaz kras">H<sub>2</sub>SO<sub>3</sub>{{arrowUp}}</div> | ||
| + | <div class="bgaz kras">H<sub>3</sub>PO<sub>4</sub></div> | ||
| + | <div class="bgaz kras">HF</div> | ||
| + | <div class="bgaz kras">HNO<sub>2</sub></div> | ||
| + | <div class="bgaz kras">H<sub>2</sub>CO<sub>3</sub>{{arrowUp}}</div> | ||
| + | <div class="bgaz kras">H<sub>2</sub>S{{arrowUp}}</div> | ||
| + | <div class="bgaz kras">HCN</div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz">H<sub>2</sub>CrO<sub>4</sub></div> | ||
| + | <div class="bgaz">H<sub>2</sub>Cr<sub>2</sub>O<sub>7</sub></div> | ||
| + | <div class="bgaz">HMnO<sub>4</sub></div> | ||
| + | </div> | ||
| + | </div> | ||
| + | </div> | ||
| + | <br claer="all"> | ||
| + | |||
| + | <div class="forin"> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz zel">Na<sub>2</sub>SO<sub>4</sub></div> | ||
| + | <div class="bgaz zel">K<sub>2</sub>CO<sub>3</sub>{{arrowUp}}</div> | ||
| + | <div class="bgaz zel">Ba(NO<sub>3</sub>)<sub>2</sub></div> | ||
| + | <div class="bgaz zel">CaCO<sub>3</sub>{{arrowUp}}</div> | ||
| + | <div class="bgaz zel">MgBr<sub>2</sub></div> | ||
| + | <div class="bgaz zel">Na<sub>3</sub>PO<sub>4</sub></div> | ||
| + | <div class="bgaz zel">CuSO<sub>3</sub>{{arrowUp}}</div> | ||
| + | <div class="bgaz zel"><span class="amfot">Zn</span>CO<sub>3</sub>{{arrowUp}}</div> | ||
| + | <div class="bgaz zel"><span class="amfot">Al<sub>2</sub></span>(SO<sub>4</sub>)<sub>3</sub></div> | ||
| + | </div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz zel">Na<span class="kras">H</span>SO<sub>4</sub></div> | ||
| + | <div class="bgaz zel">K<span class="kras">H</span>CO<sub>3</sub>{{arrowUp}}</div> | ||
| + | <div class="bgaz zel">Ba(<span class="kras">H</span>S)<sub>2</sub></div> | ||
| + | <div class="bgaz zel">Ca(<span class="kras">H</span>CO<sub>3</sub>)<sub>2</sub>{{arrowUp}}</div> | ||
| + | <div class="bgaz zel">Mg<span class="kras">H</span>PO<sub>4</sub></div> | ||
| + | <div class="bgaz zel">Na<span class="kras">H<sub>2</sub></span>PO<sub>4</sub></div> | ||
| + | <div class="bgaz zel">Na<span class="kras">H</span>PO<sub>4</sub></div> | ||
| + | <div class="bgaz zel">Cu(<span class="kras">H</span>SO<sub>3</sub>)<sub>2</sub>{{arrowUp}}</div> | ||
| + | <div class="bgaz zel">Zn(<span class="kras">H</span>CO<sub>3</sub>)<sub>2</sub>{{arrowUp}}</div> | ||
| + | </div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz zel">Ba<span class="tsin">(OH)</span>NO<sub>3</sub></div> | ||
| + | <div class="bgaz zel">Mg<span class="tsin">(OH)</span>Cl</div> | ||
| + | <div class="bgaz zel">Ca<span class="tsin">(OH)</span>I</div> | ||
| + | <div class="bgaz zel">Fe<span class="tsin">(OH)</span>Cl<sub>2</sub></div> | ||
| + | <div class="bgaz zel">Fe<span class="tsin">(OH)<sub>2</sub></span>Cl</div> | ||
| + | <div class="bgaz zel">Al<span class="tsin">(OH)</span>SO<sub>4</sub></div> | ||
| + | <div class="bgaz zel">Zn<span class="tsin">(OH)</span>Cl</div> | ||
| + | </div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz tkras">KNaSO<sub>4</sub></div> | ||
| + | <div class="bgaz tkras">KAl(SO<sub>4</sub>)<sub>2</sub></div> | ||
| + | <div class="bgaz tkras">NH<sub>4</sub>Fe(SO<sub>4</sub>)<sub>2</sub></div> | ||
| + | </div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz kompl">K<sub>3</sub>[Fe(CN)<sub>6</sub>]</div> | ||
| + | <div class="bgaz kompl">K<sub>4</sub>[Fe(CN)<sub>6</sub>]</div> | ||
| + | <div class="bgaz kompl">[Cu(NH<sub>3</sub>)<sub>4</sub>]SO<sub>4</sub></div> | ||
| + | </div> | ||
| + | <div class="line"> | ||
| + | |||
| + | <div class="bgaz">K<div class="arrow"></div><span style="position:absolute; top:0; left:25px; margin-top:-10px;">Cl</span> <span style="position:absolute; top:20px; left:25px; margin-top:-10px;">OCl</span></div> | ||
| + | </div> | ||
| + | </div> | ||
| + | </div> | ||
| + | {{center|[[file:Shkala electrootric.png|Шкала электроотрицательности химических элементов]]}}<br> | ||
| − | + | <div id="KNS-conteinersrs"> | |
| − | + | <div id="prostyeveshestva"> | |
| + | <div id="prostyeislojnye"> | ||
| + | === Простые и сложные вещества === | ||
'''Все химические вещества делятся на простые и сложные.''' | '''Все химические вещества делятся на простые и сложные.''' | ||
| − | + | {{center|[[file:Prostie slojnie vesh.png|Простые и сложные вещества|link=]]}} | |
| − | К простым веществам относятся те, которые состоят из атомов одного химического элемента. | + | К '''простым''' веществам относятся те, которые состоят из атомов одного химического элемента. |
В зависимости от количества атомов в составе простого вещества или от различного строения кристаллической решетки, простые вещества создают различные аллотропные модификации или аллотропные видоизменения (например О<sub>2</sub> – кислород и О<sub>3</sub> – озон; алмаз и графит). | В зависимости от количества атомов в составе простого вещества или от различного строения кристаллической решетки, простые вещества создают различные аллотропные модификации или аллотропные видоизменения (например О<sub>2</sub> – кислород и О<sub>3</sub> – озон; алмаз и графит). | ||
| − | Вещества состоящие из атомов двух или более химических элементов называются сложными химическими веществами. | + | Вещества состоящие из атомов двух или более химических элементов называются '''сложными''' химическими веществами. |
При взаимодействии двух элементов образуются бинарные соединения. | При взаимодействии двух элементов образуются бинарные соединения. | ||
При наименовании бинарных соединений, их окончание обозначается суффиксом – ид. Например: Mg<sub>3</sub>N<sub>2</sub> – нитрид магния. | При наименовании бинарных соединений, их окончание обозначается суффиксом – ид. Например: Mg<sub>3</sub>N<sub>2</sub> – нитрид магния. | ||
Мы подробно рассмотрим наиболее важную группу бинарных соединений – оксиды. | Мы подробно рассмотрим наиболее важную группу бинарных соединений – оксиды. | ||
| + | </div> | ||
| + | <div id="meneme"> | ||
| + | |||
| + | === Металлы и неметаллы === | ||
| + | Условно все элементы делят на две группы – металлы и неметаллы. | ||
| + | {{left|[[file:KNS.png|250px|class=show-for-large-up|Металлы и неметаллы|link=]]}} | ||
| + | '''Металлами''' называют элементы, обладающие способностью легко отдавать имеющиеся у них на внешнем электронном слое 1,2, 3 электрона. | ||
| + | |||
| + | '''Неметаллами''' называют элементы с 4 и более электронами на внешнем электронном слое (а также бор , у которого 3 электрона на внешнем электронном слое). | ||
| + | {{center|[[file:НеметаллыKNS.png|250px|class=hide-for-large-up|Металлы и неметаллы|link=]]}} | ||
| + | Однако среди неметаллов встречается группа элементов, которые являются газами и молекула который состоит из одного атома – это инертные или благородные газы (VIII – A группа). А среди металлов встречаются такие, соединения которых проявляют как свойства кислоты, так и свойства основания, поэтому их называют амфотерные – т.е. «двойственные». | ||
| + | |||
| + | (Сравни названия с корнем «амфос» - амфора - ваза с двумя ручками, амфибия - животное, которое дышит и в воде и на воздухе – например, лягушка). | ||
| + | |||
| + | В предлагаемой таблице элементы с металлическими свойствами и их соединения обозначены синим цветом. Элементы с неметаллическими свойствами и их соединения обозначены красным цветом. В связи с тем, что амфотерные вещества включают двойственные свойства, они обозначены фиолетовым цветом, так как фиолетовый цвет получается при смешивании красного и синего.</div> | ||
| + | </div> | ||
| + | <div id="oksidy"> | ||
== Оксиды == | == Оксиды == | ||
| − | Оксидами называются сложные химические вещества, состоящие из атомов двух элементов, | + | {{center|'''Оксидами называются сложные химические вещества, состоящие из атомов двух элементов, одним из которых является кислород.'''}} |
| + | |||
| + | {{center|[[file:OksidyCvetnye.png|Оксиды различных металлов|link=]]}} | ||
| + | <br> | ||
| + | При наименовании оксидов вначале указывается корень слова – «окси» –, затем добавляется суффикс – «ид» и называется элемент в родительном падеже. '''Например:''' ВаО – оксид бария. | ||
| − | + | Для элементов с переменной валентностью указывается валентность элемента в составе оксида, '''например''': СuO – оксид меди (II) или Cu<sub>2</sub>O – оксид меди (I). | |
| − | Оксиды делятся на 4 группы – несолеобразующие, основные, амфотерные и кислотные. | + | Оксиды делятся на '''4 группы''' – '''несолеобразующие, основные, амфотерные и кислотные.''' |
К несолеобразующим оксидам относятся оксиды неметаллов со степенью окисления +1 и +2 (H<sub>2</sub>O, CO, SiO, NO, N<sub>2</sub>O). | К несолеобразующим оксидам относятся оксиды неметаллов со степенью окисления +1 и +2 (H<sub>2</sub>O, CO, SiO, NO, N<sub>2</sub>O). | ||
| Строка 65: | Строка 310: | ||
(Для Cl, Br, I степень окисления также равна +1) (Cl<sub>2</sub>O), и оксиды металлов со степенью окисления +5, +6, +7 (CrO<sub>3</sub>, Mn<sub>2</sub>O<sub>7</sub>, V<sub>2</sub>O<sub>5</sub>) Кислотным оксидам в качестве гидроксида соответствуют кислоты. | (Для Cl, Br, I степень окисления также равна +1) (Cl<sub>2</sub>O), и оксиды металлов со степенью окисления +5, +6, +7 (CrO<sub>3</sub>, Mn<sub>2</sub>O<sub>7</sub>, V<sub>2</sub>O<sub>5</sub>) Кислотным оксидам в качестве гидроксида соответствуют кислоты. | ||
| + | <div id="bezrazlichnye"> | ||
== Несолеобразующие оксиды == | == Несолеобразующие оксиды == | ||
| Строка 76: | Строка 322: | ||
2) Несолеобразующие оксиды получают прямым синтезом (эндотермическая реакция происходящая в воздухе при разряде молний) | 2) Несолеобразующие оксиды получают прямым синтезом (эндотермическая реакция происходящая в воздухе при разряде молний) | ||
| − | N2 + | + | N2 +O<sub>2</sub> <sup><ins>''t=2000''</ins></sup><span style="font-family:georgia; font-size:1.5em;">→</span> 2NO — Q |
3) Несолеобразующие оксиды получают при пропускании углекислого газа над раскаленным углеродом (углем) | 3) Несолеобразующие оксиды получают при пропускании углекислого газа над раскаленным углеродом (углем) | ||
| − | + | СО<sub>2</sub> + С {{arrowT}} 2CO | |
4) Несолеобразующие оксиды получают при термическом или каталитическом разложении веществ | 4) Несолеобразующие оксиды получают при термическом или каталитическом разложении веществ | ||
| − | НСООН <sup><ins>''t, H<sub>2</sub>SO<sub>4</sub>''</ins></sup><span style="font- | + | НСООН <sup><ins>''t, H<sub>2</sub>SO<sub>4</sub>''</ins></sup><span style="font-family:georgia; font-size:1.5em;">→</span> H<sub>2</sub>O + CO |
5) Несолеобразующие оксиды получают в окислительно – восстановительных реакциях | 5) Несолеобразующие оксиды получают в окислительно – восстановительных реакциях | ||
| Строка 96: | Строка 342: | ||
1) При обычной температуре вода реагирует с активными металлами. | 1) При обычной температуре вода реагирует с активными металлами. | ||
| − | 2H<sub>2</sub>O + 2Na {{arrowleft}} 2NaOH + H2{{ArrowUp}} | + | 2H<sub>2</sub>O + 2Na {{arrowleft}} <span class="eleotr" data-title="гидроксид натрия">2NaOH</span> + H2{{ArrowUp}} |
| − | |||
2) Несолеобразующие оксиды доокисляются до кислотных оксидов с большей степенью окисления | 2) Несолеобразующие оксиды доокисляются до кислотных оксидов с большей степенью окисления | ||
| Строка 111: | Строка 356: | ||
CO + FeO {{arrowleft}} Fe + CO<sub>2</sub> | CO + FeO {{arrowleft}} Fe + CO<sub>2</sub> | ||
| − | 2CO + SnO<sub>2</sub> {{arrowleft}} Sn + 2CO<sub>2</sub> | + | 2CO + SnO<sub>2</sub> {{arrowleft}} Sn + 2CO<sub>2</sub> |
=== Характеристика некоторых представителей несолеобразующих оксидов === | === Характеристика некоторых представителей несолеобразующих оксидов === | ||
| Строка 123: | Строка 368: | ||
NO – оксид азота (II) – бесцветный газ, без запаха, малорастворим в воде, единственный оксид, который образуется из воздуха при разрядах молний в эндотермической реакции. | NO – оксид азота (II) – бесцветный газ, без запаха, малорастворим в воде, единственный оксид, который образуется из воздуха при разрядах молний в эндотермической реакции. | ||
| − | N<sub>2</sub> + O<sub>2</sub> <sup><ins>''t=2000''</ins></sup><span style="font- | + | N<sub>2</sub> + O<sub>2</sub> <sup><ins>''t=2000''</ins></sup><span style="font-family:georgia; font-size:1.5em;">→</span> 2NO — Q. |
| + | </div> | ||
| + | <div id="osnovnye"> | ||
== Основные оксиды == | == Основные оксиды == | ||
| Строка 201: | Строка 448: | ||
3) Основные оксиды щелочных и щелочеземельных металлов взаимодействуют с водой с образованием щелочей | 3) Основные оксиды щелочных и щелочеземельных металлов взаимодействуют с водой с образованием щелочей | ||
| − | Na<sub>2</sub>O + H<sub>2</sub>O {{arrowleft}} 2NaOH | + | Na<sub>2</sub>O + H<sub>2</sub>O {{arrowleft}} <span class="eleotr" data-title="гидроксид натрия">2NaOH</span> |
4) Основные оксиды взаимодействуют с амфотерными оксидам при сплавлении | 4) Основные оксиды взаимодействуют с амфотерными оксидам при сплавлении | ||
| − | Na<sub>2</sub>O + ZnO {{arrowT}} Na<sub>2</sub>ZnO<sub>2</sub> | + | Na<sub>2</sub>O + ZnO {{arrowT}} <span class="eleotr" data-title="Цинкат натрия">Na<sub>2</sub>ZnO<sub>2</sub></span> |
5) Основные оксиды реагируют с кислотными оксидами с образованием солей | 5) Основные оксиды реагируют с кислотными оксидами с образованием солей | ||
| − | CaO + CO<sub>2</sub> {{arrowleft}} CaCO<sub>3</sub> | + | CaO + CO<sub>2</sub> {{arrowleft}} <span class="eleotr" data-title="Карбонат кальция">CaCO<sub>3</sub></span> |
6) Основные оксиды реагируют с кислотами с образованием солей | 6) Основные оксиды реагируют с кислотами с образованием солей | ||
| − | BaO + 2HCl {{arrowleft}} BaCl<sub>2</sub> + H<sub>2</sub>O | + | BaO + 2HCl {{arrowleft}} <span class="eleotr" data-title="Хлорид бария">BaCl<sub>2</sub></span> + H<sub>2</sub>O |
| − | |||
7) Основные оксиды реагируют с амфотерными основаниями с образованием солей | 7) Основные оксиды реагируют с амфотерными основаниями с образованием солей | ||
| − | Na<sub>2</sub>O + Zn(OH)<sub>2</sub> {{arrowT}} Na<sub>2</sub>ZnO<sub>2</sub> + H<sub>2</sub>O | + | Na<sub>2</sub>O + Zn(OH)<sub>2</sub> {{arrowT}} <span class="eleotr" data-title="Цинкат натрия">Na<sub>2</sub>ZnO<sub>2</sub></span> + H<sub>2</sub>O |
| − | |||
| − | |||
8) Основные оксиды могут донейтрализовывать кислые соли | 8) Основные оксиды могут донейтрализовывать кислые соли | ||
| − | Na<sub>2</sub>O + 2NaHCO<sub>3</sub> {{arrowleft}} 2Na<sub>2</sub>CO<sub>3</sub> + H<sub>2</sub>O | + | Na<sub>2</sub>O + 2NaHCO<sub>3</sub> {{arrowleft}} <span class="eleotr" data-title="Карбонат натрия">2Na<sub>2</sub>CO<sub>3</sub></span> + H<sub>2</sub>O |
| − | |||
=== Характеристика некоторых представителей основных оксидов === | === Характеристика некоторых представителей основных оксидов === | ||
| Строка 231: | Строка 474: | ||
CaO – оксид кальция, негашеная известь – белое твердое вещество, легко реагирующее с водой с большим выделением тепла (гашение извести), углекислым газом, tпл = 2630<sup>0</sup>С. | CaO – оксид кальция, негашеная известь – белое твердое вещество, легко реагирующее с водой с большим выделением тепла (гашение извести), углекислым газом, tпл = 2630<sup>0</sup>С. | ||
| − | CaO + H<sub>2</sub>O {{arrowleft}} Сa(OH)<sub>2</sub> + Q | + | CaO + H<sub>2</sub>O {{arrowleft}} <span class="eleotr" data-title="гидроксид кальция">Сa(OH)<sub>2</sub></span> + Q |
| − | + | ||
| + | CuO – Оксид меди (II) твердое хрупкое вещество черного цвета, нерастворимое в воде, при температуре свыше 800 <sup>0</sup>С разлагается до образования Cu<sub>2</sub>O – оксида меди (I), плотность 6,45 г/см<sup>3</sup>. | ||
| − | + | '''Получают''' | |
| − | Cu<sub>2</sub>(ОН)<sub>2</sub>CO<sub>3</sub> {{arrowT}} CuO + CO<sub>2</sub>{{ArrowUp}} + H<sub>2</sub>O | + | <span class="eleotr" data-title="малахит">Cu<sub>2</sub>(ОН)<sub>2</sub>CO<sub>3</sub></span> {{arrowT}} CuO + CO<sub>2</sub>{{ArrowUp}} + H<sub>2</sub>O |
| − | + | </div> | |
| + | <div id="amfoternye"> | ||
== Амфотерные оксиды == | == Амфотерные оксиды == | ||
| Строка 262: | Строка 507: | ||
5) Амфотерные оксиды получают термическим разложением амфотерных оснований | 5) Амфотерные оксиды получают термическим разложением амфотерных оснований | ||
| − | + | Zn(OH)<sub>2</sub> {{arrowT}} ZnO + H<sub>2</sub>O | |
6) Амфотерные оксиды получают при термическом разложении солей, образованных газообразными кислотными оксидами и амфотерными металлами | 6) Амфотерные оксиды получают при термическом разложении солей, образованных газообразными кислотными оксидами и амфотерными металлами | ||
| Строка 270: | Строка 515: | ||
7) Амфотерные оксиды получают при термическом разложении кислых солей, образованных амфотерными металлами | 7) Амфотерные оксиды получают при термическом разложении кислых солей, образованных амфотерными металлами | ||
| − | + | 2Al(HCO<sub>3</sub>)<sub>3</sub> {{arrowT}} Al<sub>2</sub>O<sub>3</sub> + 6CO<sub>2</sub>{{ArrowUp}} + 3H<sub>2</sub>O | |
| − | |||
| − | |||
=== Химические свойства амфотерных оксидов === | === Химические свойства амфотерных оксидов === | ||
| − | |||
1) Амфотерные оксиды восстанавливаются до металла более активными металлами | 1) Амфотерные оксиды восстанавливаются до металла более активными металлами | ||
| Строка 299: | Строка 541: | ||
5) Амфотерные оксиды реагируют с основными оксидами при сплавлении с образованием солей | 5) Амфотерные оксиды реагируют с основными оксидами при сплавлении с образованием солей | ||
| − | ZnO + Na<sub>2</sub>O {{arrowT}} Na<sub>2</sub>ZnO<sub>2</sub> | + | ZnO + Na<sub>2</sub>O {{arrowT}} <span class="eleotr" data-title="Цинкат натрия">Na<sub>2</sub>ZnO<sub>2</sub></span> |
| − | CaO + ZnO {{arrowT}} СaZnO<sub>2</sub> | + | CaO + ZnO {{arrowT}} <span class="eleotr" data-title="Цинкат кальция">СaZnO<sub>2</sub></span> |
6 ) Амфотерные оксиды реагируют с сильными кислотными оксидами с образованием солей | 6 ) Амфотерные оксиды реагируют с сильными кислотными оксидами с образованием солей | ||
| − | ZnO + N<sub>2</sub>O<sub>5</sub> {{arrowT}} Zn(NO<sub>3</sub>)<sub>2</sub> | + | ZnO + N<sub>2</sub>O<sub>5</sub> {{arrowT}} <span class="eleotr" data-title="Нитрат цинка">Zn(NO<sub>3</sub>)<sub>2</sub></span> |
7) Амфотерные оксиды реагируют с основаниями с образованием солей и воды | 7) Амфотерные оксиды реагируют с основаниями с образованием солей и воды | ||
| − | ZnO + Сa(OН)<sub>2</sub> {{arrowT}} СaZnO<sub>2</sub> + H<sub>2</sub>O | + | ZnO + Сa(OН)<sub>2</sub> {{arrowT}} <span class="eleotr" data-title="Цинкат кальция">СaZnO<sub>2</sub> + H<sub>2</sub>O</span> |
8) Амфотерные оксиды реагируют с сильными кислотами с образованием солей и воды | 8) Амфотерные оксиды реагируют с сильными кислотами с образованием солей и воды | ||
| − | ZnO + 2НNO<sub>3</sub> {{arrowleft}} Zn(NO<sub>3</sub>)<sub>2</sub> + H<sub>2</sub>O | + | ZnO + 2НNO<sub>3</sub> {{arrowleft}} <span class="eleotr" data-title="Нитрат цинка">Zn(NO<sub>3</sub>)<sub>2</sub></span> + H<sub>2</sub>O |
| − | |||
=== Характеристика некоторых представителей амфотерны оксидов === | === Характеристика некоторых представителей амфотерны оксидов === | ||
ZnO — оксид цинка-белое кристаллическое вещество, практически нерастворимое в воде, tпл = 1975 <sup>0</sup>С. Употребляется в качестве наполнителя для белой краски и изготовления лекарственных мазей. | ZnO — оксид цинка-белое кристаллическое вещество, практически нерастворимое в воде, tпл = 1975 <sup>0</sup>С. Употребляется в качестве наполнителя для белой краски и изготовления лекарственных мазей. | ||
| + | </div> | ||
| + | <div id="kislotnye"> | ||
== Кислотные оксиды == | == Кислотные оксиды == | ||
| Строка 354: | Строка 597: | ||
8) Кислотный оксид можно получить при термическом разложении кислых солей, образованных газообразными оксидами | 8) Кислотный оксид можно получить при термическом разложении кислых солей, образованных газообразными оксидами | ||
| − | 2NaHCO<sub>3</sub> {{arrowT}} Na<sub>2</sub>CO<sub>3</sub> + CO<sub>2</sub>{{ArrowUp}} + H<sub>2</sub>O | + | 2NaHCO<sub>3</sub> {{arrowT}} <span class="eleotr" data-title="карбонат натрия">Na<sub>2</sub>CO<sub>3</sub></span> + CO<sub>2</sub>{{ArrowUp}} + H<sub>2</sub>O |
| − | |||
=== Химические свойства кислотных оксидов === | === Химические свойства кислотных оксидов === | ||
| Строка 381: | Строка 623: | ||
6) Кислотные оксиды реагируют с водой с образованием кислот | 6) Кислотные оксиды реагируют с водой с образованием кислот | ||
| − | SO<sub>3</sub> + H<sub>2</sub>O {{arrowleft}} Н<sub>2</sub>SO<sub>4</sub> | + | SO<sub>3</sub> + H<sub>2</sub>O {{arrowleft}} <span class="eleotr" data-title="серная кислота">Н<sub>2</sub>SO<sub>4</sub></span> |
7) Кислотные оксиды реагируют с амфотерными оксидами образованием солей | 7) Кислотные оксиды реагируют с амфотерными оксидами образованием солей | ||
| − | N<sub>2</sub>O<sub>5</sub> + ZnO {{arrowleft}} Zn(NO<sub>3</sub>)<sub>2</sub> | + | N<sub>2</sub>O<sub>5</sub> + ZnO {{arrowleft}} <span class="eleotr" data-title="Нитрат цинка">Zn(NO<sub>3</sub>)<sub>2</sub></span> |
8) Кислотные оксиды реагируют с щелочами с образованием солей | 8) Кислотные оксиды реагируют с щелочами с образованием солей | ||
| − | SO<sub>2</sub> + NaOH {{arrowleft}} NaHSO<sub>3</sub> | + | SO<sub>2</sub> + NaOH {{arrowleft}} <span class="eleotr" data-title="Гидросульфит натрия">NaHSO<sub>3</sub></span> |
SO<sub>2</sub> + 2NaOH {{arrowleft}} Na<sub>2</sub>SO<sub>3</sub> + H<sub>2</sub>O | SO<sub>2</sub> + 2NaOH {{arrowleft}} Na<sub>2</sub>SO<sub>3</sub> + H<sub>2</sub>O | ||
| Строка 396: | Строка 638: | ||
9) Кислотные оксиды реагируют с амфотерными основаниями с образованием солей и воды. | 9) Кислотные оксиды реагируют с амфотерными основаниями с образованием солей и воды. | ||
| − | 3N<sub>2</sub>O<sub>5</sub> + 2Al(OH)<sub>3</sub> {{arrowleft}} 2Al(NO<sub>3</sub>)<sub>3</sub> + 3 H<sub>2</sub>O | + | 3N<sub>2</sub>O<sub>5</sub> + 2Al(OH)<sub>3</sub> {{arrowleft}} <span class="eleotr" data-title="Нитрат алюминия">2Al(NO<sub>3</sub>)<sub>3</sub></span> + 3 H<sub>2</sub>O |
| − | + | ||
| − | |||
10) Более активные кислотные газообразные оксиды вытесняют менее активные газообразные оксиды из кислот и солей | 10) Более активные кислотные газообразные оксиды вытесняют менее активные газообразные оксиды из кислот и солей | ||
| − | H<sub>2</sub>CO<sub>3</sub> + SO<sub>2</sub> {{arrowleft}} H<sub>2</sub>SO<sub>3</sub> + CO<sub>2</sub>{{ArrowUp}} | + | <span class="eleotr" data-title="Угольная кислота">H<sub>2</sub>CO<sub>3</sub></span> + SO<sub>2</sub> {{arrowleft}} <span class="eleotr" data-title="сернистая кислота">H<sub>2</sub>SO<sub>3</sub></span> + CO<sub>2</sub>{{ArrowUp}} |
| − | + | <span class="eleotr" data-title="Карбонат натрия">Na<sub>2</sub>CO<sub>3</sub></span> + SO<sub>2</sub> {{arrowleft}} <span class="eleotr" data-title="Сульфит натрия">Na<sub>2</sub>SO<sub>3</sub></span> + CO<sub>2</sub>{{ArrowUp}} | |
| − | |||
| − | Na<sub>2</sub>CO<sub>3</sub> + SO<sub>2</sub> {{arrowleft}} Na<sub>2</sub>SO<sub>3</sub> + CO<sub>2</sub>{{ArrowUp}} | ||
| − | |||
| − | |||
11) Кислотные оксиды донейтрализовывают основные соли. | 11) Кислотные оксиды донейтрализовывают основные соли. | ||
| − | N<sub>2</sub>O<sub>5</sub> + 2Ca(OH)NO<sub>3</sub> {{arrowleft}} 2Ca(NO<sub>3</sub>)<sub>2</sub> + H<sub>2</sub>O | + | N<sub>2</sub>O<sub>5</sub> + 2Ca(OH)NO<sub>3</sub> {{arrowleft}} <span class="eleotr" data-title="Нитрат кальция">2Ca(NO<sub>3</sub>)<sub>2</sub></span> + H<sub>2</sub>O |
| − | |||
| − | |||
=== Характеристика некоторых представителей кислотных оксидов === | === Характеристика некоторых представителей кислотных оксидов === | ||
| Строка 422: | Строка 657: | ||
Р<sub>2</sub>O<sub>5</sub> — белое гигроскопичное порошкообразное вещество, возгоняется при 359 <sup>0</sup>С, применяется как водопоглощающее средство. | Р<sub>2</sub>O<sub>5</sub> — белое гигроскопичное порошкообразное вещество, возгоняется при 359 <sup>0</sup>С, применяется как водопоглощающее средство. | ||
| + | </div> | ||
| + | </div> | ||
| − | == | + | <div id="soli"> |
| + | == Соли == | ||
| − | + | '''Солями''' называют сложные химические вещества, состоящие из атомов металлов и кислотных остатков. | |
| − | + | '''Соли''' бывают '''средние (нормальные)''', '''кислые''', '''основные''', '''двойные''', '''комплексные''', '''смешанные'''. | |
| + | <div id="srednie"> | ||
| + | '''Средними или нормальными солями''' называются соли, в которых полностью замещены все атомы водорода на атомы металлов, а все гидроксильные группы замещены кислотными остатками. | ||
| + | </div> | ||
| + | <div id="kislye"> | ||
| + | '''Кислыми солями''' называют соли, в которых не все атомы водорода из кислот замещены атомами металлов. | ||
| + | </div> | ||
| + | <div id="osnovnyesoli"> | ||
| + | '''Основными солями''' называются соли, в которых наряду с кислотными остатками сохранились гидроксогруппы группы от оснований. | ||
| + | </div> | ||
| + | <div id="dvoinyesoli"> | ||
| + | '''Двойными солями''' называются такие, в которых атомы водорода замещены атомами двух разных металлов. | ||
| + | </div> | ||
| + | <div id="kompleks"> | ||
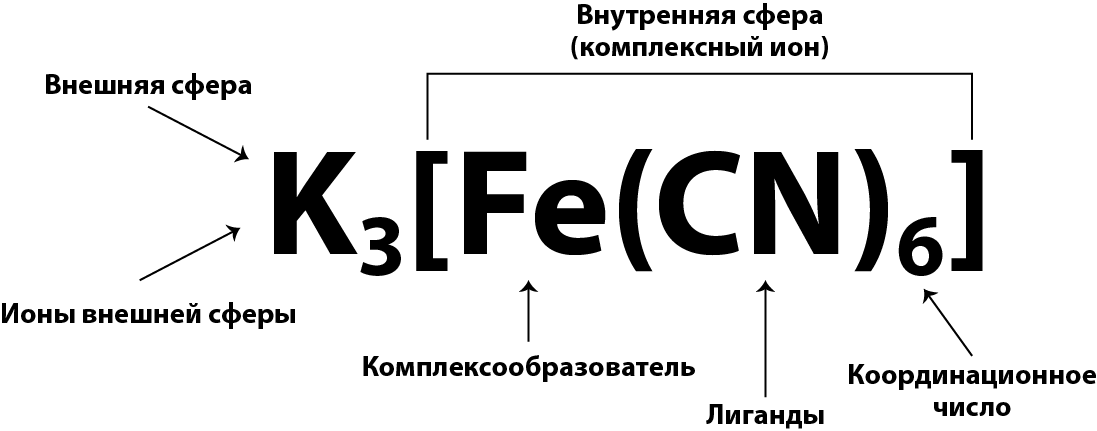
| + | '''Комплексные соли''', имеющие слоистое строение, состоят из центрального '''атома металла – комплексообразователя''', окруженного '''лигандами''' – противоположно заряженными ионами по сравнению с комплексообразователем или нейтральными молекулами, что составляет '''внутреннюю сферу''' комплексной соли, а следующий слой составляют ионы '''внешней сферы''', противоположно заряженные по отношению к ионам внутренней сферы. | ||
| + | </div> | ||
| − | + | {{center-p|[[file:Geksacnaferatkalia.png|Cхема строения гексацианоферрата (III) калия]]}} | |
| − | + | '''Смешанными солями''' называют соли, у которых при одном атоме металла находятся два разных кислотных остатка. Ca(OCl)Cl — гипохлоритхлорид кальция (хлорная известь). | |
| − | + | === Способы получения солей === | |
| − | + | 1) Соли получают методом прямого синтеза в реакции металлов с неметаллами | |
| − | + | 2Na + Cl<sub>2</sub> {{arrowleft}} <span class="eleotr" data-title="Хлорид натрия">2NaCl</span> | |
| − | == | + | Fe + S {{arrowleft}} <span class="eleotr" data-title="Сульфид железа (II)">FeS</span> |
| − | + | 2) Соли образуются в реакции взаимодействия металлов с кислотами | |
| − | + | Zn + 2HCl {{arrowleft}} <span class="eleotr" data-title="Хлорид цинка">ZnCl<sub>2</sub></span> + H<sub>2</sub> {{ArrowUp}} | |
| − | + | 3) Новые соли образуются при реакции солей с более активными металлами | |
| − | + | Fe + <span class="eleotr" data-title="Сульфат меди">CuSO<sub>4</sub></span> {{arrowT}} <span class="eleotr" data-title="Сульфат железа (II)">FeSO<sub>4</sub></span> + Cu | |
| − | + | 4) Соли образуются при сплавлении основных и амфотерных оксидов | |
| − | + | K<sub>2</sub>O + ZnO {{arrowT}} <span class="eleotr" data-title="Цинкат калия">K<sub>2</sub>ZnO<sub>2</sub></span> | |
| − | + | 5) Соли образуются при реакции основных и кислотных оксидов | |
| − | + | CaO + CO<sub>2</sub> {{arrowleft}} <span class="eleotr" data-title="Карбонат кальция">CaCO<sub>3</sub></span> | |
| − | + | 6) Соли образуются при сплавлении амфотерных и кислотных оксидов | |
| − | + | Al2O<sub>3</sub> + P<sub>2</sub>O<sub>5</sub> {{arrowT}} <span class="eleotr" data-title="Фосфат алюминия">2AlPO<sub>4</sub></span> | |
| − | |||
| − | |||
| − | + | 7)Соли образуются при реакции основных оксидов с кислотами | |
| − | |||
| − | + | CuO + H<sub>2</sub>SO<sub>4</sub> {{arrowT}} <span class="eleotr" data-title="Сульфат меди">CuSO<sub>4</sub></span> + H<sub>2</sub>O | |
| − | + | 8) Соли образуются при реакции кислотных оксидов с щелочами, при этом могут образоваться как средние, так и кислые соли | |
| − | |||
| − | + | СO<sub>2</sub> + NaOH {{arrowleft}} + <span class="eleotr" data-title="Гидрокарбонат натрия">NaHСO<sub>3</sub></span> | |
| − | + | СO<sub>2</sub> + 2NaOH {{arrowleft}} + <span class="eleotr" data-title="Карбонат натрия">Na<sub>2</sub>СO3</span> + H<sub>2</sub>O | |
| − | + | 9) Новые соли образуются при реакции более активных газообразных оксидов с солями | |
| − | + | SO<sub>2</sub> + Na<sub>2</sub>CO<sub>3</sub> {{arrowleft}} <span class="eleotr" data-title="Сульфит натрия">Na<sub>2</sub>SO<sub>3</sub></span> + CO<sub>2</sub>{{ArrowUp}} | |
| − | + | 10) Соли образуются при реакции нейтрализации между основаниями и кислотами, причем продуктами реакции могут быть средние, кислые и основные соли | |
| − | + | Ba(OH)<sub>2</sub> + H<sub>2</sub>SO<sub>4</sub> {{arrowleft}} <span class="eleotr" data-title="Сульфат бария">BaSO<sub>4</sub>{{arrowdown}}</span> + 2H<sub>2</sub>O | |
| − | H<sub>2</sub> | + | NaOH + H<sub>2</sub>SO<sub>4</sub> {{arrowleft}} <span class="eleotr" data-title="гидросульфат натрия">NaHSO<sub>4</sub></span> + H<sub>2</sub>O |
| − | |||
| − | 2) | + | Ba(OH)<sub>2</sub> + HCl {{arrowleft}} <span class="eleotr" data-title="гидроксохлорид бария">Ba(OH)Cl</span> + H<sub>2</sub>O |
| − | + | 11) Новые соли образуются при реакции между основаниями и солями | |
| − | 3) | + | Ca(OH)<sub>2</sub> + 2Na<sub>3</sub>PO<sub>4</sub> {{arrowleft}} <span class="eleotr" data-title="Фосфат кальция">Ca<sub>3</sub>(PO<sub>4</sub>)<sub>2</sub>{{arrowdown}}</span> + 3NaOH |
| − | + | === Химические свойства солей === | |
| − | + | 1. Соли взаимодействуют в реакциях замещения с более активными металлами | |
| − | + | 3K + AlCl<sub>3</sub>{{arrowleft}} 3KCl + Al | |
| − | + | Fe + CuSO<sub>4</sub> {{arrowleft}} FeSO<sub>4</sub> + Cu | |
| − | + | 2. Соли реагируют с растворимыми основаниями (щелочами) с образованием новой соли и нового основания | |
| − | + | 2NaOH + CuSO<sub>4</sub> {{arrowleft}} Cu(OH)2 {{arrowdown}} + Na<sub>2</sub>(SO<sub>4</sub>)<sub>2</sub> | |
| + | |||
| + | 3. Соли реагируют с кислотами с образованием новой соли и новой кислоты. | ||
| − | + | Na<sub>3</sub>PO4 + 3HCl {{arrowleft}} 3NaCl + H<sub>3</sub>PO<sub>4</sub> | |
| − | + | 4. Соли реагируют между собой с образованием новых солей, особенно, если образуется менее диссоциирующее вещество. | |
| − | + | BaCl<sub>2</sub> + Na<sub>2</sub>(SO<sub>4</sub>)<sub>2</sub> {{arrowleft}} BaSO<sub>4</sub>{{arrowdown}} + 2NaCl | |
| − | + | '''Солями''' называют сложные химические вещества, состоящие из атомов металлов и кислотных остатков. Кроме атомов металлов в состав солей может входить ион аммония - вещества, образованного по принципу донорно-акцепторной связи. | |
| + | </div> | ||
| + | <div id="gidroksidy"> | ||
| + | <div id="shelochi"><div id="osnovaniya"><div id="amfos"> | ||
| − | + | == Основания == | |
| − | + | '''Основаниями''' называются сложные химические вещества, состоящие из атомов металлов, соединенных с одной или несколькими гидроксильными группами. | |
| + | Различают '''растворимые''' и '''нерастворимые''' в воде основания. Растворимые основания называются '''щелочами'''. | ||
| − | + | К растворимым основаниям – щелочам относят все основания металлов с валентностью I, а также основания бария, стронция и кальция. | |
| + | {{right|[[file:ShelochKNS.jpeg|250px|class=show-for-large-up]]}}{{center|[[file:ShelochKNS.jpeg|250px|class=hide-for-large-up]]}} | ||
| + | Среди оснований выделяют группу веществ, именующуюся '''амфотерными (двойственными)''' основаниями. К амфотерным основаниям относятся основания, где у металлов валентность равна III и IV, а также основание двухвалентного цинка. Все амфотерные основания нерастворимы в воде. Амфотерные основания обладают способностью реагировать как с кислотами, так и с щелочами. Одно и тоже амфотерное основание можно представить в виде Al(OH)<sub>3</sub> и H<sub>3</sub>AlO<sub>3</sub>. В химических реакциях вещество проявляется в той или иной форме в зависимости от среды, в которой происходит реакция. Если гидроксид алюминия реагирует с кислотой, то выбирается формула Al(OH)<sub>3</sub>, а при реакции с щелочью формула отражает '''ортоалюминиевую кислоту''' '''H<sub>3</sub>AlO<sub>3</sub>'''. Все амфотерные основания в присутствии щелочей обладают способностью выделять воду [кроме Zn(OH)<sub>2</sub>], и таким образом проявляются как в орто – так и в метаформе '''HAlO<sub>2</sub> (метаалюминиевая кислота)''' + H<sub>2</sub>O, образуя два типа соединений. | ||
| − | + | === Способы получения щелочей и оснований === | |
| − | + | {{center|[[file:Ролик-9 сайт.mp4|740px|start=5]]}} | |
| − | + | 1. Щелочи получают взаимодействием активных металлов с водой | |
| − | + | 2Na + 2H<sub>2</sub>O → <span class="eleotr" data-title="гидроксид натрия">2NaOH</span> + H<sub>2</sub>↑ | |
| − | + | 2. Щелочи получают взаимодействием оксидов активных металлов с водой | |
| − | + | СaO + H<sub>2</sub>O → Ca(OH)<sub>2</sub> | |
| − | + | 3. Нерастворимые в воде основания, в том числе и амфотерные основания, получают в реакциях обмена из солей, действием растворимых щелочей | |
| − | + | MgCl<sub>2</sub> + 2KOH → <span class="eleotr" data-title="гидроксид магния">Mg(OH)<sub>2</sub> ↓ </span> + 2KCl | |
| − | + | ZnSO<sub>4</sub> + 2NaOH → <span class="eleotr" data-title="гидроксид цинка">Zn(OH)<sub>2</sub> ↓</span> + Na<sub>2</sub>SO<sub>4</sub> | |
| − | + | FeCl<sub>3</sub> + 3NaOH → <span class="eleotr" data-title="гидроксид железа (III)">Fe(OH)<sub>3</sub> ↓</span> + 3NaCl | |
| − | + | 4. Гидроксиды калия и натрия в больших количествах получают электролизом из водных растворов их солей в виде хлоридов. | |
| − | + | 2KCl + 2H<sub>2</sub>O {{arrowleft}} 2KOH + H<sub>2</sub>{{ArrowUp}} + Cl<sub>2</sub>{{ArrowUp}} | |
| − | + | === Химические свойства оснований === | |
| − | + | 1. Щелочи взаимодействуют с оксидом углорода (II), с образованием формиата щелочного металла. | |
| − | + | NaOH + CO {{arrowleft}} <span class="eleotr" data-title="формиат натрия">HCOONa</span> | |
| − | + | 2. Щелочи взаимодействуют с амфотерными оскидами с образованием солей. | |
| − | + | 2NaOH + ZnO {{arrowleft}} <span class="eleotr" data-title="цинкат натрия">Na<sub>2</sub>ZnO<sub>2</sub></span> + H<sub>2</sub>O | |
| − | + | 6NaOH + Al<sub>2</sub>O<sub>3</sub> {{arrowleft}} <span class="eleotr" data-title="ортоалюминат натрия">2Na<sub>3</sub>AlO<sub>3</sub></span> + 3H<sub>2</sub>O | |
| − | == | + | 2NaOH + Al<sub>2</sub>O<sub>3</sub> {{arrowleft}} <span class="eleotr" data-title="метаалюминат натрия">2NaAlO<sub>2</sub></span> + H<sub>2</sub>O (наиболее часто встречающийся вариант реакции) |
| − | + | 3. Щелочи взаимодействуют с оксидом углорода (IV), с образованием двух видов солей | |
| − | + | NaOH + CO<sub>2</sub> {{arrowleft}} <span class="eleotr" data-title="гидрокарбонат натрия">NaHCO<sub>3</sub></span> | |
| − | + | NaOH + CO<sub>2</sub> {{arrowleft}} <span class="eleotr" data-title="карбонат натрия">Na<sub>2</sub>CO<sub>3</sub></span> + H<sub>2</sub>O | |
| − | + | 4. Щелочи взаимодействуют с амфотерными гидроскидами с образованием солей. | |
| − | + | 2NaOH + Zn(OH)<sub>2</sub> {{arrowleft}} <span class="eleotr" data-title="цинкат натрия">Na<sub>2</sub>ZnO<sub>2</sub></span> + 2H<sub>2</sub>O | |
| − | + | 3NaOH + Al(OH)<sub>3</sub> {{arrowleft}} <span class="eleotr" data-title="ортоалюминат натрия">Na<sub>3</sub>AlO<sub>3</sub></span> + 3H<sub>2</sub>O | |
| − | |||
| − | + | NaOH + Al(OH)<sub>3</sub> {{arrowleft}} <span class="eleotr" data-title="метаалюминат натрия">NaAlO<sub>2</sub></span> + 2H<sub>2</sub>O | |
| − | + | 5. Щелочи и нерастворимые основания взаимодействуют с кислотами. | |
| − | + | NaOH + HCl {{arrowleft}} NaCl + H<sub>2</sub>O | |
| − | 2 | + | Fe(OH)<sub>3</sub> + 3HCl {{arrowleft}} FeCl<sub>3</sub> + 3H<sub>2</sub>O |
| + | |||
| + | Растворимые щелочи, нерастворимые основания и нерастворимые амфотерные основания при взаимодействии с сильными кислотами переходят в растворимые соли. | ||
| − | + | Реакция между основаниями и кислотами, в результате которой образуется соль и вода, называется реакцией '''нейтрализации'''. | |
| − | + | 6. В случае неполной нейтрализации основания кислотой, образуются основные соли | |
| + | |||
| + | Ba(OH)<sub>2</sub> + HNO<sub>3</sub> {{arrowleft}} <span class="eleotr" data-title="гидроксонитрат бария">Ba(OH)NO<sub>3</sub></span> + H<sub>2</sub>O | ||
| − | + | 7. Щелочи взаимодействуют с солями с образованием новых оснований и новых солей | |
| − | + | FeCl<sub>3</sub> + 3NaOH {{arrowleft}} <span class="eleotr" data-title="гидроксид железа (III)">Fe(OH)<sub>3</sub>{{arrowdown}}</span> + 3NaCl | |
| − | + | CuSO<sub>4</sub> + 2KOH {{arrowleft}} <span class="eleotr" data-title="гидроксид меди (II)">Cu(OH)<sub>2</sub>{{arrowdown}}</span> + K<sub>2</sub>SO<sub>4</sub> | |
| + | </div></div></div> | ||
| + | <div id="kisloty"><div id="metkisloty"> | ||
| − | + | == Кислоты == | |
| − | + | К кислотам относятся сложные химические вещества, состоящие из атомов водорода, способных обмениваться на атомы металлов, и кислотных остатков. Количество атомов водорода, входящих в состав кислоты определяет основность кислоты. По признаку основности кислоты разделяют на одноосновные, двухосновные и многоосновные. По наличию атома кислорода кислоты разделяют на бескислородные (HI, HBr, HCl, HF, H<sub>2</sub>S{{ArrowUp}}, HCN) и кислородсодержащие( HClO<sub>4</sub>, H<sub>2</sub>SO<sub>4</sub>, HNO<sub>3</sub>, H<sub>4</sub>P<sub>2</sub>O<sub>7</sub>, H<sub>2</sub>SO<sub>3</sub>{{ArrowUp}}, H<sub>3</sub>PO<sub>4</sub>, HNO<sub>2</sub>, H<sub>2</sub>CO<sub>3</sub>{{ArrowUp}}). | |
| − | + | === Способы получения кислот === | |
| − | + | 1) Бинарные бескислородные кислоты можно получить прямым синтезом из неметаллов, одним из которых должен быть водород | |
| − | + | H<sub>2</sub> + Cl<sub>2</sub> {{arrowT}} 2HCl | |
| − | + | H<sub>2</sub> + S {{arrowT}} H<sub>2</sub>S | |
| − | + | 2) Галогенсодержащие кислоты получают вытеснением менее сильных по электроотрицательности галогенов более сильными галогенами | |
| − | + | 2HI + Cl<sub>2</sub> {{arrowleft}} 2HCl + I<sub>2</sub>{{arrowdown}} | |
| − | + | 3) Кислородсодержащие кислоты получают взаимодействием кислотных оксидов с водой | |
| − | + | P<sub>2</sub>O<sub>5</sub> + 3H<sub>2</sub>O {{arrowleft}} 2H<sub>3</sub>PO<sub>4</sub> | |
| − | + | 4) Новые кислоты могут быть получены в реакциях доокисления | |
| − | + | 2H<sub>2</sub>SO<sub>3</sub> + O<sub>2</sub> {{arrowleft}} 2H<sub>2</sub>SO<sub>4</sub> | |
| − | + | 5) Кислоты получают вытеснением более активными кислотными оксидами менее активных оксидов (особенно характерно для газообразных кислотных оксидов) | |
| − | + | H<sub>2</sub>CO<sub>3</sub> + SO<sub>2</sub> {{arrowleft}} H<sub>2</sub>SO<sub>3</sub> + CO<sub>2</sub>{{ArrowUp}} | |
| − | + | 6) Кислоты можно получить в реакциях обмена между солями и другими сильными кислотами | |
| − | + | Ba(NO<sub>3</sub>)<sub>2</sub> + H<sub>2</sub>SO<sub>4</sub> {{arrowleft}} BaSO<sub>4</sub>{{arrowdown}} + 2HNO<sub>3</sub> | |
| − | + | === Химические свойства кислот === | |
| − | + | 1) Кислоты взаимодействуют с активными и амфотерными металлами с выделением водорода | |
| − | + | 2HCl + Zn {{arrowleft}} ZnCl<sub>2</sub> + H<sub>2</sub>{{ArrowUp}} | |
| − | + | H<sub>2</sub>SO<sub>4</sub><sub>(разб.)</sub> + Mn {{arrowleft}} MnSO<sub>4</sub> + H<sub>2</sub>{{ArrowUp}} | |
| − | + | 2) Концентрированные кислоты, такие как серная и азотная являются сильными окислителями и при реакции с металлами выделяют другие продукты реакции : сернистый газ, сероводород, серу, оксиды азота с различной степенью окисления или аммиак. | |
| − | + | 3) Для галогенсодержащих бескислородных кислот характерно замещение в кислотах менее активных галогенов более активными галогенами | |
| − | + | 2HI + Cl<sub>2</sub> {{arrowleft}} 2HCl + I<sub>2</sub> {{arrowdown}} | |
| − | + | 4) Кислоты взаимодействуют с основными оксидами с образованием соли и воды | |
| − | + | H<sub>2</sub>SO<sub>4(разб.)</sub> + BaO {{arrowleft}} BaSO<sub>4</sub>{{arrowdown}} + H<sub>2</sub>O | |
| − | + | 5) Кислоты взаимодействуют с амфотерными оксидами с образованием соли и воды | |
| − | + | 2HNO<sub>3</sub> + ZnO {{arrowleft}} Zn(NO<sub>3</sub>)<sub>2</sub> + H<sub>2</sub>O | |
| − | + | 6) Кислоты способны взаимодействовать с более активными кислотными оксидами с образованием новой кислоты и выделением менее активного кислотного оксида. Особенно хорошо реакция прослеживается с газообразными оксидами | |
| − | + | H2CO<sub>3</sub> + SO<sub>2</sub> {{arrowleft}} H<sub>2</sub>SO<sub>3</sub> + CO<sub>2</sub>{{ArrowUp}} | |
| − | + | 7) Кислоты взаимодействуют с основаниями как растворимыми (щелочами), так и нерастворимыми в реакции нейтрализации. Продуктами этих реакций могут быть как средние соли, так и продукты неполной нейтрализации – соли кислые | |
| − | + | 2NaOH + H<sub>2</sub>SO<sub>4</sub> {{arrowleft}} Na<sub>2</sub>SO<sub>4</sub> + 2H<sub>2</sub>O | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | 2NaOH | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
NaOH + H<sub>2</sub>SO<sub>4</sub> {{arrowleft}} NaHSO<sub>4</sub> + H<sub>2</sub>O | NaOH + H<sub>2</sub>SO<sub>4</sub> {{arrowleft}} NaHSO<sub>4</sub> + H<sub>2</sub>O | ||
| − | |||
| − | + | 8) Между кислотами происходят оксислительно-восстановительные реакции с изменением степени окисления элементов, входящих в состав этих кислот | |
| − | + | H<sub>2</sub>SO<sub>4</sub> + HBr {{arrowleft}} Br<sub>2</sub> + SO<sub>2</sub>{{ArrowUp}} + H<sub>2</sub>O | |
| − | + | 9) При взаимодействии кислот с солями в реакциях обмена образуются как новая кислота, так и новая соль | |
| − | + | H<sub>2</sub>SO<sub>4</sub><sub>(конц)</sub> + Ba(NO<sub>3</sub>)<sub>2</sub> {{arrowleft}} BaSO<sub>4</sub>{{arrowdown}} + 2HNO<sub>3</sub> | |
| − | + | 10) Кислоты способны проводить донейтрализацию основных солей с образованием средних солей | |
| − | + | Mg(OH)Cl + HCl {{arrowleft}} MgCl<sub>2</sub> + H<sub>2</sub>O | |
| − | |||
| − | + | 11) Сильные кислоты разлагают соли, содержащие газообразные оксиды | |
| − | + | CaSO<sub>3</sub> + 2HCl {{arrowleft}} CaCl<sub>2</sub> + SO<sub>2</sub>{{ArrowUp}} | |
| − | + | === Характеристика некоторых представителей кислот === | |
| − | + | '''HNO<sub>3</sub> азотная кислота'''. Это бесцветная жидкость с резким запахом, легко испаряется, t<sub>кип</sub> = 86<sup>0</sup>С, с водой смешивается в любых соотношениях. Среди всех кислот – эта кислота самый сильный окислитель. При хранении имеет желтую окраску т.к. разлагается с выделением бурого газа – NO<sub>2</sub> – оксида азота (IV), растворяющегося в ней. Тлеющая лучина, поднесенная к поверхности концентрированной азотной кислоты, разгорается за счет выделения кислорода. | |
| − | + | 4HNO<sub>3</sub> <sup><ins>''hv''</ins></sup><span style="font-family:georgia; font-size:1.5em;">→</span> 2H<sub>2</sub>O + 4NO<sub>2</sub> + O<sub>2</sub>{{ArrowUp}} | |
| − | + | Поступаемая в продажу кислота обычно имеет 63% концентрацию и плотность равную 1,4г/см<sup>3</sup>. При попадании на кожу вызывает сильные ожоги с образованием желтых пятен, так как реагирует с белками. Ее надо смыть большим количеством воды и нейтрализовать раствором соды. | |
| − | + | '''H<sub>2</sub>SO<sub>4</sub> серная кислота''' – это бесцветная маслянистая жидкость без запаха, t <sub>крист</sub> +10,5<sup>0</sup>C. Старинное название серной кислоты - олеум, а безводной H<sub>2</sub>SO<sub>4</sub> – купоросное масло. Серная кислота, являясь сильным окислителем, проявляет типичные свойства кислоты. Эта двухосновная кислота диссоциирует ступенчато, образуя кислые и средние соли. Раствор серной кислоты с концентрацией менее 70% называется разбавленным, более 70% - концентрированным. Концентрированная серная кислота при попадании на кожу оставляет сильные ожоги, поэтому при попадании кислоты на кожу надо обильно смыть ее водой и обработать раствором питьевой соды. Избегать попадания серной кислоты в глаза. | |
| − | + | '''HCl соляная кислота''' – водный раствор хлороводорода, бесцветная жидкость дымящаяся на влажном воздухе, t<sub>пл</sub> = – 114<sup>0</sup>С, t<sub>кип</sub> = - 85<sup>0</sup>С. Получают сжиганием водорода в хлоре и растворением полученного хлороводорода в воде. В поступающей в продажу соляной кислоте массовая доля хлороводорода 37%, при плотности раствора 1,19г/см<sup>3</sup>. Соляная кислота применяется для получения солей, травления металлов, в пищевой промышленности, медицине, химическом анализе. Входит в состав желудочного сока. | |
| − | + | '''Н<sub>3</sub>РО<sub>4</sub> фосфорная кислота, ортофосфорная кислота'''. | |
| + | Это – бесцветное кристаллическое вещество, t<sub>пл</sub> = 42<sup>0</sup>С, трехосновная кислота, однако несильная, хорошо растворима в воде, не ядовита, применяется в пищевой промышленности для приготовления сиропов. В промышленности получают экстракционным методом, обрабатывая фосфориты и апатиты концентрированной серной кислотой. | ||
| − | 3 | + | Ca<sub>3</sub>(PO<sub>4</sub>)<sub>2</sub> + 3H<sub>2</sub>SO<sub>4</sub> {{arrowleft}} 3CaSO<sub>4</sub>{{arrowdown}} + 2H<sub>3</sub>PO<sub>4</sub> |
| + | </div></div></div></div> | ||
| − | + | == Глоссарий == | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | == | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
:{{bib|'''Металлами''' называют элементы, обладающие способностью легко отдавать имеющиеся у них на внешнем электронном слое 1,2, 3 электрона.}} | :{{bib|'''Металлами''' называют элементы, обладающие способностью легко отдавать имеющиеся у них на внешнем электронном слое 1,2, 3 электрона.}} | ||
| − | :{{bib|'''Неметаллами''' называют элементы с 4 и более электронами на внешнем электронном слое ( а также бор , у которого 3 электрона на внешнем электронном слое).}} | + | :{{bib|'''Неметаллами''' называют элементы с 4 и более электронами на внешнем электронном слое (а также бор, у которого 3 электрона на внешнем электронном слое).}} |
:{{bib|'''Инертные''' или '''благородные газы''' (VIII – A группа) — это группа элементов, которые являются газами, и молекула которых состоит из одного атома.}} | :{{bib|'''Инертные''' или '''благородные газы''' (VIII – A группа) — это группа элементов, которые являются газами, и молекула которых состоит из одного атома.}} | ||
:{{bib|'''Амфотерными металлами''' являются такие, соединения которых проявляют как свойства кислоты, так и свойства основания, поэтому их называют «двойственные». ''(Сравни названия с корнем «амфос» – амфора – ваза с двумя ручками, амфибия – животное, которое дышит и в воде и на воздухе – например, лягушка)''.}} | :{{bib|'''Амфотерными металлами''' являются такие, соединения которых проявляют как свойства кислоты, так и свойства основания, поэтому их называют «двойственные». ''(Сравни названия с корнем «амфос» – амфора – ваза с двумя ручками, амфибия – животное, которое дышит и в воде и на воздухе – например, лягушка)''.}} | ||
| − | :{{bib|'''Простыми''' | + | :{{bib|'''Простыми''' веществами называются такие, молекулы которых состоят из атомов одного химического элемента. В зависимости от количества атомов в составе простого вещества или от различного строения кристаллической решетки, простые вещества создают различные '''аллотропные''' модификации или '''аллотропные''' видоизменения (например О<sub>2</sub> – кислород и О<sub>3</sub> – озон; алмаз и графит).}} |
:{{bib|'''Сложными''' химическими веществами называют вещества, состоящие из атомов двух или более химических элементов.}} | :{{bib|'''Сложными''' химическими веществами называют вещества, состоящие из атомов двух или более химических элементов.}} | ||
:{{bib|'''Бинарные''' соединения.состоят из атомов двух элементов. При наименовании бинарных соединений, их окончание обозначается суффиксом – ид. Например: Mg<sub>3</sub>N<sub>2</sub> – нитрид магния.}} | :{{bib|'''Бинарные''' соединения.состоят из атомов двух элементов. При наименовании бинарных соединений, их окончание обозначается суффиксом – ид. Например: Mg<sub>3</sub>N<sub>2</sub> – нитрид магния.}} | ||
| − | :{{bib|'''Оксидами''' называются сложные химические вещества, состоящие из атомов двух элементов, одном из которых является кислород. При | + | :{{bib|'''Оксидами''' называются сложные химические вещества, состоящие из атомов двух элементов, одном из которых является кислород. При наименовании оксидов вначале указывается корень слова – окси-, затем добавляется суффикс –ид и называется элемент в родительном падеже. Например: ВаО – оксид бария. Для элементов с переменной валентностью указывается валентность элемента в составе оксида, например: СuO –оксид меди (II) или Cu<sub>2</sub>O – оксид меди (I).}} |
| − | :{{bib|'''Несолеобразующими''' | + | :{{bib|'''Несолеобразующими''' оксидами называются оксиды неметаллов со степенью окисления +1 и +2 (H<sub>2</sub>O, CO, SiO, NO, N<sub>2</sub>O).}} |
| − | :{{bib|''' | + | :{{bib|'''Основными оксидами''' называются оксиды металлов со степенью окисления +1 и +2 (K<sub>2</sub>O, Na<sub>2</sub>O, BaO, CaO, MgO, FeO, CrO, MnO, VO, PbO, SnO, CuO), '''(кроме ZnO)'''. Основным оксидам в качестве гидроксида соответствуют основания и растворимые основания – щелочи.}} |
| − | :{{bib|'''Амфотерными''' | + | :{{bib|'''Амфотерными''' оксидами называются оксиды металлов со степенью окисления +3 и +4 (Al<sub>2</sub>O<sub>3</sub>, Fe<sub>2</sub>O<sub>3</sub>, Cr<sub>2</sub>O<sub>3</sub>, MnO<sub>2</sub>, V<sub>2</sub>O<sub>3</sub>, PbO<sub>2</sub>, SnO<sub>2</sub> и '''ZnO'''). Амфотерыми оксидам в качестве гидроксида соответствуют амфотерные основания.}} |
| − | :{{bib|'''Кислотными''' | + | :{{bib|'''Кислотными''' оксидами называются оксиды неметаллов со степенью окисления +3, +4, +5, +6, +7, (Cl<sub>2</sub>O<sub>7</sub>, SO<sub>3</sub>, N<sub>2</sub>O<sub>5</sub>, P<sub>2</sub>O<sub>5</sub>, SO<sub>2</sub>{{ArrowUp}}, N<sub>2</sub>O<sub>3</sub>, P<sub>2</sub>O<sub>3</sub>, CO<sub>2</sub>{{ArrowUp}}, SiO<sub>2</sub>{{arrowdown}}), (Для Cl, Br, I степень окисления также равна +1) (Cl<sub>2</sub>O), и оксиды металлов со степенью окисления +5, +6, +7 (CrO<sub>3</sub>, Mn<sub>2</sub>O<sub>7</sub>, V<sub>2</sub>O<sub>5</sub>). Кислотным оксидам в качестве гидроксида соответствуют кислоты.}} |
| − | |||
| − | |||
| − | |||
| − | |||
| − | == | + | == Библиография == |
| − | * {{bib| | + | * {{bib|Кособаева Б. – Использование компьютера в учебном процессе химии / Текст / Б. Кособаева, Н.Б. Арстанбекова // Абай атындагы Казак Улуттукпедагогикалык университеттинин Хабарши (Вестник) Жаратылыш таануу-география илимдери сериясынын 2012 №2 (32). – 68–71–бб.}} |
| + | * {{bib|Стартовый эксперимент как форма включенности каждого ученика в учебный процесс / Текст / Б. Кособаева, Син Е.Е. // Химия в школе. – Москва, 2016. – №6.}} | ||
| + | * {{bib|Дидактические особенности использования технологии обучения на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №6(48), С.155–160.}} | ||
| + | * {{bib|Применение технологии системного усвоения знаний в обучении химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №7(49), С.152–159.}} | ||
| + | * {{bib|Реализация межпредметных связей на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №10(52), С.136–139.}} | ||
| + | * {{bib|Методологические аспекты обучения в современных условиях. / Текст / Б. Кособаева, Син Е.Е., Жакышова Б.Ш. // Проблемы современной науки и образования. – Иваново, 2016. – №13(55), С.104–108.}} | ||
| + | * {{bib|Формирование системы понятий при обучении химии в школе. / Текст / Б. Кособаева, П.Э. Токомбаева // Вестник Кыргызского национального университета имени Ж. Баласагына. – Бишкек, 2017. – Специальный выпуск. С.77–81.}} | ||
| + | * {{bib|Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.}} | ||
| + | * {{bib|Р.А. Лидин Справочник по общей и неорганической химии. М. «Просвещение» 1997г.}} | ||
| + | * {{bib|И.Т. Гороновский, Ю.П. Назаренко, Е.Ф. Некряч. Киев, «Наукова думка», 1974г.}} | ||
| + | * {{bib|Джейн Верзейм, Крис Окслейд и д-р Джон Ватерхаус .Химия. Школьный иллюстрированный справочник (пер. с англ.), М. «Росмэн», 1995г.}} | ||
| + | * {{bib|Л.Л.Андреева, Д.Ю. Добротин, О.С. Габриелян и др. ХИМИЯ, «Большой справочник для школьников и поступающих в вузы», М. «Дрофа», 2004г.}} | ||
| + | * {{bib|Химия. Справочник школьника. Центр гуманитарных наук при факультете журналистики МГУ им. М.В. Ломоносова. М. 1997 г.}} | ||
| + | * {{bib|«Хочу все знать» Сб. Ленинград»Детская литература».1987 г.}} | ||
| + | * {{bib|«Что такое. Кто такой». Изд. «Педагогика» М. 1990 г.}} | ||
| + | * {{bib|«Энциклопедия для детей». Химия т. 17 Изд. дом «Аванта».2000г.}} | ||
| − | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | + | <div class="light" style="float:right;">[[#Начало|В начало]]</div><br clear=all /> |
</div> | </div> | ||
| Строка 863: | Строка 987: | ||
<div class="sbstyle"> | <div class="sbstyle"> | ||
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric"> </div> | + | <div class="large-10 small-10 large-centered small-centered columns rubric">Факты из жизни</div> |
</div> | </div> | ||
| + | В килограммовом пакете кристаллической или стиральной соды (Na<sub>2</sub>CO<sub>3</sub> • 10H<sub>2</sub>O) содержится только 370 граммов активного вещества, остальное – кристаллическая вода. | ||
| + | Наибольшее количество NaOH используется для очистки нефти. | ||
| + | |||
| + | {{center|[[File:Granat sok.jpg|Гранатовый сок может стать отличным индикатором кислотности]]}} | ||
| + | |||
| + | Самая высокая кислотность в организме человека наблюдается в желудке, где PH может достигать единицы. | ||
</div> | </div> | ||
| + | <div class="sbstyle" style="margin-top:20px"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Химия драгоценных камней</div> | ||
| + | </div> | ||
| + | <ul class="small-block-grid-1 large-block-grid-2"> | ||
| + | <li>[[File:Jemchug.png|Жемчуг]]</li> | ||
| + | <li style="padding-top:10px;">[[File:Nefrit.png|Нефрит]]</li> | ||
| + | <li>[[File:Granat.png|Гранат]]</li> | ||
| + | <li>[[File:Ametist.png|Аметист]]</li> | ||
| + | <li>[[File:Cirkon.png|Циркон]]</li> | ||
| + | <li>[[File:Izumrud.png|Изумруд]]</li> | ||
| + | <li>[[File:Rubin.png|Рубин]]</li> | ||
| + | <li>[[File:Sapfir.png|Сапфир]]</li> | ||
| + | </ul> | ||
| + | </div> | ||
| − | <div class="sbstyle"> | + | <div class="sbstyle" style="margin-top:20px"> |
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric"> </div> | + | <div class="large-10 small-10 large-centered small-centered columns rubric">Кыргызстан</div> |
</div> | </div> | ||
| + | {{center-p|[[file:TEC Bishkek.jpg|Бишкекская ТЭЦ]]}} | ||
| − | |||
| + | Низкокалорийные угли с месторождения Кара-Кече в Кыргызстане выгоднее переводить в газообразную топливную смесь (CO + H<sub>2</sub>) обработкой угля водой при нагревании и транспортировать по газопроводу до Бишкека. | ||
| + | |||
| + | C + H<sub>2</sub>O {{arrowT}} CO + H<sub>2</sub> | ||
| + | |||
| + | Методику можно использовать для получения чистого водорода. | ||
| + | |||
| + | 9C + 7H<sub>2</sub>O + O<sub>2</sub> {{arrowT}} 9CO + 7H<sub>2</sub> | ||
| + | При горении угля в воздухе, когда в системе температура поднимается выше 800<sup>о</sup>С возможно образование соединения углерода с азотом воздуха и получения очень ядовитого газа дициана '''(CN≡NC)''' | ||
| + | </div> | ||
<div class="sbstyle"> | <div class="sbstyle"> | ||
<div class="row"> | <div class="row"> | ||
| − | <div class="large-10 small-10 large-centered small-centered columns rubric"></div> | + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Пройди тестирование</div> |
| + | </div> | ||
| + | |||
</div> | </div> | ||
| − | + | </div> | |
{{lang|:KR:Химия: Органикалык эмес бирикмелердин класстары}} | {{lang|:KR:Химия: Органикалык эмес бирикмелердин класстары}} | ||
[[Category:Средняя школа]] | [[Category:Средняя школа]] | ||
[[Category:Химия]] | [[Category:Химия]] | ||
Текущая версия на 09:44, 22 октября 2018

Сложные вещества делятся на оксиды, гидроксиды и соли. Каждый класс соединений, в свою очередь, делится на виды соединений.
Оксиды включают несолеобразующие, основные, амфотерные и кислотные оксиды.
Гидроксиды делятся на щелочи (растворимые основания), основания, амфотерные основания и кислоты.
Соли включают нормальные или средние соли, кислые, основные, комплексные или двойные, и смешанные соли.
Все соединения располагаются в порядке уменьшения их реагирующей способности слева направо.
Для объяснения принципов использования таблицы разработаны правила:
1) Легче всего химические реакции происходят между веществами, формулы которых окрашены в противоположные цвета – синий и красный.
2) Вещества, формулы которых окрашены в фиолетовый цвет, способны реагировать с веществами, формулы которых окрашены как в синий, так и в красный цвет.
3) Вещества, формулы которых окрашены в одинаковый цвет между собой не реагируют.
4) Оксиды реагируют с простыми веществами и гидроксидами и не могут реагировать с солями.
5) Гидроксиды реагируют с оксидами и солями.
6) Соли могут реагировать только с гидроксидами.
Для подтверждения этих правил, все названные группы веществ сгруппированы в широкие полоски. Расположение металлов, неметаллов и сложных веществ в определенном порядке подчиняется свойству активности веществ. Сохранение генетической связи элемента с его соединениями выполненное в цвете, позволяет быстро научить разбираться, какие группы веществ будут реагировать с друг с другом , а какие не будут.
Содержание
Классификация неогранических соединений
H3AlO3 → HAlO2 + H2O; H2ZnO2; H3FeO3 → HFeO2 + H2O;
H3CrO3 → HCrO2 + H2O; H4PbO4 → H2PbO3 + H2O; H4SnO4 → H2O + H2SnO3
Простые и сложные вещества
Все химические вещества делятся на простые и сложные.

К простым веществам относятся те, которые состоят из атомов одного химического элемента.
В зависимости от количества атомов в составе простого вещества или от различного строения кристаллической решетки, простые вещества создают различные аллотропные модификации или аллотропные видоизменения (например О2 – кислород и О3 – озон; алмаз и графит).
Вещества состоящие из атомов двух или более химических элементов называются сложными химическими веществами.
При взаимодействии двух элементов образуются бинарные соединения. При наименовании бинарных соединений, их окончание обозначается суффиксом – ид. Например: Mg3N2 – нитрид магния. Мы подробно рассмотрим наиболее важную группу бинарных соединений – оксиды.
Металлы и неметаллы
Условно все элементы делят на две группы – металлы и неметаллы.
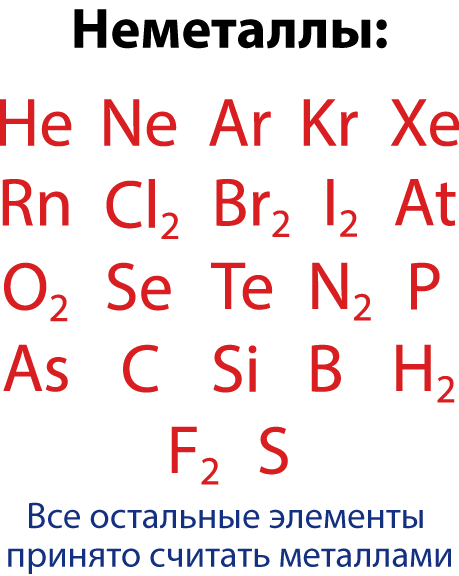
Металлами называют элементы, обладающие способностью легко отдавать имеющиеся у них на внешнем электронном слое 1,2, 3 электрона.
Неметаллами называют элементы с 4 и более электронами на внешнем электронном слое (а также бор , у которого 3 электрона на внешнем электронном слое).
Однако среди неметаллов встречается группа элементов, которые являются газами и молекула который состоит из одного атома – это инертные или благородные газы (VIII – A группа). А среди металлов встречаются такие, соединения которых проявляют как свойства кислоты, так и свойства основания, поэтому их называют амфотерные – т.е. «двойственные».
(Сравни названия с корнем «амфос» - амфора - ваза с двумя ручками, амфибия - животное, которое дышит и в воде и на воздухе – например, лягушка).
В предлагаемой таблице элементы с металлическими свойствами и их соединения обозначены синим цветом. Элементы с неметаллическими свойствами и их соединения обозначены красным цветом. В связи с тем, что амфотерные вещества включают двойственные свойства, они обозначены фиолетовым цветом, так как фиолетовый цвет получается при смешивании красного и синего.Оксиды

При наименовании оксидов вначале указывается корень слова – «окси» –, затем добавляется суффикс – «ид» и называется элемент в родительном падеже. Например: ВаО – оксид бария.
Для элементов с переменной валентностью указывается валентность элемента в составе оксида, например: СuO – оксид меди (II) или Cu2O – оксид меди (I).
Оксиды делятся на 4 группы – несолеобразующие, основные, амфотерные и кислотные.
К несолеобразующим оксидам относятся оксиды неметаллов со степенью окисления +1 и +2 (H2O, CO, SiO, NO, N2O).
К основным оксидам относятся оксиды металлов со степенью окисления +1 и +2 (K2O, Na2O, BaO, CaO, MgO, FeO, CrO, MnO, VO, PbO, SnO, CuO). Основным оксидам в качестве гидроксида соответствуют основания и растворимые основания – щелочи.
К амфотерным оксидам относятся оксиды металлов со степенью окисления +3 и +4 (Al2O3, ZnO, Fe2O3, Cr2O3, MnO2, V2O3, PbO2, SnO2)
Амфотерыми оксидам в качестве гидроксида соответствуют амфотерные основания.
К кислотным оксидам относятся оксиды неметаллов со степенью окисления +3, +4, +5, +6, +7 (по увеличению номера группы в периодической системе); Cl2O7, SO3, N2O5, P2O5, SO2↑, N2O3, P2O3, CO2↑, SiO2↓ (по уменьшению степени активности оксидов слева на право)
(Для Cl, Br, I степень окисления также равна +1) (Cl2O), и оксиды металлов со степенью окисления +5, +6, +7 (CrO3, Mn2O7, V2O5) Кислотным оксидам в качестве гидроксида соответствуют кислоты.
Несолеобразующие оксиды
Способы получения несолеобразующих оксидов
1) Несолеобразующие оксиды получают окислением неметаллов (чаще при недостатке кислорода)
2С + О2 ![]() 2CO
2CO
2) Несолеобразующие оксиды получают прямым синтезом (эндотермическая реакция происходящая в воздухе при разряде молний)
N2 +O2 t=2000→ 2NO — Q
3) Несолеобразующие оксиды получают при пропускании углекислого газа над раскаленным углеродом (углем)
СО2 + С ![]() 2CO
2CO
4) Несолеобразующие оксиды получают при термическом или каталитическом разложении веществ
НСООН t, H2SO4→ H2O + CO
5) Несолеобразующие оксиды получают в окислительно – восстановительных реакциях
3Cu + 8HNO3(разб) ![]() 3Cu(NO3)2 + 2NO + 4H2O
3Cu(NO3)2 + 2NO + 4H2O
4Mg + 10HNO3(разб) ![]() 4Mg(NO3)2 + N2O + 5H2O
4Mg(NO3)2 + N2O + 5H2O
Химические свойства несолеобразующих оксидов
1) При обычной температуре вода реагирует с активными металлами.
2H2O + 2Na ![]() 2NaOH + H2↑
2NaOH + H2↑
2) Несолеобразующие оксиды доокисляются до кислотных оксидов с большей степенью окисления
2CO + O2 ![]() 2CO2
2CO2
2NO + O2 ![]() 2NO2
2NO2
2SiO + O2 ![]() 2SiO2
2SiO2
3) Оксид углерода (II) является хорошим восстановителем для металлов
CO + FeO ![]() Fe + CO2
Fe + CO2
2CO + SnO2 ![]() Sn + 2CO2
Sn + 2CO2
Характеристика некоторых представителей несолеобразующих оксидов
CO – оксид углерода(II), угарный газ, газ без цвета, вкуса, запаха, ядовит, в концентрации 0,2% смертелен, т. к. необратимо связывается с гемоглобином крови. t кип = -192 0С, t пл. = -2030С. Горюч, содержится в табачном дыме.
N2O – оксид азота (I), «веселящий газ» – это анестезирующие вещество, растворимое в воде, тошнотворно-сладкого запаха, в смеси с кислородом употребляется как наркоз перед хирургическими операциями, при вдыхании его бывает стадия смеха, эйфории у больного. При высокой температуре разлагается:
2N2O ![]() 2N2 +O2 +39 Ккал.
2N2 +O2 +39 Ккал.
NO – оксид азота (II) – бесцветный газ, без запаха, малорастворим в воде, единственный оксид, который образуется из воздуха при разрядах молний в эндотермической реакции.
N2 + O2 t=2000→ 2NO — Q.
Основные оксиды
Способы получения основных оксидов
1) Основные оксиды получают при окислении металлов (без нагревания)
2Fe + O2 ![]() 2FeO
2FeO
2) Из одного основного оксида получают другой действием более активного металла
CuO + Mg ![]() MgO +Cu
MgO +Cu
3) Основные оксиды получают частичным восстановлением амфотерных оксидов более активными металлами:
Fe2O3 + Mg ![]() 2FeO + MgO
2FeO + MgO
4) Основные оксиды получают частичным восстановлением амфотерных оксидов углеродом
Fe2O3 + C ![]() 2FeO + CO
2FeO + CO
5) Основные оксиды получают частичным восстановлением амфотерных оксидов оксидом углерода (II)
Fe2O3 + CO ![]() 2FeO + CO2
2FeO + CO2
6) Основные оксиды получают частичным восстановлением амфотерных оксидов водородом
Fe2O3 + H2 ![]() 2FeO + H2O
2FeO + H2O
7) Основные оксиды получают частичным восстановлением кислотных оксидов металлами
CrO3 + 2Mg ![]() CrO + 2MgO
CrO + 2MgO
8) Основные оксиды получают частичным восстановлением кислотных оксидов углеродом
CrO3 + 2C ![]() CrO + 2CO
CrO + 2CO
9) Основные оксиды получают частичным восстановлением кислотных оксидов оксидом углерода (II)
CrO3 + 2CO ![]() CrO + 2CO2
CrO + 2CO2
10) Основные оксиды получают частичным восстановлением кислотных оксидов водородом
CrO3 + 2H2 ![]() CrO + 2H2O
CrO + 2H2O
11) Основный оксид можно получить при термическом разложении нерастворимых оснований (из щелочей нельзя!)
Cu(OH)2 ![]() CuO + H2O
CuO + H2O
12) Основные оксиды можно получить при термическом разложении солей, образованных газообразными кислотными оксидами
CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
CuSO3 ![]() CuO + SO2↑
CuO + SO2↑
Химические свойства основных оксидов
1) Основные оксиды восстанавливаются более активными металлами
MgO + Ba ![]() BaO + Mg
BaO + Mg
2)Основные оксиды металлов, стоящих в ряду активности за водородом, восстанавливаются водородом
CuO + H2 ![]() Cu + H2O
Cu + H2O
Основные оксиды металлов, стоящих в ряду активности за алюминием восстанавливаются коксом ( C ) или оксидом углерода (II)
FeO + C ![]() Fe + CO↑
Fe + CO↑
SnO + CO ![]() Sn + CO2↑
Sn + CO2↑
Основные оксиды металлов с переменной валентностью могут доокисляться кислородом
4FeO + O2 ![]() 2Fe2O3
2Fe2O3
3) Основные оксиды щелочных и щелочеземельных металлов взаимодействуют с водой с образованием щелочей
Na2O + H2O ![]() 2NaOH
2NaOH
4) Основные оксиды взаимодействуют с амфотерными оксидам при сплавлении
Na2O + ZnO ![]() Na2ZnO2
Na2ZnO2
5) Основные оксиды реагируют с кислотными оксидами с образованием солей
CaO + CO2 ![]() CaCO3
CaCO3
6) Основные оксиды реагируют с кислотами с образованием солей
BaO + 2HCl ![]() BaCl2 + H2O
BaCl2 + H2O
7) Основные оксиды реагируют с амфотерными основаниями с образованием солей
Na2O + Zn(OH)2 ![]() Na2ZnO2 + H2O
Na2ZnO2 + H2O
8) Основные оксиды могут донейтрализовывать кислые соли
Na2O + 2NaHCO3 ![]() 2Na2CO3 + H2O
2Na2CO3 + H2O
Характеристика некоторых представителей основных оксидов
CaO – оксид кальция, негашеная известь – белое твердое вещество, легко реагирующее с водой с большим выделением тепла (гашение извести), углекислым газом, tпл = 26300С.
CaO + H2O ![]() Сa(OH)2 + Q
Сa(OH)2 + Q
CuO – Оксид меди (II) твердое хрупкое вещество черного цвета, нерастворимое в воде, при температуре свыше 800 0С разлагается до образования Cu2O – оксида меди (I), плотность 6,45 г/см3.
Получают
Cu2(ОН)2CO3 ![]() CuO + CO2↑ + H2O
CuO + CO2↑ + H2O
Амфотерные оксиды
Способы получения амфотерных оксидов
1) Амфотерные оксиды получают окислением металлов
4Al + 3O2 ![]() 2Al2O3
2Al2O3
2) Амфотерные оксиды получают из основных оксидов доокислением металлов
4FeO + O2 ![]() 2Fe2O3
2Fe2O3
3) Из одного амфотерного оксида получают другой действием более активного металла
Fe2O3 + 2Al ![]() Al2O3 + 2Fe
Al2O3 + 2Fe
4) Амфотерные оксиды получают частичным восстановлением кислотных оксидов
V2O5 + 2H2 ![]() V2O3 + 2H2O
Оксид ванадия(V) Оксид ванадия (III)
V2O3 + 2H2O
Оксид ванадия(V) Оксид ванадия (III)
5) Амфотерные оксиды получают термическим разложением амфотерных оснований
Zn(OH)2 ![]() ZnO + H2O
ZnO + H2O
6) Амфотерные оксиды получают при термическом разложении солей, образованных газообразными кислотными оксидами и амфотерными металлами
ZnCO3![]() ZnO + CO2↑
ZnO + CO2↑
7) Амфотерные оксиды получают при термическом разложении кислых солей, образованных амфотерными металлами
2Al(HCO3)3 ![]() Al2O3 + 6CO2↑ + 3H2O
Al2O3 + 6CO2↑ + 3H2O
Химические свойства амфотерных оксидов
1) Амфотерные оксиды восстанавливаются до металла более активными металлами
MnO2 + 2Mg ![]() Mn + 2MgO
Mn + 2MgO
2) Амфотерные оксиды металлов, стоящих в ряду активности за водородом, восстанавливаются водородом до основного оксида
Fe2O3 + H2 ![]() 2FeO + H2O
2FeO + H2O
3) Амфотерные оксиды металлов, стоящих в ряду активности за алюминием восстанавливаются до основного оксида или металла коксом (С) или оксидом углерода (II)
Fe2O3 + C ![]() 2FeO + CO↑
2FeO + CO↑
2Fe2O3 + 3C ![]() 4Fe + 3CO2↑
4Fe + 3CO2↑
ZnO + CO ![]() Zn + CO2↑
Zn + CO2↑
4) Амфотерные оксиды металлов с переменной валентностью могут доокисляться до кислотных оксидов только атомарным кислородом
Cr2O3 + 3[О] ![]() 2CrO3
2CrO3
5) Амфотерные оксиды реагируют с основными оксидами при сплавлении с образованием солей
ZnO + Na2O ![]() Na2ZnO2
Na2ZnO2
CaO + ZnO ![]() СaZnO2
СaZnO2
6 ) Амфотерные оксиды реагируют с сильными кислотными оксидами с образованием солей
ZnO + N2O5 ![]() Zn(NO3)2
Zn(NO3)2
7) Амфотерные оксиды реагируют с основаниями с образованием солей и воды
ZnO + Сa(OН)2 ![]() СaZnO2 + H2O
СaZnO2 + H2O
8) Амфотерные оксиды реагируют с сильными кислотами с образованием солей и воды
ZnO + 2НNO3 ![]() Zn(NO3)2 + H2O
Zn(NO3)2 + H2O
Характеристика некоторых представителей амфотерны оксидов
ZnO — оксид цинка-белое кристаллическое вещество, практически нерастворимое в воде, tпл = 1975 0С. Употребляется в качестве наполнителя для белой краски и изготовления лекарственных мазей.
Кислотные оксиды
Способы получения кислотных оксидов
1) Кислотный оксид из металла можно получить только при окислении его атомарным кислородом в окислительно-восстановительной реакции
Cr + 3[O] ![]() CrO3
CrO3
2) Кислотный оксид можно получить из неметалла прямым окислением или горением
4P + 5O2 ![]() 2P2O5
2P2O5
3) Кислотный оксид можно получить из несолеобразующего оксида доокислением
2CO + O2 ![]() 2CO2
2CO2
4) Кислотный оксид можно получить из основного оксида доокислением атомарным кислородом
CrO + 2[O] ![]() CrO3
CrO3
5) Кислотный оксид можно получить из амфотерного оксида доокислением атомарным кислородом
Cr2O3 + 3[O] ![]() 2CrO3
2CrO3
6) Кислотный оксид можно получить из кислотного оксида доокислением кислородом
P2O3 + O2 ![]() P2O5
P2O5
7) Кислотный оксид можно получить при термическом разложении средних солей, образованных газообразными оксидами
CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
8) Кислотный оксид можно получить при термическом разложении кислых солей, образованных газообразными оксидами
2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
Химические свойства кислотных оксидов
1) Кислотные оксиды реагируют с активными металлами
SiO2 + 2Mg ![]() 2MgO + Si (получается аморфный кремний)
2MgO + Si (получается аморфный кремний)
2) Кислотные оксиды реагируют с водородом
SiO2 + 2H2 ![]() 2H2O + Si (получается аморфный кремний)
2H2O + Si (получается аморфный кремний)
3) Кислотные оксиды реагируют с углеродом
SiO2 + C ![]() CO2 + Si ( получается кристаллический кремний, т.к. С - кристаллическая затравка для образования кристаллов)
CO2 + Si ( получается кристаллический кремний, т.к. С - кристаллическая затравка для образования кристаллов)
4) Кислотные оксиды реагируют с оксидом углерода (II)
SiO2 + 2CO ![]() 2CO2 + Si
2CO2 + Si
5) Кислотные оксиды доокисляются кислородом
P2O3 + О2 ![]() P2O5
P2O5
6) Кислотные оксиды реагируют с водой с образованием кислот
SO3 + H2O ![]() Н2SO4
Н2SO4
7) Кислотные оксиды реагируют с амфотерными оксидами образованием солей
N2O5 + ZnO ![]() Zn(NO3)2
Zn(NO3)2
8) Кислотные оксиды реагируют с щелочами с образованием солей
SO2 + NaOH ![]() NaHSO3
NaHSO3
SO2 + 2NaOH ![]() Na2SO3 + H2O
Сульфит натрия
Na2SO3 + H2O
Сульфит натрия
9) Кислотные оксиды реагируют с амфотерными основаниями с образованием солей и воды.
3N2O5 + 2Al(OH)3 ![]() 2Al(NO3)3 + 3 H2O
2Al(NO3)3 + 3 H2O
10) Более активные кислотные газообразные оксиды вытесняют менее активные газообразные оксиды из кислот и солей
H2CO3 + SO2 ![]() H2SO3 + CO2↑
H2SO3 + CO2↑
Na2CO3 + SO2 ![]() Na2SO3 + CO2↑
Na2SO3 + CO2↑
11) Кислотные оксиды донейтрализовывают основные соли.
N2O5 + 2Ca(OH)NO3 ![]() 2Ca(NO3)2 + H2O
2Ca(NO3)2 + H2O
Характеристика некоторых представителей кислотных оксидов
SO3 — оксид серы (VI), серный ангидрид – бесцветная летучая жидкость,tпл. 16,8 0С, получают окислением SO2 в присутствии катализатора, проявляет сильные окислительные свойства.
2SO2 + О2 ![]() 2SO3
2SO3
Р2O5 — белое гигроскопичное порошкообразное вещество, возгоняется при 359 0С, применяется как водопоглощающее средство.
Соли
Солями называют сложные химические вещества, состоящие из атомов металлов и кислотных остатков.
Соли бывают средние (нормальные), кислые, основные, двойные, комплексные, смешанные.
Средними или нормальными солями называются соли, в которых полностью замещены все атомы водорода на атомы металлов, а все гидроксильные группы замещены кислотными остатками.
Кислыми солями называют соли, в которых не все атомы водорода из кислот замещены атомами металлов.
Основными солями называются соли, в которых наряду с кислотными остатками сохранились гидроксогруппы группы от оснований.
Двойными солями называются такие, в которых атомы водорода замещены атомами двух разных металлов.
Комплексные соли, имеющие слоистое строение, состоят из центрального атома металла – комплексообразователя, окруженного лигандами – противоположно заряженными ионами по сравнению с комплексообразователем или нейтральными молекулами, что составляет внутреннюю сферу комплексной соли, а следующий слой составляют ионы внешней сферы, противоположно заряженные по отношению к ионам внутренней сферы.
Смешанными солями называют соли, у которых при одном атоме металла находятся два разных кислотных остатка. Ca(OCl)Cl — гипохлоритхлорид кальция (хлорная известь).
Способы получения солей
1) Соли получают методом прямого синтеза в реакции металлов с неметаллами
2Na + Cl2 ![]() 2NaCl
2NaCl
Fe + S ![]() FeS
FeS
2) Соли образуются в реакции взаимодействия металлов с кислотами
Zn + 2HCl ![]() ZnCl2 + H2 ↑
ZnCl2 + H2 ↑
3) Новые соли образуются при реакции солей с более активными металлами
Fe + CuSO4 ![]() FeSO4 + Cu
FeSO4 + Cu
4) Соли образуются при сплавлении основных и амфотерных оксидов
K2O + ZnO ![]() K2ZnO2
K2ZnO2
5) Соли образуются при реакции основных и кислотных оксидов
CaO + CO2 ![]() CaCO3
CaCO3
6) Соли образуются при сплавлении амфотерных и кислотных оксидов
Al2O3 + P2O5 ![]() 2AlPO4
2AlPO4
7)Соли образуются при реакции основных оксидов с кислотами
CuO + H2SO4 ![]() CuSO4 + H2O
CuSO4 + H2O
8) Соли образуются при реакции кислотных оксидов с щелочами, при этом могут образоваться как средние, так и кислые соли
СO2 + NaOH ![]() + NaHСO3
+ NaHСO3
СO2 + 2NaOH ![]() + Na2СO3 + H2O
+ Na2СO3 + H2O
9) Новые соли образуются при реакции более активных газообразных оксидов с солями
SO2 + Na2CO3 ![]() Na2SO3 + CO2↑
Na2SO3 + CO2↑
10) Соли образуются при реакции нейтрализации между основаниями и кислотами, причем продуктами реакции могут быть средние, кислые и основные соли
Ba(OH)2 + H2SO4 ![]() BaSO4↓ + 2H2O
BaSO4↓ + 2H2O
NaOH + H2SO4 ![]() NaHSO4 + H2O
NaHSO4 + H2O
Ba(OH)2 + HCl ![]() Ba(OH)Cl + H2O
Ba(OH)Cl + H2O
11) Новые соли образуются при реакции между основаниями и солями
Ca(OH)2 + 2Na3PO4 ![]() Ca3(PO4)2↓ + 3NaOH
Ca3(PO4)2↓ + 3NaOH
Химические свойства солей
1. Соли взаимодействуют в реакциях замещения с более активными металлами
3K + AlCl3![]() 3KCl + Al
3KCl + Al
Fe + CuSO4 ![]() FeSO4 + Cu
FeSO4 + Cu
2. Соли реагируют с растворимыми основаниями (щелочами) с образованием новой соли и нового основания
2NaOH + CuSO4 ![]() Cu(OH)2 ↓ + Na2(SO4)2
Cu(OH)2 ↓ + Na2(SO4)2
3. Соли реагируют с кислотами с образованием новой соли и новой кислоты.
Na3PO4 + 3HCl ![]() 3NaCl + H3PO4
3NaCl + H3PO4
4. Соли реагируют между собой с образованием новых солей, особенно, если образуется менее диссоциирующее вещество.
BaCl2 + Na2(SO4)2 ![]() BaSO4↓ + 2NaCl
BaSO4↓ + 2NaCl
Солями называют сложные химические вещества, состоящие из атомов металлов и кислотных остатков. Кроме атомов металлов в состав солей может входить ион аммония - вещества, образованного по принципу донорно-акцепторной связи.
Основания
Основаниями называются сложные химические вещества, состоящие из атомов металлов, соединенных с одной или несколькими гидроксильными группами. Различают растворимые и нерастворимые в воде основания. Растворимые основания называются щелочами.
К растворимым основаниям – щелочам относят все основания металлов с валентностью I, а также основания бария, стронция и кальция.
Среди оснований выделяют группу веществ, именующуюся амфотерными (двойственными) основаниями. К амфотерным основаниям относятся основания, где у металлов валентность равна III и IV, а также основание двухвалентного цинка. Все амфотерные основания нерастворимы в воде. Амфотерные основания обладают способностью реагировать как с кислотами, так и с щелочами. Одно и тоже амфотерное основание можно представить в виде Al(OH)3 и H3AlO3. В химических реакциях вещество проявляется в той или иной форме в зависимости от среды, в которой происходит реакция. Если гидроксид алюминия реагирует с кислотой, то выбирается формула Al(OH)3, а при реакции с щелочью формула отражает ортоалюминиевую кислоту H3AlO3. Все амфотерные основания в присутствии щелочей обладают способностью выделять воду [кроме Zn(OH)2], и таким образом проявляются как в орто – так и в метаформе HAlO2 (метаалюминиевая кислота) + H2O, образуя два типа соединений.
Способы получения щелочей и оснований
1. Щелочи получают взаимодействием активных металлов с водой
2Na + 2H2O → 2NaOH + H2↑
2. Щелочи получают взаимодействием оксидов активных металлов с водой
СaO + H2O → Ca(OH)2
3. Нерастворимые в воде основания, в том числе и амфотерные основания, получают в реакциях обмена из солей, действием растворимых щелочей
MgCl2 + 2KOH → Mg(OH)2 ↓ + 2KCl
ZnSO4 + 2NaOH → Zn(OH)2 ↓ + Na2SO4
FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
4. Гидроксиды калия и натрия в больших количествах получают электролизом из водных растворов их солей в виде хлоридов.
2KCl + 2H2O ![]() 2KOH + H2↑ + Cl2↑
2KOH + H2↑ + Cl2↑
Химические свойства оснований
1. Щелочи взаимодействуют с оксидом углорода (II), с образованием формиата щелочного металла.
NaOH + CO ![]() HCOONa
HCOONa
2. Щелочи взаимодействуют с амфотерными оскидами с образованием солей.
2NaOH + ZnO ![]() Na2ZnO2 + H2O
Na2ZnO2 + H2O
6NaOH + Al2O3 ![]() 2Na3AlO3 + 3H2O
2Na3AlO3 + 3H2O
2NaOH + Al2O3 ![]() 2NaAlO2 + H2O (наиболее часто встречающийся вариант реакции)
2NaAlO2 + H2O (наиболее часто встречающийся вариант реакции)
3. Щелочи взаимодействуют с оксидом углорода (IV), с образованием двух видов солей
NaOH + CO2 ![]() NaHCO3
NaHCO3
NaOH + CO2 ![]() Na2CO3 + H2O
Na2CO3 + H2O
4. Щелочи взаимодействуют с амфотерными гидроскидами с образованием солей.
2NaOH + Zn(OH)2 ![]() Na2ZnO2 + 2H2O
Na2ZnO2 + 2H2O
3NaOH + Al(OH)3 ![]() Na3AlO3 + 3H2O
Na3AlO3 + 3H2O
NaOH + Al(OH)3 ![]() NaAlO2 + 2H2O
NaAlO2 + 2H2O
5. Щелочи и нерастворимые основания взаимодействуют с кислотами.
NaOH + HCl ![]() NaCl + H2O
NaCl + H2O
Fe(OH)3 + 3HCl ![]() FeCl3 + 3H2O
FeCl3 + 3H2O
Растворимые щелочи, нерастворимые основания и нерастворимые амфотерные основания при взаимодействии с сильными кислотами переходят в растворимые соли.
Реакция между основаниями и кислотами, в результате которой образуется соль и вода, называется реакцией нейтрализации.
6. В случае неполной нейтрализации основания кислотой, образуются основные соли
Ba(OH)2 + HNO3 ![]() Ba(OH)NO3 + H2O
Ba(OH)NO3 + H2O
7. Щелочи взаимодействуют с солями с образованием новых оснований и новых солей
FeCl3 + 3NaOH ![]() Fe(OH)3↓ + 3NaCl
Fe(OH)3↓ + 3NaCl
CuSO4 + 2KOH ![]() Cu(OH)2↓ + K2SO4
Cu(OH)2↓ + K2SO4
Кислоты
К кислотам относятся сложные химические вещества, состоящие из атомов водорода, способных обмениваться на атомы металлов, и кислотных остатков. Количество атомов водорода, входящих в состав кислоты определяет основность кислоты. По признаку основности кислоты разделяют на одноосновные, двухосновные и многоосновные. По наличию атома кислорода кислоты разделяют на бескислородные (HI, HBr, HCl, HF, H2S↑, HCN) и кислородсодержащие( HClO4, H2SO4, HNO3, H4P2O7, H2SO3↑, H3PO4, HNO2, H2CO3↑).
Способы получения кислот
1) Бинарные бескислородные кислоты можно получить прямым синтезом из неметаллов, одним из которых должен быть водород
H2 + Cl2 ![]() 2HCl
2HCl
H2 + S ![]() H2S
H2S
2) Галогенсодержащие кислоты получают вытеснением менее сильных по электроотрицательности галогенов более сильными галогенами
2HI + Cl2 ![]() 2HCl + I2↓
2HCl + I2↓
3) Кислородсодержащие кислоты получают взаимодействием кислотных оксидов с водой
P2O5 + 3H2O ![]() 2H3PO4
2H3PO4
4) Новые кислоты могут быть получены в реакциях доокисления
2H2SO3 + O2 ![]() 2H2SO4
2H2SO4
5) Кислоты получают вытеснением более активными кислотными оксидами менее активных оксидов (особенно характерно для газообразных кислотных оксидов)
H2CO3 + SO2 ![]() H2SO3 + CO2↑
H2SO3 + CO2↑
6) Кислоты можно получить в реакциях обмена между солями и другими сильными кислотами
Ba(NO3)2 + H2SO4 ![]() BaSO4↓ + 2HNO3
BaSO4↓ + 2HNO3
Химические свойства кислот
1) Кислоты взаимодействуют с активными и амфотерными металлами с выделением водорода
2HCl + Zn ![]() ZnCl2 + H2↑
ZnCl2 + H2↑
H2SO4(разб.) + Mn ![]() MnSO4 + H2↑
MnSO4 + H2↑
2) Концентрированные кислоты, такие как серная и азотная являются сильными окислителями и при реакции с металлами выделяют другие продукты реакции : сернистый газ, сероводород, серу, оксиды азота с различной степенью окисления или аммиак.
3) Для галогенсодержащих бескислородных кислот характерно замещение в кислотах менее активных галогенов более активными галогенами
2HI + Cl2 ![]() 2HCl + I2 ↓
2HCl + I2 ↓
4) Кислоты взаимодействуют с основными оксидами с образованием соли и воды
H2SO4(разб.) + BaO ![]() BaSO4↓ + H2O
BaSO4↓ + H2O
5) Кислоты взаимодействуют с амфотерными оксидами с образованием соли и воды
2HNO3 + ZnO ![]() Zn(NO3)2 + H2O
Zn(NO3)2 + H2O
6) Кислоты способны взаимодействовать с более активными кислотными оксидами с образованием новой кислоты и выделением менее активного кислотного оксида. Особенно хорошо реакция прослеживается с газообразными оксидами
H2CO3 + SO2 ![]() H2SO3 + CO2↑
H2SO3 + CO2↑
7) Кислоты взаимодействуют с основаниями как растворимыми (щелочами), так и нерастворимыми в реакции нейтрализации. Продуктами этих реакций могут быть как средние соли, так и продукты неполной нейтрализации – соли кислые
2NaOH + H2SO4 ![]() Na2SO4 + 2H2O
Na2SO4 + 2H2O
NaOH + H2SO4 ![]() NaHSO4 + H2O
NaHSO4 + H2O
8) Между кислотами происходят оксислительно-восстановительные реакции с изменением степени окисления элементов, входящих в состав этих кислот
H2SO4 + HBr ![]() Br2 + SO2↑ + H2O
Br2 + SO2↑ + H2O
9) При взаимодействии кислот с солями в реакциях обмена образуются как новая кислота, так и новая соль
H2SO4(конц) + Ba(NO3)2 ![]() BaSO4↓ + 2HNO3
BaSO4↓ + 2HNO3
10) Кислоты способны проводить донейтрализацию основных солей с образованием средних солей
Mg(OH)Cl + HCl ![]() MgCl2 + H2O
MgCl2 + H2O
11) Сильные кислоты разлагают соли, содержащие газообразные оксиды
CaSO3 + 2HCl ![]() CaCl2 + SO2↑
CaCl2 + SO2↑
Характеристика некоторых представителей кислот
HNO3 азотная кислота. Это бесцветная жидкость с резким запахом, легко испаряется, tкип = 860С, с водой смешивается в любых соотношениях. Среди всех кислот – эта кислота самый сильный окислитель. При хранении имеет желтую окраску т.к. разлагается с выделением бурого газа – NO2 – оксида азота (IV), растворяющегося в ней. Тлеющая лучина, поднесенная к поверхности концентрированной азотной кислоты, разгорается за счет выделения кислорода.
4HNO3 hv→ 2H2O + 4NO2 + O2↑
Поступаемая в продажу кислота обычно имеет 63% концентрацию и плотность равную 1,4г/см3. При попадании на кожу вызывает сильные ожоги с образованием желтых пятен, так как реагирует с белками. Ее надо смыть большим количеством воды и нейтрализовать раствором соды.
H2SO4 серная кислота – это бесцветная маслянистая жидкость без запаха, t крист +10,50C. Старинное название серной кислоты - олеум, а безводной H2SO4 – купоросное масло. Серная кислота, являясь сильным окислителем, проявляет типичные свойства кислоты. Эта двухосновная кислота диссоциирует ступенчато, образуя кислые и средние соли. Раствор серной кислоты с концентрацией менее 70% называется разбавленным, более 70% - концентрированным. Концентрированная серная кислота при попадании на кожу оставляет сильные ожоги, поэтому при попадании кислоты на кожу надо обильно смыть ее водой и обработать раствором питьевой соды. Избегать попадания серной кислоты в глаза.
HCl соляная кислота – водный раствор хлороводорода, бесцветная жидкость дымящаяся на влажном воздухе, tпл = – 1140С, tкип = - 850С. Получают сжиганием водорода в хлоре и растворением полученного хлороводорода в воде. В поступающей в продажу соляной кислоте массовая доля хлороводорода 37%, при плотности раствора 1,19г/см3. Соляная кислота применяется для получения солей, травления металлов, в пищевой промышленности, медицине, химическом анализе. Входит в состав желудочного сока.
Н3РО4 фосфорная кислота, ортофосфорная кислота. Это – бесцветное кристаллическое вещество, tпл = 420С, трехосновная кислота, однако несильная, хорошо растворима в воде, не ядовита, применяется в пищевой промышленности для приготовления сиропов. В промышленности получают экстракционным методом, обрабатывая фосфориты и апатиты концентрированной серной кислотой.
Ca3(PO4)2 + 3H2SO4 ![]() 3CaSO4↓ + 2H3PO4
3CaSO4↓ + 2H3PO4
Глоссарий
- Металлами называют элементы, обладающие способностью легко отдавать имеющиеся у них на внешнем электронном слое 1,2, 3 электрона.
- Неметаллами называют элементы с 4 и более электронами на внешнем электронном слое (а также бор, у которого 3 электрона на внешнем электронном слое).
- Инертные или благородные газы (VIII – A группа) — это группа элементов, которые являются газами, и молекула которых состоит из одного атома.
- Амфотерными металлами являются такие, соединения которых проявляют как свойства кислоты, так и свойства основания, поэтому их называют «двойственные». (Сравни названия с корнем «амфос» – амфора – ваза с двумя ручками, амфибия – животное, которое дышит и в воде и на воздухе – например, лягушка).
- Простыми веществами называются такие, молекулы которых состоят из атомов одного химического элемента. В зависимости от количества атомов в составе простого вещества или от различного строения кристаллической решетки, простые вещества создают различные аллотропные модификации или аллотропные видоизменения (например О2 – кислород и О3 – озон; алмаз и графит).
- Сложными химическими веществами называют вещества, состоящие из атомов двух или более химических элементов.
- Бинарные соединения.состоят из атомов двух элементов. При наименовании бинарных соединений, их окончание обозначается суффиксом – ид. Например: Mg3N2 – нитрид магния.
- Оксидами называются сложные химические вещества, состоящие из атомов двух элементов, одном из которых является кислород. При наименовании оксидов вначале указывается корень слова – окси-, затем добавляется суффикс –ид и называется элемент в родительном падеже. Например: ВаО – оксид бария. Для элементов с переменной валентностью указывается валентность элемента в составе оксида, например: СuO –оксид меди (II) или Cu2O – оксид меди (I).
- Несолеобразующими оксидами называются оксиды неметаллов со степенью окисления +1 и +2 (H2O, CO, SiO, NO, N2O).
- Основными оксидами называются оксиды металлов со степенью окисления +1 и +2 (K2O, Na2O, BaO, CaO, MgO, FeO, CrO, MnO, VO, PbO, SnO, CuO), (кроме ZnO). Основным оксидам в качестве гидроксида соответствуют основания и растворимые основания – щелочи.
- Амфотерными оксидами называются оксиды металлов со степенью окисления +3 и +4 (Al2O3, Fe2O3, Cr2O3, MnO2, V2O3, PbO2, SnO2 и ZnO). Амфотерыми оксидам в качестве гидроксида соответствуют амфотерные основания.
- Кислотными оксидами называются оксиды неметаллов со степенью окисления +3, +4, +5, +6, +7, (Cl2O7, SO3, N2O5, P2O5, SO2↑, N2O3, P2O3, CO2↑, SiO2↓), (Для Cl, Br, I степень окисления также равна +1) (Cl2O), и оксиды металлов со степенью окисления +5, +6, +7 (CrO3, Mn2O7, V2O5). Кислотным оксидам в качестве гидроксида соответствуют кислоты.
Библиография
- Кособаева Б. – Использование компьютера в учебном процессе химии / Текст / Б. Кособаева, Н.Б. Арстанбекова // Абай атындагы Казак Улуттукпедагогикалык университеттинин Хабарши (Вестник) Жаратылыш таануу-география илимдери сериясынын 2012 №2 (32). – 68–71–бб.
- Стартовый эксперимент как форма включенности каждого ученика в учебный процесс / Текст / Б. Кособаева, Син Е.Е. // Химия в школе. – Москва, 2016. – №6.
- Дидактические особенности использования технологии обучения на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №6(48), С.155–160.
- Применение технологии системного усвоения знаний в обучении химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №7(49), С.152–159.
- Реализация межпредметных связей на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №10(52), С.136–139.
- Методологические аспекты обучения в современных условиях. / Текст / Б. Кособаева, Син Е.Е., Жакышова Б.Ш. // Проблемы современной науки и образования. – Иваново, 2016. – №13(55), С.104–108.
- Формирование системы понятий при обучении химии в школе. / Текст / Б. Кособаева, П.Э. Токомбаева // Вестник Кыргызского национального университета имени Ж. Баласагына. – Бишкек, 2017. – Специальный выпуск. С.77–81.
- Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.
- Р.А. Лидин Справочник по общей и неорганической химии. М. «Просвещение» 1997г.
- И.Т. Гороновский, Ю.П. Назаренко, Е.Ф. Некряч. Киев, «Наукова думка», 1974г.
- Джейн Верзейм, Крис Окслейд и д-р Джон Ватерхаус .Химия. Школьный иллюстрированный справочник (пер. с англ.), М. «Росмэн», 1995г.
- Л.Л.Андреева, Д.Ю. Добротин, О.С. Габриелян и др. ХИМИЯ, «Большой справочник для школьников и поступающих в вузы», М. «Дрофа», 2004г.
- Химия. Справочник школьника. Центр гуманитарных наук при факультете журналистики МГУ им. М.В. Ломоносова. М. 1997 г.
- «Хочу все знать» Сб. Ленинград»Детская литература».1987 г.
- «Что такое. Кто такой». Изд. «Педагогика» М. 1990 г.
- «Энциклопедия для детей». Химия т. 17 Изд. дом «Аванта».2000г.
В килограммовом пакете кристаллической или стиральной соды (Na2CO3 • 10H2O) содержится только 370 граммов активного вещества, остальное – кристаллическая вода.
Наибольшее количество NaOH используется для очистки нефти.
Самая высокая кислотность в организме человека наблюдается в желудке, где PH может достигать единицы.
Низкокалорийные угли с месторождения Кара-Кече в Кыргызстане выгоднее переводить в газообразную топливную смесь (CO + H2) обработкой угля водой при нагревании и транспортировать по газопроводу до Бишкека.
C + H2O ![]() CO + H2
CO + H2
Методику можно использовать для получения чистого водорода.
9C + 7H2O + O2 ![]() 9CO + 7H2
9CO + 7H2
При горении угля в воздухе, когда в системе температура поднимается выше 800оС возможно образование соединения углерода с азотом воздуха и получения очень ядовитого газа дициана (CN≡NC)