Химия: Металлдар — различия между версиями
Admine2 (обсуждение | вклад) |
Admine2 (обсуждение | вклад) |
||
| (не показано 28 промежуточных версий этого же участника) | |||
| Строка 1: | Строка 1: | ||
{{Якорь|Начало}} | {{Якорь|Начало}} | ||
<div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | ||
| − | + | ||
== Металлдардын жалпы касиеттери == | == Металлдардын жалпы касиеттери == | ||
| − | Сырткы энергетикалык деңгээлинде | + | Сырткы энергетикалык деңгээлинде 1, 2 же 3 электрону бар элементтер металлдарга кирет. (Суутектен, гелийден жана бордон башкасы. Металлдар элементтердин мезгилдик системасында негизги жана кошумча подгруппаларда жайгашкан). Аларга жылуулук жана электр өткөргүчтүк, согууга элпектик, ийилгичтик жана зымдай созулуу касиеттери таандык .Бардык металлдар кадимки температурада сымаптан башкасы катуу абалда болот, металлдык жалтырактыкка ээ жана алтындай сары, күмүш сымал-боз түстө, ал түгүл көгүш түстɵргɵ боелуп, кубулуп турат. |
| − | {{center-p|[[file:Metally demonstracia.png|600px|center| | + | {{center-p|[[file:Metally demonstracia.png|600px|center|Кээ бир металлдардын сырткы кɵрүнүшү]]}} |
| − | Бул касиеттер металлдардын атомунун түзүлүшүнө жана түйүндөрүндө нейтралдык атомдор менен бирге оң заряддалган иондор жайгашкан кристаллдык торчолордун жаратылышына да байланыштуу болот. Ал эми электрондор (электрондук газ) түйүн аралык мейкиндикте жайгашат. Типтүү металлдар-калыбына келтиргичтер, бирок алар амфотердик касиеттерге (металлдык да металл эместик да касиети) да ээ болот. Металлдар касиеттери боюнча бир нече топторго биригишет: щелочтук металлдар (<span class="metall">Li, Na, K, Rb,Cs, Fr</span>), щелочтук жер металлдар (<span class="metall">Ca, Sr, Ba, Ra</span>), түстүү металлдар (<span class="metall">Ag, Au, Cu, Mn, Co, Ni, Cr</span>), кара металл–Fe жана анын куймалары), асыл металлдар (<span class="metall">Ag, Au, Pt,Ru, Rh,Pd, Os, Ir</span>), жеңил | + | Бул касиеттер металлдардын атомунун түзүлүшүнө жана түйүндөрүндө нейтралдык атомдор менен бирге оң заряддалган иондор жайгашкан кристаллдык торчолордун жаратылышына да байланыштуу болот. Ал эми электрондор (электрондук газ) түйүн аралык мейкиндикте жайгашат. Типтүү металлдар-калыбына келтиргичтер, бирок алар амфотердик касиеттерге (металлдык да металл эместик да касиети) да ээ болот. Металлдар касиеттери боюнча бир нече топторго биригишет: щелочтук металлдар (<span class="metall">Li, Na, K, Rb,Cs, Fr</span>), щелочтук жер металлдар (<span class="metall">Ca, Sr, Ba, Ra</span>), түстүү металлдар (<span class="metall">Ag, Au, Cu, Mn, Co, Ni, Cr</span>), кара металл–Fe жана анын куймалары), асыл металлдар (<span class="metall">Ag, Au, Pt,Ru, Rh,Pd, Os, Ir</span>), жеңил металлдар – тыгыздыгы 5 г/см<sup>3</sup> төмөн жана оор металлдар – тыгыздыгы 5 г/см<sup>3</sup> жогору болгон. Металлдардын тыгыздыгы 0,53 г/см<sup>3</sup> болгон литийден 22, 7 г/см<sup>3</sup> болгон осмийге чейинки мааниге ээ болот. |
Бир нече металлдардын жана металл эместердин аралашмасынан турган куймаларда металлдардын жеке касиеттери толугу менен өзгөрүп кетет. Алар катуу эритмелер, интерметаллиддер жана механикалык аралашмалар болушу мүмкүн. Куймалар бекем болот, кыйынчылык менен эрийт, алардын балкып эрүү температурасы кескин төмөндɵйт, кислотага, щелочко туруктуу болуу менен жаңы касиеттерге ээ болот. | Бир нече металлдардын жана металл эместердин аралашмасынан турган куймаларда металлдардын жеке касиеттери толугу менен өзгөрүп кетет. Алар катуу эритмелер, интерметаллиддер жана механикалык аралашмалар болушу мүмкүн. Куймалар бекем болот, кыйынчылык менен эрийт, алардын балкып эрүү температурасы кескин төмөндɵйт, кислотага, щелочко туруктуу болуу менен жаңы касиеттерге ээ болот. | ||
| Строка 13: | Строка 13: | ||
==Щелочтук металлдар== | ==Щелочтук металлдар== | ||
| − | {{right|[[file: | + | <div class="show-for-large-up">{{right|[[file:ЛитийKG.mp4|300px]]}}</div> |
| − | <span class="metall">'''Li, Na, К , Rb, Cs, Fr'''</span> металлдары суу менен аракеттенишип, щелочторду–сууда эрүүчү негиздерди пайда кылгандыгы үчүн щелочтуу металлдар деп аталат. Бардык щелочтуу металлдардын S –электрондук катмарында 1<big class="elektron" data-title="–">е</big> толот, ошондуктан калыбына келтиргичтер катары металлдык касиеттерди алып жүрɵт, кычкылдануу даражасы '''+1''' барабар, I валенттүү болот. Балкып эрүү температурасы төмөн (t<small>бал</small>) болот, цезий адамдын колунун жылуулугунан эле балкып эрийт. | + | <div class="hide-for-large-up">{{center|[[file:ЛитийKG.mp4]]}}</div> |
| + | <span class="metall">'''Li, Na, К , Rb, Cs, Fr'''</span> металлдары суу менен аракеттенишип, щелочторду–сууда эрүүчү негиздерди пайда кылгандыгы үчүн щелочтуу металлдар деп аталат. Бардык щелочтуу металлдардын S –электрондук катмарында 1<big class="elektron" data-title="–">е</big> толот, ошондуктан калыбына келтиргичтер катары металлдык касиеттерди алып жүрɵт, кычкылдануу даражасы '''+1''' барабар, I валенттүү болот. Балкып эрүү температурасы төмөн (t<small>бал</small>) болот, мисалы, цезий адамдын колунун жылуулугунан эле балкып эрийт. | ||
Бул металлдардын туздары жалынды мүнөздүү ар түрдүү түстөргө боёшот: литий – ачык кызыл, натрий–кызгылт сары, калий – кочкул, рубидий–кызыл, цезий – көгүш түскө. | Бул металлдардын туздары жалынды мүнөздүү ар түрдүү түстөргө боёшот: литий – ачык кызыл, натрий–кызгылт сары, калий – кочкул, рубидий–кызыл, цезий – көгүш түскө. | ||
| − | {{center-p|[[file:Img10.jpg|400px|center| | + | {{center-p|[[file:Img10.jpg|400px|center|Металлдардын жалындын түсүн боёшу]]}} |
Франций – туруксуз изотобу бар радиоактивдүү элемент. | Франций – туруксуз изотобу бар радиоактивдүү элемент. | ||
| Строка 24: | Строка 25: | ||
Щелочтук металлдар реакцияга активдүү киргендиктен, жаратылышта эркин түрдɵ эмес, туздардын курамында кездешет. Алардын ичинен эң кеңири таралганы NaCl (таш тузу, кайнатма туз, галит) болуп саналат. Ал эми соданы (Na<sub>2</sub>CO<sub>3</sub>) адамдар байыртадан эле билишкен. Калий селитрасы (KNO<sub>3</sub>) мылтыктын дарысынын курамына киргендиктен, адамзаттын тарыхында чоң мааниге ээ болгон. Щелочтук металлдар балкыган хлориддердин же гидроксиддерди электролиздөө жолу менен алынат. | Щелочтук металлдар реакцияга активдүү киргендиктен, жаратылышта эркин түрдɵ эмес, туздардын курамында кездешет. Алардын ичинен эң кеңири таралганы NaCl (таш тузу, кайнатма туз, галит) болуп саналат. Ал эми соданы (Na<sub>2</sub>CO<sub>3</sub>) адамдар байыртадан эле билишкен. Калий селитрасы (KNO<sub>3</sub>) мылтыктын дарысынын курамына киргендиктен, адамзаттын тарыхында чоң мааниге ээ болгон. Щелочтук металлдар балкыган хлориддердин же гидроксиддерди электролиздөө жолу менен алынат. | ||
| − | <div class="blocktext">2NaCl <sup><ins>''Электролиз''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→</span> | + | <div class="blocktext">2NaCl <sup><ins>''Электролиз''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→</span> 2Na + Cl<small>2</small><span style="font-famili:georgia; font-size:1.5em;">↑</span>, 4NaOH <sup><ins>''Электролиз''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→</span> 4Na + 2H<small>2</small>O + O<small>2</small>{{ArrowUp}}</div> |
| − | <div class="show-for-large-up">{{right-p|[[file: | + | <div class="show-for-large-up">{{right-p|[[file:Shelochnye.jpg|250px|Щелочтук металлдар]]}}</div> |
| − | <div class="show-for-small-only">{{center|[[file: | + | <div class="show-for-small-only">{{center|[[file:Shelochnye.jpg|250px|Щелочтук металлдар]]}}</div> |
Бардык щелочтуу металлдар жумшак, тыгыздыгы төмөн болот. Литий (0,53 г/см<sup>3</sup>) жана натрий (0,97 г/см<sup>3</sup>) суудан жеңил болот, суу менен реакцияга киргенде анын үстүндө сүзөт. | Бардык щелочтуу металлдар жумшак, тыгыздыгы төмөн болот. Литий (0,53 г/см<sup>3</sup>) жана натрий (0,97 г/см<sup>3</sup>) суудан жеңил болот, суу менен реакцияга киргенде анын үстүндө сүзөт. | ||
| Строка 38: | Строка 39: | ||
== Щелочтук жер металлдар == | == Щелочтук жер металлдар == | ||
| − | {{center-p|[[file: | + | {{center-p|[[file:Shelochnozemelnye.jpg|600px|Щелочтук жер металлдар: Mg – магний, Ca – кальций, Sr – стронций жана барий – Ba]]}} |
<span class="metall">'''Ca, Sr, Ba, Ra'''</span> металлдарынын гидроксиддери эритмелерде щелочтук касиетке ээ болгондуктан, алар «щелочтук жер металлдар» деп аталат. Ал эми алардын оксиддери кыйынчылык менен эригендиктен «жер» деп аталган оор металлдардын оксиддерине жакындашат. | <span class="metall">'''Ca, Sr, Ba, Ra'''</span> металлдарынын гидроксиддери эритмелерде щелочтук касиетке ээ болгондуктан, алар «щелочтук жер металлдар» деп аталат. Ал эми алардын оксиддери кыйынчылык менен эригендиктен «жер» деп аталган оор металлдардын оксиддерине жакындашат. | ||
| Строка 44: | Строка 45: | ||
<span class="metall">(Mg)</span> – магний, <span class="metall">(Ca)</span> – кальций, <span class="metall">(Sr)</span> – стронций, <span class="metall">(Ba)</span> – барий металлдык касиетке ээ болот. Күмүш сымал ак түстөгү бардык металлдар жылуулукту, электр тогун жакшы өткөрүшөт, алардын тыгыздыгы мезгилдик системада жогортон төмөн карай жогорулайт, ал эми балкып эрүү температурасы төмөндөйт. Алар абадагы кычкылтек менен кычкылданып кетпеши үчүн щелочтуу металлдар сыяктуу эле керосиндин астында сакталат. Жумшак, бычак менен кесилет. Жалынды мүнөздүү түстөргө боёшот. | <span class="metall">(Mg)</span> – магний, <span class="metall">(Ca)</span> – кальций, <span class="metall">(Sr)</span> – стронций, <span class="metall">(Ba)</span> – барий металлдык касиетке ээ болот. Күмүш сымал ак түстөгү бардык металлдар жылуулукту, электр тогун жакшы өткөрүшөт, алардын тыгыздыгы мезгилдик системада жогортон төмөн карай жогорулайт, ал эми балкып эрүү температурасы төмөндөйт. Алар абадагы кычкылтек менен кычкылданып кетпеши үчүн щелочтуу металлдар сыяктуу эле керосиндин астында сакталат. Жумшак, бычак менен кесилет. Жалынды мүнөздүү түстөргө боёшот. | ||
| − | {{center|[[file: | + | {{center|[[file:СтронцийKG.mp4|350px]] [[file:КальцийKG.mp4|350px]]}} |
<div class="blocktext">Металлдар жаратылышта эркин түрдө кездешпейт, алар CaCO<sub>3</sub> • MgCO<sub>3</sub> – доломит, CaCO<sub>3</sub> – бор, акиташ, мрамор, CaSO<sub>4</sub> • 2H<sub>2</sub>O – жаратылыш гипси, Ca<sub>3</sub> (PO<sub>4</sub>)<sub>2</sub> – фосфорит туздарынын курамында кездешет. Кальций жана магний хлориддерди электролиздөө, ал эми стронций жана барий алюминотермиялык жол менен алынат. Бардык металлдардын сырткы энергетикалык деңгээлинде 2ден <big class="elektron" data-title="–">е</big> болот, ошондуктан алар 2 <big class="elektron" data-title="–">е</big> оңой эле берип, күчтүү калыбына келтиргич болуп калат, алардын кычкылдануу даражасы +2 барабар, металлдык касиеттери (ЭМС) жогортон төмөн карай жогорулайт. Щелочтук жер металлдар суутек, кычкылтек, күкүрт жана хлор менен реакцияга кирет, суу менен активдүү реакциялашат.</div> | <div class="blocktext">Металлдар жаратылышта эркин түрдө кездешпейт, алар CaCO<sub>3</sub> • MgCO<sub>3</sub> – доломит, CaCO<sub>3</sub> – бор, акиташ, мрамор, CaSO<sub>4</sub> • 2H<sub>2</sub>O – жаратылыш гипси, Ca<sub>3</sub> (PO<sub>4</sub>)<sub>2</sub> – фосфорит туздарынын курамында кездешет. Кальций жана магний хлориддерди электролиздөө, ал эми стронций жана барий алюминотермиялык жол менен алынат. Бардык металлдардын сырткы энергетикалык деңгээлинде 2ден <big class="elektron" data-title="–">е</big> болот, ошондуктан алар 2 <big class="elektron" data-title="–">е</big> оңой эле берип, күчтүү калыбына келтиргич болуп калат, алардын кычкылдануу даражасы +2 барабар, металлдык касиеттери (ЭМС) жогортон төмөн карай жогорулайт. Щелочтук жер металлдар суутек, кычкылтек, күкүрт жана хлор менен реакцияга кирет, суу менен активдүү реакциялашат.</div> | ||
| − | Кальцийдин оксиди суу менен реакцияга киргенде курулушта | + | Кальцийдин оксиди суу менен реакцияга киргенде курулушта кеңири пайдаланылган өчүрүлгөн акиташ алынат. Щелочтук жер металлдар кальций (Ca<sup>2+</sup>) жана магнийдин (Mg<sup>2+</sup>) катиондорунун сууда болушу суунун шордуулугуна алып келет». '''«Шордуу сууда»''' (Ca<sup>2+</sup>) жана ( Mg<sup>2+</sup>) көп болгондуктан, самын көбүрбөйт, алар жогорку карбон кислоталарынын эрибеген туздарын пайда кылат. Бул учурда чай жакшы демделбейт, эт эзилип кетет. Шордуу суу кебер пайда кылгандыктан, ичтен күйүүчү кыймылдаткычтарды муздатууга жана буу казандарын иштетүүгө жараксыз болуп саналат. Шордуу сууну тамакка колдонуудан бөйрөктө таш пайда болушу мүмкүн. Сууну жумшартуунун заманбап жолу – натрийдин иондорун кальцийдин иондоруна алмаштырууга жɵндɵмдүү болгон чайырларды–катиониттерди колдонуу болуп саналат. |
Кальций – сөөк тканынын жана тиштин негизги компоненти болуп саналат. | Кальций – сөөк тканынын жана тиштин негизги компоненти болуп саналат. | ||
| Строка 54: | Строка 55: | ||
==Алюминий== | ==Алюминий== | ||
| − | {{right|[[file: | + | {{right|[[file:Al.jpg|150px|link=]]}} |
'''Алюминий <span class="metall">(Al)</span> – сырткы электрондук деңгээлинде 3е кармап турган, III валенттүү жана кычкылдануу даражасы '''+3''', терс электрлүүлүгү '''1,5''' барабар болгон III группанын негизги подгруппасынын элементи. Ал амфотердүү, б.а. кислоталык да негиздик да касиетке ээ. Алюминий – жер шарына эң кеңири таралган металл (8,8%). Ал жаратылышта эркин абалында кездешпестен, алюмосиликаттар: Na<sub>2</sub>O • AL<sub>2</sub>O<sub>3</sub> • 2SiO<sub>2</sub> – нефелин, K<sub>2</sub>O • Al<sub>2</sub>O<sub>3</sub> • 6SiO<sub>2</sub> – ортоклаз (талаа шпаты), Al<sub>2</sub>O<sub>3</sub> • 2SiO<sub>2</sub> • 2H<sub>2</sub>O – каолинит (чопо), Al<sub>2</sub>O<sub>3</sub> • nH<sub>2</sub>O – боксит, Al<sub>2</sub>O<sub>3</sub> – корунд (глинозем), Na<sub>3</sub>AlF<sub>6</sub> – криолит түрүндө кездешет. | '''Алюминий <span class="metall">(Al)</span> – сырткы электрондук деңгээлинде 3е кармап турган, III валенттүү жана кычкылдануу даражасы '''+3''', терс электрлүүлүгү '''1,5''' барабар болгон III группанын негизги подгруппасынын элементи. Ал амфотердүү, б.а. кислоталык да негиздик да касиетке ээ. Алюминий – жер шарына эң кеңири таралган металл (8,8%). Ал жаратылышта эркин абалында кездешпестен, алюмосиликаттар: Na<sub>2</sub>O • AL<sub>2</sub>O<sub>3</sub> • 2SiO<sub>2</sub> – нефелин, K<sub>2</sub>O • Al<sub>2</sub>O<sub>3</sub> • 6SiO<sub>2</sub> – ортоклаз (талаа шпаты), Al<sub>2</sub>O<sub>3</sub> • 2SiO<sub>2</sub> • 2H<sub>2</sub>O – каолинит (чопо), Al<sub>2</sub>O<sub>3</sub> • nH<sub>2</sub>O – боксит, Al<sub>2</sub>O<sub>3</sub> – корунд (глинозем), Na<sub>3</sub>AlF<sub>6</sub> – криолит түрүндө кездешет. | ||
| − | {{right-p|[[file:Aljuminij-v-prirode.png|350px|Алюминий | + | {{right-p|[[file:Aljuminij-v-prirode KG.png|350px|class=show-for-large-up|Алюминий жаратылышта]]}} |
| + | {{center-p|[[file:Aljuminij-v-prirode KG.png|class=hide-for-large-up|Алюминий жаратылышта]]}} | ||
'''Башка металлдардын туздары менен боёлгон корунддар баалуу таш катары эсептелет. Аларга сапфирлер, рубиндер кирет.''' | '''Башка металлдардын туздары менен боёлгон корунддар баалуу таш катары эсептелет. Аларга сапфирлер, рубиндер кирет.''' | ||
| Строка 65: | Строка 67: | ||
<div class="blocktext">2Al<sub>2</sub>O<sub>3</sub> <sup><ins>'''''Электролиз, t=950, Na3AlF6'''''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→</span> 4Al+ 3O<sub>2</sub><span style="font-famili:georgia; font-size:1.5em;">↑</span> | <div class="blocktext">2Al<sub>2</sub>O<sub>3</sub> <sup><ins>'''''Электролиз, t=950, Na3AlF6'''''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→</span> 4Al+ 3O<sub>2</sub><span style="font-famili:georgia; font-size:1.5em;">↑</span> | ||
</div> | </div> | ||
| − | {{left|[[file: | + | {{left|[[file:АллюминийKG.mp4|300px]]}} |
| − | Алюминий калыңдыгы 5–10 нм болгон оксид пленкасы Al<sub>2</sub>O менен капталып калат, ал абдан бекем болгондуктан алюминийди андан аркы кычкылдануудан сактайт. Ошондуктан, алюминий суу менен реакцияга кирбейт. Алюминийдин амальгамасы (сымап менен болгон куймасы) оксид пленкасынан ажыратылгандан кийин кычкылтек, суутек, хлор, күкүрт жана көмүртек, ал түгүл суу менен да реакцияга кирет. | + | Алюминий калыңдыгы 5–10 нм болгон оксид пленкасы Al<sub>2</sub>O<sub>3</sub> менен капталып калат, ал абдан бекем болгондуктан алюминийди андан аркы кычкылдануудан сактайт. Ошондуктан, алюминий суу менен реакцияга кирбейт. Алюминийдин амальгамасы (сымап менен болгон куймасы) оксид пленкасынан ажыратылгандан кийин кычкылтек, суутек, хлор, күкүрт жана көмүртек, ал түгүл суу менен да реакцияга кирет. |
Амфотердик металл катары алюминий щелочтор менен реакцияга кирет да | Амфотердик металл катары алюминий щелочтор менен реакцияга кирет да | ||
| Строка 72: | Строка 74: | ||
<div style="text-align:center;"> 2Al + 2NaOH + 2H<sub>2</sub>O = 2NaAlO<sub>2</sub> + 3Н<sub>2</sub><span style="font-famili:georgia; font-size:1.5em;">↑</span>,</div> | <div style="text-align:center;"> 2Al + 2NaOH + 2H<sub>2</sub>O = 2NaAlO<sub>2</sub> + 3Н<sub>2</sub><span style="font-famili:georgia; font-size:1.5em;">↑</span>,</div> | ||
| − | + | натрий метаалюминатын пайда кылат. | |
| − | Башка заттар менен реакциялашып, AlH<sub>3</sub> – ''' | + | Башка заттар менен реакциялашып, AlH<sub>3</sub> – '''алюминий гидридин''', Al<sub>2</sub>O<sub>3</sub> – '''алюминий оксидин''', Al(OH)<sub>3</sub> – '''алюминий гидроксидин''' пайда кылат. |
| − | Өзгɵчɵ | + | Өзгɵчɵ алюминий куймалары – дюралюмин (Al + 5%Cu + 2%Mg), силумин (Al + Si), «Термит» – оксид менен (Fe<sub>3</sub>O<sub>4</sub>) алюминий порошогунун аралашмасы өтө баалуу, алар авиа жана машина курууда, кеме курууда кеңири колдонулат. Куймаларды иштетүүдɵ кɵп ɵлчɵмдɵгү жылуулук бөлүнүп чыккандыктан, алар металлдарды термиттик ширетүүдɵ пайдаланылат. |
8Al +3Fe<sub>3</sub>O<sub>4</sub> = 4Al<sub>2</sub>O<sub>3</sub> + 9Fe + ΔH 853,5 кДж/моль | 8Al +3Fe<sub>3</sub>O<sub>4</sub> = 4Al<sub>2</sub>O<sub>3</sub> + 9Fe + ΔH 853,5 кДж/моль | ||
| Строка 84: | Строка 86: | ||
<ul class="small-block-grid-1 large-block-grid-2"> | <ul class="small-block-grid-1 large-block-grid-2"> | ||
<li>Темир химиялык элементтердин ичинен жер шарында таралышы боюнча ( массалык үлүшү 4,7–6,0%) төртүнчү орунда жана металлдардын арасынан алюминийден кийинки экинчи орунда турат. Темир байыртадан бери эле белгилүү болгон элементтердин катарына кирет. Алгачкы жолу темирди Египетте, биздин заманга чейин 2чи миң жылдыкта Месопотамияда, андан соң Закавказьеде, Кичи Азияда жана байыркы Грецияда колдонушкан. Уюган темир – метеориттен алынган ɵтɵ сейрек кездешүүчү зат.</li> | <li>Темир химиялык элементтердин ичинен жер шарында таралышы боюнча ( массалык үлүшү 4,7–6,0%) төртүнчү орунда жана металлдардын арасынан алюминийден кийинки экинчи орунда турат. Темир байыртадан бери эле белгилүү болгон элементтердин катарына кирет. Алгачкы жолу темирди Египетте, биздин заманга чейин 2чи миң жылдыкта Месопотамияда, андан соң Закавказьеде, Кичи Азияда жана байыркы Грецияда колдонушкан. Уюган темир – метеориттен алынган ɵтɵ сейрек кездешүүчү зат.</li> | ||
| − | <li>{{center-p|[[file: | + | <li>{{center-p|[[file:Meteorit.png|300px|Уюган темир]]}}</li> |
| + | <li>{{center|[[file:Rolik-5.mp4]]}}</li> | ||
| + | <li>{{center-p|[[file:Fe.jpg|300px|Болот куюлуучу цех]]}}</li> | ||
</ul> | </ul> | ||
| − | |||
Темир жаратылышта бирикмелердин, тоо кендеринин курамында жана тирүү организмдерде кездешет. | Темир жаратылышта бирикмелердин, тоо кендеринин курамында жана тирүү организмдерде кездешет. | ||
| Строка 93: | Строка 96: | ||
Темир – күмүш түстүү – ак, согууга элпек, башкаларга салыштырмалуу жумшак металл, балкып эрүү температурасы 1539 <sup>о</sup>С, 20 <sup>о</sup>С тыгыздыгы 7,87 г/см<sup>3</sup>. барабар, 768 <sup>о</sup>С тɵмɵн болгондо темир ферромагниттүү, ширетүүгɵ, согууга, калыпка келтирүүгɵ ыңгайлуу болот. '''+2, +3, +6''' кычкылдануу даражаларын кɵрсɵтɵт. Нымдуу абада темир кычкылданат (дат басат) да, Fe<sup>+2</sup> жана Fe<sup>+3</sup> бирикмелерин пайда кылат. Темир амфотердүү металл. | Темир – күмүш түстүү – ак, согууга элпек, башкаларга салыштырмалуу жумшак металл, балкып эрүү температурасы 1539 <sup>о</sup>С, 20 <sup>о</sup>С тыгыздыгы 7,87 г/см<sup>3</sup>. барабар, 768 <sup>о</sup>С тɵмɵн болгондо темир ферромагниттүү, ширетүүгɵ, согууга, калыпка келтирүүгɵ ыңгайлуу болот. '''+2, +3, +6''' кычкылдануу даражаларын кɵрсɵтɵт. Нымдуу абада темир кычкылданат (дат басат) да, Fe<sup>+2</sup> жана Fe<sup>+3</sup> бирикмелерин пайда кылат. Темир амфотердүү металл. | ||
| − | {{left|[[file:P8 1.png|300px|link=]]}} | + | {{left|[[file:P8 1 KG.png|class=show-for-large-up|300px|link=]]}} |
| + | {{center-p|[[file:P8 1 KG.png|class=hide-for-large-up|link=]]}} | ||
Суюлтулган кислоталар менен аракеттенишкенде темир кычкылдануу даражасы '''+2''' барабар болгон бирикмелерди пайда кылат, ал эми концентрацияланган азот кислотасы менен реакцияга киргенде темирдин активдүүлүгү тɵмɵндɵтɵйт. Металл эместерден кычкылтек, хлор жана күкүрт менен аракеттенишет. | Суюлтулган кислоталар менен аракеттенишкенде темир кычкылдануу даражасы '''+2''' барабар болгон бирикмелерди пайда кылат, ал эми концентрацияланган азот кислотасы менен реакцияга киргенде темирдин активдүүлүгү тɵмɵндɵтɵйт. Металл эместерден кычкылтек, хлор жана күкүрт менен аракеттенишет. | ||
| − | Темирди аныктоо үчүн мүнɵздүү түстү берген реактивдер колдонулат, Fe<sup>2</sup> – берлин лазурунун изумруд сымал (ачык жашыл түс) түсүн берсе, Fe<sup>3</sup> – кɵк түстү берет. | + | Темирди аныктоо үчүн мүнɵздүү түстү берген реактивдер колдонулат, Fe<sup>+2</sup> – берлин лазурунун изумруд сымал (ачык жашыл түс) түсүн берсе, Fe<sup>+3</sup> – кɵк түстү берет. |
Темир жана анын куймалары кара металлдарга кирет. Темирдин куймалары катары – курамында 2% кɵп кɵмүртек болгон ''чоюн'' жана 0,02 – 2.0% чейинки кɵмүртекти кармап турган болотту атоого болот. Мындан сырткары курамында Mn, Si, S, P ж.б. элементтердин аралашмасы болгон болоттун түрлɵрү да бар. Бул элементтер болоттун коррозиялык касиетин күчɵтɵт. Темирди балкытып эритүү процесси кɵмүртектин жана ис газынын атайын мештерде – домналарда темирди анын оксиддеринен калыбына келтирүүсүнɵ негизделген. | Темир жана анын куймалары кара металлдарга кирет. Темирдин куймалары катары – курамында 2% кɵп кɵмүртек болгон ''чоюн'' жана 0,02 – 2.0% чейинки кɵмүртекти кармап турган болотту атоого болот. Мындан сырткары курамында Mn, Si, S, P ж.б. элементтердин аралашмасы болгон болоттун түрлɵрү да бар. Бул элементтер болоттун коррозиялык касиетин күчɵтɵт. Темирди балкытып эритүү процесси кɵмүртектин жана ис газынын атайын мештерде – домналарда темирди анын оксиддеринен калыбына келтирүүсүнɵ негизделген. | ||
| Строка 102: | Строка 106: | ||
<br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| − | == Пайдалуу | + | == Пайдалуу шилтемелер == |
| − | {{bib| | + | {{bib|YouTubeдагы [https://www.youtube.com/channel/UCjAmQ-4NL3UZX0W_nmjn4_w '''Thoisoi'''] каналынан ɵзгɵчɵ эксперименттерди жана химиялык элементтер жɵнүндɵ кызыктуу маалыматтарды ала аласыңар}} |
==Глоссарий== | ==Глоссарий== | ||
:{{bib|'''Аквакомплекстер''' – курамында суунун молекуласын алып жүргɵн комплекстер же кристаллогидраттар.}} | :{{bib|'''Аквакомплекстер''' – курамында суунун молекуласын алып жүргɵн комплекстер же кристаллогидраттар.}} | ||
:{{bib|'''«Алкалдар» араб тилинен''' – «күл», «щелочь» деп которулат.}} | :{{bib|'''«Алкалдар» араб тилинен''' – «күл», «щелочь» деп которулат.}} | ||
:{{bib|'''Алюминотермия''' – металлдык алюминий менен алардын оксиддерин калыбына келтирүү аркылуу металлдарды жана металл эместерди алуунун жолу.}} | :{{bib|'''Алюминотермия''' – металлдык алюминий менен алардын оксиддерин калыбына келтирүү аркылуу металлдарды жана металл эместерди алуунун жолу.}} | ||
| − | :{{bib|'''Амфотердүүлүк''' – кислоталык да, щелочтук да касиеттин | + | :{{bib|'''Амфотердүүлүк''' – кислоталык да, щелочтук да касиеттин болушу.}} |
:{{bib|'''Асыл металлдар''' – алтын, платина, күмүш, рутений, родий, палладий, осмий, иридий.}} | :{{bib|'''Асыл металлдар''' – алтын, платина, күмүш, рутений, родий, палладий, осмий, иридий.}} | ||
| − | :{{bib|'''Гидроксиддер''' – курамында гидроксил тобун алып жүргɵн органикалык эмес бирикмелер | + | :{{bib|'''Гидроксиддер''' – курамында гидроксил тобун алып жүргɵн органикалык эмес бирикмелер.}} |
| − | :{{bib|'''Интерметаллиддер''' – курамдын туруктуулук законуна баш ийбеген | + | :{{bib|'''Интерметаллиддер''' – курамдын туруктуулук законуна баш ийбеген металлдар, алардын химиялык бирикмелери.}} |
:{{bib|'''Согууга элпектик''' – балка менен согуу аркылуу форма берүү, ысытууда күчɵйт.}} | :{{bib|'''Согууга элпектик''' – балка менен согуу аркылуу форма берүү, ысытууда күчɵйт.}} | ||
:{{bib|'''Кокс''' – абаны катыштырбай кɵмүрдү ысытуу менен алынган катуу зат. Чоюнду балкытып эритүүдɵ колдонулат.}} | :{{bib|'''Кокс''' – абаны катыштырбай кɵмүрдү ысытуу менен алынган катуу зат. Чоюнду балкытып эритүүдɵ колдонулат.}} | ||
:{{bib|'''Металлдардын коррозиясы''' – сырткы чɵйрɵнүн таасири астында металлдардын бузулуусу.}} | :{{bib|'''Металлдардын коррозиясы''' – сырткы чɵйрɵнүн таасири астында металлдардын бузулуусу.}} | ||
| − | :{{bib|'''Металлдар''' – ɵзгɵчɵ жалтырактыкка ээ болгон, | + | :{{bib|'''Металлдар''' – ɵзгɵчɵ жалтырактыкка ээ болгон, согууга элпек, электр тогун жана жылуулукту жакшы ɵткɵргɵн, сырткы деңгээлинде 1,2,3 электронду кармап жүргɵн жɵнɵкɵй заттар жана куймалар.}} |
:{{bib|'''Магниттүүлүк''' – магнитке тартылуу.}} | :{{bib|'''Магниттүүлүк''' – магнитке тартылуу.}} | ||
:{{bib|'''Металл эместер''' – металлдарга мүнɵздүү касиетке ээ болбогон жɵнɵкɵй заттар.}} | :{{bib|'''Металл эместер''' – металлдарга мүнɵздүү касиетке ээ болбогон жɵнɵкɵй заттар.}} | ||
| Строка 125: | Строка 129: | ||
:{{bib|'''Тыгыздык''' –массанын кɵлɵмгɵ болгон катышы.}} | :{{bib|'''Тыгыздык''' –массанын кɵлɵмгɵ болгон катышы.}} | ||
:{{bib|'''Прокатка''' – белгилүү бир форманы берүү үчүн айланып туруучу валлдардын ортосунда ɵзгɵчɵ станоктордо басым астында кысуу менен металлдарды ысык абалында иштетүү.}} | :{{bib|'''Прокатка''' – белгилүү бир форманы берүү үчүн айланып туруучу валлдардын ортосунда ɵзгɵчɵ станоктордо басым астында кысуу менен металлдарды ысык абалында иштетүү.}} | ||
| − | :{{bib|'''Реакциялашууга жɵндɵмдүү''' – молекулалардын, атомдордун, иондордун | + | :{{bib|'''Реакциялашууга жɵндɵмдүү''' – молекулалардын, атомдордун, иондордун активдүүлүгүнүн мүнɵздɵмɵсү.}} |
:{{bib|'''Жылуулук ɵткɵргүчтүк''' – нерсенин жылуулук ɵткɵрүү касиети.}} | :{{bib|'''Жылуулук ɵткɵргүчтүк''' – нерсенин жылуулук ɵткɵрүү касиети.}} | ||
:{{bib|'''Ширетүү''' – ортолорун балкып эриген металл менен бириктирүү.}} | :{{bib|'''Ширетүү''' – ортолорун балкып эриген металл менен бириктирүү.}} | ||
| Строка 137: | Строка 141: | ||
== Библиография == | == Библиография == | ||
| − | ==== | + | ==== Справочниктер ==== |
* {{bib|Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.}} | * {{bib|Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.}} | ||
* {{bib|Р.А. Лидин Справочник по общей и неорганической химии. М. «Просвещение» 1997г.}} | * {{bib|Р.А. Лидин Справочник по общей и неорганической химии. М. «Просвещение» 1997г.}} | ||
| Строка 147: | Строка 151: | ||
* {{bib|«Что такое. Кто такой». Изд. «Педагогика» М. 1990 г.}} | * {{bib|«Что такое. Кто такой». Изд. «Педагогика» М. 1990 г.}} | ||
* {{bib|«Энциклопедия для детей». Химия т. 17 Изд. дом «Аванта».2000г.}} | * {{bib|«Энциклопедия для детей». Химия т. 17 Изд. дом «Аванта».2000г.}} | ||
| − | ==== | + | ==== Китептер ==== |
* {{bib|В.А.Волков, Е.В. Вонский, Г.И. Кузнецова. «Выдающиеся химики мира», М. «Высшая школа», 1991 г.}} | * {{bib|В.А.Волков, Е.В. Вонский, Г.И. Кузнецова. «Выдающиеся химики мира», М. «Высшая школа», 1991 г.}} | ||
* {{bib|В.А.Крицман «Книга для чтения по неорганической химии», М. «Просвещение», 1974 г.}} | * {{bib|В.А.Крицман «Книга для чтения по неорганической химии», М. «Просвещение», 1974 г.}} | ||
| Строка 160: | Строка 164: | ||
* {{bib|«Я познаю мир». Детская энциклопедия. Химия. М. АСТ 1995 г.}} | * {{bib|«Я познаю мир». Детская энциклопедия. Химия. М. АСТ 1995 г.}} | ||
| − | ==== | + | ==== Окуу колдонмолору ==== |
* {{bib|Химия. Пособие-репетитор для поступающих в вузы. Ред. В.Н. Чернышов, А.С.Егоров, Ростов-на-Дону, «Феникс»,1997г.}} | * {{bib|Химия. Пособие-репетитор для поступающих в вузы. Ред. В.Н. Чернышов, А.С.Егоров, Ростов-на-Дону, «Феникс»,1997г.}} | ||
| − | ==== | + | ==== Усулдук колдонмолор ==== |
* {{bib|М.В. Горский. Обучение основам общей химии. М. «Просвещение», 1991 г.}} | * {{bib|М.В. Горский. Обучение основам общей химии. М. «Просвещение», 1991 г.}} | ||
</div> | </div> | ||
| Строка 177: | Строка 181: | ||
Ал адамдын организмине кɵңүл кɵтɵрүүчү газдын мас кылуучу таасирин далилдей алган. | Ал адамдын организмине кɵңүл кɵтɵрүүчү газдын мас кылуучу таасирин далилдей алган. | ||
| − | {{center-p|[[файл: | + | {{center-p|[[файл:Gemfi devi.jpg|220px|Гемфри Дэви Томаса Филлипс тарткан портрети]]}} |
| − | Ойлоп табылгандардын ичинен метанды жардырууда колдонулган коопсуз шахтерлордун лампасын белгилеп кетсек болот. Ал кɵптɵгɵн жылдар бою шахталарда | + | Ойлоп табылгандардын ичинен метанды жардырууда колдонулган коопсуз шахтерлордун лампасын белгилеп кетсек болот. Ал кɵптɵгɵн жылдар бою шахталарда электр жарыгын колдонгонго чейин пайдаланылган. |
Дэви Бристолдогу Пневматикалык институтта иштеген жана ал орто билимдүү гана болсо да, 1802–жылы Королдук институттун профессору болуп калган. | Дэви Бристолдогу Пневматикалык институтта иштеген жана ал орто билимдүү гана болсо да, 1802–жылы Королдук институттун профессору болуп калган. | ||
| Строка 186: | Строка 190: | ||
1826–жылы Дэви апоплексия оорусунан жабыркаган (мээге кан куюлуп, шал ооруусунун пайда болушу). 1829–жылдын 29–майында Европадан Англияга бара жатканда Дэви экинчи жолу бул оору менен ооругандыктан, элүү бир жашында Женевада кɵз жумган. | 1826–жылы Дэви апоплексия оорусунан жабыркаган (мээге кан куюлуп, шал ооруусунун пайда болушу). 1829–жылдын 29–майында Европадан Англияга бара жатканда Дэви экинчи жолу бул оору менен ооругандыктан, элүү бир жашында Женевада кɵз жумган. | ||
| − | Лондондогу Вестминстер аббатствосунда Англиянын белгилүү адамдары коюлган жерге | + | Лондондогу Вестминстер аббатствосунда Англиянын белгилүү адамдары коюлган жерге кɵмүлгɵн. Анын урматына Лондондогу Королдук коомчулук окумуштуулар үчүн сыйлык–Дэви медалын тапшырышкан. |
</div> | </div> | ||
<div class="sbstyle" style="margin-top:20px;"> | <div class="sbstyle" style="margin-top:20px;"> | ||
| Строка 219: | Строка 223: | ||
{{step |symb=4 }}Адамдын организминде ар бир секундада ɵзүнɵ 0,003 грамм калийди кармап турган калийдин радиоактивдүу изотобунун 5000 атому ажырап турат. | {{step |symb=4 }}Адамдын организминде ар бир секундада ɵзүнɵ 0,003 грамм калийди кармап турган калийдин радиоактивдүу изотобунун 5000 атому ажырап турат. | ||
| − | |||
| − | |||
{{step |symb=5 }}76% калийдин жана 24% натрийдин куймасы суюк абалда болот, минус 12 градус Цельсиядада катууланат. | {{step |symb=5 }}76% калийдин жана 24% натрийдин куймасы суюк абалда болот, минус 12 градус Цельсиядада катууланат. | ||
</div> | </div> | ||
| − | + | <div class="sbstyle" style="margin-top:20px;"> | |
| − | <div class=sbstyle" style="margin-top:20px;"> | ||
<div class="row"> | <div class="row"> | ||
<div class="large-10 small-10 large-centered small-centered columns rubric">Лайфхак</div> | <div class="large-10 small-10 large-centered small-centered columns rubric">Лайфхак</div> | ||
</div> | </div> | ||
<br />Бул видеодон силер жумуртканы кантип отсуз бышырууга боло тургандыгын кɵрɵ аласыңар. | <br />Бул видеодон силер жумуртканы кантип отсуз бышырууга боло тургандыгын кɵрɵ аласыңар. | ||
| − | {{center|[[file: | + | {{center|[[file:Как сварить яйцоKG.mp4|280px]]}} |
| + | </div> | ||
| + | |||
| + | <div class="sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="margin-top:20px">Тестти</div> | ||
| + | </div> | ||
| + | |||
</div> | </div> | ||
</div> | </div> | ||
{{lang|Химия: Металлы}} | {{lang|Химия: Металлы}} | ||
Текущая версия на 09:40, 22 октября 2018
Содержание
Металлдардын жалпы касиеттери
Сырткы энергетикалык деңгээлинде 1, 2 же 3 электрону бар элементтер металлдарга кирет. (Суутектен, гелийден жана бордон башкасы. Металлдар элементтердин мезгилдик системасында негизги жана кошумча подгруппаларда жайгашкан). Аларга жылуулук жана электр өткөргүчтүк, согууга элпектик, ийилгичтик жана зымдай созулуу касиеттери таандык .Бардык металлдар кадимки температурада сымаптан башкасы катуу абалда болот, металлдык жалтырактыкка ээ жана алтындай сары, күмүш сымал-боз түстө, ал түгүл көгүш түстɵргɵ боелуп, кубулуп турат.
Бул касиеттер металлдардын атомунун түзүлүшүнө жана түйүндөрүндө нейтралдык атомдор менен бирге оң заряддалган иондор жайгашкан кристаллдык торчолордун жаратылышына да байланыштуу болот. Ал эми электрондор (электрондук газ) түйүн аралык мейкиндикте жайгашат. Типтүү металлдар-калыбына келтиргичтер, бирок алар амфотердик касиеттерге (металлдык да металл эместик да касиети) да ээ болот. Металлдар касиеттери боюнча бир нече топторго биригишет: щелочтук металлдар (), щелочтук жер металлдар (), түстүү металлдар (), кара металл–Fe жана анын куймалары), асыл металлдар (), жеңил металлдар – тыгыздыгы 5 г/см3 төмөн жана оор металлдар – тыгыздыгы 5 г/см3 жогору болгон. Металлдардын тыгыздыгы 0,53 г/см3 болгон литийден 22, 7 г/см3 болгон осмийге чейинки мааниге ээ болот.
Бир нече металлдардын жана металл эместердин аралашмасынан турган куймаларда металлдардын жеке касиеттери толугу менен өзгөрүп кетет. Алар катуу эритмелер, интерметаллиддер жана механикалык аралашмалар болушу мүмкүн. Куймалар бекем болот, кыйынчылык менен эрийт, алардын балкып эрүү температурасы кескин төмөндɵйт, кислотага, щелочко туруктуу болуу менен жаңы касиеттерге ээ болот.
Щелочтук металлдар
металлдары суу менен аракеттенишип, щелочторду–сууда эрүүчү негиздерди пайда кылгандыгы үчүн щелочтуу металлдар деп аталат. Бардык щелочтуу металлдардын S –электрондук катмарында 1е толот, ошондуктан калыбына келтиргичтер катары металлдык касиеттерди алып жүрɵт, кычкылдануу даражасы +1 барабар, I валенттүү болот. Балкып эрүү температурасы төмөн (tбал) болот, мисалы, цезий адамдын колунун жылуулугунан эле балкып эрийт.
Бул металлдардын туздары жалынды мүнөздүү ар түрдүү түстөргө боёшот: литий – ачык кызыл, натрий–кызгылт сары, калий – кочкул, рубидий–кызыл, цезий – көгүш түскө.
Франций – туруксуз изотобу бар радиоактивдүү элемент.
Щелочтук металлдар реакцияга активдүү киргендиктен, жаратылышта эркин түрдɵ эмес, туздардын курамында кездешет. Алардын ичинен эң кеңири таралганы NaCl (таш тузу, кайнатма туз, галит) болуп саналат. Ал эми соданы (Na2CO3) адамдар байыртадан эле билишкен. Калий селитрасы (KNO3) мылтыктын дарысынын курамына киргендиктен, адамзаттын тарыхында чоң мааниге ээ болгон. Щелочтук металлдар балкыган хлориддердин же гидроксиддерди электролиздөө жолу менен алынат.
Бардык щелочтуу металлдар жумшак, тыгыздыгы төмөн болот. Литий (0,53 г/см3) жана натрий (0,97 г/см3) суудан жеңил болот, суу менен реакцияга киргенде анын үстүндө сүзөт.
Бардык металлдар күмүш сымал ак түстө болушат, электр тогун жана жылуулукту жакшы өткөрүшөт. Жумшак, бычак менен кесүүгө болот.
Щелочтуу металлдар башка заттар менен реакцияга кубаттуу киргендиктен, аларды керосиндин астында сакташат.
Суутек, күкүрт, көмүртек жана хлор менен реакцияга кирет. Калий жана натрий кычкылтек менен реакциялашканда өтө кычкылды (Na2O2), суу менен реакцияга киргенде гидроксиддер–щелочторду (LiOH, NaOH, KOH) пайда кылат.
Щелочтук жер металлдар
металлдарынын гидроксиддери эритмелерде щелочтук касиетке ээ болгондуктан, алар «щелочтук жер металлдар» деп аталат. Ал эми алардын оксиддери кыйынчылык менен эригендиктен «жер» деп аталган оор металлдардын оксиддерине жакындашат.
– магний, – кальций, – стронций, – барий металлдык касиетке ээ болот. Күмүш сымал ак түстөгү бардык металлдар жылуулукту, электр тогун жакшы өткөрүшөт, алардын тыгыздыгы мезгилдик системада жогортон төмөн карай жогорулайт, ал эми балкып эрүү температурасы төмөндөйт. Алар абадагы кычкылтек менен кычкылданып кетпеши үчүн щелочтуу металлдар сыяктуу эле керосиндин астында сакталат. Жумшак, бычак менен кесилет. Жалынды мүнөздүү түстөргө боёшот.
Кальцийдин оксиди суу менен реакцияга киргенде курулушта кеңири пайдаланылган өчүрүлгөн акиташ алынат. Щелочтук жер металлдар кальций (Ca2+) жана магнийдин (Mg2+) катиондорунун сууда болушу суунун шордуулугуна алып келет». «Шордуу сууда» (Ca2+) жана ( Mg2+) көп болгондуктан, самын көбүрбөйт, алар жогорку карбон кислоталарынын эрибеген туздарын пайда кылат. Бул учурда чай жакшы демделбейт, эт эзилип кетет. Шордуу суу кебер пайда кылгандыктан, ичтен күйүүчү кыймылдаткычтарды муздатууга жана буу казандарын иштетүүгө жараксыз болуп саналат. Шордуу сууну тамакка колдонуудан бөйрөктө таш пайда болушу мүмкүн. Сууну жумшартуунун заманбап жолу – натрийдин иондорун кальцийдин иондоруна алмаштырууга жɵндɵмдүү болгон чайырларды–катиониттерди колдонуу болуп саналат.
Кальций – сөөк тканынын жана тиштин негизги компоненти болуп саналат.
Алюминий

Алюминий – сырткы электрондук деңгээлинде 3е кармап турган, III валенттүү жана кычкылдануу даражасы +3, терс электрлүүлүгү 1,5 барабар болгон III группанын негизги подгруппасынын элементи. Ал амфотердүү, б.а. кислоталык да негиздик да касиетке ээ. Алюминий – жер шарына эң кеңири таралган металл (8,8%). Ал жаратылышта эркин абалында кездешпестен, алюмосиликаттар: Na2O • AL2O3 • 2SiO2 – нефелин, K2O • Al2O3 • 6SiO2 – ортоклаз (талаа шпаты), Al2O3 • 2SiO2 • 2H2O – каолинит (чопо), Al2O3 • nH2O – боксит, Al2O3 – корунд (глинозем), Na3AlF6 – криолит түрүндө кездешет.
Башка металлдардын туздары менен боёлгон корунддар баалуу таш катары эсептелет. Аларга сапфирлер, рубиндер кирет.
Алюминий электр тогун жана жылуулукту жакшы ɵткɵргɵн, күмүш сымал ак түстɵгү жеңил металл. Балкып эрүү температурасы + 660оС барабар.
Алюминий криолиттин балкымасынан Al2O3 электролиздɵɵ аркылуу алынат.
Алюминий калыңдыгы 5–10 нм болгон оксид пленкасы Al2O3 менен капталып калат, ал абдан бекем болгондуктан алюминийди андан аркы кычкылдануудан сактайт. Ошондуктан, алюминий суу менен реакцияга кирбейт. Алюминийдин амальгамасы (сымап менен болгон куймасы) оксид пленкасынан ажыратылгандан кийин кычкылтек, суутек, хлор, күкүрт жана көмүртек, ал түгүл суу менен да реакцияга кирет.
Амфотердик металл катары алюминий щелочтор менен реакцияга кирет да
натрий метаалюминатын пайда кылат.
Башка заттар менен реакциялашып, AlH3 – алюминий гидридин, Al2O3 – алюминий оксидин, Al(OH)3 – алюминий гидроксидин пайда кылат.
Өзгɵчɵ алюминий куймалары – дюралюмин (Al + 5%Cu + 2%Mg), силумин (Al + Si), «Термит» – оксид менен (Fe3O4) алюминий порошогунун аралашмасы өтө баалуу, алар авиа жана машина курууда, кеме курууда кеңири колдонулат. Куймаларды иштетүүдɵ кɵп ɵлчɵмдɵгү жылуулук бөлүнүп чыккандыктан, алар металлдарды термиттик ширетүүдɵ пайдаланылат.
8Al +3Fe3O4 = 4Al2O3 + 9Fe + ΔH 853,5 кДж/моль
Темир
- Темир химиялык элементтердин ичинен жер шарында таралышы боюнча ( массалык үлүшү 4,7–6,0%) төртүнчү орунда жана металлдардын арасынан алюминийден кийинки экинчи орунда турат. Темир байыртадан бери эле белгилүү болгон элементтердин катарына кирет. Алгачкы жолу темирди Египетте, биздин заманга чейин 2чи миң жылдыкта Месопотамияда, андан соң Закавказьеде, Кичи Азияда жана байыркы Грецияда колдонушкан. Уюган темир – метеориттен алынган ɵтɵ сейрек кездешүүчү зат.
Темир жаратылышта бирикмелердин, тоо кендеринин курамында жана тирүү организмдерде кездешет.
Fe2O3 • 3H2O – күрɵң түстүү железняк, лимонит; Fe2O3 – кызыл темир, гематит; Fe3O4 – магниттик темир, магнетит; FeS2 – темир колчеданы, пирит.
Темир – күмүш түстүү – ак, согууга элпек, башкаларга салыштырмалуу жумшак металл, балкып эрүү температурасы 1539 оС, 20 оС тыгыздыгы 7,87 г/см3. барабар, 768 оС тɵмɵн болгондо темир ферромагниттүү, ширетүүгɵ, согууга, калыпка келтирүүгɵ ыңгайлуу болот. +2, +3, +6 кычкылдануу даражаларын кɵрсɵтɵт. Нымдуу абада темир кычкылданат (дат басат) да, Fe+2 жана Fe+3 бирикмелерин пайда кылат. Темир амфотердүү металл.
Суюлтулган кислоталар менен аракеттенишкенде темир кычкылдануу даражасы +2 барабар болгон бирикмелерди пайда кылат, ал эми концентрацияланган азот кислотасы менен реакцияга киргенде темирдин активдүүлүгү тɵмɵндɵтɵйт. Металл эместерден кычкылтек, хлор жана күкүрт менен аракеттенишет.
Темирди аныктоо үчүн мүнɵздүү түстү берген реактивдер колдонулат, Fe+2 – берлин лазурунун изумруд сымал (ачык жашыл түс) түсүн берсе, Fe+3 – кɵк түстү берет.
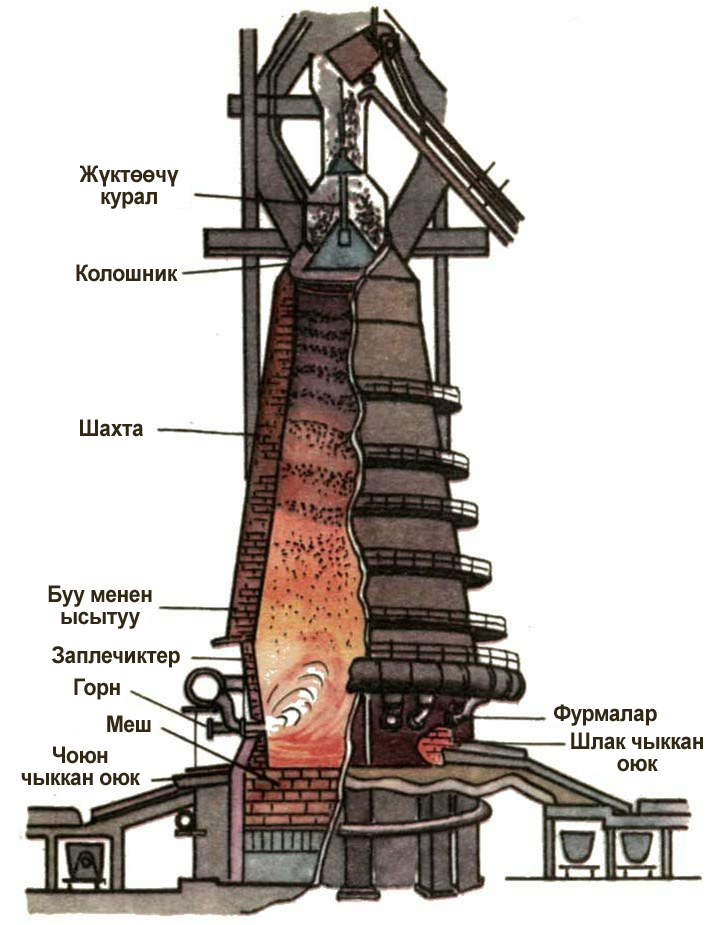
Темир жана анын куймалары кара металлдарга кирет. Темирдин куймалары катары – курамында 2% кɵп кɵмүртек болгон чоюн жана 0,02 – 2.0% чейинки кɵмүртекти кармап турган болотту атоого болот. Мындан сырткары курамында Mn, Si, S, P ж.б. элементтердин аралашмасы болгон болоттун түрлɵрү да бар. Бул элементтер болоттун коррозиялык касиетин күчɵтɵт. Темирди балкытып эритүү процесси кɵмүртектин жана ис газынын атайын мештерде – домналарда темирди анын оксиддеринен калыбына келтирүүсүнɵ негизделген.
Пайдалуу шилтемелер
Глоссарий
- Аквакомплекстер – курамында суунун молекуласын алып жүргɵн комплекстер же кристаллогидраттар.
- «Алкалдар» араб тилинен – «күл», «щелочь» деп которулат.
- Алюминотермия – металлдык алюминий менен алардын оксиддерин калыбына келтирүү аркылуу металлдарды жана металл эместерди алуунун жолу.
- Амфотердүүлүк – кислоталык да, щелочтук да касиеттин болушу.
- Асыл металлдар – алтын, платина, күмүш, рутений, родий, палладий, осмий, иридий.
- Гидроксиддер – курамында гидроксил тобун алып жүргɵн органикалык эмес бирикмелер.
- Интерметаллиддер – курамдын туруктуулук законуна баш ийбеген металлдар, алардын химиялык бирикмелери.
- Согууга элпектик – балка менен согуу аркылуу форма берүү, ысытууда күчɵйт.
- Кокс – абаны катыштырбай кɵмүрдү ысытуу менен алынган катуу зат. Чоюнду балкытып эритүүдɵ колдонулат.
- Металлдардын коррозиясы – сырткы чɵйрɵнүн таасири астында металлдардын бузулуусу.
- Металлдар – ɵзгɵчɵ жалтырактыкка ээ болгон, согууга элпек, электр тогун жана жылуулукту жакшы ɵткɵргɵн, сырткы деңгээлинде 1,2,3 электронду кармап жүргɵн жɵнɵкɵй заттар жана куймалар.
- Магниттүүлүк – магнитке тартылуу.
- Металл эместер – металлдарга мүнɵздүү касиетке ээ болбогон жɵнɵкɵй заттар.
- Негиздер – молекуласы металлдардын атомунан жана бир же бир нече гидроксил тобунан турган заттар.
- Опал – сүттɵй ак түс ( башка түстөр да коштоп турат).
- Металлдардын активдүүлүгүн тɵмɵндɵтүү (пассивдештирүү) – кычкылдандыргычтын таасири астында металлдын сырткы катмарында коргоочу катмардын пайда болууусу.
- Ийилгичтик – кадимки жана жогорку температурада басым астында талкаланбастан туруп, калыбын ɵзгɵртүү жɵндɵмдүүлүгү.
- Өтɵ кычкылдар – кычкылтектин атомдору бири–бири жана башка элементтин атому менен байланышкан химиялык бирикмелер.
- Тыгыздык –массанын кɵлɵмгɵ болгон катышы.
- Прокатка – белгилүү бир форманы берүү үчүн айланып туруучу валлдардын ортосунда ɵзгɵчɵ станоктордо басым астында кысуу менен металлдарды ысык абалында иштетүү.
- Реакциялашууга жɵндɵмдүү – молекулалардын, атомдордун, иондордун активдүүлүгүнүн мүнɵздɵмɵсү.
- Жылуулук ɵткɵргүчтүк – нерсенин жылуулук ɵткɵрүү касиети.
- Ширетүү – ортолорун балкып эриген металл менен бириктирүү.
- Куймалар – эки же андан ашык металлдардан жана металл эместерден турган, металлдык касиетке ээ болгон системалар.
- Щелочтук металлдар – суу менен реакцияга киргенде щелочторду–сууда эрүүчү негиздерди пайда кылган металлдар.
- Щелочтор – сууда эрүүчү негиздер.
- Щелочтук жер металлдар – «щелочтук» деген сɵздɵн алынган, «жер» деп металлдардын кендерин аташкан.
- Электролиз – заттар аркылуу туруктуу электр тогун ɵткɵргɵндɵ алардын ажырашы.
- Электр ɵткɵргүчтүк – электр тогун ɵткɵрүү жɵндɵмдүүлүгү.
Библиография
Справочниктер
- Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.
- Р.А. Лидин Справочник по общей и неорганической химии. М. «Просвещение» 1997г.
- И.Т. Гороновский, Ю.П. Назаренко, Е.Ф. Некряч. Киев, «Наукова думка», 1974г.
- Джейн Верзейм, Крис Окслейд и д-р Джон Ватерхаус .Химия. Школьный иллюстрированный справочник (пер. с англ.), М. «Росмэн», 1995г.
- Л.Л.Андреева, Д.Ю. Добротин, О.С. Габриелян и др. ХИМИЯ, «Большой справочник для школьников и поступающих в вузы», М. «Дрофа», 2004г.
- Химия. Справочник школьника. Центр гуманитарных наук при факультете журналистики МГУ им. М.В. Ломоносова. М. 1997 г.
- «Хочу все знать» Сб. Ленинград»Детская литература».1987 г.
- «Что такое. Кто такой». Изд. «Педагогика» М. 1990 г.
- «Энциклопедия для детей». Химия т. 17 Изд. дом «Аванта».2000г.
Китептер
- В.А.Волков, Е.В. Вонский, Г.И. Кузнецова. «Выдающиеся химики мира», М. «Высшая школа», 1991 г.
- В.А.Крицман «Книга для чтения по неорганической химии», М. «Просвещение», 1974 г.
- Варкентина Н.А., Дженлода Р.Х. «Химические элементы в школьном курсе химии». «Азиятехнографика». Бишкек, 2010 г.
- Книга для чтения по химии. 1 ч. Гос. Изд. Минпроса РСФСР, М. 1960 г.
- Книга для чтения по химии. 2 ч. Гос. Изд. Минпроса РСФСР, М. 1961 г.
- М. Фримантл. «Химия в действии», 2 ч. М. «Мир», 1991г.
- П.Р. Таубе, Е.И.Руденко. «От водорода до …?» «Высшая школа», 1964 г.
- Популярная библиотека химических элементов. Ред. Акад. И.В. Петрянов – Соколов. М. «Наука», 1983 г.
- Э. Гроссе, Х. Вайсмантель «Химия для пюбознательных» Ленинград. «Химия» 1985 г.
- Ю.И. Соловьев,Д.Н. Трифонов, А.Н. Шамин «История химии», М. «Просвещение», 1984 г.
- «Я познаю мир». Детская энциклопедия. Химия. М. АСТ 1995 г.
Окуу колдонмолору
- Химия. Пособие-репетитор для поступающих в вузы. Ред. В.Н. Чернышов, А.С.Егоров, Ростов-на-Дону, «Феникс»,1997г.
Усулдук колдонмолор
- М.В. Горский. Обучение основам общей химии. М. «Просвещение», 1991 г.
Англиялык соодагер Бэйкер ɵзүнүн бардык мүлкүн «мыкты илимий ачылыш жасагандыгы жɵнүндɵ доклад окуган» адамга тапшыруу үчүн Королдук илимий коомчулукка калтырган. 1807–жылдын ноябрь айында Гэмфри Дэви электр тогунун таасири астында щелочторду ажыратуу менен калийди жана натрийди алгандыгын билдирген. Кийинчерээк ал барийди, магнийди, кальцийди жана стронцийди бɵлүп алган. Дэви электрохимиянын негиздɵɵчүсү болуп калган.
Ал адамдын организмине кɵңүл кɵтɵрүүчү газдын мас кылуучу таасирин далилдей алган.
Ойлоп табылгандардын ичинен метанды жардырууда колдонулган коопсуз шахтерлордун лампасын белгилеп кетсек болот. Ал кɵптɵгɵн жылдар бою шахталарда электр жарыгын колдонгонго чейин пайдаланылган.
Дэви Бристолдогу Пневматикалык институтта иштеген жана ал орто билимдүү гана болсо да, 1802–жылы Королдук институттун профессору болуп калган.
1805 – жылы Франция Илимдер академиясы ага 3000 франк ɵлчɵмүндɵгү сыйлык берген. 1812–жылы Дэви 34 жашында илимий эмгектери үчүн рыцарлык титулга кɵрсɵтүлгɵн. Кɵптɵгɵн илимий уюмдардын мүчɵсү, анын ичинен Петербург ИА чет ɵлкɵлɵгү ардактуу мүчɵсү (1826–ж.).
1826–жылы Дэви апоплексия оорусунан жабыркаган (мээге кан куюлуп, шал ооруусунун пайда болушу). 1829–жылдын 29–майында Европадан Англияга бара жатканда Дэви экинчи жолу бул оору менен ооругандыктан, элүү бир жашында Женевада кɵз жумган.
Лондондогу Вестминстер аббатствосунда Англиянын белгилүү адамдары коюлган жерге кɵмүлгɵн. Анын урматына Лондондогу Королдук коомчулук окумуштуулар үчүн сыйлык–Дэви медалын тапшырышкан.
Советтик химик. Эритмелердин жана металлдардын куймаларынын физикалык–химиялык анализин иштеп чыккан. Куймалардын курамын анализдɵɵ үчүн ал жаңы методдорду жана приборлорду түзгɵн.
Орус металлургу. 1868–жылы болотту куюу, согуу менен калыпка келтирүү жана термикалык жактан кайрадан иштетүү боюнча жакшы шарттарды иштеп чыккан. Ошондон баштап болоттон жасалган куралдар бронза куралдарын сүрүп чыгарган. Конвекторлоо процессинде кычкылтек менен үйлɵɵнү колдонууга боло тургандыгын алдын ала айткан.
Орус металлургу, тоо инженери. Ал болоттун түзүлүшүн билүү үчүн 1831–жылы микроскопту колдонгон биринчи изилдɵɵчү болгон. Кысылган абанын агымына болоттон жасалган буюмдарды чыңалтуунун жолун ойлоп тапкан. Куюлган болотту алган жана кɵптɵгɵн заводдогу механизмдерди ɵнүктүргɵн.
1 1 кг литийдин гидридинен 2800 литр суутекти алууга болот, бул 120–150 атмосфералык басым астында 40 кг баллондун кɵлɵмүнɵ барабар.
2 Дарыядан алынган туз менен бүткүл кургактыкты 130 метрге чейин каптоого болот.
3 Суюк самындын курамына калий кирет.
4 Адамдын организминде ар бир секундада ɵзүнɵ 0,003 грамм калийди кармап турган калийдин радиоактивдүу изотобунун 5000 атому ажырап турат.
5 76% калийдин жана 24% натрийдин куймасы суюк абалда болот, минус 12 градус Цельсиядада катууланат.
Бул видеодон силер жумуртканы кантип отсуз бышырууга боло тургандыгын кɵрɵ аласыңар.