Химия: Металлдар — различия между версиями
Admine2 (обсуждение | вклад) (Новая страница: «{{lang|Химия: Металлы}}») |
Admine2 (обсуждение | вклад) |
||
| Строка 1: | Строка 1: | ||
| + | {{Якорь|Начало}} | ||
| + | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | ||
| + | <div class="cutok">[[#Металлдардын жаппы касиеттери|Металлдардын жаппы касиеттери]] [[#Щелочтук металлдар|Щелочтук металлдар]] [[#Щелочтук жер металлдар|Щелочтук жер металлдар]] [[#Темир|Темир]]</div> | ||
| + | == Металлдардын жалпы касиеттери == | ||
| + | Сырткы энергетикалык деңгээлинде 1, 2, 3 электронду өзүнө кармаган элементтер металлдарга кирет. (Суутектен, гелийден жана бордон башкасы. Металлдар Элементтердин мезгилдик системасында негизги жана кошумча подгруппаларда жайгашкан). Аларга жылуулук жана электр өткөргүчтүк, согууга элпектик, ийилгичтик жана зымдай созулуу касиети таандык .Бардык металлдар кадимки температурада сымаптан башкасы катуу абалда болот, металлдык жалтырактыкка ээ жана алтындай сары, күмүш сымал-боз түстө, ал түгүл көгүш түстɵргɵ боелуп, кубулуп турат. | ||
| + | |||
| + | {{center-p|[[file:Metally demonstracia.png|600px|center|Внешний вид различных металлов]]}} | ||
| + | |||
| + | Бул касиеттер металлдардын атомунун түзүлүшүнө жана түйүндөрүндө нейтралдык атомдор менен бирге оң заряддалган иондор жайгашкан кристаллдык торчолордун жаратылышына да байланыштуу болот. Ал эми электрондор (электрондук газ) түйүн аралык мейкиндикте жайгашат. Типтүү металлдар-калыбына келтиргичтер, бирок алар амфотердик касиеттерге (металлдык да металл эместик да касиети) да ээ болот. Металлдар касиеттери боюнча бир нече топторго биригишет: щелочтук металлдар (<span class="metall">Li, Na, K, Rb,Cs, Fr</span>), щелочтук жер металлдар (<span class="metall">Ca, Sr, Ba, Ra</span>), түстүү металлдар (<span class="metall">Ag, Au, Cu, Mn, Co, Ni, Cr</span>), кара металл–Fe жана анын куймалары), асыл металлдар (<span class="metall">Ag, Au, Pt,Ru, Rh,Pd, Os, Ir</span>), жеңил металлдар – 5 г/см<sup>3</sup> тыгыздыктан төмөн жана оор металлдар – тыгыздыгы андан жогору. Металлдардын тыгыздыгы 0,53 г/см<sup>3</sup> болгон литийден 22, 7 г/см<sup>3</sup> болгон осмийге чейинки мааниге ээ болот. | ||
| + | |||
| + | Бир нече металлдардын жана металл эместердин аралашмасынан турган куймаларда металлдардын жеке касиеттери толугу менен өзгөрүп кетет. Алар катуу эритмелер, интерметаллиддер жана механикалык аралашмалар болушу мүмкүн. Куймалар бекем болот, кыйынчылык менен эрийт, алардын балкып эрүү температурасы кескин төмөндɵйт, кислотага, щелочко туруктуу болуу менен жаңы касиеттерге ээ болот. | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | ==Щелочтук металлдар== | ||
| + | {{right|[[file:Litium.mp4|300px]]}} | ||
| + | <span class="metall">'''Li, Na, К , Rb, Cs, Fr'''</span> металлдары суу менен аракеттенишип, щелочторду–сууда эрүүчү негиздерди пайда кылгандыгы үчүн щелочтуу металлдар деп аталат. Бардык щелочтуу металлдардын S –электрондук катмарында 1<big class="elektron" data-title="–">е</big> толот, ошондуктан калыбына келтиргичтер катары металлдык касиеттерди алып жүрɵт, кычкылдануу даражасы '''+1''' барабар, I валенттүү болот. Балкып эрүү температурасы төмөн (t<small>бал</small>) болот, цезий адамдын колунун жылуулугунан эле балкып эрийт. | ||
| + | |||
| + | Бул металлдардын туздары жалынды мүнөздүү ар түрдүү түстөргө боёшот: литий – ачык кызыл, натрий–кызгылт сары, калий – кочкул, рубидий–кызыл, цезий – көгүш түскө. | ||
| + | |||
| + | {{center-p|[[file:Img10.jpg|400px|center|Окрашивание пламени разными металлами]]}} | ||
| + | |||
| + | Франций – туруксуз изотобу бар радиоактивдүү элемент. | ||
| + | |||
| + | Щелочтук металлдар реакцияга активдүү киргендиктен, жаратылышта эркин түрдɵ эмес, туздардын курамында кездешет. Алардын ичинен эң кеңири таралганы NaCl (таш тузу, кайнатма туз, галит) болуп саналат. Ал эми соданы (Na<sub>2</sub>CO<sub>3</sub>) адамдар байыртадан эле билишкен. Калий селитрасы (KNO<sub>3</sub>) мылтыктын дарысынын курамына киргендиктен, адамзаттын тарыхында чоң мааниге ээ болгон. Щелочтук металлдар балкыган хлориддердин же гидроксиддерди электролиздөө жолу менен алынат. | ||
| + | |||
| + | <div class="blocktext">2NaCl <sup><ins>''Электролиз''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→</span> Na + Cl<small>2</small><span style="font-famili:georgia; font-size:1.5em;">↑</span>, 4NaOH <sup><ins>''Электролиз''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→</span> 4Na + 2H<small>2</small>O + O<small>2</small>{{ArrowUp}}</div> | ||
| + | |||
| + | <div class="show-for-large-up">{{right-p|[[file:Щелочные металлы.jpg|250px|Щелочные металлы]]}}</div> | ||
| + | <div class="show-for-small-only">{{center|[[file:Щелочные металлы.jpg|250px|Щелочные металлы]]}}</div> | ||
| + | Бардык щелочтуу металлдар жумшак, тыгыздыгы төмөн болот. Литий (0,53 г/см<sup>3</sup>) жана натрий (0,97 г/см<sup>3</sup>) суудан жеңил болот, суу менен реакцияга киргенде анын үстүндө сүзөт. | ||
| + | |||
| + | Бардык металлдар күмүш сымал ак түстө болушат, электр тогун жана жылуулукту жакшы өткөрүшөт. Жумшак, бычак менен кесүүгө болот. | ||
| + | |||
| + | Щелочтуу металлдар башка заттар менен реакцияга кубаттуу киргендиктен, аларды керосиндин астында сакташат. | ||
| + | |||
| + | Суутек, күкүрт, көмүртек жана хлор менен реакцияга кирет. Калий жана натрий кычкылтек менен реакциялашканда өтө кычкылды (Na<sub>2</sub>O<sub>2</sub>), суу менен реакцияга киргенде гидроксиддер–щелочторду (LiOH, NaOH, KOH) пайда кылат. | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | == Щелочтук жер металлдар == | ||
| + | {{center-p|[[file:Шелочноземельные металлы.jpg|600px|Щелочноземельные металлы: Mg – магний, Ca – кальций, Sr – стронций, Ba – барий соответственно.]]}} | ||
| + | |||
| + | <span class="metall">'''Ca, Sr, Ba, Ra'''</span> металлдарынын гидроксиддери эритмелерде щелочтук касиетке ээ болгондуктан, алар «щелочтук жер металлдар» деп аталат. Ал эми алардын оксиддери кыйынчылык менен эригендиктен «жер» деп аталган оор металлдардын оксиддерине жакындашат. | ||
| + | |||
| + | <span class="metall">(Mg)</span> – магний, <span class="metall">(Ca)</span> – кальций, <span class="metall">(Sr)</span> – стронций, <span class="metall">(Ba)</span> – барий металлдык касиетке ээ болот. Күмүш сымал ак түстөгү бардык металлдар жылуулукту, электр тогун жакшы өткөрүшөт, алардын тыгыздыгы мезгилдик системада жогортон төмөн карай жогорулайт, ал эми балкып эрүү температурасы төмөндөйт. Алар абадагы кычкылтек менен кычкылданып кетпеши үчүн щелочтуу металлдар сыяктуу эле керосиндин астында сакталат. Жумшак, бычак менен кесилет. Жалынды мүнөздүү түстөргө боёшот. | ||
| + | |||
| + | {{center|[[file:Sequence 01 1.mp4|350px]] [[file:Ca.mp4|350px]]}} | ||
| + | |||
| + | <div class="blocktext">Металлдар жаратылышта эркин түрдө кездешпейт, алар CaCO<sub>3</sub> • MgCO<sub>3</sub> – доломит, CaCO<sub>3</sub> – бор, акиташ, мрамор, CaSO<sub>4</sub> • 2H<sub>2</sub>O – жаратылыш гипси, Ca<sub>3</sub> (PO<sub>4</sub>)<sub>2</sub> – фосфорит туздарынын курамында кездешет. Кальций жана магний хлориддерди электролиздөө, ал эми стронций жана барий алюминотермиялык жол менен алынат. Бардык металлдардын сырткы энергетикалык деңгээлинде 2ден <big class="elektron" data-title="–">е</big> болот, ошондуктан алар 2 <big class="elektron" data-title="–">е</big> оңой эле берип, күчтүү калыбына келтиргич болуп калат, алардын кычкылдануу даражасы +2 барабар, металлдык касиеттери (ЭМС) жогортон төмөн карай жогорулайт. Щелочтук жер металлдар суутек, кычкылтек, күкүрт жана хлор менен реакцияга кирет, суу менен активдүү реакциялашат.</div> | ||
| + | |||
| + | Кальцийдин оксиди суу менен реакцияга киргенде курулушта катары кеңири пайдаланылган өчүрүлгөн акиташ алынат. Щелочтук жер металлдар кальций (Ca<sup>2+</sup>) жана магнийдин (Mg<sup>2+</sup>) катиондорунун сууда болушу суунун шордуулугуна алып келет». '''«Шордуу сууда»''' (Ca<sup>2+</sup>) жана ( Mg<sup>2+</sup>) көп болгондуктан, самын көбүрбөйт, алар жогорку карбон кислоталарынын эрибеген туздарын пайда кылат. Бул учурда чай жакшы демделбейт, эт эзилип кетет. Шордуу суу кебер пайда кылгандыктан, ичтен күйүүчү кыймылдаткычтарды муздатууга жана буу казандарын иштетүүгө жараксыз болуп саналат. Шордуу сууну тамакка колдонуудан бөйрөктө таш пайда болушу мүмкүн. Сууну жумшартуунун заманбап жолу – натрийдин иондорун кальцийдин иондоруна алмаштырууга жɵндɵмдүү болгон чайырларды–катиониттерди колдонуу болуп саналат. | ||
| + | |||
| + | Кальций – сөөк тканынын жана тиштин негизги компоненти болуп саналат. | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | ==Алюминий== | ||
| + | {{right|[[file:Аллюминий.jpg|150px|link=]]}} | ||
| + | '''Алюминий <span class="metall">(Al)</span> – сырткы электрондук деңгээлинде 3е кармап турган, III валенттүү жана кычкылдануу даражасы '''+3''', терс электрлүүлүгү '''1,5''' барабар болгон III группанын негизги подгруппасынын элементи. Ал амфотердүү, б.а. кислоталык да негиздик да касиетке ээ. Алюминий – жер шарына эң кеңири таралган металл (8,8%). Ал жаратылышта эркин абалында кездешпестен, алюмосиликаттар: Na<sub>2</sub>O • AL<sub>2</sub>O<sub>3</sub> • 2SiO<sub>2</sub> – нефелин, K<sub>2</sub>O • Al<sub>2</sub>O<sub>3</sub> • 6SiO<sub>2</sub> – ортоклаз (талаа шпаты), Al<sub>2</sub>O<sub>3</sub> • 2SiO<sub>2</sub> • 2H<sub>2</sub>O – каолинит (чопо), Al<sub>2</sub>O<sub>3</sub> • nH<sub>2</sub>O – боксит, Al<sub>2</sub>O<sub>3</sub> – корунд (глинозем), Na<sub>3</sub>AlF<sub>6</sub> – криолит түрүндө кездешет. | ||
| + | {{right-p|[[file:Aljuminij-v-prirode.png|350px|Алюминий в природе]]}} | ||
| + | |||
| + | '''Башка металлдардын туздары менен боёлгон корунддар баалуу таш катары эсептелет. Аларга сапфирлер, рубиндер кирет.''' | ||
| + | |||
| + | Алюминий электр тогун жана жылуулукту жакшы ɵткɵргɵн, күмүш сымал ак түстɵгү жеңил металл. Балкып эрүү температурасы + 660<sup>о</sup>С барабар. | ||
| + | |||
| + | Алюминий криолиттин балкымасынан Al<sub>2</sub>O<sub>3</sub> электролиздɵɵ аркылуу алынат. | ||
| + | <div class="blocktext">2Al<sub>2</sub>O<sub>3</sub> <sup><ins>'''''Электролиз, t=950, Na3AlF6'''''</ins></sup><span style="font-famili:georgia; font-size:1.5em;">→</span> 4Al+ 3O<sub>2</sub><span style="font-famili:georgia; font-size:1.5em;">↑</span> | ||
| + | </div> | ||
| + | {{left|[[file:Sequence 01.mp4|300px]]}} | ||
| + | Алюминий калыңдыгы 5–10 нм болгон оксид пленкасы Al<sub>2</sub>O менен капталып калат, ал абдан бекем болгондуктан алюминийди андан аркы кычкылдануудан сактайт. Ошондуктан, алюминий суу менен реакцияга кирбейт. Алюминийдин амальгамасы (сымап менен болгон куймасы) оксид пленкасынан ажыратылгандан кийин кычкылтек, суутек, хлор, күкүрт жана көмүртек, ал түгүл суу менен да реакцияга кирет. | ||
| + | |||
| + | Амфотердик металл катары алюминий щелочтор менен реакцияга кирет да | ||
| + | |||
| + | <div style="text-align:center;"> 2Al + 2NaOH + 2H<sub>2</sub>O = 2NaAlO<sub>2</sub> + 3Н<sub>2</sub><span style="font-famili:georgia; font-size:1.5em;">↑</span>,</div> | ||
| + | |||
| + | натрийдин метаалюминатын пайда кылат. | ||
| + | |||
| + | Башка заттар менен реакциялашып, AlH<sub>3</sub> – '''алюминийдин гидридин''', Al<sub>2</sub>O<sub>3</sub> – '''алюминийдин оксидин''', Al(OH)<sub>3</sub> – '''алюминийдин гидроксидин''' пайда кылат. | ||
| + | |||
| + | Өзгɵчɵ алюминийдин куймалары – дюралюмин (Al + 5%Cu + 2%Mg), силумин (Al + Si), «Термит» – оксид менен (Fe<sub>3</sub>O<sub>4</sub>) алюминийдин порошогунун аралашмасы өтө баалуу, алар авиа жана машина курууда, кеме курууда кеңири колдонулат. Куймаларды иштетүүдɵ кɵп ɵлчɵмдɵгү жылуулук бөлүнүп чыккандыктан, алар металлдарды термиттик ширетүүдɵ пайдаланылат. | ||
| + | |||
| + | 8Al +3Fe<sub>3</sub>O<sub>4</sub> = 4Al<sub>2</sub>O<sub>3</sub> + 9Fe + ΔH 853,5 кДж/моль | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | ==Железо== | ||
| + | <ul class="small-block-grid-1 large-block-grid-2"> | ||
| + | <li>Железо является четвертым элементом по распространенности среди химических элементов по массовой доле (4,7-6,0%) и вторым среди металлов, уступая лишь алюминию. Железо относится к металлам, известным с глубокой древности. Сначала с ним познакомились в Египте, Месопотамии во 2 тысячелетии до нашей эры, затем в Закавказье, Малой Азии, и Древней Греции. Самородное железо – редкость, в основном метеоритного происхождения.</li> | ||
| + | <li>{{center-p|[[file:Метеорит.png|300px|Железный самородок космического происхождения]]}}</li> | ||
| + | </ul> | ||
| + | {{right-p|[[file:Fe.jpg|300px|Сталелитейный цех]]}} | ||
| + | В природе железо находится в связанном виде, входит в состав горных пород, а также содержится в живых организмах. | ||
| + | |||
| + | Fe<sub>2</sub>O<sub>3</sub> • 3H<sub>2</sub>O – бурый железняк, лимонит ; Fe<sub>2</sub>O<sub>3</sub> – красный железняк, гематит; Fe<sub>3</sub>O<sub>4</sub> – магнитный железняк, магнетит; FeS<sub>2</sub> – железный колчедан, пирит. | ||
| + | |||
| + | Железо – серебристо-белый, пластичный, относительно мягкий металл tпл 1539<sup>о</sup>С, плотность при 20<sup>о</sup>С – 7,87 г/см<sup>3</sup> При t<sup>o</sup> ниже 768<sup>о</sup>С железо ферромагнитно, хорошо подвергается сварке, ковке, прокатке. Проявляет степени окисления''': +2, +3, +6'''. Во влажном воздухе железо окисляется (ржавеет),образуя соединения Fe<sup>+2</sup> и Fe<sup>+3</sup>. Железо металл амфотерный. | ||
| + | {{left|[[file:P8 1.png|300px|link=]]}} | ||
| + | С разбавленными кислотами железо образует соединения со степенью окисления '''+2''', концентрированная азотная кислота железо пассивирует, Взаимодействует с неметаллами: кислородом, хлором, серой. | ||
| + | |||
| + | Для определения железа используют реактивы, дающие с ним характерную окраску, с Fe<sup>3+</sup> образуется изумрудный оттенок берлинской лазури, с Fe<sup>2+</sup> - комплекс синего цвета - турнбулевая синь. С роданидом калия или аммония трехвалентное железо образует комплекс темно–красного цвета часто используемый в кино под названием «кровь дракона». | ||
| + | |||
| + | Железо и его сплавы относятся к черным металлам. Это чугун, содержащий более 2% углерода и сталь - сплав железа с содержанием углерода 0,02 – 2.0%. Различают стали, которые содержат примеси Mn, Si, S, P и др. элементов. Они повышают коррозионные свойства сталей. Процесс выплавления железа основан на способности углерода и угарного газа в специальных печах – домнах восстанавливать железо из оксидов железа. | ||
| + | <br clear=all /> | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | ==Полезные ссылки== | ||
| + | {{bib|Канал [https://www.youtube.com/channel/UCjAmQ-4NL3UZX0W_nmjn4_w '''Thoisoi'''] на YouTube где вы сможете увидеть необычные эксперименты и узнать еще больше о химических элементах}} | ||
| + | ==Глоссарий== | ||
| + | :{{bib|'''Аквакомплексы''' – комплексы, включающие в состав молекулы воды – или кристаллогидраты.}} | ||
| + | :{{bib|'''«Алкали»''' по арабски – «зола», «щелочь».}} | ||
| + | :{{bib|'''Алюминотермия''' - способ получения металлов и неметаллов восстановлением их окислов металлическим алюминием.}} | ||
| + | :{{bib|'''Амфотерность''' - способность проявлять как кислотные, так и основные свойства.}} | ||
| + | :{{bib|'''Благородные металлы''' – золото, платина, серебро, рутений, родий, палладий, осмий, иридий.}} | ||
| + | :{{bib|'''Гидроксиды''' – неорганические соединения, содержащие в составе гидроксильную группу. Производные оксидов и воды.}} | ||
| + | :{{bib|'''Интерметаллиды''' – химические соединения металлов друг с другом, не подчиняющиеся законам постоянства состава.}} | ||
| + | :{{bib|'''Ковка''' - придавать форму ударами молота., усиливается при нагревании.}} | ||
| + | :{{bib|'''Кокс''' - твердый пористый продукт, полученный прокаливанием каменного угля без доступа воздуха. Применяется для выплавки чугуна.}} | ||
| + | :{{bib|'''Коррозия металлов''' - разрушение металлов под воздействием окружающей среды.}} | ||
| + | :{{bib|'''Металлы''' – простые вещества и сплавы, обладающие особым блеском, ковкостью, хорошей теплопроводностью и электропроводностью и имеющие 1,2, 3 электрона на внешнем уровне.}} | ||
| + | :{{bib|'''Намагничиваемость''' - магнитная восприимчивость.}} | ||
| + | :{{bib|'''Неметаллы''' – химически простое вещество не имеющие характерных для металлов свойств.}} | ||
| + | :{{bib|'''Основания''' – вещества, молекулы которых состоят из атомов металлов и одной или нескольких гидроксильных групп.}} | ||
| + | :{{bib|'''Опаловый''' – имеющий молочно-белый цвет с радужными оттенками.}} | ||
| + | :{{bib|'''Пассивирование металлов''' - образование на повехности металла защитного слоя при действии окислителя.}} | ||
| + | :{{bib|'''Пластичность''' - способность изменять форму под давлением при обычных и повышенных температурах не разрушаясь.}} | ||
| + | :{{bib|'''Пероксиды''' – химические соединения, в которых атомы кислорода связаны друг с другом и с атомом другого элемента.}} | ||
| + | :{{bib|'''Плотность''' - отношение массы к объему.}} | ||
| + | :{{bib|'''Прокатка''' – горячая обработка металла путем давления, обжима его между вращающимися валами в особых станах для придания ему нужной формы.}} | ||
| + | :{{bib|'''Реакционноспособный''' - характеристика относительной химической активности молекул, атомов, ионов.}} | ||
| + | :{{bib|'''Сварка''' – соединение, заполнением промежутков расплавленным металлом.}} | ||
| + | :{{bib|'''Сплавы''' – системы, состоящие из двух или более металлов и неметаллов, обладающие характерными свойствами металлов.}} | ||
| + | :{{bib|'''Теплопроводность''' - свойство тел передавать тепло.}} | ||
| + | :{{bib|'''Ферромагнитный материал''' — магнитный материал Металлический материал в твердом состоянии, способный намагничиваться под действием внешнего магнитного поля и частично сохранять приобретенную намагниченность после удаления внешнего поля.}} | ||
| + | :{{bib|'''Щелочные металлы''' называют так, потому что при реакции с водой они образуют щелочи - растворимые основания.}} | ||
| + | :{{bib|'''Щелочи''' - растворимые основания.}} | ||
| + | :{{bib|'''Щелочноземельные металлы''' – от слов «щелочной», «землями» называли руды металлов.}} | ||
| + | :{{bib|'''Электролиз''' – разложение веществ при прохождении через них постоянного электрического тока.}} | ||
| + | :{{bib|'''Электропроводность''' – способность проводить электричество.}} | ||
| + | <br clear=all /><div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | == Библиография == | ||
| + | ==== Справочники ==== | ||
| + | * {{bib|Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.}} | ||
| + | * {{bib|Р.А. Лидин Справочник по общей и неорганической химии. М. «Просвещение» 1997г.}} | ||
| + | * {{bib|И.Т. Гороновский, Ю.П. Назаренко, Е.Ф. Некряч. Киев, «Наукова думка», 1974г.}} | ||
| + | * {{bib|Джейн Верзейм, Крис Окслейд и д-р Джон Ватерхаус .Химия. Школьный иллюстрированный справочник (пер. с англ.), М. «Росмэн», 1995г.}} | ||
| + | * {{bib|Л.Л.Андреева, Д.Ю. Добротин, О.С. Габриелян и др. ХИМИЯ, «Большой справочник для школьников и поступающих в вузы», М. «Дрофа», 2004г.}} | ||
| + | * {{bib|Химия. Справочник школьника. Центр гуманитарных наук при факультете журналистики МГУ им. М.В. Ломоносова. М. 1997 г.}} | ||
| + | * {{bib|«Хочу все знать» Сб. Ленинград»Детская литература».1987 г.}} | ||
| + | * {{bib|«Что такое. Кто такой». Изд. «Педагогика» М. 1990 г.}} | ||
| + | * {{bib|«Энциклопедия для детей». Химия т. 17 Изд. дом «Аванта».2000г.}} | ||
| + | ==== Книги ==== | ||
| + | * {{bib|В.А.Волков, Е.В. Вонский, Г.И. Кузнецова. «Выдающиеся химики мира», М. «Высшая школа», 1991 г.}} | ||
| + | * {{bib|В.А.Крицман «Книга для чтения по неорганической химии», М. «Просвещение», 1974 г.}} | ||
| + | * {{bib|Варкентина Н.А., Дженлода Р.Х. «Химические элементы в школьном курсе химии». «Азиятехнографика». Бишкек, 2010 г.}} | ||
| + | * {{bib|Книга для чтения по химии. 1 ч. Гос. Изд. Минпроса РСФСР, М. 1960 г.}} | ||
| + | * {{bib|Книга для чтения по химии. 2 ч. Гос. Изд. Минпроса РСФСР, М. 1961 г.}} | ||
| + | * {{bib|М. Фримантл. «Химия в действии», 2 ч. М. «Мир», 1991г.}} | ||
| + | * {{bib|П.Р. Таубе, Е.И.Руденко. «От водорода до …?» «Высшая школа», 1964 г.}} | ||
| + | * {{bib|Популярная библиотека химических элементов. Ред. Акад. И.В. Петрянов – Соколов. М. «Наука», 1983 г.}} | ||
| + | * {{bib|Э. Гроссе, Х. Вайсмантель «Химия для пюбознательных» Ленинград. «Химия» 1985 г.}} | ||
| + | * {{bib|Ю.И. Соловьев,Д.Н. Трифонов, А.Н. Шамин «История химии», М. «Просвещение», 1984 г.}} | ||
| + | * {{bib|«Я познаю мир». Детская энциклопедия. Химия. М. АСТ 1995 г.}} | ||
| + | |||
| + | ====Учебные пособия==== | ||
| + | * {{bib|Химия. Пособие-репетитор для поступающих в вузы. Ред. В.Н. Чернышов, А.С.Егоров, Ростов-на-Дону, «Феникс»,1997г.}} | ||
| + | ==== Методические пособия ==== | ||
| + | * {{bib|М.В. Горский. Обучение основам общей химии. М. «Просвещение», 1991 г.}} | ||
| + | </div> | ||
| + | |||
| + | <!-- Sidebar --> | ||
| + | <div class="large-4 medium-5 columns"> | ||
| + | <!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | ||
| + | <div class="sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Химия в лицах</div> | ||
| + | </div> | ||
| + | <span class="firstcharacter">А</span>нглийский торговец Бэйкер завещал свое состояние Королевскому научному обществу на выплату тому, кто прочтет «доклад о выдающемся открытии». В ноябре 1807 года эту премию получил Гэмфри Дэви после доклада о получении калия и натрия путем разложения щелочей действием электрического тока. Позже он выделил и получил барий, магний, кальций и стронций. Дэви стал основателем электрохимии. | ||
| + | |||
| + | Он сумел доказать опьяняющее действие веселящего газа на организм. | ||
| + | {{center-p|[[файл:Гемфри-Дэви.jpg|220px|Гемфри Дэви на портрете работы Томаса Филлипса]]}} | ||
| + | Из практических изобретений надо выделить безопасную для взрыва метана шахтерскую лампу, которой пользовались долгие годы до введения в шахтах электрического освещения. | ||
| + | |||
| + | Дэви работал в Пневматическом институте в Бристоле, и хотя у него было только среднее образование, он стал с 1802 профессором Королевского института. | ||
| + | |||
| + | В 1805 году Французская академия наук присудила ему премию в 3000 франков. В 1812 году Дэви в возрасте 34 лет за научные работы был посвящён в рыцари. Член множества научных организаций, в том числе иностранный почётный член Петербургской АН (1826 год). | ||
| + | |||
| + | В 1826 году Дэви поразил первый апоплексический удар, а 29 мая 1829 года на пути в Англию из Европы Дэви поразил второй удар, от которого он и умер на пятьдесят первом году жизни в Женеве. | ||
| + | |||
| + | Похоронен в Вестминстерском аббатстве в Лондоне, на месте захоронения выдающихся людей Англии. В его честь Лондонское Королевское общество учредило награду для учёных — медаль Дэви. | ||
| + | </div> | ||
| + | <div class="sbstyle" style="margin-top:20px;"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Химия в лицах</div> | ||
| + | </div> | ||
| + | {{center-p|[[file:Kurnakov.jpg|280px|Академик Курнаков Николай Семенович]]}} | ||
| + | |||
| + | |||
| + | Советский химик. Разработал физико-химический анализ растворов и сплавов металлов. Для анализа состава сплавов он создал новые методы и приборы. | ||
| + | ---- | ||
| + | {{center-p|[[file:Chernov.jpg|280px|Заслуги Дмитрия Константиновича Чернова перед наукой огромны. Он выражал новые, передовые идеи в области металлургии.]]}} | ||
| + | |||
| + | |||
| + | Русский металлург. Разработал в 1868 году наилучшие условия отливки, ковки и термической обработки стали. С тех пор стальные орудия вытеснили бронзовые. Предсказал преимущества применения кислородного дутья в конвекторном процессе. | ||
| + | ---- | ||
| + | {{center-p|[[file:Anosov.jpg|280px|Павел Петрович Аносов в чине генерал-майора. Портрет 1851 года.]]}} | ||
| + | |||
| + | |||
| + | Русский металлург, горный инженер. Он был первым исследователем, применившим еще в 1831 году микроскоп для изучения структуры стали. Изобрел способ закалки стальных изделий в струе сжатого воздуха. Получил литую сталь и усовершенствовал многие заводские механизмы. | ||
| + | </div> | ||
| + | <!-- Второй элемент сайдбара --> | ||
| + | <div class="shadow radius sbstyle" style="margin-top:20px;"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="background-color:lightgrey;">Интересные факты</div> | ||
| + | </div> | ||
| + | {{step |symb=1 }}Из 1 кг гидрида лития можно получить 2800 литров водорода, столько его содержит 40 кг баллон под давлением 120-150 атмосфер. | ||
| + | |||
| + | {{step |symb=2 }}Солью, извлеченной из морской воды можно было бы засыпать всю сушу слоем в 130 метров. | ||
| + | |||
| + | {{step |symb=3 }}В состав жидкого мыла входит калий. | ||
| + | |||
| + | {{step |symb=4 }}Каждую секунду в организме человека распадается 5000 атомов радиоактивного изотопа калия, которого в нем содержится около 0,003 грамма. | ||
| + | |||
| + | {{step |symb=5 }}Сплав 76% калия и 24% натрия жидкий и затвердевает при минус 12 градусов Цельсия. | ||
| + | |||
| + | {{step |symb=5 }}Известно, что при использовании сильных окислителей была достигнута степень окисления железа +8. | ||
| + | </div> | ||
| + | <!-- третий элемент сайдбара викторины игры тесты --> | ||
| + | <div class="shadow radius sbstyle" style="margin-top:20px;"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric" style="background-color:lightgrey;">Вопросы</div> | ||
| + | </div> | ||
| + | Попробуйте ответить правильно на пять вопросов: | ||
| + | <quiz display = simple shuffleanswers=true > | ||
| + | {Каким способом получают щелочные металлы? | ||
| + | |type="()"} | ||
| + | + Электролизом | ||
| + | - Восстановлением | ||
| + | - Выплавкой | ||
| + | |||
| + | {Какой щелочной элемент реагирует с воздухом при обычных условиях сразу с образованием двух соединений? | ||
| + | |type="()"} | ||
| + | - Натрий | ||
| + | - Калий | ||
| + | + Литий | ||
| + | |||
| + | {В какой цвет окрашивает пламя калий? | ||
| + | |type="()"} | ||
| + | - Красный | ||
| + | + Фиолетовый | ||
| + | - Зеленый | ||
| + | |||
| + | {Какова валентность атомов щелочных металлов? | ||
| + | |type="()"} | ||
| + | + 1 | ||
| + | - 3 | ||
| + | - 2 | ||
| + | |||
| + | {Какова температура плавления цезия? | ||
| + | |type="()"} | ||
| + | - 27<sup>о</sup>С | ||
| + | + 28,5<sup>о</sup>С | ||
| + | - 29,5<sup>о</sup>С | ||
| + | </quiz> | ||
| + | </div> | ||
| + | <div class=sbstyle" style="margin-top:20px;"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Лайфхак</div> | ||
| + | </div> | ||
| + | <br />В этом видео вы узнаете как сварить яйца без огня. | ||
| + | {{center|[[file:Lifehack.mp4|280px]]}} | ||
| + | </div> | ||
| + | </div> | ||
{{lang|Химия: Металлы}} | {{lang|Химия: Металлы}} | ||
Версия 08:10, 4 мая 2018
Содержание
Металлдардын жалпы касиеттери
Сырткы энергетикалык деңгээлинде 1, 2, 3 электронду өзүнө кармаган элементтер металлдарга кирет. (Суутектен, гелийден жана бордон башкасы. Металлдар Элементтердин мезгилдик системасында негизги жана кошумча подгруппаларда жайгашкан). Аларга жылуулук жана электр өткөргүчтүк, согууга элпектик, ийилгичтик жана зымдай созулуу касиети таандык .Бардык металлдар кадимки температурада сымаптан башкасы катуу абалда болот, металлдык жалтырактыкка ээ жана алтындай сары, күмүш сымал-боз түстө, ал түгүл көгүш түстɵргɵ боелуп, кубулуп турат.
Бул касиеттер металлдардын атомунун түзүлүшүнө жана түйүндөрүндө нейтралдык атомдор менен бирге оң заряддалган иондор жайгашкан кристаллдык торчолордун жаратылышына да байланыштуу болот. Ал эми электрондор (электрондук газ) түйүн аралык мейкиндикте жайгашат. Типтүү металлдар-калыбына келтиргичтер, бирок алар амфотердик касиеттерге (металлдык да металл эместик да касиети) да ээ болот. Металлдар касиеттери боюнча бир нече топторго биригишет: щелочтук металлдар (), щелочтук жер металлдар (), түстүү металлдар (), кара металл–Fe жана анын куймалары), асыл металлдар (), жеңил металлдар – 5 г/см3 тыгыздыктан төмөн жана оор металлдар – тыгыздыгы андан жогору. Металлдардын тыгыздыгы 0,53 г/см3 болгон литийден 22, 7 г/см3 болгон осмийге чейинки мааниге ээ болот.
Бир нече металлдардын жана металл эместердин аралашмасынан турган куймаларда металлдардын жеке касиеттери толугу менен өзгөрүп кетет. Алар катуу эритмелер, интерметаллиддер жана механикалык аралашмалар болушу мүмкүн. Куймалар бекем болот, кыйынчылык менен эрийт, алардын балкып эрүү температурасы кескин төмөндɵйт, кислотага, щелочко туруктуу болуу менен жаңы касиеттерге ээ болот.
Щелочтук металлдар
металлдары суу менен аракеттенишип, щелочторду–сууда эрүүчү негиздерди пайда кылгандыгы үчүн щелочтуу металлдар деп аталат. Бардык щелочтуу металлдардын S –электрондук катмарында 1е толот, ошондуктан калыбына келтиргичтер катары металлдык касиеттерди алып жүрɵт, кычкылдануу даражасы +1 барабар, I валенттүү болот. Балкып эрүү температурасы төмөн (tбал) болот, цезий адамдын колунун жылуулугунан эле балкып эрийт.
Бул металлдардын туздары жалынды мүнөздүү ар түрдүү түстөргө боёшот: литий – ачык кызыл, натрий–кызгылт сары, калий – кочкул, рубидий–кызыл, цезий – көгүш түскө.
Франций – туруксуз изотобу бар радиоактивдүү элемент.
Щелочтук металлдар реакцияга активдүү киргендиктен, жаратылышта эркин түрдɵ эмес, туздардын курамында кездешет. Алардын ичинен эң кеңири таралганы NaCl (таш тузу, кайнатма туз, галит) болуп саналат. Ал эми соданы (Na2CO3) адамдар байыртадан эле билишкен. Калий селитрасы (KNO3) мылтыктын дарысынын курамына киргендиктен, адамзаттын тарыхында чоң мааниге ээ болгон. Щелочтук металлдар балкыган хлориддердин же гидроксиддерди электролиздөө жолу менен алынат.
Бардык щелочтуу металлдар жумшак, тыгыздыгы төмөн болот. Литий (0,53 г/см3) жана натрий (0,97 г/см3) суудан жеңил болот, суу менен реакцияга киргенде анын үстүндө сүзөт.
Бардык металлдар күмүш сымал ак түстө болушат, электр тогун жана жылуулукту жакшы өткөрүшөт. Жумшак, бычак менен кесүүгө болот.
Щелочтуу металлдар башка заттар менен реакцияга кубаттуу киргендиктен, аларды керосиндин астында сакташат.
Суутек, күкүрт, көмүртек жана хлор менен реакцияга кирет. Калий жана натрий кычкылтек менен реакциялашканда өтө кычкылды (Na2O2), суу менен реакцияга киргенде гидроксиддер–щелочторду (LiOH, NaOH, KOH) пайда кылат.
Щелочтук жер металлдар
металлдарынын гидроксиддери эритмелерде щелочтук касиетке ээ болгондуктан, алар «щелочтук жер металлдар» деп аталат. Ал эми алардын оксиддери кыйынчылык менен эригендиктен «жер» деп аталган оор металлдардын оксиддерине жакындашат.
– магний, – кальций, – стронций, – барий металлдык касиетке ээ болот. Күмүш сымал ак түстөгү бардык металлдар жылуулукту, электр тогун жакшы өткөрүшөт, алардын тыгыздыгы мезгилдик системада жогортон төмөн карай жогорулайт, ал эми балкып эрүү температурасы төмөндөйт. Алар абадагы кычкылтек менен кычкылданып кетпеши үчүн щелочтуу металлдар сыяктуу эле керосиндин астында сакталат. Жумшак, бычак менен кесилет. Жалынды мүнөздүү түстөргө боёшот.
Кальцийдин оксиди суу менен реакцияга киргенде курулушта катары кеңири пайдаланылган өчүрүлгөн акиташ алынат. Щелочтук жер металлдар кальций (Ca2+) жана магнийдин (Mg2+) катиондорунун сууда болушу суунун шордуулугуна алып келет». «Шордуу сууда» (Ca2+) жана ( Mg2+) көп болгондуктан, самын көбүрбөйт, алар жогорку карбон кислоталарынын эрибеген туздарын пайда кылат. Бул учурда чай жакшы демделбейт, эт эзилип кетет. Шордуу суу кебер пайда кылгандыктан, ичтен күйүүчү кыймылдаткычтарды муздатууга жана буу казандарын иштетүүгө жараксыз болуп саналат. Шордуу сууну тамакка колдонуудан бөйрөктө таш пайда болушу мүмкүн. Сууну жумшартуунун заманбап жолу – натрийдин иондорун кальцийдин иондоруна алмаштырууга жɵндɵмдүү болгон чайырларды–катиониттерди колдонуу болуп саналат.
Кальций – сөөк тканынын жана тиштин негизги компоненти болуп саналат.
Алюминий

Алюминий – сырткы электрондук деңгээлинде 3е кармап турган, III валенттүү жана кычкылдануу даражасы +3, терс электрлүүлүгү 1,5 барабар болгон III группанын негизги подгруппасынын элементи. Ал амфотердүү, б.а. кислоталык да негиздик да касиетке ээ. Алюминий – жер шарына эң кеңири таралган металл (8,8%). Ал жаратылышта эркин абалында кездешпестен, алюмосиликаттар: Na2O • AL2O3 • 2SiO2 – нефелин, K2O • Al2O3 • 6SiO2 – ортоклаз (талаа шпаты), Al2O3 • 2SiO2 • 2H2O – каолинит (чопо), Al2O3 • nH2O – боксит, Al2O3 – корунд (глинозем), Na3AlF6 – криолит түрүндө кездешет.
Башка металлдардын туздары менен боёлгон корунддар баалуу таш катары эсептелет. Аларга сапфирлер, рубиндер кирет.
Алюминий электр тогун жана жылуулукту жакшы ɵткɵргɵн, күмүш сымал ак түстɵгү жеңил металл. Балкып эрүү температурасы + 660оС барабар.
Алюминий криолиттин балкымасынан Al2O3 электролиздɵɵ аркылуу алынат.
Алюминий калыңдыгы 5–10 нм болгон оксид пленкасы Al2O менен капталып калат, ал абдан бекем болгондуктан алюминийди андан аркы кычкылдануудан сактайт. Ошондуктан, алюминий суу менен реакцияга кирбейт. Алюминийдин амальгамасы (сымап менен болгон куймасы) оксид пленкасынан ажыратылгандан кийин кычкылтек, суутек, хлор, күкүрт жана көмүртек, ал түгүл суу менен да реакцияга кирет.
Амфотердик металл катары алюминий щелочтор менен реакцияга кирет да
натрийдин метаалюминатын пайда кылат.
Башка заттар менен реакциялашып, AlH3 – алюминийдин гидридин, Al2O3 – алюминийдин оксидин, Al(OH)3 – алюминийдин гидроксидин пайда кылат.
Өзгɵчɵ алюминийдин куймалары – дюралюмин (Al + 5%Cu + 2%Mg), силумин (Al + Si), «Термит» – оксид менен (Fe3O4) алюминийдин порошогунун аралашмасы өтө баалуу, алар авиа жана машина курууда, кеме курууда кеңири колдонулат. Куймаларды иштетүүдɵ кɵп ɵлчɵмдɵгү жылуулук бөлүнүп чыккандыктан, алар металлдарды термиттик ширетүүдɵ пайдаланылат.
8Al +3Fe3O4 = 4Al2O3 + 9Fe + ΔH 853,5 кДж/моль
Железо
- Железо является четвертым элементом по распространенности среди химических элементов по массовой доле (4,7-6,0%) и вторым среди металлов, уступая лишь алюминию. Железо относится к металлам, известным с глубокой древности. Сначала с ним познакомились в Египте, Месопотамии во 2 тысячелетии до нашей эры, затем в Закавказье, Малой Азии, и Древней Греции. Самородное железо – редкость, в основном метеоритного происхождения.
В природе железо находится в связанном виде, входит в состав горных пород, а также содержится в живых организмах.
Fe2O3 • 3H2O – бурый железняк, лимонит ; Fe2O3 – красный железняк, гематит; Fe3O4 – магнитный железняк, магнетит; FeS2 – железный колчедан, пирит.
Железо – серебристо-белый, пластичный, относительно мягкий металл tпл 1539оС, плотность при 20оС – 7,87 г/см3 При to ниже 768оС железо ферромагнитно, хорошо подвергается сварке, ковке, прокатке. Проявляет степени окисления: +2, +3, +6. Во влажном воздухе железо окисляется (ржавеет),образуя соединения Fe+2 и Fe+3. Железо металл амфотерный.
С разбавленными кислотами железо образует соединения со степенью окисления +2, концентрированная азотная кислота железо пассивирует, Взаимодействует с неметаллами: кислородом, хлором, серой.
Для определения железа используют реактивы, дающие с ним характерную окраску, с Fe3+ образуется изумрудный оттенок берлинской лазури, с Fe2+ - комплекс синего цвета - турнбулевая синь. С роданидом калия или аммония трехвалентное железо образует комплекс темно–красного цвета часто используемый в кино под названием «кровь дракона».
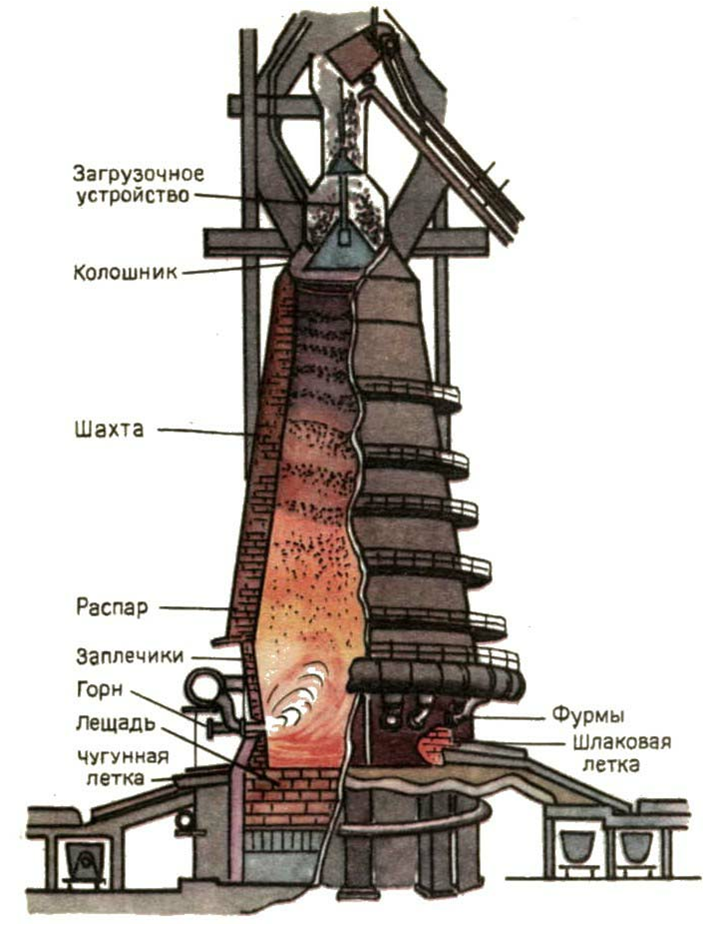
Железо и его сплавы относятся к черным металлам. Это чугун, содержащий более 2% углерода и сталь - сплав железа с содержанием углерода 0,02 – 2.0%. Различают стали, которые содержат примеси Mn, Si, S, P и др. элементов. Они повышают коррозионные свойства сталей. Процесс выплавления железа основан на способности углерода и угарного газа в специальных печах – домнах восстанавливать железо из оксидов железа.
Полезные ссылки
Глоссарий
- Аквакомплексы – комплексы, включающие в состав молекулы воды – или кристаллогидраты.
- «Алкали» по арабски – «зола», «щелочь».
- Алюминотермия - способ получения металлов и неметаллов восстановлением их окислов металлическим алюминием.
- Амфотерность - способность проявлять как кислотные, так и основные свойства.
- Благородные металлы – золото, платина, серебро, рутений, родий, палладий, осмий, иридий.
- Гидроксиды – неорганические соединения, содержащие в составе гидроксильную группу. Производные оксидов и воды.
- Интерметаллиды – химические соединения металлов друг с другом, не подчиняющиеся законам постоянства состава.
- Ковка - придавать форму ударами молота., усиливается при нагревании.
- Кокс - твердый пористый продукт, полученный прокаливанием каменного угля без доступа воздуха. Применяется для выплавки чугуна.
- Коррозия металлов - разрушение металлов под воздействием окружающей среды.
- Металлы – простые вещества и сплавы, обладающие особым блеском, ковкостью, хорошей теплопроводностью и электропроводностью и имеющие 1,2, 3 электрона на внешнем уровне.
- Намагничиваемость - магнитная восприимчивость.
- Неметаллы – химически простое вещество не имеющие характерных для металлов свойств.
- Основания – вещества, молекулы которых состоят из атомов металлов и одной или нескольких гидроксильных групп.
- Опаловый – имеющий молочно-белый цвет с радужными оттенками.
- Пассивирование металлов - образование на повехности металла защитного слоя при действии окислителя.
- Пластичность - способность изменять форму под давлением при обычных и повышенных температурах не разрушаясь.
- Пероксиды – химические соединения, в которых атомы кислорода связаны друг с другом и с атомом другого элемента.
- Плотность - отношение массы к объему.
- Прокатка – горячая обработка металла путем давления, обжима его между вращающимися валами в особых станах для придания ему нужной формы.
- Реакционноспособный - характеристика относительной химической активности молекул, атомов, ионов.
- Сварка – соединение, заполнением промежутков расплавленным металлом.
- Сплавы – системы, состоящие из двух или более металлов и неметаллов, обладающие характерными свойствами металлов.
- Теплопроводность - свойство тел передавать тепло.
- Ферромагнитный материал — магнитный материал Металлический материал в твердом состоянии, способный намагничиваться под действием внешнего магнитного поля и частично сохранять приобретенную намагниченность после удаления внешнего поля.
- Щелочные металлы называют так, потому что при реакции с водой они образуют щелочи - растворимые основания.
- Щелочи - растворимые основания.
- Щелочноземельные металлы – от слов «щелочной», «землями» называли руды металлов.
- Электролиз – разложение веществ при прохождении через них постоянного электрического тока.
- Электропроводность – способность проводить электричество.
Библиография
Справочники
- Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.
- Р.А. Лидин Справочник по общей и неорганической химии. М. «Просвещение» 1997г.
- И.Т. Гороновский, Ю.П. Назаренко, Е.Ф. Некряч. Киев, «Наукова думка», 1974г.
- Джейн Верзейм, Крис Окслейд и д-р Джон Ватерхаус .Химия. Школьный иллюстрированный справочник (пер. с англ.), М. «Росмэн», 1995г.
- Л.Л.Андреева, Д.Ю. Добротин, О.С. Габриелян и др. ХИМИЯ, «Большой справочник для школьников и поступающих в вузы», М. «Дрофа», 2004г.
- Химия. Справочник школьника. Центр гуманитарных наук при факультете журналистики МГУ им. М.В. Ломоносова. М. 1997 г.
- «Хочу все знать» Сб. Ленинград»Детская литература».1987 г.
- «Что такое. Кто такой». Изд. «Педагогика» М. 1990 г.
- «Энциклопедия для детей». Химия т. 17 Изд. дом «Аванта».2000г.
Книги
- В.А.Волков, Е.В. Вонский, Г.И. Кузнецова. «Выдающиеся химики мира», М. «Высшая школа», 1991 г.
- В.А.Крицман «Книга для чтения по неорганической химии», М. «Просвещение», 1974 г.
- Варкентина Н.А., Дженлода Р.Х. «Химические элементы в школьном курсе химии». «Азиятехнографика». Бишкек, 2010 г.
- Книга для чтения по химии. 1 ч. Гос. Изд. Минпроса РСФСР, М. 1960 г.
- Книга для чтения по химии. 2 ч. Гос. Изд. Минпроса РСФСР, М. 1961 г.
- М. Фримантл. «Химия в действии», 2 ч. М. «Мир», 1991г.
- П.Р. Таубе, Е.И.Руденко. «От водорода до …?» «Высшая школа», 1964 г.
- Популярная библиотека химических элементов. Ред. Акад. И.В. Петрянов – Соколов. М. «Наука», 1983 г.
- Э. Гроссе, Х. Вайсмантель «Химия для пюбознательных» Ленинград. «Химия» 1985 г.
- Ю.И. Соловьев,Д.Н. Трифонов, А.Н. Шамин «История химии», М. «Просвещение», 1984 г.
- «Я познаю мир». Детская энциклопедия. Химия. М. АСТ 1995 г.
Учебные пособия
- Химия. Пособие-репетитор для поступающих в вузы. Ред. В.Н. Чернышов, А.С.Егоров, Ростов-на-Дону, «Феникс»,1997г.
Методические пособия
- М.В. Горский. Обучение основам общей химии. М. «Просвещение», 1991 г.
Английский торговец Бэйкер завещал свое состояние Королевскому научному обществу на выплату тому, кто прочтет «доклад о выдающемся открытии». В ноябре 1807 года эту премию получил Гэмфри Дэви после доклада о получении калия и натрия путем разложения щелочей действием электрического тока. Позже он выделил и получил барий, магний, кальций и стронций. Дэви стал основателем электрохимии.
Он сумел доказать опьяняющее действие веселящего газа на организм.
Из практических изобретений надо выделить безопасную для взрыва метана шахтерскую лампу, которой пользовались долгие годы до введения в шахтах электрического освещения.
Дэви работал в Пневматическом институте в Бристоле, и хотя у него было только среднее образование, он стал с 1802 профессором Королевского института.
В 1805 году Французская академия наук присудила ему премию в 3000 франков. В 1812 году Дэви в возрасте 34 лет за научные работы был посвящён в рыцари. Член множества научных организаций, в том числе иностранный почётный член Петербургской АН (1826 год).
В 1826 году Дэви поразил первый апоплексический удар, а 29 мая 1829 года на пути в Англию из Европы Дэви поразил второй удар, от которого он и умер на пятьдесят первом году жизни в Женеве.
Похоронен в Вестминстерском аббатстве в Лондоне, на месте захоронения выдающихся людей Англии. В его честь Лондонское Королевское общество учредило награду для учёных — медаль Дэви.
Советский химик. Разработал физико-химический анализ растворов и сплавов металлов. Для анализа состава сплавов он создал новые методы и приборы.
Русский металлург. Разработал в 1868 году наилучшие условия отливки, ковки и термической обработки стали. С тех пор стальные орудия вытеснили бронзовые. Предсказал преимущества применения кислородного дутья в конвекторном процессе.
Русский металлург, горный инженер. Он был первым исследователем, применившим еще в 1831 году микроскоп для изучения структуры стали. Изобрел способ закалки стальных изделий в струе сжатого воздуха. Получил литую сталь и усовершенствовал многие заводские механизмы.
1 Из 1 кг гидрида лития можно получить 2800 литров водорода, столько его содержит 40 кг баллон под давлением 120-150 атмосфер.
2 Солью, извлеченной из морской воды можно было бы засыпать всю сушу слоем в 130 метров.
3 В состав жидкого мыла входит калий.
4 Каждую секунду в организме человека распадается 5000 атомов радиоактивного изотопа калия, которого в нем содержится около 0,003 грамма.
5 Сплав 76% калия и 24% натрия жидкий и затвердевает при минус 12 градусов Цельсия.
5 Известно, что при использовании сильных окислителей была достигнута степень окисления железа +8.
Попробуйте ответить правильно на пять вопросов:
В этом видео вы узнаете как сварить яйца без огня.