Химия: Электролиттик диссоциация — различия между версиями
Admine2 (обсуждение | вклад) (Новая страница: «{{lang|Химия: Электролитическая диссоциация}}») |
Admine2 (обсуждение | вклад) |
||
| Строка 1: | Строка 1: | ||
| + | {{Якорь|Начало}} | ||
| + | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | ||
| + | <div class="cutok">[[#Электролиттер жана электролит эместер|Электролиттер жана электролит эместер]] [[#Ион алмашуу реакциясы|Ион алмашуу реакциясы]] [[#Суунун иондук туундусу. Эритменин pH кɵрсɵткүчү|Суунун иондук туундусу. Эритменин pH кɵрсɵткүчү]] [[#Туздардын гидролизи|Туздардын гидролизи]] [[#Буферные растворы|Буферные растворы]]</div> | ||
| + | == Электролиттер жана электролит эместер == | ||
| + | Кээ бир заттардын эриген же балкыган абалда электр тогун ɵткɵрɵ тургандыгы, ал эми башкалары ушундай эле шартта электр тогун ɵткɵрбɵй тургандыгы белгилүү. Муну биз жɵнɵкɵй эле куралдын жардамы менен байкасак болот. | ||
| + | |||
| + | {{left-p|[[file:Apparat ch.png|200px|class=show-for-large-up|Эритмелердин электр ɵткɵргүчтүгүн аныктоочу курал]]}} | ||
| + | {{center|[[file:Apparat ch.png|300px|class=hide-for-large-up|Эритмелердин электр ɵткɵргүчтүгүн аныктоочу курал]]}} | ||
| + | |||
| + | Ал электр тогу менен байланыштырылган кɵмүр электроддорунан турат. Чынжырга токтун бар же жок экендигин кɵрсɵтүүчү электр лампочкасы да туташтырылган. Эгерде электродду канттын эритмесине салсак, анда лампочка күйбɵйт. Ал эми электродду натрий хлоридинин эритмесине салсак, ал жарык болуп күйɵт. Эритмелери же балкыган эритиндилери электр тогунун таасири астында иондорго ажыраган заттар электролиттер деп аталат. Эритмелери электр тогунун таасири астында иондорго ажырабаган заттар электролит эместер деп аталат. Электролиттерге кислоталар, негиздер жана бардык туздар кирет, ал эми электролит эместерге кɵпчүлүк органикалык заттар кирет. | ||
| + | |||
| + | == Электролиттик диссоциация теориясы == | ||
| + | |||
| + | Электролиттердин эритмелеринин ɵзгɵчɵлүгүн түшүндүрүү максатында, 1887-жылы швед окумуштуусу С. Аррениус электролиттик диссоциация теориясын сунуш кылган. Кийинчерээк бул теория атомдордун түзүлүшү жана химиялык байланыштар жɵнүндɵгү окуунун негизинде, окумуштуулар тарабынан ɵнүктүрүлгɵн. Бул теориянын учурдагы мазмууну тɵмɵнкү үч жободо берилген: | ||
| + | {{right-p|[[file:DissociationNaCl.png|400px|class=show-for-large-up|Электролитическая диссоциация раствора хлорида натрия]]}} | ||
| + | '''1.''' Электролиттер сууда эригенде иондорго-оң жана терс ионго ажырашат (диссоциацияланат). Иондор атомго караганда туруктуу болгон электрондук абалда болушат. | ||
| + | |||
| + | {{center|[[file:DissociationNaCl.png|400px|class=hide-for-large-up|Электролитическая диссоциация раствора хлорида натрия]]}} | ||
| + | Алар бир эле атомдон турушу мүмкүн, бул- жɵнɵкɵй иондор (Na<sup>+</sup>, Mg<sup>2+</sup>, Аl<sup>3+</sup> и т.д.)болушат. Же болбосо, бир нече атомдон турушу мүмкүн, бул – татаал иондор (NО<sub>3</sub><sup>–</sup>, SO<sub>4</sub><sup>2–</sup> , РО<sub>4</sub><sup>3–</sup> ж.б.). | ||
| + | |||
| + | '''2.''' Электр тогунун таасири астында иондор багыттуу кыймылга келишет: оң заряддалган иондор катодго тартылат, терс заряддалган иондор анодго тартылат. Ошондуктан, оң заряддалган иондор-катиондор деп, терс заряддалган иондор–аниондор деп аталат. Иондордун багыттуу кыймылы алардын карама–каршы заряддалган электроддорго тартылуусунан келип чыгат. | ||
| + | |||
| + | <ul class="large-block-grid-2 small-block-grid-1"> | ||
| + | <li>{{center-p|[[Файл:Хаотическое движение ионов.jpg|425px|Иондордун баш аламан кыймылы]]}} | ||
| + | </li> | ||
| + | <li>{{center-p|[[Файл:Направленное движение ионов.jpg|425px|Иондордун багытттуу кыймылы]]}} | ||
| + | </li> | ||
| + | </ul> | ||
| + | |||
| + | {{right-p|[[file:DissociationMgNo3.png|300px|class=show-for-large-up|Процесс диссоциации на примере нитрата магния]]}} | ||
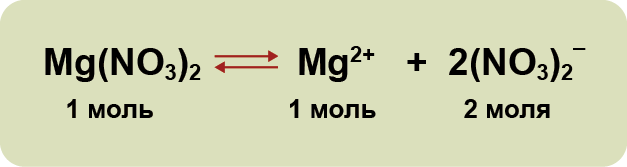
| + | '''3.''' '''Диссоциация''' – кайталанма процесс: молекулалардын иондорго ажырашы '''''(диссоциация)''''' менен катар эле иондордун биригүүсү '''''(ассоциация)''''' жүрүп турат. Ошондуктан, электролиттик диссоциациянын теңдемесинде барабардыктын ордуна карама–каршы багытталган жебелер (стрелка) жазылат. Мисалы: | ||
| + | |||
| + | {{center|[[file:DissociationMgNo3.png|300px|class=hide-for-large-up|Процесс диссоциации на примере нитрата магния]]}} | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | == Диссоциациянын механизми == | ||
| + | <ul class="large-block-grid-2 small-block-grid-1"> | ||
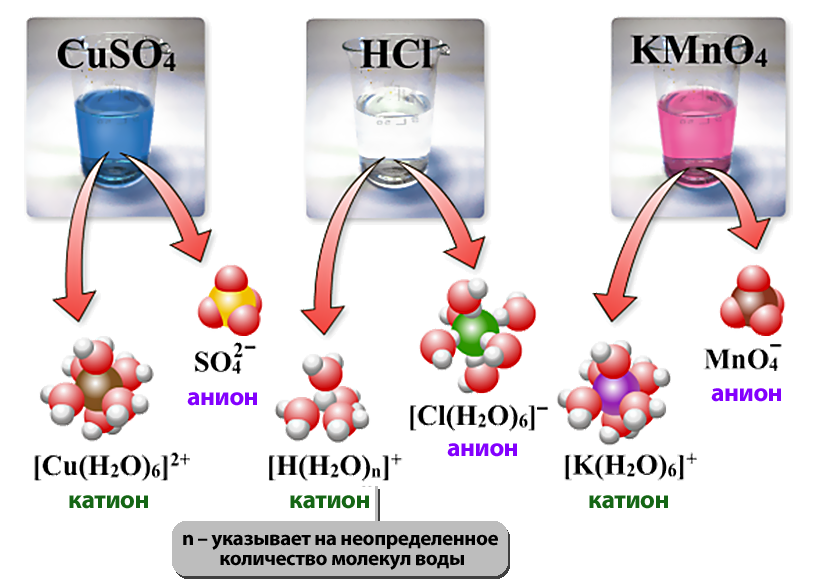
| + | <li>Электролиттик диссоциациянын механизмин карап кɵрɵлү. '''Иондук байланыш менен байланышкан заттар жеңил диссоциацияланат, себеби, бул заттар иондордон турат.''' Алар эригенде, суунун диполу оң жана терс заряддалган иондордун айланасына багыт алат. Иондор менен суунун диполунун ортосунда тартылуу күчү пайда болот. Жыйынтыгында, иондордун ортосундагы байланыш начарлайт да, иондор кристаллдан эритмеге ɵтүшɵт. | ||
| + | </li> | ||
| + | <li>{{center-p|[[Файл:Механизм диссоциации.png|450px|Механизм электролитической диссоциации (растворение в воде)]]}} | ||
| + | </li> | ||
| + | </ul> | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
| + | |||
| + | == Кислоталардын, негиздердин жана туздардын диссоциациясы == | ||
| + | |||
| + | Электролиттик диссоциация теориясынын негизинде кислоталарга, негиздерге жана туздарга аныктама берилип, касиеттери белгиленет. | ||
| + | |||
| + | <div class="blocktext">Кислоталар – диссоциация учурунда катиондор катары суутектин иондору ажырап бɵлүнгɵн электролиттер</div> | ||
| + | |||
| + | {{center|H<sub>3</sub>РO<sub>4</sub> {{ArrowLR}} 3H<sup>+</sup> + РO<sub>4</sub><sup>3–</sup> – фосфат иону}} | ||
| + | |||
| + | Кɵп негиздүү кислоталардын диссоциациясы биринчи баскычта жакшы жүрɵт, экинчи баскычта азыраак, ал эми үчүнчүдɵ бир аз гана жүрɵт. Ошондуктан, фосфор кислотасы диссоциацияланганда, H<sub>3</sub>РO<sub>4</sub> молекуласынан башка иондорго да ажырайт (акырындык саны менен азаят). | ||
| + | {| class="mw-datatable" style="margin-left: auto; margin-right: auto;" | ||
| + | |- | ||
| + | |H<sub>3</sub>РO<sub>4</sub> {{ArrowLR}} H<sup>+</sup> + Н<sub>2</sub>РO<sub>4</sub><sup>¯</sup> | ||
| + | |дигидрофосфат иону; (биринчи баскыч) | ||
| + | |- | ||
| + | |H<sub>2</sub>РO<sub>4</sub><sup>–</sup> {{ArrowLR}} H<sup>+</sup> + НРO<sub>4</sub><sup>2–</sup> | ||
| + | |гидрофосфат иону; (экинчи баскыч) | ||
| + | |- | ||
| + | |РO<sub>4</sub><sup>2–</sup> {{ArrowLR}} H<sup>+</sup> + РO<sub>4</sub><sup>3–</sup> | ||
| + | |фосфат иону; (үчүнчү баскыч) | ||
| + | |} | ||
| + | <div class="blocktext">Негиздер – диссоциацияланганда аниондор катарында гидроксид иондору гана ажырап бɵлүнгɵн электролиттер. Мисалы: KOH = K + OH</div> | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
| + | |||
| + | == Диссоциация даражасы == | ||
| + | {{left-p|[[Файл:Степень диссоциации.png|class=show-for-large-up|150px|Степень диссоциации]]}} | ||
| + | Электролиттик диссоциация – кайталанма процесс болгондуктан, электролиттердин эритмесинде иондордон сырткары молекулалар да болот. Ошондуктан, электролиттердин эритмеси диссоциация даражасы менен мүнɵздɵлɵт (грек тамгасы альфа '''α''' менен белгиленет.). Диссоциация даражасы – бул иондорго ажыраган молекулардын санынын N<sup>i</sup> молекуланын жалпы санына N болгон катышына барабар: | ||
| + | {{center|[[Файл:Степень диссоциации.png|class=hide-for-large-up|150px|Диссоциация даражасы]]}} | ||
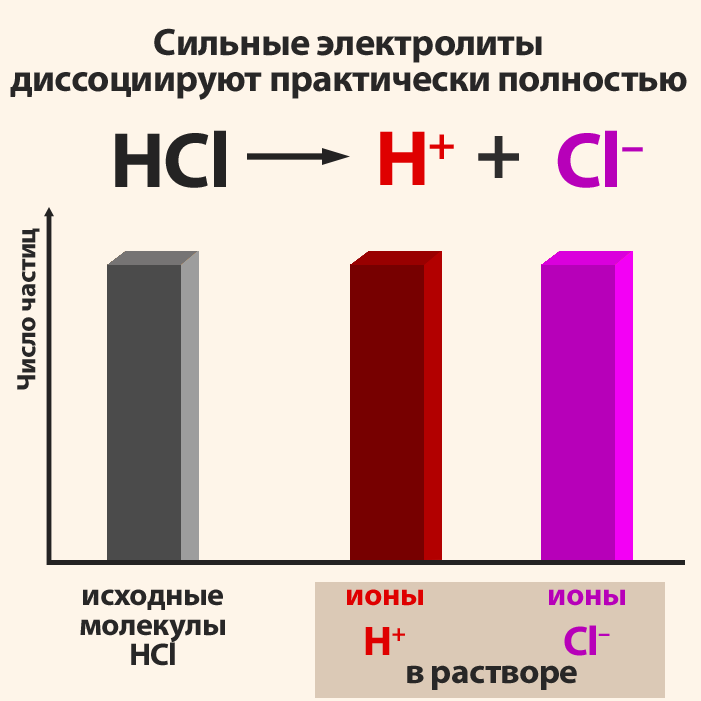
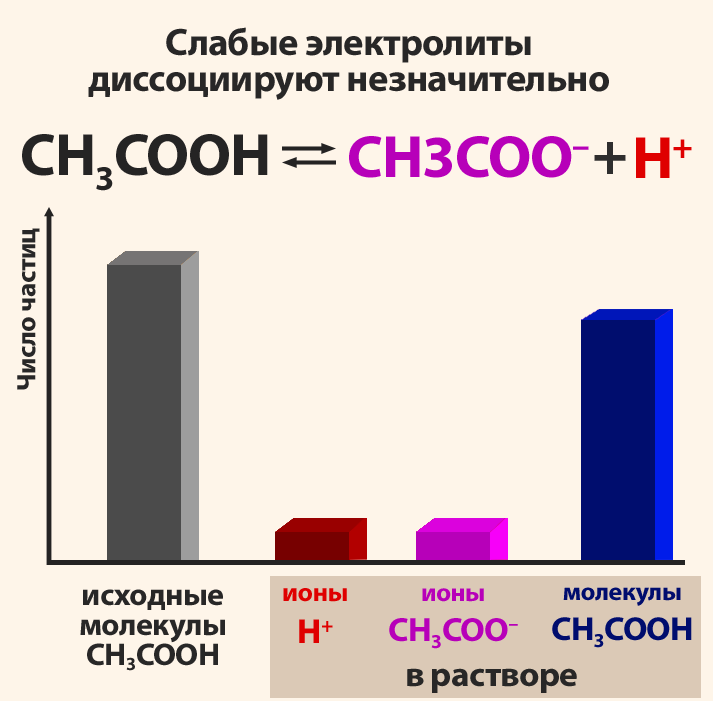
| + | Электролиттердин диссоциация даражасы пайыздар менен туюнтулат. Эгерде '''α = 0 болсо''', анда диссоциациянын болбогондугун билдирет, '''α = 1''' же 100% болсо, анда электролит иондорго толугу менен ажырайт. Эгер '''α = 20% болсо''', анда берилген электролиттин 100 молекуласынын 20 гана иондорго ажырагандыгын билдирет. | ||
| + | <ul class="small-block-grid-1 large-block-grid-2"> | ||
| + | <li>{{center|[[Файл:Electrolits1.png|500px|Сильные электролиты]]}}</li> | ||
| + | <li>{{center|[[Файл:Electrolits2.png|500px|Слабые электролиты]]}}</li> | ||
| + | </ul> | ||
| + | <ul class="small-block-grid-1 large-block-grid-2"> | ||
| + | <li>{{center|[[Файл:Acid dissociation.png|500px|Степень диссоциации некоторых кислот в водных растворах при 18 градусах по цельсию]]}}</li> | ||
| + | <li>Ар түрдүү электролиттердин диссоциация даражасы да ар башка болот. Тажрыйба кɵргɵзгɵндɵй, диссиоциация даражасы электролиттердин концентрациясынан жана температурадан кɵз каранды болот.</li> | ||
| + | </ul> | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
| + | |||
| + | == Ион алмашуу реакциясы == | ||
| + | Электролиттик диссоциация теориясына ылайык, электролиттердин ортосунда жүргɵн бардык реакциялар иондук реакция болуп саналат. Алар иондук реакция деп, ал эми бул реакциялардын теңдемелери иондук теңдеме деп аталат. Алар молекулалык түрдɵ жазылган реакцияларга караганда жɵнɵкɵйүрɵɵк болушат. | ||
| + | |||
| + | <div class="blocktext">Иондук теңдемени түзгөн учурда тɵмɵнкүлɵрдү билүү керек: *аз диссоциациялануучу зат (суу), *начар эриген заттар (чɵкмɵ түрүндɵ чɵккɵн заттар), *газ абалындагы заттар молекулалык түрдɵ жазылат</div> | ||
| + | {{right-p|[[Файл:Реакции.png|400px|class=show-for-large-up|Пример реакций с выделением веществ]]}} | ||
| + | Теңдемени жазганда, формуланын жанына {{Arrowdown}} белгиси коюлса, анда бул заттын чɵкмɵ түрүндɵ чɵккɵнүн билдирет. Ал эми {{ArrowUp}} белги заттын газ абалында бɵлүнүп чыккандыгын билдирет. | ||
| + | |||
| + | {{center|[[Файл:Реакции.png|400px|class=hide-for-large-up|Пример реакций с выделением веществ]]}} | ||
| + | <ul class="small-block-grid-1 large-block-grid-2"> | ||
| + | <li> | ||
| + | Күчтүү электролиттер толугу менен диссоциациялангандыктан, ион түрүндɵ жазылат. Теңдеменин сол жагындагы заряддардын суммасы оң жактагы заряддардын суммасына барабар болушу керек. Бул жоболорду бышыктоо үчүн мисалды карап кɵрɵлү.<br>Мисалы:<br> | ||
| + | {{center|[[Файл:ExempleIO.png|600px|Пример реакции ионного обмена]]}} </li> | ||
| + | <li>{{center|[[Файл:IOinfo.png|600px|Реакции ионного обмена]]}}</li> | ||
| + | </ul> | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
| + | |||
| + | == Суунун иондук туундусу. Эритменин pH кɵрсɵткүчү == | ||
| + | <ul class="small-block-grid-1 large-block-grid-2"> | ||
| + | <li> | ||
| + | <p>Суунун молекуласынын концентрациясынын диссоциация даражасы тɵмɵнкү маанини кɵрсɵтүү менен турактуу чоңдук (1000 г/л)/(18 г/моль) = 55,56 моль/л. болуп саналат.</p> | ||
| + | <p>20 – 25 °C суунун диссоциация константасы 1,8•10<sup>−16</sup> моль/л. барабар болот. Суу начар электролит (амфолит) болгондуктан, анын диссоциясынын константасын–суунун диссоциацияланышын жазып кɵрɵлү.</p> | ||
| + | |||
| + | '''K•[H<sub>2</sub>O] = [H<sup>+</sup>] [OH<sup>–</sup>'''] | ||
| + | |||
| + | <p>Кɵрсɵткүчтү белгилейбиз K•[H<sub>2</sub>O] = K<sub>в</sub> = 1,8·10<sup>−16</sup> моль/л·55,56 моль/л = 10<sup>−14</sup>моль<sup>2</sup>/л<sup>2</sup> = [H<sup>+</sup>]·[OH<sup>−</sup>] (25 °C температурада).</p> | ||
| + | </li> | ||
| + | <li> | ||
| + | {{center-p|[[Файл:Sreda.png|400px|Концентрации ионов. PH раствора]]}} | ||
| + | </li> | ||
| + | </ul> | ||
| + | |||
| + | <div class="blocktext">Протондордун концентрациясынын жана гидроксид ионунун кɵрсɵткүчүнɵ барабар болгон K<sub>з</sub> константасы суунун иондук кɵрсɵткүчү деп аталат. Ал таза сууга гана эмес, ал түгүл заттардын суюлтулган эритмелери үчүн да турактуу болуп саналат. Температуранын жогорулашы менен суунун диссоциациясы жогорулайт, ошондуктан, K<sub>з</sub>, дагы жогорулайт, температуранын тɵмɵндɵшү менен ал тɵмɵндɵйт. Суу диссоциацияланганда, ар бир суутектин оң ионуна Н<sup>+</sup> бир гидроксиддин терс иону туура келет, ошондуктан, таза сууда булардын концентрациясы: [Н<sup>+</sup>] = [ОН<sup>–</sup>] бирдей болот. </div> | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
| + | |||
| + | == Туздардын гидролизи (суунун ажырашы) == | ||
| + | |||
| + | '''Туздардын гидролизи – бул туздар менен суунун ортосундагы алмашуу реакциялары.Туз эритмеде диссоциацияланганда, анын иондору суунун молекуласы менен аракеттенишет.''' | ||
| + | |||
| + | <div class="blocktext">Туздун катиондору суунун OH<sup>–</sup> иону менен ал эми аниондору Н<sup>+</sup> иону менен биригет.</div> | ||
| + | |||
| + | Гидролиздин жыйынтыгында, диссоциацияланбаган, начарыраак, бирок, гидролизденген тузга караганда туруктуу болгон электролит алынат. Гидролиз гидролизге учураган туз начар кислотадан же начар негизден пайда болгон учурда ишке ашат Гидролиз – бул нейтралдашуу процессине карама–каршы жүргɵн процесс. | ||
| + | |||
| + | {{center|Cu(OH)<sub>2</sub>+H<sub>2</sub>SO<sub>4</sub> [[file:ArrowNG.png|50px]] CuSO<sub>4</sub>+2H<sub>2</sub>O}} | ||
| + | |||
| + | Гидролиз суюлтулган эритмелерде ылдам жана аягына чейин жүрɵт. | ||
| + | |||
| + | Диссоциация даражасына карата бардык кислоталар жана эрүүчү негиздер (щелочтор) күчтүү жана начар болуп, экиге бɵлүнүшɵт. | ||
| + | |||
| + | Күчтүү кислоталар: HClO<sub>4</sub>, HClO<sub>3</sub>, H<sub>2</sub>SO<sub>4</sub>, HNO<sub>3</sub>, HI, HBr, HCl. | ||
| + | |||
| + | Күчтүү негиздер (щелочтор): CsOH, RbOH, KOH, NaOH, LiOH, Ba(OH)<sub>2</sub>, Sr(OH)<sub>2</sub>, Ca(OH)<sub>2</sub>. | ||
| + | |||
| + | 1) Күчтүү кислотадан жана күчтүү негизден пайда болгон туздар гидролизге учурабайт. Сууда эригенде алар толугу менен оң заряддалган катиондорго жана терс заряддалган аниондорго диссоциацияланат. | ||
| + | |||
| + | 2) Күчтүү кислотадан жана начар негизден пайда болгон туздар кычкыл чɵйрɵнү '''рН≤7''' пайда кылуу менен гидролизденет. | ||
| + | |||
| + | '''''I баскыч:''''' | ||
| + | |||
| + | CuCl<sub>2</sub>+HOH{{Arrowleft}}Cu(OH)Cl+HCl | ||
| + | |||
| + | Cu<sup>2+</sup> + <span class="ion">2Cl<sup>–</sup></span> + HOH{{Arrowleft}}CuOH<sup>+</sup> + <span class="ion">Cl<sup>–</sup></span> + H<sup>+</sup> + <span class="ion">Cl<sup>–</sup></span> | ||
| + | |||
| + | Cu<sup>2+</sup>+HOH{{Arrowleft}}CuOH<sup>+</sup> + H<sup>+</sup> | ||
| + | |||
| + | '''(рН < 7)''' | ||
| + | |||
| + | '''''II баскыч''''' | ||
| + | |||
| + | Cu(OH)Cl + HOH {{Arrowleft}} Cu(OH)<sub>2</sub>{{Arrowdown}} + HCl | ||
| + | |||
| + | CuOH<sup>+</sup> + <span class="ion">Cl<sup>–</sup></span> + HOH {{Arrowleft}} Cu(OH)<sub>2</sub>{{Arrowdown}} + H<sup>+</sup> + <span class="ion">Cl<sup>–</sup></span> | ||
| + | |||
| + | CuOH<sup>+</sup> + HOH {{Arrowleft}} Cu(OH)<sub>2</sub>{{Arrowdown}} +H<sup>+</sup> | ||
| + | |||
| + | '''(pH ≤ 7) – <span style="color:red">кислая среда</span>''' | ||
| + | |||
| + | 3) Күчтүү негизден жана начар кислотадан пайда болгон туздар щелочтуу чɵйрɵнү '''рН≥7''' пайда кылуу менен гидролизденет. | ||
| + | |||
| + | '''''I баскыч''''' | ||
| + | |||
| + | K<sub>2</sub>S + HOH {{Arrowleft}} KHS + KOH | ||
| + | |||
| + | <span class="ion">2K<sup>+</sup></span> + S<sup>2–</sup> + HOH {{Arrowleft}} <span class="ion">K<sup>+</sup></span> + HS<sup>–</sup> + <span class="ion">K<sup>+</sup></span> + OH<sup>–</sup> | ||
| + | |||
| + | S<sup>2–</sup> +HOH {{Arrowleft}} HS<sup>–</sup> + OH<sup>–</sup> | ||
| + | |||
| + | '''(рН > 7)''' | ||
| + | |||
| + | '''''II баскыч''''' | ||
| + | |||
| + | KHS + HOH {{Arrowleft}} H<sub>2</sub>S{{ArrowUp}} + KOH | ||
| + | |||
| + | <span class="ion">K<sup>+</sup></span> + HS<sup>–</sup> + HOH {{Arrowleft}} H<sub>2</sub>S{{ArrowUp}} + <span class="ion">K<sup>+</sup></span> + OH<sup>–</sup> | ||
| + | |||
| + | HS<sup>–</sup> + HOH {{Arrowleft}} H<sub>2</sub>S{{ArrowUp}} + OH<sup>–</sup> | ||
| + | |||
| + | '''(pH ≥ 7) – щелочтуу чɵйрɵ''' | ||
| + | |||
| + | 4) Начар кислотадан жана начар негизден пайда болгон туздар, эгер туз эрүүчү туз болсо гана, гидролизденет. Адатта мындай туздар: | ||
| + | |||
| + | * сууда эрибейт | ||
| + | * эриткенде ажырап кетет | ||
| + | |||
| + | (NH<sub>4</sub>)<sub>2</sub>S + 2HOH {{Arrowleft}} <span class="razlogenie"><span>2NH<sub>3</sub>↑ 2H<sub>2</sub>O<div class="arr2">↓</div><div class="arr1">↓</div></span>2NH<sub>4</sub>OH</span> + H<sub>2</sub>S{{ArrowUp}} | ||
| + | |||
| + | |||
| + | |||
| + | 2NH<sub>4</sub><sup>+</sup> + S<sup>2–</sup> {{Arrowleft}} 2NH<sub>3</sub>{{ArrowUp}} + H<sub>2</sub>S{{ArrowUp}} | ||
| + | |||
| + | * Гидролизге учураганда, начар негиз жана начар кислота пайда болот. | ||
| + | |||
| + | CH<sub>3</sub>COONH<sub>4</sub> + HOH {{Arrowleft}} CH<sub>3</sub>COOH + NH<sub>4</sub>OH | ||
| + | |||
| + | CH<sub>3</sub>COO<sup>–</sup> + NH<sub>4</sub><sup>+</sup> + HOH {{Arrowleft}} CH<sub>3</sub>COOH + NH<sub>4</sub>OH | ||
| + | |||
| + | Уксус кислотасынын диссоциация константасы CH<sub>3</sub>COOH = 1,8·10<sup>-5</sup> барабар болот, ал эми аммоний гидроксидинин диссоциация константасы да NH<sub>4</sub>OH = 1,8·10<sup>-5</sup> барабар болот. Б.а. бул заттардын сандык кɵрсɵткүчтɵрүнүн бири–бирине барабар болгондугу, аммоний ацетаты гидролизденгенде нейтралдуу чɵйрɵнүн алынгандыгын кɵрсɵтɵт. | ||
| + | |||
| + | <div class="blocktext">((Химиктер адатта туздарды жытынан аныкташат (цианиддерден башкасын). Аммоний ацетаты уксус кислотасындай жыттанат, ошондуктан, бул туздун кычкылдуулугунун тɵмɵн экендиги айтылып жүрɵт.)</div> | ||
| + | |||
| + | Ошондой эле кɵпкɵ чейин сактаганда, газ абалындагы зат катары аммиактын учмалыгын да белгилɵɵгɵ болот. | ||
| + | |||
| + | '''Туздардын гидролизи баскыч менен жүрүшү мүмкүн. Баскычтардын саны туздун курамындагы металлдын же кислота калдыгынын валенттүүлүгүнɵ барабар болот.''' | ||
| + | <div class="mw-customtoggle-pr1 resettext" style="background-color:#bbcdff; padding:3px"><h4>''' 1–Мисал'''</h4></div><br> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-pr1"> | ||
| + | ''I баскыч:'' | ||
| + | Na<sub>3</sub>PO<sub>4</sub> + HOH {{Arrowleft}} Na<sub>2</sub>HPO<sub>4</sub> + NaOH | ||
| + | |||
| + | <span class="ion">3Na<sup>+</sup></span> + PO<sub>4</sub><sup>3–</sup> + HOH {{Arrowleft}} <span class="ion">2Na<sup>+</sup></span> + HPO<sub>4</sub><sup>2–</sup> + <span class="ion">Na<sup>+</sup></span> + OH<sup>–</sup> | ||
| + | |||
| + | PO<sub>4</sub><sup>3–</sup> + HOH {{Arrowleft}} HPO<sub>4</sub><sup>2–</sup> + OH<sup>–</sup> | ||
| + | |||
| + | ''II баскыч'' | ||
| + | |||
| + | Na<sub>2</sub>HPO<sub>4</sub> + HOH {{Arrowleft}} NaH<sub>2</sub>PO<sub>4</sub> + NaOH | ||
| + | |||
| + | <span class="ion">2Na<sup>+</sup></span> + HPO<sub>4</sub><sup>2–</sup>+HOH {{Arrowleft}} <span class="ion">Na<sup>+</sup></span> + H<sub>2</sub>PO<sup>4–</sup> + <span class="ion">Na<sup>+</sup></span> | ||
| + | + OH<sup>–</sup> | ||
| + | |||
| + | HPO<sub>4</sub><sup>2–</sup> + HOH {{Arrowleft}} H<sub>2</sub>PO<sub>4</sub><sup>–</sup> + OH<sup>–</sup> | ||
| + | |||
| + | ''III баскыч'' Реакция жүрбɵйт,себеби, НРО<sub>4</sub> – начар электролит болуп саналат. | ||
| + | ---- | ||
| + | </div> | ||
| + | <div class="mw-customtoggle-pr2 resettext" style="background-color:#bbcdff; padding:3px"><h4>'''2–Мисал'''</h4></div><br> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-pr2"> | ||
| + | ''I баскыч'' | ||
| + | |||
| + | Al<sub>2</sub>(SO<sub>4</sub>)<sub>3</sub> + 2HOH {{Arrowleft}} 2Al(OH)SO<sub>4</sub>+H<sub>2</sub>SO<sub>4</sub> | ||
| + | |||
| + | 2Al<sup>3+</sup> + <span class="ion">3SO<sub>4</sub><sup>2–</sup></span> + 2HOH {{Arrowleft}} 2AlOH<sup>2+</sup> + <span class="ion">2SO<sub>4</sub><sup>2–</sup></span> + 2H<sup>+</sup> + <span class="ion">SO<sub>4</sub><sup>2–</sup></span> | ||
| + | |||
| + | 2Al<sup>3+</sup> + 2HOH {{Arrowleft}} 2AlOH<sup>2+</sup> + 2H<sup>+</sup> | ||
| + | |||
| + | ''II баскыч'' | ||
| + | |||
| + | 2Al(OH)SO<sub>4</sub> + 2HOH {{Arrowleft}} [Al(OH)<sub>2</sub>]<sub>2</sub>SO<sub>4</sub> + H<sub>2</sub>SO<sub>4</sub> | ||
| + | |||
| + | 2AlOH<sup>2+</sup> + <span class="ion">2SO<sub>4</sub><sup>2–</sup></span> + 2HOH {{Arrowleft}} 2Al(OH)<sub>2</sub><sup>+</sup> + <span class="ion">SO<sub>4</sub><sup>2–</sup></span> + 2H<sup>+</sup> + <span class="ion">SO<sub>4</sub><sup>2–</sup></span> | ||
| + | |||
| + | 2AlOH<sup>2+</sup> + 2HOH {{Arrowleft}} 2Al(OH)<sup>2+</sup> + 2H<sup>+</sup> | ||
| + | |||
| + | ''III баскыч'' | ||
| + | |||
| + | [Al(OH)<sub>2</sub>]<sub>2</sub>SO<sub>4</sub> + 2HOH {{Arrowleft}} 2Al(OH)<sub>3</sub>{{Arrowdown}} + H<sub>2</sub>SO<sub>4</sub> | ||
| + | |||
| + | 2Al(OH)<sup>2+</sup> + <span class="ion">SO<sub>4</sub><sup>2–</sup></span> + 2HOH {{Arrowleft}} 2Al(OH)<sub>3</sub>{{Arrowdown}} + 2H<sup>+</sup> + <span class="ion">SO<sub>4</sub><sup>2–</sup></span> | ||
| + | |||
| + | 2Al(OH)<sup>2+</sup> + 2HOH {{Arrowleft}} 2Al(OH)<sub>3</sub>{{Arrowdown}} + 2H<sup>+</sup> | ||
| + | |||
| + | ''III баскычта реакция жүрбɵйт, себеби алынган зат кайра баштапкы заттарга ажырап, суутектин иондорунун ɵзүнчɵ топтолуусуна алып келет. Бирок, эритмени суюлтуу жана температураны жогорулатуу менен гидролиздин жүрүшүн күчɵтүүгɵ болот. Ошондуктан, гидролиз III баскычта да жүрүшү мүмкүн.'' | ||
| + | ---- | ||
| + | </div> | ||
| + | <div class = "textblock"> | ||
| + | Ошентип, туздар эрүүчү болсо,алар күчтүү жана начар компоненттерден (катион же анион) пайда болсо, анда гидролизденет. Туздун курамында щелочтон алынган күчтүү катион болсо, гидролизден кийин щелочтуу чɵйрɵ түзүлɵт. Эгерде туз күчтүү кислотадан жана начар негизден пайда болсо, анда күчтүү анион гидролизден кийин кычкыл чɵйрɵнүн түзүлүшүнɵ алып келет. Б.а. «Ким күчтүү болсо, ошонуку туура!» деген эреже сакталат. | ||
| + | </div> | ||
| + | |||
| + | Туздардын эригичтүүлүгүнүн ɵзгɵртүлгɵн таблицасы, гидролизден кийинки '''рН''' чɵйрɵнү аныктоого багытталган. | ||
| + | |||
| + | {{Dissociation}} | ||
| + | |||
| + | Бул таблицадагы тузду гидролиздин натыйжасы аркылуу сүрɵттɵп жазууга болот. | ||
| + | |||
| + | '''Эгерде туз таблицада тɵмɵнкү түстɵр менен белгиленсе, анда:''' | ||
| + | |||
| + | <span style="background-color:#e5e5e5; width:30px; height:1em; margin-right:10px; display:inline-block; border:1px solid black;"></span> мындай туз диссоциацияланат жана гидролизге учурабайт. | ||
| + | |||
| + | <span style="background-color:#fbe8e8; width:30px; height:1em; margin-right:10px; display:inline-block; border:1px solid black;"></span> гидролизденет, кычкыл чɵйрɵ түзүлɵт, '''рН <7''' болот. | ||
| + | |||
| + | <span style="background-color:#e5f5fb; width:30px; height:1em; margin-right:10px; display:inline-block; border:1px solid black;"></span> гидролизден кийин щелочтук чɵйрɵ түзүлɵт, мында суутектик кɵрсɵткүчтүн '''рН''' мааниси '''7 ден чоң болот'''. | ||
| + | |||
| + | <span style="background-color:#ffffff; width:30px; height:1em; margin-right:10px; display:inline-block; border:1px solid black;"></span> анализдɵɵнү талап кылат: туз бул сектордогу башка туздардай эле эрибейт же сууда эригенде ажырап кетет. Туз эрүүчү болсо, анда гидролиздин натыйжасында, нейтралдуу чɵйрɵ '''рН=7,0''' түзүлɵт. | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
| + | |||
| + | == Буфердик эритмелер == | ||
| + | |||
| + | Буфердик системанын болушу менен кандын ж.б. суюктуктардын курамынын туруктуулугун сактоого организм жɵндɵмдүү болот. Кычкылдуулугу жана щелочтуулугу ар түрдүү болгон кɵптɵгɵн заттар организмге сырттан кирет жана анда иштелип чыгат, бирок, H<sup>+</sup> жана OH<sup>–</sup> иондорунун концентрациясын ɵзгɵртүү менен кан үчүн туруктуу '''(pH = 7,37 – 7,44)''' чɵйрɵ сакталат. | ||
| + | |||
| + | Бул кɵрсɵткүчтɵрдүн тɵмɵндɵшү же жогорулашы ɵлүмгɵ алып келет. Буфердик эритмелер деп, бир аз ɵлчɵмдɵ кислотаны же щелочту кошсо, суюлтса да суутектик кɵрсɵткүчү '''рН''' ɵзгɵрбɵй, турактуу болгон эритмелерди айтабыз. Буфердик системалар начар негизден жана күчтүү кислотадан пайда болгон же начар кислотадан жана күчтүү негиздерден пайда болгон туздардан турат. | ||
| + | |||
| + | {{center|[[file:Классификация буферных систем.png|600px|Классификация буферных систем]]}} | ||
| + | |||
| + | |||
| + | '''Мисалы:''' NH<sub>4</sub>OH + NH<sub>4</sub>Cl '''''pH = 9,2''''' '''же''' CH<sub>3</sub>COOH + CH<sub>3</sub>COONa '''''pH=4,7''''' | ||
| + | |||
| + | Кислотаны кошуу менен суутектин иондору, ал эми щелочту кошуу менен гидроксид иондору менен байланышат, эритменин чɵйрɵсү '''pH''' бир аз гана ɵзгɵрɵт. Буфердик эритмелердеги чɵйрɵ '''рН''' буфердик ченем (емкость) аркылуу жɵнгɵ салынат. | ||
| + | <div class="blocktext"> | ||
| + | Буфердик ченем деп, эритменин чɵйрɵсүн рН 1ге чейин тɵмɵндɵтүү үчүн, 1 л буфердик эритмеге кошулган кислотанын же щелочтун молунун санын айтабыз. </div> | ||
| + | |||
| + | Организмдин ар бир клеткасында ички чɵйрɵнүн туруктуулугун сактаган ар түрдүү буфердик система иштейт. | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
| + | |||
| + | == Гидролиздин мааниси жана колдонулушу == | ||
| + | Туздардын суу менен болгон алмашуу реакциясы жаратылышта кеңири таралган. | ||
| + | {{right-p|[[file:Малахит.png|350px|class=show-for-large-up|Минерал малахит – продукт гидролиза природных карбонатов.]]}} | ||
| + | Гидролиз кубулушу жер катмарынын химиялык кайрадан ɵзгɵрүүсү үчүн чоң роль ойнойт. Жер катмарындагы кɵптɵгɵн минералдар – металлдардын сульфиддери сууда начар эрийт, бирок, суу менен акырындап аракеттенише баштайт. Мындай процесстер Жердин үстүндɵ да жүрүп турат, бирок, жердин терең катмарында, жогорку температурада өтө кубаттуу жүрɵт. Жыйынтыгында, вулкан учурунда, жердин үстүнɵ абдан кɵп ɵлчɵмдɵ күкүртүү суутек бɵлүнүп чыгат. Ал эми силикат тоо тектери акырындап, гидроксиддерге, андан соң металлдардын оксидине айлана баштайт. Жыйынтыгында, минералдардын гидролизи– алюмосиликаттар пайда болуп, тоо тектери бузула баштайт. | ||
| + | {{center|[[file:Малахит.png|350px|class=hide-for-large-up|Минерал малахит – продукт гидролиза природных карбонатов.]]}} | ||
| + | Бизге белгилүү болгон малахит '''(Cu<sub>2</sub>(OH)<sub>2</sub>CO<sub>2</sub>)''' – табийгый карбонаттардын гидролизинен пайда болгон. | ||
| + | |||
| + | Дүйнɵлүк океанда туздар суу менен кубаттуу аракеттенишет. Дарыялар менен агып чыккан кальцийдин жана магнийдин гидрокарбонаттары деңиз сууларына кошулуп, аларда начар шелочтук чɵйрɵнү түзɵт. Жээктеги суулардын мына ушундай начар щелочтук чɵйрɵсүндɵ рН 9га барабар болот, ошондуктан, деңиз ɵсүмдүктɵрүндɵ фотосинтез кубаттуу жүрɵт жана деңиз жаныбарлары да ылдам чоңоюшат. Сүт эмүүчүлɵрдүн, анын ичинен адамдын канындагы рН бирдейлигин билүү менен силер, Жердеги жаныбарлар дүйнɵсүнүн биримдиги жɵнүндɵ жыйынтык чыгара аласыңар. | ||
| + | |||
| + | Гидролиз мунайчыларды бир топ түйшүккɵ салды. Бизге белгилүү болгондой, нефтте суунун жана кɵптɵгɵн туздардын аралашмасы, ɵзгɵчɵ кальцийдин жана магнийдин хлориди кɵп болот. Нефтини кайра иштеткен учурда, аны 250 <sup>o</sup>С ысытканда хлориддер суунун буусу менен кубаттуу аракеттенишет. Бɵлүнүп чыккан газ абалындагы хлордуу суутек жабдуулар жасалган металл менен реакцияга кирип, аны бузат, бул нефть продуктыларынын баасынын жогорулашына алып келет. Бирок, гидролиздин пайдасын да айтпай коюуга болбойт. Мисалы, алюминий сульфатынын суу менен аракеттенишинен пайда болгон алюминий гидроксидинин чɵкмɵсү кылымдардан бери боёк катары колдонулуп келе жатат. Кездемеге сиңирилгенден кийин алюминий гидроксиди боёкторду жеңил адсорбциялайт жана жууса да кетпеген боёктордун катмарын пайда кылат. Бул жол менен кездемени боёочу сапаттуу боёктор алынат. Ушул эле процесс ичүүчү сууну жана ɵнɵр жай калдыктарын тазалоодо да колдонулат. Алюминийдин гидроксидинин кɵпшɵк, аморфтуу чɵкмɵсүн топуракта тоголоктошот да, аларды адсорбциялоо менен зыяндуу, уу заттарды чɵктүрүп, бɵлүп алышат. Ушундай эле жол менен табият суулары алюминийдин бирикмелеринен турган чопо менен тазаланат. | ||
| + | |||
| + | Натрийдин карбонатынын жана натрийдин фосфатынын Na<sub>2</sub>CO<sub>3</sub>, Na<sub>3</sub>PO<sub>4</sub> туздарынын гидролизи сууну тазалоо жана аны жумшартуу үчүн колдонулат. | ||
| + | |||
| + | Топурактын кычкылдуулугун азайтуу максатында акиташтоо да гидролиздɵɵ реакциясына негизделген: | ||
| + | |||
| + | CO<sub>3</sub><sup>2</sup><sup>-</sup>+HOH{{ArrowLR}}HCO<sub>3</sub><sub>-</sub>+OH<sup>+</sup> | ||
| + | |||
| + | Гидролиз аркылуу ɵнɵр жайында азык–түлүк эмес чийки заттардан ''(жыгач, пахтанын кабыгы, күн карама шакелдери, саман)'' бир катар баалуу продуктылар: '''этил спирти, белковые дрожж, глюкоза, кургак муз''' иштелип чыгат. | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div> | ||
| + | <br clear=all /> | ||
| + | |||
| + | == Пайдалуу шилтемелер == | ||
| + | {{bib|Канал [https://www.youtube.com/channel/UCjAmQ-4NL3UZX0W_nmjn4_w '''Thoisoi'''] на YouTube где вы сможете увидеть необычные эксперименты и узнать еще больше о химических элементах}} | ||
| + | ==Глоссарий== | ||
| + | :{{bib|'''Аквакомплекстер''' – суунун молекуласынын курамына кирген комплекстер же кристаллогидраттар}} | ||
| + | <span style="color:red">:{{bib|'''Буфер, буферная система''' ''(англ. buffer, от buff – смягчать удар)'' – растворы с определённой устойчивой концентрацией водородных или гидроксид-ионов.}}</span> | ||
| + | |||
| + | == Библиография == | ||
| + | * {{bib|Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.}} | ||
| + | * {{bib|Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. – С. 244}} | ||
| + | * {{bib|Ефимов А.И. и др. Свойства неорганических соединений. Справочник. - Л.: Химия, 1983. – С. 140-141}} | ||
| + | * {{bib|Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. - Мн.: Современная школа, 2005. - 608 с ISBN 985-6751-04-7.}} | ||
| + | </div> | ||
| + | |||
| + | <!-- Sidebar --> | ||
| + | <div class="large-4 medium-5 columns"> | ||
| + | <!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | ||
| + | <div class="sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Белгилүү химиктер</div> | ||
| + | </div> | ||
| + | {{center-p|[[file:88a.jpg|400px|Сванте Август Аррениус]]}} | ||
| + | <span class="firstcharacter">Ш</span>вед физик–химиги Сванте Август Аррениус Упсаладан алыс эмес жердеги Вейк имениесинде туулган. | ||
| + | |||
| + | Аррениус ар түрдүү типтеги эритмелер аркылуу электр тогунун ɵтүшүн изилдеген. Ал кээ бир заттардын молекулалары сууда эригенде диссоциациялана тургандыгын, б.а. эки же андан кɵп бɵлүкчɵлɵргɵ–иондорго ажырай тургандыгын божомолдогон. «Бирок, ар бир бүтүн молекула электронейтралдуу болсо да, анын бɵлүкчɵлɵрү бир аз электр зарядына ээ болот, ал бɵлүкчɵнүн жаратылышына карата, же оң, же терс болушу мүмкүн. Мисалы, натрий хлоридин (туз) сууда эриткенде, ал '''оң заряддалган натрийдин атомуна жана терс заряддалган хлордун атомуна ажырайт.''' Бул заряддалган атомдор, молекуланын активдүү курамдык бɵлүгү катары эритмелерде гана пайда болот жана электр тогунун ɵтүщү үчүн шарт түзɵт. Электр тогу ɵз кезегинде активдүү курамдык бɵлүктɵрдү карама–каршы заряддалган электроддорго багыттайт». | ||
| + | |||
| + | 1884–ж. Аррениус Упсаль Университетинде докторлук диссертациясын жактаганда, мына ушул гипотезалар менен чыккан. Ал мезгилде кɵптɵгɵн окумуштуулар эритмеде карама–каршы заряддалган бɵлүкчɵлɵрдүн болооруна ишенишкен эмес. Ошондуктан, факультет кеңеши диссертацияны ɵз деңгээлинде баалаган эмес. | ||
| + | |||
| + | 1903–ж. гана Аррениуска «химия илимин ɵнүктүрүүдɵ анын электролиттик диссоциация теориясынын ɵзгɵчɵ маанисин таануу максатында»Нобель сыйлыгы ыйгарылган.Швеция королевствосунун илимдер академиясынын атынан чыккан X.Р.Тернеблад Аррениустун иондор теориясы «математика менен жакындашып», электрохимиянын ɵнүгүшүнɵ жол салгандыгын баса кɵрсɵткɵн. «Аррениустун теориясынын маанилүү натыйжаларынын бири, химия боюнча биринчи Нобель сыйлыгын алган Вант–Гоффтун эмгегин жыйынтыктагандыгы болуп саналат», – деген Тернеблад. | ||
| + | </div> | ||
| + | <div class="sbstyle" style="margin-top:20px;"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Сода жана анын колдонулушу</div> | ||
| + | </div> | ||
| + | {{center|<big>'''Машина–автоматта сода менен кур жууганга болобу?'''</big>}} | ||
| + | Кир жуучу машинада сода менен кантип кир жууйбуз? Ал үчүн барабандын ɵзүнɵ жарым стакан сода салып, кадимки режимде жууш керек. Эгерде кир буюмдар кɵп болсо, анда содадан бир стакан салуу керек. Ал эми ага дагы бир стакан ак уксустун эритмесин кошсок, соданын эффективдүүлүгү андан да жогорулайт. | ||
| + | {{center|[[file:Stirka-belya-1.jpg|400px|Можно ли стирать содой в машинке-автомат?]]}} | ||
| + | <big>'''Сода менен тактарды кетирүү'''</big> | ||
| + | |||
| + | Тактарды сода менен кетирүүчү бир нече ыкмаларды сунуш кылабыз: | ||
| + | |||
| + | *Такты кетирүү үчүн, сода пастасын даярдап алалы: бир чоң кашык соданы сууга аралаштырабыз. Суунун ордуна суутектин ɵтɵ кычкылын же уксусту колдонсо да болот. Алынган пастаны кир такка сүрүп, 15 мүнɵттɵн кийин жууп салабыз. Эгерде так кетпесе, процедураны кайталайбыз. Так абдан терең болсо,анда тиш щетка менен сүрүп кетирсек болот. Бирок, сода пастасын ɵтɵ назик, жука кездемелерге колдонууга болбойт; | ||
| + | *Соданы буюмдарды кургак жол менен тазалоого да колдонууга болот. Ал үчүн соданы кир тактын үстүнɵ жука кылып себелɵɵ керек( электи колдонсо ыңгайлуу болот), анан пакетке аба киргизбей ороп, 2 саатка коёбуз. Андан кийин кийимди кагып, 40 мүнɵт эшикке жайып коюу керек; | ||
| + | *Жагымсыз жытты кетирүү үчүн соданы таза носкиге салып, оозун байлап койгула. Андан кийин аны кийим салынган пакетке салып туруп, аба киргизбей кургак, салкын жерге түнү менен коюп койсо болот. Эртең менен пакетти ачып, соданы кийимден кагып түшүргүлɵ.Андан соң кийимди бир нече саатка чейин эшикке күнгɵ жайып койгула. Эгерде жыт кетпесе, процедураны кайталагыла; | ||
| + | *Килемдин бетиндеги же дасторкондогу такты соданы уксус менен ɵчүрүп алып, тазалоо керек. Ал үчүн адегенде соданы кир такка себелейбиз, андан соң чүпүрɵктү уксус менен нымдап туруп, ортосунан четти кɵздɵй такты сүрɵбүз. Бул процедураны бир нече жолу кайталап, аягында таза суу менен чайкап коёбуз. | ||
| + | |||
| + | <big>'''Сода менен агартуу'''</big> | ||
| + | |||
| + | Кирди сода менен жууп жана агартууга болобу? Ооба, ал үчүн соданы нашатыр спирти менен аралаштыруу керек. 5 литр таза сууга 5 кашык сода жана 2 кашык нашатыр спиртин кошуу керек. Алынган эритмеге ак түстүү кирлерди 2–3 саатка чейин чылап койгула. Андан кийин гана жуугула. Эгерде чылагандан кийин кирлерди ушул эритмеге кайнатсак, алардын саргыч түсү кетет. | ||
| + | |||
| + | <big>'''Кальцийлештирген сода менен кантип кир жууганга болот?'''</big> | ||
| + | {{center|[[file:Soda-stirka.jpg|400px|Как стирать кальцинированной содой?]]}} | ||
| + | Соданын экинчи түрү–кальцийлештирилген сода, тамак–аш содасына караганда бир канча эффективдүү. Аны турмуш–тиричилик химия бɵлүмдɵрүнɵн сатып алууга болот. Кальцийлештирген соданын колдонулушу: | ||
| + | *Кир жуугуч машинанын тетиктеринен кеберди( накип) жана аны туура эмес пайдалануудан пайда болгон жагымсыз жытты кетирүү үчүн колдонулат. Ал үчүн соданы бирдей ɵлчɵмдɵ суу менен аралаштырып, аралашма менен барабанды жана кир жуугуч каражат салынуучу лотокко салып, 30 мүнɵттɵн кийин чүпүрɵк менен сүрүп коюу керек. Андан кийин автомат машинага кир салбай туруп, «тез жууган» режимде иштеткиле; | ||
| + | *Сууну жакшы жумшартат. Ал үчүн кир жуугуч порошокко 2 чоң кашык сода кошулат (суунун катуулугу жогору болсо, 5 кашыкка чейин кошуу керек). Суунун температурасы 50 градустан тɵмɵн болбошу керек, бул кебердин болушунун да алдын алат. Бирок, жибек жана жүн кийимдерди мындай аралашма менен жууганга болбойт; | ||
| + | *Кирлерди чылап коюу үчүн 3 чоң кашык соданы 40 градуска чейин жылытылган 10 литр сууга кошкула. Эритмеге кийимдерди салып, чылап койгула. 2–3 сааттан кийин жуусаңар болот; | ||
| + | *Ашканадагы майлыктарды таза жууш үчүн тɵмɵнкү эрежени колдонсок болот: бир ууч соданы майдаланган (теркада) кир самын менен аралаштырып, эмаль чаканын жарымынан суу куюп туруп, салып койгула. Самын эригенден кийин, сууга майлыктарды салып, жай отко 20 мүнɵт кайнаткыла. Андан кийин машинада кадимкидей жууп койгула; | ||
| + | *Майлыктагы майдын тактарын кетирүү үчүн соданы ɵсүмдүк майы, агартуучу каражат жана порошок менен аралаштыруу керек. Ар бир ингредиенттен 3 чоң кашыктан алып, чакадагы кайнак сууга салгыла да кир кол арчыгычтарды, майлыктарды салып койгула. Алар суу муздаганча чыланып турсун. Түнү бою калтырып коюуга да болот. Андан соң аларды таза, жылуу сууга чайкагыла да, машинкада жууп койгула. | ||
| + | |||
| + | |||
| + | <big>'''Сода кошулган универсалдык тазалоочу каражат'''</big> | ||
| + | {{center|[[file:Soda-dlya-stirki-i-mytya.jpg|400px|Универсальное чистящее средство с содой]]}} | ||
| + | Идиш–аяктарды жууш үчүн жана сантехниканы тазалоо үчүн каражаттарды ɵзүбүз даярдап алсак да болот. Ал үчүн тɵмɵнкүлɵр керек: | ||
| + | *теркадан ɵткɵрүлгɵн «детское» самыны, | ||
| + | *1 стакан сууну кошуп, аралаштырабыз да, | ||
| + | *дагы бир стакан сууну куюп,250 грамм соданы акырындык менен кошобуз, | ||
| + | *кайрадан аралаштырабыз. | ||
| + | Мындай паста менен акиташты да кетирүүгɵ болот. | ||
| + | |||
| + | |||
| + | <big>'''Сода кошулган башка тазалоочу каражаттар'''</big> | ||
| + | |||
| + | Соданы пайдалануу менен тɵмɵнкүлɵрдү даярдасак болот: | ||
| + | *идиш–аяк жуугуч аралашма; | ||
| + | *кир кетирүүчү гель; | ||
| + | *ваннаны тазалоочу каражат. | ||
| + | Идиш–аяктарды жуучу гелди даярдоо үчүн кир самын (25 грамм), 100 грамм тамак–аш содасы, жарым литр ысык суу, 4 кашык глицерин, бир кашык арак же суюлтулган спиртти даярдап алгыла. Кир самынды теркадан ɵткɵрүп, бир аз суу куйгула да кичине толкундуу мешке (микроволновая печ) койгула. Эритмени аралаштырып, калган сууну акырындык менен куйгула. Самын эригенден кийин муздаткыла да, ага глицеринди, аракты кошуп, аралаштыргыла. Пайда болгон кɵбүктɵрдү башка идишке куюп алып, пайдалана бергиле. | ||
| + | |||
| + | Кир кетирүүчү гелди даярдоо үчүн 1 литр суу, 50 грамм теркадан ɵткɵрүлгɵн кир самын жана 45 грамм кальцийлештирилген сода керектелет. Кайнап жаткан сууга майдаланган самынды салып, жакшылап аралаштыргыла. Андан кийин аралашмага соданы кошуп койгула. 5 килограмм кир кийимдерди жууганга 2 чоң кашык гелди барабанга куюп, кир жуусаңар болот. | ||
| + | |||
| + | Ваннаны тазалоочу каражатты даярдоо үчүн аралашмага жарым стакан сода, суюк самын жана 5 тамчы розмариндин же лаванданын майы кошулат. Соданы самын менен аралаштырып, майды кошкула. Аралашма кургап кетпеши үчүн ага бир чай кашык глицерин кошуп, идиштин оозун бекем жаап коюу керек. | ||
| + | |||
| + | {{center|'''Мына ошентип, кийимдерди сода менен жууганга болобу деген суроого: ооба болот деп жооп беребиз.Соданы пайдалануу менен ар түрдүү тактарды жеңил эле кетиребиз жана ар кандай кымбат каражаттарды сатып албай, акчаны экономдосок да болот экен.'''}} | ||
| + | </div> | ||
| + | <div class="sbstyle" style="margin-top:20px;"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Суу дүйнɵсү</div> | ||
| + | </div> | ||
| + | |||
| + | Бүт дүйнɵ жүзүндɵ 22 мартта '''Суу ресурстарынын күнү''' белгиленет. Бул майрам Бириккен Улуттар Уюмунун Генералдык Ассамблеясынын чечими менен, жалпы адамзатка айлана– чɵйрɵгɵ жана коомдун ɵнүгүшү үчүн суу ресурстарынын маанилүүлүгүн эстетүү максатында белгиленген. | ||
| + | |||
| + | Азыркы мезгилде биздин планетанын территориясынын 70% суудан турат. Бирок, бул суунун 1% гана ичүүгɵ болот. Жыл ɵткɵн сайын суу ресурстарынын проблемалары күчɵɵдɵ. Акыркы 50 жылда гана суу менен байланышкан 507 чыр–чатак болуп, анын 21 согушка алып келген. Суу – планетадагы эң жɵнɵкɵй зат. Бирок, ошол эле учурда сууда, бизге белгисиз болгон табышмактар да бар. Окумуштуулар азыркыга чейин сууну изилдеп, кызыктуу кɵп фактыларды табышууда. | ||
| + | |||
| + | {{center-p|[[file:Voda-ch.jpg|300px|Водный мир]]}} | ||
| + | <big>'''Силер билесиңерби'''</big> | ||
| + | |||
| + | '''эң таза суунун Финляндияда экендигин?''' | ||
| + | |||
| + | ЮНЕСКОнун маалыматы боюнча, эң таза суу Финляндияда экен. Алар 122 ɵлкɵнүн табийгый таза сууларын изилдеген. Ал эми дүйнɵ жүзү боюнча 1 млрд адамдын таза сууну колдонууга мүмкүнчүлүгү таптакыр жок экен. | ||
| + | |||
| + | '''муз ысык суудан тез алынабы?''' | ||
| + | |||
| + | Эгерде логикалык жактан ойлоп кɵрсɵк, муз албетте, муздак суудан алынат. Ысык суу биринчи муздашы, анан тоңушу керек, ал эми муздак сууну ошол замат эле тоңдурабыз.Бирок, тажрыйбаларда кɵрсɵткɵндɵй, ысык суу музга тез айланат экен. | ||
| + | |||
| + | Эмне үчүн ысык суунун муздак сууга караганда тез тоңо тургандыгынын себеби, азыркыга чейин белгисиз. Балким, себеби муздатууда, буулантууда, муздун пайда болушунда эмес, суюлтулган газдардын ысык жана муздак сууга тийгизген таасириндедир. | ||
| + | {{center-p|[[file:Lednik ch.jpg|300px|Ледники в океане]]}} | ||
| + | |||
| + | |||
| + | '''суунун ɵтɵ катуу тоңо тургандыгын? ''' | ||
| + | |||
| + | Суунун 0 градуста тоңуп, 100 градуста кайнай тургандыгы физика курсунан бардыгына белгилүү. Бирок, кээ бир суулардын андан да тɵмɵнкү температурада гана тоңо тургандыгы айтылып жүрɵт. Мындай касиетке аралашмасы жок эң таза суу ээ болот. 0 градуска чейин муздатса да, мындай суу суюк абалда калат. Белгилүү бир тɵмɵнкү температурада гана суу музга айланат же кайнайт экен. | ||
| + | |||
| + | '''суунун 3 кɵп агрегаттык абалы бар экендигин?''' | ||
| + | |||
| + | Суунун үч агрегаттык абалда: суюк, катуу жана газ абалда болоору бардыгыбызга белгилүү. Бирок, окумуштуулар суунун 5 суюк абалы жана 14 тоңгон катуу абалы бар экендигин белгилешкен. | ||
| + | Эгерде тоңгон таза сууну дагы муздата берсек эмне болот? Сууда укмуштуудай айлануулар башталат. Цельсий шкаласы боюнча минус 120 градуста суу ɵтɵ илээшкек, созулгуч болсо, ал эми минус 135 градуста суу '''айнектей''' абалга келет. «Айнек»суу – бул кристаллдык түзүлүшкɵ ээ эмес, айнектей катуу зат. | ||
| + | </div> | ||
| + | <div class="sbstyle" style="margin-top:20px;"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Ар түрдүү кар бүртүкчɵлɵрү</div> | ||
| + | </div> | ||
| + | <big>'''Эл аралык классификация боюнча кардын түрлɵрү'''</big> | ||
| + | |||
| + | <small style="color:grey;">© А. К. Дюнин, В царстве снега, Издательство «Наука», Новосибирск, 1983</small> | ||
| + | <ul class="example-orbit" data-orbit data-options="animation:slide; pause_on_hover:true;animation_speed:500;navigation_arrows:true; resume_on_mouseout: true; timer_speed:4500;"> | ||
| + | <li class="active"> | ||
| + | [[Image:Sn1.jpg|Пластинки]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Пластинки'''<br> | ||
| + | <small>Самые простые из снежинок — плоские шестиугольные призмы.</small> | ||
| + | </div> | ||
| + | </li> | ||
| + | <li> | ||
| + | [[Image:Sn2.jpg|Звезды]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Звезды'''<br> | ||
| + | <small>Как и пластинки, звезды обычно плоские и тонкие, с шестью лучами.</small> | ||
| + | </div> | ||
| + | </li> | ||
| + | <li> | ||
| + | [[Image:Sn3.jpg|Столбики]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Столбики'''<br> | ||
| + | <small>Полые внутри, могут иметь форму карандаша.</small> | ||
| + | </div> | ||
| + | </li> | ||
| + | <li> | ||
| + | [[Image:Sn4.jpg|Иглы]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Иглы'''<br> | ||
| + | <small>Длинные и тонкие кристаллы, иногда состоят из нескольких веточек.</small> | ||
| + | </div> | ||
| + | </li> | ||
| + | <li> | ||
| + | [[Image:Sn5.jpg|Пространственные дендриты]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Пространственные дендриты'''<br> | ||
| + | <small>Объемные снежинки, образуются при срастании нескольких кристаллов.</small> | ||
| + | </div> | ||
| + | </li> | ||
| + | <li> | ||
| + | [[Image:Sn6.jpg|Увенчанные столбики]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Увенчанные столбики'''<br> | ||
| + | <small>Образуются в случае, если столбики попадают в иные условия, и кристаллы меняют направление роста.</small> | ||
| + | </div> | ||
| + | </li> | ||
| + | <li> | ||
| + | [[Image:Sn7.jpg|Неправильные кристаллы]] | ||
| + | <div class="orbit-caption-sn"> | ||
| + | '''Неправильные кристаллы'''<br> | ||
| + | <small>Самый распространенный тип. Образуется при повреждении снежинки.</small> | ||
| + | </div> | ||
| + | </li> | ||
| + | </ul> | ||
| + | <small style="color:grey;">© Kichigin | Shutterstock.com</small> | ||
| + | </div> | ||
| + | </div> | ||
{{lang|Химия: Электролитическая диссоциация}} | {{lang|Химия: Электролитическая диссоциация}} | ||
Версия 15:08, 3 мая 2018
Содержание
- 1 Электролиттер жана электролит эместер
- 2 Электролиттик диссоциация теориясы
- 3 Диссоциациянын механизми
- 4 Кислоталардын, негиздердин жана туздардын диссоциациясы
- 5 Диссоциация даражасы
- 6 Ион алмашуу реакциясы
- 7 Суунун иондук туундусу. Эритменин pH кɵрсɵткүчү
- 8 Туздардын гидролизи (суунун ажырашы)
- 9 Буфердик эритмелер
- 10 Гидролиздин мааниси жана колдонулушу
- 11 Пайдалуу шилтемелер
- 12 Глоссарий
- 13 Библиография
Электролиттер жана электролит эместер
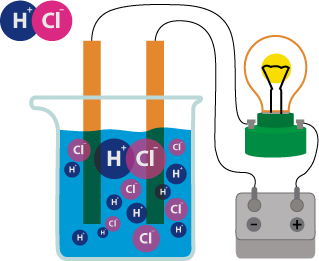
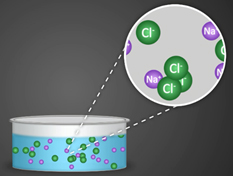
Кээ бир заттардын эриген же балкыган абалда электр тогун ɵткɵрɵ тургандыгы, ал эми башкалары ушундай эле шартта электр тогун ɵткɵрбɵй тургандыгы белгилүү. Муну биз жɵнɵкɵй эле куралдын жардамы менен байкасак болот.
Ал электр тогу менен байланыштырылган кɵмүр электроддорунан турат. Чынжырга токтун бар же жок экендигин кɵрсɵтүүчү электр лампочкасы да туташтырылган. Эгерде электродду канттын эритмесине салсак, анда лампочка күйбɵйт. Ал эми электродду натрий хлоридинин эритмесине салсак, ал жарык болуп күйɵт. Эритмелери же балкыган эритиндилери электр тогунун таасири астында иондорго ажыраган заттар электролиттер деп аталат. Эритмелери электр тогунун таасири астында иондорго ажырабаган заттар электролит эместер деп аталат. Электролиттерге кислоталар, негиздер жана бардык туздар кирет, ал эми электролит эместерге кɵпчүлүк органикалык заттар кирет.
Электролиттик диссоциация теориясы
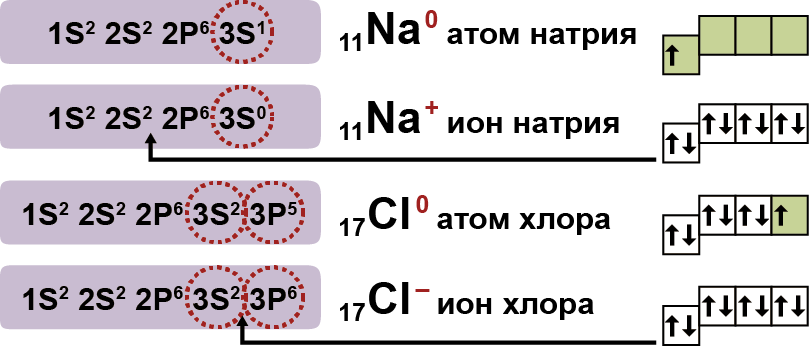
Электролиттердин эритмелеринин ɵзгɵчɵлүгүн түшүндүрүү максатында, 1887-жылы швед окумуштуусу С. Аррениус электролиттик диссоциация теориясын сунуш кылган. Кийинчерээк бул теория атомдордун түзүлүшү жана химиялык байланыштар жɵнүндɵгү окуунун негизинде, окумуштуулар тарабынан ɵнүктүрүлгɵн. Бул теориянын учурдагы мазмууну тɵмɵнкү үч жободо берилген:
1. Электролиттер сууда эригенде иондорго-оң жана терс ионго ажырашат (диссоциацияланат). Иондор атомго караганда туруктуу болгон электрондук абалда болушат.
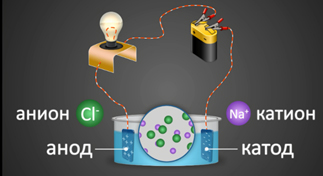
Алар бир эле атомдон турушу мүмкүн, бул- жɵнɵкɵй иондор (Na+, Mg2+, Аl3+ и т.д.)болушат. Же болбосо, бир нече атомдон турушу мүмкүн, бул – татаал иондор (NО3–, SO42– , РО43– ж.б.).
2. Электр тогунун таасири астында иондор багыттуу кыймылга келишет: оң заряддалган иондор катодго тартылат, терс заряддалган иондор анодго тартылат. Ошондуктан, оң заряддалган иондор-катиондор деп, терс заряддалган иондор–аниондор деп аталат. Иондордун багыттуу кыймылы алардын карама–каршы заряддалган электроддорго тартылуусунан келип чыгат.
3. Диссоциация – кайталанма процесс: молекулалардын иондорго ажырашы (диссоциация) менен катар эле иондордун биригүүсү (ассоциация) жүрүп турат. Ошондуктан, электролиттик диссоциациянын теңдемесинде барабардыктын ордуна карама–каршы багытталган жебелер (стрелка) жазылат. Мисалы:
Диссоциациянын механизми
- Электролиттик диссоциациянын механизмин карап кɵрɵлү. Иондук байланыш менен байланышкан заттар жеңил диссоциацияланат, себеби, бул заттар иондордон турат. Алар эригенде, суунун диполу оң жана терс заряддалган иондордун айланасына багыт алат. Иондор менен суунун диполунун ортосунда тартылуу күчү пайда болот. Жыйынтыгында, иондордун ортосундагы байланыш начарлайт да, иондор кристаллдан эритмеге ɵтүшɵт.
Кислоталардын, негиздердин жана туздардын диссоциациясы
Электролиттик диссоциация теориясынын негизинде кислоталарга, негиздерге жана туздарга аныктама берилип, касиеттери белгиленет.
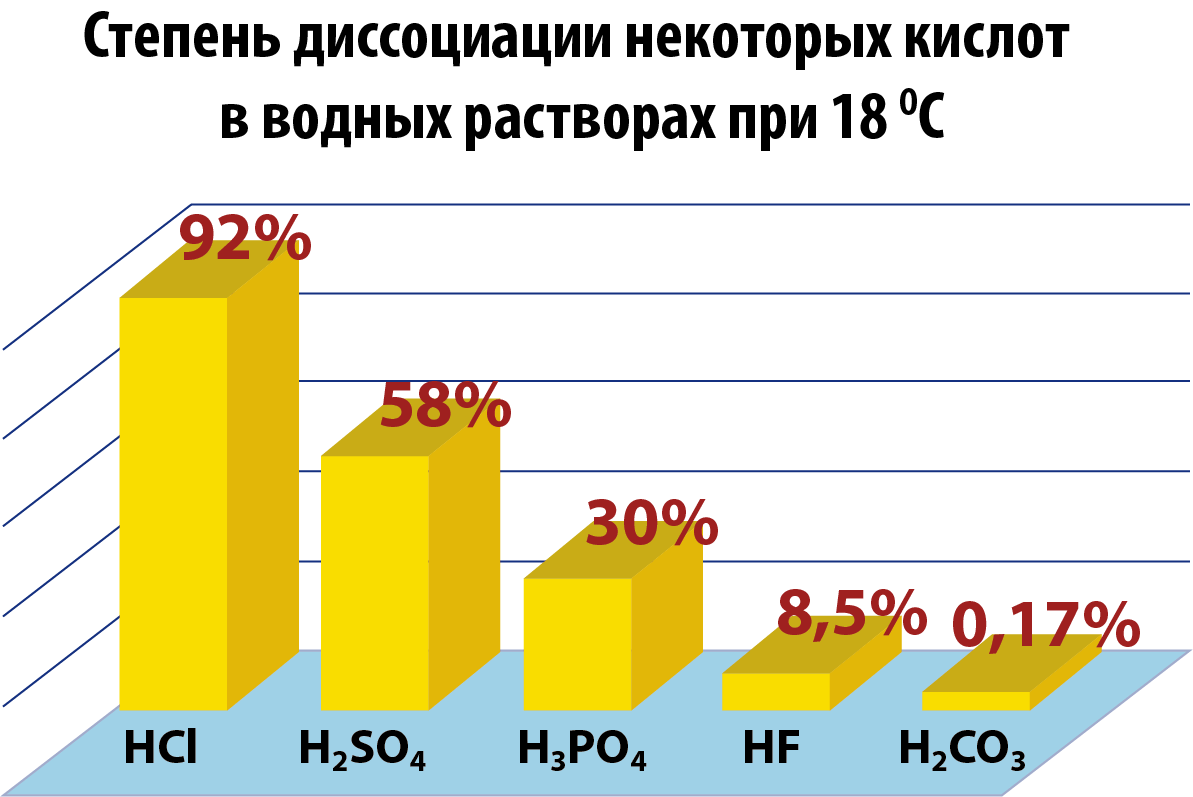
Кɵп негиздүү кислоталардын диссоциациясы биринчи баскычта жакшы жүрɵт, экинчи баскычта азыраак, ал эми үчүнчүдɵ бир аз гана жүрɵт. Ошондуктан, фосфор кислотасы диссоциацияланганда, H3РO4 молекуласынан башка иондорго да ажырайт (акырындык саны менен азаят).
| H3РO4 |
дигидрофосфат иону; (биринчи баскыч) |
| H2РO4– |
гидрофосфат иону; (экинчи баскыч) |
| РO42– |
фосфат иону; (үчүнчү баскыч) |
Диссоциация даражасы
Электролиттик диссоциация – кайталанма процесс болгондуктан, электролиттердин эритмесинде иондордон сырткары молекулалар да болот. Ошондуктан, электролиттердин эритмеси диссоциация даражасы менен мүнɵздɵлɵт (грек тамгасы альфа α менен белгиленет.). Диссоциация даражасы – бул иондорго ажыраган молекулардын санынын Ni молекуланын жалпы санына N болгон катышына барабар:
Электролиттердин диссоциация даражасы пайыздар менен туюнтулат. Эгерде α = 0 болсо, анда диссоциациянын болбогондугун билдирет, α = 1 же 100% болсо, анда электролит иондорго толугу менен ажырайт. Эгер α = 20% болсо, анда берилген электролиттин 100 молекуласынын 20 гана иондорго ажырагандыгын билдирет.
- Ар түрдүү электролиттердин диссоциация даражасы да ар башка болот. Тажрыйба кɵргɵзгɵндɵй, диссиоциация даражасы электролиттердин концентрациясынан жана температурадан кɵз каранды болот.
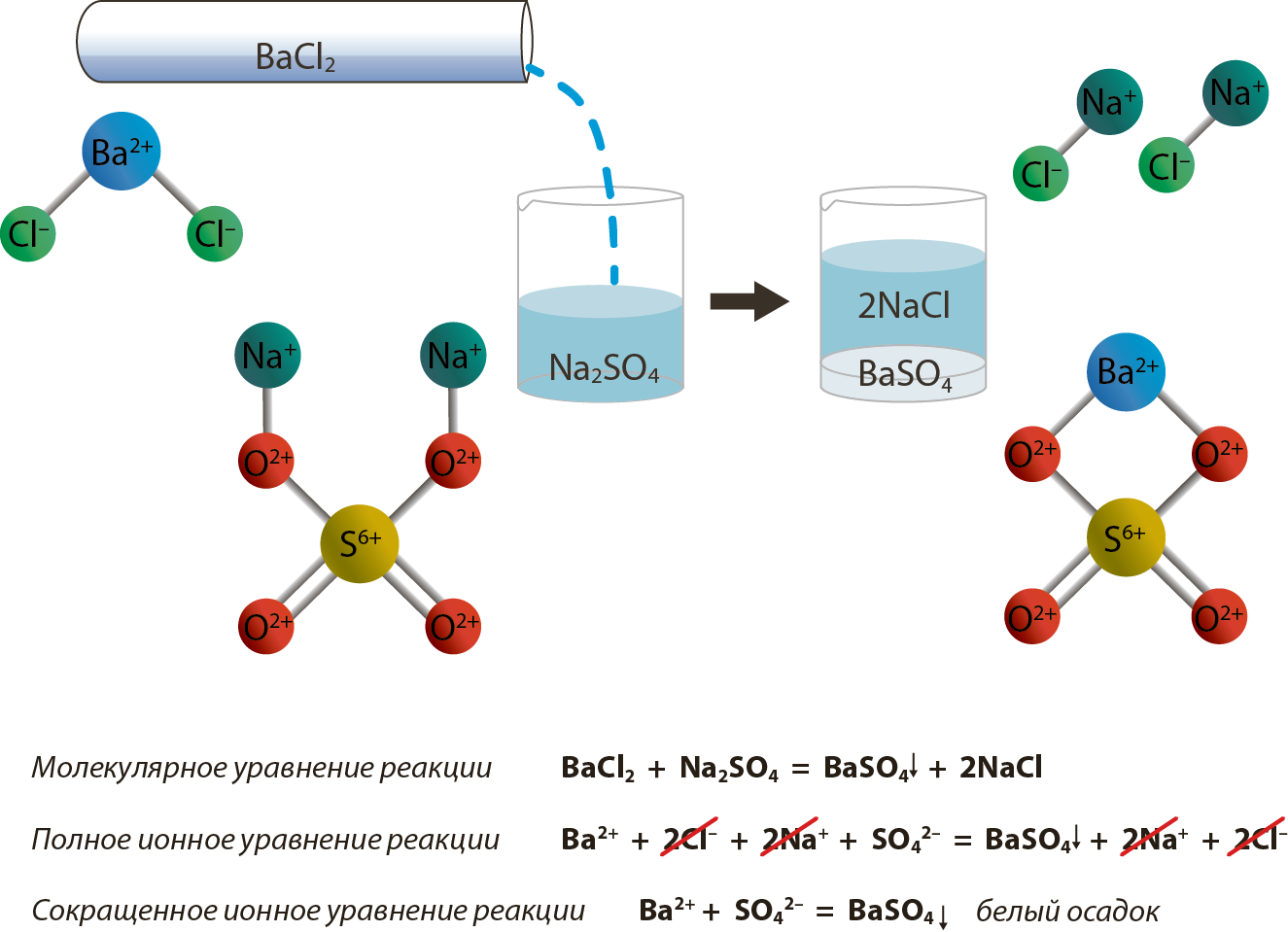
Ион алмашуу реакциясы
Электролиттик диссоциация теориясына ылайык, электролиттердин ортосунда жүргɵн бардык реакциялар иондук реакция болуп саналат. Алар иондук реакция деп, ал эми бул реакциялардын теңдемелери иондук теңдеме деп аталат. Алар молекулалык түрдɵ жазылган реакцияларга караганда жɵнɵкɵйүрɵɵк болушат.
Теңдемени жазганда, формуланын жанына ↓ белгиси коюлса, анда бул заттын чɵкмɵ түрүндɵ чɵккɵнүн билдирет. Ал эми ↑ белги заттын газ абалында бɵлүнүп чыккандыгын билдирет.
-
Күчтүү электролиттер толугу менен диссоциациялангандыктан, ион түрүндɵ жазылат. Теңдеменин сол жагындагы заряддардын суммасы оң жактагы заряддардын суммасына барабар болушу керек. Бул жоболорду бышыктоо үчүн мисалды карап кɵрɵлү.
Мисалы:
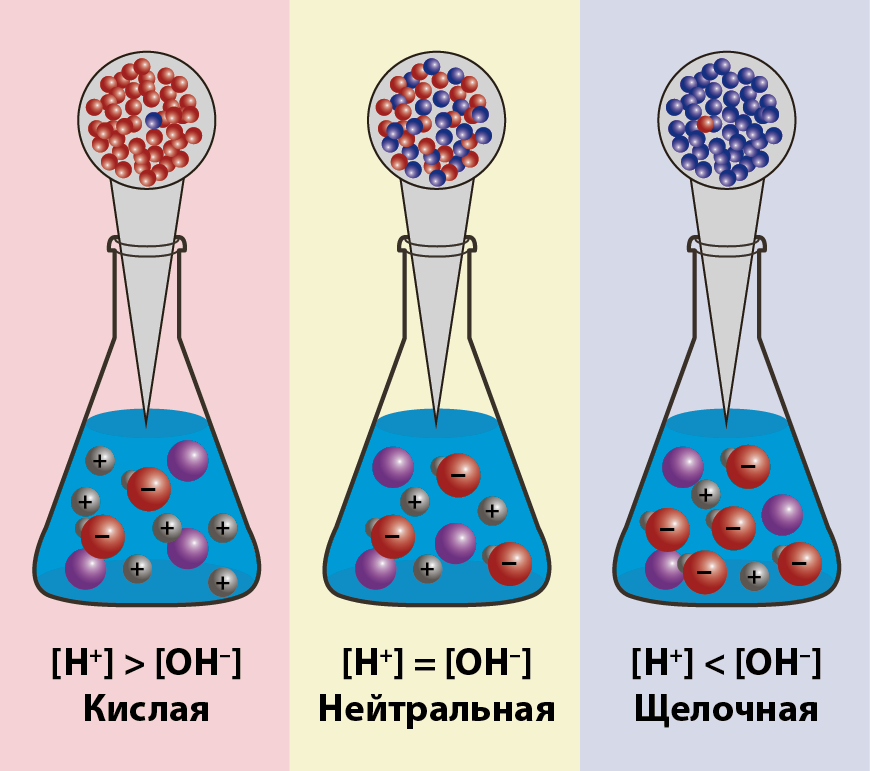
Суунун иондук туундусу. Эритменин pH кɵрсɵткүчү
-
Суунун молекуласынын концентрациясынын диссоциация даражасы тɵмɵнкү маанини кɵрсɵтүү менен турактуу чоңдук (1000 г/л)/(18 г/моль) = 55,56 моль/л. болуп саналат.
20 – 25 °C суунун диссоциация константасы 1,8•10−16 моль/л. барабар болот. Суу начар электролит (амфолит) болгондуктан, анын диссоциясынын константасын–суунун диссоциацияланышын жазып кɵрɵлү.
K•[H2O] = [H+] [OH–]
Кɵрсɵткүчтү белгилейбиз K•[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль2/л2 = [H+]·[OH−] (25 °C температурада).
Туздардын гидролизи (суунун ажырашы)
Туздардын гидролизи – бул туздар менен суунун ортосундагы алмашуу реакциялары.Туз эритмеде диссоциацияланганда, анын иондору суунун молекуласы менен аракеттенишет.
Гидролиздин жыйынтыгында, диссоциацияланбаган, начарыраак, бирок, гидролизденген тузга караганда туруктуу болгон электролит алынат. Гидролиз гидролизге учураган туз начар кислотадан же начар негизден пайда болгон учурда ишке ашат Гидролиз – бул нейтралдашуу процессине карама–каршы жүргɵн процесс.
Гидролиз суюлтулган эритмелерде ылдам жана аягына чейин жүрɵт.
Диссоциация даражасына карата бардык кислоталар жана эрүүчү негиздер (щелочтор) күчтүү жана начар болуп, экиге бɵлүнүшɵт.
Күчтүү кислоталар: HClO4, HClO3, H2SO4, HNO3, HI, HBr, HCl.
Күчтүү негиздер (щелочтор): CsOH, RbOH, KOH, NaOH, LiOH, Ba(OH)2, Sr(OH)2, Ca(OH)2.
1) Күчтүү кислотадан жана күчтүү негизден пайда болгон туздар гидролизге учурабайт. Сууда эригенде алар толугу менен оң заряддалган катиондорго жана терс заряддалган аниондорго диссоциацияланат.
2) Күчтүү кислотадан жана начар негизден пайда болгон туздар кычкыл чɵйрɵнү рН≤7 пайда кылуу менен гидролизденет.
I баскыч:
CuCl2+HOH![]() Cu(OH)Cl+HCl
Cu(OH)Cl+HCl
Cu2+ + 2Cl– + HOH![]() CuOH+ + Cl– + H+ + Cl–
CuOH+ + Cl– + H+ + Cl–
Cu2++HOH![]() CuOH+ + H+
CuOH+ + H+
(рН < 7)
II баскыч
Cu(OH)Cl + HOH ![]() Cu(OH)2↓ + HCl
Cu(OH)2↓ + HCl
CuOH+ + Cl– + HOH ![]() Cu(OH)2↓ + H+ + Cl–
Cu(OH)2↓ + H+ + Cl–
CuOH+ + HOH ![]() Cu(OH)2↓ +H+
Cu(OH)2↓ +H+
(pH ≤ 7) – кислая среда
3) Күчтүү негизден жана начар кислотадан пайда болгон туздар щелочтуу чɵйрɵнү рН≥7 пайда кылуу менен гидролизденет.
I баскыч
K2S + HOH ![]() KHS + KOH
KHS + KOH
2K+ + S2– + HOH ![]() K+ + HS– + K+ + OH–
K+ + HS– + K+ + OH–
S2– +HOH ![]() HS– + OH–
HS– + OH–
(рН > 7)
II баскыч
KHS + HOH ![]() H2S↑ + KOH
H2S↑ + KOH
K+ + HS– + HOH ![]() H2S↑ + K+ + OH–
H2S↑ + K+ + OH–
HS– + HOH ![]() H2S↑ + OH–
H2S↑ + OH–
(pH ≥ 7) – щелочтуу чɵйрɵ
4) Начар кислотадан жана начар негизден пайда болгон туздар, эгер туз эрүүчү туз болсо гана, гидролизденет. Адатта мындай туздар:
- сууда эрибейт
- эриткенде ажырап кетет
2NH4+ + S2– ![]() 2NH3↑ + H2S↑
2NH3↑ + H2S↑
- Гидролизге учураганда, начар негиз жана начар кислота пайда болот.
CH3COONH4 + HOH ![]() CH3COOH + NH4OH
CH3COOH + NH4OH
CH3COO– + NH4+ + HOH ![]() CH3COOH + NH4OH
CH3COOH + NH4OH
Уксус кислотасынын диссоциация константасы CH3COOH = 1,8·10-5 барабар болот, ал эми аммоний гидроксидинин диссоциация константасы да NH4OH = 1,8·10-5 барабар болот. Б.а. бул заттардын сандык кɵрсɵткүчтɵрүнүн бири–бирине барабар болгондугу, аммоний ацетаты гидролизденгенде нейтралдуу чɵйрɵнүн алынгандыгын кɵрсɵтɵт.
Ошондой эле кɵпкɵ чейин сактаганда, газ абалындагы зат катары аммиактын учмалыгын да белгилɵɵгɵ болот.
Туздардын гидролизи баскыч менен жүрүшү мүмкүн. Баскычтардын саны туздун курамындагы металлдын же кислота калдыгынын валенттүүлүгүнɵ барабар болот.
1–Мисал
I баскыч:
Na3PO4 + HOH ![]() Na2HPO4 + NaOH
Na2HPO4 + NaOH
3Na+ + PO43– + HOH ![]() 2Na+ + HPO42– + Na+ + OH–
2Na+ + HPO42– + Na+ + OH–
PO43– + HOH ![]() HPO42– + OH–
HPO42– + OH–
II баскыч
Na2HPO4 + HOH ![]() NaH2PO4 + NaOH
NaH2PO4 + NaOH
2Na+ + HPO42–+HOH ![]() Na+ + H2PO4– + Na+
+ OH–
Na+ + H2PO4– + Na+
+ OH–
HPO42– + HOH ![]() H2PO4– + OH–
H2PO4– + OH–
III баскыч Реакция жүрбɵйт,себеби, НРО4 – начар электролит болуп саналат.
2–Мисал
I баскыч
Al2(SO4)3 + 2HOH ![]() 2Al(OH)SO4+H2SO4
2Al(OH)SO4+H2SO4
2Al3+ + 3SO42– + 2HOH ![]() 2AlOH2+ + 2SO42– + 2H+ + SO42–
2AlOH2+ + 2SO42– + 2H+ + SO42–
2Al3+ + 2HOH ![]() 2AlOH2+ + 2H+
2AlOH2+ + 2H+
II баскыч
2Al(OH)SO4 + 2HOH ![]() [Al(OH)2]2SO4 + H2SO4
[Al(OH)2]2SO4 + H2SO4
2AlOH2+ + 2SO42– + 2HOH ![]() 2Al(OH)2+ + SO42– + 2H+ + SO42–
2Al(OH)2+ + SO42– + 2H+ + SO42–
2AlOH2+ + 2HOH ![]() 2Al(OH)2+ + 2H+
2Al(OH)2+ + 2H+
III баскыч
[Al(OH)2]2SO4 + 2HOH ![]() 2Al(OH)3↓ + H2SO4
2Al(OH)3↓ + H2SO4
2Al(OH)2+ + SO42– + 2HOH ![]() 2Al(OH)3↓ + 2H+ + SO42–
2Al(OH)3↓ + 2H+ + SO42–
2Al(OH)2+ + 2HOH ![]() 2Al(OH)3↓ + 2H+
2Al(OH)3↓ + 2H+
III баскычта реакция жүрбɵйт, себеби алынган зат кайра баштапкы заттарга ажырап, суутектин иондорунун ɵзүнчɵ топтолуусуна алып келет. Бирок, эритмени суюлтуу жана температураны жогорулатуу менен гидролиздин жүрүшүн күчɵтүүгɵ болот. Ошондуктан, гидролиз III баскычта да жүрүшү мүмкүн.
Ошентип, туздар эрүүчү болсо,алар күчтүү жана начар компоненттерден (катион же анион) пайда болсо, анда гидролизденет. Туздун курамында щелочтон алынган күчтүү катион болсо, гидролизден кийин щелочтуу чɵйрɵ түзүлɵт. Эгерде туз күчтүү кислотадан жана начар негизден пайда болсо, анда күчтүү анион гидролизден кийин кычкыл чɵйрɵнүн түзүлүшүнɵ алып келет. Б.а. «Ким күчтүү болсо, ошонуку туура!» деген эреже сакталат.
Туздардын эригичтүүлүгүнүн ɵзгɵртүлгɵн таблицасы, гидролизден кийинки рН чɵйрɵнү аныктоого багытталган.
HOH
Гидроксид водорода, соединение гидроксильной группы OH– и катиона H+
CsOH
Гидроксид цезия – сильнейшее основание.
RbOH
Гидроксид рубидия, является одним из наиболее сильных оснований.
KOH
Гидроксид калия. Сильное основание.
NaOH
Гидроксид натрия. Сильное основание.
LiOH
Гидроксид лития. Сильное основание.
Ba(OH)2
Гидроксид бария. Сильное основание.
Sr(OH)2
Гидроксид стронция. Сильное основание.
Ca(OH)2
Гидроксид кальция. Сильное основание.
NH4OH
Гидроксид аммония. Сильное основание.
Mg(OH)2
Гидроксид магния. Слабое основание. Не растворяется в воде.
Al(OH)3
Гидроксид алюминия. Слабое основание. Не растворяется в воде.
Mn(OH)2
Гидроксид марганца. Слабое основание. Не растворяется в воде.
Zn(OH)2
Гидроксид цинка. Слабое основание. Не растворяется в воде.
Cr(OH)3
Гидроксид хрома. Слабое основание. Не растворяется в воде.
Fe(OH)2
Гидроксид железа (II). Слабое основание. Не растворяется в воде.
Fe(OH)3
Гидроксид железа (III). Слабое основание. Не растворяется в воде.
Co(OH)2
Гидроксид кобальта. Слабое основание. Не растворяется в воде.
Ni(OH)2
Гидроксид никеля. Слабое основание. Не растворяется в воде.
Pb(OH)2
Гидроксид свинца. Слабое основание. Малорастворим в воде.
Cu(OH)2
Гидроксид меди. Слабое основание. Не растворяется в воде.
Hg(OH)2
Не существует в водном растворе.
Ag(OH)
Не существует.
HClO4
Хлорная кислота. Cильный окислитель, так как содержит хлор в высшей степени окисления +7.
CsClO4
Перхлорат цезия. Слабо растворим в воде примерно 2 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
RbClO4
Перхлорат рубидия. Слабо растворим в воде.
Диссоциирует, образуя нейтральную среду.
KClO4
Перхлорат калия. Слабо растворим в воде примерно 2,1 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
NaClO4
Перхлорат натрия. Хорошо растворяется в воде примерно 211 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
LiClO4
Перхлорат лития. Растворим в воде примерно 58 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
Ba(ClO4)2
Перхлорат бария. Хорошо растворяется в воде примерно 340 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
Sr(ClO4)2
Перхлорат стронция. Нет данных.
Диссоциирует, образуя нейтральную среду.
Ca(ClO4)2
Перхлорат кальция. Хорошо растворяется в воде примерно 188 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
NH4ClO4
Перхлорат аммония. Хорошо растворяется в воде примерно 24,5 гр на 100 мл при температуре 25oC.
Диссоциирует, образуя нейтральную среду.
Mg(ClO4)2
Перхлорат магния. Хорошо растворяется в воде примерно 52 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al(ClO4)3
Перхлорат алюминия. Хорошо растворяется в воде примерно 135 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Mn(ClO4)2
Перхлорат марганца. Хорошо растворяется в воде примерно 52 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Zn(ClO4)2
Перхлорат цинка. Хорошо растворяется в воде примерно 112 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr(ClO4)3
Перхлорат хрома. Хорошо растворяется в воде примерно 133 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(ClO4)2
Перхлорат железа (II). Хорошо растворяется в воде примерно 300 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(ClO4)3
Перхлорат железа (III). Хорошо растворяется в воде примерно 395 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Co(ClO4)2
Перхлорат кобальта. Хорошо растворяется в воде примерно 110 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Ni(ClO4)2
Перхлорат никеля. Хорошо растворяется в воде примерно 111 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Pb(ClO4)2
Перхлорат свинца. Хорошо растворяется в воде примерно 80 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cu(ClO4)2
Перхлорат меди. Хорошо растворяется в воде примерно 150 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Hg(ClO4)2
Перхлорат ртути (II). Хорошо растворяется в воде примерно 290 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AgClO4
Перхлорат серебра. Хорошо растворяется в воде примерно 557 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HClO3
Хлорноватая кислота. сильная кислота, в которой хлор имеет степень окисления +5.
Заменить.
CsClO3
Хлорат цезия. Растворяется в воде примерно 9 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
RbClO3
Хлорат рубидия. Растворяется в воде примерно 7 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
KClO3
Хлорат калия. Растворяется в воде примерно 8 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
NaClO3
Хлорат натрия. Хорошо растворяется в воде примерно 100 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
LiClO3
Хлорат лития. Хорошо растворяется в воде примерно 400 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Ba(ClO3)2
Хлорат бария. Растворяется в воде примерно 37 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Sr(ClO3)2
Хлорат стронция. Хорошо растворяется в воде примерно 185 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Ca(ClO3)2
Хлорат кальция. Хорошо растворяется в воде примерно 218 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
NH4ClO3
Хлорат аммония. Растворяется в воде примерно 30 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Mg(ClO3)2
Хлорат магния. Хорошо растворяется в воде примерно 145 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al(ClO3)3
Хлорат алюминия. Растворяется в воде примерно 77 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Mn(ClO3)2
Хлорат марганца. Нет данных
В результате гидролиза, образуется кислая среда.
Zn(ClO3)2
Хлорат цинка. Хорошо растворяется в воде примерно 218 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr(ClO3)3
Хлорат хрома. Хорошо растворяется в воде примерно 142 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(ClO3)2
Хлорат железа (II). Хорошо растворяется в воде примерно 210 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(ClO3)3
Хлорат железа (III). Нет данных
В результате гидролиза, образуется кислая среда.
Co(ClO3)2
Хлорат кобальта. Хорошо растворяется в воде примерно 185 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Ni(ClO3)2
Хлорат никеля. Хорошо растворяется в воде примерно 145 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Pb(ClO3)2
Хлорат свинца. Хорошо растворяется в воде примерно 144 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cu(ClO3)2
Хлорат меди. Хорошо растворяется в воде примерно 250 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Hg(ClO3)2
Хлорат ртути. Растворяется в воде примерно 25 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AgClO3
Хлорат серебра. Растворяется в воде примерно 18 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
H2SO4
Серная кислота. сильная кислота, отвечающая высшей степени окисления серы (+6)
Cs2SO4
Сульфат цезия. Хорошо растворяется в воде примерно 180 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Rb2SO4
Сульфат рубидия. Растворяется в воде примерно 51 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
K2SO4
Сульфат калия. Растворяется в воде примерно 12 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Na2SO4
Сульфат натрия. Растворяется в воде примерно 30 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
Li2SO4
Сульфат лития. Растворяется в воде примерно 34 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
BaSO4
Сульфат бария. Не растворяется в воде.
SrSO4
Сульфат стронция. Плохо растворяется в воде, примерно 0,013 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
CaSO4
Сульфат кальция. Плохо растворяется в воде, примерно 0,26 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
(NH4)2SO4
Сульфат аммония. Хорошо растворяется в воде, примерно 118 гр на 100 мл при температуре 25oC.
Диссоциирует. Образует нейтральную среду.
MgSO4
Сульфат магния. Растворяется в воде, примерно 36 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al2(SO4)3
Сульфат алюминия. Растворяется в воде, примерно 37 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
MnSO4
Сульфат марганца. Хорошо растворяется в воде, примерно 63 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
ZnSO4
Сульфат цинка. Хорошо растворяется в воде, примерно 57 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr2(SO4)3
Сульфат хрома. Хорошо растворяется в воде, примерно 220 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
FeSO4
Сульфат железа (II). Хорошо растворяется в воде, примерно 53 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe2(SO4)3
Сульфат железа (III). Очень хорошо растворяется в воде, примерно 440 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CoSO4
Сульфат кобальта. Растворяется в воде, примерно 39 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
NiSO4
Сульфат никеля. Растворяется в воде, примерно 45 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
PbSO4
Сульфат свинца. Не растворяется в воде.
CuSO4
Сульфат меди. Растворяется в воде, примерно 22 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HgSO4
Сульфат ртути. Почти не растворим.
Гидролизуется большим количеством воды, образуя кислую среду.
Ag2SO4
Сульфат серебра. Плохо растворяется в воде, примерно 0,84 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HNO3
Азотная кислота. Cильный окислитель. Нитрат-ион в воде не гидролизуется.
CsNO3
Нитрат цезия. Растворяется в воде, примерно 28 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
RbNO3
Нитрат рубидия. Хорошо растворяется в воде, примерно 70 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
KNO3
Нитрат калия. Растворяется в воде, примерно 38 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NaNO3
Нитрат натрия. Хорошо растворяется в воде, примерно 90 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
LiNO3
Нитрат лития. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Ba(NO3)2
Нитрат бария. Растворяется в воде, примерно 10 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Sr(NO3)2
Нитрат стронция. Растворяется в воде, примерно 74 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Ca(NO3)2
Нитрат кальция. Хорошо растворяется в воде, примерно 140 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NH4NO3
Нитрат аммония. Хорошо растворяется в воде, примерно 212 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Mg(NO3)2
Нитрат магния. Растворяется в воде, примерно 72,7 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al(NO3)3
Нитрат алюминия. Растворяется в воде, примерно 78 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Mn(NO3)2
Нитрат марганца. Хорошо растворяется в воде, примерно 140 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Zn(NO3)2
Нитрат цинка. Хорошо растворяется в воде, примерно 130 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr(NO3)3
Нитрат хрома. Хорошо растворяется в воде, примерно 145 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(NO3)2
Нитрат железа (II). Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(NO3)3
Нитрат железа (III). Хорошо растворяется в воде, примерно 160 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Co(NO3)2
Нитрат кобальта. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Ni(NO3)2
Нитрат никеля. Хорошо растворяется в воде, примерно 98 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Pb(NO3)2
Нитрат свинца. Растворяется в воде, примерно 56,5 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cu(NO3)2
Нитрат меди. Хорошо растворяется в воде, примерно 145 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Hg(NO3)2
Нитрат ртути. Растворим в кислых водных растворах.
В результате гидролиза, образуется кислая среда.
AgNO3
Нитрат серебра. Хорошо растворяется в воде, примерно 250 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HI
Иодоводородная кислота. Сильный окислитель.
CsI
Иодид цезия. Хорошо растворяется в воде, примерно 90 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
RbI
Иодид рубидия. Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
KI
Иодид калия. Хорошо растворяется в воде, примерно 148 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NaI
Иодид натрия. Хорошо растворяется в воде, примерно 184 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
LiI
Иодид лития. Хорошо растворяется в воде, примерно 167 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
BaI2
Иодид бария. Хорошо растворяется в воде, примерно 218 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
SrI2
Иодид стронция. Хорошо растворяется в воде, примерно 180 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
CaI2
Иодид кальция. Хорошо растворяется в воде, примерно 215 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NH4I
Иодид аммония. Хорошо растворяется в воде, примерно 176 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
MgI2
Иодид магния. Хорошо растворяется в воде, примерно 142 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AlI3
Иодид алюминия. Хорошо растворяется в воде.
В результате гидролиза, образуется кислая среда.
MnI2
Иодид марганца. Растворяется в воде.
В результате гидролиза, образуется кислая среда.
ZnI2
Иодид цинка. Хорошо растворяется в воде, примерно 440 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CrI3
Иодид хрома. Плохо растворяется в воде.
В результате гидролиза, образуется кислая среда.
FeI2
Иодид железа (II). Растворяется в воде.
В результате гидролиза, образуется кислая среда.
FeI3
Иодид железа (III). Диспропорционирует при растворении в воде.
В результате гидролиза, образуется кислая среда.
CoI2
Иодид кобальта. Хорошо растворяется в воде, примерно 210 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
NiI2
Иодид никеля. Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
PbI2
Иодид свинца. Плохо растворяется в воде, примерно 0,076 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CuI2
Иодид меди. Диспропорционирует при растворении в воде.
В результате гидролиза, образуется кислая среда.
HgI2
Иодид ртути. Не растворяется в воде.
AgI
Иодид серебра. Не растворяется в воде.
HBr
Бромоводородная кислота. Сильная одноосновная кислота.
CsBr
Бромид цезия. Хорошо растворяется в воде, примерно 110 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
RbBr
Бромид рубидия. Хорошо растворяется в воде, примерно 114 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
KBr
Бромид калия. Растворяется в воде, примерно 68 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NaBr
Бромид натрия. Хорошо растворяется в воде, примерно 94 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
LiBr
Бромид лития. Хорошо растворяется в воде, примерно 170 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Ba(Br)2
Бромид бария. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Sr(Br)2
Бромид стронция. Хорошо растворяется в воде, примерно 107 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Ca(Br)2
Бромид кальция. Хорошо растворяется в воде, примерно 153 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NH4Br
Бромид аммония. Хорошо растворяется в воде, примерно 78 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
Mg(Br)2
Бромид магния. Хорошо растворяется в воде, примерно 103 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Al(Br)3
Бромид алюминия. Хорошо растворяется в воде.
В результате гидролиза, образуется кислая среда.
Mn(Br)2
Бромид марганца. Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Zn(Br)2
Бромид цинка. Хорошо растворяется в воде, примерно 470 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cr(Br)3
Бромид хрома. Растворяется в воде.
В результате гидролиза, образуется кислая среда.
Fe(Br)2
Бромид железа (II). Хорошо растворяется в воде, примерно 120 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Fe(Br)3
Бромид железа (III). Хорошо растворяется в воде, примерно 455 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Co(Br)2
Бромид кобальта. Хорошо растворяется в воде, примерно 115 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Ni(Br)2
Бромид никеля. Хорошо растворяется в воде, примерно 134 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Pb(Br)2
Бромид свинца. Плохо растворяется в воде, примерно 0,97 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Cu(Br)2
Бромид меди. Хорошо растворяется в воде, примерно 127 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
Hg(Br)2
Бромид ртути. Плохо растворяется в воде, примерно 0,61 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AgBr
Бромид серебра. Не растворяется в воде.
HCl
Соляная кислота. Сильная одноосновная кислота.
CsCl
Хлорид цезия. Хорошо растворяется в воде, примерно 190 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
RbCl
Хлорид рубидия. Хорошо растворяется в воде, примерно 95 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
KCl
Хлорид калия. Растворяется в воде, примерно 36 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NaCl
Хлорид натрия. Растворяется в воде, примерно 36 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
LiCl
Хлорид лития. Хорошо растворяется в воде, примерно 84,5 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
BaCl2
Хлорид бария. Растворяется в воде, примерно 37,4 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
SrCl2
Хлорид стронция. Хорошо растворяется в воде, примерно 56 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
CaCl2
Хлорид кальция. Хорошо растворяется в воде, примерно 77 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
NH4Cl
Хлорид аммония. Растворяется в воде, примерно 39 гр на 100 мл при температуре 25oC.
Диссоциирует, образует нейтральную среду.
MgCl2
Хлорид магния. Хорошо растворяется в воде, примерно 55,5 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
AlCl3
Хлорид алюминия. Растворяется в воде, примерно 45 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
MnCl2
Хлорид марганца. Хорошо растворяется в воде, примерно 77 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
ZnCl2
Хлорид цинка. Хорошо растворяется в воде, примерно 408 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CrCl3
Хлорид хрома. В воде растворим в присутствии восстановителей (Cr2+, Fe2+).
В результате гидролиза, образуется кислая среда.
FeCl2
Хлорид железа (II). Хорошо растворяется в воде, примерно 64 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
FeCl3
Хлорид железа (IIШ). Хорошо растворяется в воде, примерно 99 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CoCl2
Хлорид кобальта. Хорошо растворяется в воде, примерно 56 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
NiCl2
Хлорид никеля. Хорошо растворяется в воде, примерно 65 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
PbCl2
Хлорид свинца. Плохо растворяется в воде, примерно 1,08 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
CuCl2
Хлорид меди. Хорошо растворяется в воде, примерно 76 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется кислая среда.
HgCl2
Хлорид ртути. Не растворяется в воде.
AgCl
Хлорид серебра. Не растворяется в воде.
H2SO3
Сернистая кислота. Неустойчивая двухосновная кислота средней силы.
Cs2SO3
Сульфит цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Rb2SO3
Сульфит рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
K2SO3
Сульфит калия. Хорошо растворяется в воде, примерно 106 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Na2SO3
Сульфит натрия. Растворяется в воде, примерно 28 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Li2SO3
Сульфит лития. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
BaSO3
Сульфит бария. Плохо растворяется в воде, примерно 0,02 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
SrSO3
Сульфит стронция. Не растворяется в воде.
CaSO3
Сульфит кальция. Не растворяется в воде.
(NH4)2SO3
Сульфит аммония. Растворяется в воде, примерно 65 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
MgSO3
Сульфит магния. Плохо растворяется в воде, примерно 0,65 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Al2(SO3)3
Сульфит алюминия.
Гидролиз протекает практически полностью, оба продукта реакции уходят из зоны реакции в виде осадка или газа.
MnSO3
Сульфит марганца. Не растворяется в воде.
ZnSO3
Сульфит цинка. Плохо растворяется в воде, примерно 0.16 гр на 100 мл при температуре 25oC.
Гидролиз протекает практически полностью, оба продукта реакции уходят из зоны реакции в виде осадка или газа.
CrSO3
Сульфит хрома. Не растворяется в воде.
FeSO3
Сульфит железа (II). Плохо растворяется в воде.
Гидролиз протекает практически полностью, оба продукта реакции уходят из зоны реакции в виде осадка или газа.
Fe2(SO3)3
Сульфит железа (III). Диспропорционирует при растворении в воде.
CoSO3
Сульфит кобальта. Не растворяется в воде.
NiSO3
Сульфит никеля. Не растворяется в воде.
PbSO3
Сульфит свинца. Не растворяется в воде.
CuSO3
Сульфит меди. Не растворяется в воде.
HgSO3
Сульфит ртути. Не растворяется в воде.
Ag2SO3
Сульфит серебра. Очень плохо растворяется в воде, примерно 0.00005255 гр на 100 мл при температуре 25oC.
Гидролиз протекает практически полностью, оба продукта реакции уходят из зоны реакции в виде осадка или газа.
H3PO4
Ортофо́сфорная кислота (фо́сфорная кислота). Трёхосновная кислота средней силы.
Cs3PO4
Фосфат цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Rb3PO4
Фосфат рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
K3PO4
Фосфат калия. Хорошо растворяется в воде, примерно 106 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Na3PO4
Фосфат натрия. Растворяется в воде, примерно 14,5 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Li3PO4
Фосфат лития. Плохо растворяется в воде, примерно 0,037 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Ba3(PO4)2
Фосфат бария. Не растворяется в воде.
Sr3(PO4)2
Фосфат стронция. Не растворяется в воде.
Ca3(PO4)2
Фосфат кальция. Не растворяется в воде.
(NH4)3PO4
Фосфат аммония. Растворяется в воде, примерно 22 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Mg3(PO4)2
Фосфат магния. Не растворяется в воде.
AlPO4
Фосфат алюминия. Не растворяется в воде.
Mn3(PO4)2
Фосфат марганца. Не растворяется в воде.
Zn3(PO4)2
Фосфат цинка. Не растворяется в воде.
CrPO4
Фосфат хрома. Не растворяется в воде.
Fe3(PO4)2
Фосфат железа (II). Не растворяется в воде.
FePO4
Фосфат железа (III). Очень плохо растворяется в воде, примерно 0,67 гр на 100 мл при температуре 100oC.
Гидролиз не протекает.
Co3(PO4)2
Фосфат кобальта. Не растворяется в воде.
Ni3(PO4)2
Фосфат никеля. Не растворяется в воде.
Pb3(PO4)2
Фосфат свинца. Не растворяется в воде.
Cu3(PO4)2
Фосфат меди. Не растворяется в воде.
Hg3(PO4)2
Фосфат ртути. Не растворяется в воде.
Ag3PO4
Фосфат серебра. Не растворяется в воде.
HF
Плавиковая кислота (фтороводородная кислота). Кислота средней силы.
CsF
Фторид цезия. Очень хорошо растворяется в воде, примерно 322 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
RbF
Фторид рубидия. Очень хорошо растворяется в воде, примерно 300 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
KF
Фторид калия. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
NaF
Фторид натрия. Растворяется в воде, примерно 4,3 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
LiF
Фторид лития. Плохо растворяется в воде, примерно 0,13 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
BaF2
Фторид бария. Плохо растворяется в воде, примерно 0,160 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
SrF2
Фторид стронция. Плохо растворяется в воде, примерно 0,021 гр на 100 мл при температуре 25oC.
CaF2
Фторид кальция. Не растворяется в воде.
NH4F
Фторид аммония. Хорошо растворяется в воде, примерно 84,5 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
MgF2
Фторид магния. Очень плохо растворяется в воде, примерно 0,0078 гр на 100 мл при температуре 25oC.
AlF3
Фторид алюминия. Плохо растворяется в воде, примерно 0,5 гр на 100 мл при температуре 25oC.
MnF2
Фторид марганца. Плохо растворяется в воде, примерно 1,06 гр на 100 мл при температуре 25oC.
ZnF2
Фторид цинка. Плохо растворяется в воде, примерно 1,6 гр на 100 мл при температуре 25oC.
CrF3
Фторид хрома. Плохо растворяется в воде, примерно 4 гр на 100 мл при температуре 25oC.
FeF2
Фторид железа (II). Очень плохо растворяется в воде.
FeF3
Фторид железа (III). Очень плохо растворяется в воде, примерно 0,091 гр на 100 мл при температуре 25oC.
CoF2
Фторид кобальта. Плохо растворяется в воде, примерно 1,5 гр на 100 мл при температуре 25oC.
NiF2
Фторид никеля. Растворяется в воде, примерно 2,6 гр на 100 мл при температуре 25oC.
PbF2
Фторид свинца. Плохо растворяется в воде, примерно 0,068 гр на 100 мл при температуре 25oC.
CuF2
Фторид меди. Растворяется в воде, примерно 4,75 гр на 100 мл при температуре 25oC.
При повышении температуры разлагается парами воды.
HgF2
Фторид ртути.
Не существует в водной среде.
AgF
Фторид серебра. Хорошо растворяется в воде, примерно 180 гр на 100 мл при температуре 25oC.
HNO2
Азо́тистая кислота. Слабая одноосновная кислота.
CsNO2
Нитрит цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
RbNO2
Нитрит рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
KNO2
Нитрит калия. Хорошо растворяется в воде, примерно 312 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
NaNO2
Нитрит натрия. Растворяется в воде, примерно 84 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
LiNO2
Нитрит лития. Хорошо растворяется в воде, примерно 105 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Ba(NO2)2
Нитрит бария. Растворяется в воде, примерно 74 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Sr(NO2)2
Нитрит стронция. Растворяется в воде, примерно 77 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Ca(NO2)2
Нитрит кальция. Растворяется в воде, примерно 77 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
NH4NO2
Нитрит аммония. Растворяется в воде, примерно 200 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Mg(NO2)2
Нитрит магния. Растворяется в воде.
В результате гидролиза, образуется слабощелочная среда.
Al(NO2)3
Нитрит алюминия. Растворяется в воде, примерно 63,7 гр на 100 мл при температуре 25oC.
Mn(NO2)2
Нитрит марганца. Растворяется в воде.
Раствор имеет нейтральную среду.
Zn(NO2)2
Нитрит цинка. Растворяется в воде.
Раствор имеет нейтральную среду.
Cr(NO2)3
Нитрит хрома.
Не существует в воде.
Fe(NO2)2
Нитрит железа (II).
Растворяется в воде.
Fe(NO2)3
Нитрит железа (III).
Не существует в воде.
Co(NO2)2
Нитрит кобальта.
Растворяется в воде.
Ni(NO2)2
Нитрит никеля.
Растворяется в воде.
Pb(NO2)2
Нитрит свинца.
Растворяется в воде.
Cu(NO2)2
Нитрит меди.
Растворяется в воде.
Hg(NO2)2
Нитрит ртути.
Плохо растворяется в воде.
AgNO2
Нитрит серебра.
Плохо растворяется в воде.
H2CO3
Угольная кислота.
Cлабая двухосновная кислота.
Cs2CO3
Карбонат цезия. Растворяется в воде, примерно 75,5 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
Rb2CO3
Карбонат рубидия. Хорошо растворяется в воде, примерно 223 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
K2CO3
Карбонат калия. Хорошо растворяется в воде, примерно 112 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
Na2CO3
Карбонат натрия. Растворяется в воде, примерно 29,4 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
Li2CO3
Карбонат лития. Растворяется в воде, примерно 1,27 гр на 100 мл при температуре 25oC.
В результате гидролиза, образуется щелочная среда.
BaCO3
Карбонат бария.
Не растворяется в воде
SrCO3
Карбонат стронция.
Не растворяется в воде
CaCO3
Карбонат кальция.
Не растворяется в воде
(NH4)2CO3
Карбонат аммония. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 15oC.
MgCO3
Карбонат магния. Плохо растворяется в воде.
Al2(CO3)3
Карбонат алюминия.
Не существует в воде.
MnCO3
Карбонат марганца.
Не растворяется в воде.
ZnCO3
Карбонат цинка.
Не растворяется в воде.
Cr2(CO3)3
Карбонат хрома.
Не существует в воде.
FeCO3
Карбонат железа (II).
Не растворяется в воде.
Fe2(CO3)3
Карбонат железа (III).
Не существует в воде.
CoCO3
Карбонат кобальта.
Не растворяется в воде.
NiCO3
Карбонат никеля.
Не растворяется в воде.
PbCO3
Карбонат свинца.
Не растворяется в воде.
CuCO3
Карбонат меди.
Не растворяется в воде.
HgCO3
Карбонат ртути.
Не растворяется в воде.
Ag2CO3
Карбонат серебра.
Не растворяется в воде.
H2S
Сероводородная кислота.
Cлабая, двухосновная кислота.
Cs2S
Сульфид цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Rb2S
Сульфид рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
K2S
Сульфид калия. Реагирует с водой.
В результате гидролиза, образуется щелочная среда.
Na2S
Сульфид натрия. Растворяется в воде, примерно 20 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
Li2S
Сульфид лития. Хорошо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
BaS
Сульфид бария. Растворяется в воде, примерно 9 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
SrS
Сульфид стронция. Плохо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
CaS
Сульфид кальция. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
(NH4)2S
Сульфид аммония. Хорошо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
MgS
Сульфид магния. Плохо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Al2S3
Сульфид алюминия.
Не существует в воде.
MnS
Сульфид марганца. Не растворяется в воде.
ZnS
Сульфид цинка. Не растворяется в воде.
Cr2S3
Сульфид хрома.
Не существует в воде.
FeS
Сульфид железа (II). Не растворяется в воде.
Fe2S3
Сульфид железа (III). Диспропорционирует при растворении в воде.
CoS
Сульфид кобальта. Не растворяется в воде.
NiS
Сульфид никеля. Не растворяется в воде.
PbS
Сульфид свинца. Не растворяется в воде.
CuS
Сульфид меди. Не растворяется в воде.
HgS
Сульфид ртути.
Не существует в воде.
Ag2S
Сульфид серебра. Не растворяется в воде.
H2SiO3
Метакремниевая кислота.
Очень слабая кислота.
Cs2SiO3
Силикат цезия.
Не растворяется в воде.
Rb2SiO3
Силикат рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
K2SiO3
Силикат калия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Na2SiO3
Силикат натрия. Растворяется в воде, примерно 22 гр на 100 мл при температуре 20oC.
В результате гидролиза, образуется щелочная среда.
Li2SiO3
Силикат лития.
Не растворяется в воде.
BaSiO3
Силикат бария.
Не растворяется в воде.
SrSiO3
Силикат стронция.
Не растворяется в воде.
CaSiO3
Силикат кальция.
Не растворяется в воде.
(NH4)2SiO3
Силикат аммония.
Не существует в воде.
MgSiO3
Силикат магния.
Не растворяется в воде.
Al2(SiO3)3
Силикат алюминия.
Не существует в воде.
MnSiO3
Силикат марганца.
Не растворяется в воде.
ZnSiO3
Силикат цинка.
Не растворяется в воде.
Cr2(SiO3)3
Силикат хрома.
Не существует в воде.
FeSiO3
Силикат железа (II).
Не существует в воде.
Fe2(SiO3)3
Силикат железа (III).
Не существует в воде.
CoSiO3
Силикат кобальта.
Не существует в воде.
NiSiO3
Силикат никеля.
Не существует в воде.
PbSiO3
Силикат свинца.
Не растворяется в воде.
CuSiO3
Силикат меди.
Не существует в воде.
HgSiO3
Силикат ртути.
Не существует в воде.
Ag2SiO3
Силикат серебра.
Не существует в воде.
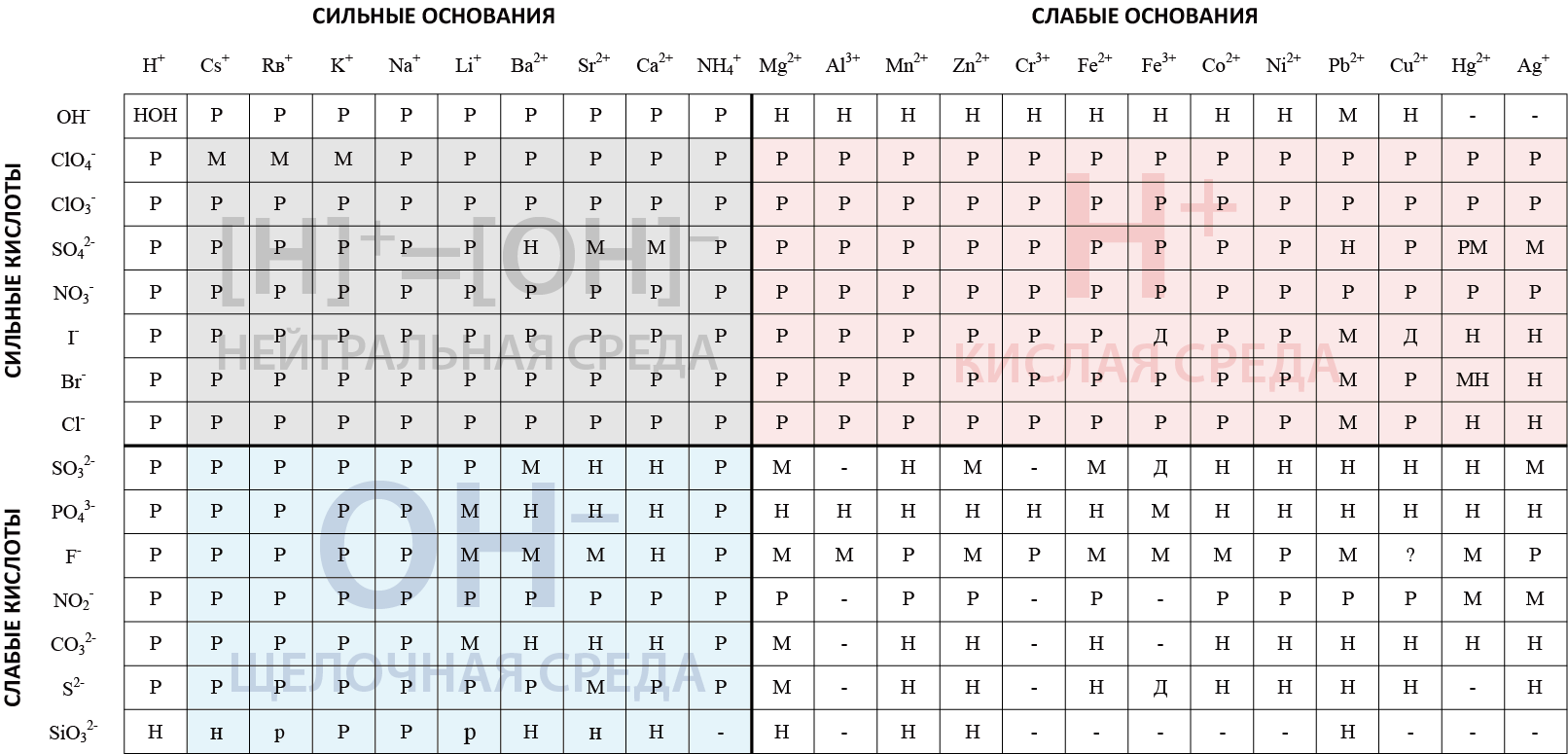
Бул таблицадагы тузду гидролиздин натыйжасы аркылуу сүрɵттɵп жазууга болот.
Эгерде туз таблицада тɵмɵнкү түстɵр менен белгиленсе, анда:
мындай туз диссоциацияланат жана гидролизге учурабайт.
гидролизденет, кычкыл чɵйрɵ түзүлɵт, рН <7 болот.
гидролизден кийин щелочтук чɵйрɵ түзүлɵт, мында суутектик кɵрсɵткүчтүн рН мааниси 7 ден чоң болот.
анализдɵɵнү талап кылат: туз бул сектордогу башка туздардай эле эрибейт же сууда эригенде ажырап кетет. Туз эрүүчү болсо, анда гидролиздин натыйжасында, нейтралдуу чɵйрɵ рН=7,0 түзүлɵт.
Буфердик эритмелер
Буфердик системанын болушу менен кандын ж.б. суюктуктардын курамынын туруктуулугун сактоого организм жɵндɵмдүү болот. Кычкылдуулугу жана щелочтуулугу ар түрдүү болгон кɵптɵгɵн заттар организмге сырттан кирет жана анда иштелип чыгат, бирок, H+ жана OH– иондорунун концентрациясын ɵзгɵртүү менен кан үчүн туруктуу (pH = 7,37 – 7,44) чɵйрɵ сакталат.
Бул кɵрсɵткүчтɵрдүн тɵмɵндɵшү же жогорулашы ɵлүмгɵ алып келет. Буфердик эритмелер деп, бир аз ɵлчɵмдɵ кислотаны же щелочту кошсо, суюлтса да суутектик кɵрсɵткүчү рН ɵзгɵрбɵй, турактуу болгон эритмелерди айтабыз. Буфердик системалар начар негизден жана күчтүү кислотадан пайда болгон же начар кислотадан жана күчтүү негиздерден пайда болгон туздардан турат.
Мисалы: NH4OH + NH4Cl pH = 9,2 же CH3COOH + CH3COONa pH=4,7
Кислотаны кошуу менен суутектин иондору, ал эми щелочту кошуу менен гидроксид иондору менен байланышат, эритменин чɵйрɵсү pH бир аз гана ɵзгɵрɵт. Буфердик эритмелердеги чɵйрɵ рН буфердик ченем (емкость) аркылуу жɵнгɵ салынат.
Организмдин ар бир клеткасында ички чɵйрɵнүн туруктуулугун сактаган ар түрдүү буфердик система иштейт.
Гидролиздин мааниси жана колдонулушу
Туздардын суу менен болгон алмашуу реакциясы жаратылышта кеңири таралган.
Гидролиз кубулушу жер катмарынын химиялык кайрадан ɵзгɵрүүсү үчүн чоң роль ойнойт. Жер катмарындагы кɵптɵгɵн минералдар – металлдардын сульфиддери сууда начар эрийт, бирок, суу менен акырындап аракеттенише баштайт. Мындай процесстер Жердин үстүндɵ да жүрүп турат, бирок, жердин терең катмарында, жогорку температурада өтө кубаттуу жүрɵт. Жыйынтыгында, вулкан учурунда, жердин үстүнɵ абдан кɵп ɵлчɵмдɵ күкүртүү суутек бɵлүнүп чыгат. Ал эми силикат тоо тектери акырындап, гидроксиддерге, андан соң металлдардын оксидине айлана баштайт. Жыйынтыгында, минералдардын гидролизи– алюмосиликаттар пайда болуп, тоо тектери бузула баштайт.
Бизге белгилүү болгон малахит (Cu2(OH)2CO2) – табийгый карбонаттардын гидролизинен пайда болгон.
Дүйнɵлүк океанда туздар суу менен кубаттуу аракеттенишет. Дарыялар менен агып чыккан кальцийдин жана магнийдин гидрокарбонаттары деңиз сууларына кошулуп, аларда начар шелочтук чɵйрɵнү түзɵт. Жээктеги суулардын мына ушундай начар щелочтук чɵйрɵсүндɵ рН 9га барабар болот, ошондуктан, деңиз ɵсүмдүктɵрүндɵ фотосинтез кубаттуу жүрɵт жана деңиз жаныбарлары да ылдам чоңоюшат. Сүт эмүүчүлɵрдүн, анын ичинен адамдын канындагы рН бирдейлигин билүү менен силер, Жердеги жаныбарлар дүйнɵсүнүн биримдиги жɵнүндɵ жыйынтык чыгара аласыңар.
Гидролиз мунайчыларды бир топ түйшүккɵ салды. Бизге белгилүү болгондой, нефтте суунун жана кɵптɵгɵн туздардын аралашмасы, ɵзгɵчɵ кальцийдин жана магнийдин хлориди кɵп болот. Нефтини кайра иштеткен учурда, аны 250 oС ысытканда хлориддер суунун буусу менен кубаттуу аракеттенишет. Бɵлүнүп чыккан газ абалындагы хлордуу суутек жабдуулар жасалган металл менен реакцияга кирип, аны бузат, бул нефть продуктыларынын баасынын жогорулашына алып келет. Бирок, гидролиздин пайдасын да айтпай коюуга болбойт. Мисалы, алюминий сульфатынын суу менен аракеттенишинен пайда болгон алюминий гидроксидинин чɵкмɵсү кылымдардан бери боёк катары колдонулуп келе жатат. Кездемеге сиңирилгенден кийин алюминий гидроксиди боёкторду жеңил адсорбциялайт жана жууса да кетпеген боёктордун катмарын пайда кылат. Бул жол менен кездемени боёочу сапаттуу боёктор алынат. Ушул эле процесс ичүүчү сууну жана ɵнɵр жай калдыктарын тазалоодо да колдонулат. Алюминийдин гидроксидинин кɵпшɵк, аморфтуу чɵкмɵсүн топуракта тоголоктошот да, аларды адсорбциялоо менен зыяндуу, уу заттарды чɵктүрүп, бɵлүп алышат. Ушундай эле жол менен табият суулары алюминийдин бирикмелеринен турган чопо менен тазаланат.
Натрийдин карбонатынын жана натрийдин фосфатынын Na2CO3, Na3PO4 туздарынын гидролизи сууну тазалоо жана аны жумшартуу үчүн колдонулат.
Топурактын кычкылдуулугун азайтуу максатында акиташтоо да гидролиздɵɵ реакциясына негизделген:
CO32-+HOH![]() HCO3-+OH+
HCO3-+OH+
Гидролиз аркылуу ɵнɵр жайында азык–түлүк эмес чийки заттардан (жыгач, пахтанын кабыгы, күн карама шакелдери, саман) бир катар баалуу продуктылар: этил спирти, белковые дрожж, глюкоза, кургак муз иштелип чыгат.
Пайдалуу шилтемелер
Глоссарий
- Аквакомплекстер – суунун молекуласынын курамына кирген комплекстер же кристаллогидраттар
Библиография
- Химическая энциклопедия, ред. И.Л. Кнунянц, Изд. «Советская энциклопедия», 1-5 т., М., 1988 г.
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. – С. 244
- Ефимов А.И. и др. Свойства неорганических соединений. Справочник. - Л.: Химия, 1983. – С. 140-141
- Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. - Мн.: Современная школа, 2005. - 608 с ISBN 985-6751-04-7.
Швед физик–химиги Сванте Август Аррениус Упсаладан алыс эмес жердеги Вейк имениесинде туулган.
Аррениус ар түрдүү типтеги эритмелер аркылуу электр тогунун ɵтүшүн изилдеген. Ал кээ бир заттардын молекулалары сууда эригенде диссоциациялана тургандыгын, б.а. эки же андан кɵп бɵлүкчɵлɵргɵ–иондорго ажырай тургандыгын божомолдогон. «Бирок, ар бир бүтүн молекула электронейтралдуу болсо да, анын бɵлүкчɵлɵрү бир аз электр зарядына ээ болот, ал бɵлүкчɵнүн жаратылышына карата, же оң, же терс болушу мүмкүн. Мисалы, натрий хлоридин (туз) сууда эриткенде, ал оң заряддалган натрийдин атомуна жана терс заряддалган хлордун атомуна ажырайт. Бул заряддалган атомдор, молекуланын активдүү курамдык бɵлүгү катары эритмелерде гана пайда болот жана электр тогунун ɵтүщү үчүн шарт түзɵт. Электр тогу ɵз кезегинде активдүү курамдык бɵлүктɵрдү карама–каршы заряддалган электроддорго багыттайт».
1884–ж. Аррениус Упсаль Университетинде докторлук диссертациясын жактаганда, мына ушул гипотезалар менен чыккан. Ал мезгилде кɵптɵгɵн окумуштуулар эритмеде карама–каршы заряддалган бɵлүкчɵлɵрдүн болооруна ишенишкен эмес. Ошондуктан, факультет кеңеши диссертацияны ɵз деңгээлинде баалаган эмес.
1903–ж. гана Аррениуска «химия илимин ɵнүктүрүүдɵ анын электролиттик диссоциация теориясынын ɵзгɵчɵ маанисин таануу максатында»Нобель сыйлыгы ыйгарылган.Швеция королевствосунун илимдер академиясынын атынан чыккан X.Р.Тернеблад Аррениустун иондор теориясы «математика менен жакындашып», электрохимиянын ɵнүгүшүнɵ жол салгандыгын баса кɵрсɵткɵн. «Аррениустун теориясынын маанилүү натыйжаларынын бири, химия боюнча биринчи Нобель сыйлыгын алган Вант–Гоффтун эмгегин жыйынтыктагандыгы болуп саналат», – деген Тернеблад.
Кир жуучу машинада сода менен кантип кир жууйбуз? Ал үчүн барабандын ɵзүнɵ жарым стакан сода салып, кадимки режимде жууш керек. Эгерде кир буюмдар кɵп болсо, анда содадан бир стакан салуу керек. Ал эми ага дагы бир стакан ак уксустун эритмесин кошсок, соданын эффективдүүлүгү андан да жогорулайт.
Сода менен тактарды кетирүү
Тактарды сода менен кетирүүчү бир нече ыкмаларды сунуш кылабыз:
- Такты кетирүү үчүн, сода пастасын даярдап алалы: бир чоң кашык соданы сууга аралаштырабыз. Суунун ордуна суутектин ɵтɵ кычкылын же уксусту колдонсо да болот. Алынган пастаны кир такка сүрүп, 15 мүнɵттɵн кийин жууп салабыз. Эгерде так кетпесе, процедураны кайталайбыз. Так абдан терең болсо,анда тиш щетка менен сүрүп кетирсек болот. Бирок, сода пастасын ɵтɵ назик, жука кездемелерге колдонууга болбойт;
- Соданы буюмдарды кургак жол менен тазалоого да колдонууга болот. Ал үчүн соданы кир тактын үстүнɵ жука кылып себелɵɵ керек( электи колдонсо ыңгайлуу болот), анан пакетке аба киргизбей ороп, 2 саатка коёбуз. Андан кийин кийимди кагып, 40 мүнɵт эшикке жайып коюу керек;
- Жагымсыз жытты кетирүү үчүн соданы таза носкиге салып, оозун байлап койгула. Андан кийин аны кийим салынган пакетке салып туруп, аба киргизбей кургак, салкын жерге түнү менен коюп койсо болот. Эртең менен пакетти ачып, соданы кийимден кагып түшүргүлɵ.Андан соң кийимди бир нече саатка чейин эшикке күнгɵ жайып койгула. Эгерде жыт кетпесе, процедураны кайталагыла;
- Килемдин бетиндеги же дасторкондогу такты соданы уксус менен ɵчүрүп алып, тазалоо керек. Ал үчүн адегенде соданы кир такка себелейбиз, андан соң чүпүрɵктү уксус менен нымдап туруп, ортосунан четти кɵздɵй такты сүрɵбүз. Бул процедураны бир нече жолу кайталап, аягында таза суу менен чайкап коёбуз.
Сода менен агартуу
Кирди сода менен жууп жана агартууга болобу? Ооба, ал үчүн соданы нашатыр спирти менен аралаштыруу керек. 5 литр таза сууга 5 кашык сода жана 2 кашык нашатыр спиртин кошуу керек. Алынган эритмеге ак түстүү кирлерди 2–3 саатка чейин чылап койгула. Андан кийин гана жуугула. Эгерде чылагандан кийин кирлерди ушул эритмеге кайнатсак, алардын саргыч түсү кетет.
Кальцийлештирген сода менен кантип кир жууганга болот?
Соданын экинчи түрү–кальцийлештирилген сода, тамак–аш содасына караганда бир канча эффективдүү. Аны турмуш–тиричилик химия бɵлүмдɵрүнɵн сатып алууга болот. Кальцийлештирген соданын колдонулушу:
- Кир жуугуч машинанын тетиктеринен кеберди( накип) жана аны туура эмес пайдалануудан пайда болгон жагымсыз жытты кетирүү үчүн колдонулат. Ал үчүн соданы бирдей ɵлчɵмдɵ суу менен аралаштырып, аралашма менен барабанды жана кир жуугуч каражат салынуучу лотокко салып, 30 мүнɵттɵн кийин чүпүрɵк менен сүрүп коюу керек. Андан кийин автомат машинага кир салбай туруп, «тез жууган» режимде иштеткиле;
- Сууну жакшы жумшартат. Ал үчүн кир жуугуч порошокко 2 чоң кашык сода кошулат (суунун катуулугу жогору болсо, 5 кашыкка чейин кошуу керек). Суунун температурасы 50 градустан тɵмɵн болбошу керек, бул кебердин болушунун да алдын алат. Бирок, жибек жана жүн кийимдерди мындай аралашма менен жууганга болбойт;
- Кирлерди чылап коюу үчүн 3 чоң кашык соданы 40 градуска чейин жылытылган 10 литр сууга кошкула. Эритмеге кийимдерди салып, чылап койгула. 2–3 сааттан кийин жуусаңар болот;
- Ашканадагы майлыктарды таза жууш үчүн тɵмɵнкү эрежени колдонсок болот: бир ууч соданы майдаланган (теркада) кир самын менен аралаштырып, эмаль чаканын жарымынан суу куюп туруп, салып койгула. Самын эригенден кийин, сууга майлыктарды салып, жай отко 20 мүнɵт кайнаткыла. Андан кийин машинада кадимкидей жууп койгула;
- Майлыктагы майдын тактарын кетирүү үчүн соданы ɵсүмдүк майы, агартуучу каражат жана порошок менен аралаштыруу керек. Ар бир ингредиенттен 3 чоң кашыктан алып, чакадагы кайнак сууга салгыла да кир кол арчыгычтарды, майлыктарды салып койгула. Алар суу муздаганча чыланып турсун. Түнү бою калтырып коюуга да болот. Андан соң аларды таза, жылуу сууга чайкагыла да, машинкада жууп койгула.
Сода кошулган универсалдык тазалоочу каражат
Идиш–аяктарды жууш үчүн жана сантехниканы тазалоо үчүн каражаттарды ɵзүбүз даярдап алсак да болот. Ал үчүн тɵмɵнкүлɵр керек:
- теркадан ɵткɵрүлгɵн «детское» самыны,
- 1 стакан сууну кошуп, аралаштырабыз да,
- дагы бир стакан сууну куюп,250 грамм соданы акырындык менен кошобуз,
- кайрадан аралаштырабыз.
Мындай паста менен акиташты да кетирүүгɵ болот.
Сода кошулган башка тазалоочу каражаттар
Соданы пайдалануу менен тɵмɵнкүлɵрдү даярдасак болот:
- идиш–аяк жуугуч аралашма;
- кир кетирүүчү гель;
- ваннаны тазалоочу каражат.
Идиш–аяктарды жуучу гелди даярдоо үчүн кир самын (25 грамм), 100 грамм тамак–аш содасы, жарым литр ысык суу, 4 кашык глицерин, бир кашык арак же суюлтулган спиртти даярдап алгыла. Кир самынды теркадан ɵткɵрүп, бир аз суу куйгула да кичине толкундуу мешке (микроволновая печ) койгула. Эритмени аралаштырып, калган сууну акырындык менен куйгула. Самын эригенден кийин муздаткыла да, ага глицеринди, аракты кошуп, аралаштыргыла. Пайда болгон кɵбүктɵрдү башка идишке куюп алып, пайдалана бергиле.
Кир кетирүүчү гелди даярдоо үчүн 1 литр суу, 50 грамм теркадан ɵткɵрүлгɵн кир самын жана 45 грамм кальцийлештирилген сода керектелет. Кайнап жаткан сууга майдаланган самынды салып, жакшылап аралаштыргыла. Андан кийин аралашмага соданы кошуп койгула. 5 килограмм кир кийимдерди жууганга 2 чоң кашык гелди барабанга куюп, кир жуусаңар болот.
Ваннаны тазалоочу каражатты даярдоо үчүн аралашмага жарым стакан сода, суюк самын жана 5 тамчы розмариндин же лаванданын майы кошулат. Соданы самын менен аралаштырып, майды кошкула. Аралашма кургап кетпеши үчүн ага бир чай кашык глицерин кошуп, идиштин оозун бекем жаап коюу керек.
Бүт дүйнɵ жүзүндɵ 22 мартта Суу ресурстарынын күнү белгиленет. Бул майрам Бириккен Улуттар Уюмунун Генералдык Ассамблеясынын чечими менен, жалпы адамзатка айлана– чɵйрɵгɵ жана коомдун ɵнүгүшү үчүн суу ресурстарынын маанилүүлүгүн эстетүү максатында белгиленген.
Азыркы мезгилде биздин планетанын территориясынын 70% суудан турат. Бирок, бул суунун 1% гана ичүүгɵ болот. Жыл ɵткɵн сайын суу ресурстарынын проблемалары күчɵɵдɵ. Акыркы 50 жылда гана суу менен байланышкан 507 чыр–чатак болуп, анын 21 согушка алып келген. Суу – планетадагы эң жɵнɵкɵй зат. Бирок, ошол эле учурда сууда, бизге белгисиз болгон табышмактар да бар. Окумуштуулар азыркыга чейин сууну изилдеп, кызыктуу кɵп фактыларды табышууда.
Силер билесиңерби
эң таза суунун Финляндияда экендигин?
ЮНЕСКОнун маалыматы боюнча, эң таза суу Финляндияда экен. Алар 122 ɵлкɵнүн табийгый таза сууларын изилдеген. Ал эми дүйнɵ жүзү боюнча 1 млрд адамдын таза сууну колдонууга мүмкүнчүлүгү таптакыр жок экен.
муз ысык суудан тез алынабы?
Эгерде логикалык жактан ойлоп кɵрсɵк, муз албетте, муздак суудан алынат. Ысык суу биринчи муздашы, анан тоңушу керек, ал эми муздак сууну ошол замат эле тоңдурабыз.Бирок, тажрыйбаларда кɵрсɵткɵндɵй, ысык суу музга тез айланат экен.
Эмне үчүн ысык суунун муздак сууга караганда тез тоңо тургандыгынын себеби, азыркыга чейин белгисиз. Балким, себеби муздатууда, буулантууда, муздун пайда болушунда эмес, суюлтулган газдардын ысык жана муздак сууга тийгизген таасириндедир.
суунун ɵтɵ катуу тоңо тургандыгын?
Суунун 0 градуста тоңуп, 100 градуста кайнай тургандыгы физика курсунан бардыгына белгилүү. Бирок, кээ бир суулардын андан да тɵмɵнкү температурада гана тоңо тургандыгы айтылып жүрɵт. Мындай касиетке аралашмасы жок эң таза суу ээ болот. 0 градуска чейин муздатса да, мындай суу суюк абалда калат. Белгилүү бир тɵмɵнкү температурада гана суу музга айланат же кайнайт экен.
суунун 3 кɵп агрегаттык абалы бар экендигин?
Суунун үч агрегаттык абалда: суюк, катуу жана газ абалда болоору бардыгыбызга белгилүү. Бирок, окумуштуулар суунун 5 суюк абалы жана 14 тоңгон катуу абалы бар экендигин белгилешкен. Эгерде тоңгон таза сууну дагы муздата берсек эмне болот? Сууда укмуштуудай айлануулар башталат. Цельсий шкаласы боюнча минус 120 градуста суу ɵтɵ илээшкек, созулгуч болсо, ал эми минус 135 градуста суу айнектей абалга келет. «Айнек»суу – бул кристаллдык түзүлүшкɵ ээ эмес, айнектей катуу зат.
Эл аралык классификация боюнча кардын түрлɵрү
© А. К. Дюнин, В царстве снега, Издательство «Наука», Новосибирск, 1983
-

Пластинки
Самые простые из снежинок — плоские шестиугольные призмы. -

Звезды
Как и пластинки, звезды обычно плоские и тонкие, с шестью лучами. -

Столбики
Полые внутри, могут иметь форму карандаша. -

Иглы
Длинные и тонкие кристаллы, иногда состоят из нескольких веточек. -

Пространственные дендриты
Объемные снежинки, образуются при срастании нескольких кристаллов. -

Увенчанные столбики
Образуются в случае, если столбики попадают в иные условия, и кристаллы меняют направление роста. -

Неправильные кристаллы
Самый распространенный тип. Образуется при повреждении снежинки.
© Kichigin | Shutterstock.com