Химия: Атомдун түзүлүшү — различия между версиями
Admine2 (обсуждение | вклад) (Новая страница: «{{lang|Химия: Строение атомов химических элементов}}») |
Admine2 (обсуждение | вклад) |
||
| Строка 1: | Строка 1: | ||
| + | {{Якорь|Начало}} | ||
| + | <div class="row chem-bg"> <div class="maintext large-8 medium-7 columns"> <!-- Page Content --> | ||
| + | <div class="cutok">[[#Строение атома|Строение атома]] [[#Состав атомного ядра|Состав атомного ядра]] [[#Изотопы|Изотопы]] [[#Радиоактивность|Радиоактивность]]<br>[[#Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева|Характеристика химического элемента]]</div> | ||
| + | === Строение атома === | ||
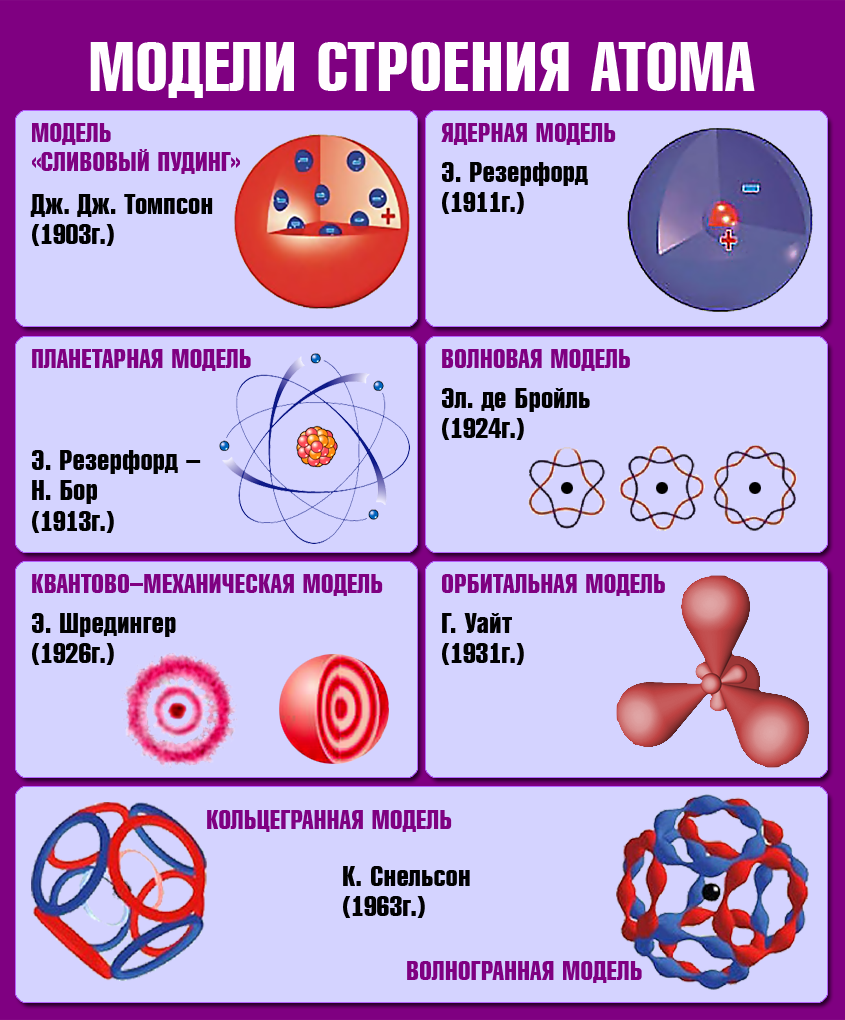
| + | <div class="show-for-large-up">{{right|[[file:Модели атома.png|350px|Модели атомного строения]]}}</div> | ||
| + | <div class="hide-for-large-up">{{center|[[file:Модели атома.png|450px|Модели атомного строения]]}}</div> | ||
| + | Гипотеза о том, что все вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий тому назад. Сторонники атомистической теории (Демокрит, Левкипп, Анаксагор, Анаксимандр, Эпикур, Лукреций Кар) рассматривали атом как мельчайшую неделимую частицу и считали, что все многообразие мира есть не что иное, как сочетание неизменных частиц — атомов. | ||
| + | |||
| + | '''Демокрит:''' ''«Cуществует предел деления атома».'' | ||
| + | |||
| + | '''Аристотель:''' ''«Делимость вещества бесконечна».'' | ||
| + | |||
| + | '''Париж, 1626 г.:''' ''«Учение об атоме запрещено под страхом смерти».'' | ||
| + | |||
| + | Сторонниками атомистической теории были М.В. Ломоносов, Ж. Гей-Люссак, Д. Дальтон и др. | ||
| + | |||
| + | '''Толчком к подробному изучению строения атома послужили:''' | ||
| + | |||
| + | #открытие рентгеновского излучения (1895 г., В.К. Рентген); | ||
| + | #открытие радиоактивности и новых радиоактивных элементов (1896 г., А. Беккерель, М. и П. Кюри); | ||
| + | #открытие электрона (1896 г., Дж. Дж. Томсон). | ||
| + | |||
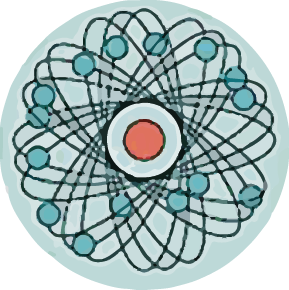
| + | Мысль об электронном строении атома, впервые высказанную В. Вебером в 1896 г., развил X. Лоренц: «Электроны входят в состав атома». Опираясь на эти открытия, Дж. Томсон в 1898 г. предложил модель атома в виде положительно заряженного шара радиусом 10<sup>-10</sup> м. в котором плавают электроны, нейтрализующие положительный заряд. | ||
| + | |||
| + | ==== Ядерная модель атома ==== | ||
| + | |||
| + | Экспериментальная проверка модели Томсона была осуществлена в 1911 г. английским физиком Э. Резерфордом. | ||
| + | |||
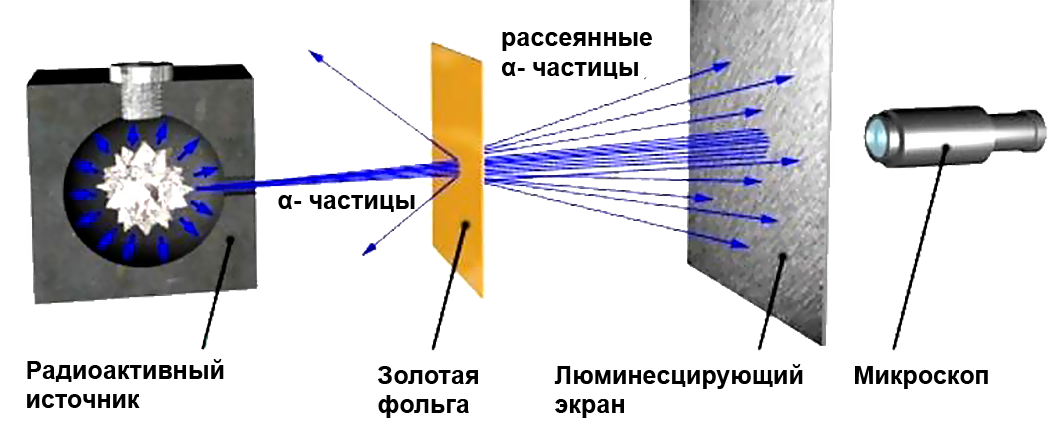
| + | Идея опыта заключалась в изучении рассеяния α-частиц (заряд +2е, масса 6,64.10<sup>-27</sup> кг) на атомах. α-частицы были выбраны, т.к. их кинетическая энергия много больше кинетической энергии электронов (β-лучи) и, в отличие от γ-лучей они имеют электрический заряд. | ||
| + | <div class="show-for-large-up">{{right-p|[[file:Опыты-резерфорда.png|370px|Опыт Резерфорда по изучению модели атома]]}}</div> | ||
| + | <div class="hide-for-large-up">{{center-p|[[file:Опыты-резерфорда.png|250px|Опыт Резерфорда по изучению модели атома]]}}</div> | ||
| + | Пучок α-частиц пропускался через тонкую золотую фольгу. Золото было выбрано как очень пластичный материал, из которого можно получить фольгу толщиной практически в один атомный слой. Опыты были повторены и на других материалах | ||
| + | |||
| + | Э. Резерфорд и его помощники Г. Гейгер и Э. Марсден обнаружили, что какая-то частьa-частиц отклоняется на довольно значительный угол от своего первоначального направления, а небольшая часть отражается от фольги. Но согласно модели атома Томсона эти α-частицы при взаимодействии с атомами фольги отклоняются на малые углы, порядка 2°. | ||
| + | |||
| + | Резерфорд показал, что модель Томсона находится в противоречии с его опытами. Обобщая результаты своих опытов, '''Резерфорд предложил ядерную (планетарную) модель строения атома''': | ||
| + | |||
| + | #'''Атом имеет ядро, размеры которого малы по сравнению с размерами самого атома (~ 10<sup>-15</sup> м).''' | ||
| + | #'''В ядре сконцентрирована почти вся масса атома.''' | ||
| + | #'''Отрицательный заряд всех электронов распределен по всему объему атома и компенсирует положительный заряд ядра.''' | ||
| + | {{center|'''Планетарная модель атома'''}} | ||
| + | {{center|[[file:Planetardyk model kalyn 2.mp4|350px|start=1]]}} | ||
| + | |||
| + | |||
| + | Расчеты показали, что α-частицы, которые взаимодействуют с электронами в веществе, почти не отклоняются. | ||
| + | |||
| + | {{right-p|[[file:Ядерная модель.png|class=show-for-large-up|140px|Предложенная Резерфордом ядерная модель строения атома]]}} | ||
| + | {{center|[[file:Ядерная модель.png|150px|class=hide-for-large-up|Предложенная Резерфордом ядерная модель строения атома]]}} | ||
| + | '''Однако предложенная модель строения атома не позволила объяснить устойчивость атома:''' | ||
| + | |||
| + | - ускоренное движение электрона согласно теории Максвелла сопровождается электромагнитным излучением, поэтому энергия электрона уменьшается, и он движется по спирали, приближаясь к ядру. Казалось бы, электрон должен упасть на ядро (расчет показывает, что это должно произойти за 10<sup>-8</sup> с), так как при движении по спирали уменьшается энергия электрона, в действительности атомы являются устойчивыми системами; | ||
| + | |||
| + | - спектр излучения при этом должен быть непрерывным (должны присутствовать все длины волн). На опыте спектр получается линейчатым; | ||
| + | |||
| + | - нет ответа на вопрос о строении ядра. Если в него входят только положительные частицы, то почему они не отталкиваются? | ||
| + | |||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | == Состав атомного ядра == | ||
| + | '''Атом''' — наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. В 1911 г англ. учёный Э. Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. | ||
| + | |||
| + | Общий заряд свободного атома равен нулю, так как заряды ядра и электронной оболочки уравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен −1). | ||
| + | |||
| + | {{center|'''Протонно-нейтронная теория'''}} | ||
| + | {{center|[[file:Proton neitron kalyn 3.mp4|350px]]}} | ||
| + | |||
| + | Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц – нейтронов, не имеющих заряда. Обобщенные характеристики элементарных частиц в составе атома можно представить в виде таблицы: | ||
| + | {| class="tbtext mw-datatable" style="text-align: center; margin: auto" | ||
| + | |- | ||
| + | !Название частицы | ||
| + | !Обозначение | ||
| + | !Заряд | ||
| + | !Масса | ||
| + | |- | ||
| + | !протон | ||
| + | |p | ||
| + | | +1 | ||
| + | |1 | ||
| + | |- | ||
| + | !нейтрон | ||
| + | |n | ||
| + | |0 | ||
| + | |1 | ||
| + | |- | ||
| + | !электрон | ||
| + | |e− | ||
| + | |−1 | ||
| + | |принимается равной 0 | ||
| + | |} | ||
| + | |||
| + | Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов). | ||
| + | |||
| + | Например, в атоме натрия <sup>23</sup>Na число протонов p = 11, а число нейтронов n = 23 − 11 = 12 | ||
| + | |||
| + | '''Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют [[#Изотопы|изотопами]].''' | ||
| + | |||
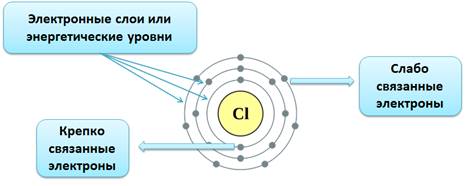
| + | Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях '''(электронных слоях)'''. | ||
| + | {{right-p|[[file:Электронные слои.jpg|350px|class=show-for-large-up|Энергетические уровни]]}} | ||
| + | {{center-p|[[file:Электронные слои.jpg|350px|class=hide-for-large-up|Энергетические уровни]]}} | ||
| + | Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями – '''ква́нтами.''' Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее ''(сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже),'' вначале заполняются уровни с низкой энергией электрона и только затем — высокие. | ||
| + | |||
| + | Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле: | ||
| + | N = 2n<sup>2</sup>, где <span style="color:#ff00e4;">N — максимальное число электронов на уровне,</span> <span style="color:#00a222;">n — номер уровня.</span> | ||
| + | |||
| + | Тогда для первого уровня N = 2 x 1<sup>2</sup> = 2, | ||
| + | |||
| + | для второго N = 2 x 2<sup>2</sup> = 8 и т. д. | ||
| + | |||
| + | Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы. | ||
| + | |||
| + | В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень важно понимать, что уровни читаются снизу вверх, что соответствует их энергии. Поэтому столбик цифр в клеточке с натрием: | ||
| + | {{left-p|[[file:Na na.gif|150px|Натрий]]}} | ||
| + | <div class="resettext"> | ||
| + | '''1'''<br> | ||
| + | '''8'''<br> | ||
| + | '''2''' | ||
| + | <div style="text-align:center"> | ||
| + | cледует читать так:<br> | ||
| + | на 1-м уровне — 2 электрона,<br> | ||
| + | на 2-м уровне — 8 электронов,<br> | ||
| + | на 3-м уровне — 1 электрон | ||
| + | </div></div> | ||
| + | Распределение электронов по уровням можно представить в виде схемы: [[file:Nael.png|70px|Распределение электронов по уровням на примере натрия]] | ||
| + | |||
| + | Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться: | ||
| + | #максимальным количеством электронов: на 1-м уровне не больше 2 e−, | ||
| + | #на 2-м — 8 e−, | ||
| + | #на внешнем уровне — 8 e−; | ||
| + | |||
| + | '''число электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)''' | ||
| + | |||
| + | Тогда для натрия ход рассуждений будет следующий: | ||
| + | #Общее число электронов равно 11, следовательно, первый уровень заполнен и содержит 2 e−; | ||
| + | #Третий, наружный уровень содержит 1 e− (I группа) | ||
| + | #Второй уровень содержит остальные электроны: 11 − (2 + 1) = 8 (заполнен полностью) | ||
| + | |||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | == Изотопы == | ||
| + | '''Изотопы – разновидность атомов одного и того же химического элемента, отличающиеся друг от друга только своей массой.''' | ||
| + | |||
| + | Обозначение изотопов: '''слева от символа элемента указывают массовое число (вверху)''' и '''порядковый номер элемента (внизу)''' | ||
| + | |||
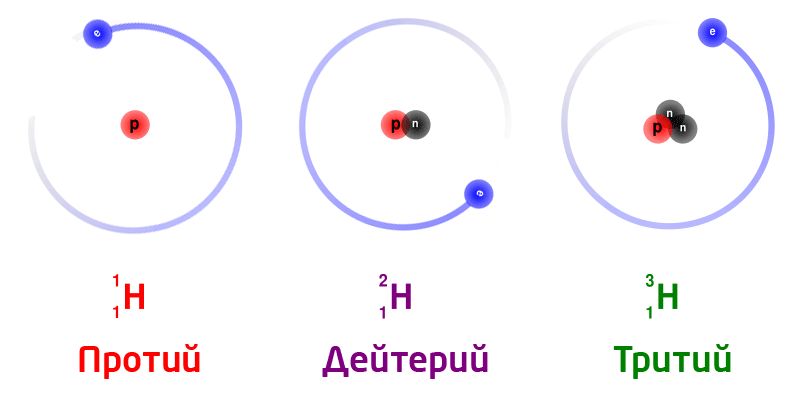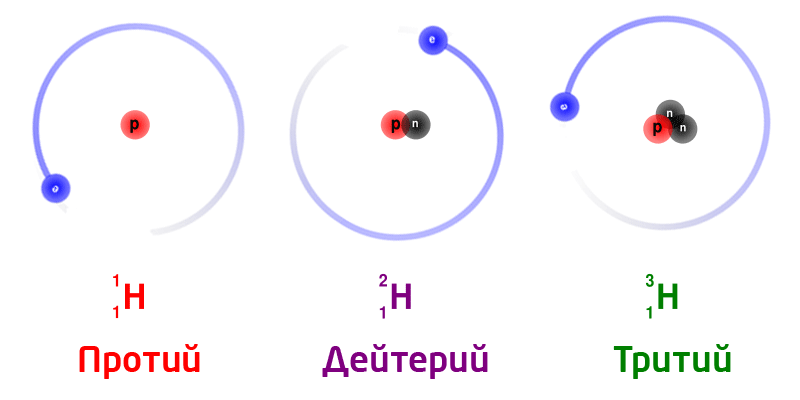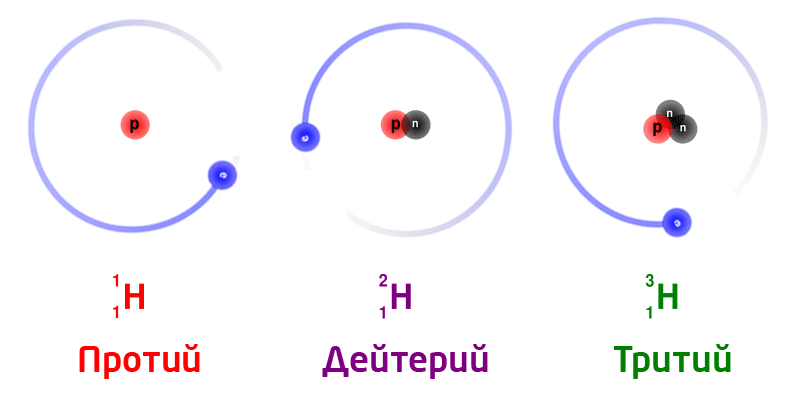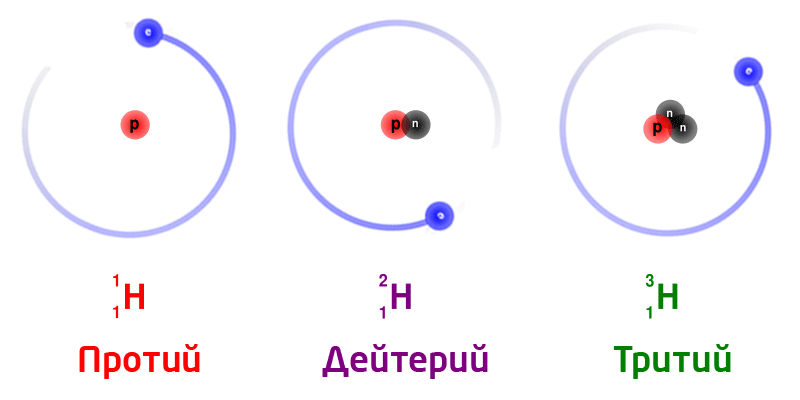
| + | '''Изотопы природного водорода:''' | ||
| + | {{center|[[file:Hydrogen Deuterium Tritium Nuclei Schmatic-de.svg.gif|700px|Изотопы водорода]]}} | ||
| + | |||
| + | Изотопы одного и того же химического элемента имеют разную массу, так как в ядрах содержится разное количество нейтронов. | ||
| + | |||
| + | '''Химический элемент – это вид атомов с одинаковым зарядом ядра.''' | ||
| + | |||
| + | В природе химические элементы существуют в виде смесей изотопов. Изотопный состав одного и того же химического элемента выражают в атомных долях (ωат.), которые указывают какую часть составляет число атомов данного изотопа от общего числа атомов всех изотопов данного элемента, принятого за единицу или 100%. | ||
| + | ---- | ||
| + | Например: | ||
| + | |||
| + | ω<sub>ат</sub> (<sup>35</sup>Сl) = 0,754 или '''75,4%''' | ||
| + | |||
| + | ω<sub>ат</sub> (<sup>37</sup>Сl) = 0,246 или '''24,6%''' | ||
| + | ---- | ||
| + | В таблице Менделеева приведены средние значения относительных атомных масс химических элементов с учётом их изотопного состава. Поэтому Ar , указанные в таблице являются дробными. | ||
| + | |||
| + | '''Ar <sup>средняя</sup>= ω<sub>ат.(1)</sub> x Ar<sub>(1)</sub> + … + ω<sub>ат.(n)</sub> x Ar<sub>(n)</sub>''' | ||
| + | ---- | ||
| + | '''''Например:''''' | ||
| + | |||
| + | Ar <sup>средняя</sup>(Cl) = 0,754 x 35 + 0,246 x 37 = 35,453 | ||
| + | ---- | ||
| + | ==== Почему у изотопов разная масса? ==== | ||
| + | <div class="textblock"> | ||
| + | • Изотопы имеют разную массу из-за различного числа нейтронов в их ядрах. | ||
| + | |||
| + | • В природе химические элементы существуют в виде смесей изотопов. | ||
| + | |||
| + | • В таблице Менделеева приведены средние значения относительных атомных масс химических элементов с учётом их изотопного состава. Поэтому Ar , указанные в таблице являются дробными. </div> | ||
| + | <div class="show-for-large-up">{{right|[[file:Изотопы углерода.png|450px|Изотопы углерода]]}}</div> | ||
| + | <div class="hide-for-large-up">{{center|[[file:Изотопы углерода.png|450px|Изотопы углерода]]}}</div> | ||
| + | Природа устроена так, что один и тот же элемент может существовать в виде двух или нескольких изотопов. Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы. | ||
| + | |||
| + | Изотопами называются вещества, состоящие из атомов с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре. Изотопы отличаются друг от друга только массовым числом. Все элементы состоят из одного или нескольких ''изотопов''. | ||
| + | |||
| + | Например, алмаз состоит из элемента углерода. Если бы удалось изготовить два совершенно одинаковых брильянта из углерода с массовым числом 12 и углерода с массовым числом 13, то оба кристалла в химическом отношении были бы одним и тем же элементом углеродом (заряд ядра + 6), но их масса была бы немного разной. Правда, стоимость брильянтов из чистого углерода-12 и чистого углерода-13 была бы во много раз выше, чем у обычных. Дело в том, что разделять изотопы чрезвычайно трудно из-за того, что их химические и физические свойства очень близки. | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | == Радиоактивность == | ||
| + | <ul class="large-block-grid-2 small-block-grid-1 maintext"> | ||
| + | <li> | ||
| + | 1896 г. Французский физик А. Беккерель, изучая явление люминесценции солей урана, установил, что урановая соль испускает лучи неизвестного типа, которые проходят через бумагу, дерево, тонкие металлические пластины, ионизируют воздух.<br> | ||
| + | |||
| + | <p>1897-98 г. Мария Склодовская-Кюри и Пьер Кюри, исследуя урановые руды, обнаружила новые химические элементы: полоний, радий. Явление самопроизвольного превращения неустойчивых изотопов в устойчивые, сопровождающееся испусканием частиц и излучением энергии, называется естественной радиоактивностью.</p> | ||
| + | </li> | ||
| + | <li> | ||
| + | <ul class=" example-orbit" data-orbit="" data-options="animation:slide; pause_on_hover:true; animation_speed:500; navigation_arrows:true; resume_on_mouseout: true; timer_speed:4500;" > | ||
| + | <li class="active"> | ||
| + | [[file:Слайд1-rad.JPG]] | ||
| + | </li> | ||
| + | <li> | ||
| + | [[file:Слайд2-rad.JPG]] | ||
| + | </li> | ||
| + | <li> | ||
| + | [[file:Слайд3-rad.JPG]] | ||
| + | </li> | ||
| + | <li> | ||
| + | [[file:Слайд4-rad.JPG]] | ||
| + | </li> | ||
| + | <li> | ||
| + | [[file:Слайд5-rad.JPG]] | ||
| + | </li> | ||
| + | <li> | ||
| + | [[file:Слайд6-rad.JPG]] | ||
| + | </li> | ||
| + | <li> | ||
| + | [[file:Слайд7-rad.JPG]] | ||
| + | </li> | ||
| + | <li> | ||
| + | [[file:Слайд8-rad.JPG]] | ||
| + | </li> | ||
| + | <li> | ||
| + | [[file:Слайд9-rad.JPG]] | ||
| + | </li> | ||
| + | </ul> | ||
| + | </li> | ||
| + | </ul> | ||
| + | '''Все химические элементы, начиная с порядкового номера 83, являются радиоактивными.''' | ||
| + | === Виды радиоактивных излучений === | ||
| + | 1898 г. подвергая радиоактивное излучение действию магнитного поля, Э. Резерфорд выделил два вида лучей: α-лучи — тяжелые положительно заряженные частицы (ядра атомов гелия) и β-лучи — легкие отрицательно заряженные частицы (тождественны электронам). | ||
| + | {{center|[[file:Types radiotion big.png|650px|Виды радиоактивного излучения]]}} | ||
| + | В 1900 г. П. Виллард открыл γ-лучи — нейтральное излучение, где масса покоя равна нулю (аналогично свойствам света, но ). После установления Резерфордом структуры атома стало ясно, что радиоактивность представляет собой ядерный процесс.1902 г. Э. Резерфорд и Ф. Содди доказали, что в результате радиоактивного распада происходит превращение атомов одного химического элемента в атомы другого химического элемента, сопровождаемое испусканием различных частиц и сформулировали правила смещения. | ||
| + | |||
| + | |||
| + | |||
| + | == Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева == | ||
| + | Основной источник познаний о химических элементах – [[Химия: Периодический закон и система#Периодическая система химических элементов|Периодическая система химических элементов Д. И. Менделеева]]. Навыки описывать химический элемент, имея перед собой только эту таблицу, крайне необходимы любому ученику и являются основой познаний о химии. | ||
| + | |||
| + | Составим план описания химического элемента с помощью Периодической системы Д.И. Менделеева и дадим описание одного химического элемента металла и одного неметалла в соответствии с составленным планом. | ||
| + | |||
| + | <div class="mw-customtoggle-plan resettext" style="background-color:#bbcdff; padding:3px">'''План описания химического элемента'''</div> <br> | ||
| + | |||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-plan"> | ||
| + | #Находим химический элемент в таблице и по его положению описываем строение его атомов. | ||
| + | #Все химические элементы в таблице делятся на металлы и неметаллы. Отмечаем металл или неметалл, описываемый нами элемент. | ||
| + | #Сравнение свойств нашего простого вещества металла или неметалла с соседними по подгруппе элементами. | ||
| + | #Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами. | ||
| + | #Состав и характеристика высшего оксида описываемого элемента (то есть относится к основным, кислотным или амфотерным). | ||
| + | #Состав и характеристика высшего гидроксида (то есть он является основанием, амфотерным гидроксидом, кислородосодержащей кислотой). | ||
| + | #Если элемент неметалл, то состав летучего водородного соединения. | ||
| + | #При описании химического элемента металла и неметалла следует руководствоваться знаниями о строении химических элементов, а также основными закономерностями изменения свойств атомов, простых веществ и соединений, образованных химическими элементами главных подгрупп и периодов Периодической системы Д. И. Менделеева, которые были рассмотрены ранее. | ||
| + | ---- | ||
| + | </div> | ||
| + | <div class="mw-customtoggle-Ca resettext" style="background-color:#bbcdff; padding:3px">'''Характеристика металла на примере кальция (Са)'''</div> <br> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-Ca"> | ||
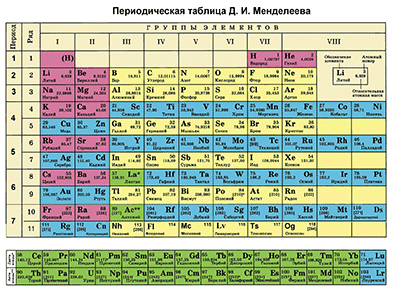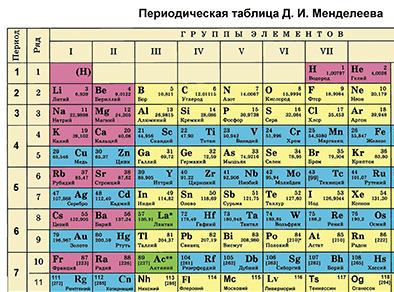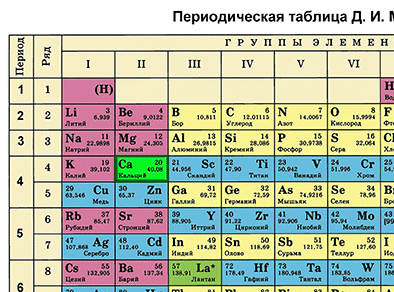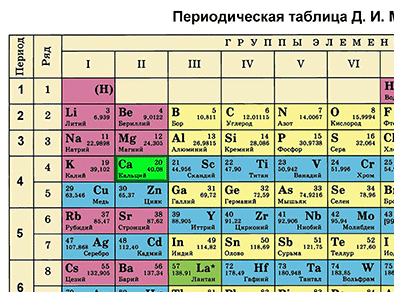
| + | '''Первый пункт''' - находим химический элемент в таблице и по его положению описываем строение его атомов. | ||
| + | |||
| + | {{center|[[Файл:Mends Ca.gif|350px|Находим кальций в таблице Менделеева]]}} | ||
| + | |||
| + | Кальций в Периодической системе находится под номером 20 и имеет относительную атомную массу 40. Значит, порядковый номер кальция равен 20 и заряд его ядра +20 ('''Z''' (зэт) - число протонов, имеющих положительный заряд). Массовое число равно 40 ('''А'''=40 (а равно 40)). Отсюда находим '''N''' (эн) – число нейтронов, не имеющих заряда. '''N = А – Z''' (эн равно а минус зэт) равно 20. Так как атом в целом электронейтрален (число протонов равно числу электронов), то число электронов равно 20. | ||
| + | |||
| + | Химический элемент кальций находится в четвертом периоде Периодической системы, значит, электроны расположены на четырех энергетических уровнях. Записываем на основании этого электронную формулу кальция: | ||
| + | |||
| + | <sub>20</sub>Ca 2e<sup>-</sup> 8e<sup>-</sup> 8e<sup>-</sup> 2e<sup>-</sup> ''(черточки над е)'' Это значит, что на первом энергетическом уровне вокруг ядра атома кальция находится два электрона, на втором – восемь, на третьем – тоже восемь, на четвертом – два электрона. | ||
| + | |||
| + | Из электронной формулы видно, что кальций имеет на внешнем ''(четвертом)'' энергетическом уровне два электрона, то есть, отдавая внешние, наименее устойчивые электроны, он будет проявлять восстановительные свойства и иметь степень окисления +2. Восстановительные свойства кальция будут выражены сильнее, чем у магния и бериллия, но слабее, чем у стронция. Это обусловлено тем, что чем больше радиус атома (он возрастает с увеличением количества энергетических уровней), тем легче внешние электроны покидают атом, так как связь с ядром уменьшается. | ||
| + | |||
| + | Когда электроны покидают внешнюю оболочку атома, он превращается в ион. В частности, кальций превращается в ион Са<sup>2+</sup> (кальций-два-плюс). | ||
| + | |||
| + | '''Второй пункт''' плана описания. Отмечаем металл или неметалл, описываемый нами элемент. | ||
| + | |||
| + | Атомы кальция образуют простое вещество, соединяясь металлической связью в металлическую кристаллическую решетку. Значит, кальций металл, обладающий такими металлическими свойствами как металлический блеск, хорошая теплопроводность и электропроводность, пластичность, высокая плотность и высокая температура плавления. | ||
| + | |||
| + | '''Третий пункт''' плана. Сравнение свойств простого вещества металла или неметалла с соседними по подгруппе элементами. | ||
| + | |||
| + | Металлические свойства кальция сильнее, чем у бериллия и магния, но слабее, чем у стронция. Металлические свойства веществ обусловлены способностью атомов, входящих в эти вещества отдавать внешние электроны. Из предыдущего пункта известно, что атом кальция гораздо быстрее отдает свои внешние электроны, чем бериллий и магний. | ||
| + | |||
| + | '''Четвертый пункт''' плана. Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами. | ||
| + | |||
| + | Металлические свойства кальция выражены слабее, чем у калия. Калий на внешнем энергетическом уровне содержит только один электрон, а кальций два. Так как металлические свойства обусловлены устойчивостью электронов на внешнем энергетическом уровне атома (чем менее устойчивы электроны, тем выше металлические свойства), то один электрон у калия будет менее устойчив, а значит, его металлические свойства будут выше. | ||
| + | |||
| + | '''Пятый пункт''' плана. Состав и характеристика высшего оксида описываемого элемента. | ||
| + | |||
| + | Оксид кальция СаО (кальций-о) является основным оксидом и проявляет такие свойства основного оксида как взаимодействие с водой с образованием щелочи, взаимодействие с кислотным оксидом с образованием соли, взаимодействие с кислотой с образованием соли и воды. | ||
| + | |||
| + | '''Шестой пункт''' плана. Состав и характеристика высшего гидроксида. | ||
| + | |||
| + | В качестве гидроксида кальцию соответствует основание Са(ОН)<sub>2</sub> (кальций-о-аш-два). Он проявляет типичные свойства оснований: мылкость на ощупь, изменение окраски индикаторов, взаимодействие с кислотами с образованием соли и воды, взаимодействие с оксидом неметалла с образованием соли и воды, взаимодействие с солью с образованием новой соли и нового основания. | ||
| + | |||
| + | Последний, '''седьмой пункт''' - состав летучего водородного соединения. Металл кальций летучего водородного соединения не образует. | ||
| + | ---- | ||
| + | </div> | ||
| + | <div class="mw-customtoggle-P resettext" style="background-color:#bbcdff; padding:3px">'''Характеристика неметалла на примере фосфора (Р)'''</div> <br> | ||
| + | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-P"> | ||
| + | '''Первый пункт''' - находим химический элемент в таблице и по его положению описываем строение его атомов. | ||
| + | |||
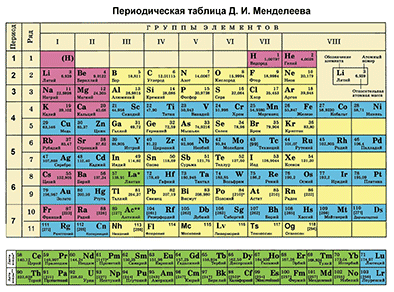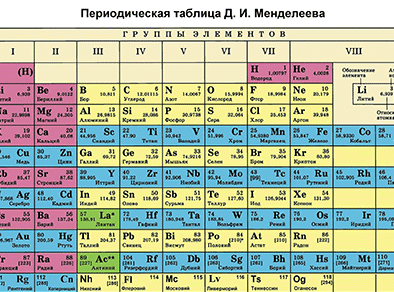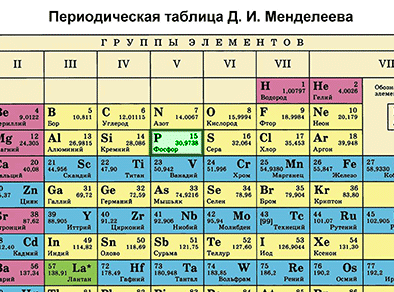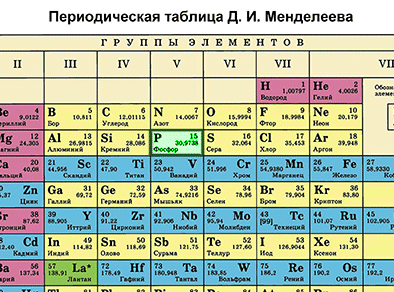
| + | {{center|[[Файл:Mends P.gif|350px|Находим фосфор в таблице Менделеева]]}} | ||
| + | |||
| + | '''Фосфор''' – элемент VA-группы Периодической системы, 3-го периода. Порядковый номер фосфора равен 15 и заряд его ядра +15 (число протонов '''Z''' (зэт)). Так как атом в целом электронейтрален (число протонов равно числу электронов), то число электронов равно 15. Массовое число 30 ('''А'''=30 (а равно 30)). Отсюда находим '''N''' (эн) – число нейтронов. '''N = А – Z''' (эн равно а минус зэт) равно 15. Записываем строение электронной оболочки фосфора. | ||
| + | |||
| + | <sub>15</sub>Р 2е<sup>-</sup>8е<sup>-</sup>5е<sup>-</sup> (черточки над е). Это значит, что на первом энергетическом уровне вокруг ядра атома кальция находится два электрона, на втором – восемь, на третьем – пять электронов. | ||
| + | |||
| + | '''Второй пункт''' плана описания. Отмечаем металл или неметалл, описываемый нами элемент. | ||
| + | |||
| + | Атомы фосфора проявляют как окислительные (степень окисления при этом -3), так и восстановительные свойства (степени окисления +3 и +5). | ||
| + | |||
| + | Фосфор – менее сильный окислитель, чем азот, но более сильный, чем мышьяк. Это связано с тем, что радиус атомов от азота к мышьяку увеличивается. По этой же причине восстановительные свойства пятой группы, главной подгруппы при переходе от азота к мышьяку усиливаются. | ||
| + | |||
| + | Фосфор относится к типичным неметаллам. Строение кристаллической решетки фосфора зависит от его аллотропной модификации. Есть белый, красный и черный фосфор. У наиболее распространенного белого фосфора молекулы имеют вид тэтраэдра. Красный и черный фосфор имеют иное строение кристаллической решетки. | ||
| + | |||
| + | '''Третий пункт''' плана. Сравнение свойств простого вещества металла или неметалла с соседними по подгруппе элементами. | ||
| + | |||
| + | Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка. | ||
| + | |||
| + | '''Четвертый пункт''' плана. Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами. | ||
| + | |||
| + | Неметаллические свойства у фосфора выражены сильнее, чем у кремния, но слабее, чем у серы. | ||
| + | |||
| + | '''Пятый пункт''' плана. Состав и характеристика высшего оксида описываемого элемента. | ||
| + | |||
| + | Высший оксид фосфора имеет формулу Р<sub>2</sub>О<sub>5</sub> (пэ-два-о-пять). Это кислотный оксид, который проявляет все типичные свойства кислотных оксидов. Например, такие как при взаимодействии со щелочью образовывать соль и воду, при взаимодействии с основным оксидом образовывать соль, при взаимодействии с водой образовывать кислоту. | ||
| + | |||
| + | '''Шестой пункт''' плана. Состав и характеристика высшего гидроксида. | ||
| + | |||
| + | Высший гидроксид фосфора – фосфорная кислота Н<sub>3</sub>РО<sub>4</sub> (аш-три-пэ-о-четыре), раствор которой проявляет все типичные свойства кислот. Например, такие как кислый вкус, изменение окраски индикаторов, взаимодействие с основаниями и оксидами металлов с образованием соли и воды. | ||
| + | |||
| + | '''Cедьмой пункт''' - состав летучего водородного соединения. | ||
| + | |||
| + | С водородом фосфор образует летучее соединение фосфин РН<sub>3</sub> (пэ-аш-три). | ||
| + | ---- | ||
| + | </div> | ||
| + | '''''При помощи Периодической системы Д. И. Менделеева можно дать характеристику большинству элементов-металлов и элементов-неметаллов главных подгрупп.''''' | ||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | |||
| + | == Глоссарий == | ||
| + | :{{bib|'''d-элементы''' – элементы, в которых заполняется d-подуровень второго снаружи уровня.}} | ||
| + | :{{bib|'''f-элементы''' – элементы в которых заполняется f-подуровень третьего снаружи уровня.}} | ||
| + | :{{bib|'''Завершенность внешнего уровня''' – если на внешнем уровне атома 8 электронов (для водорода и гелия 2 электрона)}} | ||
| + | :{{bib|'''Изотопы''' – разновидность атомов одного и того же химического элемента, отличающиеся друг от друга только своей массой, с одинаковым порядковым номером.}} | ||
| + | :{{bib|'''Металлические свойства''' – способность атома отдавать электроны до завершения внешнего уровня.}} | ||
| + | :{{bib|'''Неметаллические свойства''' - способность атома принимать электроны до завершения внешнего уровня.}} | ||
| + | :{{bib|'''Орбиталь (s, p, d, f)''' – часть атомного пространства, в котором вероятность нахождения данного электрона наибольшая (~ 90%).}} | ||
| + | :{{bib|'''Радиоактивность''' - это явление распада изотопов с излучением субатомных частиц и электромагнитных волн.}} | ||
| + | :{{bib|'''Радиус атома''' – расстояние от ядра атома до внешнего уровня}} | ||
| + | :{{bib|'''р-элементы''' – элементы, в атомах которых электронами заполняется p-подуровень внешнего энергетического уровня.}} | ||
| + | :{{bib|'''Состав атомного ядра''' входят элементарные частицы – протоны (p) и нейтроны (n).}} | ||
| + | :{{bib|'''Химический элемент''' – это вид атомов с определённым зарядом ядра.}} | ||
| + | :{{bib|'''Электронное облако''' – это модель квантовой механики, описывающая движение электрона в атоме.}} | ||
| + | :{{bib|'''Энергетический уровень''' – это энергетический слой с определённым уровнем энергии находящихся на нём электронов.Число энергетических уровней в атоме химического элемента равно номеру периода, в котором этот элемент расположен.}} | ||
| + | |||
| + | == Полезные ссылки == | ||
| + | {{bib|[http://s-konda.ru/exam/chemistry_9-3.htm S-konda.ru Готовимся к экзаменам.]}} | ||
| + | {{bib|«Строение атома. Состав атомных ядер. Изотопы. Химический элемент», «Строение электронных оболочек атомов первых 20 элементов периодической системы Д. И. Менделеева» : Сайт « Химуля. Соm» [ Электронный ресурс]// URL: https://sites.google.com/site/himulacom/zvonok-na-urok/8-klass (дата обращения 04.03.18)}} | ||
| + | {{bib|«Строение атомного ядра. Субатомные частицы. Элементы Изотопы» : Сайт «Химуля. Соm» » [ Электронный ресурс]// URL: http://www.hemi.nsu.ru/ucheb123.htm (дата обращения 04.03.18)}} | ||
| + | {{bib|Картинка «Виды радиоактивных излучений»: Сайт « Doza.pro» [ Электронный ресурс]// URL: https://www.google.com/imgres?imgurl (дата обращения 04.03.18)}} | ||
| + | {{bib|Картинка « Изотопы»: Сайт « Калкулятор. Справочный портал» [ Электронный ресурс]// URL: https://www.calc.ru/Izotopy.html (дата обращения 04.03.18)}} | ||
| + | {{bib|Картинка «Модели строения атомов»: Сайт «Tutor. Onlin» [ Электронный ресурс]// URL: https://www.tutoronline.ru/blog/modeli-stroenija-atomov (дата обращения 04.03.18)}} | ||
| + | <br> | ||
| + | |||
| + | == Библиография == | ||
| + | нету | ||
| + | * {{bib|Ахметов Н. С. Актуальные вопроса курса неорганической химии. — М.: Просвещение, 1991. — 224 с — ISBN 5-09-002630-0}} | ||
| + | |||
| + | <div class="light" style="float:right;>[[#Начало|В начало]]</div><br clear=all /> | ||
| + | </div> | ||
| + | |||
| + | <!-- Sidebar --> | ||
| + | <div class="large-4 medium-5 columns"> | ||
| + | <!-- Первый элемент сайдбара Это интересно или топ5/10/15 --> | ||
| + | <div class="sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Занимательные факты</div> | ||
| + | </div> | ||
| + | {{center|[[file:САХЭ1.jpg|400px|Атомная подводная лодка USS Tucson (SSN-770)]]}} | ||
| + | На борту атомной подводной лодки фоновая радиация меньше, чем на суше. | ||
| + | {{center|[[file:САХЭ2.jpg|400px|Центральный вокзал Нью-Йорка]]}} | ||
| + | При постройке Центрального вокзала Нью-Йорка было использовано большое количество гранита. По этой причине уровень радиации там очень высок и превышает даже нормы, допустимые на атомных электростанциях. | ||
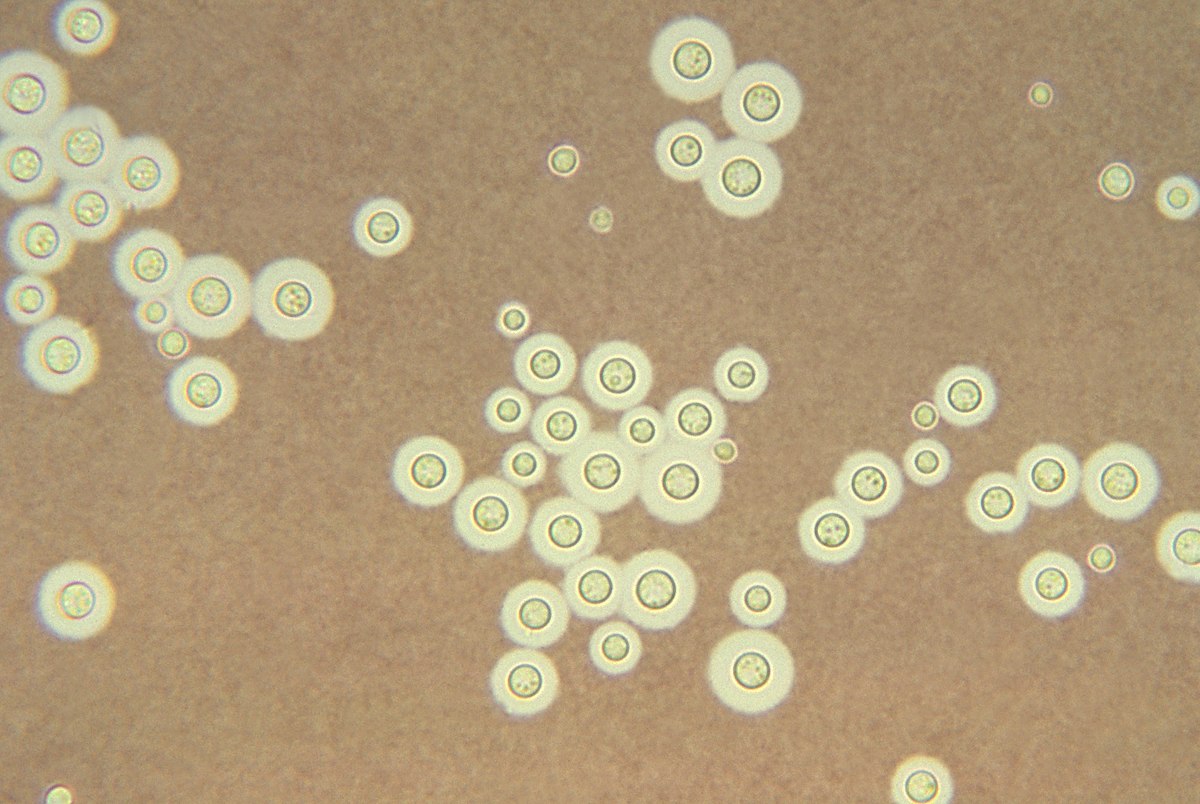
| + | {{center|[[file:САХЭ3.jpg|400px|Cryptococcus neoformans под микроскопом]]}} | ||
| + | В Чернобыльской зоне растут грибы под названием Cryptococcus neoformans, которые отлично себя чувствуют под воздействием излучения. | ||
| + | {{center|[[file:САХЭ11.jpg|400px|Чернобыльская АЭС]]}} | ||
| + | Владимир Правик был одним из первых пожарных, тушивших Чернобыльскую АЭС. Говорят, что под воздействием радиации его глаза поменяли цвет с коричневого на голубой. | ||
| + | |||
| + | Высаженные в Чернобыльской зоне соевые бобы развили антирадиационную защиту. Это открытие может пригодиться людям. | ||
| + | |||
| + | После изучения жизни вокруг Чернобыля и других зон атомных катастроф обнаружилось, что некоторые виды выжили благодаря генетическим мутациям, произошедшим под воздействием радиации. | ||
| + | {{center|[[file:САХЭ4.jpg|400px|Табачный дым]]}} | ||
| + | Средний курильщик в течение года получает дозу излучения, примерно равную 300 рентгеновским процедурам. Это связано с тем, что в дыме присутствуют радиоактивные изотопы. | ||
| + | {{center|[[file:САХЭ5.jpg|400px|Нейтронная звезда (рис.)]]}} | ||
| + | 24 декабря 2004 года Земля попала под самый сильный в истории выброс радиации. Этот выброс пришёл от нейтронной звезды, находящейся в 50 тысячах световых лет от нашей планеты. | ||
| + | {{center|[[file:САХЭ6.png|400px|Бананы]]}} | ||
| + | Бананы имеют довольно высокий уровень радиоактивности. | ||
| + | {{center|[[file:САХЭ7.jpg|400px|Астронавт в открытом космосе]]}} | ||
| + | Закрывая глаза, астронавты иногда видят яркие вспышки. Они вызваны космическим излучением, попадающим на сетчатку. | ||
| + | {{center|[[file:САХЭ8.jpg|400px|Стюардесса]]}} | ||
| + | Пилоты и стюардессы в год получают большую дозу излучения, чем работники АЭС. Поэтому они официально классифицируются как «работающие в условиях радиации». | ||
| + | {{center|[[file:САХЭ9.jpg|400px|Обогащенный уран 235]]}} | ||
| + | Горсть урана почти так же радиоактивна, как 10 бананов. Мы ведь говорили, что бананы радиоактивны! | ||
| + | {{center|[[file:САХЭ10.jpg|400px|Кадры хроники «Манхэттенского проекта»]]}} | ||
| + | Программа США по разработке ядерного оружия получила название «Манхэттенский проект». В рамках этой программы ставились довольно жестокие эксперименты по воздействию радиации на человека. Например, малышей кормили радиоактивной овсянкой. | ||
| + | |||
| + | В рамках того же Манхэттенского проекта Альберт Стивенс получил инъекцию плутония. Он умер лишь спустя 20 лет и стал человеком, прожившим дольше всего после такой дозы радиации. | ||
| + | {{center|[[file:САХЭ12.jpg|400px|Мария Кюри]]}} | ||
| + | Радий, открытый Марией Кюри, сначала использовали везде — от зубной пасты до конфет. Естественно, это привело к проблемам со здоровьем. | ||
| + | {{center|[[file:САХЭ13.jpg|400px|Современная АЭС]]}} | ||
| + | Люди, живущие рядом с угольными электростанциями, получают большую дозу излучения, чем те, кто живёт рядом с АЭС. | ||
| + | {{center|[[file:САХЭ14.jpg|400px|Аура человека]]}} | ||
| + | Оказалось, что на самом деле человек излучает больше радиации, чем его сотовый телефон. | ||
| + | {{center|[[file:САХЭ15.jpg|400px|Промышленные отходы]]}} | ||
| + | Промышленные отходы, содержащие мышьяк, более вредны для людей, чем аналогичное количество ядерных отходов. | ||
| + | |||
| + | '''Мы постоянно подвергаемся воздействию радиации, большая часть которой безвредна. Опасно только ионизирующее излучение в достаточно высоких дозах (рентгеновские лучи, гамма-лучи и т. п.)''' | ||
| + | </div> | ||
| + | |||
| + | <div class="sbstyle"> | ||
| + | <div class="row"> | ||
| + | <div class="large-10 small-10 large-centered small-centered columns rubric">Любопытное об атоме</div> | ||
| + | </div> | ||
| + | {{center|[[file:LAtom1.png|150px|В точке в конце предложения может уместиться 2 млрд атомов.]]}} | ||
| + | |||
| + | В точке в конце предложения может уместиться 2 млрд атомов. | ||
| + | |||
| + | {{center|[[file:LAtom2.png|150px|В одной песчинке столько же атомов, сколько самих песчинок на всем пляже.]]}} | ||
| + | |||
| + | В одной песчинке столько же атомов, сколько самих песчинок на всем пляже. | ||
| + | |||
| + | {{center|[[file:LAtom3.png|150px|Толщина книжной страницы – около полумиллиона атомов.]]}} | ||
| + | |||
| + | Толщина книжной страницы – около полумиллиона атомов. | ||
| + | |||
| + | {{center|[[file:LAtom4.png|150px|В настоящее время официальное число субатомных частиц – 24.]]}} | ||
| + | |||
| + | В настоящее время официальное число субатомных частиц – 24. | ||
| + | |||
| + | {{center|[[file:LAtom5.png|150px|В космосе содержится в среднем два атома на кубический метр, хотя иногда сила тяготения собирает их вместе, превращая в звезды, планеты и жирафов.]]}} | ||
| + | |||
| + | В космосе содержится в среднем два атома на кубический метр, хотя иногда сила тяготения собирает их вместе, превращая в звезды, планеты и жирафов. | ||
| + | |||
| + | {{center|[[file:LAtom6.png|150px|Если бы электрон весил как монета в 50 тыйынов, то протон весил бы как четыре литра молока.]]}} | ||
| + | |||
| + | Если бы электрон весил как монета в 50 тыйынов, то протон весил бы как четыре литра молока. | ||
| + | |||
| + | {{center|[[file:LAtom7.png|150px|Если из атомов, которые составляют всех людей на Земле, удалить пустоты, то все человечество целиком сжалось бы до размера яблока.]]}} | ||
| + | |||
| + | Если из атомов, которые составляют всех людей на Земле, удалить пустоты, то все человечество целиком сжалось бы до размера яблока. | ||
| + | |||
| + | {{center|[[file:LAtom8.png|150px|Если представить атом в виде сферы диаметром один километр, то его ядро будет размером с мелкую монету.]]}} | ||
| + | |||
| + | Если представить атом в виде сферы диаметром один километр, то его ядро будет размером с мелкую монету. | ||
| + | </div> | ||
| + | </div> | ||
{{lang|Химия: Строение атомов химических элементов}} | {{lang|Химия: Строение атомов химических элементов}} | ||
| + | [[Category:Средняя школа]] | ||
| + | [[Category:Химия]] | ||
Версия 05:38, 29 апреля 2018
Содержание
Строение атома
Гипотеза о том, что все вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий тому назад. Сторонники атомистической теории (Демокрит, Левкипп, Анаксагор, Анаксимандр, Эпикур, Лукреций Кар) рассматривали атом как мельчайшую неделимую частицу и считали, что все многообразие мира есть не что иное, как сочетание неизменных частиц — атомов.
Демокрит: «Cуществует предел деления атома».
Аристотель: «Делимость вещества бесконечна».
Париж, 1626 г.: «Учение об атоме запрещено под страхом смерти».
Сторонниками атомистической теории были М.В. Ломоносов, Ж. Гей-Люссак, Д. Дальтон и др.
Толчком к подробному изучению строения атома послужили:
- открытие рентгеновского излучения (1895 г., В.К. Рентген);
- открытие радиоактивности и новых радиоактивных элементов (1896 г., А. Беккерель, М. и П. Кюри);
- открытие электрона (1896 г., Дж. Дж. Томсон).
Мысль об электронном строении атома, впервые высказанную В. Вебером в 1896 г., развил X. Лоренц: «Электроны входят в состав атома». Опираясь на эти открытия, Дж. Томсон в 1898 г. предложил модель атома в виде положительно заряженного шара радиусом 10-10 м. в котором плавают электроны, нейтрализующие положительный заряд.
Ядерная модель атома
Экспериментальная проверка модели Томсона была осуществлена в 1911 г. английским физиком Э. Резерфордом.
Идея опыта заключалась в изучении рассеяния α-частиц (заряд +2е, масса 6,64.10-27 кг) на атомах. α-частицы были выбраны, т.к. их кинетическая энергия много больше кинетической энергии электронов (β-лучи) и, в отличие от γ-лучей они имеют электрический заряд.
Пучок α-частиц пропускался через тонкую золотую фольгу. Золото было выбрано как очень пластичный материал, из которого можно получить фольгу толщиной практически в один атомный слой. Опыты были повторены и на других материалах
Э. Резерфорд и его помощники Г. Гейгер и Э. Марсден обнаружили, что какая-то частьa-частиц отклоняется на довольно значительный угол от своего первоначального направления, а небольшая часть отражается от фольги. Но согласно модели атома Томсона эти α-частицы при взаимодействии с атомами фольги отклоняются на малые углы, порядка 2°.
Резерфорд показал, что модель Томсона находится в противоречии с его опытами. Обобщая результаты своих опытов, Резерфорд предложил ядерную (планетарную) модель строения атома:
- Атом имеет ядро, размеры которого малы по сравнению с размерами самого атома (~ 10-15 м).
- В ядре сконцентрирована почти вся масса атома.
- Отрицательный заряд всех электронов распределен по всему объему атома и компенсирует положительный заряд ядра.
Расчеты показали, что α-частицы, которые взаимодействуют с электронами в веществе, почти не отклоняются.
Однако предложенная модель строения атома не позволила объяснить устойчивость атома:
- ускоренное движение электрона согласно теории Максвелла сопровождается электромагнитным излучением, поэтому энергия электрона уменьшается, и он движется по спирали, приближаясь к ядру. Казалось бы, электрон должен упасть на ядро (расчет показывает, что это должно произойти за 10-8 с), так как при движении по спирали уменьшается энергия электрона, в действительности атомы являются устойчивыми системами;
- спектр излучения при этом должен быть непрерывным (должны присутствовать все длины волн). На опыте спектр получается линейчатым;
- нет ответа на вопрос о строении ядра. Если в него входят только положительные частицы, то почему они не отталкиваются?
Состав атомного ядра
Атом — наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. В 1911 г англ. учёный Э. Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами.
Общий заряд свободного атома равен нулю, так как заряды ядра и электронной оболочки уравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен −1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц – нейтронов, не имеющих заряда. Обобщенные характеристики элементарных частиц в составе атома можно представить в виде таблицы:
| Название частицы | Обозначение | Заряд | Масса |
|---|---|---|---|
| протон | p | +1 | 1 |
| нейтрон | n | 0 | 1 |
| электрон | e− | −1 | принимается равной 0 |
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 − 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями – ква́нтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем — высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле: N = 2n2, где N — максимальное число электронов на уровне, n — номер уровня.
Тогда для первого уровня N = 2 x 12 = 2,
для второго N = 2 x 22 = 8 и т. д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень важно понимать, что уровни читаются снизу вверх, что соответствует их энергии. Поэтому столбик цифр в клеточке с натрием:
1
8
2
cледует читать так:
на 1-м уровне — 2 электрона,
на 2-м уровне — 8 электронов,
на 3-м уровне — 1 электрон
Распределение электронов по уровням можно представить в виде схемы: ![]()
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
- максимальным количеством электронов: на 1-м уровне не больше 2 e−,
- на 2-м — 8 e−,
- на внешнем уровне — 8 e−;
число электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
Тогда для натрия ход рассуждений будет следующий:
- Общее число электронов равно 11, следовательно, первый уровень заполнен и содержит 2 e−;
- Третий, наружный уровень содержит 1 e− (I группа)
- Второй уровень содержит остальные электроны: 11 − (2 + 1) = 8 (заполнен полностью)
Изотопы
Изотопы – разновидность атомов одного и того же химического элемента, отличающиеся друг от друга только своей массой.
Обозначение изотопов: слева от символа элемента указывают массовое число (вверху) и порядковый номер элемента (внизу)
Изотопы природного водорода:
Изотопы одного и того же химического элемента имеют разную массу, так как в ядрах содержится разное количество нейтронов.
Химический элемент – это вид атомов с одинаковым зарядом ядра.
В природе химические элементы существуют в виде смесей изотопов. Изотопный состав одного и того же химического элемента выражают в атомных долях (ωат.), которые указывают какую часть составляет число атомов данного изотопа от общего числа атомов всех изотопов данного элемента, принятого за единицу или 100%.
Например:
ωат (35Сl) = 0,754 или 75,4%
ωат (37Сl) = 0,246 или 24,6%
В таблице Менделеева приведены средние значения относительных атомных масс химических элементов с учётом их изотопного состава. Поэтому Ar , указанные в таблице являются дробными.
Ar средняя= ωат.(1) x Ar(1) + … + ωат.(n) x Ar(n)
Например:
Ar средняя(Cl) = 0,754 x 35 + 0,246 x 37 = 35,453
Почему у изотопов разная масса?
• Изотопы имеют разную массу из-за различного числа нейтронов в их ядрах.
• В природе химические элементы существуют в виде смесей изотопов.
• В таблице Менделеева приведены средние значения относительных атомных масс химических элементов с учётом их изотопного состава. Поэтому Ar , указанные в таблице являются дробными.Природа устроена так, что один и тот же элемент может существовать в виде двух или нескольких изотопов. Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Изотопами называются вещества, состоящие из атомов с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре. Изотопы отличаются друг от друга только массовым числом. Все элементы состоят из одного или нескольких изотопов.
Например, алмаз состоит из элемента углерода. Если бы удалось изготовить два совершенно одинаковых брильянта из углерода с массовым числом 12 и углерода с массовым числом 13, то оба кристалла в химическом отношении были бы одним и тем же элементом углеродом (заряд ядра + 6), но их масса была бы немного разной. Правда, стоимость брильянтов из чистого углерода-12 и чистого углерода-13 была бы во много раз выше, чем у обычных. Дело в том, что разделять изотопы чрезвычайно трудно из-за того, что их химические и физические свойства очень близки.
Радиоактивность
-
1896 г. Французский физик А. Беккерель, изучая явление люминесценции солей урана, установил, что урановая соль испускает лучи неизвестного типа, которые проходят через бумагу, дерево, тонкие металлические пластины, ионизируют воздух.
1897-98 г. Мария Склодовская-Кюри и Пьер Кюри, исследуя урановые руды, обнаружила новые химические элементы: полоний, радий. Явление самопроизвольного превращения неустойчивых изотопов в устойчивые, сопровождающееся испусканием частиц и излучением энергии, называется естественной радиоактивностью.
Все химические элементы, начиная с порядкового номера 83, являются радиоактивными.
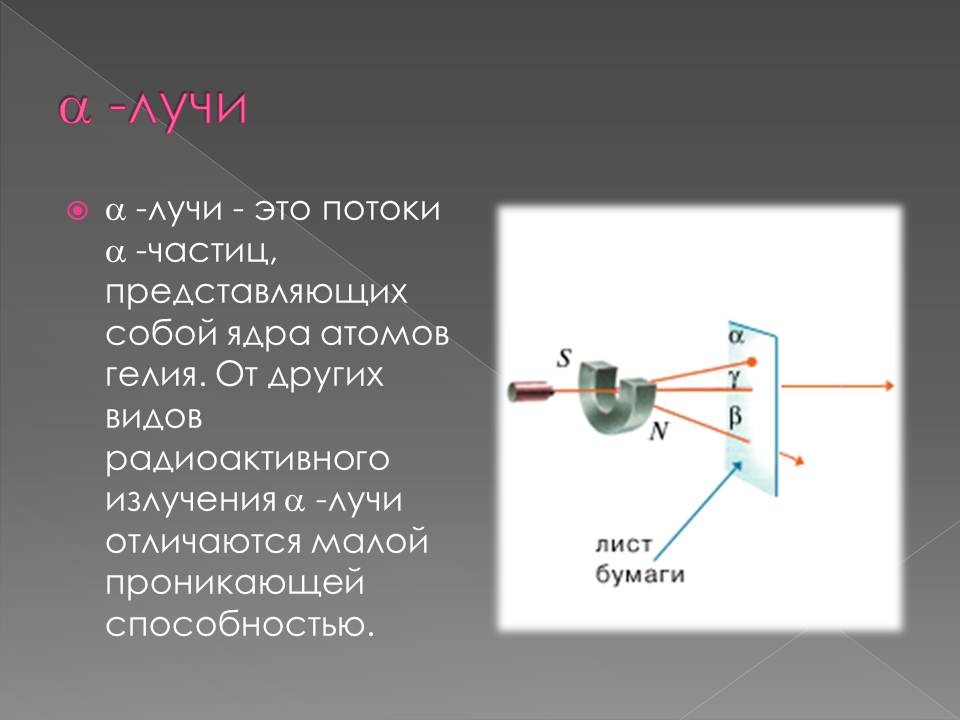
Виды радиоактивных излучений
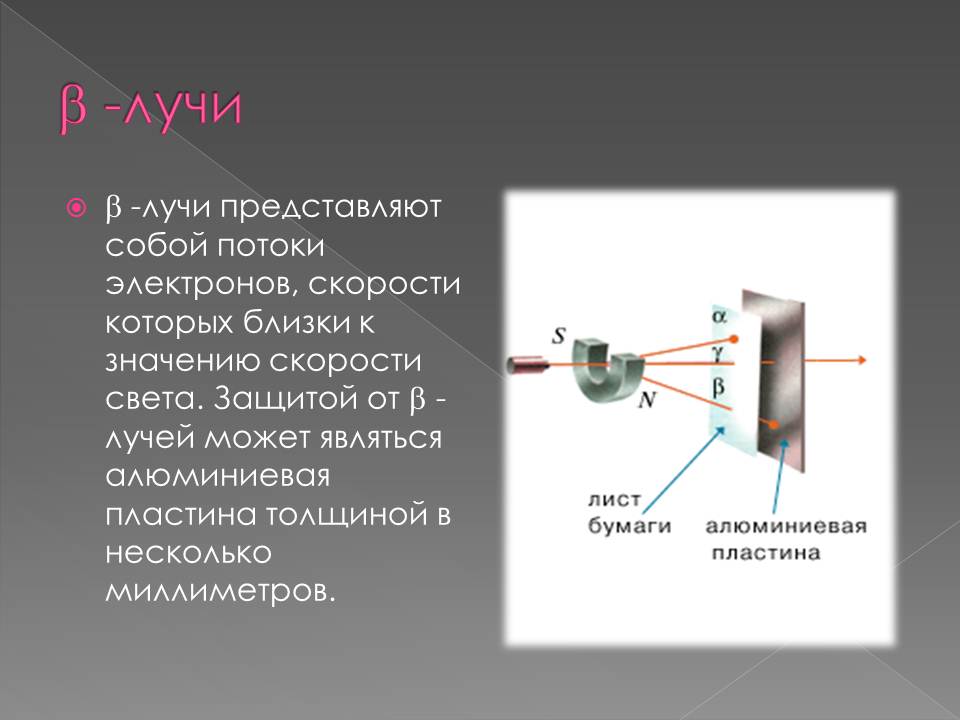
1898 г. подвергая радиоактивное излучение действию магнитного поля, Э. Резерфорд выделил два вида лучей: α-лучи — тяжелые положительно заряженные частицы (ядра атомов гелия) и β-лучи — легкие отрицательно заряженные частицы (тождественны электронам).
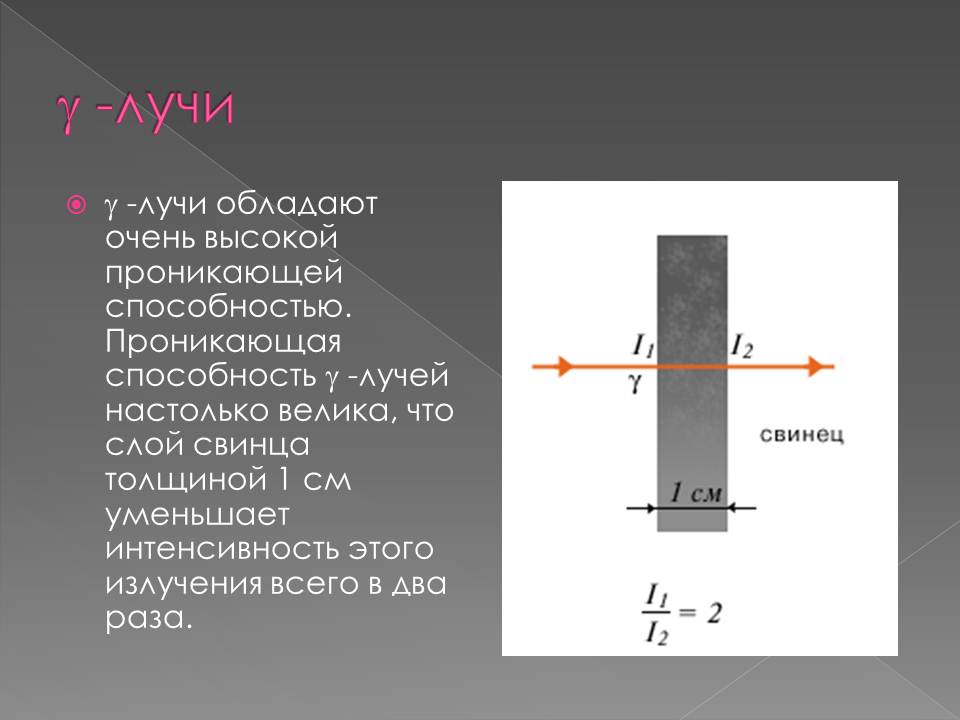
В 1900 г. П. Виллард открыл γ-лучи — нейтральное излучение, где масса покоя равна нулю (аналогично свойствам света, но ). После установления Резерфордом структуры атома стало ясно, что радиоактивность представляет собой ядерный процесс.1902 г. Э. Резерфорд и Ф. Содди доказали, что в результате радиоактивного распада происходит превращение атомов одного химического элемента в атомы другого химического элемента, сопровождаемое испусканием различных частиц и сформулировали правила смещения.
Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Основной источник познаний о химических элементах – Периодическая система химических элементов Д. И. Менделеева. Навыки описывать химический элемент, имея перед собой только эту таблицу, крайне необходимы любому ученику и являются основой познаний о химии.
Составим план описания химического элемента с помощью Периодической системы Д.И. Менделеева и дадим описание одного химического элемента металла и одного неметалла в соответствии с составленным планом.
- Находим химический элемент в таблице и по его положению описываем строение его атомов.
- Все химические элементы в таблице делятся на металлы и неметаллы. Отмечаем металл или неметалл, описываемый нами элемент.
- Сравнение свойств нашего простого вещества металла или неметалла с соседними по подгруппе элементами.
- Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами.
- Состав и характеристика высшего оксида описываемого элемента (то есть относится к основным, кислотным или амфотерным).
- Состав и характеристика высшего гидроксида (то есть он является основанием, амфотерным гидроксидом, кислородосодержащей кислотой).
- Если элемент неметалл, то состав летучего водородного соединения.
- При описании химического элемента металла и неметалла следует руководствоваться знаниями о строении химических элементов, а также основными закономерностями изменения свойств атомов, простых веществ и соединений, образованных химическими элементами главных подгрупп и периодов Периодической системы Д. И. Менделеева, которые были рассмотрены ранее.
Первый пункт - находим химический элемент в таблице и по его положению описываем строение его атомов.
Кальций в Периодической системе находится под номером 20 и имеет относительную атомную массу 40. Значит, порядковый номер кальция равен 20 и заряд его ядра +20 (Z (зэт) - число протонов, имеющих положительный заряд). Массовое число равно 40 (А=40 (а равно 40)). Отсюда находим N (эн) – число нейтронов, не имеющих заряда. N = А – Z (эн равно а минус зэт) равно 20. Так как атом в целом электронейтрален (число протонов равно числу электронов), то число электронов равно 20.
Химический элемент кальций находится в четвертом периоде Периодической системы, значит, электроны расположены на четырех энергетических уровнях. Записываем на основании этого электронную формулу кальция:
20Ca 2e- 8e- 8e- 2e- (черточки над е) Это значит, что на первом энергетическом уровне вокруг ядра атома кальция находится два электрона, на втором – восемь, на третьем – тоже восемь, на четвертом – два электрона.
Из электронной формулы видно, что кальций имеет на внешнем (четвертом) энергетическом уровне два электрона, то есть, отдавая внешние, наименее устойчивые электроны, он будет проявлять восстановительные свойства и иметь степень окисления +2. Восстановительные свойства кальция будут выражены сильнее, чем у магния и бериллия, но слабее, чем у стронция. Это обусловлено тем, что чем больше радиус атома (он возрастает с увеличением количества энергетических уровней), тем легче внешние электроны покидают атом, так как связь с ядром уменьшается.
Когда электроны покидают внешнюю оболочку атома, он превращается в ион. В частности, кальций превращается в ион Са2+ (кальций-два-плюс).
Второй пункт плана описания. Отмечаем металл или неметалл, описываемый нами элемент.
Атомы кальция образуют простое вещество, соединяясь металлической связью в металлическую кристаллическую решетку. Значит, кальций металл, обладающий такими металлическими свойствами как металлический блеск, хорошая теплопроводность и электропроводность, пластичность, высокая плотность и высокая температура плавления.
Третий пункт плана. Сравнение свойств простого вещества металла или неметалла с соседними по подгруппе элементами.
Металлические свойства кальция сильнее, чем у бериллия и магния, но слабее, чем у стронция. Металлические свойства веществ обусловлены способностью атомов, входящих в эти вещества отдавать внешние электроны. Из предыдущего пункта известно, что атом кальция гораздо быстрее отдает свои внешние электроны, чем бериллий и магний.
Четвертый пункт плана. Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами.
Металлические свойства кальция выражены слабее, чем у калия. Калий на внешнем энергетическом уровне содержит только один электрон, а кальций два. Так как металлические свойства обусловлены устойчивостью электронов на внешнем энергетическом уровне атома (чем менее устойчивы электроны, тем выше металлические свойства), то один электрон у калия будет менее устойчив, а значит, его металлические свойства будут выше.
Пятый пункт плана. Состав и характеристика высшего оксида описываемого элемента.
Оксид кальция СаО (кальций-о) является основным оксидом и проявляет такие свойства основного оксида как взаимодействие с водой с образованием щелочи, взаимодействие с кислотным оксидом с образованием соли, взаимодействие с кислотой с образованием соли и воды.
Шестой пункт плана. Состав и характеристика высшего гидроксида.
В качестве гидроксида кальцию соответствует основание Са(ОН)2 (кальций-о-аш-два). Он проявляет типичные свойства оснований: мылкость на ощупь, изменение окраски индикаторов, взаимодействие с кислотами с образованием соли и воды, взаимодействие с оксидом неметалла с образованием соли и воды, взаимодействие с солью с образованием новой соли и нового основания.
Последний, седьмой пункт - состав летучего водородного соединения. Металл кальций летучего водородного соединения не образует.
Первый пункт - находим химический элемент в таблице и по его положению описываем строение его атомов.
Фосфор – элемент VA-группы Периодической системы, 3-го периода. Порядковый номер фосфора равен 15 и заряд его ядра +15 (число протонов Z (зэт)). Так как атом в целом электронейтрален (число протонов равно числу электронов), то число электронов равно 15. Массовое число 30 (А=30 (а равно 30)). Отсюда находим N (эн) – число нейтронов. N = А – Z (эн равно а минус зэт) равно 15. Записываем строение электронной оболочки фосфора.
15Р 2е-8е-5е- (черточки над е). Это значит, что на первом энергетическом уровне вокруг ядра атома кальция находится два электрона, на втором – восемь, на третьем – пять электронов.
Второй пункт плана описания. Отмечаем металл или неметалл, описываемый нами элемент.
Атомы фосфора проявляют как окислительные (степень окисления при этом -3), так и восстановительные свойства (степени окисления +3 и +5).
Фосфор – менее сильный окислитель, чем азот, но более сильный, чем мышьяк. Это связано с тем, что радиус атомов от азота к мышьяку увеличивается. По этой же причине восстановительные свойства пятой группы, главной подгруппы при переходе от азота к мышьяку усиливаются.
Фосфор относится к типичным неметаллам. Строение кристаллической решетки фосфора зависит от его аллотропной модификации. Есть белый, красный и черный фосфор. У наиболее распространенного белого фосфора молекулы имеют вид тэтраэдра. Красный и черный фосфор имеют иное строение кристаллической решетки.
Третий пункт плана. Сравнение свойств простого вещества металла или неметалла с соседними по подгруппе элементами.
Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка.
Четвертый пункт плана. Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами.
Неметаллические свойства у фосфора выражены сильнее, чем у кремния, но слабее, чем у серы.
Пятый пункт плана. Состав и характеристика высшего оксида описываемого элемента.
Высший оксид фосфора имеет формулу Р2О5 (пэ-два-о-пять). Это кислотный оксид, который проявляет все типичные свойства кислотных оксидов. Например, такие как при взаимодействии со щелочью образовывать соль и воду, при взаимодействии с основным оксидом образовывать соль, при взаимодействии с водой образовывать кислоту.
Шестой пункт плана. Состав и характеристика высшего гидроксида.
Высший гидроксид фосфора – фосфорная кислота Н3РО4 (аш-три-пэ-о-четыре), раствор которой проявляет все типичные свойства кислот. Например, такие как кислый вкус, изменение окраски индикаторов, взаимодействие с основаниями и оксидами металлов с образованием соли и воды.
Cедьмой пункт - состав летучего водородного соединения.
С водородом фосфор образует летучее соединение фосфин РН3 (пэ-аш-три).
При помощи Периодической системы Д. И. Менделеева можно дать характеристику большинству элементов-металлов и элементов-неметаллов главных подгрупп.
Глоссарий
- d-элементы – элементы, в которых заполняется d-подуровень второго снаружи уровня.
- f-элементы – элементы в которых заполняется f-подуровень третьего снаружи уровня.
- Завершенность внешнего уровня – если на внешнем уровне атома 8 электронов (для водорода и гелия 2 электрона)
- Изотопы – разновидность атомов одного и того же химического элемента, отличающиеся друг от друга только своей массой, с одинаковым порядковым номером.
- Металлические свойства – способность атома отдавать электроны до завершения внешнего уровня.
- Неметаллические свойства - способность атома принимать электроны до завершения внешнего уровня.
- Орбиталь (s, p, d, f) – часть атомного пространства, в котором вероятность нахождения данного электрона наибольшая (~ 90%).
- Радиоактивность - это явление распада изотопов с излучением субатомных частиц и электромагнитных волн.
- Радиус атома – расстояние от ядра атома до внешнего уровня
- р-элементы – элементы, в атомах которых электронами заполняется p-подуровень внешнего энергетического уровня.
- Состав атомного ядра входят элементарные частицы – протоны (p) и нейтроны (n).
- Химический элемент – это вид атомов с определённым зарядом ядра.
- Электронное облако – это модель квантовой механики, описывающая движение электрона в атоме.
- Энергетический уровень – это энергетический слой с определённым уровнем энергии находящихся на нём электронов.Число энергетических уровней в атоме химического элемента равно номеру периода, в котором этот элемент расположен.
Полезные ссылки
Библиография
нету
- Ахметов Н. С. Актуальные вопроса курса неорганической химии. — М.: Просвещение, 1991. — 224 с — ISBN 5-09-002630-0
На борту атомной подводной лодки фоновая радиация меньше, чем на суше.
При постройке Центрального вокзала Нью-Йорка было использовано большое количество гранита. По этой причине уровень радиации там очень высок и превышает даже нормы, допустимые на атомных электростанциях.
В Чернобыльской зоне растут грибы под названием Cryptococcus neoformans, которые отлично себя чувствуют под воздействием излучения.
Владимир Правик был одним из первых пожарных, тушивших Чернобыльскую АЭС. Говорят, что под воздействием радиации его глаза поменяли цвет с коричневого на голубой.
Высаженные в Чернобыльской зоне соевые бобы развили антирадиационную защиту. Это открытие может пригодиться людям.
После изучения жизни вокруг Чернобыля и других зон атомных катастроф обнаружилось, что некоторые виды выжили благодаря генетическим мутациям, произошедшим под воздействием радиации.
Средний курильщик в течение года получает дозу излучения, примерно равную 300 рентгеновским процедурам. Это связано с тем, что в дыме присутствуют радиоактивные изотопы.
24 декабря 2004 года Земля попала под самый сильный в истории выброс радиации. Этот выброс пришёл от нейтронной звезды, находящейся в 50 тысячах световых лет от нашей планеты.
Бананы имеют довольно высокий уровень радиоактивности.
Закрывая глаза, астронавты иногда видят яркие вспышки. Они вызваны космическим излучением, попадающим на сетчатку.
Пилоты и стюардессы в год получают большую дозу излучения, чем работники АЭС. Поэтому они официально классифицируются как «работающие в условиях радиации».
Горсть урана почти так же радиоактивна, как 10 бананов. Мы ведь говорили, что бананы радиоактивны!
Программа США по разработке ядерного оружия получила название «Манхэттенский проект». В рамках этой программы ставились довольно жестокие эксперименты по воздействию радиации на человека. Например, малышей кормили радиоактивной овсянкой.
В рамках того же Манхэттенского проекта Альберт Стивенс получил инъекцию плутония. Он умер лишь спустя 20 лет и стал человеком, прожившим дольше всего после такой дозы радиации.
Радий, открытый Марией Кюри, сначала использовали везде — от зубной пасты до конфет. Естественно, это привело к проблемам со здоровьем.
Люди, живущие рядом с угольными электростанциями, получают большую дозу излучения, чем те, кто живёт рядом с АЭС.
Оказалось, что на самом деле человек излучает больше радиации, чем его сотовый телефон.
Промышленные отходы, содержащие мышьяк, более вредны для людей, чем аналогичное количество ядерных отходов.
Мы постоянно подвергаемся воздействию радиации, большая часть которой безвредна. Опасно только ионизирующее излучение в достаточно высоких дозах (рентгеновские лучи, гамма-лучи и т. п.)
В точке в конце предложения может уместиться 2 млрд атомов.
В одной песчинке столько же атомов, сколько самих песчинок на всем пляже.
Толщина книжной страницы – около полумиллиона атомов.
В настоящее время официальное число субатомных частиц – 24.
В космосе содержится в среднем два атома на кубический метр, хотя иногда сила тяготения собирает их вместе, превращая в звезды, планеты и жирафов.
Если бы электрон весил как монета в 50 тыйынов, то протон весил бы как четыре литра молока.
Если из атомов, которые составляют всех людей на Земле, удалить пустоты, то все человечество целиком сжалось бы до размера яблока.
Если представить атом в виде сферы диаметром один километр, то его ядро будет размером с мелкую монету.