Химия: Мезгилдик закон жана мезгилдик система — различия между версиями
Admine2 (обсуждение | вклад) (→Химиялык элементтердин мезгилдик ситемасы) |
Admine2 (обсуждение | вклад) (→Химиялык элементтердин мезгилдик ситемасы) |
||
| Строка 157: | Строка 157: | ||
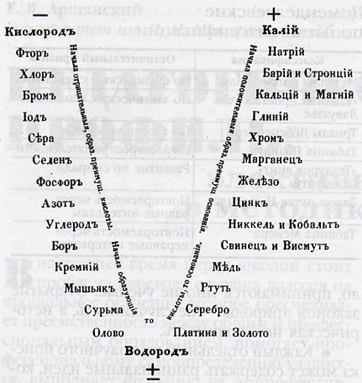
Мезгилдик система – мезгилдик закондун графикалык сүрөттөлүшү болуп саналат. Ал мезгилден жана 8 группадан турат. | Мезгилдик система – мезгилдик закондун графикалык сүрөттөлүшү болуп саналат. Ал мезгилден жана 8 группадан турат. | ||
| − | <div class="mw-customtoggle-tabm resettext" >'''Д. И. Менделеевдин Мезгилдик системасы (кыска формасы)'''</div> | + | <div class="mw-customtoggle-tabm resettext" style="background: #3f4851; padding: .2em 5px .4em; margin-bottom:10px;">'''Д. И. Менделеевдин Мезгилдик системасы (кыска формасы)'''</div> |
<div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-tabm"> | <div class="mw-collapsible mw-collapsed" id="mw-customcollapsible-tabm"> | ||
{{Периодическая система химических элементов}} | {{Периодическая система химических элементов}} | ||
Версия 05:15, 29 апреля 2018
Содержание
Мезгилдик закондун ачылышынын өбөлгөлөрү
Берцелиустун классификациясы
Белгилүү швед химиги И. Я. Берцелиус бардык элементтерди металлдарга жана металл эместерге бөлгөн. Мында ал алар түзгөн жөнөкөй заттардын жана бирикмелердин касиеттеринин айрымачылыгын негиз кылган. Ал металлдардан негиздик оксиддер жана негиздер алынаарын, ал эми металл эместерден кислоталык оксиддер жана кислоталар алынаарын аныктаган.
Кемчиликтери
Эки гана топко бөлүнгөн жана бири–биринен кескин айрымаланган элементтер да бир топко кирип калган. Кээ бир металлдарда металлдык жана металл эместик касиеттердин (амфотердүүлүк) болушу да баш аламандыкка алып келген. Бул классификация ийгиликке ээ болгон эмес.
Деберейнердин үчтүктөрү (1816–ж.)
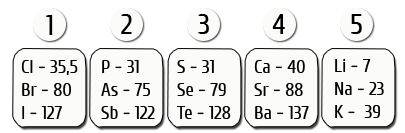
Немец химиги И. В. Деберейнер элементтерди алар түзгөн заттардын касиеттеринин окшоштуктарына карата үчтөн бөлүп чыккан. Ортодо жайгашкан элементтин салыштырмалуу атомдук массасы (Аг) эки жагындагы элементтердин массаларынын орточо санына барабар болгон.
Мисалы: үчтүктөр: Li, Nа, К.
Аг(Nа) = (7 + 39): 2 = 23
И. Деберейнердин эмгеги элементтердин атомдук салмагы менен касиеттеринин ортосунда байланыш бар экендигин көрсөтө алган.
Кемчиликтери:
Деберейнер 5 гана үчтүктү , б.а. 15 элементтин гана классификациясын түзгөн. Бирок, ошол кезде белгилүү болгон башка элементтерди классификацияга киргизе алган эмес.
Шанкуртуанын спиралы (1862–ж.)
Париж жогорку мектебинин профессору А. Бегье де Шанкуртуа элементтерди атомдук массаларынын өсүшү боюнча спираль же цилиндр түрдө жайгаштырууну сунуш кылган. Бул учурда ал кээ бир элементтерди спиралдын тик (вертикалдык) багыты боюнча биринин астына бирин жайгаштырганда, касиеттеринин окшоштугунун кайталангандыгын байкаган. Ошентип, алгачкы жолу элементтердин касиетинин мезгилдүү кайталангындыгы жөнүндө ой пайда болгон, бирок ага көңүл бурулган эмес.
Кемчиликтери
Де Шанкуртуанын спиралынын кемчилиги – касиеттери ар башка болгон элементтердин бир катарга жайгаштырылышы болгон. Мисалы, тигинен кеткен (вертикалдык) бир катарга литий, натрий, калий, бериллий, магний, кальций, кычкылтек, күкүрт, селен, теллур ж.б. элементтер тизилип калган.
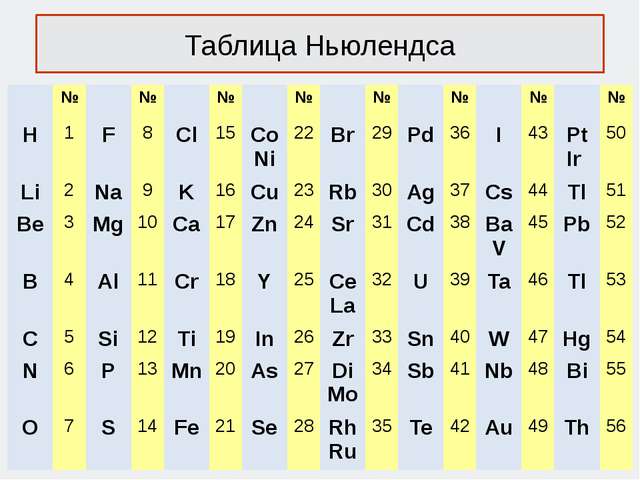
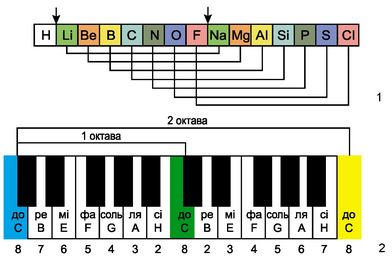
Ньюлендстин октавасы (1865 г.)
Америкалык химик Д. А. Р. Ньюлендс өзүнө белгилүү болгон элементтерди атомдук массаларынын өсүшүнө карата сегизден жайгаштырууга аракет кылган. Ал ар бир сегизинчи элементтин касиетинин окшоштугу кайталангандыгын байкаган, муну сегиз үндөн турган музыкалык октавага салыштырган. Өзүнүн ачылышын октава закону деп атаган.
«Окшош элементтердин катар саны бири–биринен жети деген санга же бүтүн санга айрымаланышат,б.а. ар бир жети элементтен кийин группанын окшош мүчөлөрү бир катарга жайгашып калат, бул музыкалык октавага туура келет».
Автордун таблицадан музыкалык гармонияны табууга болгон көшөргөн аракети бул моделдин беделин түшүргөн.
Кемчилиги
Ньюлендс өзү тапкан закон ченемдүүлүктү жеткире түшүндүрө алган эмес жана анын таблицасында ачыла элек элементтерге орун калбай калган. Ошондой эле, кээ бир касиеттери кескин айрымаланган элементтер вертикалдык бир катарга жайгашып калган.
Лондондогу химиялык коом анын октава законун көңүлкоштук менен кабыл алган жана алар Ньюлендске элементтерди системага алфавит боюнча жайгаштырып, кандайдыр бир закон ченемдүлүктү табууну сунуш кылышкан.
Мейердин таблицасы (1864–ж.)
Немец изилдөөчүсү Л. Мейер химиялык элементтерди атомдук массаларынын өсүшү менен жайгаштырган.
Кемчилиги
Бул таблицага Мейер болгону 28 элементти, б.а. ошол кезде белгилүү болгон элементтердин жарымынан азын гана жайгаштыра алган. Калган элементтердин: В, Аl, Сu, Аg ж.б. кайсы жерге жайгаштырылаары белгисиз бойдон калган, таблицанын ирээти да так болгон эмес.
Мезгилдик закон
Байыркы заманда эле алхимиктер химиялык элементтерди системага келтире турган жаратылыштын законун табууга аракет кылышкан. Бирок, аларда элементтер жөнүндөгү кенен жана так маалыматтар болгон эмес. XIX кылымдын ортосунда химиялык элементтер жөнүндөгү маалыматтар жетиштүү болуп, ачылган элементтердин саны да өскөндүктөн, илимде элементтердин классификациясын түзүүнүн табийгый зарылдыгы келип чыккан. Элементтерди металлдарга жана металл эместерге бөлгөн алгачкы классификация жеткиликсиз болгон. Д.И.Менделеевге чейин классификация түзүүгө аракет кылган окумуштуулар (И.В.Деберейнер, Дж.А. Ньюлендс, Л. Ю. Мейер) мезгилдик закондун ачылышына өбөлгө түзүшкөн. Алар көптөгөн иштерди жасашкан, бирок, чындыкты таба алышкан эмес. Дмитрий Иванович элементтин массасы менен алардын касиетинин ортосундагы байланышты аныктаган.
Дмитрий Иванович Менделеев Тобольск шаарында туулган. Ал үй–бүлөдөгү он жетинчи бала болгон. Тобольск гимназиясын аяктагандан кийин Санкт–Петербургдагы Педагогикалык институтка кирип, аны алтын медаль менен бүтүргөн жана магистрдик диссертациясын жактап, чет мамлекетке эки жылдык илимий иш сапарга барган. Чет мамлекеттен кайтып келгенден кийин Петербург Университетине чакырышкан. Студенттерге химиядан лекция окуу менен бирге, алар үчун окуу колдонмосун жазууну туура көргөн. Ал “Химиянын негизи» деген жаңы китепти жазууну чечкен. Мезгилдик закондун ачылышына 15 жыл талыкпай эмгектенген. 1869–жылы 1–мартта. Дмитрий Иванович Петербургдан губернияларга иш боюнча барып келмек болгон.
Менделеев химиялык элементтерди алардын атомдук салмагынын өсүшү менен жайгаштырган жана белгилүү бир аралыктан – мезгилден кийин касиеттеринин кайталангандыгын байкаган.
Дмитрий Иванович мезгилдерди, окшош элементтерди биринин астына бири – тик катарга келгидей кылып жайгаштырган, ошентип, мезгилдик система түзүлгөн.
1869–жылы 1–марттагы Мезгилдик закондун аныктамасы:
Ал убакта мезгилдик законду колдогондор, орус окумуштууларынын ичинде да өтө аз болгон Каршы тургандар, өзгөчө Германия жана Англияда көп болгон.
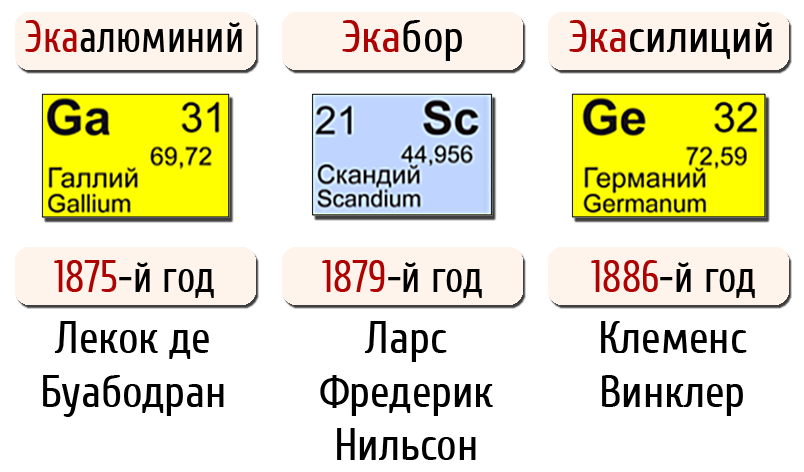
Мезгилдик закондун ачылышын – илимий алдын–ала көрө билүүчүлүктүн мыкты үлгүсү катары белгилөөгө болот. 1870–ж. Дмитрий Иванович ачыла элек үч элементтин касиеттерин алдын ала мүнөздөп жазган, аларды экасилиций, экаалюминий жана экабор деп атаган.
5 жылдан кийин 1875–жылы франсуз окумуштуусу Лекок де Буабодран жаңы элементти ачып, аны галлий деп атаган. Галлийдин кээ бир касиеттери Менделеев жазып кеткен экаалюминийге окшош болуп, бирок атомдук салмагы кичине болуп белгиленген. Буга карабастан, Менделеев Францияга Буабодранга кат жазып, бул элементтин касиетин өзүнүн алдын–ала айтканын далилдөөгө аракет кылган.
Окумуштуулар Д.И. Менделеевдин айткандары туура келгендигине абдан таң калышкан. Ушундан кийин гана мезгилдик законго жана системага көңүл бурула баштаган.
1879–жылы. Л. Нильсон Швецияда скандийди ачкан, бул элементти Д.И.Менделеев алдын–ала сүрөттөп, аны экабор деп атаган.
1886–жылы К. Винклер Германияда германий элементин ачкан, бул Д.И. Менделеев белгилеген экасилиций элементи болгон.
Д.И.Менделеев мындан башка да гениалдуу идеяларды айтып кеткен.
Д. И. Менделеевдин мезгилдик системасында төрт элементти атомдук салмактын өсүшүнө карата жайгаштырылган эмес.
Ar – K, Co – Ni, Te – I, Th – Pa
Бул элементтердин өз ордуна коюлгандыгы, Д.И. Менделеевдин божомолунун тууралыгы Атомдун түзүлүш теориясы ачылгандан кийин далилденген.
XIX–кылымдын аягында Д.И. Менделеев атом башка майда көзгө көрүнбөгөн бөлүкчөлөрдөн тураарын жазып кеткен. 1907 –жылы Менделеевдин көзү өткөндөн кийин атомдун элементардык майда бөлүкчөлөрдөн тураары далилденген. Атомдун түзүлүш теориясы Менделеевдин төрт элементти атомдук салмактын өсүшүнө эмес, касиетине карата жайгаштыргандыгынын тууралыгын толугу менен тастыктаган.
Мезгилдик закондун азыркы учурдагы аныктамасы
Андан бери 150 жылдай өтсө да Дмитрий Иванович Менделеевтин төмөнкү сөздөрүн белгилеп кетсек болот. «Мезгилдик закон келечекте маанисин жоготуп, колдонуудан чыгып калбайт, ал андан ары өнүгүп, толукталып гана турмакчы». Андан бери көптөгөн элементтер ачылды, бирок ал дагы чек эмес деп ойлойбуз.
Мезгилдик закондун графикалык туюнтулушу химиялык элементтердин мезгилдик системасы деп аталат. Бул элементтердин жана алардын бирикмелеринин химиясынын кыскача конспектиси болуп саналат.
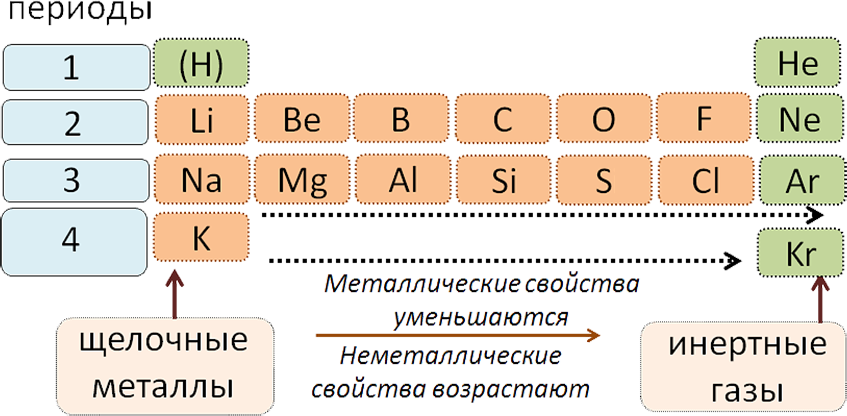
Мезгилдик системада мезгилде атомдук салмактын өсүшү менен элементтердин касиеттеринин өзгөрүшү (солдон оңго карай):
1. Металлдык касиеттери начарлайт;
2. Металл эместик касиеттери күчөйт;
3. Жогорку оксиддеринин жана гидроксиддеринин касиеттери негиздиктен амфотердикке, андан кислоталыкка өтөт;
4. Элементтердин валенттүүлүгү жогорку оксиддеринде I ден VII ге чейин өсөт, ал эми суутектик бирикмелеринде IV төн Iге чейин төмөндөйт.
Химиялык элементтердин мезгилдик ситемасы
Мезгилдик система – мезгилдик закондун графикалык сүрөттөлүшү болуп саналат. Ал мезгилден жана 8 группадан турат.
| Группа → Период ↓ |
I | II | III | IV | V | VI | VII | VIII | ||||||||||||||||||||||
| A | B | A | B | B | A | B | A | B | A | B | A | B | A | B | A | |||||||||||||||
| 1 | 1 H |
2 He |
||||||||||||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
||||||||||||||||||||
| 29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
|||||||||||||||||||||||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
||||||||||||||||||||
| 47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
|||||||||||||||||||||||
| 6 | 55 Cs |
56 Ba |
* | 72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
||||||||||||||||||||
| 79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
|||||||||||||||||||||||
| 7 | 87 Fr |
88 Ra |
** | 104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
||||||||||||||||||||
| 111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
|||||||||||||||||||||||
| Лантаноиды * | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||||||||||||
| Актиноиды ** | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||||||||||||
Мындан сырткары Мезгилдик таблицанын узун варианты да бар, бирок, анда лантаноиддер жана актиноиддер таблицадан сырткары белгиленген эмес.
Д. И.Менделеевдин таблицасындагы мезгилдерди жана группаларды мүнɵздɵɵ
Период – химические элементы, расположенные в строчку (1 – 7)
Малые (1, 2, 3) – состоят из одного ряда элементов
Большие (4, 5, 6, 7) – состоят из двух рядов – чётного и нечётного
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом, а заканчиваются благородным газом.
Во всех периодах с увеличением относительных атомных масс элементов наблюдается усиление неметаллических и ослабление металлических свойств. В больших периодах переход свойств от активного металла к благородному газу происходит более медленно (через 18 и 32 элемента), чем в малых периодах (через 8 элементов). Кроме того, в малых периодах слева направо валентность в соединениях с кислородом возрастает от 1 до 7 (например, от Na до Cl). В больших периодах вначале валентность возрастает от 1 до 8 (например, в пятом периоде от рубидия к рутению), затем происходит резкий скачок, и валентность уменьшается до 1 у серебра, потом снова возрастает.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы.
Различают главные (А) и побочные подгруппы (Б).
Главные подгруппы состоят из элементов малых и больших периодов.
Побочные подгруппы состоят из элементов только больших периодов.
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам. Номер группы показывает высшую валентность элемента (кроме N, O, F).
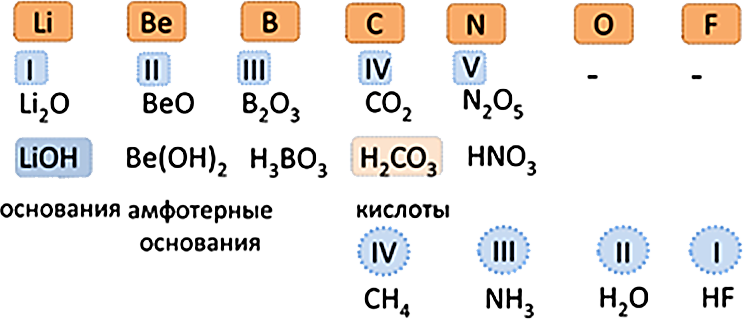
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные.
| Группа | I | II | III | IV | V | VI | VII | VIII (кроме инертных газов) |
|---|---|---|---|---|---|---|---|---|
| Высший оксид | Э2О | ЭО | Э2О3 | ЭО2 | Э2О5 | ЭО3 | Э2О7 | ЭО4 |
| Гидрат высшего оксида | ЭОН | Э(ОН)2 | Э(ОН)3 | Н2ЭО3 | Н3ЭО4 | Н2ЭО4 | НЭО4 | Н4ЭО4 |
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I - III групп образуют твердые вещества - гидриды (водород в степени окисления - 1), а IV - VII групп - газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) - нейтральны, V группы (ЭН3) - основания, VI и VII групп (Н2Э и НЭ) - кислоты.
Глоссарий
- Атомдук сан — Д. И. Менделеевдин мезгилдик ситемасындагы элементтин катар саны. Атомдук сан элементтин ядросунун оң зарядына, б.а. ядродогу протондордун санына барабар.
- Д.И. Менделеевдин мезгилдик закону – жөнөкөй заттардын, элементтердин формаларынын жана бирикмелеринин касиеттери ал элементтердин атомдук массаларынан мезгилдүү көз карандылыкта болот.
- Д.И. Менделеевдин мезгилдик системасы –химиялык элементтердин ирээттелген табийгый классификациясы, б.а. мезгилдик законунун графикалык сүрөттөлүшү.
- Химиялык элемент – бул белгилүү бир касиеттерге (ядронун заряды, массасы ж.б.) ээ болгон атомдордун белгилүү бир түрү.
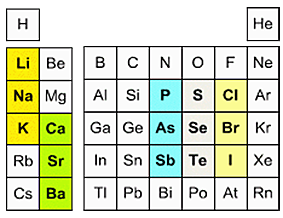
- Щелочтук жер элементтер (щелочтук жер металлдар) – химиялык элементтер – кальций, стронций, барий жана радий.
- Щелочтук элементтер (щелочтук металлдар) – биринчи группанын (IА–группа) негизги подгруппасынын элементтери – литий, натрий, калий, рубидий, цезий, франций.
- Терс электрдүүлүк — элементтин электрондук жупту өзүнө тартып алуу жөндөмдүүлүгү.
- Элемент – бир түрдүү атомдордон турган зат ( ядролорунун заряддары бирдей). Көбүнчө элементтин бир нече ИЗОТОБУ болот.
Пайдалуу ссылкалар
Бибилиография:
- Ахметов Н. С. Актуальные вопроса курса неорганической химии. — М.: Просвещение, 1991. — 224 с — ISBN 5-09-002630-0
- Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — 271 с.
- Менделеев Д. И. Основы химии, т. 2. М.: Госхимиздат, 1947. 389 c.
- Менделеев Д.И. Периодическая законность химических элементов // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.).
- Г.В. Пчелкина.Химуля. Уроки.
№ 96 – элемент – кюрий – окумуштуу үй–бүлөө Кюрилердин урматына аталган.
№ 99 – элемент–эйнштейний – белгилүү физик Альберт Эйнштейндин атынан аталган.
№ 100 – элемент–фермий –биринчи атомдук реакторду түзгөн,ойлоп табуучу Энрико Ферминин атынан аталган.
№ 101–элемент – менделеевий – элементтердин мезгилдик законун түзгөн гениалдуу окумуштуу Дмитрий Иванович Менделеевдин урматына аталган.
№ 102 – элемент – нобелий – Стокгольмдогу Нобель институтунун окумуштуулар тобу тарабынан Альфред Нобелдин атынан аталган.Бирок, 1957–жылкы текшерүү бул элементтин ачыла электигин тастыктаган. 1958–жылы гана Дубнада Г. М. Флеровдун жетекчилиги астында ядролук изилдөөлөрдүн. Бириккен институтунун лабораториясында бул элемент синтезделип алынган.
№ 103 – элемент–лоуренсий – циклотронду ойлоп тапкан жана Берклидеги радиациялык лабораториянын негиздөөчүсү Лоуренстин урматына аталган.
№ 104 – элемент–курчатовий, – Дубнада синтезделип алынган жана белгилүү советтик физик, СССРдеги Атомдук энергетика институтун негиздеген И. В. Курчатовдун аты менен аталган.
Д. И. Менделеевдин мезгилдик системасы ачыла элек, али белгисиз болгон 12 элементти алдын ала сүрөттөп жазган: скандий (экабор), галлий (экаалюминий), германий (экасилиций), технеций (экамарганец), гафний (цирконийдин аналогу), полоний (экателлур), астат (экайод), франций (экацезий), радий (экабарий), актиний (экалантан) протактиний (экатантал). Д. И. Менделеев бул элементтердин атомдук салмагын эсептеген жана скандийдин, галлийдин жана германийдин касиеттерин сүрөттөп жазган.
Төмөнкү элементтер мамлекеттердин жана материктердин атынан аталган: рутений (Россия латын тилинде – «Рутения» деп айтылат), полоний (Польша), галлий (Талия – Франциянын мурунку аталышы ), скандий (Скандинавия), америций (Америка), европий (Европа).
Рений, платина – дарыялардын атынан аталса, жез – купрум – Кипр аралынын атынан аталган.
Шаарлардын аты менен төмөнкү элементтер аталган: : лютеций ( Париждин мурунку аты), гафний (Копенгагендин мурунку аты). Калифорний – бул элемент жасалма жол менен Калифорния штатындагы Университетте алынган. Ошондуктан, бул штаттын аты менен аталган.
Кээ бир элементтер өзүнүн касиетине карата аталып калган: мисалы, Йод – грек тилинен «кочкул, филетовый» деп которулат; Бром –грек тилинен которгондо «жагымсыз» деген маанини билдирет; Фтор – грек тилинен «талкалоочу, бузуучу» деп которулат; Хлор – грек тилинен «жашыл» деп которулат; Родий – грек тилинен «күлгүн, роза» деп которулат ( родийдин кээ бир бирикмелеринин эритмелери күлгүн түстө болот); Осмий – грек тилинен которгондо «жыт» деген маанини түшүндүрөт; Хром – грек тилинен «боёк, краска» деп которулат (анын туздары ар түрдүү түстөргө боёлуп турат); Фосфор – грек тилинен «жарыкты алып жүрүүчү» деп которулат; Суутек – латын сөзүнөн алынган, гидрогениум – «сууну пайда кылуучу» деп которулат; Кычкылтек – латин тилинде «оксигениум» деп аталат, бул – «кислотаны пайда кылуучу» деп которулат; Сымап – латынча – «гидраргирум» – «күмүш суу» деген маанини билдирет.
Торий Берцелиус тарабынан скандинавиянын согуш кудайынын аты Торанын атынан аталган.
Ванадий–скандинавиялык сулуулуктун кудайы Ванадистин аты менен аталган.
Титан байыркы немец элинин эпосундагы эльфтердин ханышасы Титаниянын атынан коюлган. Титан ачылгандан көп өтпөй эле бул ат менен Уран планетасынын үчүнчү спутнигин аташкан.
Прометий элементи мифтеги каарман Прометейдин аты менен аталган, ал асмандан отту уурдап алып, адамдарга берген деп мифте айтылат.
Лантан грек тилинен «жашынуу» деген маанини түшүндүрөт. Швед химиги Мозандер 1839–жылы лантанды ачкан жана ушул ат менен аны атаган.
Ниобий элементи – Танталдын кызы Ниобеинин аты менен аталган. Бул ниобий менен танталдын окшоштугуна байланыштуу болгон.
Теллур элементинин аты латын сөзүнөн алынган, ал «жер» деп которулат; селен элементи – грек тилинен «ай» деп которулат; уран, нептуний, плутоний – планеталардын аты менен аталган; Церий – кичи планета Цереранын урматына аталган.
Гелийдин аты «Гелиос» – «күн» деген грек сөзүнөн алынган.
Кайсы бир элементтер минералдардын аты менен аталган: Мисалы, цирконий – циркон минералынын аты менен, барий – барита минералынын, стронций – стронцианиттин, бериллий – берилла минералынын, вольфрам – вольфрамит минералынын аты менен аталган; кальций – калькс, –грек тилинен «жумшак таш» деп которулат; литий – литеос – грек тилинен «таш» деп которулат.
Таң калыштуусу, адамдын организминде Менделеевдин мезгилдик системасындагы бардык элементтер болот экен.Алардын кээ бирлери кɵп ɵлчɵмдɵ болсо, башкалары ɵтɵ эле аз ɵлчɵмдɵ болушат. Ал элементтерди башка заттар менен алмаштырууга болбойт жана алардын ар бири организм үчүн белгилүү бир кызматты аткарат.
Биздин денебиздин 96% кɵмүртектин, суутектин, кычкылтектин жана азоттун атомдорунан турат. Ошондой эле, организм үчүн химиялык кошулмалардын мааниси да чоң болуп саналат. Калган 4% башка химиялык элементтерден түзүлɵт. Бирок, алар аз ɵлчɵмдɵ болсо да, организмге ɵз таасирин тийгизип турат. Химиялык элементтер, тагыраак айтканда, алардын бирикмелери биздин организмдин маанилүү бɵлүгүн түзүп турат.
70 кг салмактагы адамдын денесинде:
- кɵмүртек – 12,6 кг
- кычкылтек – 45,5 кг
- суутек – 7 кг
- азот – 2,1 кг
- кальций – 1,4 кг
- натрий – 150 г
- калий – 100 г
- магний – 200 г
- хлор – 200 г
- фосфор – 0,7 кг
- күкүрт – 175 г
- темир – 5 г
- фтор – 100 г
- кремний – 3 г
- йод – 0,1 г
- мышьяк – 0,0005 г. болот.
Адамдын салмагынын тɵрттɵн үч бɵлүгү суудан тураары баарыбызга белгилүү. Балдардын организминде 80% суюктук болсо, улгайган адамдардын денесинде 50% болот. Ошондуктан, суюктуктун запасын толуктоо үчүн бир суткада 2 литр , ысык мезгилде андан да кɵп суу ичип туруу керек. Суу биздин организмибиздин негизин түзүп турат.
Адамдын денесинин 20% белоктордон, углеводдордон, майлардан жана алардын бирикмелеринен турат. Бул бирикмелердин бардыгынын курамында кɵмүртек болот. Ошондуктан, кɵмүртекти биздин организмди түзгɵн негизги элемент десек да болот. Майлардын жана углеводдордун курамы үч гана элементтен: суутектен, кɵмүртектен жана кычкылтектен турат. Бул элементтерге азотту кошсо, белок пайда болот. Өзүңɵр кɵрүп тургандай, биздин организм тɵрт гана элементти пайдалануу менен ɵзүнɵ керектүү микроэлементтерди жана бирикмелерди иштетип чыга алат.
Организм үчүн пайдалуу азык-заттар менен туура тамактануу эң маанилүү болуп саналат. Күн сайын биз колдонгон тамактарда белоктор, углеводдор жана майлар болушу керек. Биз туура тамактанып, таза абада кɵп болуу менен суунун балансын дайыма сактасак, ден-соолугубуз чың болуп, узак ɵмүр сүрɵбүз.
Менделеевдин дүйнɵдɵгү эң чоң таблицасы Испаниядагы Мурсия Университетинин химия факультетиндеги дубалдарга жайгаштырылган.
Таблица жалпысынан 150 м2 аянтты ээлеп турат. Ал ɵлчɵмү 75×75 см болгон 118 металл квадраттарынан турат. Ар бир элемент ɵзүнчɵ квадратка жайгаштырылган. Бул таблицаны түзгɵн дизайнерлер азыркы учурда аны дүйнɵдɵгү эң чоң Мезгилдик система деп эсептешет.
Химия факультетинин деканы Педро Лозано Родригес «Биз коомчулукка химия илими жɵнүндɵ жакшы маалымат бергибиз келет, себеби, химия коомдун жыргалчылыгы үчүн кызмат кылат. Адамдар бизди курчап турган дүйнɵнү мына ушул мезгилдик таблицадагы элементтер түзɵ тургандыгын билиши керек”, – деп айткан.
Бул «Кɵркɵмдүү ансамль» студенттер үчүн ачык асмандын алдындагы аудитория катары пайдаланылып, дагы 50 орунга трибуна коюу менен аяктайт.
Башка да гиганттык Мезгилдик системалар
Мурсия Университетиндеги Мезгилдик таблица дайыма колдонулуп турган эң чоң таблица болсо да, башка да гиганттык таблицаны түзүүгɵ аракеттер дайыма болуп турган. 2006-жылы Чикагодо Дж. Дейли Ричард борборунда (АКШ) сегиз этаждык имаратка плакаттардан түзүлгɵн мезгилдик система убактылуу илинген.
2016-жылы Сан-Антониодогу 100дɵн ашык мектеп Менделеевдин дүйнɵдɵгү эң чоң таблицасын чогултушкан, алар стадионго 3,5×4,5 м ɵлчɵмдɵгү элементтерди тизишкен. Бул таблица 2000 м2 ашык аянтты ээлеген.
Санкт-Петербургдагы Менделеевдин таблицасы ɵтɵ деле чоң ɵлчɵмдɵ эмес (болгону 69 м2), бирок тарыхый мааниге ээ. Ал 1935-жылы түзүлгɵн, анын макети 1906-жылы Менделеев тирүү кезинде басмадан 8- жолу чыккан Мезгилдик таблицага туура келет.