Химия: Периодический закон и система — различия между версиями
Admine2 (обсуждение | вклад) (→Бибилиография:) |
Admine2 (обсуждение | вклад) (→Бибилиография:) |
||
| Строка 257: | Строка 257: | ||
<div class="large-10 small-10 large-centered small-centered columns rubric" style="background-color:lightgrey;">Любопытные факты</div> | <div class="large-10 small-10 large-centered small-centered columns rubric" style="background-color:lightgrey;">Любопытные факты</div> | ||
</div> | </div> | ||
| + | {{center-p|[[file:На главную страница.jpg|300px|3D таблица Менделеева (рис.)]]}} | ||
'''Элемент № 96''' - кюрий назван в честь супругов Кюри. | '''Элемент № 96''' - кюрий назван в честь супругов Кюри. | ||
Версия 10:42, 6 марта 2018
Содержание
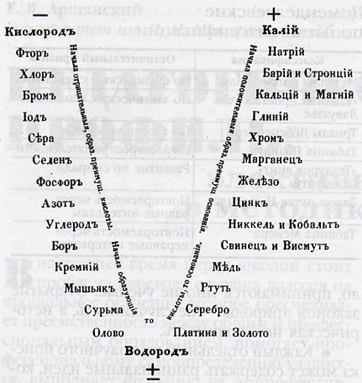
Исторические предпосылки открытия периодического закона
Классификация Берцелиуса
Выдающийся шведский химик И. Я. Берцелиус разделил все элементы на металлы и неметаллы на основе различий в свойствах образованных ими простых веществ и соединений. Он определил, что металлам соответствуют основные оксиды и основания, а неметаллам - кислотные оксиды и кислоты.
Недостатки
Но групп было всего две, они были велики и включали значительно отличающиеся друг от друга элементы. Наличие амфотерных оксидов и гидроксидов у некоторых металлов вносило путаницу. Классификация была неудачной.
Триады Деберейнера (1816 г.)
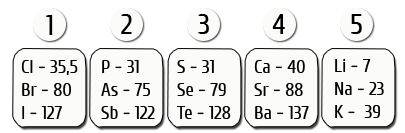
Немецкий химик И. В. Деберейнер разделил элементы по три на основе сходства в свойствах образуемых им веществ и так, чтобы величина, которую мы сейчас понимаем как относительную атомную массу (Аг) среднего элемента, была равна среднему арифметическому двух крайних.
Пример триады: Li, Nа, К.
Аг(Nа) = (7 + 39): 2 = 23
Работа И. Деберейнера послужила подтверждением мысли о наличии определенной связи между атомными массами и свойствами элементов.
Недостатки
Но ему удалось составить лишь 5 триад, т.е. использовать только 15 элементов, остальные все известные в то время элементы он классифицировать не сумел.
Спираль Шанкуртуа (1862 г.)
Профессор Парижской высшей школы А. Бегье де Шанкуртуа предложил располагать элементы по спирали или образующей цилиндра в порядке возрастания их атомных масс и указал, что в этом случае можно заметить сходство свойств образуемых элементами веществ, если они попадают на одну и ту же вертикальную линию цилиндра, располагаясь один под другим.
Так впервые родилась мысль о периодичности свойств элементов, но на нее не обратили внимания, и вскоре она оказалась забытой.
Недостатки
Недостатком спирали де Шанкуртуа было то обстоятельство, что на одной линии с близкими по своей химической природе элементами, оказывались при этом и элементы совсем иного химического поведения.
Так, на одну вертикаль попадали литий, натрий, калий, бериллий, магний, кальций, кислород, сера, селен, теллур и.т.д.
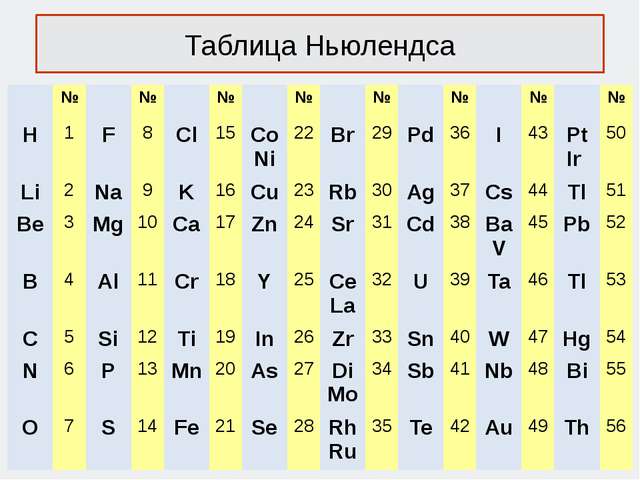
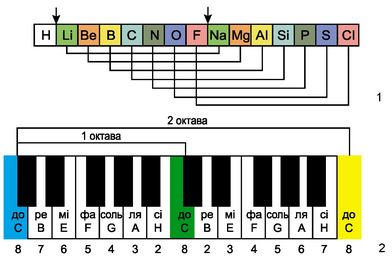
Октавы Ньюлендса (1865 г.)
Американский химик Д. А. Р. Ньюлендс пытался расположить известные ему элементы в порядке возрастания их атомных масс и обнаружил поразительное сходство между каждым восьмым по счету элементом, начиная с любого, подобно строению музыкальной октавы, состоящей из восьми звуков. Он назвал свое открытие законом октав:
«Номера аналогичных элементов, как правило, отличаются или на целое число семь, или на кратное семи; другими словами, члены одной и той же группы соотносятся друг с другом в том же отношении, как и крайние точки одной или больше октав в музыке».
Модель была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию
Недостатки
Ньюлендсу не удалось удовлетворительно объяснить найденную закономерность, более того, в его таблице не нашлось места не открытым еще элементам, а в некоторые вертикальные столбцы попали элементы, резко отличающиеся по своим свойствам.
Лондонское химическое общество встретило его закон октав равнодушно и предложило Ньюлендсу попробовать расположить элементы по алфавиту и выявить какую-либо закономерность.
Таблица Мейера (1864 г.)
Немецкий исследователь Л. Мейер расположил химические элементы также в порядке увеличения их атомных масс.
Недостатки
Но в эту таблицу Мейер поместил всего 28 элементов, то есть меньше половины известных в то время. Расположение остальных элементов: В, Аl, Сu, Аg и др. - оставалось неясным, а структура таблицы была неопределенной.
Периодический закон и периодическая система
Еще алхимики пытались найти закон природы, на основе которого можно было бы систематизировать химические элементы. Но им недоставало надежных и подробных сведений об элементах. К середине XIX в. знаний о химических элементах стало достаточно, а число элементов возросло настолько, что в науке возникла естественная потребность в их классификации. Первые попытки классификации элементов на металлы и неметаллы оказались несостоятельными. Предшественники Д.И.Менделеева (И. В. Деберейнер, Дж. А. Ньюлендс, Л. Ю. Мейер) многое сделали для подготовки открытия периодического закона, но не смогли постичь истину. Дмитрий Иванович установил связь между массой элементов и их свойствами.
Дмитрий Иванович родился в г. Тобольске. Он был семнадцатым ребенком в семье. Закончив в родном городе гимназию, Дмитрий Иванович поступил в Санкт-Петербурге в Главный педагогический институт, после окончания которого с золотой медалью уехал на два года в научную командировку за границу. После возвращения его пригласили в Петербургский университет. Приступая к чтению лекций по химии, Менделеев не нашел ничего, что можно было бы рекомендовать студентам в качестве учебного пособия. И он решил написать новую книгу – «Основы химии».
Открытию периодического закона предшествовало 15 лет напряженной работы. 1 марта 1869 г. Дмитрий Иванович предполагал выехать из Петербурга в губернии по делам.
Менделеев расположил химические элементы в порядке возрастания их атомных масс и заметил, что свойства элементов повторяются через определенный промежуток – период.
Дмитрий Иванович расположил периоды так, чтобы сходные элементы располагались друг под другом – на одной вертикали, так была построена периодическая система элементов.
Формулировка периодического закона Д.И. Менделеева от 1 марта 1869г.
К сожалению, сторонников периодического закона сначала было очень мало, даже среди русских ученых. Противников – много, особенно в Германии и Англии.
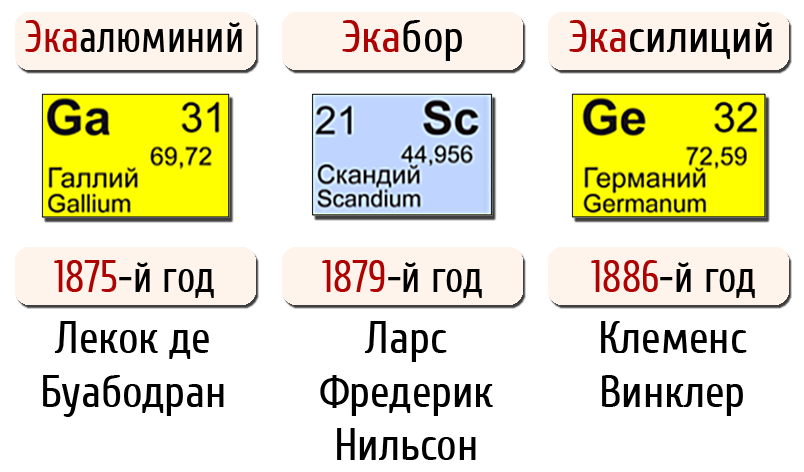
Открытие периодического закона – это блестящий образец научного предвидения: в 1870 г. Дмитрий Иванович предсказал существование трех еще неизвестных тогда элементов, которые назвал экасилицием, экаалюминием и экабором.
Он сумел правильно предсказать и важнейшие свойства новых элементов. И вот через 5 лет, в 1875 г., французский ученый П.Э. Лекок де Буабодран, ничего не знавший о работах Дмитрия Ивановича, открыл новый металл, назвав его галлием. По ряду свойств и способу открытия галлий совпадал с экаалюминием, предсказанным Менделеевым. Но его вес оказался меньше предсказанного. Несмотря на это, Дмитрий Иванович послал во Францию письмо, настаивая на своем предсказании.
Ученый мир был ошеломлен тем, что предсказание Менделеевым свойств экаалюминияоказалось таким точным. С этого момента периодический закон начинает утверждаться в химии.
В 1879 г. Л. Нильсон в Швеции открыл скандий, в котором воплотился предсказанный Дмитрием Ивановичем экабор.
В 1886 г. К. Винклер в Германии открыл германий, который оказался экасилицием.
Но гениальность Дмитрия Ивановича Менделеева и его открытия — не только эти предсказания!
В четырёх местах периодической системы Д. И. Менделеев расположил элементы не в порядке возрастания атомных масс:
Ar – K, Co – Ni, Te – I, Th - Pa
Ещё в конце 19 века Д.И. Менделеев писал, что, по-видимому, атом состоит из других более мелких частиц. После его смерти в 1907 г. было доказано, что атом состоит из элементарных частиц. Теория строения атома подтвердила правоту Менделеева, перестановки данных элементов не в соответствии с ростом атомных масс полностью оправданы.
Современная формулировка периодического закона
И вот спустя более 130 лет после открытия периодического закона мы можем вспомнить слова Дмитрия Ивановича: «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются». Сколько химических элементов открыто на данный момент? И это далеко не предел.
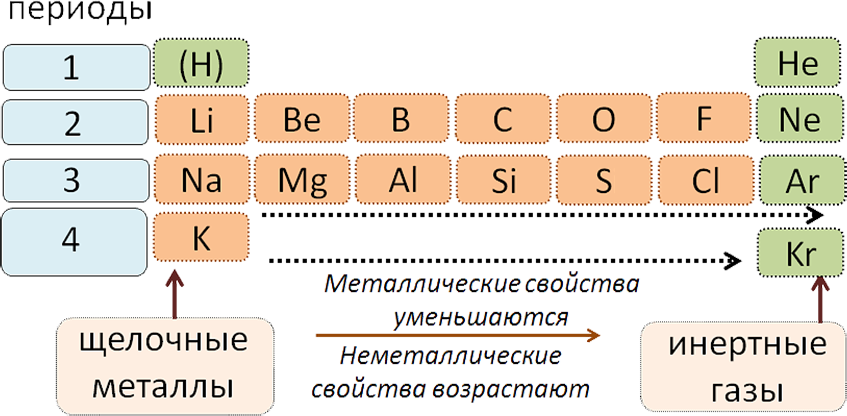
Графическим изображением периодического закона является периодическая система химических элементов. Это краткий конспект всей химии элементов и их соединений. Изменения свойств в периодической системе с ростом величины атомных весов в периоде (слева направо):
1. Металлические свойства уменьшаются
2. Неметаллические свойства возрастают
3. Свойства высших оксидов и гидроксидов изменяются от основных через амфотерные к кислотным.
4. Валентность элементов в формулах высших оксидов возрастает от I до VII, а в формулах летучих водородных соединений уменьшается от IV до I.
Периодическая система химических элементов
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
| Группа → Период ↓ |
I | II | III | IV | V | VI | VII | VIII | ||||||||||||||||||||||
| A | B | A | B | B | A | B | A | B | A | B | A | B | A | B | A | |||||||||||||||
| 1 | 1 H |
2 He |
||||||||||||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
||||||||||||||||||||
| 29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
|||||||||||||||||||||||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
||||||||||||||||||||
| 47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
|||||||||||||||||||||||
| 6 | 55 Cs |
56 Ba |
* | 72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
||||||||||||||||||||
| 79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
|||||||||||||||||||||||
| 7 | 87 Fr |
88 Ra |
** | 104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
||||||||||||||||||||
| 111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
|||||||||||||||||||||||
| Лантаноиды * | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||||||||||||
| Актиноиды ** | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||||||||||||
Существует ещё и длинный вариант таблицы, он похож на полудлинный, но только лантаноиды и актиноиды не вынесены за пределы таблицы.
Описание периодов и групп таблицы Менделеева
Период – химические элементы, расположенные в строчку (1 – 7)
Малые (1, 2, 3) – состоят из одного ряда элементов
Большие (4, 5, 6, 7) – состоят из двух рядов – чётного и нечётного
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом, а заканчиваются благородным газом.
Во всех периодах с увеличением относительных атомных масс элементов наблюдается усиление неметаллических и ослабление металлических свойств. В больших периодах переход свойств от активного металла к благородному газу происходит более медленно (через 18 и 32 элемента), чем в малых периодах (через 8 элементов). Кроме того, в малых периодах слева направо валентность в соединениях с кислородом возрастает от 1 до 7 (например, от Na до Cl). В больших периодах вначале валентность возрастает от 1 до 8 (например, в пятом периоде от рубидия к рутению), затем происходит резкий скачок, и валентность уменьшается до 1 у серебра, потом снова возрастает.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы.
Различают главные (А) и побочные подгруппы (Б).
Главные подгруппы состоят из элементов малых и больших периодов.
Побочные подгруппы состоят из элементов только больших периодов.
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам. Номер группы показывает высшую валентность элемента (кроме N, O, F).
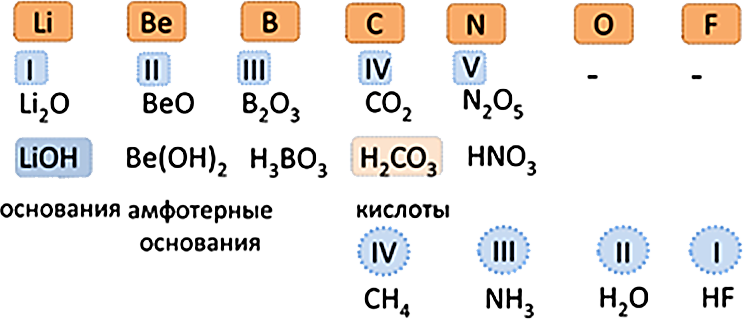
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные.
| Группа | I | II | III | IV | V | VI | VII | VIII (кроме инертных газов) |
|---|---|---|---|---|---|---|---|---|
| Высший оксид | Э2О | ЭО | Э2О3 | ЭО2 | Э2О5 | ЭО3 | Э2О7 | ЭО4 |
| Гидрат высшего оксида | ЭОН | Э(ОН)2 | Э(ОН)3 | Н2ЭО3 | Н3ЭО4 | Н2ЭО4 | НЭО4 | Н4ЭО4 |
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I - III групп образуют твердые вещества - гидриды (водород в степени окисления - 1), а IV - VII групп - газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) - нейтральны, V группы (ЭН3) - основания, VI и VII групп (Н2Э и НЭ) - кислоты.
Глоссарий
- Атомный номер — то же, что порядковый номер элемента в периодической системе Д.И.Менделеева. атомный номер численно равен положительному заряду ядра этого элемента, т.е. числу протонов в ядре данного элемента.
- Периодический закон Д.И. Менделеева – свойства простых веществ, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра элементов.
- Периодическая система химических элементов Д.И. Менделеева – упорядоченное множество химических элементов, их естественная классификация, которая является графическим выражением периодического закона химических элементов.
- Химический элемент – это определенный вид атомов, характеризующийся определенной совокупностью свойств (зарядом ядра, массой и др.).
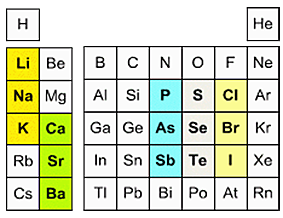
- Щелочноземельные элементы (щелочноземельные металлы) – химические элементы кальций, стронций, барий и радий.
- Щелочные элементы (щелочные металлы) – элементы гл подгруппы первой группы (IА-группы) литий, натрий, калий, рубидий, цезий, франций.
- Электроотрицательность – способность элемента оттягивать на себя электронную пару.
- Элемент - вещество, состоящее из атомов одного вида (из атомов с одинаковым зарядом ядра). Часто элемент содержит в своем составе несколько изотопов.
Полезные ссылки
Бибилиография:
- Ахметов Н. С. Актуальные вопроса курса неорганической химии. — М.: Просвещение, 1991. — 224 с — ISBN 5-09-002630-0
- Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — 271 с.
- Менделеев Д. И. Основы химии, т. 2. М.: Госхимиздат, 1947. 389 c.
- Менделеев Д.И. Периодическая законность химических элементов // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.).
- Г.В. Пчелкина.Химуля. Уроки.
Элемент № 96 - кюрий назван в честь супругов Кюри.
Элемент № 99 - эйнштейний назван в честь выдающегося физика Альберта Эйнштейна.
Элемент № 100 - фермий назван по имени изобретателя первого атомного реактора Энрико Ферми.
Элемент № 101 назван менделеевием в честь гениального автора периодического закона элементов Дмитрия Ивановича Менделеева.
Элемент № 102 - нобелий назван группой ученых института Нобеля в Стокгольме в честь Альфреда Нобеля. Но проверка в 1957 г. не подтвердила открытие этого элемента. Только в 1958 г. в Дубне в лаборатории Объединенного института ядерных исследований под руководством Г. М. Флерова был осуществлен ядерный синтез элемента № 102.
Элемент № 103 - лоуренсий назван в честь изобретателя циклотрона, основателя и директора радиационной лаборатории в Беркли Лоуренса.
Элемент № 104 - курчатовий, который был синтезирован в Дубне, назван в честь выдающегося советского физика, основателя института атомной энергии в СССР И. В. Курчатова.
Названия государств и материков имеют элементы: рутений (Россия латыни - Рутения), полоний (Польша), галлий (Талия - старинное название Франции), скандий (Скандинавия), америций (Америка), европий (Европа).
Названия рек отражено в названиях таких элементов: рений, платина. Медь - купрум - названа по названию острова Кипра.
Названия городов имеют следующие элементы: лютеций (старинное название Парижа), гафний (старинное название Копенгагена). Элементы иттрий, эрбий, иттербий, тербий названы по имени города иттербий в Швеции, где был найден минерал, содержащий эти элементы. Берклий происходит от названия города Беркли, в котором он был открыт. Калифорний - от названия штата, где находится университет, в котором этот элемент был искусственно получен.
Некоторые элементы имеют названия, связанные с их свойствами. Например, Йод - получил название от греческого слова, означающего фиолетовый; Бром - от греческого слова, означающего вонь; Фтор - от греческого слова, означающего разрушительный; Хлор - от греческого слова, означающего зеленый; Иридий - от греческого слова, означающего радуга; Родий - от греческого слова, означающего роза (растворы некоторых соединений родия имеют розовый цвет); Осмий - от греческого слова, означающего запах; Хром - от греческого слова, означающего краска (его соли имеют разнообразную окраску); Фосфор - гречески означает носитель света; Водород - от латинского слова гидрогениум - то, что рождает воду; Кислород - от латинского слова оксигениум - то, что рождает кислоту; Ртуть - от латинского слова гидраргирум - серебряная вода.
Торий назван Берцелиусом в честь скандинавского бога войны и грома Тора.
Ванадий назван в честь скандинавской богини красоты Ванадис.
Титан был назван в честь сказочной царицы эльфов Титания с древненемецкого эпоса. Через некоторое время после открытия титана этим именем астрономы назвали третий спутник планеты Уран.
Элемент прометий назван в честь мифического героя Прометея, который, якобы, украл с неба огонь и передал его людям.
Лантан гречески означает «прятаться». Это название дал лантану шведский химик Мозандер, открывший его в 1839 г. Только через столетия разделили лантаноиды и выделили лантан.
Элемент ниобий назван в честь Ниобеи - дочери Тантала. Это название обусловлено сходством ниобия с танталом.
Название теллура происходит от латинского слова - земля; селена - от греческого названия месяца; уран, нептуний, плутоний - получили названия также по названиям соответствующих планет. Церий назван в честь малой планеты Цереры.
Название гелия происходит от греческого слова Гелиос - солнце.
Названия некоторых элементов связаны с названиями минералов. Например, название элемента циркония происходит от названия минерала циркона, бария - от минерала барита, стронция - от стронцианита, бериллия - от берилла, вольфрама - от вольфрамита. Бор происходит от старого названия буры - борак, кальций - от греческого слова калькс, т.е. мягкий камень, литий - от греческого слова литеос - камень.
Человек, как бы это ни было удивительно, содержит в себе практически все химические элементы таблицы Менделеева. Какие-то из них присутствуют в большом количестве, другие составляют ничтожную долю. Состав человека, количество элементов в нем можно описывать очень долго, но для слаженной работы организма главное не количество, а качество. Но все же, каждый из них незаменим для нашего организма, независимо от его массы или процентного содержания в нашем теле.
Наше тело на 96% состоит из атомов углерода и водорода, а также кислорода и азота. Но не так важны для организма атомы, как химические соединения, которые просто не могут происходить без них. Ведь они являются главными составляющими для осуществления жизненно необходимых соединений для нашего организма. Остальные 4% составляют прочие химические элементы. Но, несмотря на их низкое содержание, не стоит уменьшать их влияние на наш организм. Химические элементы, а точнее, их соединения, являются составляющими нашего организма.
Тело человека, весящего 70 кг, содержит:
- углерод – 12,6 кг
- кислород – 45,5 кг
- водород – 7 кг
- азот – 2,1 кг
- кальций – 1,4 кг
- натрий – 150 г
- калий – 100 г
- магний – 200 г
- хлор – 200 г
- фосфор – 0,7 кг
- сера – 175 г
- железо – 5 г
- фтор – 100 г
- кремний – 3 г
- йод – 0,1 г
- мышьяк – 0,0005 г.
Как известно, человек на треть своей массы состоит из воды. У детей процент содержания жидкости в организме достигает 80%. У пожилых людей он равен 50%. Поэтому восполнять запасы жидкости просто необходимо, для этого употребляйте воду в объеме 2 литра в сутки, в жаркое время это количества увеличивается. Вода является неотъемлемой составляющей нашего организма.
На 20% человек состоит из белков, углевода и жиров и соединений из них. Одной из важных составляющих этих элементов является углерод, без него соединения просто не будут происходить. Именно поэтому углерод можно отнести к одному из главных составляющих элементов нашего организма. Для получения жиров и углеводов требуется лишь три составляющих: углерод, водород и кислород. Присоединив молекулы азота, получается белок. Как видите, наш организм способен производить жизненно необходимые микроэлементы и соединения, использую при этом все лишь четыре химических элемента.
Для правильной работы нашего организма необходимо употреблять только полезную и правильную пищу. Пища, которую человек потребляет ежедневно, должна быть насыщенна белками, углеводами и жирами.
Наш организм самостоятельно производит все необходимые соединения. Нам следует лишь пополнять его полезными веществами, пополнять водный запас, больше находиться на свежем воздухе, и тогда наш организм будет работать как часы.
Самая большая таблица Менделеева была установлена на стенах химического факультета в Университете Мурсии в Испании.
В общей сложности инсталляция занимает в общей сложности около 150 м2. Самая большая таблица Менделеева состоит из 118 металлических квадратов размером 75×75 см. В неё включены все известные химические элементы, каждый из которых занимает отдельный квадрат. Дизайнеры этой гигантской таблицы считают, что их работа является на данный момент самой большой Периодической системой в мире.
«Мы хотим направить положительный посыл обществу о химии и о том, насколько химия способствовала благополучию общества», — рассказывает декан химического факультета Педро Лозано Родригес. «Люди должны знать, что всё, что нас окружает, формируется элементами, содержащимися в этой периодической таблице».
«Художественный ансамбль» будет завершен с добавлением трибуны на 50 мест, которая будет использоваться как аудитория под открытым небом для студентов.
Другие гигантские Периодические таблицы
Хотя инсталляция в Университете Мурсии, вероятно, является самой большой постоянно действующей периодической таблицей, таблицу Менделеева не раз пробовали воссоздать в гигантской форме. В 2006 году в Центре Ричарда Дж. Дейли в Чикаго (США) временно была организована восьмиэтажная периодическая таблица выполненная с помощью плакатов.
В 2016 году более 100 школ в Сан-Антонио собрали самую большую в мире таблицу Менделеева, уложив элементы размером 3,5×4,5 м на стадионе. Эта таблица заняла площадь площадь более 2000 м2.
Таблица Менделеева в Санкт-Петербурге не такая большая (всего 69 м2), но более интересна с исторической точки зрения. Она была создана в 1935 году, а макет таблицы соответствует тому, который был дан в последнем прижизненном 8 издании, опубликованном в 1906 году.