Химия: Атомдун түзүлүшү
Содержание
Атомдун түзүлүшү
Бардык заттардын атомдордон тураары жөнүндөгү божомол мындан эки миң жылдан ашык мурда эле пайда болгон. Атомистикалык теориянын жактоочулары (Демокрит, Левкипп, Анаксагор, Анаксимандр, Эпикур, Лукреций Кар) атомду эң кичине бөлүнбөс бөлүкчө катары карашкан жана дүйнөдөгү көп түрдүүлүктү атомдордун – «өзгөрбөс бөлүкчөлөрдүн» айкалышуусу деп эсептешкен.
Демокрит: «Атомдордун бөлүнүшүнүн чеги болот»
Аристотель: «Заттар чексиз бөлүнө беришет»
Париж, 1626–жыл: «Атом жөнүндөгү окууга өлүм коркунучу менен тыюу салынган»
М.В. Ломоносов, Ж. Гей–Люссак, Д. Дальтон ж.б. атомистикалык теориянын жактоочуларынан болушкан.
Атомдун түзүлүшүн толук окуп–үйрөнүү үчүн төмөнкүлөр түрткү болгон:
- Рентген нурларынын ачылышы (1895–ж., В.К. Рентген);
- Радиоактивдүүлүктүн жана жаңы радиоактивдүү элементтердин ачылышы (1896–ж., А. Беккерель, М. жана П. Кюри);
- Электрондун ачылышы (1896–ж., Дж. Дж. Томсон).
1896–жылы В. Вебер тарабынан айтылган атомдун электрондук түзүлүшү жөнүндөгү ойду Х. Лоренц «Электрондор атомдун курамына кирет» деп айтуу менен андан ары өнүктүргөн.
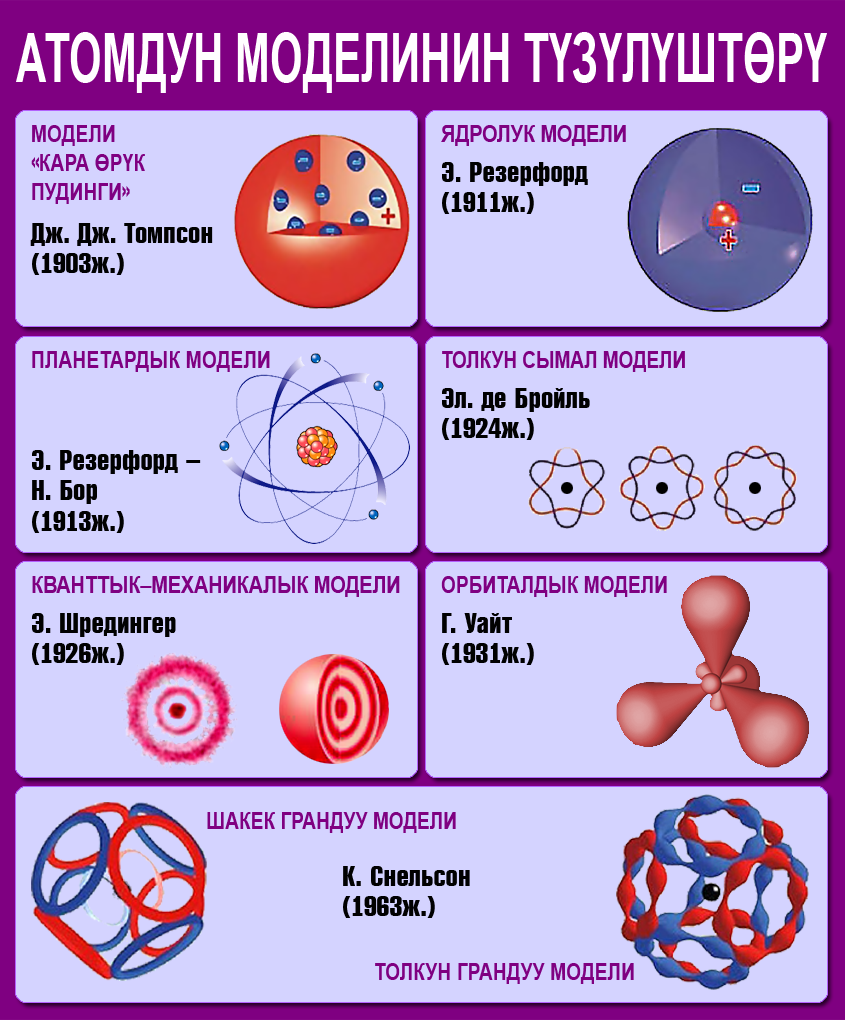
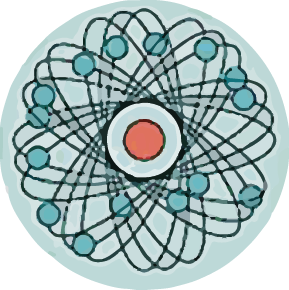
Мына ушул ачылыштарга таянып, Дж. Томсон 1898–жылы радиусу 10–10м болгон оң заряддалган шар түрүндөгү жана анын зарядын нейтралдаштырып турган электрондордон турган атомдун моделин сунуш кылган.
Атомдун ядролук модели
1911–жылы англиялык физик Э. Резерфорд Томсондун моделин эксперимент аркылуу текшерип көргөн.
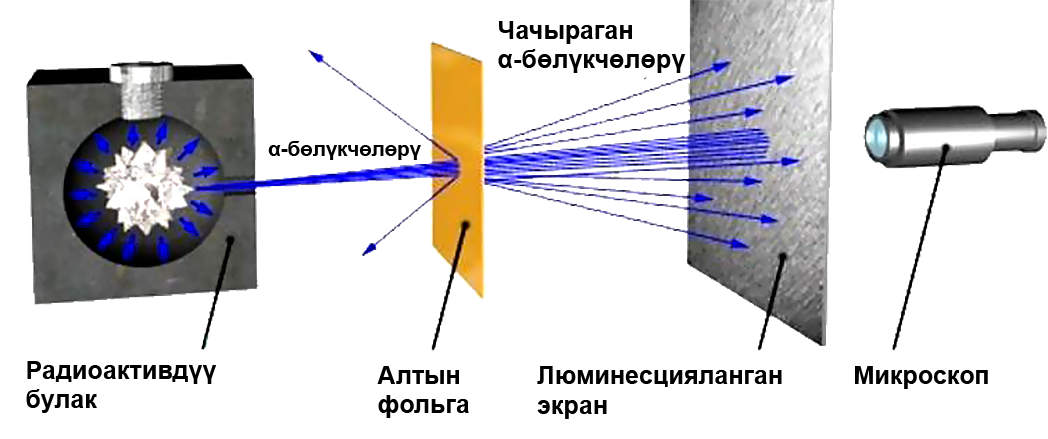
Тажрыйбанын максаты, α бөлүкчөлөрүнүн атомдордо таралышын окуп–үйрөнүү болгон (заряды +2е, массасы 6,64.10–27кг). α–бөлүкчөлөрдүн кинетикалык энергиясы β–нурларыныкына караганда көбүрөөк болгондуктан жана алар γ–нурларынан айрымаланып электр зарядына ээ болгондуктан тандалып алынган.
α–бөлүкчөлөрүнүн нурлары жука алтын фольгасы аркылуу өткөрүлгөн. Алтын өтө ийилгич материал болгондуктан, андан бир атомдук катмардан турган фольганы жасоого болот. Тажрыйбаны башка металлдардан жасалган материалдарга да жүргүзүп, кайталап көрүшкөн.
Э. Резерфорд жана анын жардамчылары Г. Гейгер жана Э. Марсден α–бөлүкчөлөрүнүн кандайдыр – бир бөлүгү белгилүү бир бурчка кыйшайып, өзүнүн баштапкы багытын кескин өзгөрткөндүгүн жана башка бөлүгү фольгадан кайрадан чагылгандыгын байкашкан. Бирок, Томсондун атом моделине ылайык, α–бөлүкчөлөрү фольгадагы атомдор менен аракеттенген убакта кичине гана бурчка, 2° кыйшайган.
Резерфорд Томсондун модели анын тажрыйбаларына карама–каршы келээрин көрсөткөн. Резерфорд өзүнүн тажрыйбаларын жыйынтыктап, атомдун түзүлүшүнүн ядролук (планетардык) моделин сунуш кылган:
- Атом өзүнөн көлөмү кичине болгон (~ 10–15м) ядродон турат.
- Атомдун негизги массасы анын ядросунда топтолгон.
- Электрондордун терс заряддары атомдо бирдей таралган жана ядронун оң зарядын нейтралдаштырып турат.
Эсептөөлөр көрсөткөндөй, затта электрондор менен аракеттенген α–бөлүкчөлөрү өздөрүнүн багытын өзгөртүшпөйт.
Бирок, сунушталган атомдун түзүлүшүнүн ядролук модели атомдун туруктуулугун түшүндүрө алган эмес:
– Максвеллдин теориясы боюнча электрондордун өтө тез кыймылы алардан электромагнитниттик нурлануунун бөлүнүп чыгышы менен коштолот, ошондуктан электрондун энергиясы азаят да, ал спираль боюнча жылып, ядрого жакындайт. Бул мезгилде электрон ядрого кулап кетчидей көрүнөт (бул 10–8с болушу мүмкүн экендигин эсептөөлөр көрсөтүп турат), анткени спираль боюнча жылганда электрондун энергиясы азаят, бирок, атомдор туруктуу система боюнча калат.
– мында нурлануунун спектри үзгүлтүксүз болушу керек (бардык узундуктагы толкундар болушу керек). Бирок, тажрыйбада сызыктуу спектр гана алынат;
– Ядронун түзүлүшү боюнча тɵмɵнкү суроого жооп берилген эмес:
– Эгерде атом оң заряддалган гана бөлүкчөлөрдөн турса, эмне үчүн алар өз ара түртүлүшпөйт?
Атомдун ядросунун курамы
Атом – химиялык жол менен бөлүнбөгөн заттын эң майда бөлүкчөсү. XX кылымда атомдун өтө татаал түзүлүштө экендиги аныкталган. 1911–жылы англиялык окумуштуу Э. Резерфорд атомдун борборунда оң заряддалган ядро болоорун тажрыйба жүзүндө далилдеген. Атомдор оң заряддалган ядродон жана терс заряддалган электрондук катмарлардан турат.
Эркин абалдагы атомдун заряды нөлгө барабар, анткени ядронун заряды менен электрондук катмарлардын заряды теңделип турат. Ошентип, ядронун зарядынын чоңдугу мезгилдик системадагы элементтин катар санына(атомдун номери) жана электрондордун (электрондун заряды −1 барабар) жалпы санына барабар болот.
Атомдун ядросу оң заряддалган протондордон жана нейтралдуу бөлүкчөлөр, – зарядга ээ эмес, нейтрондордон турат. Атомдун курамындагы элементардык бөлүкчөлөрдүн мүнөздөмөсүн жалпылап, төмөндөгүдөй таблица түрдө берүүгө болот:
| Бөлүкчөлөрдүн аталышы | Белгилениши | Заряды | Массасы |
|---|---|---|---|
| протон | p | +1 | 1 |
| нейтрон | n | 0 | 1 |
| электрон | е– | −1 | 0 барабар болот |
Протондордун саны ядронун зарядына туура келет, демек, ал атомдун катар санына барабар болот. Атомдогу нейтрондун санын табуу үчүн атомдун массасынан (протондордун жана нейтрондордун массаларынын суммасы) ядронун зарядын (протондун саны) кемитүү керек.
Мисалы, натрийдин атому 23Na протондордун саны p = 11, нейтрондордун саны n = 23 − 11 = 12 болот.
Бир эле элементтин нейтрондорунун саны ар түрдүү болушу мүмкүн. Мындай атомдор изотоптор деп аталат.
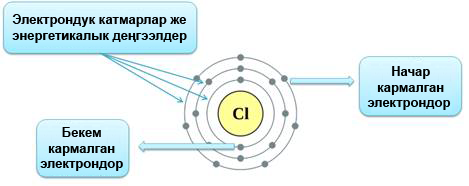
Атомдун электрондук катмары татаал түзүлүшкө ээ болот.Электрондор энергетикалык деңгээлдерде (электрондук катмарларда) жайгашат.
Деңгээлдердин номери электрондун энергиясын мүнөздөп турат. Атомдогу электрондор ар түрдүү энергиянын запасына ээ болот, алар белгилүү үлүштү сиңирип же нур чыгарып турушат, бул кванттар деп аталат.
Деңгээлдин саны канча кɵп болсо, электрон да ошончолук көп энергияга ээ болот. Системанын энергиясы канчалык төмөн болсо, ал ошончолук туруктуу болот (чон потенциалдык энергияга ээ болгон тоодогу таштын туруктуулугу менен энергиясы төмөн, түздүктөгү ташка салыштыргыла), адегенде төмөнкү энергияга ээ болгон электрондор толтурулат жана андан кийин жогорку деңгээлдер толтурулат.
Энергетикалык деңгээлдеги электрондордун максималдуу саны N=2n2 формуласы менен эсептелинет: N –деңгээлдеги электрондун максималдуу саны, n – деңгээлдин номери.
Биринчи деңгээл үчүн: N = 2 x 12 = 2,
экинчи деңгээл үчүн: N = 2 x 22 = 8 ж.б.
Негизги (А) подгруппанын элементтеринин сырткы катмарындагы электрондордун саны группанын номерине туура келет.
Учурдагы көпчүлүк мезгилдик системаларда электрондордун деңгээлдер боюнча жайгаштырылышы элемент жазылган чакмакта (клетка) көрсөтүлгөн. Деңгээлдердин энергияларына ылайык, төмөндөн жогору карай окулгандыгы маанилүү болуп саналат. Ошондуктан, натрий жазылган чакмакты төмөндөгүдөй окуу керек:
1
8
2
1– деңгээлде – 2 электрон,
2–деңгээлде – 8 электрон,
3–денгээлде – 1 электрон бар.
Электрондордун деңгээлдерде жайгашуусун схема түрүндө көрсөтүүгө болот: ![]()
Эгерде мезгилдик системада электрондордун денгээлдер боюнча бөлүштүрүлүшү көрсөтүлбөсө, анда:
- электрондордун максималдуу саны: 1–деңгээлде 2 е ашык болбойт,
- 2–деңгээлде – 8 е,
- сырткы деңгээлинде – 1 е;
Биринчи 20 элементтин сырткы деңгээлиндеги электрондордун саны группанын номерине туура келет.
Анда, натрийдин атомун көрөлү:
- Электрондордун жалпы саны 11 барабар, демек, биринчи деңгээл толгон, анда 2 е кармалат;
- Үчүнчү, сырткы денгээлде 1 е бар (I группа);
- Экинчи деңгээлде калган электрондор кармалат: 11 − (2 + 1) = 8 (толук толгон)
Изотоптор
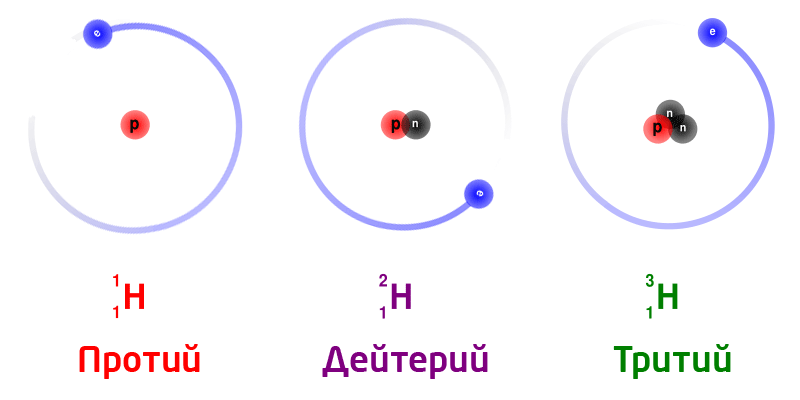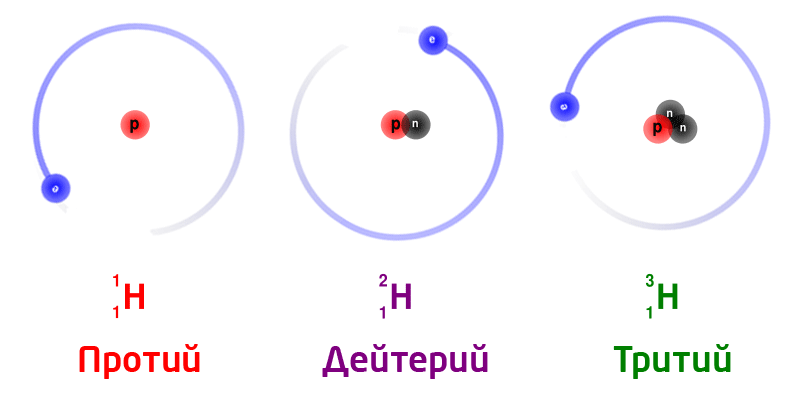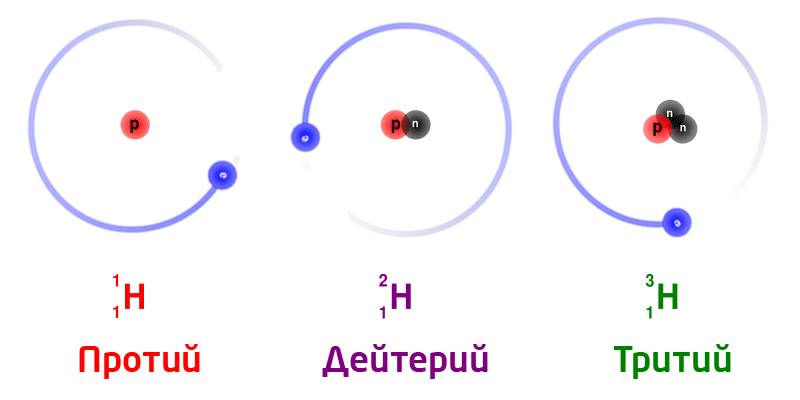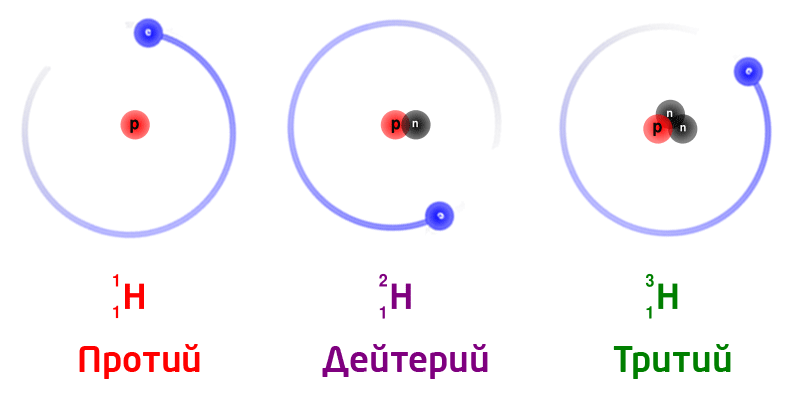
Изотоптор – бир эле химиялык элементтин атомунун бири–биринен массасынан айрымаланган көп түрдүүлүгү.
Изотоптордун белгилениши: элементтин белгисинин сол жак жогору жагында массасы жана төмөн жагында элементтин катар саны көрсөтүлөт.
Жаратылыштагы суутектин изотоптору:
Бир эле химиялык элементтин изотоптору, ядродогу нейтрондордун санына жараша ар түрдүү массага ээ болот.
Химиялык элемент – бул ядросунун заряды бирдей болгон атомдордун белгилүү бир түрү.
Жаратылышта химиялык элементтер изотоптордун аралашмасы түрүндө кездешет. Бир эле химиялык элементтин изотоптук курамы атомдук үлүш (ωат.) аркылуу берилет. Ал берилген изотоптун атомунун саны элементтин бардык изотопторунун атомдорунун 100% деп кабыл алынган жалпы санынын, канча бөлүгүн түзөөрүн көрсөтөт.
Мисалы:
ωат (35Сl) = 0,754 же 75,4%
ωат (37Сl) = 0,246 же 24,6%
Д.И. Менделеевдин таблицасында химиялык элементтердин изотопторунун курамын эске алуу менен салыштырмалуу атомдук массаларынын орточо мааниси берилген. Ошондуктан, таблицада көрсөтүлгөн салыштырмалуу атомдук массалар Ar, бөлчөк түрүндө көрсөтүлгөн.
Ar орточо= ωат.(1) x Ar(1) + … + ωат.(n) x Ar(n)
Мисалы:
Ar орточо(Cl) = 0,754 x 35 + 0,246 x 37 = 35,453
Эмне үчүн изотоптордун массасы ар түрдүү болот?
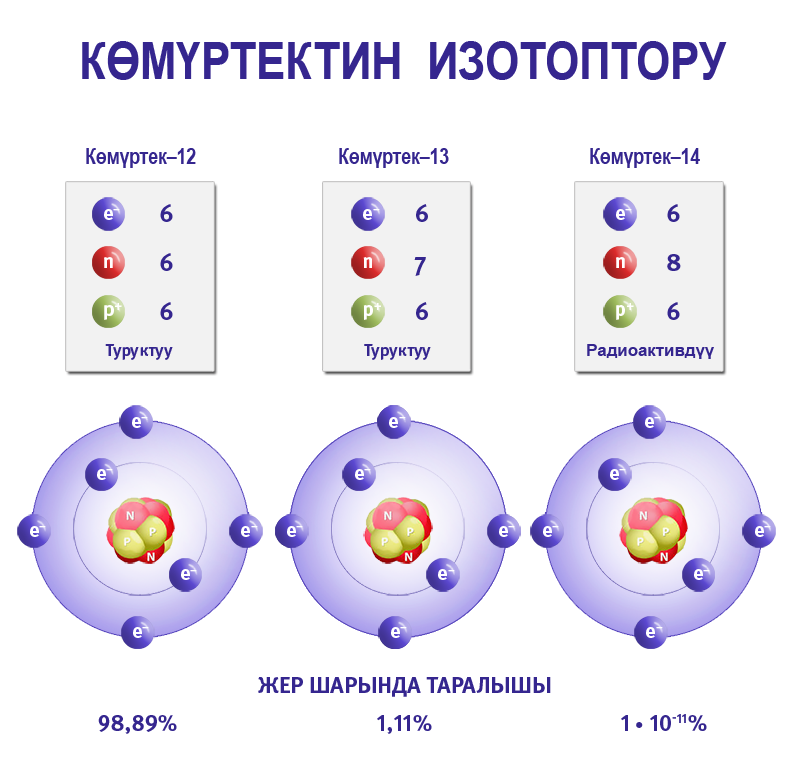
Жаратылышта бир эле химиялык элемент эки же андан көп изотоп түрүндө болушу мүмкүн. Химиялык элементтин касиетине нейтрондор таасир эте албагандыктан, бир эле элементтин изотоптору химиялык жактан такыр айрымаланбайт.
Изотоптор деп, ядронун заряддары бирдей (б.а. протондорунун саны бирдей болгон), бирок нейтрондордун саны ар түрдүү болгон атомдордон турган заттарды айтабыз. Изотоптор бири–биринен массасынан айрымаланат. Бардык элементтер бир же бир нече изотоптордон турушат.
Мисалы, алмаз көмүртек элементинен турат. Эгерде массасы 12 жана массасы 13 болгон көмүртектен окшош эки бриллиант даярдалса, анда эки кристалл тең химиялык жактан бирдей (ядросунун заряды + 6) болуп, бирок массаларынан айрымаланышат. Чындыгында, массасы 12 жана 13 болгон, таза көмүртектен даярдалган бриллианттардын баасы кадимкилерге караганда бир канча жогору болмок. Анткени, алардын химиялык жана физикалык касиеттери абдан окшош болгондуктан, аларды айрымалоо кыйындыкка алып келет.
Радиоактивдүүлүк
-
1896–жылы француз физиги А. Беккерель урандын туздарынын люминесценция кубулушун окуп–үйрөнүү менен, алардын өзүнөн белгисиз нурларды бөлүп чыгаарын жана ал нурлар кагаз, жыгач, жука металл пластинкалары аркылуу өтүп, абаны иондоштура тургандыгын байкаган. (1897–98–жылдар).
Мария Склодовская–Кюри жана Пьер Кюри уран рудаларын изилдеп, жаңы химиялык элементтерди: полонийди жана радийди ачкан. Туруксуз изотоптордун өз алдынча бөлүкчөлөрдү бөлүп чыгаруу жана энергияны нурландыруу менен туруктуу изотопторго айлануу кубулушу табийгый радиоактивдүүлүк деп аталат.
Катар саны 83тɵн жогору болгон химиялык элементтер радиоактивдүү болуп саналат.
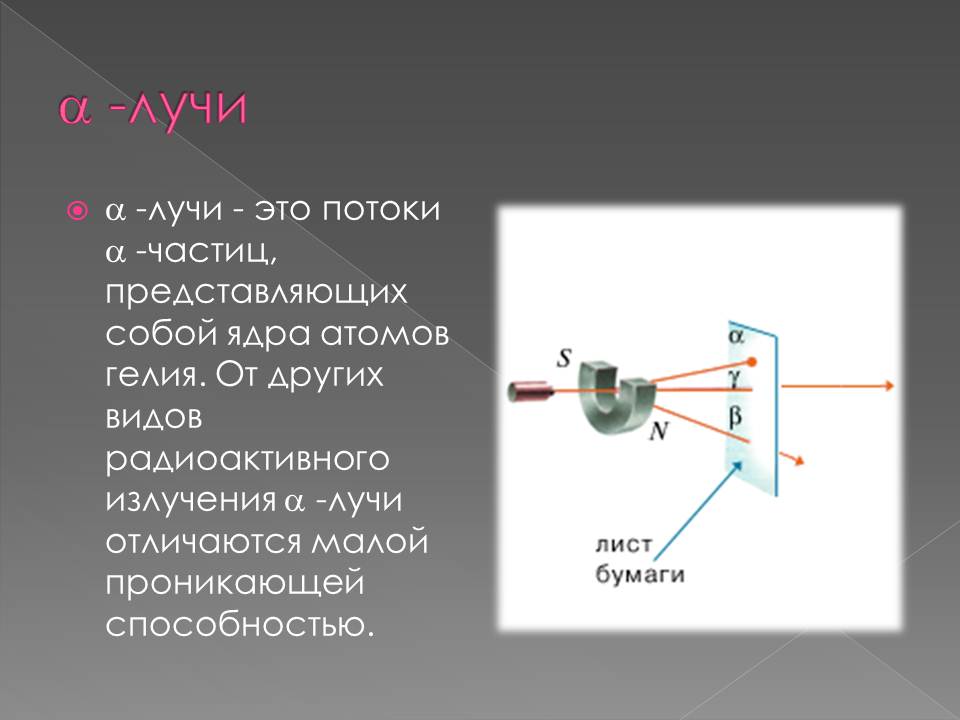
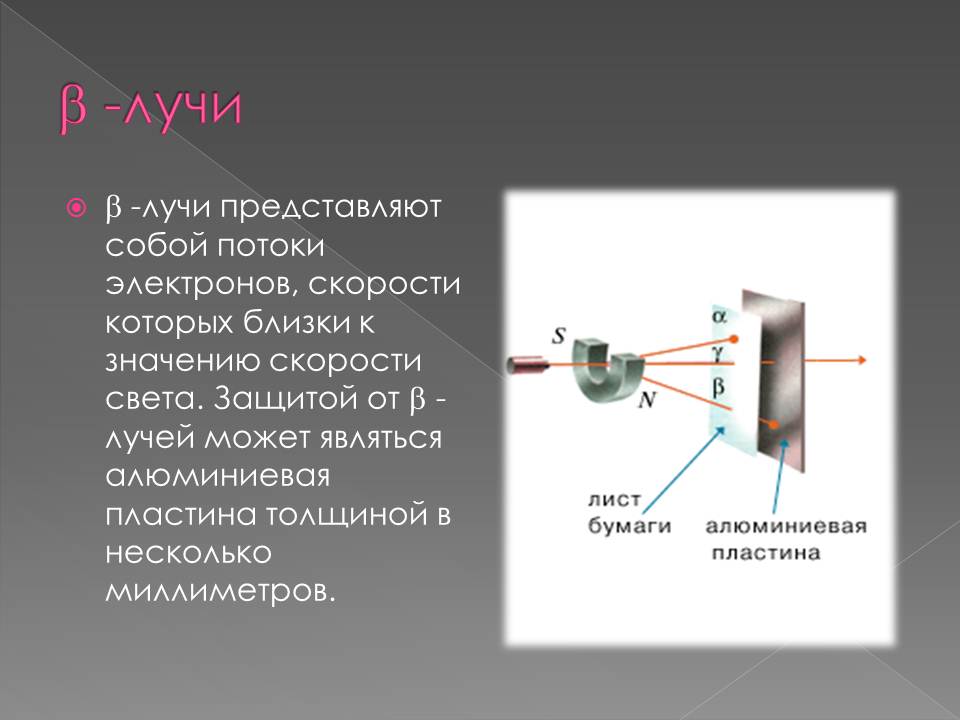
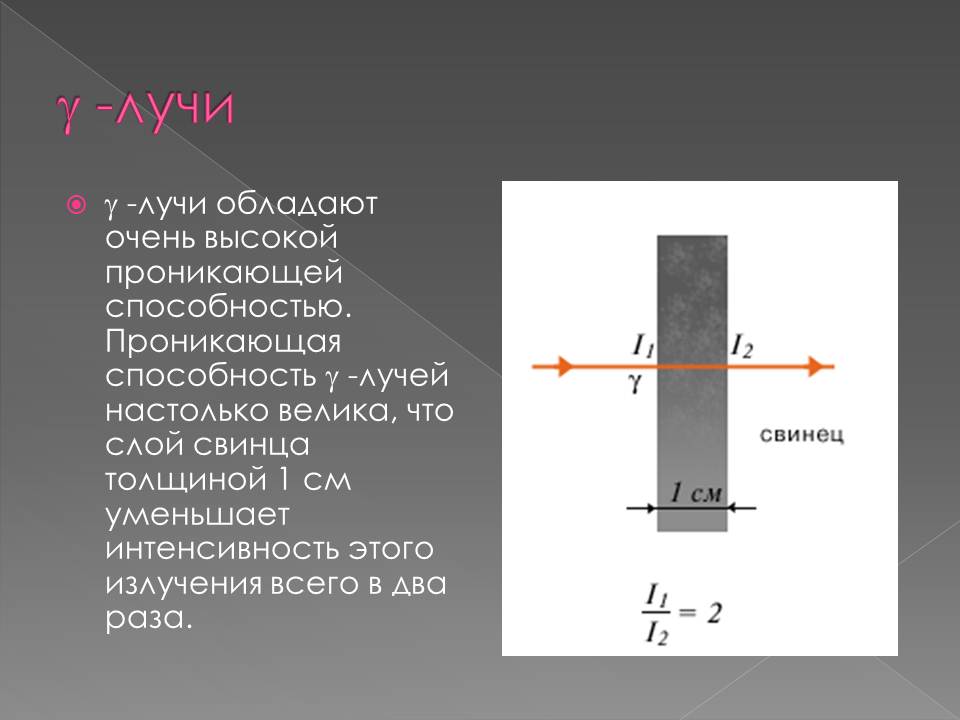
Радиоактивдүү нурлардын түрлөрү
898–жылы Э. Резерфорд радиоактивдүү заттардан бөлүнүп чыккан нурларды магнит талаасы аркылуу өткөрүү менен эки түрдөгү нурларды алган: α–нурлары – оң заряддалган оор бөлүкчөлөр (гелийдин атомунун ядросу) жана β–нурлары – терс заряддалган жеңил бөлүкчөлөр (электронго окшош).
1900–жылы П. Виллард γ–нурларын – нейтралдуу нурларды ачкан. Резерфорд тарабынан атомдун структурасы түзүлгөндөн кийин радиоактивдүүлүктүн ядролук процесс экендиги анык болгон.1902–жылы Э. Резерфорд жана Ф. Содди радиоактивдүү заттардын нурларды бөлүп чыгаруу менен ажыроосунун натыйжасында, бир химиялык элементтин башка элементке айлана тургандыгын далилдешкен.
Химиялык элементке Д.И. Менделеевдин мезгилдик системасында алган ордуна карата мүнɵздɵмɵ берүү
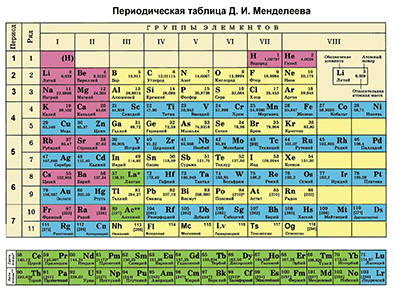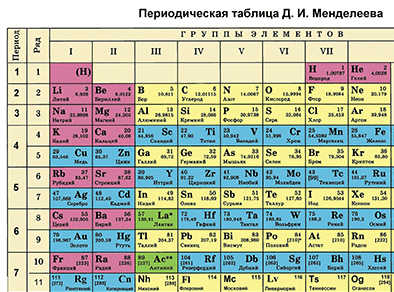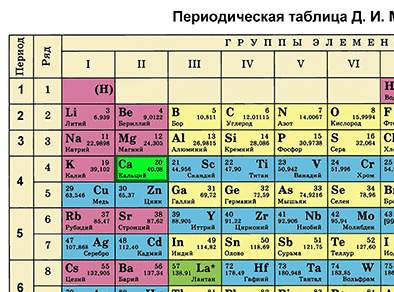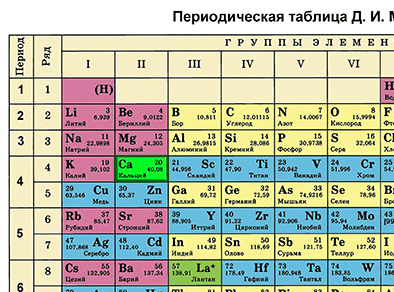
Д. И. Менделеевдин Мезгилдик системасы химиялык элементтерди таануунун негизги булагы болуп саналат. Бул таблицаны пайдалануу менен химиялык элементти мүнɵздөɵгɵ болот.
Д. И. Менделеевдин мезгилдик таблицасынын жардамы менен химиялык элементке мүнөздөмө берүүнүн кадамдарын белгилейли. Мисалы, бир металл жана бир металл эмес элементтерди карап кɵрɵлү.
- Таблицадан бир химиялык элементти белгилеп, анын алган орду боюнча атомунун түзүлүшүн сүрөттөп жазабыз.
- Таблицадагы бардык химиялык элементтер металлдарга жана металл эместерге бөлүнөт. Белгиленген элементтин металл же металл эмес экендигин аныктайбыз.
- Биз тандаган металл же металл эместин касиеттери подгруппадагы башка элементтердин касиеттери менен салыштырылат.
- Биздин металл же металл эмес элементинин касиеттери кошуна мезгилдеги элементердин касиеттери менен салыштырылат.
- Сүрөттөлгөн элементтин жогорку оксидинин курамы мүнөздөлөт (б. а. негиздик, кислоталык же амфотердикпи)
- Жогорку гидроксидинин курамы мүнөздөлөт (б.а.ал негизби, амфотердүү гидроксид же кычкылтектүү кислотабы)
- Эгер ал металл эмес болсо, анда суутектик учма кошулмалары белгиленет.
- Металл же металл эмеске мүнɵздɵмɵ берүүдɵ, элементтин түзүлүшүнɵ, ал элементтен пайда болгон бирикмелердин касиеттеринин өзгөрүүсүнɵ таянуу керек.
Биринчи бөлүм – химиялык элементти таблицадан табабыз жана анын алган ордуна ылайык, атомунун түзүлүшүн сүрөттөйбүз.
Кальцийдин катар саны 20га жана салыштырмалуу атомдук массасы 40ка барабар. Демек, кальцийдин катар саны 20 болсо, анын ядросунун заряды +20 болот. (Z (зэт) – оң заряддалган протондордун саны). Зарядга ээ эмес нейтрондордун санын – N (энди) табабыз. N = А – Z. N = 40 – 20. N = 20. Атом электронейтралдуу болгондуктан, (протондордун саны электрондордун санына барабар болот), электрондордун саны да 20 болот.
Кальций элементи мезгилдик системада төртүнчү мезгилде жайгашкандыктан, электрондор да төрт энергетикалык деңгээлде жайгашат. Кальцийдин электрондук формуласын жазабыз:
20Ca 2е 8е 8е 2е (е үстүнө сызыкча коюлат). Демек, биринчи энергетикалык деңгээлде кальцийдин атомунун ядросунун айланасында эки электрон, экинчи энергетикалык деңгээлде – сегиз электрон, үчүнчүдө – сегиз, төртүнчүдө – эки электрон айланып жүрөт.
Электрондук формулада көрүнүп тургандай, кальцийдин сырткы (төртүнчү) энергетикалык деңгээлинде эки электрону бар. Сырткы катмардагы электрондорун берүү менен ал ɵзү кычкылданат жана башка элементти калыбына келтирет. Окистенүү даражасы +2 барабар болот. Кальцийдин калыбына келтирүүчүлүк касиети магнийге жана бериллийге караганда күчтүүрөөк, бирок стронцийге караганда начарыраак болот. Бул төмөнкүдөй түшүндүрүлөт: атомдун радиусу канчалык чоң болсо (ал энергетикалык деңгээлдердин санынын көбөйүшү менен чоңоёт), ядро менен байланыш начарлайт да элемент сырткы электрондорун оңой берет.
Электрондор атомдун сырткы катмарынан бөлүнүп чыкканда, ал ионго айланат, мисалы, кальций Са2+ ионуна айланат (кальций–эки–плюс).
Экинчи бөлүм. Мүнɵздөлгөн элементтин металл же металл эместигин белгилейбиз.
Кальцийдин атомдору металлдык байланыш менен байланышып, металлдык кристаллдык торчону түзүшөт. Демек, кальций металлдык жалтырактыкка ээ болгон, жылуулукту жана электр тогун жакшы өткөргөн, ийилгич, тыгыздыгы жогору жана жогорку температурада балкып эриген металл.
Үчүнчү бөлүм. Элементтин касиетин подгруппадагы башка элементтердин касиеттери менен салыштыруу.
Кальцийдин металлдык касиети бериллийден жана магнийден күчтүү, бирок стронцийден начар. Заттардын металлдык касиети атомдордун сырткы электрондорун оңой берүүсү менен шартталат. Мурунку бөлүмдөн бизге кальцийдин бериллийге жана магнийге караганда сырткы электрондорун оңой берээри белгилүү.
Төртүнчү бөлүм. Элементтин касиеттерин кошуна мезгилдеги элементтердин касиеттери менен салыштыруу.
Кальцийдин металлдык касиети калийге караганда начарыраак болот. Калийдин сырткы энергетикалык денгээлинде бир электрон болсо, кальцийде эки электрон болот. Металлдык касиет атомдун сырткы электрондук катмарындагы электрондун кандай кармалгандыгына байланыштуу болот. Калийдин сырткы катмарындагы бир электрону начар кармалгандыктан, анын металлдык касиети күчтүү болуп саналат.
Бешинчи бөлүм. Элементтин жогорку оксидинин курамы жана аны мүнөздөө.
Кальцийдин оксиди СаО (кальций–о) негиздик оксид болуп саналат жана ал негиздик оксиддерге тиешелүү касиеттерге ээ болот. Суу менен реакцияга кирип, щелочторду пайда кылат, кислоталык оксиддер менен аракеттенишип, туздарды пайда кылат, кислоталар менен аракеттенишип, тузду жана сууну пайда кылат.
Алтынчы бөлүм. Элементтин жогорку гидроксидинин курамын мүнɵздөө.
Кальцийдин гидроксиди – Са(ОН)2 (кальций–о–аш–эки). Ал негиздик касиетке ээ болот: самын сыяктуу жылмышкак, индикатордун түсүн өзгөртөт, кислоталар жана металл эместердин оксиддери менен аракеттенишип, тузду жана сууну пайда кылат, туздар менен аракеттенишип, жаңы тузду жана жаңы негизди пайда кылат.
Жетинчи бөлүм. Суутек менен учма бирикмени пайда кылышы. Кальций металлы учма суутектик бирикмени пайда кылбайт.
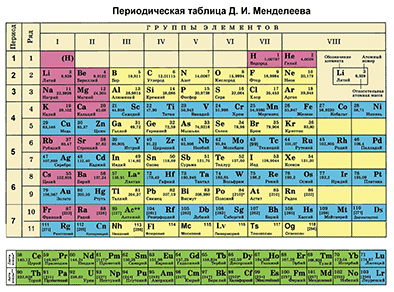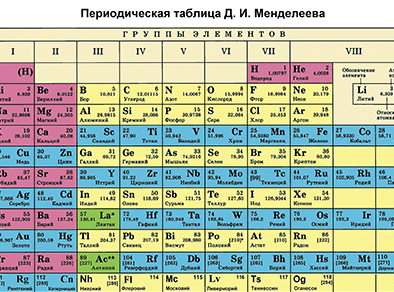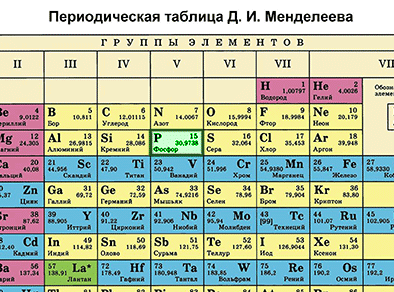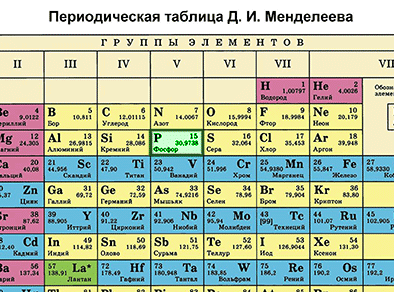
Биринчи бөлүм – таблицадан химиялык элементти табабыз жана алган орду боюнча анын атомунун түзүлүшүн сүрөттөйбүз.
Фосфор – мезгилдик системадагы VA–группанын, 3–мезгилдин элементи. Фосфордун катар саны – 15 жана ядросунун заряды +15 барабар (протондордун саны Z (зэт) да 15). Атом электронейтралдуу болгондуктан, (протондордун саны электрондордун санына барабар), электрондордун саны 15 болот. Атомдук массасы 30 (А=30) барабар. N (эн) – нейторндордун санын табабыз. N = А – Z, N = 30 – 15, N = 15 болот.
Фосфордун электрондук катмарынын формуласын жазабыз:15Р 2е 8е 5е Бул, биринчи энергетикалык деңгээлде атомдун ядросунун айланасында эки электрон, экинчи энергетикалык деңгээлде – сегиз электрон, үчүнчүдө – беш электрон айланып жүрөт.
Экинчи бөлүм. Элементтин металл же металл эмес экендигин белгилейбиз.
Фосфордун атому өзүн окистендиргич катары алып жүрөт (окистенүү даражасы –3) жана калыбына келтирүүчүлүк да касиетке ээ болот (окистенүү саны +3 жана +5).
Фосфордун окистендирүүчү касиети азотко караганда начарыраак, бирок, мышьякка караганда күчтүүрөөк болот. Бул – атомдордун радиусу азоттон мышьякты көздөй чоңойгондугуна байланыштуу болот. Ушул себептен, бешинчи группанын негизги подгруппасынын элементтеринин калыбына келтирүүчүлүк касиети азоттон мышьякты кɵздɵй күчөйт.
Фосфор металл эмес болуп саналат. Фосфордун кристаллдык торчосунун түзүлүшү анын аллотропиялык түр өзгөрүшүнөн көз каранды болот. Ак, кызыл жана кара фосфор болот. Ак фосфор жаратылышта кеңири таралган, анын молекуласы тетраэдр формасында болот. Кызыл жана кара фосфор кристаллдык торчонун башкача формадагы түзүлүштөрүнө ээ болушат.
Үчүнчү бөлүм. Элементти подгруппадагы башка элементтер менен салыштыруу.
Фосфордун металл эместик касиети азотко караганда начарыраак, бирок, мышьякка салыштырганда күчтүүрөөк болот.
Төртүнчү бөлүм. Фосфорду 3–мезгилдеги башка элементтер менен салыштыруу.
Фосфордун металл эместик касиети кремнийге караганда күчтүүрөөк, бирок, күкүрткө салыштырганда начарыраак болот.
Бешинчи бөлүм. Элементтин жогорку оксидин мүнөздөө.
Фосфордун жогорку оксиди – Р2О5 (пэ–эки–о–беш). Бул – кислоталык оксид, ошондуктан, кислоталык оксидге тиешелүү болгон касиеттерди көрсөтөт. Ал щелочь менен реакцияга кирип, тузду жана сууну пайда кылат, негиздик оксид менен аракеттенишип, тузду жана суу менен аракеттенишип, кислотаны пайда кылат.
Алтынчы бөлүм. Жогорку гидроксидинин курамына мүнөздөмө берүү.
Фосфордун жогорку гидроксиди – фосфор кислотасы Н3РО4 (аш–үч–пэ–о–төрт) болуп саналат, ал кислоталык касиетти көрсөтөт. Мисалы, даамы кычкыл болот, индикаторлордун түсүн өзгөртөт,негиздер менен жана металлдардын оксиддери менен аракеттенишип, тузду жана сууну пайда кылат.
Жетинчи бөлүм. Элементтин суутектик учма бирикмелеринин курамы.
Фосфор суутек менен реакцияга кирип, учма бирикме – фосфинди – РН3 (пэ–аш–үч) пайда кылат.
Д. И. Менделеевдин мезгилдик системасынын пайдалануу менен көпчүлүк элементтерге – негизги подгруппанын металл жана металл эместерине мүнөздөмө берүүгө болот.
Глоссарий
- Атомдун радиусу – атомдун ядросунан сырткы деңгээлге чейинки аралык.
- Атомдун ядросунун курамына элементардык бөлүкчөлөр – протондор (p) жана нейтрондор (n) кирет.
- Изотоптор – бир эле химиялык элементтин атомунун катар саны бирдей, бирок, бири–биринен массасы менен айрымаланган ар түрдүүлүгү.
- Металлдык касиеттер – атомдун электрондорду берүү жөндөмдүүлүгү.
- Металл эместик касиеттер – атомдун сырткы деңгээли толгончо электрондорду кошуп алуу жөндөмдүүлүгү.
- Орбиталь (s, p, d, f) – Электрондун көбүрөөк кыймылга келген мейкиндигинин максималдуу тыгыздыгы.
- Радиоактивдүүлүк – бул изотоптордун нурларды жана электромагниттик толкундарды бөлүп чыгаруу менен ажырашы.
- Сырткы катмардын толушу – эгерде атомдун сырткы катмарында 8 электрон болсо, анда катмары толот ( суутек жана гелийде 2 электрон болот).
- Химиялык элемент – ядросунун заряды бирдей болгон атомдордун белгилүү бир түрү.
- Электрондук булут – атомдогу электрондун кыймылын сүрөттөгөн квант механикасынын модели.
- Энергетикалык деңгээл – электрондору белгилүү бир энергияга ээ болгон энергетикалык катмар. Химиялык элементтин атомунун энергетикалык деңгээлдеринин саны, элемент жайгашкан мезгилдин номерине туура келет.
- р–элементтер – атомдогу сырткы энергетикалык деңгээлдин р деңгээлчедеги электрондору толгон элементтер.
- d–элементтер – деңгээлдин сырткы экинчи d– деңгээлчелери толгон элементтер.
- f–элементтер – деңгээлдин сырткы үчүнчү f–деңгээлчелери толгон элементтер.
Пайдалуу шилтемелер
Суу алдында жүрүүчү атомдук кемеде радиация кургактыкка караганда аз ɵлчɵмдɵ болот.
Нью–Йорктогу Борбордук вокзалды курууда гранит кɵп ɵлчɵмдɵ колдонулган. Ошондуктан, ал жерде радиациянын деңгээли ɵтɵ жогору, ал тургай атомдук станциядагы нормадан да жогору экендиги айтылат.
Чернобылда «Cryptococcus neoformans» деп аталган козу карындар өсөт, алар нурлануунун таасири астында өздөрүн мыкты сезишет.
Владимир Правик Чернобыль АЭС өчүрүүгө катышкан биринчи өрт өчүрүүчүлөрдөн болгон.. Радиациянын таасири менен анын көздөрү күрөңдөн көгүш түскө өзгөргөндүгүн айтышат.
Чернобылдын тегерегине соя өсүмдүгүн өстүрүү менен радиацияга каршы коргонууну түзүшкөн. Бул ачылыш адамдарга чоң пайдасын тийгизет.
Чернобылдын айланасындагы жана башка атомдук катастрофа болгон жерлердеги жашоону изилдөөдө, кээ бир түрлөрдүн радиациянын таасири менен генетикалык мутацияга учурап, аман калышкандыгы байкалган.
Тамекини орточо тарткан адам бир жыл ичинде болжол менен 300 жолу рентгенге тартылганда алган нурланууну алат. Бул тамекинин түтүнүндө радиоактивдүү изотоптордун болгондугу менен түшүндүрүлөт.
2004–жылы 24–декабрда Жер планетасына тарыхтагы эң күчтүү радиация таралган. Бул биздин планетага 50 миң жылдык алыстыктагы нейтрон жылдыздарынан келген.
Банандар жогорку радиоактивдүүлүккө ээ болушат.
Астронавттар көздөрүн жапса да кээде ачык жарыктарды көрө алышат. Ал жарыктар көздүн торчосуна космостук нурлануунун дал келишинен пайда болот.
Учкучтар жана стюардессалар бир жыл ичинде АЭС жумушчуларына караганда көп өлчөмдөгү нурланууну алышат. Ошондуктан, алар официалдуу түрдө «радиациянын шартында иштегендер» деген топко киришет.
Бир ууч урандын радиоактивдүүлүгү 10 банандыкына барабар болот. Ошондуктан, биз банандын радиоактивдүүлүгү жөнүндө жогоруда айтып кеттик!
АКШнын ядролук куралды иштеп чыгуу боюнча программасы «Манхэттен долбоору» деген ат менен белгилүү. Бул программанын алкагында радиациянын адамдарга тийгизген таасирин аныктоо үчүн өтө катаал эксперименттер жүргүзүлгөн. Мисалы,алар кичинекей балдарды радиоактивдүү сулуу (овсянка) менен тамактандырышкан.
Манхэттен долбоорунун алкагында Альберт Стивенс плутоний инъекциясын алган.Ал 20 жылдан кийин көзү өткөн жана бул радиацияны алгандан кийин көпкө жашаган адамдардын бири болгон.
Мария Кюри тарабынан ачылган радий элементин адегенде бардык жерде – тиш жуугуч пастадан момпосуй жасоого чейин колдонушкан. Албетте, кийинчерээк бул ден–соолуктун жабыркашына алып келген.
Жылуулук электр станцияларынын жанында жашаган адамдар Атомдук электр станцияларынын(АЭС) жанында жашагандарга караганда көп нурлануу алышат.
Адам өзүнүн мобилдик телефонуна караганда көп радиацияны бөлүп чыгарат экен.
Курамында мышьяк бар өндүрүш калдыктары ядролук калдыктарга караганда адамдарга көп зыян алып келет.
Биз дайыма бизге зыян келтирбеген радиацияга учурап турабыз. Ал эми коркунучтуу радиацияга жогорку дозадагы иондоштурулган нурлануулар (рентген нурлары, гамма–нурлары ж.б.) кирет.
Сүйлɵмдүн аягына коюлган чекитке 2 млрд атом батат.
Пляжда канча кум болсо, кумдун бир бɵлүкчɵсүндɵ ошончо атом болот.
Китеп баракчаларынын калыңдыгы, жарым миллионго жакын атомго барабар.
Азыркы учурда субатомдук бɵлүкчɵлɵрдүн официалдуу саны 24 барабар.
Космос мейкиндигинде бир куб метрге эки атом туура келет, бирок кээде тартылуу күчүнүн таасири астында алар жылдыздарга, планеталарга айланат.
Эгерде электрон 50 тыйындай массага ээ болсо, анда протондун массасы тɵрт литр сүттүн салмагындай болмок.
Эгерде жер шарындагы адамдарды түзүп турган атомдордун ортосундагы боштукту алып салсак, анда жалпы адамзат алманын ɵлчɵмүндɵй болуп калмак.
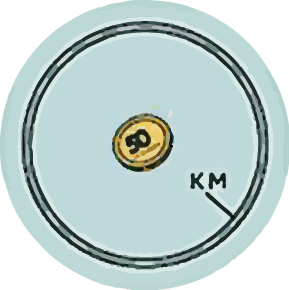
Эгерде атомду диаметри 1км болгон сфера (шар) катары элестетсек, анда анын ядросунун ɵлчɵмү майда тыйындай эле болот.